3Г71 станок технические характеристики: 3Г71 станок плоскошлифовальный с горизонтальным шпинделем универсальный. Паспорт, Руководство, Схемы, Описание, Характеристики
Содержание
3Г71 станок шлифовальный — технические характеристики
Устройство и работа станка и его основных узлов
Станок состоит из узлов, описание каждого из которых приведено ниже.
На станине в поперечном направлении по двум V-образным направляющим качения перемещается крестовый суппорт.
По направляющим крестового суппорта — плоской и V-образной в продольном направлении перемещается стол. Стол получает перемещение от гидроцилиндра, закрепленного между направляющими крестового суппорта.
Внутри крестового суппорта в его нижней части
закреплены узлы: механизм поперечной подачи, механизм продольного перемещения стола, механизм продольного реверса стола, механизм поперечного реверса стола, распределительная панель, гидропанель ВШПГ-35.
С задней стороны на станине устанавливается колонна, по вертикальным направляющим качения которой перемещается шлифовальная головка.
Внутри станины установлен гидроагрегат, обслуживание которого производится через левую дверку станины.
С правой стороны рядом со станком устанавливается бак охлаждения.
Основные размеры и посадочные места шлифовального круга станка 3г71м
Основные размеры и посадочные места шлифовального круга станка 3г71м
3г71 — станок плоскошлифовальный с крестовым столом и горизонтальным шпинделем
Купить станочный подшипник с доставкой
3г71м станок плоскошлифовальный с горизонтальным шпинделем универсальный. назначение и область применения
Плоскошлифовальный станок высокой точности c прямоугольным столом, горизонтальным шпинделем с крестовым суппортом предназначен для шлифования периферией круга поверхностей деталей весом до 150 кг с учетом крепящего приспособления и магнитной плиты. В определенных границах возможна обработка поверхностей, расположенных под углом 90° к зеркалу стола.
В определенных границах возможна обработка поверхностей, расположенных под углом 90° к зеркалу стола.
На станке могут шлифоваться детали из различных материалов. При шлифовании твердых сплавов необходимо уменьшить число оборотов шпинделя шлифовального круга.
По специальному заказу за отдельную плату вместе со станком может быть поставлен ряд приспособлений, расширяющих технологические возможности станка.
С применением различных приспособлений возможно профильное шлифование различных деталей. Точность профиля при этом зависит от метода заправки профиля круга и от применяемого приспособления для крепления деталей.
В нормальном исполнении станок комплектуется стандартной электромагнитной плитой.
Класс точности станка В. Шероховатость обработанной поверхности V 10.
Габариты рабочего пространства плоскошлифовального станка 3г71м
Чертеж рабочего пространства плоскошлифовального станка 3г71м
Кинематическая схема плоскошлифовального станка 3г71м
Кинематическая схема плоскошлифовального станка 3г71м
Схема кинематическая плоскошлифовального станка 3Г71М. Смотреть в увеличенном масштабе
Конструктивные особенности станка
Внешний вид станка
Основное назначение станка 3Г71 – шлифование различных деталей и заготовок с помощью специальных абразивных кругов. Процесс происходит при крутящем шпинделе, на котором расположен абразив. Изменение положения детали может происходить за счет смещения рабочего стола и шпиндельной головки.
В основном обработка выполняется путем контакта периферии круга с обрабатываемой заготовкой. С помощью специальных приспособлений возможно изменение угла до 90°. Однако для этого следует приобрести комплектующие, которые не входят в стандартную комплектацию оборудования.
К конструктивным и эксплуатационным характеристикам станка можно отнести следующее:
- электромагнитная плита обеспечивает стабильное положение заготовки во время ее обработки;
- независимые механизмы перемещения рабочего стола и шлифовальной головки. В основу кинематической схемы последней положены направляющие качения;
- удобное расположение устройств реагирования подач. Они находятся в нижней части суппорта рабочего стола. Там же располагается блок управления системой подачи охлаждающей жидкости.
Управляющие компоненты находятся в отдельном блоке, который установлен в правой части оборудования. Во время работы станка 3Г71 доступ к нему остается свободным независимо от режима функционирования и положения рабочего стола.
При установке дополнительных компонентов появится возможность выполнять профильное шлифование заготовок. Однако перед этим необходимо согласовать размеры и посадочные места приспособления.
Общий вид универсального плоскошлифовального станка 3г71м
Фото плоскошлифовального станка 3г71м
Фото плоскошлифовального станка 3г71м
Ооо «неоинжиниринг»
Металлообработка. Изготовление даже одной детали. По чертежам, по образцу, по изношенному образцу, и даже со слов заказчика. Из отечественных, импортных материалов или подберем аналог.
Изготовление даже одной детали. По чертежам, по образцу, по изношенному образцу, и даже со слов заказчика. Из отечественных, импортных материалов или подберем аналог.
Ооо «фет»
ООО «ФЕТ» многопрофильная транспортно-экспедиторская компания по международному аутсосингу. Мы ведем свою деятельность по трём основным направлениям: грузовые перевозки, поставка станков и оборудования из Китая под индивидуальный заказ
Ооо пкф кристалл
Крупнейший в России производитель серийных портальных машин термической (плазменной и газовой) резки металла с ЧПУ с двадцатилетним производственным опытом. Собственные разработки, полный производственный цикл, высокий профессионализм сотрудников, клиентоориентированность, техническое сопровождение оборудования на протяжении всего цикла эксплуатации – сильные стороны завода ПКФ Кристалл.
Перечень органов управления шлифовальным станком 3г71м
- Кнопка тонкой вертикальной подачи
- Рукоятка ручной вертикальной подачи
- Лимб регулировки величины вертикальной подачи
- Рукоятка ручной поперечной подачи
- Кнопка гонкой поперечной подачи
- Кнопка смазки винта и направляющих вертикальной подачи и винта поперечной подачи
- Дроссели смазки направляющих стола и крестового суппорта
- Дроссели регулировки плавности реверса стола
- Рукоятка пуска, остановки и разгрузки стола
- Рукоятка регулирования скорости стола
- Рукоятка ручного продольного реверса стола
- Рукоятка крана охлаждения
- Упор продольного реверса стола
- Рукоятка ручного продольного перемещения стола
- Рукоятка ручного поперечного реверса стола
- Кнопка фиксации механизма ручного перемещения стола
- Тумблер «С плитой — без плиты»
- Тумблер «Магнитная плита включена»
- Кнопка «Ускоренное перемещение крестового суппорта»
- Регулятор грубой настройки величины поперечной подачи
- Регулятор тонкой настройки величины поперечной подачи
- Тумблер «Включение поперечной подачи»
- Тумблер «Включение вертикальной подачи»
- Тумблер «Вертикальная подача при реверсе стола или крестового суппорта»
- Сигнальная лампа «Станок включен»
- Переключатель «Охлаждение включено»
- Кнопка «Все стоп»
- Кнопка «Шлифовальная головка вниз»
- Кнопка «Шлифовальная головка вверх»
- Кнопка «Стоп шлифовального круга»
- Кнопка «Пуск шлифовального круга» и «Пуск смазки»
- Кнопка «Сгон гидропривода»
- Кнопка «Пуск гидропривода»
- Сигнальная лампа «Нет смазки»
- Упор поперечного реверса
Перечень составных частей шлифовального станка 3г71м
- Охлаждение станка — 3Г71М.
 60
60 - Станина станка — 3Г71М.10
- Механизм подач — 3Г71М.22
- Гидрокоммуникация — 3Г71М.70
- Механизм продольного реверса — 3Г71М.25
- Суппорт крестовый — 3Г71М.20
- Механизм продольного перемещения стола — 3Г71М.21
- Стол рабочий — 3Г71.23Э
- Шлифовальная головка — 3Г71М.30
- Кожух шлифовального круга — 3Г71М.34
- Колонна — 3Г71М.11
- Гидроагрегат — 3Г71М.71
- Агрегат смазки шлифовальной головки — 3Г71М.72
- Редуктор — 3Г71М.33
- Электрооборудование — 3Г71М.80
- Станция управления — 3Г71М.81
- Панель питания электромагнитной плиты — 3711.82
- Блок поперечной подачи — 3711.83
- Панель вертикальной подачи — 3711.84
- Электрошкаф — 3711.85
- Замок — 3711.87
- Блок торможения ускоренного перемещения шлифовальной головки — 3711.88
- Механизм поперечного реверса — 3Г71М.24
- Принадлежности — 3Г71М.90
Плоскошлифовальный станок 3г71, 3г71м сегодня
Производитель станка Оршанский станкостроительный завод Красный борец. В 1959 году на заводе началось производство плоскошлифовальных станков высокой и особо высокой точности. В 1967 году был выпущен плоскошлифовальный станок 3711 первый в СССР металлорежущий станок особо высокой точности.
В 1959 году на заводе началось производство плоскошлифовальных станков высокой и особо высокой точности. В 1967 году был выпущен плоскошлифовальный станок 3711 первый в СССР металлорежущий станок особо высокой точности.
Производство универсального плоскошлифовального станка модели 3Г71 с горизонтальным шпинделем началось в 1972 году. Следующими моделями, запущенными в производство были 3Е711, 3Е711В
Популярные категории в москве
Да кстати, на портале ProСтанки выбор предложений по плоскошлифовальному станку 3г71 почти как на Авито и TIU
Работа гидропривода и взаимодействие узлов шлифовального станка 3г71м
Гидропривод станка включается в работу нажатием на кнопку «Пуск гидропривода» с последующей установкой крана гидропанели 17 в положение «Пуск». Поток масла, нагнетаемый лопастным насосом 2, через фильтр 4 по трубопроводу 12 поступает в центральную проточку реверсивного золотника 25 панели 17.
При положении золотника 25, как показано на схеме, основной поток поступает в левую проточку и по трубопроводу 18 в гидроцилиндр 20 перемещения стола. Стол движется в направлении стрелки. Слив из гидроцилиндра 20 происходит по трубопроводу 21 через дроссель 14, клапан II в гидробак I.
Стол движется в направлении стрелки. Слив из гидроцилиндра 20 происходит по трубопроводу 21 через дроссель 14, клапан II в гидробак I.
Скорость перемещения стола регулируется дросселем 14. Перемещение стола вправо происходит до момента, пока упор 19, связанный со столом, не перебросит рычаг реверса 23, который через систему рычагов произведет переключение золотника управления 24 в левое положение.
При этом правая торцевая камера золотника реверса соединяется с давлением, золотник 25 перемещается влево, в результате чего происходит реверс стола. Трубопровод 21 становится напорным, трубопровод 18 — сливным. Стол движется в обратном направлении до тех пор, пока упор 22 не перебросит рычаг 23 в обратное положение.
Далее цикл повторяется аналогично выше описанному.
Автоматическая вертикальная подача осуществляется с включением электромагнита реверсивного золотника 28.
Поток масла по трубопроводу 12 через реверсивный золотник и трубопровод 27 поступает в нижнюю полость моментного гидроцилиндра, из верхней полости масло по трубопроводу 26 через золотник и трубопровод 29 сливается в гидробак. Происходит поворот флажка по часовой стрелке.
Происходит поворот флажка по часовой стрелке.
При отключении электромагнита трубопровод 26 становится напорным, трубопровод 27 — сливным. Флажок возвращается в исходное положение
Смазка направляющих стола и крестового суппорта, винта и направляющих вертикальной подачи и винта поперечной подачи производится от трубопровода 13 через фильтр 10 и трубопровод 15.
Расход масла на смазку направляющих стола и крестового суппорта регулируется дросселем 16.
Подача масла на смазку винта и направляющих вертикальной подачи и винта поперечной подачи включается периодически нажатием на кнопку 9.
Излишки масла, поступающие с направляющих стола и крестового суппорта, по трубопроводам 7 и 8 сливаются в гидробак.
Расположение органов управления шлифовальным станком 3г71м
Расположение органов управления шлифовальным станком 3г71м
Расположение органов управления шлифовальным станком 3г71м
Расположение составных частей шлифовального станка 3г71м
Расположение составных частей шлифовального станка 3г71м
Система питания электрооборудования станка 3г71м
Станок подключается к сети трехфазного переменного тока напряжением ~380 В, частотой 50 Гц.
- На асинхронные короткозамкнутые электродвигатели M1-M3, М5, М6, М8 и трансформатор ТР3 подается напряжение 380 В переменного трехфазного тока.
- На электродвигатель М7 подается напряжение ~220 В переменного трехфазного тока, снимаемого с трансформатора Тр3.
- На цепи управления и электромагнит ЭМ1 подается напряжение ~110 в переменного тока от трансформатора Тр2.
- На кронштейн местного освещения ЛI подается напряжение ~24 В переменного тока от трансформатора Тр2.
- На аппаратуру сигнализации Л2 и Л3 подается напряжение ~5 В переменного тока от трансформатора Tpl.
- На электромагнитное приспособление подается напряжение 110 В постоянного тока через выпрямитель Д11. Цепи управления постоянного тока работают от напряжения, снимаемого от выпрямителя Д10, на вход которого подается напряжение 36 В переменного тока от трансформатора Tpl.
- Питание бесконтактного конечного выключателя ВБ2 осуществляется постоянным напряжением, снимаемым с выпрямителя Д26, на вход которого подается напряжение 31 В с обмоток 36 В и 5 В трансформатора Tpl, включенных встречно.

Схема гидравлическая плоско шлифовального станка 3г71м
Гидравлическая схема плоско шлифовального станка 3г71м
Схема гидравлическая плоскошлифовального станка 3Г71m. Смотреть в увеличенном масштабе
Схема электрическая плоскошлифовального станка 3г71м
Электрическая схема плоско шлифовального станка 3г71м
Схема электрическая плоскошлифовального станка 3Г71m. Смотреть в увеличенном масштабе
Технические характеристики
Конструктивные компоненты
Анализ технических характеристик плоскошлифовального станка следует начать с изучения его габаритов и массы. Они соответственно составляют 187*155*198 см при весе 2000 кг. Такие параметры обеспечивают максимальную устойчивость оборудования даже при максимальных режимах работы.
Согласно классификации по ГОСТ 8-82 оборудованию присвоен класс точности «Н». Максимальный размер обрабатываемых деталей не должен превышать 63*20*32 см. Для работы можно установить расстояние от поверхности стола до оси шпинделя от 8 до 44,5 см. Габариты стола составляют 63*20 см.
Габариты стола составляют 63*20 см.
Кроме этого, необходимо ознакомиться со следующими характеристиками станка:
- поперечное смещений стола. Максимальная величина составляет 23,5 см. Автоматическая подача на каждый ход от 0,3 до 4,2 мм;
- шлифовальная головка. Максимальное вертикальное перемещение равно 36,5 см. габариты шлифовального круга — 25*3,2*7,5 см. Нормированное число оборотов – 2740;
- параметры электрооборудования. Количество электродвигателей 5. Мощность силовой установки привода шпинделя составляет 2,2 кВт. Для работы гидропривода предусмотрен электродвигатель 1,1 кВт. Остальные выполняют функции по обеспечению работоспособности системы охлаждения.
Функционирование станка возможно с активной электромагнитной плитой или без нее. В последнем случае необходимы специальные прижимные устройства, обеспечивающие надеждою фиксацию заготовки.
В видеоматериале показан пример правки круга станка:
Технические характеристики:
Станки модели 3г71 предназначены для шлифования плоских поверхностей периферией круга, изделий, закрепленных на зеркале стола, на магнитной или электромагнитной плите или в приспособлении.
Наибольшие размеры обрабатываемых изделий(длина х ширина х высота), мм: 630х200х320
Наибольшее расстояние от оси шпинделя до зеркала стола, мм: 80…45
Наибольшая допустимая масса обрабатываемого изделия с учетом магнитной плиты и крепящего приспособления, кг: 100
Размеры рабочей поверхности стола (длина х ширина), мм: 630х200
Перемещение стола (продольное х поперечное), мм: 70…710х235
Поперечная автоматическая подача стола на каждый ход, мм: 0,3…4,2
Цена одного деления лимба маховика поперечного перемещения, мм: 0,05
Перемещения стола за один оборот маховика продольного перемещения, мм: 15,3
Скорость продольного перемещения стола, м/мин 5…20
Вертикальная подача
Цена деления лимба маховика, мм: 0,001Цена деления лимба микрометрической подачи, мм: 0,001Автоматическая подача (ступенчатая через 0,005 мм), мм: 0,005…0,05Перемещение шлифовальной головки за один оборот маховика, мм: 0,2
Поперечная подача
Цена деления лимба маховика, мм: 0,02Цена деления лимба микрометрической подачи, мм: 0,005Автоматич. поперечн. подача на каждый ход стола (регулир-ся бесступенч.), мм: 10…0,3Скорость автоматической непрерывной подачи, м/мин: 0,7Перемещение суппорта за один оборот маховика, мм: 2
поперечн. подача на каждый ход стола (регулир-ся бесступенч.), мм: 10…0,3Скорость автоматической непрерывной подачи, м/мин: 0,7Перемещение суппорта за один оборот маховика, мм: 2
Шлифовальная головка
Скорость ускоренного перемещения, м/мин: 0,27Размеры шлифовального круга, мм: 250х25х75Частота вращения шлифовального круга, об/мин 2740
Габаритные размеры станка (длина х ширина х высота), мм: 1870х1550х1980Масса станка, кг: 1900Завод изготовитель г.Орша,“Красный Борец”
SCIRP Открытый доступ
Издательство научных исследований
Журналы от A до Z
Журналы по темам
- Биомедицинские и биологические науки.

- Бизнес и экономика
- Химия и материаловедение.
- Информатика. и общ.
- Науки о Земле и окружающей среде.
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные науки. и гуманитарные науки
Журналы по тематике
- Биомедицина и науки о жизни
- Бизнес и экономика
- Химия и материаловедение
- Информатика и связь
- Науки о Земле и окружающей среде
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные и гуманитарные науки
Публикация у нас
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Публикуйте у нас
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp.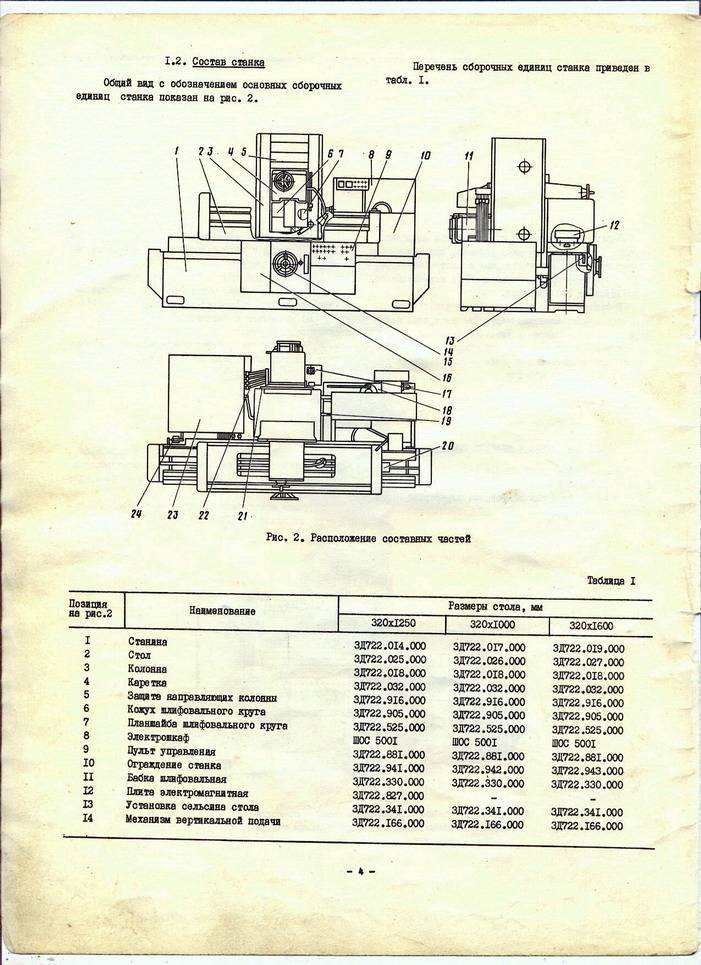 org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
| Недавно опубликованные статьи |
| Недавно опубликованные статьи |
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp. org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
Бесплатные информационные бюллетени SCIRP
Copyright © 2006-2023 Scientific Research Publishing Inc. Все права защищены.
Вершина
Структурные признаки сайтов связывания антибиотиков на рибосоме
1. Рамакришнан В. Структура рибосомы и механизм трансляции. Клетка. 2002; 108: 557–572. [PubMed] [Google Scholar]
2. Грин Р., Ноллер Х.Ф. Рибосомы и трансляция. Анну. Преподобный Биохим. 1997;66:679–716. [PubMed] [Google Scholar]
3. Хансен Дж.Л., Мур П.Б., Стейц Т.А. Структуры пяти антибиотиков, связанных в пептидилтрансферазном центре большой субъединицы рибосомы. Дж. Мол. биол. 2003; 330:1061–1075. [PubMed] [Google Scholar]
Дж. Мол. биол. 2003; 330:1061–1075. [PubMed] [Google Scholar]
4. Ogle JM, Brodersen DE, Clemons WM, Jr, Tarry MJ, Carter AP, Ramakrishnan V. Распознавание родственной транспортной РНК 30S рибосомной субъединицей. Наука. 2001; 292: 897–902. [PubMed] [Google Scholar]
5. Уилсон Д.Н. AZ бактериальных ингибиторов трансляции. Критический преподобный биохим. Мол. биол. 2009 г.;44:393–433. [PubMed] [Google Scholar]
6. Йонат А. Антибиотики, нацеленные на рибосомы: устойчивость, селективность, синергизм и клеточная регуляция. Анну. Преподобный Биохим. 2005; 74: 649–679. [PubMed] [Google Scholar]
7. Pioletti M, Schlunzen F, Harms J, Zarivach R, Gluhmann M, Avila H, Bashan A, Bartels H, Auerbach T, Jacobi C, et al. Кристаллические структуры комплексов малой субъединицы рибосомы с тетрациклином, эдеином и IF3. EMBO J. 2001; 20: 1829–1839. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Cannone JJ, Subramanian S, Schnare MN, Collett JR, D’Souza LM, Du Y, Feng B, Lin N, Madabusi LV, Muller KM, et al. Сайт сравнительной сети РНК (CRW): онлайн-база данных сравнительной информации о последовательностях и структуре рибосомных, интронных и других РНК. БМК Биоинформ. 2002; 3:2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Сайт сравнительной сети РНК (CRW): онлайн-база данных сравнительной информации о последовательностях и структуре рибосомных, интронных и других РНК. БМК Биоинформ. 2002; 3:2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Белова Л., Тенсон Т., Сюн Л., МакНиколас П.М., Манкин А.С. Новое место действия антибиотика в рибосоме: взаимодействие эвернимицина с большой субъединицей рибосомы. проц. Натл акад. науч. США. 2001;98:3726–3731. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Боровинская М.А., Пай Р.Д., Чжан В., Шувирт Б.С., Холтон Дж.М., Хирокава Г., Каджи Х., Каджи А., Кейт Дж.Х. Структурные основы ингибирования рециркуляции бактериальных рибосом аминогликозидами. Нац. Структура Мол. биол. 2007; 14: 727–732. [PubMed] [Google Scholar]
11. Johansen SK, Maus CE, Plikaytis BB, Doutthwaite S. Капреомицин связывается через интерфейс рибосомной субъединицы, используя tlyA-кодируемые 2′-O-метилирования в 16S и 23S рРНК. Мол. Клетка. 2006; 23: 173–182. [PubMed] [Академия Google]
12. Schroeder SJ, Blaha G, Tirado-Rives J, Steitz TA, Moore PB. Структуры антибиотиков, связанных с Е-сайтом 50S субъединицы рибосомы Haloarcula marismortui: 13-дезокситетанолид и гиродазол. Дж. Мол. биол. 2007; 367:1471–1479. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Schroeder SJ, Blaha G, Tirado-Rives J, Steitz TA, Moore PB. Структуры антибиотиков, связанных с Е-сайтом 50S субъединицы рибосомы Haloarcula marismortui: 13-дезокситетанолид и гиродазол. Дж. Мол. биол. 2007; 367:1471–1479. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Амит М., Беризио Р., Барам Д., Хармс Дж., Башан А., Йонат А. Щель, примыкающая к рибосомному туннелю: советы по котрансляционной укладке. ФЭБС лат. 2005; 579:3207–3213. [PubMed] [Академия Google]
14. Brandi L, Fabbretti A, La Teana A, Abbondi M, Losi D, Donadio S, Gualerzi CO. Специфическое, эффективное и селективное ингибирование инициации прокариотической трансляции новым пептидным антибиотиком. проц. Натл акад. науч. США. 2006; 103:39–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Laios E, Waddington M, Saraiya AA, Baker KA, O’Connor E, Pamarathy D, Cunningham PR. Комбинаторно-генетические технологии для создания новых противоинфекционных средств. Арка Патол. Лаборатория мед. 2004; 128:1351–1359. [PubMed] [Google Scholar]
2004; 128:1351–1359. [PubMed] [Google Scholar]
16. Яссин А., Фредрик К., Манкин А.С. Вредоносные мутации в малых субъединицах рибосомной РНК определяют функциональные участки и потенциальные мишени для антибиотиков. проц. Натл акад. науч. США. 2005; 102:16620–16625. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Ясин А., Манкин А.С. Потенциальные новые антибиотические сайты в рибосоме, обнаруженные вредными мутациями в РНК большой субъединицы рибосомы. Дж. Биол. хим. 2007; 282:24329–24342. [PubMed] [Академия Google]
18. Wimberly BT, Brodersen DE, Clemons WM, Jr, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V. Структура 30S рибосомной субъединицы. Природа. 2000;407:327–339. [PubMed] [Google Scholar]
19. Шувирт Б.С., Боровинская М.А., Хау К.В., Чжан В., Вила-Санджурджо А., Холтон Дж.М., Кейт Дж.Х. Структуры бактериальной рибосомы с разрешением 3,5 Å. Наука. 2005; 310:827–834. [PubMed] [Google Scholar]
20. Klein DJ, Schmeing TM, Moore PB, Steitz TA. Перегиб: новый мотив вторичной структуры РНК. EMBO J. 2001; 20: 4214–4221. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Перегиб: новый мотив вторичной структуры РНК. EMBO J. 2001; 20: 4214–4221. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Harms JM, Wilson DN, Schluenzen F, Connell SR, Stachelhaus T, Zaborowska Z, Spahn CM, Fucini P. Трансляционная регуляция через L11: молекулярные переключатели на рибосоме включаются и выключаются тиострептоном и микрококцином. Мол. Клетка. 2008; 30:26–38. [PubMed] [Google Scholar]
22. Восс Н.Р., Герштейн М., Стейц Т.А., Мур П.Б. Геометрия выходного туннеля рибосомного полипептида. Дж. Мол. биол. 2006; 360: 893–906. [PubMed] [Google Scholar]
23. Лемье С., Основные типы канонических и неканонических пар оснований РНК: метод распознавания и полный репертуар. Нуклеиновые Кислоты Res. 2002; 30:4250–4263. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Леонтис Н.Б., Вестхоф Э. Геометрическая номенклатура и классификация пар оснований РНК. РНК. 2001; 7: 499–512. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Gabb HA, Sanghani SR, Robert CH, Prevost C. Поиск и визуализация укладки оснований нуклеиновых кислот. Дж. Мол. График 1996;14:611, 2314. [PubMed] [Google Scholar]
Поиск и визуализация укладки оснований нуклеиновых кислот. Дж. Мол. График 1996;14:611, 2314. [PubMed] [Google Scholar]
26. Gendron P, Lemieux S, Major F. Количественный анализ трехмерных структур нуклеиновых кислот. Дж. Мол. биол. 2001; 308: 919–936. [PubMed] [Академия Google]
27. Leontis NB, Stombaugh J, Westhof E. Пары оснований, отличных от Watson-Crick, и связанные с ними матрицы изостеричности. Нуклеиновые Кислоты Res. 2002; 30:3497–3531. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Banatao DR, Altman RB, Klein TE. Анализ микроокружения и идентификация сайтов связывания магния в РНК. Нуклеиновые Кислоты Res. 2003; 31:4450–4460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Казальс Ф., Пруст Ф., Бахадур Р.П., Джанин Дж. Пересмотр описания межбелковых интерфейсов Вороного. Белковая наука. 2006; 15: 2082–209.2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Selmer M, Dunham CM, Murphy FVt, Weixlbaumer A, Petry S, Kelley AC, Weir JR, Ramakrishnan V. Структура рибосомы 70S в комплексе с мРНК и тРНК. Наука. 2006; 313:1935–1942. [PubMed] [Google Scholar]
Структура рибосомы 70S в комплексе с мРНК и тРНК. Наука. 2006; 313:1935–1942. [PubMed] [Google Scholar]
31. Дэвид-Иден Х., Мандель-Гутфренд Ю. Выявление уникальных свойств рибосомы с использованием сетевого анализа. Нуклеиновые Кислоты Res. 2008; 36: 4641–4652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Freeman LC. Центральное место занимают социальные сети I: концептуальное уточнение. соц. Сети. 1979;1:215–239. [Google Scholar]
33. Манкин А. Антибиотик блокирует путь мРНК на рибосоме. Нац. Структура Мол. биол. 2006; 13: 858–860. [PubMed] [Google Scholar]
34. Кавабата Т., Го Н. Обнаружение карманов на поверхности белков с использованием малых и больших зондовых сфер для поиска предполагаемых мест связывания лигандов. Белки. 2007; 68: 516–529. [PubMed] [Google Scholar]
35. Хансен Дж.Л., Ипполито Дж.А., Бан Н., Ниссен П., Мур П.Б., Стейц Т.А. Структуры четырех макролидных антибиотиков, связанных с большой рибосомной субъединицей. Мол. Клетка. 2002; 10: 117–128. [PubMed] [Академия Google]
Клетка. 2002; 10: 117–128. [PubMed] [Академия Google]
36. Батей Р.Т., Рэмбо Р.П., Дудна Дж.А. Третичные мотивы в структуре и укладке РНК. Ангью. хим. Междунар. Эд. англ. 1999; 38: 2326–2343. [PubMed] [Google Scholar]
37. Hermann T, Patel DJ. Сшивание третичной архитектуры РНК. Дж. Мол. биол. 1999; 294:829–849. [PubMed] [Google Scholar]
38. Мур П.Б. Структурные мотивы в РНК. Анну. Преподобный Биохим. 1999; 68: 287–300. [PubMed] [Google Scholar]
39. Tinoco I, Jr, Bustamante C. Как складывается РНК. Дж. Мол. биол. 1999;293:271–281. [PubMed] [Google Scholar]
40. Сенгер В. Принципы строения нуклеиновых кислот. Нью-Йорк: Спрингер; 1984. [Google Scholar]
41. Dalluge JJ, Hashizume T, Sopchik AE, McCloskey JA, Davis DR. Конформационная гибкость РНК: роль дигидроуридина. Нуклеиновые Кислоты Res. 1996; 24:1073–1079. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Nissen P, Ippolito JA, Ban N, Moore PB, Steitz TA. Третичные взаимодействия РНК в большой субъединице рибосомы: А-минорный мотив. проц. Натл акад. науч. США. 2001;98:4899–4903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл акад. науч. США. 2001;98:4899–4903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Xin Y, Laing C, Leontis NB, Schlick T. Аннотация третичных взаимодействий в структурах РНК выявляет вариации и корреляции. РНК. 2008; 14: 2465–2477. [Статья бесплатно PMC] [PubMed] [Google Scholar]
44. Fulle S, Gohlke H. Статика выходного туннеля рибосомы: значение для котрансляционного фолдинга пептидов, регуляции удлинения и связывания антибиотиков. Дж. Мол. биол. 2009; 387: 502–517. [PubMed] [Академия Google]
45. Давидович С., Башан А., Ауэрбах-Нево Т., Ягги Р.Д., Гонтарек Р.Р., Йонат А. Индуцированная подгонка усиливает связывание плевромутилинов с рибосомами, а удаленные взаимодействия обеспечивают их селективность. проц. Натл акад. науч. США. 2007; 104:4291–4296. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Амитай Г., Шемеш А., Ситбон Э., Шклар М., Нетанели Д., Венгер И., Пьетроковски С. Сетевой анализ белковых структур идентифицирует функциональные остатки. Дж. Мол. биол. 2004; 344:1135–1146. [PubMed] [Академия Google]
Дж. Мол. биол. 2004; 344:1135–1146. [PubMed] [Академия Google]
47. Chea E, Livesay DR. Насколько точны и статистически надежны прогнозы каталитических центров, основанные на близости центральности? БМК Биоинформ. 2007; 8:153. [Статья бесплатно PMC] [PubMed] [Google Scholar]
48. del Sol A, Fujihashi H, Amoros D, Nussinov R. Центральность остатков, функционально важные остатки и форма активного сайта: анализ семейств ферментов и неферментов. Белковая наука. 2006;15:2120–2128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Pruesse E, Quast C, Knittel K, Fuchs BM, Ludwig W, Peplies J, Glockner FO. SILVA: всеобъемлющий онлайн-ресурс для проверки качества и выравнивания данных о последовательностях рибосомной РНК, совместимых с ARB. Нуклеиновые Кислоты Res. 2007; 35: 7188–7196. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Noller HF. Рибосомная РНК и трансляция. Анну. Преподобный Биохим. 1991; 60: 191–227. [PubMed] [Google Scholar]
51. Lescoute A, Westhof E. Мотивы ля-минор в процессе распознавания декодирования. Биохимия. 2006; 88: 993–999. [PubMed] [Google Scholar]
Lescoute A, Westhof E. Мотивы ля-минор в процессе распознавания декодирования. Биохимия. 2006; 88: 993–999. [PubMed] [Google Scholar]
52. Сергиев П.В., Серебрякова М.В., Богданов А.А., Донцова О.А. Ген ybiN Escherichia coli кодирует аденин-N6-метилтрансферазу, специфичную для модификации А1618 23S рибосомной РНК, метилированного остатка, расположенного вблизи выходного канала рибосомы. Дж. Мол. биол. 2008;375:291–300. [PubMed] [Google Scholar]
53. Brodersen DE, Clemons WM, Jr, Carter AP, Morgan-Warren RJ, Wimberly BT, Ramakrishnan V. Структурная основа действия антибиотиков тетрациклина, пактамицина и гигромицина B на 30S субъединица рибосомы. Клетка. 2000; 103:1143–1154. [PubMed] [Google Scholar]
54. Картер А.П., Клемонс В.М., Бродерсен Д.Е., Морган-Уоррен Р.Дж., Уимберли Б.Т., Рамакришнан В. Функциональные выводы из структуры 30S рибосомной субъединицы и ее взаимодействия с антибиотиками. Природа. 2000;407:340–348. [PubMed] [Академия Google]
55. Hansen JL, Schmeing TM, Moore PB, Steitz TA. Структурное понимание образования пептидных связей. проц. Натл акад. науч. США. 2002;99:11670–11675. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Структурное понимание образования пептидных связей. проц. Натл акад. науч. США. 2002;99:11670–11675. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Tu D, Blaha G, Moore PB, Steitz TA. Структуры антибиотиков MLSBK, связанных с мутировавшими большими рибосомными субъединицами, обеспечивают структурное объяснение резистентности. Клетка. 2005; 121: 257–270. [PubMed] [Google Scholar]
57. Schluenzen F, Takemoto C, Wilson DN, Kaminishi T, Harms JM, Hanawa-Suetsugu K, Szaflarski W, Kawazoe M, Shirouzu M, Nierhaus KH, et al. Антибиотик казугамицин имитирует нуклеотиды мРНК, дестабилизируя связывание тРНК и ингибируя инициацию канонической трансляции. Нац. Структура Мол. биол. 2006; 13: 871–878. [PubMed] [Академия Google]
58. Боровинская М.А., Шоджи С., Фредрик К., Кейт Дж.Х. Структурные основы ингибирования биосинтеза белка гигромицином В. РНК. 2008; 14:1590–1599. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Боровинская М.А., Шоджи С., Холтон Дж. М., Фредрик К., Кейт Дж.Х. Стерический блок трансляции, вызванный антибиотиком спектиномицином. АКС хим. биол. 2007; 2: 545–552. [Бесплатная статья PMC] [PubMed] [Google Scholar]
М., Фредрик К., Кейт Дж.Х. Стерический блок трансляции, вызванный антибиотиком спектиномицином. АКС хим. биол. 2007; 2: 545–552. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Schuwirth BS, Day JM, Hau CW, Janssen GR, Dahlberg AE, Cate JH, Vila-Sanjurjo A. Структурный анализ ингибирования трансляции касугамицином. Нац. Структура Мол. биол. 2006;13:879–886. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Гурель Г., Блаха Г., Мур П.Б., Стейц Т.А. U2504 определяет видовую специфичность антибиотиков расщелины А-сайта: структуры тиамулина, гомохаррингтона и брукантина, связанные с рибосомой. Дж. Мол. биол. 2009; 389: 146–156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Zhou J, Bhattacharjee A, Chen S, Chen Y, Duffy E, Farmer J, Goldberg J, Hanselmann R, Ippolito JA, Lou R, et al. Дизайн на атомном уровне: дизайн биарилоксазолидинонов как сильнодействующих перорально активных антибиотиков. биоорг. Мед. хим. лат. 2008;18:6175–6178. [PubMed] [Академия Google]
63. Schlunzen F, Zarivach R, Harms J, Bashan A, Tocilj A, Albrecht R, Yonath A, Franceschi F. Структурные основы взаимодействия антибиотиков с пептидилтрансферазным центром эубактерий. Природа. 2001; 413:814–821. [PubMed] [Google Scholar]
Schlunzen F, Zarivach R, Harms J, Bashan A, Tocilj A, Albrecht R, Yonath A, Franceschi F. Структурные основы взаимодействия антибиотиков с пептидилтрансферазным центром эубактерий. Природа. 2001; 413:814–821. [PubMed] [Google Scholar]
64. Schlunzen F, Harms JM, Franceschi F, Hansen HA, Bartels H, Zarivach R, Yonath A. Структурная основа антибиотической активности кетолидов и азалидов. Состав. 2003; 11: 329–338. [PubMed] [Google Scholar]
65. Berisio R, Harms J, Schluenzen F, Zarivach R, Hansen HA, Fucini P, Yonath A. Структурное понимание антибиотического действия телитромицина против устойчивых мутантов. Дж. Бактериол. 2003; 185:4276–4279.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Harms JM, Schlunzen F, Fucini P, Bartels H, Yonath A. Изменения в пептидилтрансферазном центре рибосомы, вызванные синергетическим действием стрептограминов дальфопристин и хинупристин. БМС Биол. 2004; 2:4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Bashan A, Agmon I, Zarivach R, Schluenzen F, Harms J, Berisio R, Bartels H, Franceschi F, Auerbach T, Hansen HA, et al. Структурная основа рибосомного механизма образования пептидных связей, транслокации и прогрессии зарождающейся цепи. Мол. Клетка. 2003;11:91–102. [PubMed] [Google Scholar]
Структурная основа рибосомного механизма образования пептидных связей, транслокации и прогрессии зарождающейся цепи. Мол. Клетка. 2003;11:91–102. [PubMed] [Google Scholar]
68. Berisio R, Schluenzen F, Harms J, Bashan A, Auerbach T, Baram D, Yonath A. Структурное понимание роли рибосомного туннеля в клеточной регуляции. Нац. Структура биол. 2003; 10: 366–370. [PubMed] [Google Scholar]
69. Schlunzen F, Pyetan E, Fucini P, Yonath A, Harms JM. Ингибирование образования пептидной связи плевромутилинами: структура 50S рибосомной субъединицы Deinococcus radiodurans в комплексе с тиамулином. Мол. микробиол. 2004; 54: 1287–129.4. [PubMed] [Google Scholar]
70. Wilson DN, Schluenzen F, Harms JM, Starosta AL, Connell SR, Fucini P. Оксазолидиноновые антибиотики нарушают рибосомальный пептидилтрансферазный центр и влияют на позиционирование тРНК. проц. Натл. акад. науч. США. 2008;105:13339–13344. [Статья бесплатно PMC] [PubMed] [Google Scholar]
71. Pyetan E, Baram D, Auerbach-Nevo T, Yonath A.
