Анодная защита кузова автомобиля от коррозии: Катодная защита кузова от коррозии
Содержание
Анодная защита кузова от корозии » Полезные самоделки ✔тысячи самоделок для всей семьи
Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
О катодной защите кузова ранее писалось в здесь>>> но в этот раз немного дополним эту статью.
Ржавчина — враг номер один почти любого металла. «Рыжая чума», с завидным упорством и постоянством превращающая сотни тонн сверкающей высокосортной, легированной стали в груды коричневого порошка. Болезнь, для которой не существует преград… Но существуют лекарства и от нее: гальванические покрытия, лаки и краски, битумы и мастики — все они в принципе должны защитить металл. Но на деле все не так просто.
Болезнь, для которой не существует преград… Но существуют лекарства и от нее: гальванические покрытия, лаки и краски, битумы и мастики — все они в принципе должны защитить металл. Но на деле все не так просто.
Очень остро проблема защиты от коррозии стоит, к примеру, перед автомобилистами. Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
Электродный потенциал? А какое он, собственно, имеет отношение к коррозии металлов? Оказывается, самое непосредственное.
Если опустить в сосуд с электролитом два электрически связанных между собой металлических электрода, то один из них начнет растворяться, другой же останется в неприкосновенности. Так вот, оказывается, растворяется металл, электродный потенциал которого выше. Это свойство гальванической пары и дало возможность использовать эффект сохранения катода для предохранения от электрохимической коррозии кузова автомобиля.
Судостроители давно уже используют этот принцип предохранения внутренней части трюма от коррозии — они размещают внутри корпуса специальные металлические аноды (из металла с более высоким электродным потенциалом, чем у металла корпуса). Этот способ недавно взяли на вооружение и автомобилисты.
Для анодной защиты применяют оребренные (для увеличения поверхности) куски цинка С помощью вделанных в них постоянных магнитов они прикрепляются в наиболее труднодоступных и загрязняемых местах кузова. Электрическая связь осуществляется многожильным проводом: с помощью винтов цинковый анод подсоединяется к кузову.
Электрическая связь осуществляется многожильным проводом: с помощью винтов цинковый анод подсоединяется к кузову.
На его ребрах собирается дорожная грязь, влага, поваренная соль и комплект «цинк — сталь» начинает работать так, как работает всем известный гальванический элемент. При работе такой «батареи» происходит растворение цинкового анода, катод в данном случае не расходуется.
Рис. 1. Комплект для анодной защиты кузова автомобиля:
1 — оребренный цинковый электрод, 2 — соединительный провод.
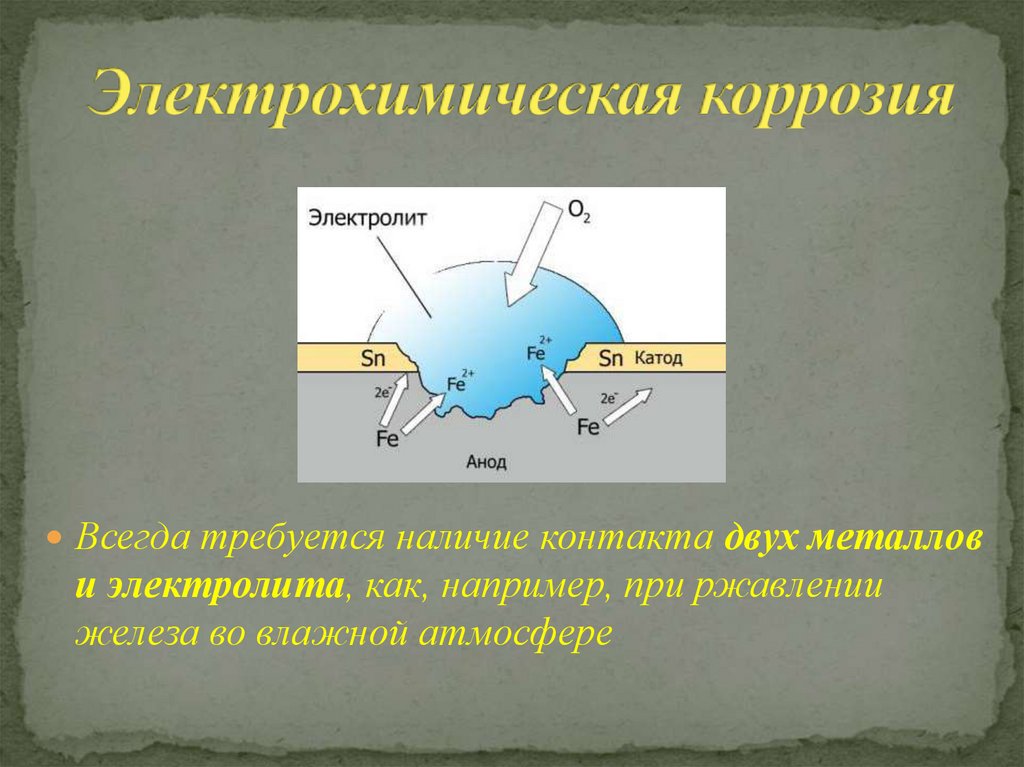
Процесс коррозии напоминает работу гальванического элемента, поскольку сталь представляет собой, в основном, сплав железа и углерода, то есть веществ с различными электродными потенциалами. При попадании на поверхность такого сплава электролита между молекулами железа и углерода начинает идти электрохимическая реакция, сопровождающаяся растворением анода (железа) и переходом его в гидраты, а затем и в окислы.
Рис. 2. Установка электрода в колесной нише.
Присутствие же электрически связанного с основным металлом цинкового электрода в корне меняет картину. По отношению, как к железу, так и к углероду цинк представляет собой металл с более высоким электродным потенциалом, то есть выступает в роли анода. Поэтому при наличии электропроводной среды, которая практически всегда присутствует на поверхностях автомобильного кузова, электрохимическая реакция идет с растворением анода (цинка), при сохранении катода, то есть металла кузова.
Рис. 3. Установка электродов в этих точках наиболее эффективна:
1 — коробчатые усилители брызговиков, 2 — места крепления корпусов фар и подфарников, 3 — нижняя часть передней панели, 4 — полости за щитками-усилителями передних крыльев, 5 — внутренние поверхности дверей, 6, 7 — передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 — фартук задней панели.
Как показали эксперименты, цинкового электрода величиной со спичечную коробку хватает на 3-5 лет.
Обманите «рыжую чуму». Подсуньте ей приманку — кусочек металла с электродным потенциалом выше, чем у стали. Коррозия охотно вцепится в него, забыв про кузов вашего автомобиля как минимум на три год.
Катодная защита кузова авто — эффективный способ защиты авто от коррозии!
Защищать машину от ржавчины следует на протяжении всего времени ее эксплуатации. Так уж заложено в природе, что все металлические изделия подвержены агрессивному химическому воздействию окружающей среды. Сегодня поговорим о коррозии, которая быстро разрушает металл, а также о том, как эффективно ей противостоять. Для противодействия данной неприятности используются разные методы, и одним из наиболее эффективных способов считается катодная защита автотранспорта от ржавчины.
Обработка всевозможными антикоррозийными препаратами дает только временный эффект. А когда железо подвергается еще и сварочным действиям, тогда спасти ослабевший металл (на участке сварочного шва) не получится ни у одного средства.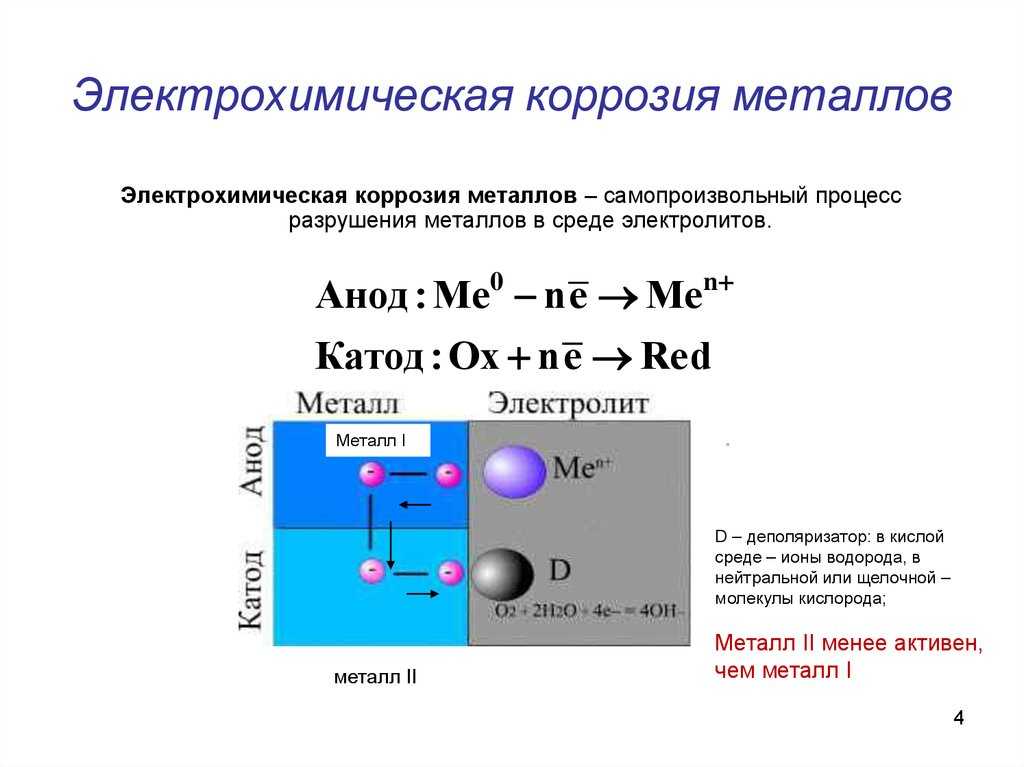 Однако есть одно исключение. Это катодная защита от коррозии.
Однако есть одно исключение. Это катодная защита от коррозии.
Катодная защита авто в действии
В этой статье вы узнаете о том, что такое катодная защита кузова, на чем она базируется, а также об основных преимуществах использования такой защиты. Следует отметить, что этот вид защиты кардинально отличается от всех остальных видов антикоррозийной защиты. В сравнении с остальными вариантами (Мовилем, мастикой и т.д.), катодный вариант защиты является высокотехнологичным.
Принцип действия указанного метода базируется на разнице полей анода и катода. В частности, катодная защита кузова предусматривает применение автомобильного кузова в качестве катода. Для этого к кузову автомобиля присоединяется минусовый контакт. А в качестве анода (плюсового контакта) используется любой материал, способный проводить ток (например, обычная железная пластина). По образовавшейся цепи протекает слабый ток, что приводит к разрушению анода. При этом сам кузов машины (выступающий в роли катода) находится под защитой, и поэтому не подвергается воздействию коррозии.
Как правило, в качестве источника питания применяется стандартный автомобильный аккумулятор. Благодаря тому, что по цепи идет ток низкого напряжения, есть возможность поддерживать защиту даже при очень слабом заряде АКБ.
Что можно задействовать в качестве анода?
Самым элементарным и эффективным вариантом считается такой способ, при котором в качестве анода применяется обычный железный гараж. В этом случае все очень просто. Нужно только подключиться к одной из его стенок.
Когда же автотранспорт хранится на улице, тогда самым результативным методом защиты станет применение особых резино-металлических компонентов. В народе они известны как антистатики. Кроме того, по периметру машины обязательно следует натянуть проволоку и посредством резистора подсоединить к ней авто. Подобный вариант гарантирует защиту днища автомобиля даже в тех случаях, когда машина хранится на улице, а не внутри гаража.
Нужно отметить и такой важный момент, что в зимний сезон года катодная защита от коррозии действует лишь при тщательной очистке машины от различных реагентов, которыми обильно посыпаются наши дороги. Когда на транспортном средстве будет слой грязи (содержащий реагенты), тогда катодная защита попросту станет бесполезной перед такой сильной химической «атакой» на ваш автомобиль.
Когда на транспортном средстве будет слой грязи (содержащий реагенты), тогда катодная защита попросту станет бесполезной перед такой сильной химической «атакой» на ваш автомобиль.
Текст: vopros-avto.ru
Жертвенный анод — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 256
Жертвенные аноды представляют собой высокоактивные металлы, которые используются для предотвращения коррозии поверхности менее активного материала. Жертвенные аноды создаются из металлического сплава с более отрицательным электрохимическим потенциалом, чем у другого металла, для защиты которого он будет использоваться. Жертвенный анод будет потребляться вместо металла, который он защищает, поэтому его называют «жертвенным» анодом.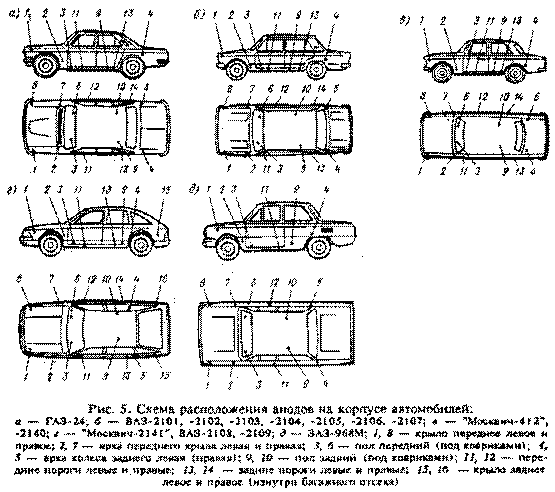
Катодная защита
Когда металлические поверхности вступают в контакт с электролитами, они подвергаются электрохимической реакции, известной как коррозия. Коррозия — это процесс возвращения металла в его естественное состояние в виде руды, вызывающий в этом процессе распад металла и ослабление его структуры. Эти металлические поверхности используются повсюду вокруг нас — от трубопроводов до зданий и кораблей. Важно обеспечить, чтобы эти металлы прослужили как можно дольше, и поэтому требуется так называемая катодная защита.
Жертвенные аноды относятся к нескольким формам катодной защиты. Другими формами катодной защиты являются
- гальваника,
- гальванизация и
- формирование сплавов.
Металл в морской воде является одним из таких примеров, когда металлическое железо контактирует с электролитами. При нормальных обстоятельствах металлическое железо реагировало бы с электролитами и начинало корродировать, ослабляя структуру и распадаясь. Добавление цинка, расходуемого анода, предотвратит «коррозию» металлического железа. Согласно таблице стандартных восстановительных потенциалов, стандартный восстановительный потенциал цинка составляет около -0,76 вольт. Стандартный восстановительный потенциал железа составляет около -0,44 вольта. Эта разница в восстановительном потенциале означает, что цинк будет окисляться намного быстрее, чем железо. На самом деле цинк полностью окислится до того, как железо начнет реагировать.
Добавление цинка, расходуемого анода, предотвратит «коррозию» металлического железа. Согласно таблице стандартных восстановительных потенциалов, стандартный восстановительный потенциал цинка составляет около -0,76 вольт. Стандартный восстановительный потенциал железа составляет около -0,44 вольта. Эта разница в восстановительном потенциале означает, что цинк будет окисляться намного быстрее, чем железо. На самом деле цинк полностью окислится до того, как железо начнет реагировать.
Какие материалы используются для расходуемых анодов?
Материалы, используемые для расходуемых анодов, представляют собой либо относительно чистые активные металлы, такие как цинк или магний, либо магниевые или алюминиевые сплавы, специально разработанные для использования в качестве расходуемых анодов. В приложениях, где аноды заглублены, анод окружает специальный материал обратной засыпки, чтобы гарантировать, что анод будет давать желаемую мощность.
Поскольку расходуемый анод работает за счет введения другой металлической поверхности с более отрицательной электроотрицательной и гораздо более анодной поверхностью. Ток будет течь от вновь введенного анода, и защищаемый металл становится катодным, создавая гальванический элемент. Реакции окисления переносятся с поверхности металла на гальванический анод и приносятся в жертву в пользу защищенной металлической структуры.
Ток будет течь от вновь введенного анода, и защищаемый металл становится катодным, создавая гальванический элемент. Реакции окисления переносятся с поверхности металла на гальванический анод и приносятся в жертву в пользу защищенной металлической структуры.
Рисунок 1 . Частично проржавевший жертвенный анод на корпусе корабля. Цифры взяты из Википедии
Как надеваются жертвенные аноды?
Жертвенные аноды обычно поставляются либо с проводами, либо с литыми ремнями для облегчения их соединения с защищаемой конструкцией. Токоподводящие провода могут быть прикреплены к конструкции с помощью сварки или механических соединений. Они должны иметь низкое сопротивление и должны быть изолированы, чтобы предотвратить повышенное сопротивление или повреждение из-за коррозии. При использовании анодов с залитыми хомутами хомуты можно либо приварить непосредственно к конструкции, либо использовать в качестве мест для крепления.
Для хорошей защиты и устойчивости к механическим повреждениям требуется крепление с низким механическим сопротивлением. В процессе подачи электронов для катодной защиты менее активного металла более активный металл подвергается коррозии. Более активный металл (анод) приносится в жертву, чтобы защитить менее активный металл (катод). Степень коррозии зависит от металла, используемого в качестве анода, но прямо пропорциональна величине подаваемого тока.
В процессе подачи электронов для катодной защиты менее активного металла более активный металл подвергается коррозии. Более активный металл (анод) приносится в жертву, чтобы защитить менее активный металл (катод). Степень коррозии зависит от металла, используемого в качестве анода, но прямо пропорциональна величине подаваемого тока.
Применение
Жертвенные аноды используются для защиты корпусов кораблей, водонагревателей, трубопроводов, распределительных систем, наземных резервуаров, подземных резервуаров и нефтеперерабатывающих заводов. Аноды в системах катодной защиты с расходуемым анодом необходимо периодически осматривать и заменять по мере износа.
Ссылки
- «Контроль коррозии» NAVFAC MO-307 Сентябрь 1992 г.
- Петруччи, Ральф Х., Уильям С. Харвуд, Джеффри Херринг и Джеффри Д. Мадура. Общая химия: принципы и современные приложения. Девятое изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education, 2007. 848. Печать.
Проблемы
- Каковы цели использования расходуемых анодов?
- Как работают жертвенные аноды?
- Какие другие виды катодной защиты?
- Какие различные металлы можно использовать в качестве расходуемых анодов? (название три)
Ответы
- Жертвенные аноды используются для защиты металлических конструкций от коррозии.

- Жертвенные аноды окисляются быстрее, чем металл, который они защищают, и полностью расходуются до того, как другой металл вступит в реакцию с электролитами.
- Несколько различных форм катодной защиты включают формование сплавов, гальваническое покрытие и цинкование металла.
- В качестве расходуемых анодов можно использовать три металла: цинк, алюминий и магний.
Жертвенный анод распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Общие | OT: Кто-нибудь использовал жертвенные цинковые аноды в автомобиле? | Практик Машинист
САГ 180
Титан
#1
Кто-нибудь на форуме пробовал прикреплять жертвенные цинковые аноды к кузову автомобиля для уменьшения коррозии?. Я живу во влажной, сырой, тропической среде, недалеко от моря: сегодня утром я поднял кусок переработанного цинкового анода лодки, который я оставил на несколько недель в качестве ржавого стального 4WD. Участок под ним имеет значительно меньше ржавчины другого цвета по сравнению с остальной мягкой сталью. Было бы разумно взять эти маленькие 1,5-дюймовые квадратные цинковые аноды и прикрепить их под автомобилем и внутри дверей, чтобы уменьшить ржавчину? парк в сравнении?.
Участок под ним имеет значительно меньше ржавчины другого цвета по сравнению с остальной мягкой сталью. Было бы разумно взять эти маленькие 1,5-дюймовые квадратные цинковые аноды и прикрепить их под автомобилем и внутри дверей, чтобы уменьшить ржавчину? парк в сравнении?.
Чип Честер
Алмаз
#2
Возможно, стоит попробовать спрей для холодного цинкования. Только что переснял трейлер, посмотрим, что получится. Однако вся эта подготовка к очистке стекла может стать барьером для входа. Также доступен без распыления.
Согласно веб-сайту ZRC, защита оцинковки фактически распространяется на царапины, защищая неоцинкованную сталь на несколько миллиметров.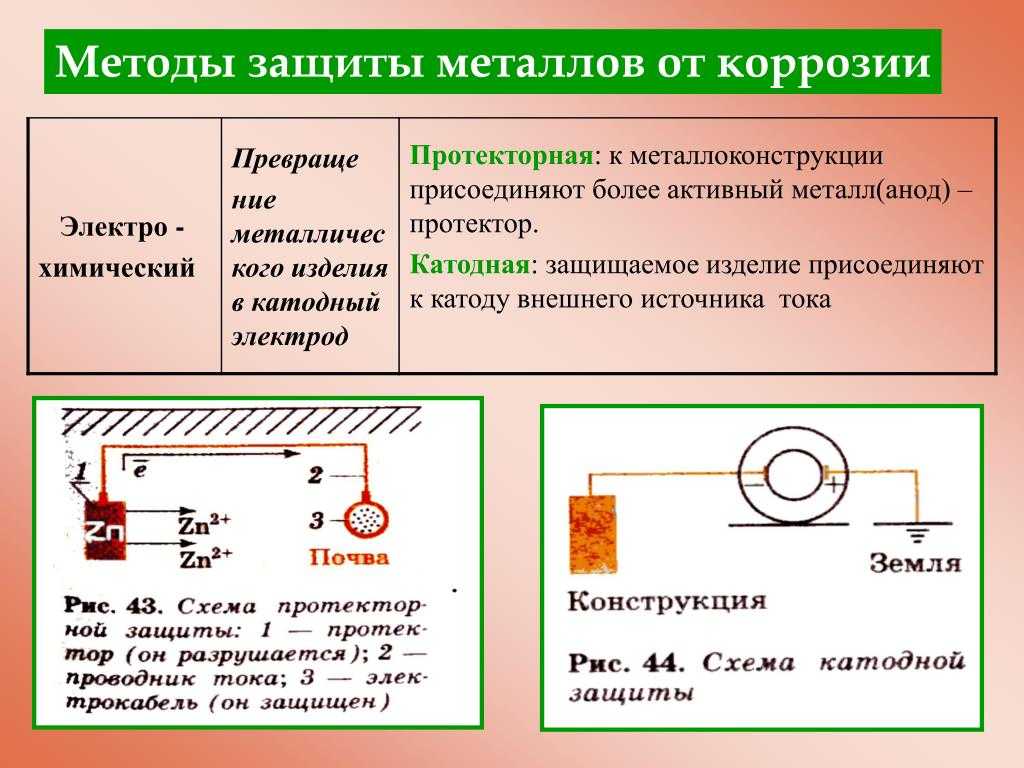
Чип
JST
Алмаз
#3
«Бросок» защиты в воде намного дольше. Вам нужно, чтобы защищенная зона и цинк находились в одной воде.
На автомобиле вода и сырость — это все локально, так что гальванопокрытие лучше, чем цинковый электрод. Если не оцинковка, то упомянутая краска хорошая.
Краска «достигает» или «выбрасывает» на некоторое расстояние, пока она и рассматриваемая область находятся в одной и той же воде. На машине, которая обычно не на большом расстоянии, поскольку вода одновременно , так и в тонком покрытии.
Мне трудно найти что-либо, кроме спрея, который ВСЕГДА забивается задолго до того, как он опустеет.
DDoug
Алмаз
#4
У меня есть пара подержанных грузовиков в жертву хорошему.
Я нахожу соотношение 2 к 1, и отсутствие блоков, похоже, помогает.
САГ 180
Титан
#5
JST сказал:
«Бросок» защиты в воде намного дольше.
Вам нужно, чтобы защищенная зона и цинк находились в одной воде.
В машине вода и сырость — это все локально, так что гальванопокрытие лучше, чем цинковый электрод. Если не оцинковка, то упомянутая краска хорошая.
Краска «достигает» или «выбрасывает» на некоторое расстояние, пока она и рассматриваемая область находятся в одной и той же воде. На машине, которая обычно не на большом расстоянии, поскольку вода одновременно , так и в тонком покрытии.
Мне трудно найти что-либо, кроме спрея, который ВСЕГДА забивается задолго до того, как он опустеет.
Нажмите, чтобы развернуть…
Я полагаю, что цинковый спрей — это следующий лучший способ после горячего цинкования кузова автомобиля. Я мог бы попробовать это И в любом случае несколько анодов в панелях порогов и нижней части дверей.
копатель Дуг сказал:
У меня есть пара подержанных грузовиков в жертву хорошему.

Я нахожу соотношение 2 к 1, и не ставить блоки, похоже, помогает.Нажмите, чтобы развернуть…
Есть ли какая-то оккультная процедура переноса ржавчины с хорошего грузовика на грузовики-доноры, а-ля «Картина Дориана Грея»?, или еще лучше «Кристина» Стивена Кинга?
Джашли73
Титан
#6
Я думал, что вся идея расходуемых анодов заключалась в том, чтобы предотвратить накопление статического электричества на объектах, проходящих через жидкость, что каким-то образом приводило к коррозии металла под действием статического разряда? Если бы расходуемых анодов не было, то металлические детали (выходит из строя) сгниет, пока лодка будет плыть по воде. ..?
..?
Возможно, я ошибаюсь насчет этого…?
kb0thn
Горячекатаный
#7
JST сказал:
Мне трудно найти что-либо, кроме спрея, который ВСЕГДА забивается задолго до того, как он опустеет.
Нажмите, чтобы развернуть…
Я покупаю и использую около дюжины баллончиков с цинковой краской в год. Я не могу вспомнить, чтобы у меня когда-либо был засор. Вы распыляете его вверх дном, пока он не станет прозрачным в конце использования? Я всегда так делаю.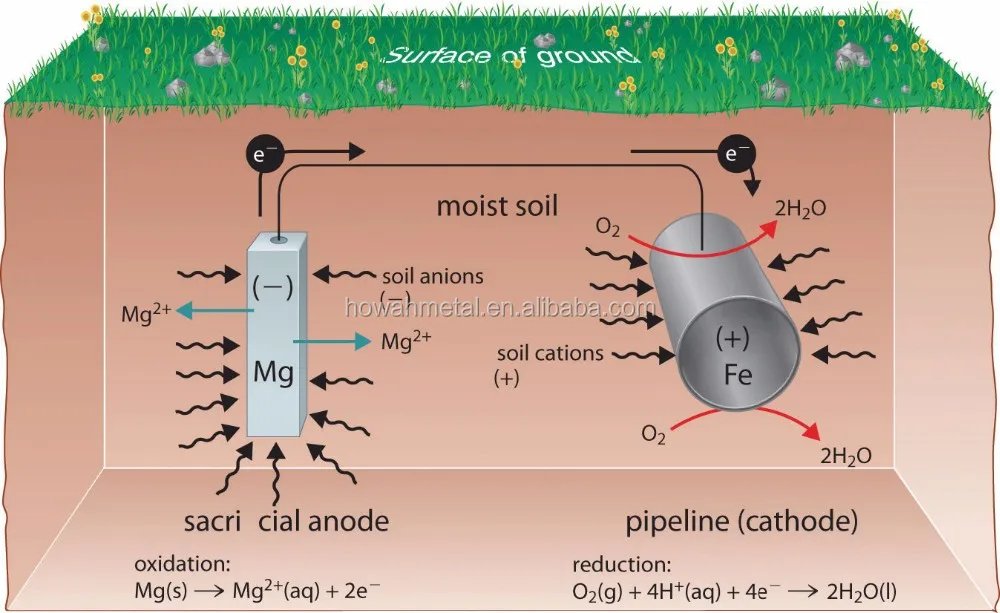
Когда я захожу в магазин, я могу посмотреть, какой бренд я использую.
JST
Алмаз
#8
Да, знаю, но с более новыми баллончиками «распылитель в любом месте» они просто распыляют краску независимо от того, как вы их держите. Я обычно использую дешевые банки Rustoleum. Их средства работают так же хорошо, как и все остальные, и я полагаю, что если я получу больше одного сеанса из банки, то у меня будут деньги впереди. У меня есть некоторые части, которые лежат на крыше уже 15 лет, и краска все еще работает. Я никогда не закрашивал его.
САГ 180
Титан
#9
JST сказал:
Да, знаю, но с более новыми баллончиками «распылитель в любом месте» они просто распыляют краску независимо от того, как вы их держите. Я обычно использую дешевые банки Rustoleum. Их средства работают так же хорошо, как и все остальные, и я полагаю, что если я получу больше одного сеанса из банки, то у меня будут деньги впереди. У меня есть некоторые части, которые лежат на крыше уже 15 лет, и краска все еще работает. Я никогда не закрашивал его.
Нажмите, чтобы развернуть…
Моей мастерской уже 8 лет, все винты и болты крыши снаружи покрыты серебристой краской для холодного цинкования, но не те, что под карнизом, которые оцинкованы: неокрашенные потеряли цинковую пластину и только начинают заржаветь. Я должен дать им очистить и покрыть их, а также.
Билл D
Алмаз
#10
Цинковые аноды на лодке работают как аккумулятор. Цинк электрически соединен с металлом лодки. он действует как мокрая батарея и создает небольшое электрическое напряжение между цинком и другими металлами. Это напряжение вызывает гальваническое действие, когда цинк наносится на другие металлы. это означает, что цинк выветривается, а другие металлы не ржавеют. АН связаны с электроотрицательностью между металлами.
На подземных трубопроводах и морских судах это можно сделать с помощью регулируемых электрических токов.
Билл D
Морской фермер
Алмаз
#11
Цинк работает только в том случае, если он связан с исходным материалом чем-то проводящим. Таким образом, прикрепление цинка к вашей машине будет отлично работать, пока вы паркуете ее под водой; но я никогда не был в вашем районе, поэтому не знаю, является ли это практичной альтернативой. Для запуска утром понадобятся два длинных шноркеля, один для двигателя и один для водителя, а зимой это будет неприятно.
Краска с высоким содержанием цинка эффективна в качестве первичной защиты только в том случае, если краска содержит 95% цинка или более. Многие из продаваемых цинковых красок содержат 93% цинка и предназначены для покрытия царапин или выбоин на уже оцинкованном металле, но они практически бесполезны для металла, который еще не оцинкован. Некоторые из них на 95% состоят из цинка и весьма эффективны. Я не знаю, почему эта разница в 2% имеет значение, но я знаю из дорогого опыта, что она имеет значение.
САГ 180
Титан
#12
Морской фермер сказал:
Цинк работает только в том случае, если он связан с исходным материалом чем-то проводящим. Таким образом, прикрепление цинка к вашей машине будет отлично работать, пока вы паркуете ее под водой; но я никогда не был в вашем районе, поэтому не знаю, является ли это практичной альтернативой. Для запуска утром понадобятся два длинных шноркеля, один для двигателя и один для водителя, а зимой это будет неприятно.
Краска с высоким содержанием цинка эффективна в качестве первичной защиты только в том случае, если краска содержит 95% цинка или более.
Многие из продаваемых цинковых красок содержат 93% цинка и предназначены для покрытия царапин или выбоин на уже оцинкованном металле, но они практически бесполезны для металла, который еще не оцинкован. Некоторые из них на 95% состоят из цинка и весьма эффективны. Я не знаю, почему эта разница в 2% имеет значение, но я знаю из дорогого опыта, что она имеет значение.
Нажмите, чтобы развернуть…
Это было бы практично в Дарвине, так как через полчаса прибывает прилив, поэтому полноприводные автомобили на прибрежных отмелях ловятся, когда прилив приходит слишком быстро, чтобы машины могли его опередить. Но ничего такого, что не исправит WD-40, позаимствованный у проплывающей мимо российской подводной лодки. Там, где я нахожусь, нередки ежедневные дожди в течение нескольких недель подряд, поэтому автомобиль будет промокнуть в течение продолжительных периодов времени в течение нескольких недель в течение сезона дождей.
Улица
Горячекатаный
№13
Когда я был в Кэрнсе, местный житель каждый год распылял на днище своего полноприводного автомобиля смесь масла и средства для предотвращения ржавчины черного тела.
рыбий жир хорошо работает в панелях, таких как пороги, двери, передние обтекатели и т. д.
Как указывалось ранее в другом посте, соляной спрей, когда соль высохнет, единственный способ удалить ее — промыть в пресной воде и высушить, смазать маслом и т.п., не работает при воздействии соли.
Что касается анодов, опустите свой автомобиль в электролит, в данном случае океан, и он будет работать до тех пор, пока анод (цинк) не съест, если ваш электролит пресная вода или тиннаро, используйте магниевый анод.
Последнее в шутку тоже не делай….
стив-л
Титан
№14
В ответ на вопрос ОП, нет, это не сработает. Назначение цинка в соленой воде или куска магния в пресной воде состоит в том, чтобы представить менее благородный жертвенный анод для электролитической коррозии. Электролитическая коррозия является естественным явлением, вызванным естественной разницей электрического заряда между различными металлами в присутствии электролита, такого как вода. Чем больше расстояние между металлами, наблюдаемое в таблице элементов, тем больше разница зарядов и больше потенциал для электрической коррозии. Использование жертвенных анодов — это не лекарство, а стратегия пластыря. Чтобы иметь электрическую коррозию, вы должны иметь разнородные металлы в полной электрической цепи через электролит. Вместо того, чтобы поощрять электрическую коррозию, гораздо лучше предотвратить использование разнородных металлов или изолировать их электрически. В случае с ОП этих факторов не существует. Коррозия у него не электрическая.
Коррозия у него не электрическая.
САГ 180
Титан
№15
стив-л сказал:
В ответ на вопрос ОП, нет, это не сработает. Назначение цинка в соленой воде или куска магния в пресной воде состоит в том, чтобы представить менее благородный жертвенный анод для электролитической коррозии. Электролитическая коррозия является естественным явлением, вызванным естественной разницей электрического заряда между различными металлами в присутствии электролита, такого как вода. Чем больше расстояние между металлами, наблюдаемое в таблице элементов, тем больше разница зарядов и больше потенциал для электрической коррозии.
Использование жертвенных анодов — это не лекарство, а стратегия пластыря. Чтобы иметь электрическую коррозию, вы должны иметь разнородные металлы в полной электрической цепи через электролит. Вместо того, чтобы поощрять электрическую коррозию, гораздо лучше предотвратить использование разнородных металлов или изолировать их электрически. В случае с ОП этих факторов не существует. Коррозия у него не электрическая.
Нажмите, чтобы развернуть…
Весь смысл расходуемого цинкового анода состоит в том, чтобы на самом деле создать электрическую коррозию , которая благоприятствует стали за счет цинка. Как указывали другие плакаты, «бросок» цинка ограничен, когда он влажный, а не в электролите. Ограниченная область защиты обходится путем окрашивания целых областей, подлежащих защите, цинком. Очевидно, что это работает, но только если покрыть всю поверхность, чтобы защитить ее от ржавчины.
Дэйв Г.

Чугун
№16
САГ 180 сказал:
Весь смысл расходуемого цинкового анода состоит в том, чтобы фактически создать электрическую коррозию, которая благоприятствует стали за счет цинка. Как указывали другие плакаты, «бросок» цинка ограничен, когда он влажный, а не в электролите. Ограниченная область защиты обходится путем окрашивания целых областей, подлежащих защите, цинком. Очевидно, что это работает, но только если покрыть всю поверхность, чтобы защитить ее от ржавчины.
Нажмите, чтобы развернуть…
Идея состоит в том, чтобы приложить к стали напряжение, чтобы «протолкнуть» ее в область, где железо термодинамически стабильно. Прикрепление цинкового анода к стали в воде создает напряжение ~1,5 вольта и защищает сталь от окисления. Как указано другими членами, цинк и сталь должны быть электрически соединены, а между ними должна быть непрерывная вода. См. прилагаемую диаграмму Пурбэ:
Прикрепление цинкового анода к стали в воде создает напряжение ~1,5 вольта и защищает сталь от окисления. Как указано другими членами, цинк и сталь должны быть электрически соединены, а между ними должна быть непрерывная вода. См. прилагаемую диаграмму Пурбэ:
дгфостер
Алмаз
# 17
В Вики есть довольно хорошая статья, которая хорошо связывает всю эту информацию воедино. Был даже небольшой раздел, посвященный непосредственно исходному вопросу ОП.
Катодная защита — Википедия
Из статьи: «Автомобили
Несколько компаний продают электронные устройства, заявляя, что они уменьшают коррозию для автомобилей и грузовиков. [SUP][37][/SUP] Специалисты по борьбе с коррозией обнаруживают, что они не работают.[SUP][38] [/SUP] Нет никаких рецензируемых научных испытаний и подтверждений, поддерживающих использование устройств.В 1996 году FTC приказала Дэвиду Маккриди, человеку, который продавал устройства, утверждающие, что они защищают автомобили от коррозии, выплатить реституцию и запретила названия «Rust Buster». » и «Раст Эвейдер».[SUP][39]»[/SUP]
[SUP][37][/SUP] Специалисты по борьбе с коррозией обнаруживают, что они не работают.[SUP][38] [/SUP] Нет никаких рецензируемых научных испытаний и подтверждений, поддерживающих использование устройств.В 1996 году FTC приказала Дэвиду Маккриди, человеку, который продавал устройства, утверждающие, что они защищают автомобили от коррозии, выплатить реституцию и запретила названия «Rust Buster». » и «Раст Эвейдер».[SUP][39]»[/SUP]
Очень интересный предмет. Если вы хотите провести простой подтверждающий эксперимент, поместите чистый стальной гвоздь в чашку с соленой водой, а также кусок алюминия. Используйте вольтметр, чтобы измерить потенциал 0,5 В между двумя
Денис
Адама
Алмаз
# 18
Процентное содержание цинка имеет значение Морской фермер, потому что для того, чтобы покрытие работало, оно должно действовать как один компонент, а не как набор отдельных металлических частиц, изолированных друг от друга, только когда это сопротивление становится достаточно низким, вы получаете защиту, равную гальванизации .
Скоттл
Алмаз
# 19
Лучший способ защитить автомобиль — защитить все от прямого контакта с водой/электролитами. ИМО требуемый продукт зависит от места на транспортном средстве. Я использовал все, от воска для полости тела до полиэтиленовой краски, отверждаемой влагой, такой как POR-15. Раньше многие компании предлагали услуги по «защите от ржавчины», которые включали распыление воска для кузова в каждую щель и полость, сверление отверстий (позже закрытых пластиковыми заглушками) для доступа, где это необходимо. Если все сделано правильно, это значительно замедлит коррозию. Они также обычно применяли некоторую форму грунтовки.
Я использовал все, от воска для полости тела до полиэтиленовой краски, отверждаемой влагой, такой как POR-15. Раньше многие компании предлагали услуги по «защите от ржавчины», которые включали распыление воска для кузова в каждую щель и полость, сверление отверстий (позже закрытых пластиковыми заглушками) для доступа, где это необходимо. Если все сделано правильно, это значительно замедлит коррозию. Они также обычно применяли некоторую форму грунтовки.
Некоторые средства, которые я испробовал на протяжении нескольких десятилетий:
Boeshield (не впечатлил)
WD-40 (короткое действие, но лучше, чем ничего)
Воск для тела Wurth (необходимо время от времени наносить заново в таких местах, как двери, где вода стекает вниз)
Асфальтовое грунтовочное покрытие (работает очень хорошо, если его время от времени осматривать и подкрашивать)
Прорезиненное грунтовочное покрытие (может быть хуже, чем без покрытия, если под него попадают влага и соль)
LPS 3 (необходимо время от времени проверять и подкрашивать)
POR-15 и т. д. (работает очень хорошо, если все сделано правильно, но наносить PITA грязно)
д. (работает очень хорошо, если все сделано правильно, но наносить PITA грязно)
ACF-50 (отличный продукт, который останавливает коррозию, но смывает поверхности, подвергшиеся воздействию солевого тумана)
Профессиональные преобразователи ржавчины (должны наноситься правильно и затем покрыт сверху)
Коричневая грунтовка Rustoleum, разбавленная и обработанная кистью (работает, но есть продукты получше.)
И еще несколько, о которых я пока не могу вспомнить.
Несколько специалистов по кузовным работам посоветовали мне покрыть воском каждую окрашенную поверхность, до которой вы можете добраться, включая двери, капот и отверстия багажника, распылить профессиональный антикоррозийный состав для тяжелых условий эксплуатации в каждый уголок и щель и, самое главное, осмотреть и подправить защиту до того, как маленькие проблемы превратятся в большие.
Как правило, продукты профессионального уровня, используемые автомастерскими, намного превосходят по своим характеристикам продукты, которые можно купить в магазинах запчастей и хозяйственных магазинах.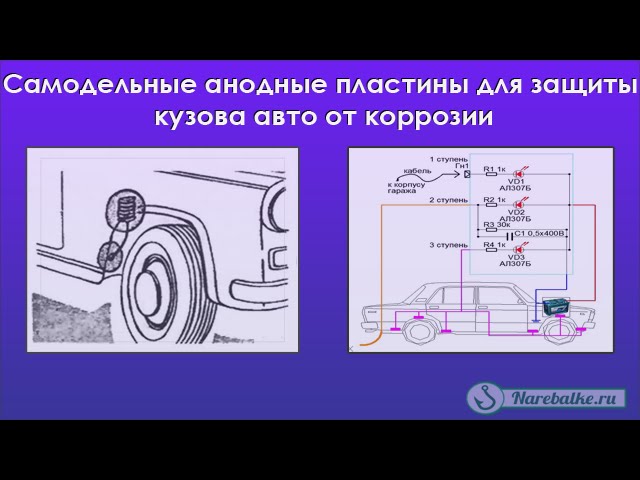
Билл D
Алмаз
#20
Адама сказал:
Процент цинка имеет значение, морской фермер, потому что для того, чтобы покрытие работало, оно должно действовать как один компонент, а не как набор отдельных металлических частиц, изолированных друг от друга, только когда это сопротивление становится достаточно низким, вы получаете защиту, равную гальванизации. /QUOTE
Краска действует как изолятор, если процентное содержание цинка не достаточно велико, чтобы атомы цинка были электрически связаны друг с другом.


 Вам нужно, чтобы защищенная зона и цинк находились в одной воде.
Вам нужно, чтобы защищенная зона и цинк находились в одной воде.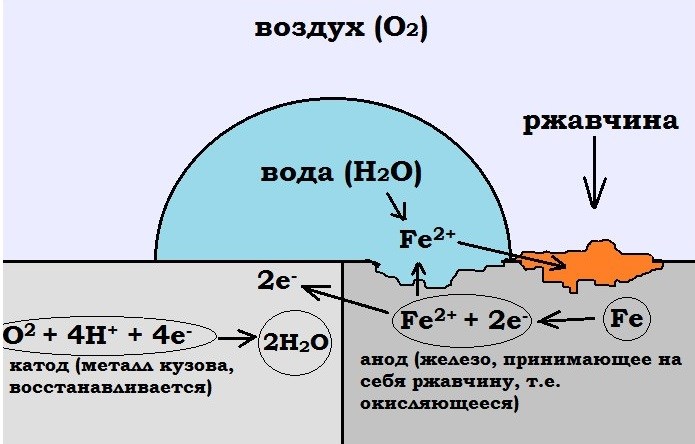
 Многие из продаваемых цинковых красок содержат 93% цинка и предназначены для покрытия царапин или выбоин на уже оцинкованном металле, но они практически бесполезны для металла, который еще не оцинкован. Некоторые из них на 95% состоят из цинка и весьма эффективны. Я не знаю, почему эта разница в 2% имеет значение, но я знаю из дорогого опыта, что она имеет значение.
Многие из продаваемых цинковых красок содержат 93% цинка и предназначены для покрытия царапин или выбоин на уже оцинкованном металле, но они практически бесполезны для металла, который еще не оцинкован. Некоторые из них на 95% состоят из цинка и весьма эффективны. Я не знаю, почему эта разница в 2% имеет значение, но я знаю из дорогого опыта, что она имеет значение. Использование жертвенных анодов — это не лекарство, а стратегия пластыря. Чтобы иметь электрическую коррозию, вы должны иметь разнородные металлы в полной электрической цепи через электролит. Вместо того, чтобы поощрять электрическую коррозию, гораздо лучше предотвратить использование разнородных металлов или изолировать их электрически. В случае с ОП этих факторов не существует. Коррозия у него не электрическая.
Использование жертвенных анодов — это не лекарство, а стратегия пластыря. Чтобы иметь электрическую коррозию, вы должны иметь разнородные металлы в полной электрической цепи через электролит. Вместо того, чтобы поощрять электрическую коррозию, гораздо лучше предотвратить использование разнородных металлов или изолировать их электрически. В случае с ОП этих факторов не существует. Коррозия у него не электрическая.