Чем отличается химическая коррозия от электрохимической: Химическая и электрохимическая коррозия – полное описание явления + Видео
Содержание
8.2.2. Электрохимическая коррозия
Электрохимическая
коррозия металла происходит в
средах, имеющих ионную проводимость (в
расплавах и растворах электролитов) и
отличается от химической механизмом
протекания.
Особенность
электрохимической коррозии заключается
в том, что две сопряженные реакции —
окисление металла и восстановление
окислителя осуществляются на различных
участках поверхности металлов Процессы
электрохимической коррозии подобны
процессам, протекающим в гальванических
элементах. Но, поскольку в коррозионном
элементе анод и катод непосредственно
соприкасаются друг с другом, то он
является короткозамкнутым (т.е. отсутствует
внешняя цепь).
Электрохимическая
коррозия может протекать:
в электролитах — водные растворы солей,
кислот, щелочей, морская вода;в атмосфере любого влажного газа;
в почве.
Особым
видом электрохимической коррозии
следует считать коррозию за счет внешнего
электрического тока. В качестве примеров
В качестве примеров
подобного рода разрушений можно привести
коррозию трубопроводов с токопроводящими
жидкостями, подземных металлических
сооружений.
МЕХАНИЗМ
ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Коррозия
металла в растворах электролитов
протекает через анодное окисление
металла
и
катодное восстановление окислителя
(деполяризатора D)
Схема
коррозионного гальванического элемента
может быть представлена следующим
образом:
Важнейшими
деполяризаторами, вызывающими коррозию,
являются растворенный кислород (O2)
и ионы водорода (H+).
Коррозия с участием кислорода протекает
с его поглощением, и ее называют коррозией
с кислородной деполяризацией.
в
кислой среде (рН < 7)
в
нейтральных и основных средах (рН > 7)
Коррозия с участием ионов водорода
сопровождается выделением водорода,
и ее называют коррозией с водородной
деполяризацией.
в
кислой среде (рН < 7)
в
нейтральных и основных средах (рН > 7)
Кроме
электрохимических реакций при коррозии
обычно протекают вторичные химические
реакции, например, взаимодействие ионов
металла с гидроксид-ионами, концентрация
которых повышается в результате катодных
реакций:
Men+
+ nOH— = Me(OH)n
ТЕРМОДИНАМИКА
ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Возможность
коррозии с водородной и кислородной
деполяризацией может быть установлена
с помощью формулы, связывающей энергию
Гиббса и напряжение гальванического
элемента.
Коррозия
возможна, если G <
0, т.е.
>
0.
Так
как напряжение равно разности потенциалов
окислителя и восстановителя
,
то
коррозия возможна при условии, что
потенциал окислителя положительнее
потенциала металла:
ок.
> Me/Men+
Для
определения возможности коррозии
металла в средах различного характера
пользуются диаграммой Пурбэ, показывающей
зависимость потенциалов водородного
и кислородного электродов от рН среды
(рис.7.4). Указанные зависимости базируются
на уравнении Нернста для водородного
и кислородного электродов:
h3/2H+
= -0,059· pH (при p(H2) = 101 кПа)
OH—/O2
= 1,23 — 0,059· pH (при p(O2) = 101 кПа)
Представленная
диаграмма характеризуется наличием
трех областей.
Если потенциал металла (область 1)
отрицательнее потенциала водородного
электрода (Me/Men+
< h3/2H+),
то возможна коррозия как с поглощением
кислорода, так и с выделением водорода.
К таким металлам относятся щелочные и
щелочноземельные металлы, алюминий,
цинк и др.Если потенциал металла положительнее
потенциала водородного электрода и
отрицательнее потенциала кислородного
электрода (Me/Men+
< OH—/O2)
(область 2), то коррозия возможна с
поглощением кислорода и невозможна с
выделением водорода.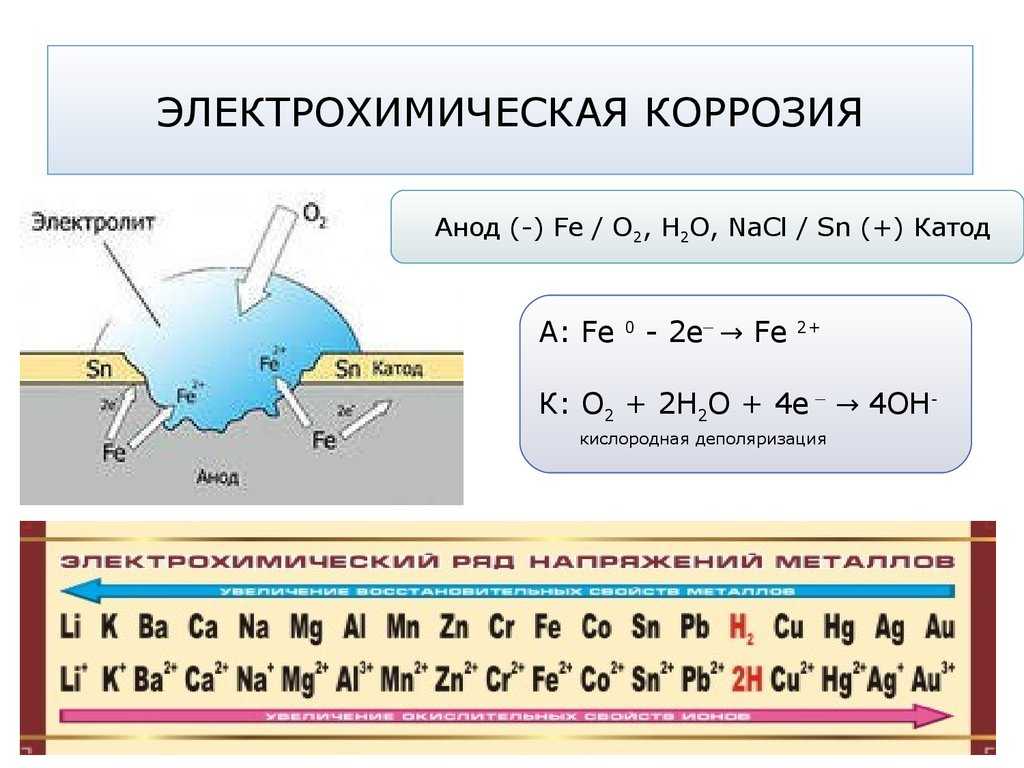 Потенциалы многих
Потенциалы многих
металлов лежат в области 2 (Cd, Ni, Sn и др.).Если потенциал металла положительнее
потенциала кислородного электрода
(Me/Men+
>OH—/O2)
(область 3), то коррозия металла невозможна.
Потенциал золота, например, Au/Au3+
= +1,5 В, в отсутствии комплексообразователя
во всей области рН положительнее
потенциала кислородного электрода.
Поэтому золото с поглощением O2
и выделением H2 корродировать не
может.
Таким
образом, при контакте металла с раствором
электролита в атмосферных условиях
большинство металлов может корродировать
с поглощением кислорода, и лишь некоторые
металлы — с выделением водорода.
что это и как с ней бороться
Все статьи
Коррозия — процесс разрушения металла под воздействием влаги, агрессивных веществ, с которым контактирует покрытие или изделие в процессе эксплуатации. Это явление распространено, его можно увидеть дома, на улице и на работе. Когда металл оказывается в щелочной, кислой среде начинается окисление, которое со временем преобразуется в ржавчину. Другими словами, происходит химическая коррозия.
Это явление распространено, его можно увидеть дома, на улице и на работе. Когда металл оказывается в щелочной, кислой среде начинается окисление, которое со временем преобразуется в ржавчину. Другими словами, происходит химическая коррозия.
Сегодня поговорим о другом типе коррозии, которая образуется из-за «блуждающих токов». Именно она появляется на кранах, полотенцесушителях и прочем сантехническом оборудовании. Разрушение металла «блуждающими токами» называют электрохимической коррозией.
Этому коррозийному процессу подвержены многие металлы, включая надёжную и долговечную нержавеющую сталь. Под воздействием электромеханического влияния изделие быстро теряет привлекательность, происходит разрушение швов, соединений, стенок металла. В результате возникает угроза аварийных ситуаций, вплоть до серьезных протечек, грозящих соседям снизу затоплением и порчей имущества.
Как определить электрохимическую коррозию
Рассмотрим пример образования признаков электрохимкоррозии на полотенцесушителе.
Оборудование производят из всевозможного сырья. Лучшим вариантом считаются модели из нержавейки, так как эксплуатационный период такого изделия гораздо продолжительней, нежели срок использования аналогов из других металлов. Однако, нержавеющая сталь не всегда способна справиться с агрессивным воздействием электрохимической коррозии.
На начальный процесс разрушения указывают практически незаметные пятна ржавчины, которая образуется на поверхности изделия, далее они добавляют в размерах, а значит — процесс прогрессирует и становится глубже.
Если очистить ржавчину грубым абразивом, то под ней прячется черная точка, говорящая об активном развитии разрушения. Так, ржавчина «поедает» металл снаружи и изнутри, создавая небольшое отверстие. В подобных случаях повреждениям подвергаются все изделие, включая фитинги. Коррозия, как правило, начинает развиваться на слабых участках, которыми являются сварные швы.
Если ржавчина обнаружена на изделии, изготовленном из стали высокого класса, то наверняка проблема заключается в наличии в воде электричества.
Электрохимкоррозия работает при поддержке «помощников», например, хлора, который используется предприятиями для обеззараживания воды, окислителя кислорода, солей кальция, магния и прочие вещества. Ржавчина активно распространяется под воздействием горячей воды — если жидкость внутри трубы нагревается свыше 70°С, разрушающее действие ускоряется.
Почему появляется коррозия?
Чтобы понимать всю схему появления ржавчины на сантехническом оборудовании, стоит знать, откуда в воде появляется электричество.
Среди причин:
- Если дом относится к старым постройкам, в нем может быть нереализованным качественное заземление, которое обязательно, если в квартире установлено множество бытовых приборов и современная сантехника, например, ванна с гидромассажем, водонагреватели и пр. Заземление обеспечивает безопасность использования техники.
При эксплуатации оборудования, которое имеет те или иные дефекты, происходит утечка токов, которые отправляются в стояки и взаимодействуют с водой.
 Таким образом появляются точечные «пробои», которые провоцируют образование ржавчины.
Таким образом появляются точечные «пробои», которые провоцируют образование ржавчины.Если заземление выполнено в соответствии с нормативами, подобные неприятности не появятся.
- Если в доме проживают любители сэкономить на оплате коммунальных счетов за электроэнергию, появляется проблема электрохимической коррозии. Так, недобросовестные жильцы используют стояк как нулевой провод или же применяют специальные приборы, чтобы «скрутить» показатели счетчика электроэнергии. В результате этих и других манипуляций высоки риски образования коррозийных процессов. Также ситуация небезопасна для жизни — при прикосновении к трубе существует риск удара током.
- Разница потенциалов между металлами провоцирует образование неприятности. Токи возникают, если два разных металла плотно контактируют друг с другом. Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов.

- Сегодня широко распространены новые материалы, используемые для изготовления труб и сантехнического оборудования: металлопластик, полиэтилен и пр. Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно.
- Образованию токов подвержены не только стояки, но и коммуникации, находящиеся под землей. Блуждающее электричество, находящееся в них, может попасть и в квартиру. На подземные системы оказывают воздействие электрический транспорт (трамвай, троллейбус, поезда метро). Появляются токи утечки, а устранить проблему смогут только эксплуатирующие компании, обязанные проводить тщательные проверки.
- Проблемы нередко возникают, если невдалеке от труб, отвечающих за подачу воды и отопление, присутствует электропроводка с некачественной изоляцией.
 Повреждения провоцируют появление токов, которые блуждают по трубам водоснабжения.
Повреждения провоцируют появление токов, которые блуждают по трубам водоснабжения. - Среди причин коррозии — статическое электричество, накапливающееся на металле при контакте с водой.
Произвести контроль над соответствием рекомендованных норм и соблюдением правил монтажа и использования оборудования в высотном доме не представляется возможным. Зачастую подобные работы выполняют мастера без опыта или с его минимальным наличием.
Как следствие — аварийные ситуации и неприятные последствия для жильцов дома. Если полотенцесушитель подвергается коррозии, вы можете не иметь к этому отношения, а также не приостановите процесс из-за разрушения инженерного оборудования по причинам, независящим от вас.
Как предотвратить электрохимическую коррозию
Существует несколько мер, которые помогут предотвратить разрушение металла:
- Приобретая полотенцесушитель, откажитесь от его установки. Работу стоит доверить опытным мастерам, которые имеют допуск к проведению подобных мероприятий.

- Конструкции в обязательном порядке нуждается в заземлении, что особенно актуально для тех, кто врезал пластиковые трубы, расположенные между общим стояком и полотенцесушителем.
Для заземления оборудования можно предпринять несколько вариантов:
- Если стояк и его элементы изготовлены из металла, необходимо соединить стояк, например, с помощью хомута и медного провода, сечение которого не меньше 4 мм2. Затем от стояка горячего водоснабжения подключаются проводом к PE-шине и электрическому щиту, находящемуся на этаже. Для обеспечения полной безопасности при эксплуатации полотенцесушителя проводят заземления других токопроводящих объектов, включая ванны, изготовленные из нержавеющей стали и чугуна.
- Когда стояк и его компоненты изготовлены из полимеров, необходимо установить металлическую вставку, отвечающую диаметру трубы. Деталь вставляют между соединением полотенцесушителя и шаровым краном. На вставку монтируют зажим заземления. Используя провод из меди, подключаются к электрощиту.

- В случае, когда стояк состоит из пластиковых и металлических элементов, устанавливают вставку из металла между монтируемым оборудованием и шаровым краном. На нее крепят зажим и посредством медного кабеля подключаются к щиту.
- Еще одно решение задачи — установка системы для уравнивания потенциалов. Монтаж выполняют непосредственно в ванной. Такой шаг позволит избежать коррозии, а также минимизирует риски, связанные с ударом тока. Если за систему водоснабжения отвечают трубы из полимеров, то к ближайшему электрощиту также выполняются подключение заземляющих повод.
- В продаже представлено множество моделей полотенцесушителей. Эксперты рекомендуют не приобретать слишком дешевые конструкции. Для безопасной и длительной эксплуатации стоит обратить внимание на оборудование, снабженное защитой от «блуждающих токов». Полотенцесушители работают на базе полимера, которым обрабатывают внутреннюю часть трубы. Он ликвидирует контакт воды с металлом.
- Полимер полностью безопасен, так как не содержит вредных веществ, способных навредить человеку.
 Он не боится чрезмерно высокой температуры, не подвержен разрушению. Стоимость подобной продукции немногим выше стандартных изделий, при этом срок службы превышает период работы аналогов в несколько раз.
Он не боится чрезмерно высокой температуры, не подвержен разрушению. Стоимость подобной продукции немногим выше стандартных изделий, при этом срок службы превышает период работы аналогов в несколько раз. - Электрическая коррозия устраняется также заменой оборудования на электрическое. В этом случае нагрев полотенцесушителя начинается при подключении устройства к розетке. Как правило, на корпусе присутствует кнопка, позволяющая включать или отключать его. Это хорошее решение для многих людей, ищущих безопасный и долговечный вариант. Прибор функционирует автономно, не зависит от работоспособности системы водоснабжения, а значит — вы сможет прогреть помещение и высушить вещи даже в том случае, если горячей воды в кране нет. Минус прибора — потребление электроэнергии, за которую придется платить.
Важно! Если выбор пал на электрическое оборудование, следует знать, что оно имеет невысокую мощность, поэтому может работать от стационарного источника питания — розетки. Однако, учитывайте, что прибор работает в ванной, где преобладает высокая влажность, а значит его подключение должно проводиться через УЗО и автомат.
Мы попытались рассказать все самое важное об электрохимической коррозии и методах ее предотвращения/устранения. Вероятно, вы не столкнетесь с подобной проблемой, но, если она уже обнаружена, лучше сразу заявить о неприятности инженеру управляющей компании.
Специалист должен рассказать, какие меры стоит предпринять, какое оборудование станет оптимальным вариантом для вашей ванной комнаты. После установки инженер выполнит проверку полотенцесушителя на предмет герметичности, а также подпишет акт ввода прибора в эксплуатации.
Монтаж полотенцесушителя желательно поручить опытному мастеру, ведь от корректности установки во многом зависит долговечность прибора, а также безопасность и комфорт пользователей.
Коррозия Терминология — E’s — AMPP
упругая деформация — изменение размеров материала при приложении напряжения в области упругости. После снятия упругого напряжения материал возвращается к своим первоначальным размерам без какой-либо остаточной деформации.
эластичность — свойство материала, которое позволяет ему восстанавливать свои первоначальные размеры после деформации под действием напряжения ниже его предела упругости.
предел упругости — максимальное напряжение, которому может быть подвергнут материал без сохранения какой-либо остаточной деформации после снятия напряжения.
электрические помехи — любые электрические помехи на металлической конструкции, находящейся в контакте с электролитом, вызванные блуждающими токами.
электрическая изоляция — состояние электрической изоляции от других металлических конструкций или окружающей среды.
электрохимическая проводимость — величина, обратная электрохимическому импедансу, DI/DE.
электрохимическая ячейка — (1) электрохимическая реакция, включающая две полуреакции, одна из которых включает окисление реагента (продукта), а другая — восстановление продукта (реагента). ( Равновесный потенциал электрохимической ячейки можно рассчитать по изменению свободной энергии для всей электрохимической реакции Равновесный потенциал электрохимической ячейки можно измерить, разделив полуреакции окисления и восстановления на отдельные отсеки и измерение напряжения, возникающего между ними в условиях, когда между ними практически не проходит заряд.) [термодинамическое использование] (2) Электрохимическая система, состоящая из анода и катода, находящихся в металлическом контакте и погруженных в электролит. (Анод и катод могут быть из разных металлов или из разных областей на одной и той же металлической поверхности.) [общее использование]
( Равновесный потенциал электрохимической ячейки можно рассчитать по изменению свободной энергии для всей электрохимической реакции Равновесный потенциал электрохимической ячейки можно измерить, разделив полуреакции окисления и восстановления на отдельные отсеки и измерение напряжения, возникающего между ними в условиях, когда между ними практически не проходит заряд.) [термодинамическое использование] (2) Электрохимическая система, состоящая из анода и катода, находящихся в металлическом контакте и погруженных в электролит. (Анод и катод могут быть из разных металлов или из разных областей на одной и той же металлической поверхности.) [общее использование]
потенциал электрохимической коррозии — см. коррозионный потенциал .
электрохимический эквивалент — масса элемента или группы элементов, окисленных или восстановленных со 100-процентной эффективностью при прохождении единичного количества заряда, такого как Фарадей (96485 кулонов), ампер-час или кулон.
электрохимический импеданс — частотно-зависимый комплексный коэффициент пропорциональности, DI/DE, между приложенным потенциалом (или током) и ответным током (или потенциалом) в гальваническом элементе. Этот коэффициент становится импедансом, когда возмущение и отклик связаны линейно (значение фактора не зависит от величины возмущения), а отклик вызван только возмущением. Значение может быть связано со скоростью коррозии, когда измерение производится при коррозионный потенциал.
электрохимический шум — колебания потенциала или тока, или того и другого, возникающие в результате неконтролируемых изменений в процессе коррозии.
электрохимический потенциал — частная производная полной электрохимической свободной энергии системы по количеству молей компонента в растворе, когда все другие факторы постоянны. (Аналогично химическому потенциалу компонента, за исключением того, что он включает как электрический, так и химический вклады в свободную энергию.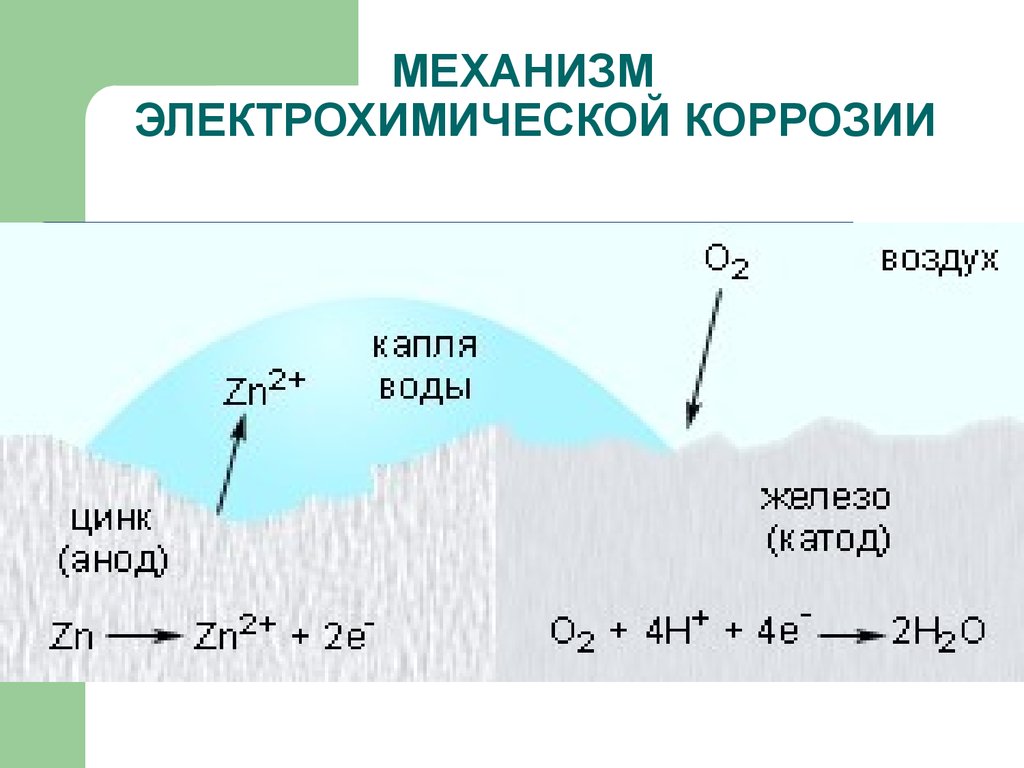 )
)
электрод — материал, который проводит электроны, используется для установления контакта с электролитом и через который ток передается к электролиту или от него.
потенциал электрода — потенциал электрода в электролите, измеренный относительно электрода сравнения.
электрокинетический потенциал — разность потенциалов в растворе, вызванная остаточным несбалансированным распределением заряда в соседнем растворе, образующим двойной слой. (Электрокинетический потенциал отличается от электродного потенциала тем, что он возникает исключительно в фазе раствора. Этот потенциал представляет собой обратимую работу, необходимую для переноса единичного заряда из бесконечности в растворе к рассматриваемой границе раздела, но не через границу раздела. .) [также известный как дзета-потенциал ]
электролиз — производство химических изменений электролита током, протекающим через электрохимическую ячейку.
электролит — химическое вещество, содержащее ионы, мигрирующие в электрическом поле.
электролитическая коррозия — неподходящий термин, но иногда неправильно используемый для обозначения гальванической коррозии , коррозия рассеянного тока или любой формы электрохимической коррозии.
электролитическая очистка — процесс удаления грязи, окалины или продуктов коррозии с поверхности металла путем воздействия на металл в качестве электрода электрического тока в электролитической ванне.
серия электродвижущих сил — список элементов, упорядоченных в соответствии с их стандартными электродными потенциалами, знак положительный для элементов, потенциалы которых более благородны, чем водород, такие как золото, и отрицательный для элементов, более активных, чем водород, таких как цинк. путать с гальванический ряд ]
электроосмос — миграция воды через полупроницаемую мембрану в результате разности потенциалов, вызванной протеканием электрического заряда через мембрану.
эллипсометрия — оптический метод, при котором плоскополяризованный свет фокусируется на поверхности, а отраженный луч анализируется для определения фазового сдвига компонентов света, чтобы получить информацию о свойствах пленок, которые могут присутствовать на поверхности. поверхность.
охрупчивание — снижение пластичности или ударной вязкости, или того и другого, материала (обычно металла или сплава).
ЭДС серии — см. электродвижущая сила серии .
эмаль — (1) краска, которая при высыхании образует твердую глянцевую поверхность. (2) покрытие, характеризующееся способностью образовывать гладкую прочную пленку.
концевой эффект — более быстрая потеря материала анода на конце анода по сравнению с другими поверхностями анода в результате более высокой плотности тока.
предел выносливости — максимальное напряжение, которое может выдержать материал в течение бесконечно большого числа циклов усталости.
окружающая среда — окружающая среда или условия (физические, химические, механические), в которых существует материал.
растрескивание под воздействием окружающей среды — растрескивание материала, причинным фактором которого является взаимодействие с окружающей средой в сочетании с напряжением растяжения, часто приводящее к хрупкому разрушению пластичного материала. [также известный как экологический крекинг ] Обсуждение — Экологический крекинг — это общий термин, который включает в себя термины, перечисленные ниже. Определения этих терминов приведены в другом месте в этом документе: щелочное растрескивание , хлоридное коррозионное растрескивание , коррозионная усталость , водородное охрупчивание , водородное растрескивание (ступенчатое растрескивание) , водородное растрескивание , растрескивание жидким металлом , коррозионное растрескивание под напряжением , сульфидное растрескивание под напряжением . Обсуждение — Следующие термины использовались в прошлом в связи с растрескиванием под действием окружающей среды, но в настоящее время устарели и не должны использоваться: щелочная хрупкость , замедленное растрескивание сезонное растрескивание , статическая усталость , сульфидное коррозионное растрескивание , сульфидное коррозионное растрескивание под напряжением .
Обсуждение — Следующие термины использовались в прошлом в связи с растрескиванием под действием окружающей среды, но в настоящее время устарели и не должны использоваться: щелочная хрупкость , замедленное растрескивание сезонное растрескивание , статическая усталость , сульфидное коррозионное растрескивание , сульфидное коррозионное растрескивание под напряжением .
экологический крекинг — см. экологический крекинг .
эпоксидная смола — тип смолы, образованной реакцией алифатических или ароматических полиолов (например, бисфенола) с эпихлоргидрином и характеризующейся наличием реакционноспособных оксирановых концевых групп.
равновесный потенциал — потенциал электрода в электролите, при котором прямая скорость данной реакции точно равна скорости обратной. (Равновесный потенциал может быть определен только в отношении конкретной электрохимической реакции. ) [также известный как обратимый потенциал ]
) [также известный как обратимый потенциал ]
эрозия — прогрессирующая потеря материала с твердой поверхности в результате механического взаимодействия между этой поверхностью и жидкостью, многокомпонентной жидкостью или твердыми частицами, переносимыми с жидкостью.
эрозия-коррозия — сочетание эрозии и коррозии в присутствии движущейся агрессивной жидкости или материала, движущегося через жидкость, приводящее к ускоренной потере материала.
плотность тока обмена — скорость переноса заряда на единицу площади при достижении электродом динамического равновесия (при его обратимом потенциале) в растворе; то есть скорость анодного переноса заряда (окисления) точно равна скорости катодного переноса заряда (восстановления).
расслаивающая коррозия — подповерхностная коррозия, идущая латерально от мест зарождения вдоль плоскостей, параллельных поверхности, с образованием продуктов коррозии, оттесняющих металл от тела материала, что приводит к появлению слоистости, напоминающей страницы книги.
внешняя цепь — провода, соединители, измерительные устройства, источники тока и т. д., которые используются для создания или измерения желаемых электрических условий внутри гальванического элемента. Это часть клетки, через которую проходят электроны.
Разница между электрохимической и электролитической ячейкой
Изучение транспорта электронов в системах, подвергающихся химическим реакциям, известно как электрохимия. Химические реакции могут использоваться либо для создания электрического тока, либо для содействия протеканию несамопроизвольной химической реакции. Электрическая энергия будет преобразована в химическую энергию или наоборот в обоих случаях. Ячейки, или, точнее, электрохимические ячейки, представляют собой системы, в которых происходят эти переходы. Гальванические элементы и электролитические элементы представляют собой две формы электрохимических элементов. Основное различие между электрохимической ячейкой и электролитической ячейкой заключается в том, что электрохимической ячейке для работы не требуется внешний ток, в отличие от электролитических ячеек.
Выписка : 12-й результат CBSE 2022
Что такое электрохимическая ячейка?
Электрохимический элемент — это устройство, которое преобразует электричество в химическую энергию. Электрохимическая ячейка представляет собой устройство, которое может генерировать электрическую энергию за счет химических процессов, протекающих самопроизвольно. Окислительно-восстановительные реакции — это химические процессы, происходящие на протяжении всего этого процесса. Электроны переносятся между химическими веществами в окислительно-восстановительных реакциях. Окислительно-восстановительная реакция состоит из двух полуреакций: окисления и восстановления. Когда происходит реакция окисления, в систему всегда высвобождаются электроны, а когда происходит реакция восстановления, электроны уносятся из системы. В результате две полуреакции протекают одновременно. Гальванические (гальванические) элементы и электролитические элементы представляют собой две формы электрохимических элементов. Две полуячейки составляют электрохимическую ячейку. В двух полуячейках протекают полуреакции.
Две полуячейки составляют электрохимическую ячейку. В двух полуячейках протекают полуреакции.
Что такое электролитическая ячейка?
Электролитическая ячейка — это устройство, которое использует электричество для производства электроэнергии. Электролитическая ячейка представляет собой форму электрохимической ячейки, которая использует электрическую энергию для инициирования химической реакции. Другими словами, электрическая энергия должна поступать откуда-то еще. Затем вы можете начать неспонтанный ответ. Наиболее распространенным типом электролитической ячейки, используемой для электролиза соединений, является электролитическая ячейка. Твердые металлические электроды также используются в электролитических ячейках. Внешняя цепь связана с двумя электродами. Один электрод служит анодом, а другой – катодом. Анод будет подвергаться реакции окисления, тогда как катод будет подвергаться реакции восстановления.
Поток электронов через катод обеспечивается внешним источником электроэнергии (от батареи, прикрепленной к двум электродам). Затем электроны вводятся в раствор электролита. Затем катионы в растворе собираются вокруг катода и поглощают проходящие через него электроны. В результате на катоде эти катионы уменьшаются. Электроны катода отталкивают анионы в растворе. Эти анионы притягиваются к аноду. Затем эти анионы теряют электроны и окисляются. В результате катод имеет отрицательный заряд, тогда как анод имеет положительный заряд.
Затем электроны вводятся в раствор электролита. Затем катионы в растворе собираются вокруг катода и поглощают проходящие через него электроны. В результате на катоде эти катионы уменьшаются. Электроны катода отталкивают анионы в растворе. Эти анионы притягиваются к аноду. Затем эти анионы теряют электроны и окисляются. В результате катод имеет отрицательный заряд, тогда как анод имеет положительный заряд.
Difference Between Electrochemical Cell and Electrolytic Cell
| Electrochemical Cell | Electrolytic Cell | |
| An electrochemical cell is a system that uses spontaneous chemical reactions to generate electrical energy | An electrolytic cell форма электрохимической ячейки, в которой электрическая энергия используется для инициирования химической реакции | |
| Для электрохимических ячеек не требуются внешние источники электрической энергии | Для электролитических ячеек требуются внешние источники электрической энергии | |
| Химические реакции в электрохимических ячейках протекают самопроизвольно | ячейка отрицательная, тогда как катод положительный | Анод электролитической ячейки положительный, тогда как катод отрицательный |
В гальванических элементах электроны идут от анода к катоду Химическая энергия превращается в электрическую в гальваническом элементе анод в электролизере Превращение электрической энергии в химическую в электролизере |
Заключение
Тип электрохимического электролизера – электролизер.
