Чем отличается химическая коррозия от электрохимической коррозии: Чем химическая коррозия отличается от электрохимической?
Содержание
Гальванический элемент. Электрохимическая коррозия металлов
16
Федеральное
агентство по образованию
Государственное
образовательное учреждение
высшего
профессионального образования
Новгородский
государственный университет им. Ярослава
Мудрого
Факультет
естественных наук и природных ресурсов
Кафедра
химии и экологии
Методические
указания
к
лабораторной работе
Великий
Новгород
2006
г
Гальванический
элемент. Электрохимическая коррозия
металлов: Методические указания/
Составители: Бойко Е.Н., Кузьмичева В.П.,
Петухова Е.А. — НовГУ, Великий Новгород,
2006. – 16 c.
Рассмотрены
классификация, условия возникновения
и механизм электрохимической коррозии.
Методические
указания предназначены для студентов
всех специальностей, изучающих химию.
СОДЕРЖАНИЕ:
1
Основные теоретические положения 4
1. 1
1
Общие понятия 4
1.2
Стадии электрохимической коррозии 4
1.3
Термодинамика электрохимической
коррозии 5
1.5
Контактная коррозия 7
2
Требования техники безопасности 8
3
Экспериментальная часть 8
4
Содержание отчета о работе 11
5
Контрольные вопросы и задачи 11
литература 12
Приложение 13
Стандартные электродные потенциалы
при 25 °C 13
1 Основные теоретические положения
1.1 Общие понятия
Коррозией называется
разрушение металлов под воздействием
внешней среды.
Сущность
коррозионных процессов сводится к
переходу металлов в термодинамически
более стабильные продукты: оксиды,
гидроксиды, основные соли и др. Все
коррозионные процессы протекают с
уменьшением свободной энергии Гиббса
и являются самопроизвольными.
Общепринято
выделять два вида коррозионных процессов:
химическую и электрохимическую коррозию.
Химическая
коррозия – процессы взаимодействия
металла с окружающей средой, протекающие
по механизму химической гетерогенной
реакции, т.е. ионизация металла и
восстановление окислительного компонента
среды, происходит в одном акте. Примером
химической коррозии является взаимодействие
металла с жидкими неэлектропроводными
средами или сухими газами.
Электрохимическая
коррозия является результатом протекания
нескольких сопряженных электрохимических
реакций, скорость которых зависит,
помимо прочих факторов, от потенциала
электрода. Коррозия электрохимического
типа происходит при воздействии на
металлы влажной атмосферы, разнообразных
электролитов, почвенной влаги.
1.2 Стадии электрохимической коррозии
Основное
отличие механизма электрохимической
коррозии от химической состоит в том,
что общая реакция взаимодействия металла
с внешней средой вследствие существования
ионов в растворе и свободных электронов
в металле может разделиться на два в
значительной мере самостоятельных
процесса:
анодный
процесс – переход металла в раствор в
виде гидратированных ионов с оставлением
эквивалентного количества электронов
в металле:
Meo
+ mH2O
Me+n
· mH2O
+ nе—
;
катодный
процесс – извлечение избыточных
электронов в металле какими – либо
деполяризаторами (атомами, молекулами
или ионами раствора, которые могут
восстанавливаться на катоде).
При коррозии в
нейтральных растворах деполяризатором
чаще всего служит растворенный в
электролите кислород, в этом случае
коррозия протекает с кислородной
деполяризацией: О2
+ 2Н2О
+ 4е—
4ОН—.
При коррозии в
кислотах в восстановительном процессе
принимают участие ионы водорода, при
этом коррозия идет с водородной
деполяризацией: 2Н+
+ 2е—
Н2.
Эти два процесса
сопровождаются движением ионов в
растворе и электронов в металле.
Кроме первичных
реакций в растворе протекают вторичные
процессы:
Ме+n
+ mH2O
+ nOH—
Me(OH)n
+ mH2O
2Me(OH)n
Me2On
+ nH2O.
Наличие электронной
проводимости в металлах и ионной
проводимости растворов позволяет
протекать анодным и катодным процессам
территориально раздельно – на различных
участках поверхности металла. Это не
Это не
обязательно для хода электрохимического
процесса, так как в некоторых слкучаях
коррозии катодные и анодные процессы
могут протекать на одной и той же
поверхности, например, на амальгамах –
сплавах металлов с ртутью, чередуясь
во времени. Однако пространственное
разделение анодных и катодных процессов
энергетически более выгодно, так как
анодные и катодные реакции локализуются
на тех участках поверхности, где их
протекание наиболее облегченно. Важно
отметить, что материальные потери при
таком механизме будут проявляться в
основном только на анодах; на катодных
участках существенных потерь металла
не будет. Причиной энергетической
неоднородности металла и сплава могут
быть неоднородность сплава по химическому
и фазовому составу, наличие примесей в
металле, пленок на его поверхности и
др. Анодные участки обычно характеризуются
меньшим электродным потенциалом, а
катодные – большим потенциалом в данной
среде. Катодные и анодные участки
чередуются и имеют очень малые размеры.
Таким образом, при наличии энергетически
неоднородной поверхности металла
коррозионный процесс заключается в
работе огромного числа коррозионных
микроэлементов.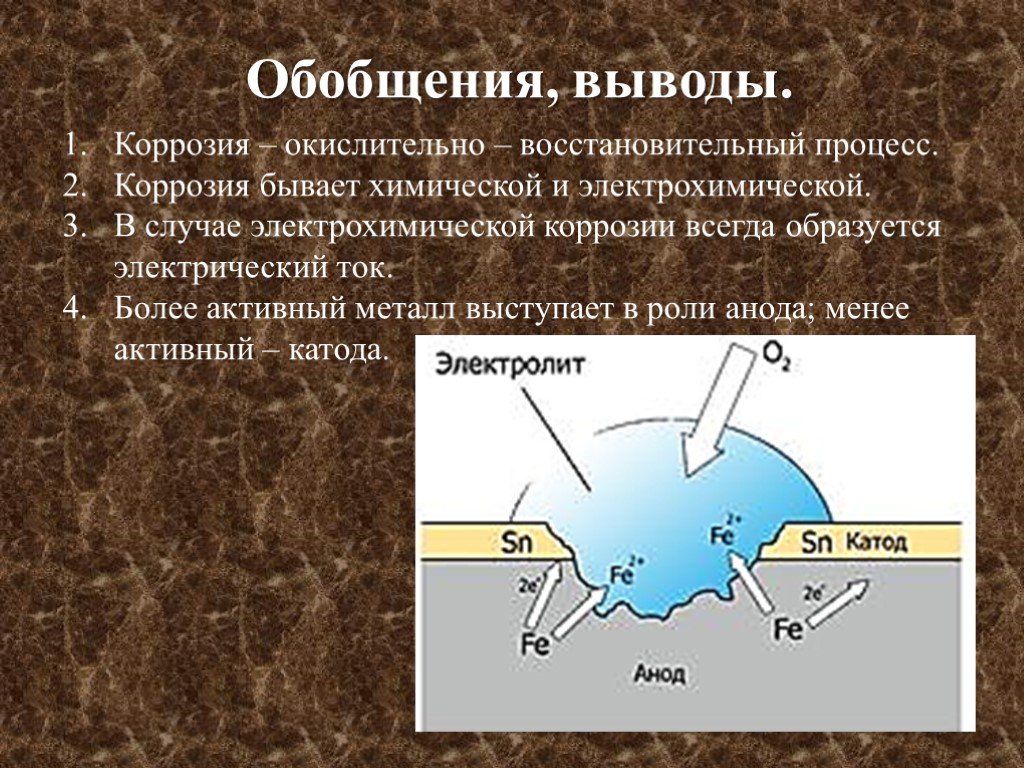 Коррозионный элемент
Коррозионный элемент
в отличие от гальванического элемента
является короткозамкнутым.
Контакт двух разных
металлов, неравномерный доступ окислителя
к металлической поверхности, различие
в условиях эксплуатации – все это
приводит к появлению в работе коррозионных
микроэлементов.
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
– Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26. 12.2016 12:03
12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
16.8: Электрохимическая коррозия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 265
- Стивен Лоуэр
- Университет Саймона Фрейзера
Цели обучения
Убедитесь, что вы полностью поняли следующие основные идеи. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Электрохимическая коррозия металлов происходит, когда электроны от атомов на поверхности металла переносятся на подходящий акцептор электронов или деполяризатор . Вода должна присутствовать, чтобы служить средой для переноса ионов.
- Наиболее распространенными деполяризаторами являются кислород, кислоты и катионы менее активных металлов.
- Поскольку электроны проходят через сам металлический объект, анодная и катодная области (две половины электрохимической ячейки) могут находиться далеко друг от друга.
- Анодные области имеют тенденцию развиваться в местах, где металл находится под напряжением или защищен от кислорода.
- Контакт с другим металлом, прямой или косвенный, может привести к коррозии более активного металла.
- Коррозию стали можно подавить с помощью цинкования , то есть путем покрытия ее цинком, более активным металлом, растворение которого оставляет на металле отрицательный заряд, препятствующий дальнейшему растворению Fe 2+ .
- Катодная защита с использованием внешнего источника напряжения широко применяется для защиты подземных сооружений, таких как резервуары, трубопроводы и опоры. Источником может быть расходуемый анод из цинка или алюминия, сетевой или фотогальванический источник питания.
Коррозию можно определить как разрушение материалов в результате химических процессов. Из них наиболее важной на сегодняшний день является электрохимическая коррозия металлов, при которой процесс окисления М → М + + е – облегчается наличием подходящего акцептора электронов, иногда называемого в науке о коррозии как деполяризатор.
В некотором смысле коррозию можно рассматривать как самопроизвольный возврат металлов в их руды; огромное количество энергии, затраченной на добычу, очистку и производство металлов в полезные предметы, рассеивается множеством различных путей. Экономические аспекты коррозии намного значительнее, чем думает большинство людей; предполагаемая стоимость коррозии только в США составляла 276 миллиардов долларов в год. Из них около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистыми потерями для экономики. Коммунальные услуги, особенно системы питьевого водоснабжения и канализации, испытывают наибольшее экономическое воздействие, а автомобили и транспорт занимают второе место.
Из них около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистыми потерями для экономики. Коммунальные услуги, особенно системы питьевого водоснабжения и канализации, испытывают наибольшее экономическое воздействие, а автомобили и транспорт занимают второе место.
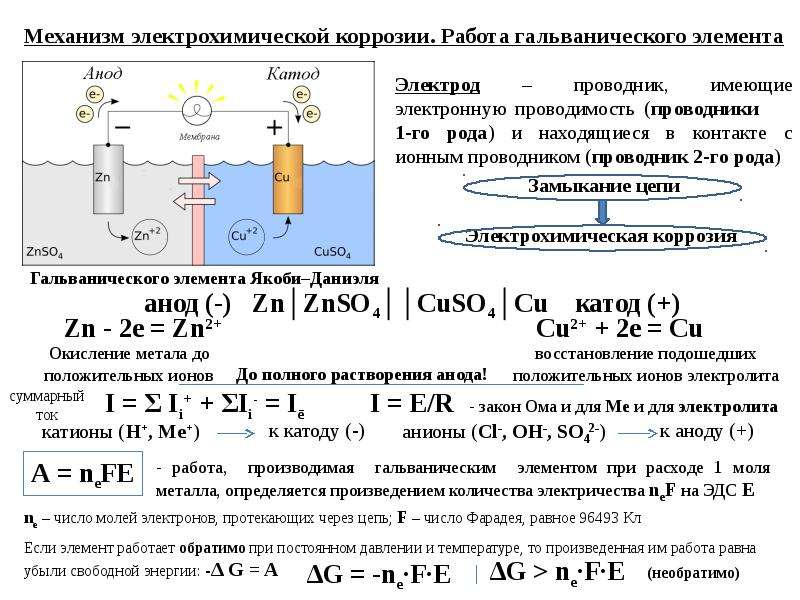
Ячейки коррозии и реакции
Особенностью большинства процессов коррозии является то, что стадии окисления и восстановления происходят в разных местах металла. Это возможно, потому что металлы являются проводящими, поэтому электроны могут течь через металл от анодных к катодным областям (рисунок \(\PageIndex{1}\)). Присутствие воды необходимо для переноса ионов к металлу и от него, но тонкой пленки адсорбированной влаги может быть достаточно.
Рисунок \(\PageIndex{1}\): Коррозия — это двухэтапный процесс. Рисунок \(\PageIndex{1}\): Электрохимическая коррозия железа. Коррозия часто начинается в месте (1), где металл находится под напряжением (на изгибе или сварке) или изолирован от воздуха (где соединяются два куска металла или под слабо прилипшей пленкой краски). Ионы металла растворяются в пленке влаги, а электроны мигрируют в другое место (2), где они поглощаются 9{–}} \rightarrow \ce{M(s)} \label{1.7.2c}\]
Ионы металла растворяются в пленке влаги, а электроны мигрируют в другое место (2), где они поглощаются 9{–}} \rightarrow \ce{M(s)} \label{1.7.2c}\]
, где \(\ce{M}\) — металл.
То, какие части металла служат анодами и катодами, может зависеть от многих факторов, как видно из обычно наблюдаемых неравномерных структур коррозии. Атомы в областях, подвергшихся напряжению, которые могут быть получены путем формовки или механической обработки, часто имеют более высокую свободную энергию и, таким образом, имеют тенденцию становиться анодными.
Рисунок \(\PageIndex{2}\): Схематическая диаграмма коррозионных ячеек на железе. (CC BY-NSA-NC; анонимно по запросу)
Если одна часть металлического предмета защищена от атмосферы так, что недостаточно \(\ce{O2}\) для создания или поддержания оксидной пленки, эта «защищенная» область часто будет местом, где коррозия наиболее активна. активный. Тот факт, что такие места обычно скрыты от глаз, объясняет большую часть трудностей в обнаружении коррозии и борьбе с ней.
Рисунок \(\PageIndex{3}\): Точечная коррозия Большинство металлов покрыты тонкой оксидной пленкой, препятствующей анодному растворению. Когда коррозия действительно возникает, иногда в металле образуются узкие отверстия или ямки. Дно этих ямок, как правило, лишено кислорода, что способствует дальнейшему прорастанию ямок в металл. (CC BY 3.0 непортированная; Стивен Лоуэр)
В отличие от анодных участков, которые, как правило, локализованы в определенных областях поверхности, катодная часть процесса может происходить практически где угодно. Поскольку оксиды металлов обычно являются полупроводниками, большинство оксидных покрытий не препятствуют потоку электронов к поверхности, поэтому почти любая область, которая подвергается воздействию \(\ce{O2}\) или какого-либо другого акцептора электронов, может действовать как катод. Тенденция мест, лишенных кислорода, к анодированию является причиной многих широко наблюдаемых моделей коррозии.
Ржавые автомобили и пятна в ванных комнатах
Любой, кто владел старым автомобилем, видел коррозию на стыках между частями кузова и под лакокрасочным покрытием. Вы также заметите, что как только начинается коррозия, она имеет тенденцию питаться сама собой. Одна из причин этого заключается в том, что одним из продуктов реакции восстановления O 2 является гидроксид-ион. Высокий уровень pH, создаваемый в этих катодных областях, имеет тенденцию разрушать защитную оксидную пленку и может даже смягчить или ослабить пленки краски, так что эти участки могут стать анодными. Большее поступление электронов способствует более интенсивному катодному действию, что порождает еще больше анодных участков и т.д.
Вы также заметите, что как только начинается коррозия, она имеет тенденцию питаться сама собой. Одна из причин этого заключается в том, что одним из продуктов реакции восстановления O 2 является гидроксид-ион. Высокий уровень pH, создаваемый в этих катодных областях, имеет тенденцию разрушать защитную оксидную пленку и может даже смягчить или ослабить пленки краски, так что эти участки могут стать анодными. Большее поступление электронов способствует более интенсивному катодному действию, что порождает еще больше анодных участков и т.д.
Рисунок \(\PageIndex{4}\): Ржавая машина. Сильно проржавевшие половицы автомобиля Chrysler New Yorker 1990 года выпуска. Автомобиль был поврежден до такой степени, что управлять им стало небезопасно. Под ржавым участком между двумя отверстиями находились две тормозные магистрали (общественное достояние; Bige1977 через Википедию).
Очень распространенной причиной коррозии является контакт двух разнородных металлов, что может произойти вблизи крепежных деталей или сварных швов. В месте соединения собирается влага, действующая как электролит и образующая ячейку, в которой два металла служат электродами. Влага и токопроводящие соли на внешних поверхностях образуют внешний токопроводящий путь, эффективно замыкая элемент накоротко и вызывая очень быструю коррозию; Вот почему автомобили так быстро ржавеют в тех местах, где дороги посыпают солью, чтобы растопить лед. 9{3+}}\) соли, выпадающие в осадок в виде зеленоватых пятен.
В месте соединения собирается влага, действующая как электролит и образующая ячейку, в которой два металла служат электродами. Влага и токопроводящие соли на внешних поверхностях образуют внешний токопроводящий путь, эффективно замыкая элемент накоротко и вызывая очень быструю коррозию; Вот почему автомобили так быстро ржавеют в тех местах, где дороги посыпают солью, чтобы растопить лед. 9{3+}}\) соли, выпадающие в осадок в виде зеленоватых пятен.
Контроль коррозии
Поскольку для возникновения коррозии должны иметь место как катодная, так и анодная стадии, предотвращение любой из них остановит коррозию. Наиболее очевидная стратегия — остановить оба процесса, покрыв объект краской или другим защитным покрытием. Даже если это будет сделано, вероятно, будут места, где покрытие сломано или не проникает, особенно если есть отверстия или резьба. Более сложный подход состоит в том, чтобы нанести на металл небольшой отрицательный заряд, что затруднит протекание реакции: 9{-}}. \]
\]
Метод защиты 1: расходуемые покрытия
Одним из способов создания этого отрицательного заряда является нанесение покрытия из более активного металла. Таким образом, очень распространенным способом защиты стали от коррозии является покрытие ее тонким слоем цинка; этот процесс известен как цинкование. Цинковое покрытие, будучи менее благородным, чем железо, склонно к избирательной коррозии. Растворение этого жертвенного покрытия оставляет после себя электроны, которые концентрируются в железе, делая его катодным и, таким образом, препятствуя его растворению.
Рисунок \(\PageIndex{5}\): Жертвенные покрытия (CC BY 3.0 Unported; Стивен Лоуэр)
Эффект покрытия железа менее активным металлом дает интересный контраст. Хорошим примером является обычная луженая банка (справа). Пока оловянное покрытие остается неповрежденным, все в порядке, но воздействие влажной атмосферы даже на крошечную часть нижележащего железа вызывает коррозию. Электроны, выпущенные из железа, перетекают в олово, делая железо более анодным, так что теперь олово активно способствует коррозии железа! Вы, наверное, замечали, как быстро разлагаются жестяные банки, оставленные на открытом воздухе.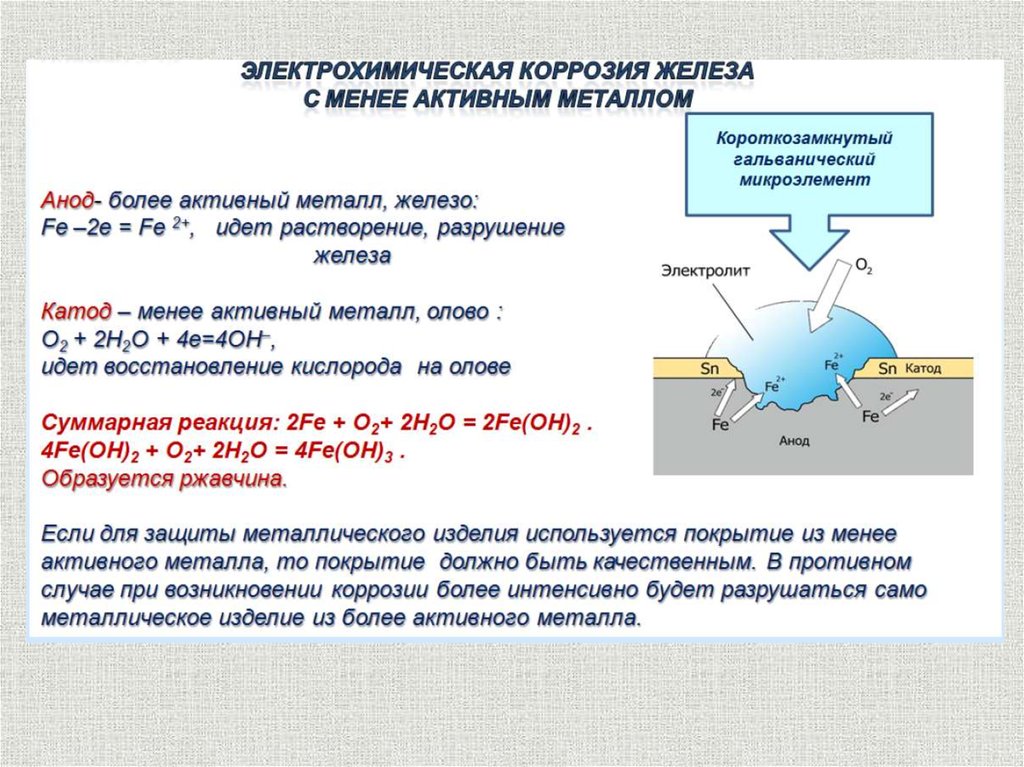
Метод защиты 2: катодная защита
Более сложная стратегия заключается в поддержании постоянного отрицательного электрического заряда на металле, чтобы предотвратить его растворение в виде положительных ионов. Поскольку вся поверхность принудительно переходит в катодное состояние, этот метод известен как катодная защита . Источником электронов может быть внешний источник питания постоянного тока (обычно используемый для защиты нефтепроводов и других заглубленных конструкций), или это может быть коррозия другого, более активного металла, такого как кусок цинка или алюминия, зарытый в землю поблизости. , как показано на иллюстрации заглубленного резервуара для хранения пропана ниже.
Рисунок \(\PageIndex{6}\): Катодная защита (CC BY 3.0, непортированная; Стивен Лоуэр)
Эта страница под названием 16.8: Электрохимическая коррозия распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Стивеном Лоуэром с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Стивен Лоуэр
- Лицензия
- СС BY
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Теги
- катодная защита
- коррозия
- коррозионная стойкость
- ржавчина
- Жертвенные покрытия
- источник@http://www.
 chem1.com/acad/webtext/virtualtextbook.html
chem1.com/acad/webtext/virtualtextbook.html
Влажная или электрохимическая коррозия
Влажная или электрохимическая коррозия
Реклама
1 из 14 изм электрохимической коррозии, выделение водорода и поглощение катодная реакция кислородного типа. Различие между сухой и влажной коррозией.
Реклама
Реклама
Мокрая или электрохимическая коррозия
- Подготовлено:
Профессор Сарала Прасанна Паттанаик
Доцент
Кафедра химии - • Влажная или электрохимическая коррозия
• Механизм влажной или электрохимической коррозии.
• Типы катодной реакции:
• Выделение h3 и поглощение типа O2.
• Различие между сухой и влажной коррозией. - Ржавление железа в присутствии электролита:
Fe → Fe2+ + 2e– (окисление)
1/2O2 + h3O + 2e– → 2OH– (восстановление)
Всего:- Fe + 1/2O2 + h3O → Fe2+ + 2OH– → Fe(OH)2
Или 2Fe + O2 + 2h3O → 2Fe2+ + 4OH– → 2Fe(OH)2
В присутствии избытка кислорода:
4Fe(OH)2 + O2 + 2h3O → 4 Fe(OH)3 или 2Fe2O3. 3ч3О
3ч3О
Металлы при воздействии кислых растворов:
4Al + 3h3SO4 → 2Al2(SO4)3 + 3h3
Fe + h3SO4 → FeSO4 + h3
Zn + h3SO4 → ZnSO4 + h3
Zn + 2HCl → ZnCl2 + h3
2Al + 6HCl→ 2AlCl3 + 3h3 - Влажная или электрохимическая коррозия
Происходит: —
• Когда металл находится в контакте с влажным воздухом или любым электролитом или жидкой средой.
• Когда части металла по-разному вентилируются или подвергаются воздействию различной концентрации
Кислород.
• Когда два разных металла частично погружены в раствор или раствор их соответствующих солей.
• Химически неоднородные поверхности металлов ведут себя как электрохимические ячейки в присутствии
вода, содержащая растворенные O2 и CO2.
• Когда металл испытывает напряжение в острых углах, изгибах, ямках, щелях, заклепках, соединениях и т. д. и подвергается воздействию
специфическая электролитическая среда.
• Коррозия возникает только в анодных областях, в то время как катодная область считается защищенной.
Механизм:-
• Включает окислительно-восстановительную или окислительно-восстановительную реакцию, протекающую отдельно на аноде и катоде.
в контакте друг с другом.
• Коррозия происходит по механизму электрохимической реакции.
• Это быстрый процесс, происходящий только на неоднородной металлической поверхности.
• Электроны перемещаются от анода к катоду через металл или коррозионную среду.
• В зависимости от характера коррозионной среды электроны, выделяющиеся на аноде, расходуются при
катодную область двумя способами:
Эволюция катодной реакции типа h3
Поглощение катодной реакции типа O2 - Эволюция типа h3 Катодная реакция
Механизм:-
• Возникает, когда металл подвергается воздействию или контактирует с кислой средой.
• Металлическая часть в анодной зоне растворяется с высвобождением электронов.
• Электроны текут через металл от анода к катоду, где ионы H+
кислый раствор высвобождается в виде h3.
• Такая коррозия включает вытеснение ионов H+ из кислого раствора
ионы металлов, за счет которых повышается рН кислого раствора. Поэтому все металлы
над водородом в электрохимическом ряду имеют тенденцию растворяться в
кислые растворы с выделением водорода.
• При таком типе коррозии анод обычно представляет собой большую металлическую область, а катод
небольшая металлическая площадь.
Реакции:- Fe(тв) + 2HCl → FeCl2 + h3(г)
Реакция на аноде: — Fe(s) → Fe+2 + 2e- (окисление)
Реакция на катоде:- 2H+ + 2e- → h3(g) (Восстановление)
Общая реакция: Fe(тв) + 2H+ → Fe+2 + h3(г) - Механизм коррозии по h3 Evolution
- Механизм коррозии по h3 Evolution
- Поглощение типа O2 Катодная реакция
Механизм:-
• Возникает, когда металл подвергается воздействию щелочного или нейтрального раствора (например, раствора соли) в
наличие кислорода.
• Из-за присутствия кислорода поверхность металла обычно покрыта тонким слоем
слой оксида. Если в оксидном слое появляются трещины, при этом создается анодная зона.
остальная часть металлической части скважины ведет себя как катод.
• Окисление происходит на аноде, а восстановление происходит на катоде и электронах.
поток через металл от анода к катоду с поглощением О2.
• При таком типе коррозии анод обычно представляет собой небольшой металлический участок, а катод
крупные колодезные металлические детали.
Реакция на аноде: — Fe(s) → Fe+2 + 2e- (окисление)
Реакция на катоде: -1/2O2 + h3O + 2e– → 2OH– (восстановление)
Общая реакция: -Fe + 1/2O2 + h3O → Fe2+ + 2OH– → Fe(OH)2
Или 2Fe + O2 + 2h3O → 2Fe(OH)2
В присутствии избытка кислорода: — 4Fe(OH)2 + O2 + 2h3O → 4 Fe(OH)3 или 2Fe2O3. 3ч3О - Механизмы коррозии при поглощении O2
- Разница: Сухая и мокрая коррозия
СУХАЯ или ХИМИЧЕСКАЯ КОРРОЗИЯ ВЛАЖНАЯ или ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Это происходит из-за прямого химического воздействия атмосферных газов на
открытая металлическая поверхность.
Это происходит, когда металл подвергается воздействию проводящей жидкости или электролитической среды.
или влаги из-за образования крошечных электрохимических ячеек.
Это происходит в сухом состоянии в отсутствие какой-либо проводящей жидкости или
электролитическая среда или влага.
Это происходит во влажном состоянии в присутствии какой-либо проводящей жидкости или
электролитическая среда или влага.
Это медленный процесс. Это быстрый процесс.
Это происходит при низкой или высокой температуре в зависимости от природы
металл.
Это происходит при нормальных температурных условиях.
Это самоконтролируемый процесс. Это непрерывный процесс.
Коррозия происходит по механизму адсорбции. Коррозия происходит по механизму электрохимической реакции.
Коррозия возникает как на гомогенных, так и на гетерогенных металлических поверхностях.
поверхности.
Коррозия возникает только на разнородных металлических поверхностях.
Коррозия на открытой металлической поверхности равномерна и возникает по всей
открытая поверхность.
Коррозия на открытой металлической поверхности носит неравномерный, сильно локализованный и
происходит только на аноде.
Коррозия не связана с образованием отдельных анодных и катодных
область.
Коррозия предполагает образование отдельных анодных и катодных областей в
контакт друг с другом.
Продукт коррозии равномерно скапливается на открытой металлической поверхности.
Коррозия происходит на аноде, но продукты коррозии скапливаются вблизи анода.
катод или что-то среднее между анодом и катодом.
Степень коррозии зависит от сродства металла с газами.
а также от природы образующегося продукта.
Степень коррозии зависит от разности потенциалов между анодом и
катода, а также от природы коррозионной среды.
Окислительная коррозия является примером сухой или химической коррозии.
Гальваническая или биметаллическая коррозия, дифференциальная аэрационная коррозия, точечная коррозия
коррозия, коррозия ватерлинии, щелевая коррозия, коррозия под напряжением и т. д.
примеры влажной или электрохимической коррозии. - Ссылки на учебники
1. Джейн П.С. и Джейн М.: инженерная химия (15-е издание), 2006 г.
Издательство Дханпат Рай, Нью-Дели.
2. Дара С.С. и Умаре С.С. Учебник по инженерной химии (12-е место).
Издание) 2008 Издательство S.Chand Publishing Company, Нью-Дели
3. Чавла Шаши: учебник инженерной химии (3-е издание).
2010 Издательство Dhanpat Rai Publishing Company, Нью-Дели.
4. Паланна О. Г. Учебник инженерной химии (4-е издание).
