Что ржавеет на воздухе: Почему железо ржавеет? | Пневмопортал
Содержание
Из-за чего металлы ржавеют
Ржавчина — итог окисления металла, также общий термин для определения оксидов железа.
Что есть общего между ржавым гвоздем, проржавевшим мостом или прохудившимся железным забором? Отчего вообще ржавеют железные конструкции и изделия из железа? Что такое ржавчина как таковая? На эти вопросы постараемся дать ответы в нашей статье. Рассмотрим причины ржавления металлов и способы защиты от этого вредного для нас природного явления.
Причины ржавления
Все начинается с добычи металла. Не только железо, но и, например, алюминий, и магний — добывают изначально в виде руды. Алюминиевая, марганцевая, железная, магниевая руды содержат в себе не чистые металлы, а их химические соединения: карбонаты, оксиды, сульфиды, гидроксиды.
Это химические соединения металлов с углеродом, кислородом, серой, водой и т. д. Чистых металлов в природе раз, два и обчелся — платина, золото, серебро — благородные металлы — они встречаются в форме металлов в свободном состоянии, и не сильно стремятся к образованию химических соединений.
Однако большинство металлов в природных условиях все же не являются свободными, и чтобы высвободить их из исходных соединений, необходимо руды плавить, восстанавливать таким образом чистые металлы.
Но выплавляя металлсодержащую руду, мы хоть и получаем металл в чистом виде, это все же состояние неустойчивое, далекое от естественного природного. По этой причине чистый металл в обычных условиях окружающей среды стремится вернуться назад в исходное состояние, то есть окислиться, а это и есть коррозия металла.
Таким образом, коррозия является естественным для металлов процессом разрушения, происходящим в условиях их взаимодействия с окружающей средой. В частности ржавление — это процесс образования гидроксида железа Fe(ОН)3, который протекает в присутствии воды.
Но на руку людям играет тот естественный факт, что окислительная реакция протекает в привычной нам атмосфере не особо стремительно, она идет с очень небольшой скоростью, поэтому мосты и самолеты не разрушаются мгновенно, а кастрюли не рассыпаются на глазах в рыжий порошок. К тому же коррозию в принципе можно замедлить, прибегнув к некоторым традиционным хитростям.
К тому же коррозию в принципе можно замедлить, прибегнув к некоторым традиционным хитростям.
Например, нержавеющая сталь не ржавеет, хотя и состоит из железа, склонного к окислению, она тем не менее не покрывается рыжим гидроксидом. А дело здесь в том, что нержавеющая сталь — это не чистое железо, нержавеющая сталь — это сплав железа и другого металла, главным образом — хрома.
Кроме хрома в состав стали могут входить никель, молибден, титан, ниобий, сера, фосфор и т. д. Добавление в сплавы дополнительных элементов, ответственных за определенные свойства получаемых сплавов, называется легированием.
Пути защиты от коррозии
Как мы отметили выше, главным легирующим элементом, добавляемым к обычной стали для придания ей антикоррозийных свойств, является хром. Хром окисляется быстрее железа, то есть принимает удар на себя. На поверхности нержавеющей стали, таким образом, появляется сначала защитная пленка из оксида хрома, которая имеет темный цвет, и не такая рыхлая как обычная железная ржавчина.
Оксид хрома не пропускает через себя вредные для железа агрессивные ионы из окружающей среды, и металл оказывается защищенным от коррозии, словно прочным герметичным защитным костюмом. То есть оксидная пленка в данном случае несет защитную функцию.
Количество хрома в нержавеющей стали, как правило, не ниже 13%, чуть меньше в нержавеющей стали содержится никеля, и в гораздо меньших количествах имеются другие легирующие добавки.
Именно благодаря защитным пленкам, принимающим на себя воздействие окружающей среды первыми, многие металлы получаются стойкими к коррозии в различных средах. Например, ложка, тарелка или кастрюля, изготовленные из алюминия, никогда особо не блестят, они, если присмотреться, имеют белесый оттенок. Это как раз оксид алюминия, который образуется при контакте чистого алюминия с воздухом, и защищает затем металл от коррозии.
Пленка оксида возникает сама, и если зачистить алюминиевую кастрюлю наждачной бумагой, то через несколько секунд блеска поверхность снова станет белесой — алюминий на зачищенной поверхности вновь окислится под действием кислорода воздуха.
Поскольку пленка оксида алюминия образуется на нем сама, без особых технологических ухищрений, она называется пассивной пленкой. Такие металлы, на которых оксидная пленка образуется естественным образом, называются пассивирующимися. В частности алюминий — пассивирующийся металл.
Некоторые металлы принудительно переводят в пассивное состояние, например высший оксид железа — Fe2О3 способен защитить железо и его сплавы на воздухе при высоких температурах и даже в воде, чем не может похвастаться ни рыжий гидроксид, ни низшие оксиды все того же железа.
Есть в явлении пассивации и нюансы. Например, в крепкой серной кислоте мгновенно пассивированная сталь оказывается устойчивой к коррозии, а в слабом растворе серной кислоты тут же начнется коррозия.
Почему так происходит? Разгадка кажущегося парадокса состоит в том, что в крепкой кислоте на поверхности нержавеющей стали мгновенно образуется пассивирующая пленка, поскольку кислота большей концентрации обладает ярко выраженными окислительными свойствами.
В то же время слабая кислота не окисляет сталь достаточно быстро, и защитная пленка не формируется, начинается просто коррозия. В таких случаях, когда окисляющая среда не достаточно агрессивна, для достижения эффекта пассивации прибегают к специальным химическим добавкам (ингибиторам, замедлителям коррозии), помогающим образованию пассивной пленки на поверхности металла.
Так как не все металлы склонны к образованию на их поверхности пассивных пленок, даже принудительно, то добавление замедлителей в окисляющую среду попросту приводит к превентивному удержанию металла в условиях восстановления, когда окисление энергетически подавляется, то есть в условиях присутствия в агрессивной среде добавки оказывается энергетически невыгодным.
Есть и другой путь удержания металла в условиях восстановления, если нет возможности использовать ингибитор, — применить более активное покрытие: оцинкованное ведро не ржавеет, поскольку цинк покрытия корродирует при контакте с окружающей средой вперед железа, то есть принимает удар на себя, являясь более активным металлом, цинк охотнее вступает в химическую реакцию.
Днище корабля часто защищено аналогичным образом: к нему крепят кусок протектора, и тогда протектор разрушается, а днище остается невредимым.
Электрохимическая антикоррозийная защита подземных коммуникаций — также весьма распространенный путь борьбы с образованием на них ржавчины. Условия восстановления создаются подачей отрицательного катодного потенциала на металл, и в таком режиме процесс окисления металла уже не сможет протекать просто энергетически.
Кто-то может спросить, почему подверженные риску коррозии поверхности просто не красят краской, почему бы просто не покрывать каждый раз эмалью уязвимую к коррозии деталь? Для чего нужны именно разные способы?
Ответ прост. Эмаль может повредиться, например автомобильная краска может в неприметном месте отколоться, и кузов начнет постепенно но непрерывно ржаветь, поскольку сернистые соединения, соли, вода, кислород воздуха, — станут поступать к этому месту, и в итоге кузов будет разрушаться.
Чтобы такое развитие событий предотвратить, прибегают к дополнительной антикоррозийной обработке кузова. Автомобиль — это не эмалированная тарелка, которую можно в случае повреждения эмали просто выбросить, и купить новую..
Автомобиль — это не эмалированная тарелка, которую можно в случае повреждения эмали просто выбросить, и купить новую..
Текущее положение дел
Несмотря на кажущуюся изученность и проработанность явления коррозии, несмотря на применяемые разносторонние методы защит, коррозия по сей день представляет определенную опасность. Трубопроводы разрушаются и это приводит к выбросам нефти и газа, падают самолеты, терпят крушение поезда. Природа более сложна, чем может показаться на первый взгляд, и человечеству предстоит изучить еще многие стороны коррозии.
Так, даже коррозиестойкие сплавы оказываются стойкими лишь в некоторых предсказуемых условиях, для работы в которых они изначально предназначены. Например, нержавеющие стали не терпят хлоридов, и поражаются ими — возникает язвенная, точечная и межкристальная коррозия.
Внешне без намека на ржавчину конструкция может внезапно рухнуть, если внутри образовались мелкие, но очень глубокие поражения. Микротрещины, пронизывающие толщу металла незаметны снаружи.
Даже сплав не подверженный коррозии может внезапно растрескаться, будучи под длительной механической нагрузкой — просто огромная трещина внезапно разрушит конструкцию. Такое уже случалось по всему миру с металлическими строительными конструкциями, механизмами, и даже с самолетами и вертолетами.
Ранее ЭлектроВести писали, что немецкий исследовательский институт Фраунхофера по переработке материалов и ресурсным стратегиям (Fraunhofer IWKS) создал экологически устойчивый «Центр демонтажа и переработки в области электрической мобильности» (нем. — Zentrum für Demontage und Recycling — Elektromobilität ZDR-EMIL). Он разместился в городе Ханау (Hanau) в Федеральной земле Гессен при поддержке регионального министерства науки и искусств.
По материалам: electrik.info.
виды, особенности, защита от коррозии
Атмосферная коррозия металлов – один из основных факторов риска при использовании металлоконструкций на открытом воздухе. Процесс начинается под действием внешних факторов и приводит к постепенному разрушению материала.
В этом материале мы расскажем о том, как формируется такой тип коррозии, в чем его опасность и какие средства используют для защиты металла.
Понятие и виды атмосферной коррозии
Появление ржавчины стимулируется микроклиматом, наблюдаемым в нижних слоях атмосферы. Материалы без дополнительной защиты постепенно начинают страдать от такой проблемы.
При этом, атмосферная коррозия не такая стремительная и губительная, как почвенная и морская. Это дает возможность использовать специальные средства для защиты от нее и продлевать длительность эксплуатаций изделий из металла.
Особенность атмосферной коррозии заключается в том, что у разных материалов и в зависимости от климата, ее протекание сильно отличается.
Есть 3 вида атмосферной коррозии:
Сухая атмосферная коррозия
В этом случае повреждение начинается и без воздействия влаги – на поверхности металла не появляется характерной деструктивной пленки из жидкости. Для протекания процесса, нужно чтобы влажность окружающей среды была меньше 60%.
Для протекания процесса, нужно чтобы влажность окружающей среды была меньше 60%.
По своей сути процесс – химический. Он слишком стремителен в силу образования окислительного слоя – он постепенно замедляет распространение ржавения внутрь. Аналогичный принцип используется и при пассивации металлов.
Если рассматривать течение процесса подробнее, его делят на два этапа:
- Быстрый. Начинается при соприкосновении необработанного материала с воздухом.
- Медленный. Постепенное протекание ржавения металла после того, как на нем появился слой окислов.
При этом ржавчина, пусть и медленно, но распространяется. Поверхность постепенно темнеет, а структура материала начинает разрушаться, теряет прочность.
Интенсивность протекания процесса будет зависеть от температуры окружающей среды. Если она высокая, скорость увеличится. Толщина пленки варьируется в зависимости от самого материала. Доказано, что дополнительным стимулятором развития процесса становится рассеивание в атмосфере агрессивных газов.
Влажная атмосферная коррозия
Такой тип коррозии стимулируется появлением слоя влаги на металле. Для России такой тип повреждений наиболее характерен. Если влажность воздуха превышает 60%, риск развития коррозийного поражения увеличивается.
Уйти от него невозможно – даже при утреннем выпадении росы влажность уже оказывается достаточной, чтобы покрыть деталь опасной пленкой.
Риск поражения также увеличивается из-за высокого уровня загрязненности воздуха, контакта с агрессивными химическими средами.
Конденсация влаги проходит по трем основным механизмам:
- Химический. Влага начинает накапливаться, потому что коррозийные продукты начинают контактировать с влажным воздухом. Это усугубляет процесс, потому ржавые участки сильнее задерживают воду.
- Капиллярная. Возникает в трещинах, зазорах и щелях.
- Абсорбционная. Связана с действием одноименных сил на стальной поверхности.
Часто в развитии процесса участвуют все три механизма, но на разных этапах его появления. Итог один – материал теряет прочность и постепенно начинает разрушаться.
Итог один – материал теряет прочность и постепенно начинает разрушаться.
Мокрая атмосферная коррозия
Быстрый и опасный тип атмосферной коррозии. Начинает появляться при стопроцентной влажности воздуха, когда на металле скапливаются капли воды.
Также процесс характерен и для тех конструкций, которые постоянно помещены в воду. Если вода загрязнена, имеет повышенную кислотность или концентрацию соли, риск только увеличивается.
Как факторы влияют на появление коррозии
Когда мы рассмотрели виды атмосферной коррозии, пришло время внимательнее оценить факторы ее возникновения и развития.
На изделие их может воздействовать сразу несколько, а при усугублении влияния скорость только растет.
Среди распространенных факторов:
Повышенная влажность воздуха
Как уже было описано выше, она создает пленку разной толщины, которая начинает разрушать материал.
Главный параметр – относительная атмосферная влажность. Она начинает значительно влиять на металл, когда уровень превышает 60%.
При стопроцентной влажности, развивается мокрая коррозия, затрагивающая практически все виды материалов.
В зависимости от сплава, критический уровень влажности может меняться. Так сталь, цинк, медь и никель начинают ржаветь при показателях выше 70%.
Техногенное загрязнение воздуха становится дополнительным фактором порчи при влажности.
Газовый состав атмосферы
Можно легко заметить, что при аналогичной влажности, уровне осадков и периодичности туманов, в разных регионах материалы ржавеют с отличной друг от друга скоростью. Причина заключается в составе атмосферы. Рассеянные в ней газы могут значительно ускорять процесс.
Наиболее опасная среди всех примесей – диоксид серы. Она дает стимулирование скорости процесса в десятки раз. Некоторые виды газов могут выступать как депассиваторы, а также отражаться на поверхности даже если она прошла обработку.
Именно по этой причине, если вы проводите установку металлоконструкции в промышленном районе с большим количеством опасных производств, нужно внимательно выбирать место. Особенно это актуально при использовании нестабильных металлов, таких, как цинк, кадмий или железо.
Особенно это актуально при использовании нестабильных металлов, таких, как цинк, кадмий или железо.
Также стоит отметить, что при высокой влажности этот негативный фактор только усугубляется.
Уровень содержания твердых частиц
Речь идет как про пассивные, так и про активные включения. Они влияют на электропроводность влаги, стимулируют ее накопление, выступают как депассиваторы.
К наиболее опасным соединениям относятся такие, как (Nh5)2SO4 и Na2SO4. Они могут быть рассеяны в воздухе в виде пыли и легко переносятся ветром. Именно по этой причине рядом с уже сильно проржавевшими металлическими изделиями коррозия начинает развиваться быстрее, чем в обычной обстановке.
Температура
Так как в нашей полосе наиболее распространена именно влажная или мокрая коррозия, температура играет важную роль в испарении воды. Когда столбик термометра опускается ниже, происходит медленное испарение воды, а значит, деталь ржавеет быстрее.
Также не стоит забывать и о географическом факторе. Он сочетает в себе все три описанных. В разных регионах отличается влажность, уровень осадков и другие факторы.
Он сочетает в себе все три описанных. В разных регионах отличается влажность, уровень осадков и другие факторы.
Кроме того, меняется состав атмосферы, наличие посторонних крупных включений и загрязнителей. Потому одинаковые по составу сплавы ржавеют с разной скоростью даже в разных районах одного города, не говоря уже о регионе.
Как протекает атмосферная коррозия?
Чтобы перейти к вопросу защиты от атмосферной коррозии, важно рассмотреть сам механизм ее протекания.
Представим металлическую заготовку и попробуем посмотреть на нее через микроскоп.
Так вы быстро увидите сформированную на поверхности тонкую пленку. Это электролит. В зависимости от того, в каких условиях хранился или использовался металл, электролит формируется из продуктов коррозии или атмосферной влаги.
При контакте с воздухом, на материале начинается развитие катодного процесса с параллельным замедлением анодного. Если атмосфера сильно загрязнена, состав электролита может меняться, на него начинают воздействовать агрессивные примеси газов и других частиц.
Когда критическая масса набирается, металл ржавеет. Процесс проникает все глубже внутрь. На финальных стадиях в листах появляются дыры, а металлические детали становятся хрупкими. Большинство механизмов защиты от действия атмосферы направлены на то, чтобы изначально не дать процессу случиться.
Как защититься от атмосферной коррозии
Защита от угрозы повреждения металла – это очень важное условие увеличения длительности эксплуатации изделий. Явление появления ржавчины хорошо изучено и для уменьшения риска используется несколько основных средств:
- Нанесение специальных покрытий. Они могут быть как металлическими, так и неметаллическими. При нанесении металлического используется цинк, никель и другие материалы. К неметаллической группе относятся многочисленные смазки, ЛКП, специальные пасты. Многие из них могут применяться не только для защиты, но и в качестве ингибиторов атмосферной коррозии на уже пораженных деталях. Так удается замедлить или блокировать распространение разрушения.

- Стабилизация уровня влажности воздуха. При условии, что воздух чистый, без сильной концентрации вредных примесей, опасных паров, уровень относительной влажности можно поддерживать на отметке в 50%. Это не устранит опасности развития сухой коррозии, но общий риск порчи значительно уменьшит.
- Использование ингибиторов. Так называются вещества, которые способны замедлить или заблокировать распространение коррозийного поражения. Обычно используются вещества летучего типа – от нитритов и бензоатов до карбонатов. Они могут применяться в различных видах – от пропитки до закачивания внутрь металлической емкости.
- Легирование. Обеспечивается на этапе выплавки стали. Такие вещества как медь, хром, никель, титан и некоторые другие помогают существенно уменьшить скорость анодной реакции. На выходе металлу также будет требоваться дополнительная защита, но и сам по себе он хорошо противостоит угрозе.
Мы знаем, как защитить материал от порчи
Так как распространение ржавчины нужно не допустить – она может полностью вывести из строя металлическое изделие, намного выгоднее изначально подумать о правильной защите. Мы справляемся с задачей методом цинкования. Он помогает создать на поверхности защитный слой, который не допускает контакта с воздухом и водой.
Мы справляемся с задачей методом цинкования. Он помогает создать на поверхности защитный слой, который не допускает контакта с воздухом и водой.
У нас три цеха горячего цинкования и одна из самых глубоких ванн в Центральном федеральном округе. Это позволяет выполнять крупные заказы и работать с массивными изделиями.
Оставьте заявку на сайте или звоните нам, чтобы оформить заказ услуги или получить ответы на интересующие вас вопросы.
Вернуться к статьям
Поделиться статьей
Ржавчина и кислород из воздуха
| Путь: понимание физики > разное > |
Ржавчина – это оксид железа.
Когда железо ржавеет на воздухе, откуда берется кислород? Воздух, конечно; воздух примерно на 20% состоит из кислорода
и что 20% расходуются на образование ржавчины — так нам говорят, и так далее.
мы обычно предполагаем. Но можем ли мы проверить это, используя несколько статей
с кухни? Да .
| Рисунок 1: Установка |
Никогда
проделав это раньше, мы не были уверены, чего ожидать, поэтому мы попробовали
пара разных вещей. Я знал по опыту, что в сухом воздухе
железо в основном просто сидит там. Однако, если это мокрое , это
ржавеет, иногда довольно быстро. В частности, когда
обычные губки из стальной ваты используются для чистки горшков, они имеют тенденцию превращаться в
отвратительная масса грязно-коричневого противного вещества не более чем за день или
два. Поэтому мы решили использовать для эксперимента мокрую стальную вату.
Для
небольшой запас воздуха, мы использовали пару винных бутылок. Мы
положил мокрую подушечку и немного воды в первую бутылку.
Поскольку никто из нас здесь не слишком ясно представляет себе, как именно ржавеет
процесс работает, мы также решили попробовать полностью погрузить коврик в воду.
Итак, мы наполнили вторую бутылку наполовину водой и вылили
подушку из стальной ваты в воду.
Чтобы измерить, сколько газа фактически было потреблено,
мы использовали воздушные шары. Мы выжимали столько воздуха, сколько могли из
два воздушных шара и наденьте по одному на горлышко каждой бутылки (рис. 1).
| Рис. На следующий вечер мы заметили, что воздушный шар на первой бутылке («только что мокрая бутылка), казалось, частично втянулась. закрученный у основания; Я немного покачал его и немного раскрутил, и к нашему большому удивлению, раздался звук вроде schloonk , и мы довольно резко пришли к цифре 2. В течение следующих нескольких дней перевернутый шар продолжал надуваться (или и плоский?). Немного
А вторая бутылка? А как насчет бутылки, наполовину наполненной водой? Есть только 24 Но в бутылке что-то происходило — прокладка ржавела. Он получал кислород от где-то Действительно, ржавчина казалась [Как
Источники ошибки Вернемся к числам, которые мы получили выше. С Из Википедии,
Есть Что создает ржавчину? — Зажечь промышленные технологииВероятно, вы видели ржавчину на старых автомобилях, зданиях и других металлических поверхностях и задавались вопросом, что это такое. Многие люди обычно думают, что ржавчина — это просто окисление, и на самом деле не знают, что ее вызывает. Итак, что вызывает ржавчину? Что создает ржавчину? Ржавчина – это оксид железа, продукт реакции между железом и кислородом в присутствии воды или влаги воздуха. Ржавчина представляет собой серьезную проблему для многих отраслей промышленности, поскольку она может привести к износу и разрушению металлических поверхностей. Его также может быть очень трудно удалить после того, как он сформировался. Ржавчина может вызвать серьезные проблемы для зданий, сооружений, автомобилей и других ценных металлических изделий. Прежде всего важно понять, что вызывает ржавчину, чтобы предотвратить ее образование. Промышленности и другим организациям, использующим металлические предметы, необходимо принимать меры для максимально возможной защиты своего имущества от ржавчины и других форм коррозии. Процессы образования ржавчины Ржавчина представляет собой оксид железа, который образуется, когда железо или сплав, содержащий железо, подвергается воздействию кислорода и влаги в течение длительного времени. Ржавление — это электрохимический процесс, который начинается с переноса электронов от металла к кислороду. Это создает в металле дефицит электронов, который необходимо восполнить за счет потока электронов из более электроотрицательного вещества. Для появления ржавчины должны присутствовать три вещи: железо, кислород и вода. Ржавчина образуется, когда эти три элемента объединяются и создают электрохимическую реакцию. железо + вода + кислород → гидратированный оксид железа(III). Именно гидратированная часть делает ржавчину коричневой, а не красной. Факторы, влияющие на скорость коррозииКогда дело доходит до коррозии, не все металлы одинаковы. Скорость ржавления зависит от различных факторов, которые можно обобщить следующим образом: Тип металла Некоторые металлы ржавеют легче, чем другие. Например, железо и сталь ржавеют быстрее, чем алюминий или нержавеющая сталь. Сплавы из нержавеющей стали содержат не менее 10,5% хрома. Хром образует тонкий слой оксида на поверхности стали, который защищает ее от дальнейшего ржавления. Если ваши приборы ржавеют, это может быть связано с тем, что они изготовлены из менее устойчивого к коррозии стального сплава. Наличие влагиРжавчина не может образоваться без воды. Причина, по которой железные трубы часто ржавеют изнутри, заключается в том, что на металле конденсируется водяной пар. Присутствие влаги ускоряет процесс ржавчины, потому что она обеспечивает электролит, необходимый для протекания реакции. Нелегированные металлы особенно подвержены коррозии во влажной среде. Вот почему вы часто видите, что оцинкованная сталь или кованое железо ржавеют быстрее, чем другие виды металла. Присутствие кислорода Ржавчина может образовываться только в присутствии кислорода. Вам нужно помнить, что в воде или во влажных местах содержится не только кислород. Углекислый газ в воздухе также может обеспечить кислород, необходимый для образования ржавчины. В присутствии воды углекислый газ реагирует с образованием угольной кислоты. Этот электролит может ускорить процесс ржавчины и вызвать коррозию. Поэтому, даже если вы не живете во влажном климате, ваши металлические поверхности все равно могут ржаветь, если они подвергаются воздействию углекислого газа и воды. Присутствие других химических веществРжавчина также может образовываться при наличии других химических веществ. Например, соль ускоряет процесс ржавчины, разъедая металл. Вот почему часто можно увидеть, как железные перила и заборы быстрее ржавеют у океана. Кислоты также могут ускорить процесс ржавчины. Основания также могут способствовать коррозии. Это связано с тем, что они нейтрализуют кислоты, образующиеся на поверхности металла, подвергая его воздействию кислорода и воды. Поэтому, если вы живете в районе с высоким уровнем загрязнения, ваши металлические поверхности могут ржаветь с большей вероятностью. ТемператураТемпература также может влиять на скорость коррозии. В общем, чем выше температура, тем быстрее процесс ржавчины. Это связано с тем, что молекулы воды и кислорода более активны при более высоких температурах, и им легче проникать через поверхность металла и вступать в реакцию с железом. Как предотвратить появление ржавчины Предотвращение образования ржавчины — это бесконечная битва, потому что существует множество способов, при которых металл может подвергаться воздействию кислорода и влаги.
|



 Конечно, это больше, чем
Конечно, это больше, чем Явных дыр нет.
Явных дыр нет. Без
Без
 Не обращайте внимания на точность маркировки; большая проблема
Не обращайте внимания на точность маркировки; большая проблема Если бы мы хотели
Если бы мы хотели Кислород реагирует с железом с образованием оксида железа, который также известен как ржавчина. Вода помогает кислороду реагировать с железом, обеспечивая источник влаги.
Кислород реагирует с железом с образованием оксида железа, который также известен как ржавчина. Вода помогает кислороду реагировать с железом, обеспечивая источник влаги. 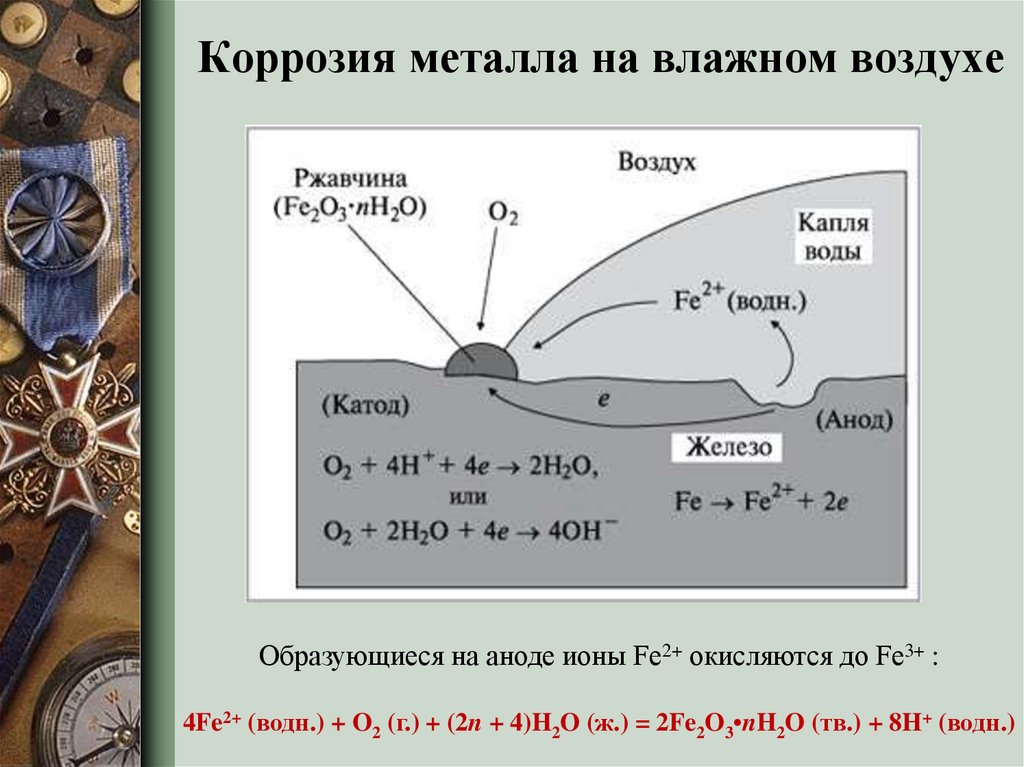 Полученный красновато-коричневый цвет обусловлен образованием гидратированного оксида железа (III).
Полученный красновато-коричневый цвет обусловлен образованием гидратированного оксида железа (III).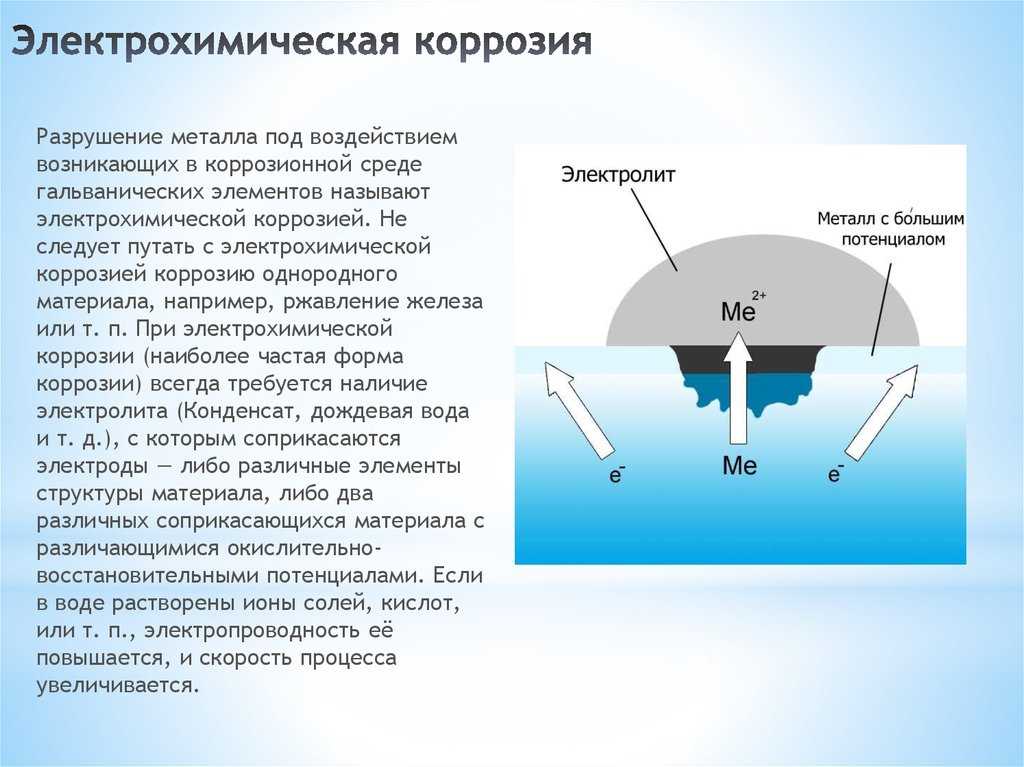 Разница обусловлена электрохимическим потенциалом металла. Чистые металлы обычно более реакционноспособны и, следовательно, более подвержены ржавчине.
Разница обусловлена электрохимическим потенциалом металла. Чистые металлы обычно более реакционноспособны и, следовательно, более подвержены ржавчине.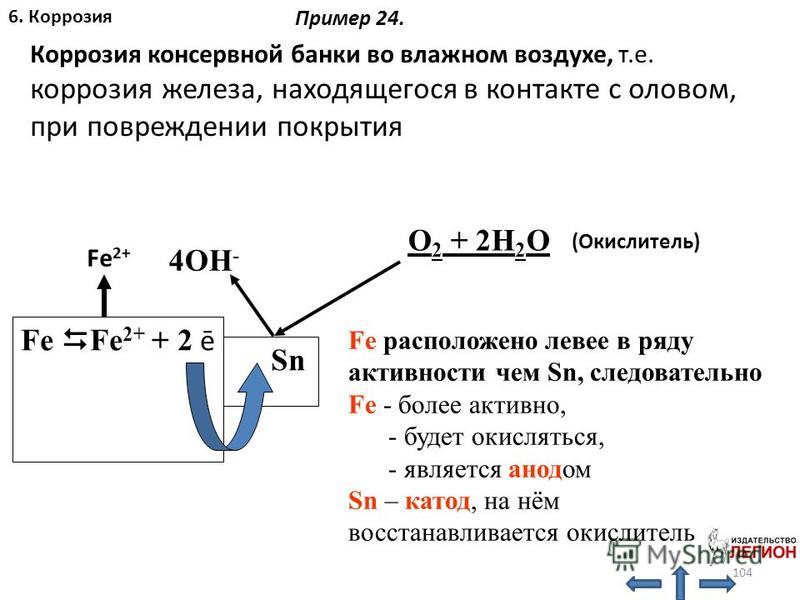 Если вы живете в сухом климате, ваши металлические поверхности могут меньше ржаветь. Это связано с тем, что для протекания реакции требуется кислород, и он более доступен во влажном воздухе.
Если вы живете в сухом климате, ваши металлические поверхности могут меньше ржаветь. Это связано с тем, что для протекания реакции требуется кислород, и он более доступен во влажном воздухе.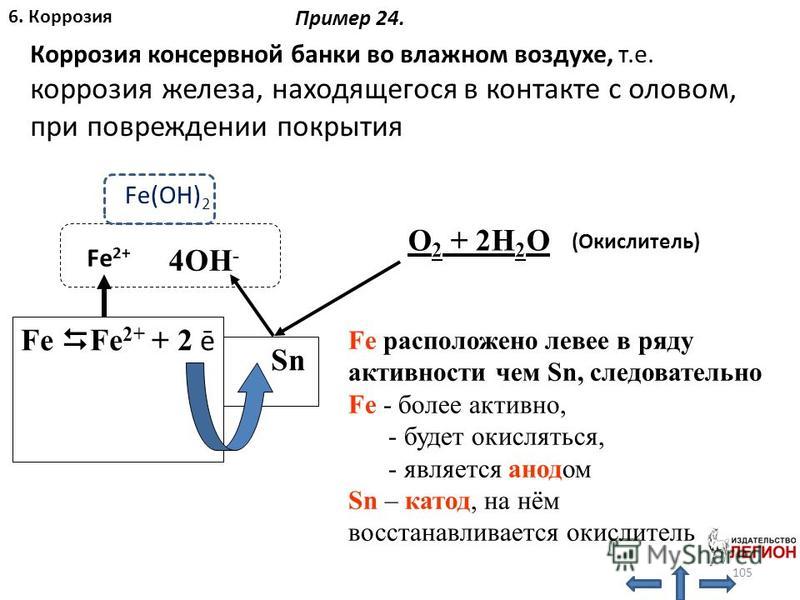 Это связано с тем, что они разрушают оксидный слой, который образуется на поверхности металла, подвергая металл воздействию кислорода и воды, что ускоряет процесс коррозии.
Это связано с тем, что они разрушают оксидный слой, который образуется на поверхности металла, подвергая металл воздействию кислорода и воды, что ускоряет процесс коррозии.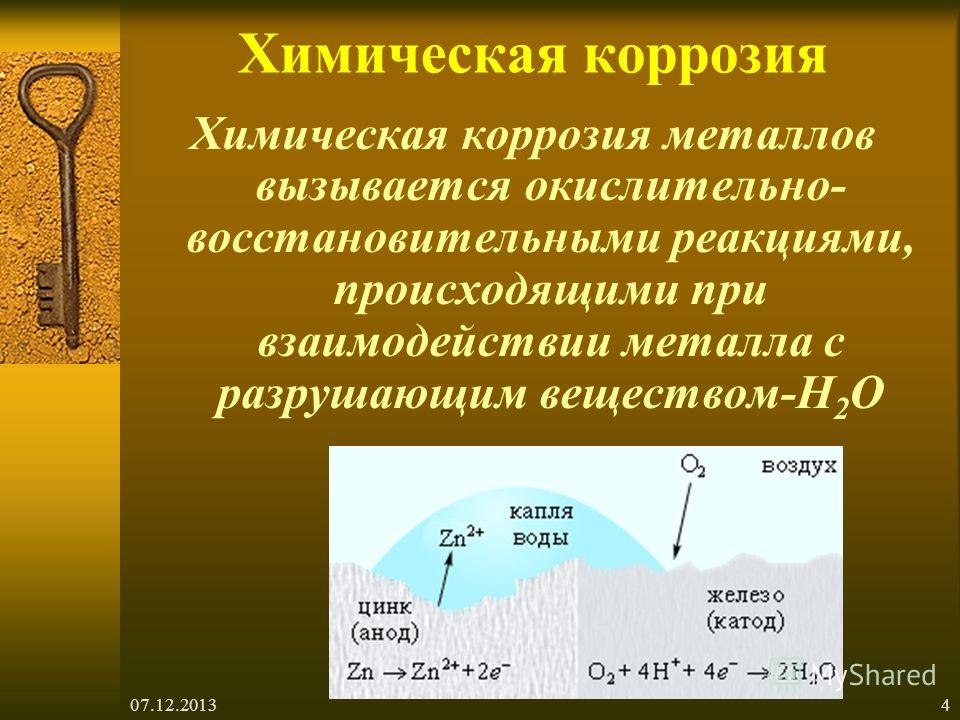 Ниже приведены некоторые общие советы по предотвращению ржавчины:
Ниже приведены некоторые общие советы по предотвращению ржавчины: