Что такое химическая и электрохимическая коррозия: Химическая коррозия
Содержание
Химическая коррозия — основные виды, факторы формирования, стадии протекания
Химическая коррозия металлов – это опасное явление, способное привести к их полному разрушению. Процесс напрямую связан со способностью материала вступать во взаимодействие со средой, представляющей повышенную химическую опасность.
Среди важных свойств протекания химической коррозии металла – параллельный процесс окисления и восстановления. Ученые не отмечают прямой связи с электрическим током, который потенциально может образовываться или воздействовать на участвующие в реакции материалы.
Если рассматривать первопричину распространения такого процесса, то мы быстро придем к выводу – она кроется в термической нестабильности металлов разных типов.
Они склонные под воздействием окислительных компонентов среды быстро переходить в устойчивое состояние и зачастую это происходит полностью непроизвольно.
Процесс окисления и восстановления при протекании химической коррозии происходит на фоне уменьшения потенциала системы. При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
Ученые определяют основным критерием, который стимулирует самопроизвольный процесс, такой показатель, как изобарно-изотермический потенциал G.
Когда реакция начинает протекать произвольно, он значительно убывает. При этом скорость уменьшения может меняться в зависимости от типа материалов, условий коррозионной среды и ряда других ключевых параметров.
Основные виды химической коррозии
Ученые выделяют два основных типа химической коррозии. Газовая протекает при контакте поверхности металла с газами. Она усиливается по мере изменения температуры среды.
Также химическая коррозия способна активно протекать в жидкостях-электролитах, если для этого формируются необходимые внешние условия.
Рассмотрим особенности обоих описанных процессов более подробно, чтобы понять, как можно создать дополнительную защиту от них.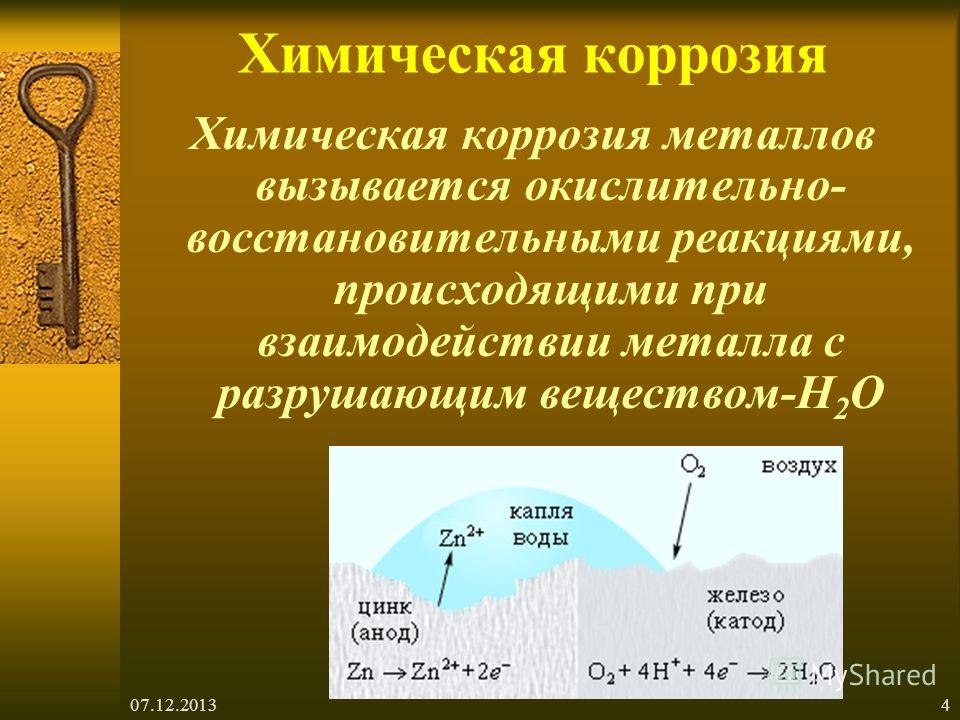
Газовая коррозия металлов
Научная статистика показывает, что газовая коррозия металлов протекает наиболее часто. При рассмотрении химической порчи она значительно более распространена, чем жидкостное ржавение при контакте с электролитами.
Важный фактор здесь – высокая температура. Если металл сильно нагрет и на него начинает воздействовать газ, происходит разрушение.
Так как уровень температур должен быть достаточно высок, а при обычном использовании создать условия для протекания такой химической коррозии довольно сложно, процесс часто наблюдается в металлургии.
Из-за этого страдает оборудование, используемое при штамповке, ковке, горячей прокатке и других процессах. Без дополнительной защиты длительность использования подобной техники станет значительно меньше.
Опасность представляет и контакт металла с кислородом. Формула реакции, которая запускается в таком случае, выглядит следующим образом: Ме + 1/2О2 – МеО.
Эта реакция имеет четкое окислительное направление, потому напрямую связана с показателями парциального кислородного давления. Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Очень важно понимать, с какой газовой смесью контактирует металл в той области, где вы его используете. Хорошее понимание парциального давления кислорода в смеси даст нам температурный интервал.
Именно в нем будет запускаться окислительный процесс, приводящий к разрушению материала или значительному ухудшению уровня его качества.
Факторы скорости протекания газовой химической коррозии
По мере исследования особенностей процесса протекания химической коррозии, ученые смогли определить важные факторы, которые влияют на ее скорость и другие особенности. К ним относятся такие, как:
- Температура среды, в которую погружен металл.
- Состав сплава и другие особенности металла.
- Особенности газовой среды, ее состав, преобладающие элементы.
- Длительность контактирования материала с коррозийной средой.

- Появляющийся продукт коррозии.
Как и в случае с другими типами коррозийных поражений, большое значение имеет тип и особенности создающейся на поверхности оксидной пленки.
Особенности формирования оксидных пленок при газовой коррозии
Весь процесс формирования оксидной пленки на поверхности металла можно разделить на две крупные стадии:
Абсорбирование молекул кислорода на поверхности металлического изделия
Это происходит на тех участках, которые находятся в непосредственном контакте с атмосферой. Заметно появление ионной связи – атом кислорода забирает у металла по два электрода.
Можно предположить, что формирование очень сильной и стабильной связи при протекании такой реакции связано с попаданием кислорода в особое поле атомов металла.
Когда поверхность материала будет полностью наполнена окислителем, окажется сформирована мономолекулярная пленка. Она имеет склонность к утолщению со временем. Это уменьшает дальнейший контакт с кислородом, но сам опасный коррозийный процесс уже оказывается запущен.
Формирование химического соединения
Это явление характерно для ситуации, в которой происходит активное взаимодействие металла и газа. Из-за воздействия окислительных компонентов сплав начинает активно терять валентные электроны. Стремительно формируются и накапливаются продукты коррозии.
Дальнейшее протекание процесса будет во многом характеризоваться особенностями оксидной пленки. Так если она отличается повышенным уровнем защиты, сам коррозийный процесс будет замедляться.
Виды оксидных пленок
Когда химическая коррозия происходит под действием температуры и газовой среды, могут сформироваться три вида пленок:
- Тонкие. Со стороны заметить их будет невозможно. Они одни из самых не прочных, могут легко стираться под действием механического давления.
- Средние. Могут быть замечены, потому что со стороны металл слегка меняет цвет.
- Толстые. Хорошо заметны невооруженным глазом.
Чтобы не допустить протекание опасных процессов разрушения материала, важно сделать пленку защитной.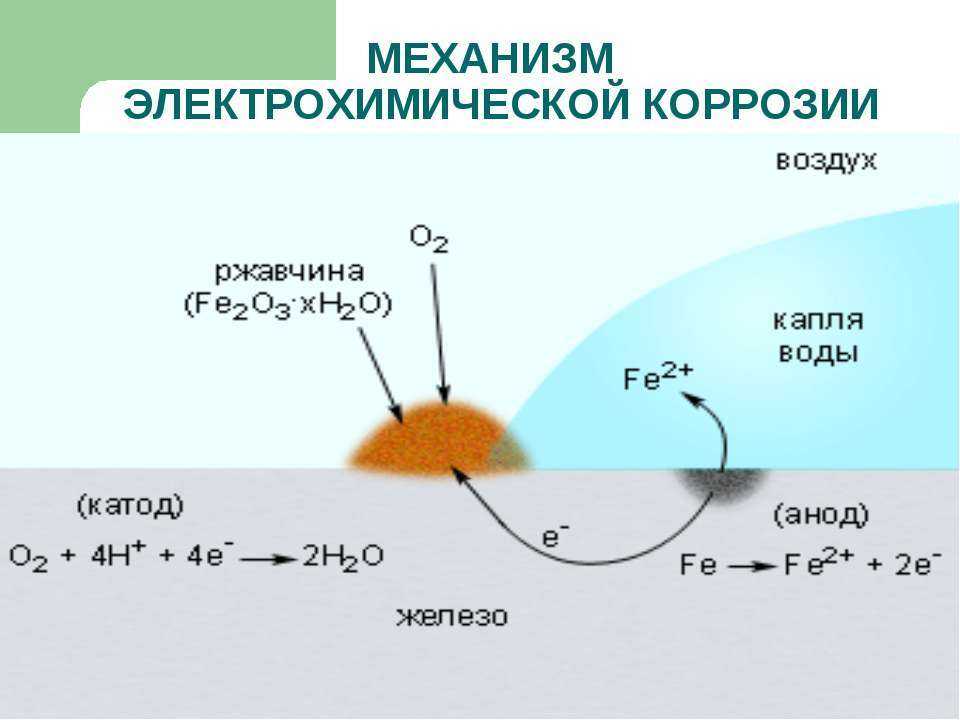
Факторы формирования защитной пленки
Оксидная пленка способна оказывать выраженное защитное воздействие на материал. Но для этого требуется, чтобы она соответствовала нескольким важным требованиям:
- Сплошность. На поверхности пленка распределяется ровным слоем, без пор и участков, которые не затронуты ею.
- Хорошее сцепление с поверхностью материала. Это требуется для удержания подобного защитного барьера на месте и исключения ухудшения его свойств.
- Химическая инертность. Пленка будет защищать металл только в том случае, если она вступает в химические реакции с окружающей средой. В противном случае, есть большая опасность, что весь защитный эффект окажется сведен к нулю.
Так как материал будет использоваться на протяжении длительного времени и сложно предсказать, что станет воздействовать на него, большое значение имеет стойкость к износу и повышенный уровень твердости.
Не менее важен и тот факт, чтобы пленка не была пористой и рыхлой. Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
При изучении различных свойств оксидных пленок, ученые особенно пристально рассматривают сплошность. Отмечается, что на нее влияет молекулярный объем. Его показатели должны быть выше атомного объема металла.
Сплошность не ставится на первое место при определении защитных свойств оксидной пленки только для небольшой группы металлов. В их числе щелочно-земельные и щелочные.
При проведении работ по защите от химической коррозии, большое внимание уделяется методу замера толщины. Анализ характеристик происходит на разных стадиях формирования. Большое значение имеют получаемые показатели скорости окисления металла и характер протекания подобного процесса.
Когда окислы оказываются сформированными, специалисты рекомендуют проверить, какую пленку они создали на поверхности, обладает ли она нужными защитными свойствами.
Химическая коррозия в жидкостях-неэлектролитах
Хотя газовая коррозия считается наиболее распространенной, порчу металла при контакте с различными жидкостями-электролитами также не стоит сбрасывать со счетов. Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Их делят на две крупные группы – органические и неорганические. Электролитов, представляющих большую опасность для металла, много – от расплавленной серы и бензола до жидкого брома, спирта, керосина, нефти и других.
Большое значение при протекании химической реакции играет чистота электролита. Когда он полностью чист, взаимодействия не наблюдается. Но стоит только попасть в состав небольшому количеству примесей, реакция начинает развиваться особенно стремительно.
Еще один дополнительный фактор риска – присутствие влаги. Тогда к опасности химической коррозии также прибавляется и угроза электрохимической.
Стадии протекания коррозии в жидкостях-неэлектролитах
Если рассматривать весь процесс более подробно и анализировать, что влияет на скорость химической коррозии, можно выделить несколько стадий ее протекания:
- Контакт окислителя с поверхностью материала.

- Запуск процесса хемосорбции реагента на поверхности.
- Протекание реакции металла и окислителя, формирование оксидной пленки.
Условия среды, состав сплава и самого электролита могут повлиять на протекание нескольких основных процессов. К ним относятся такие, как десорбция оксидов с металлом и диффузия оксидов в неэлектролит. Но оба процесса также могут и не наблюдаться.
Чтобы не допустить запуска коррозии в жидкостях-электролитах, стоит позаботиться о нанесении на поверхность специальных защитных составов. Важно, чтобы на протяжении всего времени использования изделия они полностью сохраняли свою целостность.
Факторы протекания химической коррозии
Большое значение при рассмотрении процесса химической коррозии металлов имеет определение факторов, оказывающих на нее влияние. К ним относятся такие, как:
Температура
Все окислительные процессы протекают быстрее, если температура сильно увеличивается.
Температурный режим
В особой группе риска оказываются металлические изделия, которые на протяжении определенного времени начинают охлаждаться и нагреваться попеременно. В таком случае сильно страдает защитная пленка. Она начинает трескаться, в местах, где это происходит, металл контактирует со средой, запускается повторное окисление. Новая пленка также формируется на фоне постепенного отслоения старой.
Состав среды
Это относится как к газам, так и к электролитам в жидком виде. Как уже было отмечено выше, даже небольшие загрязнения жидкости могут привести к тому, что скорость коррозийного повреждения станет значительно выше.
Состав сплава
В сплав металла добавляют различные компоненты, которые могут, как затормозить, так и ускорить окисление. К примеру, сильными замедлителями признаны такие добавки, как титан, медь и кобальт. Хорошо влияют на уменьшение скорости протекания процесса хром и алюминий.
Тип обработки поверхности
Ученые во время исследований показали, что гладкая поверхность отличается заметно более высокой устойчивостью к окислению, процесс протекает медленнее.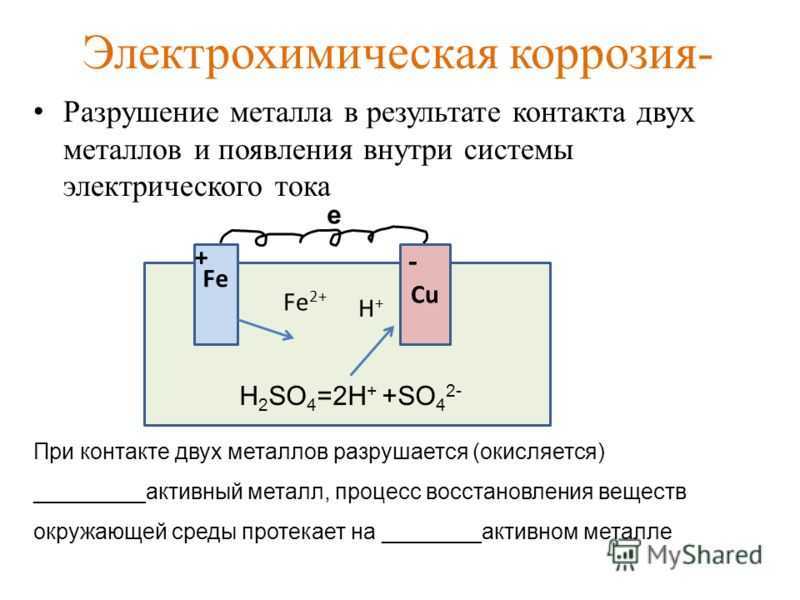 Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Структура материала
Уравнение химической коррозии показывает, что значительное замедление коррозийного процесса характерно для металлов с аустенитной структурой.
Подведем итоги
В этой статье мы рассмотрели виды химической коррозии и то, чем она отличается от электрохимической. При условии соблюдения ряда требований, удается заметно уменьшить риск разрушения металла. К ним относятся такие, как:
- Контроль формирования защитной оксидной пленки.
- Исключение контакта определенных материалов с агрессивными средами.
- Использование дополнительных защитных покрытий.
- Отслеживание состава газовой смеси или электролита.
- Применение металлов с компонентами сплава, замедляющими реакцию.
Соблюдение перечисленных требований позволит значительно увеличить длительность использования вашего металлического изделия.
Вернуться к статьям
Поделиться статьей
|
Навигация: Химическая и электрохимическая коррозия Химическая и электрохимическая коррозия
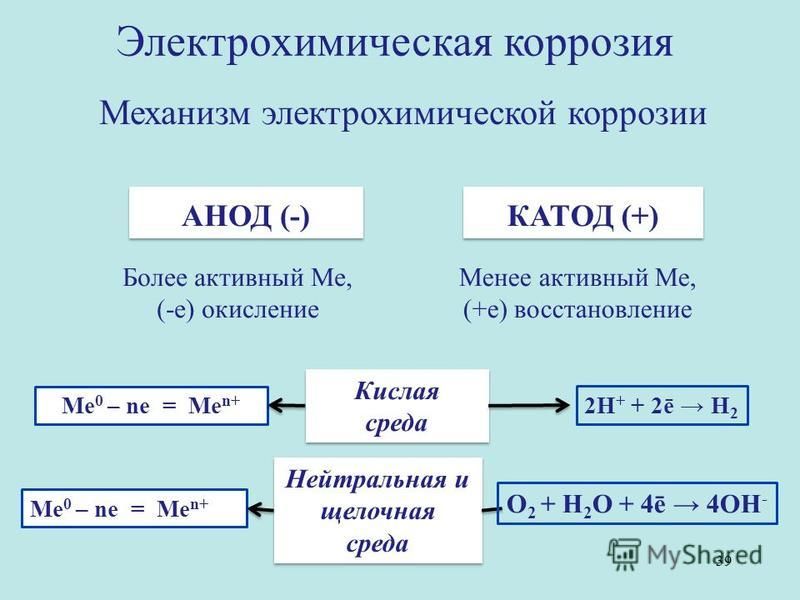
Коррозия считается электрохимической, если при выходе из металлической решетки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды. Окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединить валентные электроны металла, не удерживая около себя катионы. При электрохимической коррозии удаление атома из металлической решетки (что составляет сущность любого коррозионного процесса) осуществляется в результате двух независимых, но сопряженных, связанных между собой электрическим балансом, электрохимических процессов: анодного (переход сольватируемых катионов металла в раствор) и катодного (связывание окислителем освобождающихся электронов). Следовательно, процесс электрохимической коррозии можно замедлить не только путем торможения анодного процесса, но и воздействия на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов и восстановление растворенного кислорода. Их ча-cjo называют соответственно водородной и кислородной деполяризацией. Анодный и катодный процессы с определенной вероятностью и в той или иной последовательности протекают в любых точках металлической поверхности, где катионы и электроны могут взаимодействовать с компонентами коррозионной среды. Если поверхность однородна, то катодные и анодные процессы равновероятны по всей ее площади. В таком идеальном случае коррозия называется гомогенно-електрохимичеекой, отмечая, таким образом, отсутствие какой-либо неоднородности в распределении вероятности электрохимических процессов в любой точке поверхности, что не исключает термодинамической гетерогенности взаимодействующих фаз. В действительности на, металлических поверхностях существуют участки с различными условиями доставки реагирующих компонентов, с разным энергетическим состоянием атомов или с различными примесями. Проводимость металла очень высока, и при возникновении избыточного заряда электроны практически мгновенно перераспределяются, так что плотность заряда и электрический потенциал металла меняются одновременно по всей его поверхности независимо от того, в каких ее точках электроны освободились после ухода катионов, а в каких захватываются окислителем. В частности это означает, что от мест, где преимущественно протекает анодная реакция, электроны перемещаются в металле к местам протекания катодной. Соответственно раствор вблизи анодных участков получает избыточный положительный заряд растворившихся катионов, а вблизи катодных заряжается отрицательно в результате захвата электронов растворенным окислителем. В растворе эти заряды не перераспределяются так легко, как в металле. Поэтому с повышением скорости процесса потенциал раствора, находящегося в непосредственной близости от анодных участков, становится все более положительным, что затрудняет катодный процесс. Когда такое падение напряжения велико, коррозионную систему удобнее представить в виде системы короткозамкнутых микро-или макрогальванических элементов. В остальных случаях при определении средней по площади- скорости растворения металла современная теория, наряду с вышеизложенной моделью, позволяет также представлять электрохимически гетерогенную поверхность как квазигомогенную. Тогда ей приписывают удельные анодные и катодные характеристики, равные интегрально усредненным ‘по площади значениям одноименных характеристик моделируемой на основе теории подобия гетерогенной поверхности. Графически их изображают на коррозионной диаграмме в виде анодных и катодных поляризационных кривых, которые отображают влияние электродного потенциала на усредненные по площади и выраженные в единицах плотности тока скорости выхода катионов и электронов с данной поверхности в данный электролит. Похожие статьи: Навигация:
Главная → Справочник → Статьи → Блог → Форум
|
|
|
Сравните разницу между электрохимической коррозией и химической эрозией
В нашей повседневной жизни мы сталкиваемся со многими случаями износа или износа по разным причинам, обычно литые объекты часто окисляются до ржавчины. Люди часто используют краску, чтобы предотвратить это.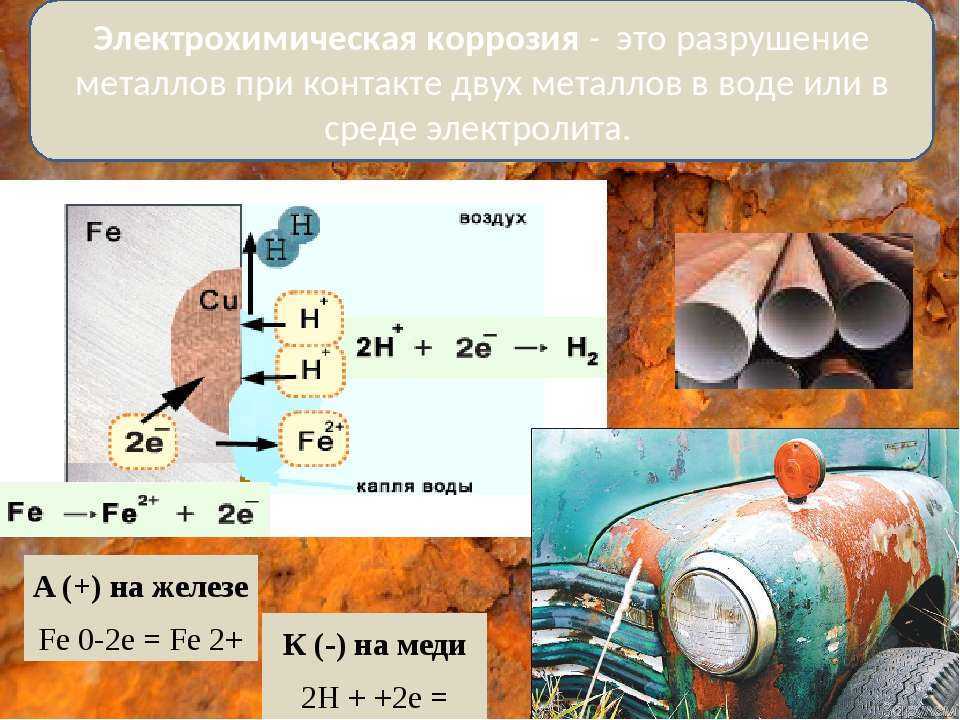
1. Химическая коррозия
Химическая коррозия вызывается реакцией металла с водяным паром или газом при высоких температурах. Или я вижу, что люди говорят сложнее, как следует
Химическая коррозия – это окислительно-восстановительный процесс, при котором электроны металла передаются непосредственно веществам в окружающей среде.
Электрохимическая коррозия представляет собой окислительно-восстановительный процесс, при котором металл подвергается коррозии под действием раствора электролита, который генерирует электроны, движущиеся от анода к катоду.
Условия электрохимической коррозии:
1) Электроды должны быть разными. Например, Fe и Cu. Прочные металлы являются катодными и быстро разрушаются
2) Электроды должны находиться в контакте друг с другом (прямо или косвенно через проводник) и в контакте с электролитом
2. Электрохимическая коррозия
Электрохимическая коррозия – разрушение металла при контакте с раствором электролита для создания электрического тока.
Например: корпус затонувшего корабля, трубопровод, помещенный в грунт, металл, контактирующий с влажным воздухом… Таким образом, электрохимическая коррозия является наиболее распространенной и наиболее сильной коррозией металлов.
а) Электрохимическая коррозия Условия: Необходимые и достаточные условия:
— Электроды должны быть разные: это могут быть пары металлов, пары металлов — неметаллы (С), пары металлов — химические соединения (xmentment). Металл, который имеет более сильный коэффициент восстановления, является катодом. Поэтому чистые металлы трудно подвергать эрозии.
— Электроды должны соприкасаться друг с другом (прямо или косвенно через проводник)
— Электроды соприкасаются с раствором электролита
b) Механизмы электрохимической коррозии: Железо или сталь представляют собой сплавы Fe-C, в которых катодами являются кристаллы Fe, электронно-лучевые кристаллы. Эти электроды вступают в непосредственный контакт друг с другом и с покрытием из жидкого электролита. Таким образом, корродированные объекты являются электрохимическими:
Таким образом, корродированные объекты являются электрохимическими:
На катоде: Атомы Fe окисляются. Эти ионы растворяются в растворе электролита, содержащем некоторое количество кислорода, где они дополнительно окисляются.
На аноде: Ионы водорода электролита перемещаются к положительному заряду, где они восстанавливаются до свободного водорода и затем высвобождаются из раствора.
Кристаллы Fe окисляются снаружи по очереди. Через некоторое время железо (сталь) будет выедено.
в) Природа электрохимической коррозии: на поверхности электродов протекает окислительно-восстановительный процесс. На катоде происходит окисление металла. На положительном электроде восстановление ионного (если раствор электролита кислый)
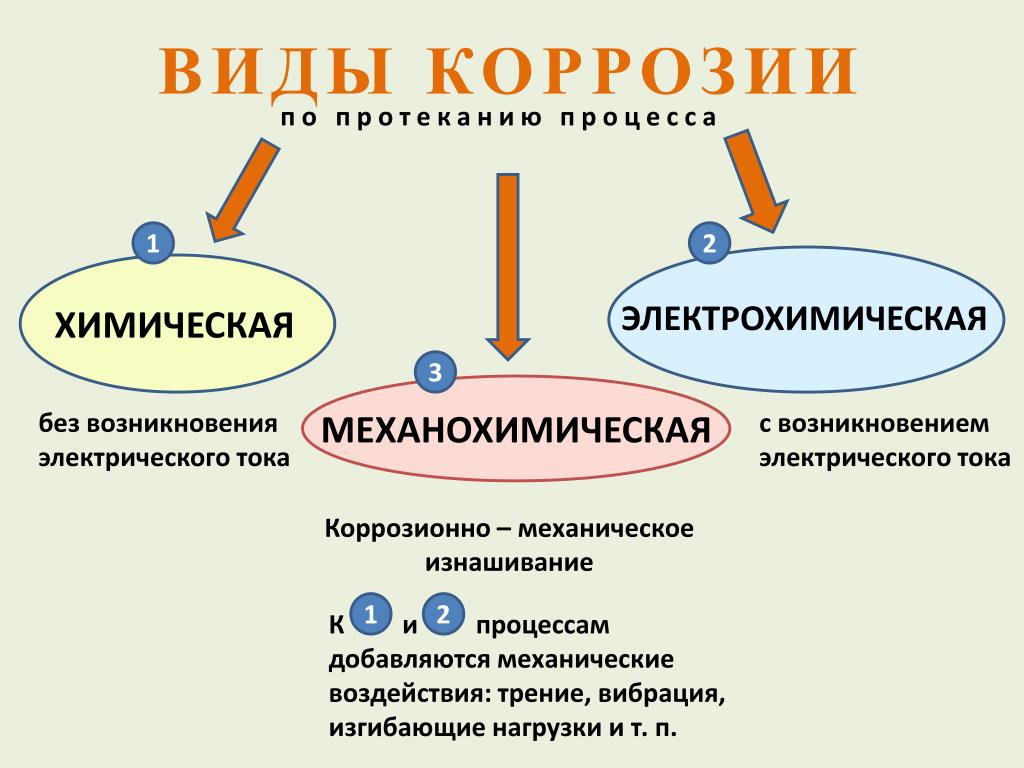
3. Сравнение электрохимической коррозии и химической эрозии
Классифицируйте | Химическая коррозия | Электрохимическая коррозия |
Corrosive Conditions | ||
Условия. — Электроды должны быть разные, будь то пары двух разных металлов или пары металлы-неметаллы или пары металлы-химические соединения (типа Fe3C). Там, где металл имеет меньший электродный потенциал, он будет катодом. — Электроды должны находиться в прямом или косвенном контакте с проводом, электроды должны контактировать с раствором электролита. | ||
Механизм эрозии | FE Оборудование, подвергнутое паровам, возникает газовая реакция кислорода: 3FE + 4H3O FE3O4 + 4H3 ↑ 3FE2 FE3O4 | |
Характер коррозии | Восстановительно-окислительная, при которой электроны металла передаются непосредственно веществам окружающей среды, коррозия протекает медленно. | Коррозия металлов под действием раствора электролита и электрического тока. Электрохимический износ происходит быстрее, чем химическая эрозия. |
Интернет-агрегация
Коррозия как электрохимический процесс
Коррозия как электрохимический процесс
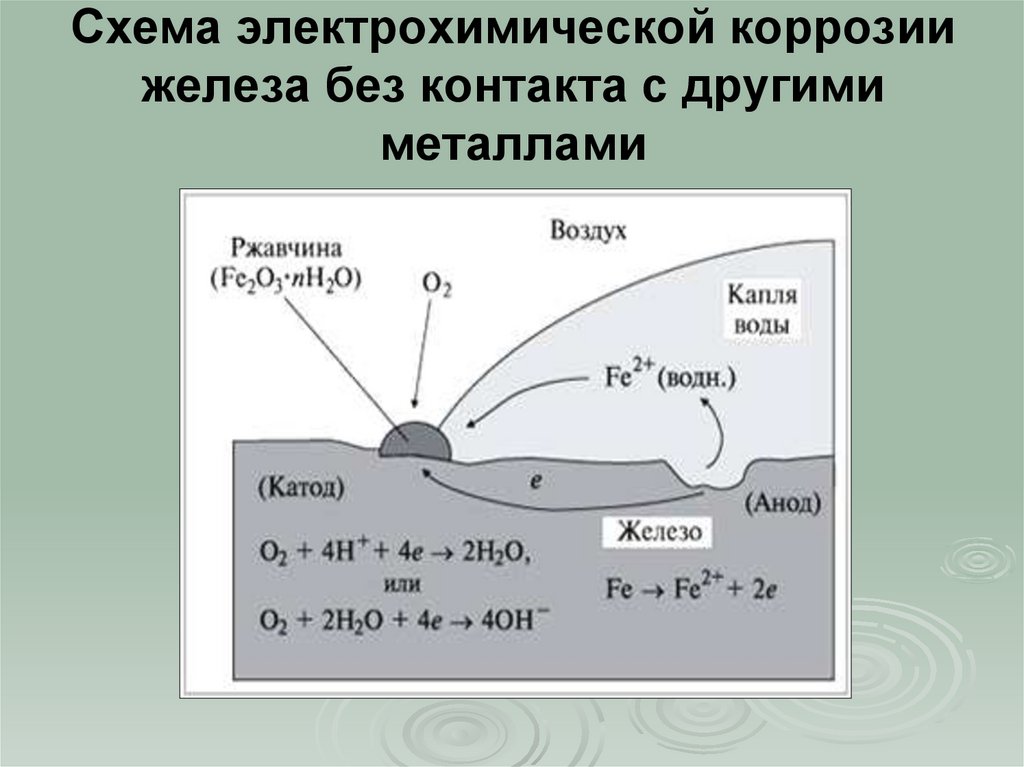
Кусок голого железа, оставленный снаружи, где он подвергается воздействию влаги, быстро заржавеет. Это произойдет еще быстрее, если влага представляет собой соленую воду. Скорость коррозии увеличивается за счет электрохимического процесса, в котором капля воды становится гальваническим элементом при контакте с металлом, окисляя железо. Рассматривая набросок капли воды (после Эббинга), окисляющееся железо поставляет электроны на край капли для восстановления кислорода из воздуха. . Fe(s) -> + Fe 2+ (водн.) + 2e — Электроны могут двигаться через металлическое железо наружу капли, где О 2 (г) + 2H 2 O(ж) + 4e — -> 4OH — (водн.) Внутри капли ионы гидроксида могут двигаться внутрь, чтобы реагировать с ионами железа (II), перемещающимися из области окисления. Гидроксид железа(II) осаждается. Fe 2+ (водн.) + 2OH — (водн.) -> Fe(OH) 2 (тв.) Ржавчина затем быстро образуется в результате окисления осадка. 4Fe(ОН) 2 (s) + O 2 (g) -> 2Fe 2 O 3 H 2 O(s) + 2H 2 O(l) Ржавление незащищенного железа в присутствии воздуха и воды в этом случае неизбежно, так как оно обусловлено электрохимическим процессом.
| Index Oxidation/ Electrochemistry concepts Reference Ebbing | ||
| Вернуться |
Подземные стальные трубы обладают прочностью для транспортировки жидкостей под высоким давлением, но они уязвимы для коррозии, вызванной электрохимическими процессами. |




 На таких участках возможно более энергичное протекание анодного или катодного процессов, и коррозия становится гетерогенно-электрохимической.
На таких участках возможно более энергичное протекание анодного или катодного процессов, и коррозия становится гетерогенно-электрохимической.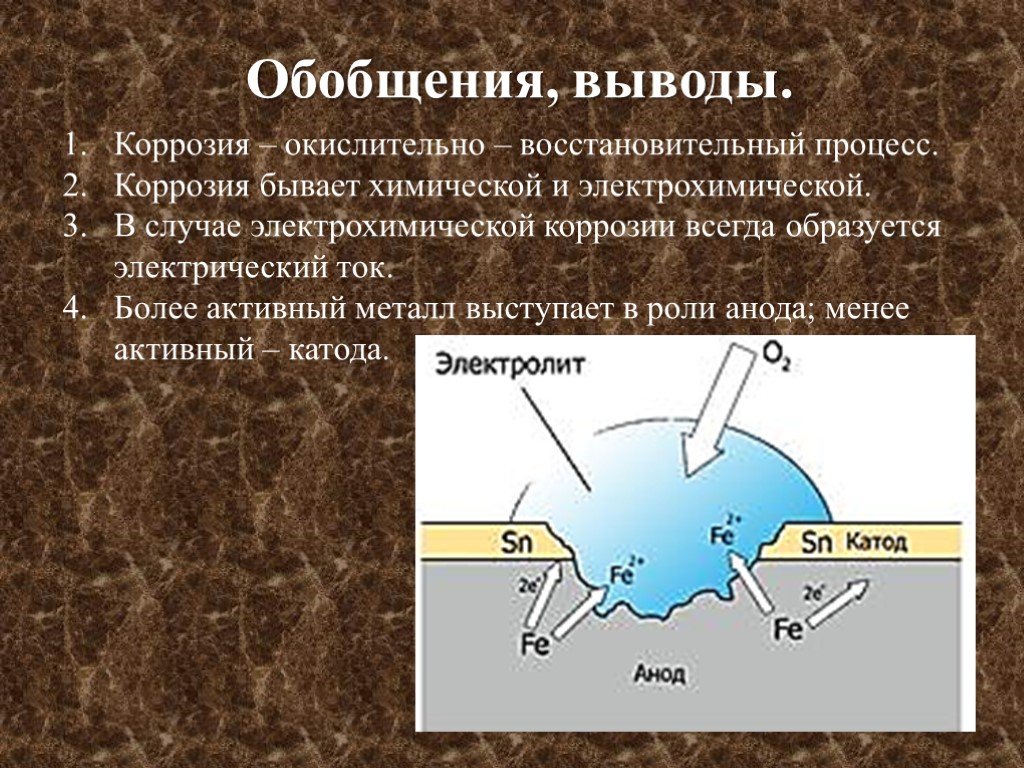 Иначе это можно представить, как вызванное протеканием тока падение напряжения между прианодным и прика-тодным слоями раствора, с учетом которого потенциал металла по отношению к прианодному слою оказывается более отрицательным, а по отношению к прикатодному — более положительным, чем по отношению к объему раствора.
Иначе это можно представить, как вызванное протеканием тока падение напряжения между прианодным и прика-тодным слоями раствора, с учетом которого потенциал металла по отношению к прианодному слою оказывается более отрицательным, а по отношению к прикатодному — более положительным, чем по отношению к объему раствора.

 nh3O
nh3O Поверхность железа внутри капли действует как анод для процесса
Поверхность железа внутри капли действует как анод для процесса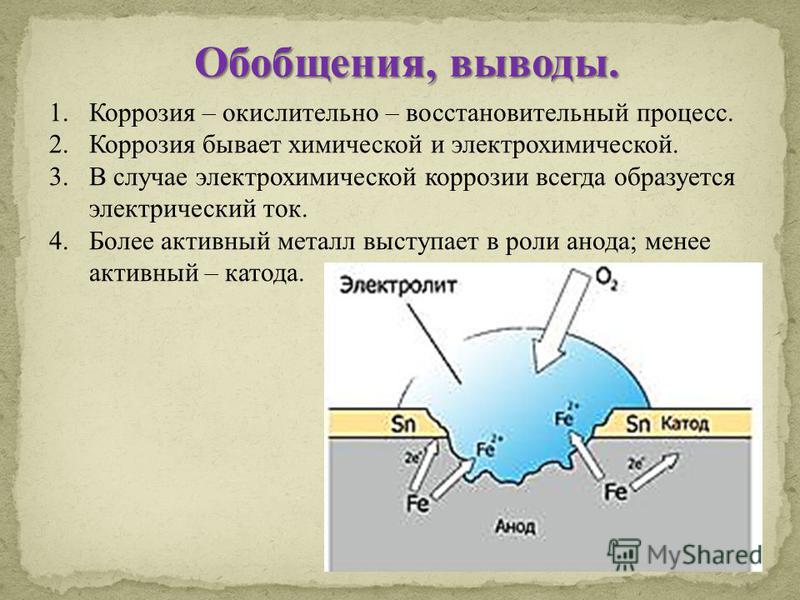 Однако другие электрохимические процессы могут обеспечить некоторую защиту от коррозии. Магниевые стержни можно использовать для защиты подземных стальных труб с помощью процесса, называемого катодной защитой.
Однако другие электрохимические процессы могут обеспечить некоторую защиту от коррозии. Магниевые стержни можно использовать для защиты подземных стальных труб с помощью процесса, называемого катодной защитой.