Характеристика медь: Электротехническая медь, основные характеристики
Содержание
Таблица характеристик меди
Медь входит в категорию металлов, встречающихся в природе в чистом самородном виде и в форме соединений. В промышленных масштабах ведется добыча медных руд – халькопирита CuFeS2, борнита Cu5FeS4 и халькозина Cu2S. Элемент медь относится к группе пластичных переходных металлов, отличается податливостью к литью и всем видам обработки. Широко применяется в машиностроении, электротехнике, приборостроении, радиоэлектронике.
Характеристики меди
Естественный цвет меди обладает золотисто-розовым оттенком, при взаимодействии с воздухом поверхность металла становится желто-красной. Характеризуется коррозийной стойкостью в сухих условиях, под воздействием влаги процесс окисления ускоряется.
Физико-химические свойства меди представлены в таблице.
|
Физические характеристики
| ||||
|
Параметр для анализа
|
Медь
| |||
|
Химическая формула
|
Cu
| |||
|
Нахождение в хим.
|
4 период, 11 группа, №29
| |||
|
ГОСТ
|
859-2014
| |||
|
Пояснение
|
Марки меди
| |||
|
Плотность меди, кг/м3
|
8920
| |||
|
Твердость по Бринеллю
|
45 (отожженная), 110 (нагартованная)
| |||
|
Температура литья, °С
|
1200
| |||
|
Температура плавления меди, °С
|
1083
| |||
|
Температура кипения, °С
|
2567
| |||
|
Температура рекристаллизации
|
200
| |||
|
Удельная теплоемкость, кДж/кг·K
|
37,5
| |||
|
Коэффициент теплопроводности при 100°С, кВт/(м·К)
|
39
| |||
|
Показатель температурного электрического сопротивления, T=20-100°С
|
4,3
| |||
|
Удельное сопротивление меди, Ом·мм²/м
|
0,026
| |||
|
Значение линейного теплового расширения, при t=20-200°С (10−6 К−1)
|
1,7
| |||
|
Показатель ударной вязкости, t = 20°С
|
630
| |||
|
Модуль упругости
|
120000
| |||
|
Параметр предела прочности
|
200
| |||
|
Значение предела текучести
|
70 (отожженная), 300 (нагартованная)
| |||
|
Величина относительного удлинения
|
50 (отожженная), 8 (нагартованная)
| |||
|
Коэффициент Пуассона
|
0,34
| |||
|
Химические свойства меди и соединений
| ||||
|
Осуществляемые реакции
|
Образуемое соединение
|
Особенности проведения
| ||
|
С простыми веществами:
С кислородом
С галогенами
С серой
С азотом
С кремнием
С углеродом
С водородом
|
оксиды меди CuО, Cu2О
галогениды CuCl2, CuBr2, 2CuI
сульфид меди CuS
—
—
—
—
|
Реагирует при нагреве
Реагирует при нагреве
Реагирует при нагреве
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
| ||
|
Со сложными соединениями:
С водой
С серной кислотой
С азотной кислотой
Со щелочами
С нитратом ртути
С оксидом азота
С солями железа (хлорид железа)
|
карбонат меди
сульфат меди, вода, оксид серы
нитрат меди, диоксид азота, вода
—
ртуть, нитрат меди
оксид меди, оксид азота (газ)
хлорид железа, хлорид меди
|
Окисление происходит в условиях влажности и при наличии оксида углерода
Взаимодействие происходит исключительно с концентрированным раствором при нагреве
В обычных условиях
НЕ РЕАГИРУЕТ
В обычных условиях
В обычных условиях
В обычных условиях
| ||
|
Реакции оксида меди:
С галогеноводородными кислотами
Растворение в азотной кислоте
Растворение в серной кислоте
С угарным газом
С водородом
С металлами большей активности (например, алюминием)
|
галогенид меди, вода
нитрат меди, оксид азота, вода
сульфат меди, оксид серы, вода
чистый металл, углекислый газ
чистое вещество, вода
чистое вещество, оксид алюминия
|
В обычных условиях
Концентрированная кислота
Концентрированная кислота
Окислительные свойства
Окислительные свойства
Окислительные свойства
| ||
|
Реакции гидроксида меди:
С кислотами
С раствором аммиака
Со щелочами
Разложение при нагреве
|
бромид меди, хлорид меди
гидроксид тетрааммиакат меди
комплексные соединения меди
оксид меди, вода
|
В обычных условиях
Легко реагирует, образуемое соединение обладает сине-фиолетовым оттенком
Реакция проводится исключительно с концентрированными растворами щелочей
| ||
|
Химические свойства солей меди
| ||||
|
Реакции
|
Образуемое вещество
|
Особенности проведения
| ||
|
Окисление:
азотной кислотой (на примере хлорида I)
кислородом (на примере хлорида I)
разложение нитрата II
разложение карбоната меди
|
нитрат меди, соляная кислота, оксид азота, вода
хлорид меди II, вода
оксид меди, оксид натрия, кислород
оксид меди, вода, углекислый газ
|
Реакция проходит при концентрированной кислоте
Требует соляной кислоты
Проходит при нагреве
Проходит при нагреве
| ||
|
Гидролиз солей элемента на примере сульфата и карбоната натрия
|
основной карбонат меди, сульфат натрия, углекислый газ
|
Выполняется по катиону слабого основания, аниону слабой кислоты
| ||
В основном состоянии атом меди подразумевает ядро с положительным зарядом, вокруг наблюдается движение 29 электронов, из них один – в наружном слое. Электронное строение схоже со структурой атомов щелочных металлов, но радиусы атомов и ионов меди существенно меньше. Этим объясняется более высокая плотность, вследствие чего металл характеризуется высокой температурой плавления. Молярная масса элемента совпадает с атомной, составляющей 63,54 г/моль.
Электронное строение схоже со структурой атомов щелочных металлов, но радиусы атомов и ионов меди существенно меньше. Этим объясняется более высокая плотность, вследствие чего металл характеризуется высокой температурой плавления. Молярная масса элемента совпадает с атомной, составляющей 63,54 г/моль.
Наиболее ценные для применения свойства меди:
- мягкость и пластичность, обуславливающие хорошую податливость в обработке и вытяжке;
- высокие показатели теплопроводности и электропроводимости;
- коррозийная устойчивость;
- невосприимчивость к ультрафиолетовому излучению, перепадам температур, химическим воздействиям;
- эстетичность поверхности.
Свариваемость металлопроката характеризуется составом меди. При высоком содержании в сплавах фосфорных, серных свинцовых примесей процесс сварки сопровождается трудностями. Подверженность металла окислению обуславливает образование хрупких швов и трещин. Сварку выполняют с использованием флюсовой либо газовой защиты и применением присадочных материалов с раскислителями.
Получение меди
В промышленных масштабах медь получают из руд – медного блеска и колчедана. Добыча чистого металла осуществляется пирометаллургическим и гидрометаллургическим способами. При пирометаллургической технологии применяются процессы обогащения с обжигом, плавки на штейн, конвертерной продувки. Гидрометаллургическая технология предусматривает выщелачивание металла с помощью слабой серной кислоты и последующим выделением из раствора чистой меди.
Востребованным сырьем в производстве выступает вторичный металл. Сплавы меди с оловом, цинком, алюминием, титаном, никелем присутствуют во многих бытовых и промышленных изделиях.
Источники лома меди:
- обмотка двигателей;
- ламповые телевизоры;
- компрессионные холодильники;
- кабели проводки;
- трансформаторы;
- вышедшие из эксплуатации автомобили, вагоны, суда.
Медные сплавы классифицируют на латунь, подразумевающую соединения меди с цинком, и бронзу, в составе которой присутствуют прочие химические элементы. В процессе переработки лома выполняется сортировка и очистка вещества от примесей.
В процессе переработки лома выполняется сортировка и очистка вещества от примесей.
Применение
Металл высоко востребован электротехнической отраслью, низкое удельное сопротивление обуславливает популярность медных силовых кабелей и комплектующих для трансформаторов. Показатели теплопроводности элемента позволяют применять его в производстве теплового оборудования – систем отопления, теплообменников, кондиционеров. Сплавы металла с золотом пользуются популярностью в ювелирном деле.
Экологичные свойства меди широко применяются в строительстве. Устойчивый к коррозии металл служит сырьем в производстве кровельных материалов, дверной фурнитуры, перил. Биологическая активность элемента объясняет использование меди в производстве минеральных удобрений. Вещество входит в состав медицинских препаратов, выступая компонентом антисептических глазных и противоожоговых растворов.
Общая характеристика и классификация медных сплавов
Для повышения прочностных свойств
медь легируют цинком, оловом, алюминием,
марганцем, железом, кремнием, никелем.
Повышая прочность медных сплавов,
легирующие элементы практически не
снижают, а некоторые из них (цинк,
алюминий) увеличивают пластичность.
Высокая пластичность – отличительная
особенность медных сплавов. По прочности
медные сплавы уступают сталям. Сплавы
меди устойчивы против коррозии, обладают
хорошими антифрикционными, технологическими
и механическими свойствами и широко
используются в качестве конструкционных
материалов.
По технологическим свойствам медные
сплавы подразделяют на деформируемые
(обрабатываемые давлением) и литейные.
Из деформируемых медных сплавов
изготавливают трубы, листы, ленту,
проволоку, из литейных путем литья
различные фасонные детали.
По способности упрочняться с помощью
термической обработки медные сплавы
делятся на упрочняемые и неупрочняемые
термической обработкой.
По химическому составу медные сплавы
подразделяют на две основные группы:
латуни и бронзы.
Медные сплавы маркируют по химическому
составу, используя буквы для обозначения
элементов и числа для указания их
массовых долей. В медных сплавах буквенные
В медных сплавах буквенные
обозначения отличаются от обозначений,
принятых для сталей. Алюминий в них
обозначают буквой А, бериллий – Б, железо
– Ж, кремний – К, магний – Мг, марганец
– Мц, медь – М, мышьяк – Мш, никель –
Н, олово – О, свинец – С, серебро – Ср,
сурьма – Су, фосфор – Ф, цинк – Ц, цирконий
– Цр, хром – Х.
Латуни
Латунями называют сплавы меди с
цинком, а иногда с добавками небольшого
количества других элементов. Из цветных
сплавов латуни являются самыми
распространенными.
По назначению и технологическим признакам
латуни подразделяются на деформируемые
и литейные.
Латуни маркируются буквой Л.
В деформируемых латунях, не содержащих
кроме меди и цинка других элементов, за
буквой Л ставиться
число, показывающее среднее содержание
меди. В многокомпонентных латунях после
Л ставятся буквы –
символы элементов, а затем числа,
указывающие содержание меди и каждого
легирующего элемента. Например, латунь
Например, латунь
марки Л68 содержит 68% меди, остальное
цинк. Латунь ЛЖМц 59-1-1 содержит 59% меди,
1% железа, 1% марганца, остальное – цинк.
В марках литейных латуней указывается
содержание цинка, а количество каждого
легирующего элемента ставиться
непосредственно за буквой, обозначающей
его. Например, латунь ЛЦ40Мц3А содержит
40% цинка, 3% марганца, 1% алюминия, остальное
– медь.
Цвет (от красноватого до светло-желтого)
и механические свойства латуни изменяются
при увеличении содержания в них цинка.
Структура латуней зависит от их
состава и может быть установлена по
известной диаграмме состояния системы
медь – цинк (Cu
— Zn). В системе
Cu – Zn
образуется шесть твердых растворов: α,
β, γ, δ, σ, η, но практическое применение
имеют латуни, содержащие до 45% цинка.
Левая часть диаграммы состояния Cu
– Zn, включающая
область однофазных (α) и двухфазных (α
+ β) латуней, приведена на рис. 45.
45.
Однофазная α–латунь представляет
собой твердый раствор цинка в меди с
решеткой ГЦК и может содержать до 39%
цинка. Однофазная α–латунь характеризуется
высокой пластичностью. При содержании
более 39% цинка в структуре появляется
хрупкая β-фаза. β-фаза – это электронное
соединение CuZn
с решеткой ОЦК.
Рис.45.
Левая часть диаграммы состояния Cu-Zn
Рис.46.
Влияние
цинка на
механические
свойства латуней
Существует две модификации β-фазы:
выше 454…486°С устойчива пластичная
β-фаза, имеющая неупорядоченное
расположение атомов. Ниже этих температур
– более твердая и хрупкая β´-фаза,
которая характеризуется упорядоченным
расположением атомов меди и атомов
цинка.
Двухфазные (α + β´)–латуни могут
содержать до 45% цинка.
В соответствии с изменением структуры
меняются механические свойства латуней.
Влияние цинка на механические свойства
латуней приведены на рис. 46.
β´-фаза появляется в структуре латуней
при содержании цинка около 30%. Поэтому
в сплавах, содержащих менее 30% цинка,
увеличение его концентрации повышает
и прочность, и пластичность. Затем
пластичность начинает уменьшаться, а
после появления в структуре значительных
качеств β´-фазы происходит резкое
падение пластичности. Прочность
продолжает повышаться при увеличении
цинка до 45%, пока латунь находиться в
двухфазном состоянии, а потом также
резко снижается. Сплавы с большим
содержанием цинка отличаются высокой
хрупкостью.
Химический состав некоторых
промышленных латуней (ГОСТ 15527-70, ГОСТ
1774-93) и их механические свойства приведены
в табл. 14, 15.
Латуни обычно хорошо обрабатываются
давлением. Наибольшую пластичность
имеют однофазные α–латуни (содержание
цинка до 39%) и они хорошо поддаются
холодной пластической деформации,
которая значительно повышает их прочность
и твердость.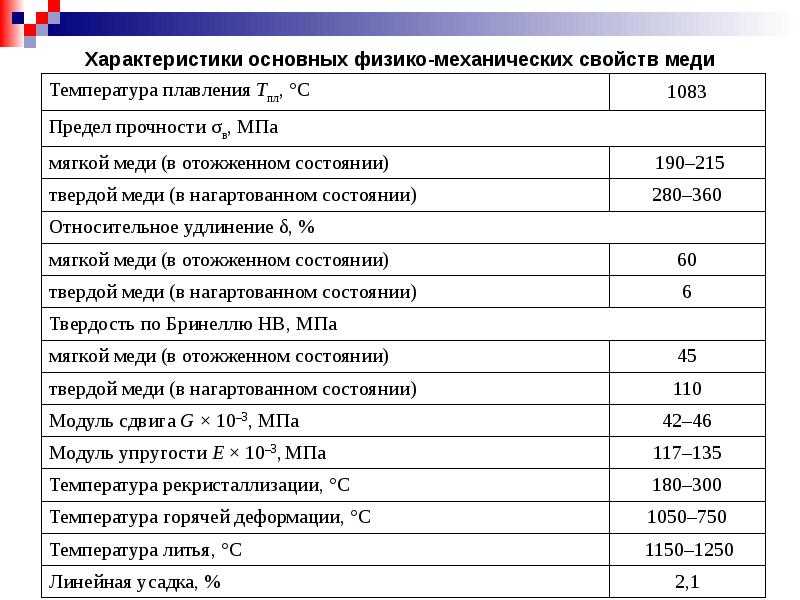
В двухфазных α + β´–латунях пластичность
резко снижена, поэтому они удовлетворительно
деформируются в горячем состоянии.
Обычно их деформируют при температуре
несколько выше 700°С.
Повышение содержания цинка удешевляет
латуни, улучшает их обрабатываемость
резанием, способность прирабатываться
и противостоять износу. Вместе с тем
уменьшаются теплопроводность и
электрическая проводимость, которые
составляют 20-50% от характеристик меди.
Примеси повышают твердость и снижают
пластичность латуней. Особенно
неблагоприятно действуют свинец и
висмут, которые в однофазных латунях
вызывают красноломкость. Поэтому
однофазные латуни в основном выпускают
в виде холоднокатаных полуфабрикатов:
полос, лент, проволоки, листов, из которых
изготовляют детали методом глубокой
вытяжки (радиаторные трубки, снарядные
гильзы, сильфоны, трубопроводы), а
также детали, требующие по условиям
эксплуатации низкую твердость (шайбы,
втулки, уплотнительные кольца и др.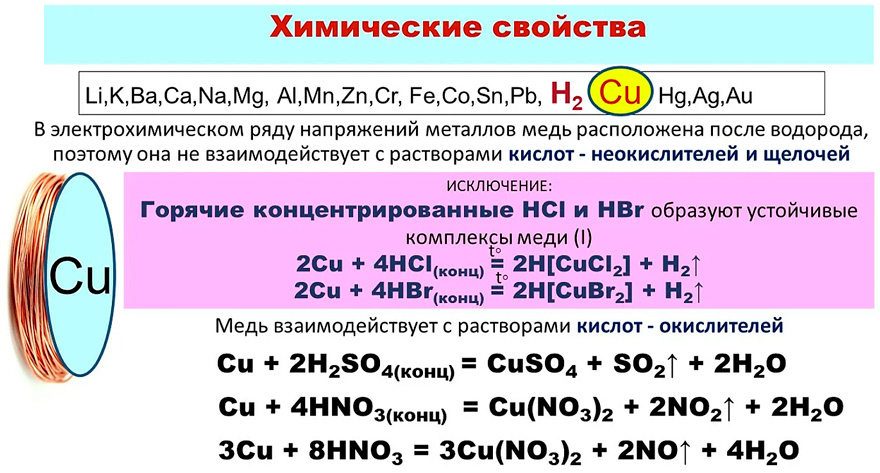 ).
).
В двухфазные латуни иногда добавляют
свинец для улучшения обрабатываемости
резанием и повышения антифрикционных
свойств.
В виду невысокой пластичности эти латуни
выпускают в виде горячекатаного
полуфабриката: листов, прутков, труб,
штамповок. Из них изготовляют втулки,
гайки, тройники, штуцеры, токопроводящие
детали электрооборудования и др.
Бронзы
Двойные или многокомпонентные сплавы
меди с оловом, алюминием, свинцом,
бериллием, кремнием, хромом и другими
элементами, среди которых цинк не
является основным легирующим, называются
бронзами.
Бронзы обозначаются
буквами Бр, за которыми ставятся буквы
и числа. В маркировках деформируемых
бронз сначала помещают буквы – символы
легирующих элементов, а затем числа,
указывающие их содержание. Например,
БрАЖ9-4 содержит 9% алюминия, 4% железа,
остальное – медь. В марках литейных
бронз после каждой буквы указывается
содержание этого легирующего элемента.
Например, БрО6Ц6С3 содержит 6% олова, 6%
цинка, 3% свинца, остальное – медь.
В зависимости от легирующего элемента
бронзы могут быть оловянистыми,
алюминиевыми, бериллиевыми, кремнистыми,
марганцовистыми, свинцовистыми и др.
Наиболее широкое распространение
получили четыре первых вида бронз.
Используют также многокомпонентные
бронзы.
Оловянные
бронзы.В
практике применяют сплавы, содержание
олова в которых не превышает обычно
10-12%, так как при более высоком их
содержании бронзы хрупки. В отличие от
латуней оловянистые бронзы склонны к
ликвации, в их микроструктуре можно
отчетливо видеть дендриты выделяющихся
соединений. Эти бронзы характеризуются
пониженной жидкотекучестью, поэтому в
них не образуются усадочные раковины,
но возникает мелкая пористость,
распределенная по объему. Это позволяет
получать отливки сложной формы без
усадочных раковин. Пластичность литых
бронз – низкая. Двойные оловянные бронзы
Двойные оловянные бронзы
применяют редко, так как они дороги. По
коррозионной стойкости в морской воде
оловянистые бронзы превосходят медь и
латунь. Их легируют цинком (Zn),
железом (Fe),
фосфором (P),
никелем (Ni),
свинцом (Pb).
Бронзы хорошо обрабатываются резанием,
паяются, хуже свариваются.
Среди медных сплавов оловянные бронзы
имеют самую низкую
Характеристики меди и реакция металла с азотной кислотой
Похоже, вы зашли на наш сайт из
Германия .
Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Стабильный металл Vs. Сильный окислитель
[Депозитные фотографии]
Медь — один из старейших известных металлов, который использовался людьми с древних времен. На латыни медь известна как cuprum, а ее атомный номер — 29. В периодической таблице Менделеева медь расположена в четвертом периоде, в первой группе.
На латыни медь известна как cuprum, а ее атомный номер — 29. В периодической таблице Менделеева медь расположена в четвертом периоде, в первой группе.
Физические и химические свойства меди
Встречающаяся в природе медь представляет собой тяжелый металл розово-красного цвета с пластичной и мягкой структурой. Температура кипения составляет более 1000 градусов по Цельсию. Купрум является хорошим проводником электричества и тепла и плавится при температуре 1084 градусов по Цельсию. Плотность металла 8,9.г/см3, а в природе встречается в основном виде.
Согласно электронной формуле атома меди он имеет 4 уровня. На 4-s валентной орбитали находится один электрон. При химическом взаимодействии с другими веществами от атома отщепляется от одной до трех отрицательно заряженных частиц (электронов), в результате чего образуются соединения меди со степенью окисления +3, +2, +1. Максимальную стабильность проявляют двухвалентные производные меди.
[Депозитные фотографии]
Медь — вещество с низкой способностью к взаимодействию. Различают две основные степени окисления металла, проявляющиеся в соединениях: +1 и +2. Вещества, у которых эти значения изменяются до +3, встречаются редко. Медь взаимодействует с углекислым газом, воздухом, соляной кислотой и другими соединениями при очень высоких температурах. На поверхности металла образуется защитная оксидная пленка. Этот металл защищает медь от дальнейшего окисления, делает ее стабильной и придает металлу низкую активность.
Различают две основные степени окисления металла, проявляющиеся в соединениях: +1 и +2. Вещества, у которых эти значения изменяются до +3, встречаются редко. Медь взаимодействует с углекислым газом, воздухом, соляной кислотой и другими соединениями при очень высоких температурах. На поверхности металла образуется защитная оксидная пленка. Этот металл защищает медь от дальнейшего окисления, делает ее стабильной и придает металлу низкую активность.
Металл взаимодействует с простыми веществами – галогенами, селеном, серой. Металл способен образовывать двойные соли или комплексные соединения. Ядовиты почти все комплексные соединения этого элемента, кроме оксидов. Вещества, образованные одновалентной медью, легко окисляются до двухвалентных эквивалентов.
В химических реакциях медь выступает как малоактивный металл. Металл не растворяется в воде в обычных условиях. В сухом воздухе металл не подвергается коррозии, но при нагревании поверхность меди покрывается черным налетом окиси. Химическая стабильность элемента проявляется в его стойкости к воздействию углерода, сухих газов, ряда органических соединений, спиртов и фенольных смол. Для меди характерны сложные реакции, при которых выделяются окрашенные соединения. Медь имеет сходство с металлами щелочной группы, так как образует одновалентные производные.
Химическая стабильность элемента проявляется в его стойкости к воздействию углерода, сухих газов, ряда органических соединений, спиртов и фенольных смол. Для меди характерны сложные реакции, при которых выделяются окрашенные соединения. Медь имеет сходство с металлами щелочной группы, так как образует одновалентные производные.
Медь — реакция с азотной кислотой
Медь растворяется в азотной кислоте. Эта реакция происходит потому, что металл окисляется сильным реагентом.
Молекула азотной кислоты
[Депозитные фотографии]
Азотная кислота (разбавленная и концентрированная) проявляет окислительные свойства, с растворением меди. При реакции металла с разбавленной кислотой образуются нитрат меди и двухвалентный оксид азота в соотношении 75% и 25%. Уравнение реакции
8HNO₃ + 3Cu → 3Cu(NO3)₂ + 2NO + 4H₂O
В процессе реакции принимают участие 1 моль меди и 3 моля концентрированной азотной кислоты. При растворении меди раствор сильно нагревается, происходит термический распад окислителя и выделяется дополнительное количество оксида азота. Уравнение реакции
При растворении меди раствор сильно нагревается, происходит термический распад окислителя и выделяется дополнительное количество оксида азота. Уравнение реакции
4HNO₃ + Cu → Cu(NO3) + 2NO₂ + 2H₂O
Этот способ растворения меди имеет свои недостатки – при реакции меди с азотной кислотой выделяется большое количество оксида азота. Для улавливания или нейтрализации оксида азота требуется специальное оборудование, поэтому этот процесс слишком дорог. Растворение меди в азотной кислоте считается завершенным, когда перестают образовываться летучие оксиды азота. Температура реакции составляет от 60 до 70 градусов Цельсия. Следующий этап – слив раствора из химического реактора. На дне реактора остаются куски меди, не вступившие в реакцию. В полученную жидкость добавляют воду, и ее фильтруют. Нажмите здесь, чтобы узнать о свойствах меди во взаимодействии с другими веществами.
Реакция азотной кислоты и меди, проиллюстрированная экспериментом
Всю реакцию азотной кислоты и меди можно проследить с помощью опыта: поместите кусок меди в концентрированную азотную кислоту. Выделяется коричневый газ – сначала медленно, затем интенсивнее. Раствор становится зеленым. Если в процессе реакции добавить много меди, раствор постепенно станет синим. Реакция меди с азотной кислотой протекает с выделением тепла и ядовитого газа, имеющего едкий запах.
Выделяется коричневый газ – сначала медленно, затем интенсивнее. Раствор становится зеленым. Если в процессе реакции добавить много меди, раствор постепенно станет синим. Реакция меди с азотной кислотой протекает с выделением тепла и ядовитого газа, имеющего едкий запах.
Реакция меди и концентрированной азотной кислоты является окислительно-восстановительной реакцией. Восстановитель – металл, окислитель – азотная кислота. Уравнение реакции
Cu + 4HNO₃ = Cu(NO3)₂ + 2NO₂↑ + 2H₂O
Реакция экзотермическая, поэтому при самопроизвольном нагревании смеси она ускоряется.
Реакция меди с азотной кислотой начинается при комнатной температуре. Металл покрывается пузырьками, которые начинают подниматься на поверхность и наполняют пробирку коричневым газом – NO₂ (ядовитый ядовитый диоксид азота с едким запахом). Этот газ в 1,5 раза тяжелее воздуха.
Реакция меди с азотной кислотой протекает в две стадии: на первой стадии кислота окисляет медь до оксида меди с выделением диоксида азота; на второй стадии оксид меди реагирует с новыми порциями кислоты, образуя нитрат меди Cu(NO₃)₂. Смесь нагревается, и реакция ускоряется.
Смесь нагревается, и реакция ускоряется.
Образец тригидрата нитрата меди(II)
[Википедия]
В результате металл растворяется, и образуется раствор нитрата меди. Нитрат меди придает раствору зеленый или синий цвет (это будет зависеть от количества используемой воды).
У нас есть еще статьи по химии для вас:
- Делаем купол из… воды!
Что такое поверхностное натяжение и почему счетчики воды не тонут? - Что такое комбуча?
Как вырастить комбучу в домашних условиях
Вы можете провести десятки химических опытов дома!
Почему такой синий?
Узнать больше
Попробуй
Использование, изображения, характеристики, свойства, периодическая таблица
Главная | Продать предложения | Купить предложения | Поиск структуры | Поставщик меди
29
медь
63,546
Медь
Медь
Общие | Штаты |
энергии | Окисление и электроны
| Внешний вид и характеристики |
Реакции | Соединения |
Радиус | проводимость | Изобилие и изотопы
Медь Общий
| Название: Медь | Символ: медь |
| Тип: переходный металл | Атомный вес: 63,546 |
| Плотность при 293 К: 8,96 г/см 3 | Атомный объем: 7,1 см 3 /моль |
| Обнаруженный: Медь известна с древних времен и используется людьми более десяти тысяч лет. | |
Медные штаты
| Состояние (т, л, ж): твердое | |
| Температура плавления: 1357,77 К (1084,62 ° С) | Температура кипения: 2833 К (2560 °С) |
Медные Энергии
| Удельная теплоемкость: 0,38 Дж·г -1 К -1 | Теплота атомизации: 338 кДж моль -1 |
| Теплота плавления: 13,050 кДж моль -1 | Теплота парообразования: 300,30 кДж моль -1 |
| 1 st энергия ионизации: 745,4 кДж моль -1 | 2 nd энергия ионизации: 1957,9 кДж моль -1 |
| 3 rd энергия ионизации: 3553,5 кДж моль -1 | Сродство к электрону: 118,5 кДж моль -1 |
Окисление меди и электроны
| Снаряды: 2,8,18,1 | Электронная конфигурация: [Ar] 3d 10 4s 1 |
| Минимальная степень окисления: 0 | Максимальная степень окисления: 4 |
Мин. общий номер окисления: 0 общий номер окисления: 0 | Макс. общее окисление №: 2 |
| Электроотрицательность (шкала Полинга): 1,95 | Объем поляризуемости: 6,7 Å 3 |
Внешний вид и характеристики меди
| Структура: ГЦК: гранецентрированная кубическая | Цвет:оранжево-красный |
| Твердость: 3,0 мооса | |
| Вредное воздействие: Медь необходима всем растениям и животным. Приготовление кислой пищи в медных кастрюлях может вызвать отравление. Медная посуда должна быть облицована для предотвращения попадания внутрь ядовитой зелени (соединений, образующихся при коррозии меди). | |
Характеристики: Медь — красновато-оранжевый мягкий металл с ярким металлическим блеском. Он податлив, пластичен и является отличным проводником тепла и электричества — только серебро имеет более высокую электропроводность, чем медь. Медные поверхности, подвергающиеся воздействию воздуха, постепенно тускнеют и приобретают тусклый коричневатый цвет. При наличии воды и воздуха медь будет медленно разъедать, образуя карбонатную медь, часто встречающуюся на крышах и статуях. Использование: Благодаря своей превосходной электропроводности медь чаще всего используется в электрическом оборудовании, таком как проводка и двигатели. Из-за медленной коррозии медь используется в кровельных работах, водосточных желобах и в качестве водосточных желобов на зданиях. Также используется в сантехнике, посуде и кухонной утвари. Коммерчески важные сплавы, такие как латунь и бронза, производятся из меди и других металлов. Оружейные металлы и американские монеты представляют собой медные сплавы. Сульфат меди используется в качестве фунгицида и альгицида в реках, озерах и прудах. Оксид меди в растворе Фелинга широко используется в тестах на наличие моносахаридов (простых сахаров). | |
Медные реакции
| Реакция с воздухом: мягкая, вес/вт ⇒ CuO, Cu 2 O | Реакция с 6 М HCl: нет |
| Реакция с 15 М HNO 3 : мягкая, ⇒ Cu(NO 3 ) 2 , № x | Реакция с 6 М NaOH: |
Соединения меди
| Оксид(ы):CuO, Cu 2 O (куприт) | Хлориды: CuCl, CuCl 2 |
| Гидрид (ы): CuH |
Медный радиус
| Атомный радиус: 135 пм | Ионный радиус (1+ ион): 91 пм |
| Ионный радиус (ион 2+): 87 пм | Ионный радиус (3+ ион): 68 пм |
| Ионный радиус (2-ион): пм | Ионный радиус (1-ион): пм |
Проводимость меди
| Теплопроводность: 401 Вт·м -1 К -1 | Электропроводность: 60,7 x 10 6 См м -1 |
Содержание меди и изотопы
Изобилие земной коры: 60 частей на миллион по массе, 19 частей на миллион по молям. | |
| Изобилие солнечной системы: 700 частей на миллиард по весу, 10 частей на миллиард по молям. | |
| Стоимость в чистом виде: $9,76 за 100 г. | |
| Стоимость, оптом: 0,66$ за 100г | |
| Источник: Медь иногда встречается в самородном виде (т. е. в виде несвязанного металла), а также содержится во многих минералах, таких как оксид; куприт (Cu 2 O), карбонаты; малахит (Cu 2 CO 3 (OH) 2 ) и азурит (Cu 2 (CO 3 ) 2 (OH) 2 ) и сульфиды; халькопирит (CuFeS 2 ) и борнит (Cu 5 FeS 4 ). | |

 таблице Менделеева
таблице Менделеева Медный век находится между неотильским (каменным) и бронзовым веками. Медный век происходил в разное время в разных культурах, когда люди начали использовать медные орудия наряду с каменными. Слово «медь» происходит от латинского слова «cuprum», означающего «кипрский металл». Средиземноморский остров Кипр был древним источником добычи меди.
Медный век находится между неотильским (каменным) и бронзовым веками. Медный век происходил в разное время в разных культурах, когда люди начали использовать медные орудия наряду с каменными. Слово «медь» происходит от латинского слова «cuprum», означающего «кипрский металл». Средиземноморский остров Кипр был древним источником добычи меди. Однако избыток меди токсичен.
Однако избыток меди токсичен.
