Электроотрицательность меди: Таблица электроотрицательности химических элементов с примерами ряда
Содержание
Таблица электроотрицательности химических элементов с примерами ряда
4.6
Средняя оценка: 4.6
Всего получено оценок: 404.
4.6
Средняя оценка: 4.6
Всего получено оценок: 404.
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.
Чем выше электроотрицательность, тем сильнее свойства окислителя.
Рис. 1. Действия окислителя и восстановителя в реакциях.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента | Элемент | Символ | Электроотрицательность |
87 | Франций | Fr | 0,79 |
55 | Цезий | Cs | 0,79 |
19 | Калий | K | 0,82 |
37 | Рубидий | Rb | 0,82 |
56 | Барий | Ba | 0,89 |
88 | Радий | Ra | 0,9 |
11 | Натрий | Na | 0,93 |
38 | Стронций | Sr | 0,95 |
3 | Литий | Li | 0,98 |
20 | Кальций | Ca | 1,0 |
57 | Лантан | La | 1,1 |
89 | Актиний | Ac | 1,1 |
70 | Иттербий | Yb | 1,1 |
58 | Церий | Ce | 1,12 |
59 | Празеодим | Pr | 1,13 |
61 | Прометей | Pm | 1,13 |
95 | Америций | Am | 1,13 |
60 | Неодим | Nd | 1,14 |
62 | Самарий | Sm | 1,17 |
64 | Гадолиний | Gd | 1,2 |
66 | Диспрозий | Dy | 1,22 |
39 | Иттрий | Y | 1,22 |
68 | Эрбий | Er | 1,24 |
69 | Тулий | Tm | 1,25 |
71 | Лютеций | Lu | 1,27 |
96 | Кюрий | Cm | 1,28 |
94 | Плутоний | Pu | 1,28 |
90 | Торий | Th | 1,3 |
97 | Берклий | Bk | 1,3 |
98 | Калифорний | Cf | 1,3 |
99 | Эйнштейний | Es | 1,3 |
100 | Фермий | Fm | 1,3 |
101 | Менделевий | Md | 1,3 |
102 | Нобелий | No | 1,3 |
12 | Магний | Mg | 1,31 |
40 | Цирконий | Zr | 1,33 |
93 | Нептуний | Np | 1,36 |
21 | Скандий | Sc | 1,36 |
92 | Уран | U | 1,38 |
73 | Тантал | Ta | 1,5 |
91 | Протактиний | Pa | 1,5 |
22 | Титан | Ti | 1,54 |
25 | Марганец | Mn | 1,55 |
4 | Бериллий | Be | 1,57 |
41 | Ниобий | Nb | 1,6 |
13 | Алюминий | Al | 1,61 |
81 | Талий | Tl | 1,62 |
30 | Цинк | Zn | 1,65 |
23 | Ванадий | V | 1,63 |
24 | Хром | Cr | 1,66 |
48 | Кадмий | Cd | 1,69 |
49 | Индий | In | 1,78 |
31 | Галлий | Ga | 1,81 |
26 | Железо | Fe | 1,83 |
82 | Свинец | Pb | 1,87 |
27 | Кобальт | Co | 1,88 |
29 | Медь | Cu | 1,9 |
75 | Рений | Re | 1,9 |
14 | Кремний | Si | 1,9 |
43 | Технеций | Tc | 1,9 |
28 | Никель | Ni | 1,91 |
47 | Серебро | Ag | 1,93 |
50 | Олово | Sn | 1,96 |
80 | Ртуть | Hg | 2 |
84 | Полоний | Po | 2 |
83 | Висмут | Bi | 2,02 |
5 | Бор | B | 2,04 |
51 | Сурьма | Sb | 2,05 |
42 | Молибден | Mo | 2,16 |
33 | Мышьяк | As | 2,18 |
15 | Фосфор | P | 2,19 |
1 | Водород | H | 2,2 |
77 | Иридий | Ir | 2,2 |
86 | Радон | Rn | 2,2 |
85 | Астат | At | 2,2 |
44 | Рутений | Ru | 2,2 |
46 | Палладий | Pd | 2,2 |
76 | Осмий | Os | 2,2 |
78 | Платина | Pt | 2,28 |
45 | Родий | Rh | 2,28 |
74 | Вольфрам | W | 2,36 |
79 | Золото | Au | 2,54 |
6 | Углерод | C | 2,55 |
34 | Селен | Se | 2,55 |
16 | Сера | S | 2,58 |
54 | Ксенон | Xe | 2,6 |
53 | Йод | I | 2,66 |
36 | Криптон | Kr | 2,96 |
7 | Азот | N | 3,04 |
17 | Хлор | Cl | 3,16 |
8 | Кислород | O | 3,44 |
9 | Фтор | F | 3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства.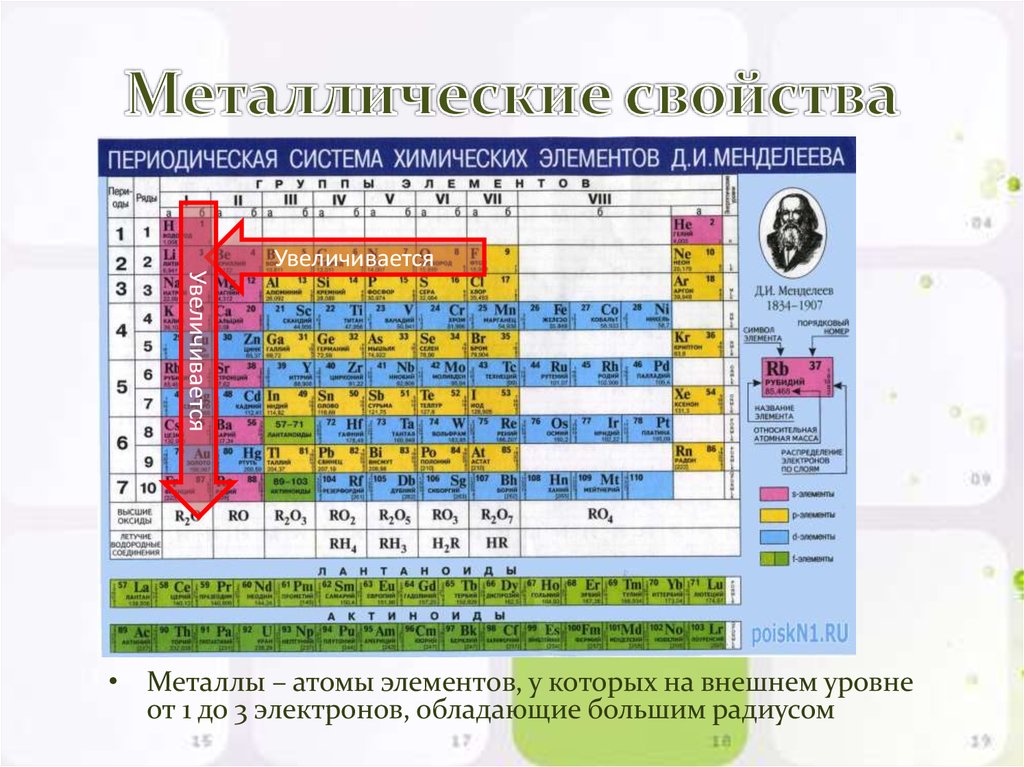 Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.
Рис. 2. Ряд электроотрицательности.
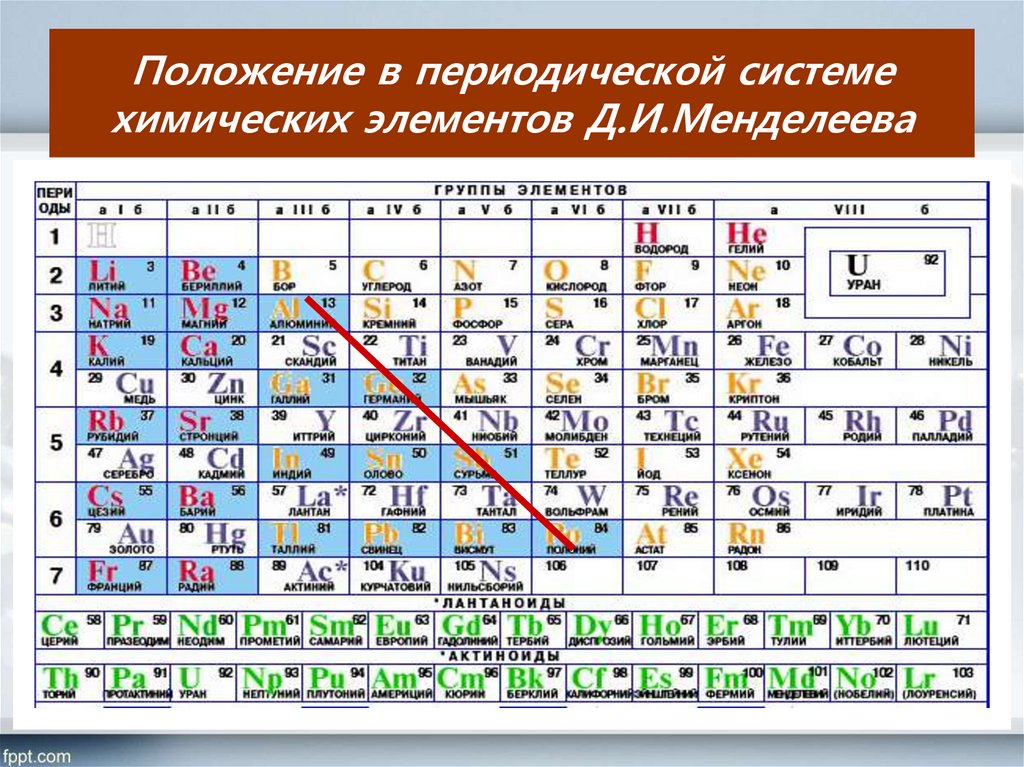
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Рис. 3. Таблица Менделеева.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 404.
А какая ваша оценка?
Новая шкала электроотрицательностей изменила представление о химии высоких давлений
Сколтех
Открытие российских и китайских ученых поможет понять, что происходит на других планетах и в недрах Земли.
Новая шкала электроотрицательностей, которую создали исследователи из «Сколтеха» и их китайские коллеги, перевернула химию высоких давлений.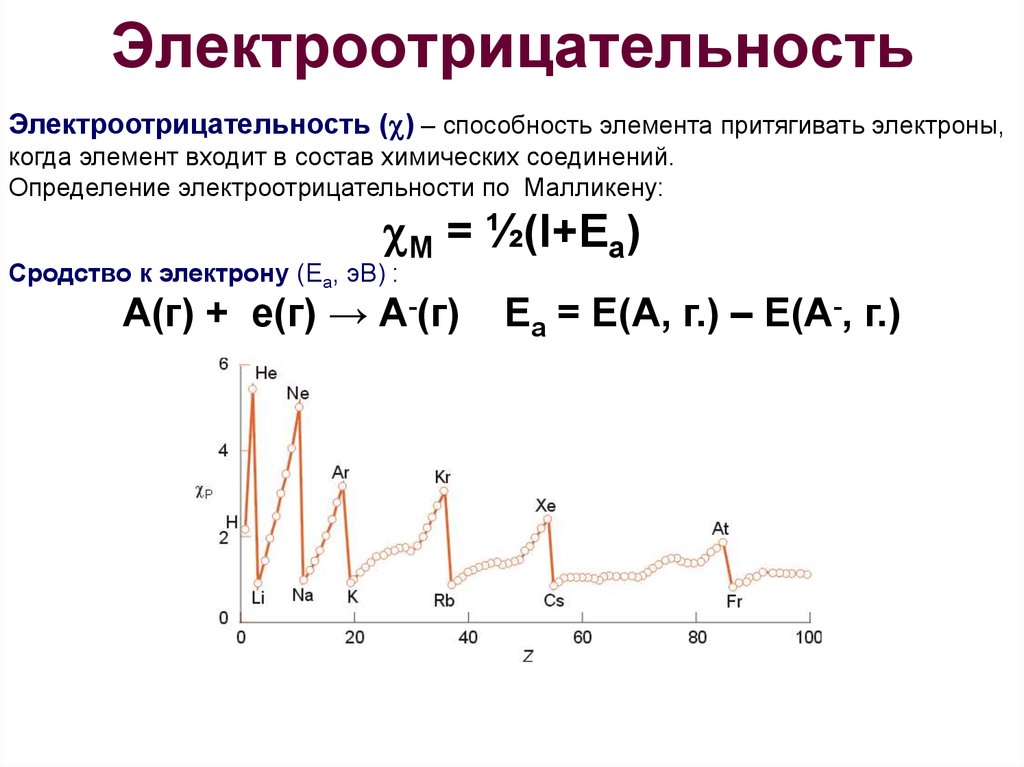 Ученые пересмотрели ключевое понятие химии — электроотрицательность. Они определили эту величину для всех элементов при различном давлении. У них также получилось объяснить множество химических аномалий, которые происходят в условиях, отличных от атмосферных.
Ученые пересмотрели ключевое понятие химии — электроотрицательность. Они определили эту величину для всех элементов при различном давлении. У них также получилось объяснить множество химических аномалий, которые происходят в условиях, отличных от атмосферных.
Исследование опубликовано в престижном журнале Proceedings of the National Academy of Sciences of the USA, кратко о результатах работы сообщили в пресс-службе «Сколтеха».
Электроотрицательность — фундаментальное свойство элементов, оно во многом определяет, как и в какие реакции вступают атомы.
«Если бросить в стакан воды кусок медной проволоки, то ничего интересного не произойдет. Если же в воду бросить кусок натрия, то сразу начнется бурная реакция, в результате которой выделится столько теплоты, что натрий расплавится. Все дело в том, что у натрия очень низкая электроотрицательность: он энергично отдает электроны другим атомам», — комментирует соавтор исследования, профессор «Сколтеха» Артем Оганов.
Электроотрицательность, возможно, самое важное для химии свойство атома. Если атом легко отдает свои электроны, электроотрицательность низкая, и наоборот. Эта величина обретает смысл в сравнении: чем сильнее она отличается у двух элементов, тем более бурно реагируют их атомы. Например, фтор и цезий — чемпионы с самой высокой и самой низкой электроотрицательностью соответственно. Их реакционная способность столь велика, что в природе ни тот ни другой в чистом виде не встречается.
Если атом легко отдает свои электроны, электроотрицательность низкая, и наоборот. Эта величина обретает смысл в сравнении: чем сильнее она отличается у двух элементов, тем более бурно реагируют их атомы. Например, фтор и цезий — чемпионы с самой высокой и самой низкой электроотрицательностью соответственно. Их реакционная способность столь велика, что в природе ни тот ни другой в чистом виде не встречается.
Электроотрицательность атомов дает хорошее представление о том, что с чем реагирует и какие типы химической связи и свойства у получающихся в результате соединений. Но все это — при обычных условиях.
«Мы очень много знаем про поведение вещества при атмосферном давлении, но ведь это, в сущности, нетипичная ситуация, — объясняет Оганов. — Большая часть вещества Земли и других планет находится под колоссальным давлением. В центре Земли, например, оно почти в 4 млн раз выше атмосферного».
Когда поведение вещества под такими давлениями научились воспроизводить в лабораториях и моделировать на компьютере, ученые стали открывать экзотические явления, которые противоречат классическим представлениям. Кстати, один из способов моделирования изобрел как раз Артем Оганов — метод предсказания кристаллических структур USPEX.
Кстати, один из способов моделирования изобрел как раз Артем Оганов — метод предсказания кристаллических структур USPEX.
Необычные свойства химических элементов под высоким давлением
- Все вещества становятся металлами.
- Инертные газы перестают быть инертными и образуют соединения, даже гелий.
- Калий и некоторые другие элементы порождают странные структуры, которых нет в периодической таблице. В них часть атомов формирует каркас, а оставшиеся заполняют полости и образуют в них цепочки. При этом периодичность каркаса и цепочки не совпадает, то есть у такой структуры нельзя выделить повторяющуюся элементарную ячейку.
- Многие вещества становятся электридами, то есть изгоняют электроны в пустоты решетки, что придает кристаллу причудливые свойства.
- Любая пара элементов, включая банальную систему «натрий-хлор» (поваренную соль), образует по неведомым правилам странные соединения, такие как Na3Cl и NaCl7. Среди такого рода аномальных веществ есть, кстати, рекордные высокотемпературные сверхпроводники.

- Начинают реагировать элементы, которые не взаимодействуют при атмосферном давлении: медь — с бором, магний — с железом и т. д.
Оганову с коллегами удалось объяснить эти необычные явления за счет пересмотра электроотрицательности. Они рассчитали электроотрицательности при давлениях от 0 до 5 млн атмосфер для всех элементов таблицы Менделеева.
«Дело в том, что при сжатии атома конфигурация его электронов меняется. И конечно, это отражается на его электроотрицательности», — говорит Оганов.
Расчет электроотрицательности отталкивается от энергии ионизации атома (насколько трудно оторвать от него электрон) и энергии сродства к электрону (насколько охотно атом присоединяет электрон из вакуума).
«При высоких давлениях эти два параметра ведут себя по-разному и имеют разный физический смысл», — рассказывает Оганов.
Под давлением исследователи рассчитали для каждого атома энергию отрыва и присоединения электрона.
«Работа шла с перерывами и заняла в общей сложности почти семь лет, — вспоминает Оганов. — Мы начали ее, когда первый автор Сяо Дун был аспирантом в моей лаборатории. А закончили, когда он уже стал профессором. Тут выполнен огромный объем не только мыслительной работы, но и тяжелых расчетов, но оно того стоило».
— Мы начали ее, когда первый автор Сяо Дун был аспирантом в моей лаборатории. А закончили, когда он уже стал профессором. Тут выполнен огромный объем не только мыслительной работы, но и тяжелых расчетов, но оно того стоило».
Оказалось, что новая шкала этих величин успешно объясняет необычные явления неклассической химии. Например, с ростом давления электроотрицательность тоже падает, атомы легче отдают электроны. Атомный остов сжимается, и остается все меньше места для электронов. Так появляются электриды: в них электронам было некуда деться, и они оказались вынуждены ютиться в пустотах решетки. Под высоким давлением фтор остается чемпионом по электроотрицательности. А вот самым электроположительным атомом оказывается не цезий, а натрий.
«А при еще более экстремальных давлениях к нему присоединяется магний, что в каком-то смысле нарушает периодический закон, ведь магний — элемент другой группы таблицы Менделеева. Столь низкая электроотрицательность натрия и магния под давлением делает их невероятно химически активными», — комментирует результаты Оганов.
Между магнием и железом под давлением разность электроотрицательностей растет аж в четыре раза. Похожим образом обстоят дела с медью и бором. Отсюда фантастические соединения этих элементов.
«Мы провели множество тестов, — рассказывает Оганов. — И да, медь действительно легко вступает в реакции с бором и другими элементами. А кобальт и родий запросто отбирают электроны у многих металлов. Мы думаем, что все это может быть очень важным для геохимии, меняя геохимическое поведение и судьбу многих элементов».
Таким образом, пересмотр ключевых понятий химии не только позволяет объяснить в рамках единой концепции массу странных явлений под высоким давлением, но и порождает новые гипотезы в области геологии, планетологии и других наук.
На сайте могут быть использованы материалы интернет-ресурсов Facebook и Instagram, владельцем которых является компания Meta Platforms Inc., запрещённая на территории Российской Федерации
Хемофилия
Остальные теги
Расскажите друзьям
East News
Большой адронный коллайдер разогнался до беспрецедентного уровня энергии
Млечный путь над долиной реки Маруха, Архыз
Deodat Gautier/Снимай науку!
Подведены итоги фотоконкурса «Снимай науку!»
Хомо футурис.
 Каким будет человек будущего?
Каким будет человек будущего?Shutterstock
Взлом с проникновением: биологи впервые сняли на видео, как вирус заражает клетку
Shutterstock
Роботы и искусство: совместимы ли эти понятия?
Хотите быть в курсе последних событий в науке?
Оставьте ваш email и подпишитесь на нашу рассылку
Ваш e-mail
Нажимая на кнопку «Подписаться», вы соглашаетесь на обработку персональных данных
Что такое медь — Свойства меди Элемент — Символ Cu
Что такое медь
Медь — химический элемент с атомным номером 29 , что означает, что в атомной структуре 29 протонов и 29 электронов. Химический символ для меди равен Cu .
Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Copper – Properties
| Element | Copper | ||
|---|---|---|---|
| Atomic Number | 29 | ||
| Symbol | Cu | ||
| Element Category | Transition Metal | ||
| Phase при STP | Твердое тело | ||
| Атомная масса [а.е.м.] | 63,546 | ||
| Плотность при STP [г/см3] | 8,92 | ||
| Electron Configuration | [Ar] 3d10 4s1 | ||
| Possible Oxidation States | +1,2 | ||
| Electron Affinity [kJ/mol] | 118.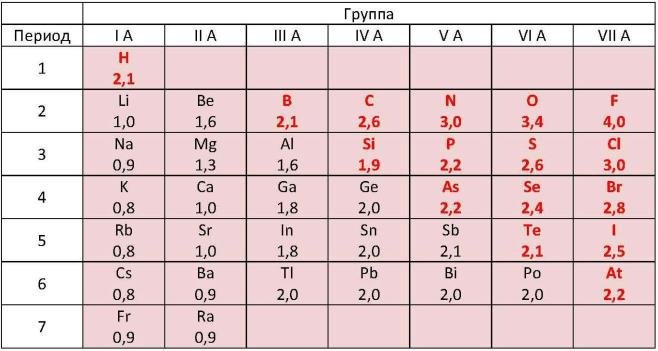 4 4 | ||
| Electronegativity [Pauling scale] | 1,9 | ||
| 1 -я энергия ионизации [EV] | 7,7264 | ||
| Год Discovery | Неизвестно | ||
| Discoverer | UNSTLOING | ||
| 0022 | Thermal properties | ||
| Melting Point [Celsius scale] | 1084.62 | ||
| Boiling Point [Celsius scale] | 2927 | ||
| Thermal Conductivity [W/m K] | 401 | ||
| Specific Heat [J/g K] | 0.38 | ||
| Heat of Fusion [kJ/mol] | 13.05 | ||
| Heat of Vaporization [kJ/mol] | 300.3 |
См. также: Свойства меди
Атомная масса меди
Атомная масса меди 63,546 ед.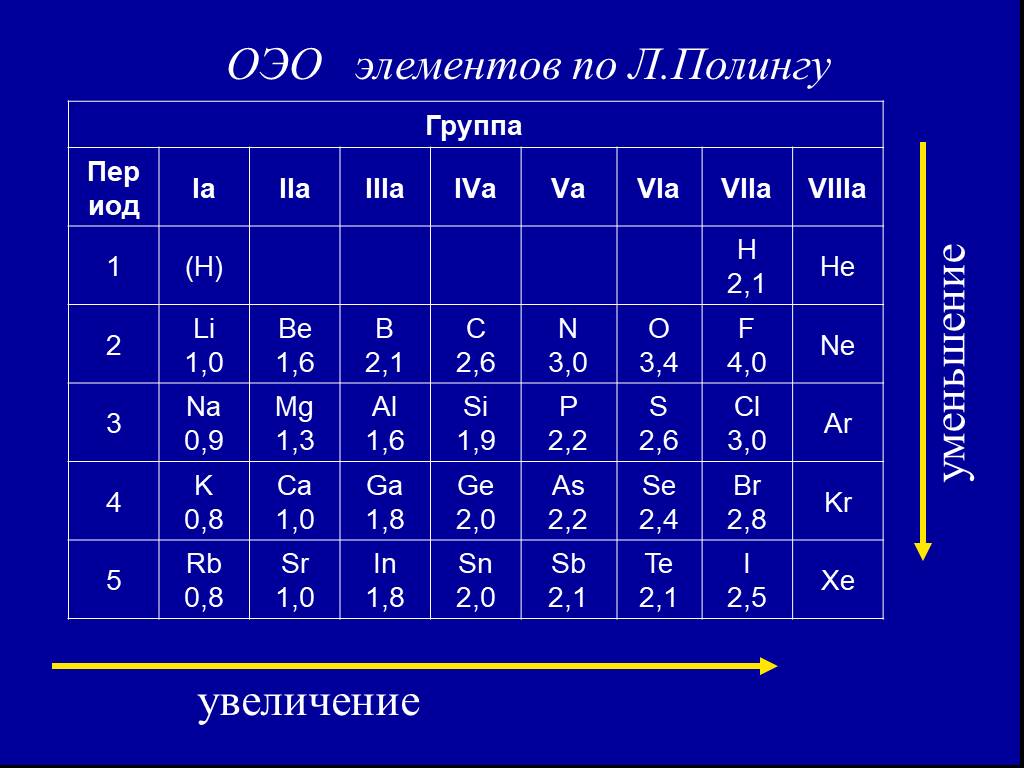
Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамм. Одна единая атомная единица массы равна примерно масса одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, поскольку из нее определяется единица атомной массы. Изотопная масса обычно отличается для других изотопов и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии составляет 62,91367 ед.
Различие между массовым числом и изотопной массой, известное как дефект массы, объясняется двумя причинами:
- Нейтрон немного тяжелее протона .
 Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов. - Энергия связи между ядрами различается. Ядро с большей энергией связи имеет меньшую полную энергию, поэтому меньшая масса согласно соотношению эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu, атомная масса меньше 63, так что это должно быть доминирующим фактором.
См. также: Массовый номер
Плотность меди
Плотность меди 8,92 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ составляет килограммов на кубический метр ( кг/м 3 ). Стандартная английская единица измерения равна массе фунтов на кубический фут9.0006 ( фунтов/фут 3 ).
Стандартная единица СИ составляет килограммов на кубический метр ( кг/м 3 ). Стандартная английская единица измерения равна массе фунтов на кубический фут9.0006 ( фунтов/фут 3 ).
См. также: Что такое плотность?
Электроотрицательность меди 1,9 .
Сродство к электрону
В химии и атомной физике сродство к электрону атома или молекулы определяется как:
изменение энергии (в кДж/моль) нейтрального атома или молекулы (в газовой фазе) при присоединении к атому электрона с образованием отрицательного иона .
X + e – → X – + энергия Сродство = – ∆H
Другими словами, это можно выразить как вероятность нейтрального атома получить электрон . Обратите внимание, что энергия ионизации измеряет тенденцию нейтрального атома сопротивляться потере электронов. Сродство к электрону измерить труднее, чем энергию ионизации.
Сродство к электрону измерить труднее, чем энергию ионизации.
Например, атом меди в газовой фазе выделяет энергию, когда он получает электрон, образуя ион меди.
Cu + e – → Cu – – ∆H = сродство = 118,4 кДж/моль
Чтобы правильно использовать сродство к электрону, важно следить за знаками. При присоединении электрона к нейтральному атому выделяется энергия. Это сродство известно как сродство к первому электрону, и эти энергии отрицательны. По соглашению отрицательный знак показывает высвобождение энергии. Однако для присоединения электрона к отрицательному иону требуется больше энергии, что подавляет любое высвобождение энергии в процессе присоединения электрона. Это сродство известно как сродство ко второму электрону, и эти энергии положительны.
Сродство неметаллов и сродство металлов
- Металлы: Металлы любят терять валентные электроны, чтобы сформировать катионы, имеющие полностью стабильную оболочку.
 Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон.
Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон. - Неметаллы: Как правило, неметаллы имеют более положительное сродство к электрону, чем металлы. Неметаллы любят приобретать электроны для образования анионов, чтобы иметь полностью стабильную электронную оболочку. Хлор наиболее сильно притягивает лишние электроны. Сродство благородных газов к электрону окончательно не измерено, поэтому оно может иметь или не иметь слегка отрицательные значения.
Электроотрицательность
Электроотрицательность , символ χ, является химическим свойством, которое описывает тенденцию атома притягивать электроны к этому атому. Для этой цели чаще всего используется безразмерная величина , шкала Полинга , символ χ.
Электроотрицательность меди:
χ = 1,9
В общем случае на электроотрицательность атома влияет как его атомный номер, так и расстояние, на котором находятся его валентные электроны от заряженного ядра. Чем выше связанное число электроотрицательности, тем больше элемент или соединение притягивает к себе электроны.
Чем выше связанное число электроотрицательности, тем больше элемент или соединение притягивает к себе электроны.
Наиболее электроотрицательному атому, фтору, присвоено значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7.
Первая энергия ионизации меди
Первая энергия ионизации меди 7,7264 эВ .
Энергия ионизации , также называемая потенциалом ионизации , представляет собой энергию, необходимую для удаления электрона из нейтрального атома.
X + энергия → X + + e −
где X — любой атом или молекула, способная к ионизации, X + — атом или молекула, у которых удален электрон (положительный ион), и e — — удаленный электрон.
Атому меди, например, требуется следующая энергия ионизации для удаления самого внешнего электрона.
Cu + IE → Cu + + e − IE = 7,7264 эВ
Чаще всего используется энергия ионизации, связанная с удалением первого электрона. n Энергия ионизации относится к количеству энергии, необходимой для удаления электрона из частиц с зарядом ( n -1).
1st ionization energy
X → X + + e −
2nd ionization energy
X + → X 2+ + e −
3rd ionization energy
X 2 + → X 3+ + e −
Энергия ионизации для различных элементов
На каждый последующий удаленный электрон приходится энергия ионизации. Электроны, вращающиеся вокруг ядра, движутся по довольно четко определенным орбитам. Некоторые из этих электронов более прочно связаны в атоме, чем другие. Например, для удаления самого внешнего электрона из атома свинца требуется всего 7,38 эВ, а для удаления самого внутреннего электрона требуется 88 000 эВ. Помогает понять реакционную способность элементов (особенно металлов, которые теряют электроны).
Помогает понять реакционную способность элементов (особенно металлов, которые теряют электроны).
Как правило, энергия ионизации увеличивается при движении вверх по группе и при перемещении слева направо по периоду. Более того:
- Энергия ионизации самая низкая для щелочных металлов, которые имеют один электрон вне замкнутой оболочки.
- Энергия ионизации возрастает по ряду на периодическом максимуме для благородных газов, имеющих замкнутые оболочки.
Например, для ионизации натрия требуется всего 496 кДж/моль или 5,14 эВ/атом. С другой стороны, неон, благородный газ, непосредственно предшествующий ему в таблице Менделеева, требует 2081 кДж/моль или 21,56 эВ/атом.
Медь – температура плавления и температура кипения
Температура плавления меди 1084,62°C .
Температура кипения Меди: 2927°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении. Температура, при которой испарение (кипение) начинается при заданном давлении, называется температурой насыщения или температурой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления – насыщение
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
Медь – удельная теплоемкость, скрытая теплота плавления, скрытая теплота парообразования
Удельная теплоемкость меди 0,38 Дж/г K .
Скрытая теплота плавления меди 13,05 кДж/моль .
Скрытая теплота испарения меди составляет 300,3 кДж/моль .
Удельная теплоемкость
Удельная теплоемкость или удельная теплоемкость — это свойство, связанное с внутренней энергией , которое очень важно в термодинамике. интенсивных свойств C V и C P определены для чистых, простых сжимаемых веществ в качестве частичных производных Ently Energy U (T, V) и Entlarpy H (T, V) и H (T, V) и H (T, V) и H (T, V) ) , соответственно:
, где индексы v и p обозначают переменные, удерживаемые фиксированными во время дифференцирования. Свойства c v и c p обозначаются как удельная теплоемкость (или теплоемкость ), потому что при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной в результате теплопередачи. Их единицы СИ составляют Дж/кг K или Дж/моль K .
Свойства c v и c p обозначаются как удельная теплоемкость (или теплоемкость ), потому что при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной в результате теплопередачи. Их единицы СИ составляют Дж/кг K или Дж/моль K .
Различные вещества подвергаются воздействию различных величин за счет добавления тепла . При подводе к разным веществам определенного количества теплоты их температуры увеличиваются на разную величину.
Теплоемкость является экстенсивным свойством материи, то есть пропорциональна размеру системы. Теплоемкость C имеет единицу измерения энергии на градус или энергию на кельвин. При выражении того же явления в виде интенсивного свойства теплоемкость делится на количество вещества, массу или объем. Таким образом, количество не зависит от размера или степени выборки.
Таким образом, количество не зависит от размера или степени выборки.
Скрытая теплота парообразования
Обычно, когда материал изменяет фазу из твердой в жидкую или из жидкой в газообразную, на это фазовое изменение затрачивается определенное количество энергии. В случае фазового перехода из жидкости в газ это количество энергии известно как энтальпии испарения (символ ∆H пар ; единица измерения: Дж), также известной как (скрытая) теплота парообразования или теплота испарения. В качестве примера см. рисунок, на котором описаны фазовые переходы воды.
Скрытая теплота – это количество теплоты, добавляемое к веществу или отводимое от него для изменения фазы. Эта энергия разрушает межмолекулярные силы притяжения и должна обеспечивать энергию, необходимую для расширения газа ( pΔV работает ). При добавлении скрытой теплоты изменения температуры не происходит. Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Скрытая теплота плавления
В случае перехода твердой фазы в жидкую изменение энтальпии, необходимое для изменения ее состояния, известно как энтальпия плавления (символ ∆H фуз ; единица измерения: Дж), также известная как (скрытая) теплота плавления . Скрытая теплота — это количество теплоты, добавляемое к веществу или отводимое от него для осуществления фазового перехода. Эта энергия разрушает межмолекулярные силы притяжения, а также должна обеспечивать энергию, необходимую для расширения системы ( pΔV работает ).
Жидкая фаза имеет более высокую внутреннюю энергию, чем твердая фаза. Это означает, что к твердому телу должна быть подведена энергия, чтобы расплавить его, а энергия высвобождается из жидкости при ее замерзании, потому что молекулы в жидкости испытывают более слабые межмолекулярные силы и, следовательно, имеют более высокую потенциальную энергию (своего рода энергия диссоциации связи для межмолекулярные силы).
Температура, при которой происходит фазовый переход, является точкой плавления .
При добавлении скрытой теплоты изменение температуры не происходит. Энтальпия плавления является функцией давления, при котором происходит это превращение. По соглашению давление принимается равным 1 атм (101,325 кПа), если не указано иное.
Медь в периодической таблице
| Водород1H | Гелий2Не | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Phosphorus15P | Sulfur16S | Chlorine17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Bromine35Br | Krypton36Kr | ||
| Рубидий37Rb | Стронций38Sr | Иттрий39Y | Цирконий40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Xenon54Xe | ||
| Caesium55Cs | Barium56Ba | Лантан57La | Гафний72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Francium87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Церий58Ce | Празеодим59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Thorium90Th | Протактиний-91Pa | Уран-92U | Нептуний-93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
The Периодическая таблица и почему батарейки работают не так, как вы думаете
Поделиться на Facebook
Share в Twitter
Share на Reddit
Share на LinkedIn
.
 некоторые из них созданы руками человека — являются бесконечным источником очарования . Но что-то в них остается загадочным для большинства людей, возможно, даже для многих химиков.
некоторые из них созданы руками человека — являются бесконечным источником очарования . Но что-то в них остается загадочным для большинства людей, возможно, даже для многих химиков.У меня была возможность напомнить себе об этой загадке, пока я читал две потрясающие книги на эту тему— Исчезающая ложка Сэма Кина и Periodic Tales Хью Олдерси-Уильямса.
В периодической таблице элементы аккуратно распределены по столбцам. Те элементы, которые находятся в одной колонке, должны обладать (примерно) схожими химическими свойствами. Большинство людей, хорошо знающих таблицу и использующих ее каждый день, включая практически всех химиков, биохимиков, материаловедов и многих инженеров, едва ли задумываются о ней, но предсказания таблицы — одни из самых странных фактов в природе. Законы, управляющие большинством явлений, происходящих у нас на глазах — от клеточного метаболизма до аккумуляторов ноутбука — продиктованы химическим составом элементов, но мы редко осознаем, насколько причудливы и чудесны лежащие в их основе силы.

Значение колонок таблицы наиболее явно проявляется в элементах в самой левой колонке, называемых щелочными металлами (включая литий, натрий и калий), и во второй колонке справа, называемых галогенами (фтор, хлор и их друзья). Эти два семейства составляют наиболее реакционноспособные из всех элементов. Атомы галогенов, таких как фтор, имеют крайнюю тенденцию отрывать электрон от других атомов, в то время как атомы щелочных металлов имеют столь же сильную тенденцию отдавать электрон. Таким образом, смешайте галоген и щелочной металл, и вы получите идеальное совпадение один к одному — соль, такую как хлорид калия или хлорид натрия, также известную как поваренная соль.
В более общем плане наблюдается тенденция постепенного перехода от донорства электронов к акцептированию электронов по мере продвижения слева направо в периодической таблице. Этот градиент количественно измеряется свойством, называемым электроотрицательностью, которое (в общем и целом) увеличивается слева направо.
 Однако, как только вы дойдете до последней колонки справа, вы сбрасываете шкалу. Элементами этого семейства являются инертные газы, которые практически не вступают в реакцию.
Однако, как только вы дойдете до последней колонки справа, вы сбрасываете шкалу. Элементами этого семейства являются инертные газы, которые практически не вступают в реакцию.Каждый ученый скажет вам, что поведение семейств химических веществ, составляющих каждый столбец, более или менее предсказуемо — иными словами, причина существования периодической таблицы — заключается в том, что все элементы тайно «хотят быть благородными газами». В атоме благородного газа, такого как неон (элемент 10), орбиты электронов вокруг ядра расположены аккуратно и симметрично, как лепестки цветка. Галоген фтор (9), с другой стороны, который имеет на один электрон меньше, чем неон, имеет асимметричное орбитальное расположение. Он отчаянно «хочет», чтобы этот дополнительный электрон сделал расположение симметричным и счастливым. Между тем, для щелочного металла натрия (11) проще всего стать подобным неону, если он потеряет один электрон.
Само собой разумеется, что это повествование о неудовлетворенных электронных желаниях атомов не является настоящим научным объяснением.
 Типичному пользователю таблицы Менделеева не нужно углубляться: истинные причины давно выяснены, и ответ теперь зарыт в каком-нибудь сложном учебнике по квантовой физике. Но если мы остановимся и задумаемся на минуту, то поймем, какое это поразительно причудливое явление.
Типичному пользователю таблицы Менделеева не нужно углубляться: истинные причины давно выяснены, и ответ теперь зарыт в каком-нибудь сложном учебнике по квантовой физике. Но если мы остановимся и задумаемся на минуту, то поймем, какое это поразительно причудливое явление.Возьмите кислород. Разъедающее — ржавое, тускнеющее, ну, окисляющее — химическое вещество по преимуществу , кислород реагирует, потому что он «хочет» завершить свой букет внешних электронных орбиталей до полного набора из восьми, и, таким образом, имитировать безмятежную икебану неона. Вряд ли имеет значение, если некоторые из этих орбиталей также должны будут летать вокруг других атомов: например, разделяя часть своих электронов с двумя атомами водорода, кислород может образовать молекулу воды. Пока внешние орбитали образуют полный октет вокруг ядра, химическая нирвана находится в пределах досягаемости.
Но вот почему это так странно. Если вы возьмете атом кислорода изолированно и подадите ему электрон, он захватит его и станет ионом кислорода O-.
 Теперь представьте, что мимо пролетает лишний электрон. Оба объекта, электрон и ион кислорода, заряжены отрицательно, поэтому они должны отталкивать друг друга. И все же кислород так жаждет этого второго электрона, что захватит его и станет дважды ионизированным ионом O—. Реакционная способность кислорода настолько сильна, что он побеждает электростатическое (или кулоновское) отталкивание, силу пресловутой интенсивности. (Обстановка, которую я описываю, я признаю, довольно абстрактна, поскольку электроны и кислород на самом деле не имеют возможности взаимодействовать в вакууме, и, вероятно, полученный ион не будет стабильным, но, пожалуйста, потерпите меня.)
Теперь представьте, что мимо пролетает лишний электрон. Оба объекта, электрон и ион кислорода, заряжены отрицательно, поэтому они должны отталкивать друг друга. И все же кислород так жаждет этого второго электрона, что захватит его и станет дважды ионизированным ионом O—. Реакционная способность кислорода настолько сильна, что он побеждает электростатическое (или кулоновское) отталкивание, силу пресловутой интенсивности. (Обстановка, которую я описываю, я признаю, довольно абстрактна, поскольку электроны и кислород на самом деле не имеют возможности взаимодействовать в вакууме, и, вероятно, полученный ион не будет стабильным, но, пожалуйста, потерпите меня.)Мы часто слышим, что все, что происходит в природе, за исключением, возможно, темной энергии, происхождение которой остается полной загадкой, является результатом действия одной из четырех фундаментальных сил: гравитации, слабого и сильного ядерных взаимодействий и электромагнетизма. Химические реакции и формирование состояний материи, таких как квазикристаллы или люди, полностью управляются электромагнитной силой.
 Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила — лишь один из них. Химические реакции являются электромагнитными, но большую часть времени они происходят против, а не вслед за электростатическими силами.
Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила — лишь один из них. Химические реакции являются электромагнитными, но большую часть времени они происходят против, а не вслед за электростатическими силами.Механизмы, питающие батарею, например, во многом связаны с электромагнитными взаимодействиями, которые мы называем химией; но вопреки тому, что мы часто думаем, электроны не перемещаются от отрицательного полюса к положительному полюсу из-за электростатики. Дело не в том, что отрицательный полюс имеет избыток электронов — отрицательный заряд, а положительный полюс — их истощение. Оба электрода в батарее электрически нейтральны .
Что действительно питает батарею, так это разница в электроотрицательности между материалами, из которых сделаны ее электроды. Возьмем, к примеру, гальваническую батарею, первую в истории батарею, изобретенную около 1800 года Алессандро Вольта. Отрицательный электрод сваи изготовлен из цинка (30), а положительный — из меди (29).
 ). Медь немного более электроотрицательна, чем цинк*.
). Медь немного более электроотрицательна, чем цинк*.Таким образом, если вы поместите два металла рядом друг с другом (или если вы соедините их проводом), часть электронов переместится из цинка в медь.
Мы говорим, что медь является положительным полюсом, а цинк отрицательным, но в действительности переход электронов будет происходить против электростатических сил, а не вслед за ними: положительный электрод, медь, станет отрицательно заряженным от лишнего электроны, за счет отрицательного электрода, цинка, который будет заряжаться положительно!
При таком положении дел простое соединение двух материалов, состоящих из атомов с разной электроотрицательностью (в случае материалов соответствующий термин — электрохимический потенциал), не дало бы много энергии. Отрицательные заряды, накапливающиеся на положительном полюсе, быстро становятся слишком сильными и отталкивают новые электроны; тем временем отрицательный электрод быстро станет положительно заряженным из-за потери электронов и, таким образом, будет сильнее цепляться за оставшиеся электроны за счет электростатического притяжения.
 Перенос электронов быстро прекратился бы.
Перенос электронов быстро прекратился бы.Вот почему аккумулятор состоит не только из двух электродов, но и из электролита. Электролит обеспечивает перенос ионов от отрицательного полюса к положительному полюсу батареи. Поскольку положительный полюс имеет тенденцию накапливать отрицательные заряды электронов, он также имеет тенденцию притягивать положительные ионы. Таким образом, ионы сохраняют нейтральные заряды с обеих сторон и позволяют продолжать передачу электронов — по крайней мере, некоторое время.
Когда переносится слишком много ионов, производительность батареи начинает снижаться. В конце концов, все ионы, которые могли двигаться, сдвинулись, и батарея разряжена. Если ваша батарея является перезаряжаемой, вы можете подать потенциал на ее электроды, чтобы переместить электроны обратно к отрицательному полюсу, и ионы последуют их примеру.
Так что же это за таинственная квантовая физика, управляющая цветочным расположением электронных орбиталей? Боюсь, это будет предметом отдельного поста.



 Каким будет человек будущего?
Каким будет человек будущего?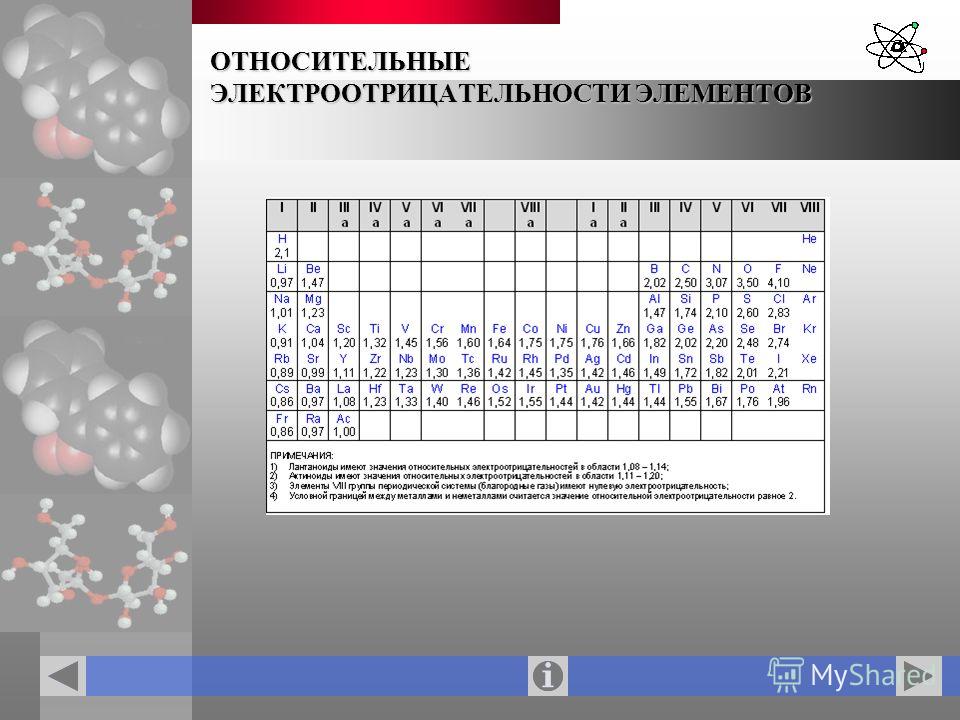 Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов. Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон.
Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон. некоторые из них созданы руками человека — являются бесконечным источником очарования . Но что-то в них остается загадочным для большинства людей, возможно, даже для многих химиков.
некоторые из них созданы руками человека — являются бесконечным источником очарования . Но что-то в них остается загадочным для большинства людей, возможно, даже для многих химиков.
 Однако, как только вы дойдете до последней колонки справа, вы сбрасываете шкалу. Элементами этого семейства являются инертные газы, которые практически не вступают в реакцию.
Однако, как только вы дойдете до последней колонки справа, вы сбрасываете шкалу. Элементами этого семейства являются инертные газы, которые практически не вступают в реакцию. Типичному пользователю таблицы Менделеева не нужно углубляться: истинные причины давно выяснены, и ответ теперь зарыт в каком-нибудь сложном учебнике по квантовой физике. Но если мы остановимся и задумаемся на минуту, то поймем, какое это поразительно причудливое явление.
Типичному пользователю таблицы Менделеева не нужно углубляться: истинные причины давно выяснены, и ответ теперь зарыт в каком-нибудь сложном учебнике по квантовой физике. Но если мы остановимся и задумаемся на минуту, то поймем, какое это поразительно причудливое явление. Теперь представьте, что мимо пролетает лишний электрон. Оба объекта, электрон и ион кислорода, заряжены отрицательно, поэтому они должны отталкивать друг друга. И все же кислород так жаждет этого второго электрона, что захватит его и станет дважды ионизированным ионом O—. Реакционная способность кислорода настолько сильна, что он побеждает электростатическое (или кулоновское) отталкивание, силу пресловутой интенсивности. (Обстановка, которую я описываю, я признаю, довольно абстрактна, поскольку электроны и кислород на самом деле не имеют возможности взаимодействовать в вакууме, и, вероятно, полученный ион не будет стабильным, но, пожалуйста, потерпите меня.)
Теперь представьте, что мимо пролетает лишний электрон. Оба объекта, электрон и ион кислорода, заряжены отрицательно, поэтому они должны отталкивать друг друга. И все же кислород так жаждет этого второго электрона, что захватит его и станет дважды ионизированным ионом O—. Реакционная способность кислорода настолько сильна, что он побеждает электростатическое (или кулоновское) отталкивание, силу пресловутой интенсивности. (Обстановка, которую я описываю, я признаю, довольно абстрактна, поскольку электроны и кислород на самом деле не имеют возможности взаимодействовать в вакууме, и, вероятно, полученный ион не будет стабильным, но, пожалуйста, потерпите меня.) Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила — лишь один из них. Химические реакции являются электромагнитными, но большую часть времени они происходят против, а не вслед за электростатическими силами.
Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила — лишь один из них. Химические реакции являются электромагнитными, но большую часть времени они происходят против, а не вслед за электростатическими силами. ). Медь немного более электроотрицательна, чем цинк*.
). Медь немного более электроотрицательна, чем цинк*. Перенос электронов быстро прекратился бы.
Перенос электронов быстро прекратился бы.