Электроотрицательность меди: Таблица электроотрицательности химических элементов с примерами ряда
Содержание
Таблица электроотрицательности химических элементов с примерами ряда
4.6
Средняя оценка: 4.6
Всего получено оценок: 394.
4.6
Средняя оценка: 4.6
Всего получено оценок: 394.
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.
Чем выше электроотрицательность, тем сильнее свойства окислителя.
Рис. 1. Действия окислителя и восстановителя в реакциях.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента | Элемент | Символ | Электроотрицательность |
87 | Франций | Fr | 0,79 |
55 | Цезий | Cs | 0,79 |
19 | Калий | K | 0,82 |
37 | Рубидий | Rb | 0,82 |
56 | Барий | Ba | 0,89 |
88 | Радий | Ra | 0,9 |
11 | Натрий | Na | 0,93 |
38 | Стронций | Sr | 0,95 |
3 | Литий | Li | 0,98 |
20 | Кальций | Ca | 1,0 |
57 | Лантан | La | 1,1 |
89 | Актиний | Ac | 1,1 |
70 | Иттербий | Yb | 1,1 |
58 | Церий | Ce | 1,12 |
59 | Празеодим | Pr | 1,13 |
61 | Прометей | Pm | 1,13 |
95 | Америций | Am | 1,13 |
60 | Неодим | Nd | 1,14 |
62 | Самарий | Sm | 1,17 |
64 | Гадолиний | Gd | 1,2 |
66 | Диспрозий | Dy | 1,22 |
39 | Иттрий | Y | 1,22 |
68 | Эрбий | Er | 1,24 |
69 | Тулий | Tm | 1,25 |
71 | Лютеций | Lu | 1,27 |
96 | Кюрий | Cm | 1,28 |
94 | Плутоний | Pu | 1,28 |
90 | Торий | Th | 1,3 |
97 | Берклий | Bk | 1,3 |
98 | Калифорний | Cf | 1,3 |
99 | Эйнштейний | Es | 1,3 |
100 | Фермий | Fm | 1,3 |
101 | Менделевий | Md | 1,3 |
102 | Нобелий | No | 1,3 |
12 | Магний | Mg | 1,31 |
40 | Цирконий | Zr | 1,33 |
93 | Нептуний | Np | 1,36 |
21 | Скандий | Sc | 1,36 |
92 | Уран | U | 1,38 |
73 | Тантал | Ta | 1,5 |
91 | Протактиний | Pa | 1,5 |
22 | Титан | Ti | 1,54 |
25 | Марганец | Mn | 1,55 |
4 | Бериллий | Be | 1,57 |
41 | Ниобий | Nb | 1,6 |
13 | Алюминий | Al | 1,61 |
81 | Талий | Tl | 1,62 |
30 | Цинк | Zn | 1,65 |
23 | Ванадий | V | 1,63 |
24 | Хром | Cr | 1,66 |
48 | Кадмий | Cd | 1,69 |
49 | Индий | In | 1,78 |
31 | Галлий | Ga | 1,81 |
26 | Железо | Fe | 1,83 |
82 | Свинец | Pb | 1,87 |
27 | Кобальт | Co | 1,88 |
29 | Медь | Cu | 1,9 |
75 | Рений | Re | 1,9 |
14 | Кремний | Si | 1,9 |
43 | Технеций | Tc | 1,9 |
28 | Никель | Ni | 1,91 |
47 | Серебро | Ag | 1,93 |
50 | Олово | Sn | 1,96 |
80 | Ртуть | Hg | 2 |
84 | Полоний | Po | 2 |
83 | Висмут | Bi | 2,02 |
5 | Бор | B | 2,04 |
51 | Сурьма | Sb | 2,05 |
42 | Молибден | Mo | 2,16 |
33 | Мышьяк | As | 2,18 |
15 | Фосфор | P | 2,19 |
1 | Водород | H | 2,2 |
77 | Иридий | Ir | 2,2 |
86 | Радон | Rn | 2,2 |
85 | Астат | At | 2,2 |
44 | Рутений | Ru | 2,2 |
46 | Палладий | Pd | 2,2 |
76 | Осмий | Os | 2,2 |
78 | Платина | Pt | 2,28 |
45 | Родий | Rh | 2,28 |
74 | Вольфрам | W | 2,36 |
79 | Золото | Au | 2,54 |
6 | Углерод | C | 2,55 |
34 | Селен | Se | 2,55 |
16 | Сера | S | 2,58 |
54 | Ксенон | Xe | 2,6 |
53 | Йод | I | 2,66 |
36 | Криптон | Kr | 2,96 |
7 | Азот | N | 3,04 |
17 | Хлор | Cl | 3,16 |
8 | Кислород | O | 3,44 |
9 | Фтор | F | 3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства.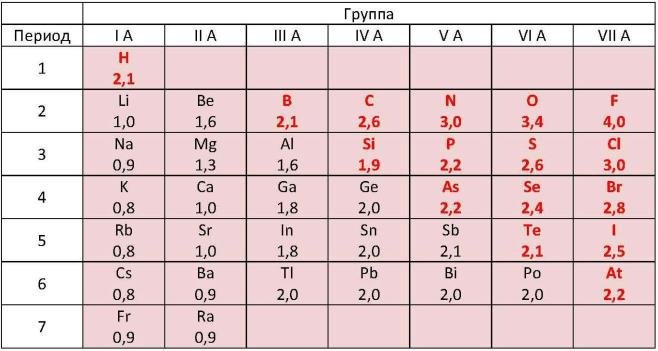 Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.
Рис. 2. Ряд электроотрицательности.
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Рис. 3. Таблица Менделеева.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 394.
А какая ваша оценка?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление
| Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Химический справочник / / Таблица электроотрицательности химических элементов. Химические элементы в порядке возрастания относительной электроотрицательности (X) по Полингу (Pauling)
Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ошибка 404: страница не найдена
Письмо ректору
Телефонный справочник
Электронная почта
Онлайн-обучение
Расписание
Научно-педагогические работники
Сервисы
Электронная служебная записка Электронная библиотека КалендарьГорячая линия по дистанционному обучению Тревожная кнопка Отзывы о преподавателяхПолезные ресурсы Виртуальный тур
| Министерство науки и высшего образования РФ | |
| Программа повышения конкурентоспособности | |
| Противодействие коррупции | |
Диалог науки и религии | |
| Наука и образование против террора | |
| Диссертационные советы | |
| Социальный навигатор | |
| Оформление социальной студенческой карты | |
| Study in Russia | |
| Уникальная научная установка НЕВОД | |
| Турнир «ТеМП» | |
| Международная олимпиада для студентов | |
| Олимпиада «Я — профи» |
|
Периодическая таблица, и почему батареи не работают так, как вы думаете,
Поделитесь на Facebook
Share в Twitter
Share на Reddit
Share на Linkedin
.
 Электронная почта
Электронная почтаПечать
Химические элементы — разновидности атомов, существующих в природе и даже созданные человеком, — являются бесконечным источником очарования . Но что-то в них остается загадочным для большинства людей, возможно, даже для многих химиков.
У меня была возможность напомнить себе об этой головоломке, когда я читал две потрясающие книги на эту тему — Исчезающая ложка Сэма Кина и Периодические рассказы Хью Олдерси-Уильямса — я проводил исследование написать текст для интерактивной периодической таблицы ScientificAmerican.com .
В периодической таблице элементы аккуратно распределены по столбцам. Те элементы, которые находятся в одной колонке, должны обладать (примерно) схожими химическими свойствами. Большинство людей, хорошо знающих таблицу и использующих ее каждый день, включая практически всех химиков, биохимиков, материаловедов и многих инженеров, едва ли задумываются о ней, но предсказания таблицы — одни из самых странных фактов в природе. Законы, которые управляют большинством явлений, происходящих у нас на глазах — от клеточного метаболизма до аккумуляторов ноутбука — продиктованы химическим составом элементов, но мы редко осознаем, насколько странными и удивительными являются лежащие в их основе силы.
Законы, которые управляют большинством явлений, происходящих у нас на глазах — от клеточного метаболизма до аккумуляторов ноутбука — продиктованы химическим составом элементов, но мы редко осознаем, насколько странными и удивительными являются лежащие в их основе силы.
Значение столбцов таблицы наиболее явно проявляется в элементах из крайнего левого столбца, называемых щелочными металлами (включая литий, натрий и калий), и во втором столбце справа, называемых галогенами (фтор, хлор и их друзья). Эти два семейства составляют наиболее реакционноспособные из всех элементов. Атомы галогенов, таких как фтор, имеют крайнюю тенденцию отрывать электрон от других атомов, в то время как атомы щелочных металлов имеют столь же сильную тенденцию отдавать электрон. Таким образом, смешайте галоген и щелочной металл, и вы получите идеальное совпадение один к одному — соль, такую как хлорид калия или хлорид натрия, также известную как поваренная соль.
В более общем плане наблюдается тенденция к постепенному переходу от донорства электронов к акцептированию электронов по мере продвижения слева направо в периодической таблице. Этот градиент количественно измеряется свойством, называемым электроотрицательностью, которое (в общем и целом) увеличивается слева направо. Однако, как только вы дойдете до последней колонки справа, вы сбрасываете шкалу. Элементами этого семейства являются инертные газы, которые практически не вступают в реакцию.
Этот градиент количественно измеряется свойством, называемым электроотрицательностью, которое (в общем и целом) увеличивается слева направо. Однако, как только вы дойдете до последней колонки справа, вы сбрасываете шкалу. Элементами этого семейства являются инертные газы, которые практически не вступают в реакцию.
Каждый ученый скажет вам, что поведение семейств химических веществ, составляющих каждый столбец, более или менее предсказуемо — иными словами, причина существования периодической таблицы — заключается в том, что все элементы тайно «хотят быть благородными газами». В атоме благородного газа, такого как неон (элемент 10), орбиты электронов вокруг ядра расположены аккуратно и симметрично, как лепестки цветка. Галоген фтор (9), с другой стороны, который имеет на один электрон меньше, чем неон, имеет асимметричное орбитальное расположение. Он отчаянно «хочет», чтобы этот дополнительный электрон сделал расположение симметричным и счастливым. Между тем, для щелочного металла натрия (11) проще всего стать подобным неону, если он потеряет один электрон.
Само собой разумеется, что это повествование о неудовлетворенных электронных желаниях атомов не является настоящим научным объяснением. Типичному пользователю таблицы Менделеева не нужно углубляться: истинные причины давно выяснены, и ответ теперь зарыт в каком-нибудь сложном учебнике по квантовой физике. Но если мы остановимся и задумаемся на минуту, то поймем, какое это поразительно причудливое явление.
Возьми кислород. Разъедающее — ржавое, тускнеющее, ну, окисляющее — химическое вещество по преимуществу , кислород реагирует, потому что он «хочет» завершить свой букет внешних электронных орбиталей до полного набора из восьми и, таким образом, имитировать безмятежную икебану неона. Вряд ли имеет значение, если некоторые из этих орбиталей также должны будут летать вокруг других атомов: например, разделяя часть своих электронов с двумя атомами водорода, кислород может образовать молекулу воды. Пока внешние орбитали образуют полный октет вокруг ядра, химическая нирвана находится в пределах досягаемости.
Но вот почему это так странно. Если вы возьмете атом кислорода изолированно и подадите ему электрон, он захватит его и станет ионом кислорода O-. Теперь представьте, что мимо пролетает лишний электрон. Оба объекта, электрон и ион кислорода, заряжены отрицательно, поэтому они должны отталкивать друг друга. И все же кислород так жаждет этого второго электрона, что захватит его и станет дважды ионизированным ионом O—. Реакционная способность кислорода настолько сильна, что он побеждает электростатическое (или кулоновское) отталкивание, силу пресловутой интенсивности. (Обстановка, которую я описываю, я признаю, довольно абстрактна, поскольку электроны и кислород на самом деле не имеют возможности взаимодействовать в вакууме, и, вероятно, полученный ион не будет стабильным, но, пожалуйста, потерпите меня.)
Мы часто слышим, что все, что происходит в природе, за исключением, возможно, темной энергии, происхождение которой остается полной загадкой, является результатом действия одной из четырех фундаментальных сил: гравитации, слабого и сильного ядерных взаимодействий и электромагнетизма. Химические реакции и формирование состояний материи, таких как квазикристаллы или люди, полностью управляются электромагнитной силой. Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила — лишь один из них. Химические реакции являются электромагнитными, но большую часть времени они происходят против, а не вслед за электростатическими силами.
Химические реакции и формирование состояний материи, таких как квазикристаллы или люди, полностью управляются электромагнитной силой. Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила — лишь один из них. Химические реакции являются электромагнитными, но большую часть времени они происходят против, а не вслед за электростатическими силами.
Механизмы, питающие батарею, например, во многом связаны с электромагнитными взаимодействиями, которые мы называем химией; но вопреки тому, что мы часто думаем, электроны не перемещаются от отрицательного полюса к положительному полюсу из-за электростатики. Дело не в том, что отрицательный полюс имеет избыток электронов — отрицательный заряд, а положительный полюс — их истощение. Оба электрода в батарее электрически нейтральны .
Что действительно питает батарею, так это разница в электроотрицательности между материалами, из которых сделаны ее электроды. Возьмем, к примеру, гальваническую батарею, первую в истории батарею, изобретенную около 1800 года Алессандро Вольта. Отрицательный электрод сваи изготовлен из цинка (30), а положительный — из меди (29).). Медь немного более электроотрицательна, чем цинк*.
Отрицательный электрод сваи изготовлен из цинка (30), а положительный — из меди (29).). Медь немного более электроотрицательна, чем цинк*.
Таким образом, если вы поместите два металла рядом друг с другом (или если вы соедините их проводом), часть электронов переместится из цинка в медь.
Мы говорим, что медь является положительным полюсом, а цинк отрицательным, но в действительности переход электронов будет происходить против электростатических сил, а не вслед за ними: положительный электрод, медь, станет отрицательно заряженным от лишнего электроны, за счет отрицательного электрода, цинка, который будет заряжаться положительно!
При таком положении дел простое соединение двух материалов, состоящих из атомов с разной электроотрицательностью (в случае материалов соответствующий термин — электрохимический потенциал), не дало бы много энергии. Отрицательные заряды, накапливающиеся на положительном полюсе, быстро становятся слишком сильными и отталкивают новые электроны; тем временем отрицательный электрод быстро станет положительно заряженным из-за потери электронов и, таким образом, будет сильнее цепляться за оставшиеся электроны за счет электростатического притяжения. Перенос электронов быстро прекратился бы.
Перенос электронов быстро прекратился бы.
Вот почему аккумулятор состоит не только из двух электродов, но и из электролита. Электролит обеспечивает перенос ионов от отрицательного полюса к положительному полюсу батареи. Поскольку положительный полюс имеет тенденцию накапливать отрицательные заряды электронов, он также имеет тенденцию притягивать положительные ионы. Таким образом, ионы сохраняют нейтральные заряды с обеих сторон и позволяют продолжать передачу электронов — по крайней мере, некоторое время.
Когда переносится слишком много ионов, производительность батареи начинает снижаться. В конце концов, все ионы, которые могли двигаться, сдвинулись, и батарея разряжена. Если ваша батарея является перезаряжаемой, вы можете подать потенциал на ее электроды, чтобы переместить электроны обратно к отрицательному полюсу, и ионы последуют их примеру.
Так что же это за загадочная квантовая физика, управляющая цветочным расположением электронных орбиталей? Боюсь, это будет предметом отдельного поста.
(*) Примечание: внимательный читатель заметит, что фактически медь в таблице находится слева от цинка. Однако медь является более электроотрицательной из двух металлов. Правило увеличения электроотрицательности при движении слева направо имеет несколько исключений.
При подготовке этого эссе мне пригодились беседы с Петром Зеленаем.
Высказанные мнения принадлежат автору (авторам) и не обязательно совпадают с мнением Scientific American.
ОБ АВТОРАХ
Давиде Кастельвекки — штатный репортер Nature , который был одержим квантовым вращением почти всю свою жизнь. Подпишитесь на него в Твиттере @dcastelvecchi
Квантовая физика
Вселенная локально нереальна, и лауреаты Нобелевской премии по физике доказали это
Изменение климата
«Абсолютно никаких сомнений» в том, что климат усилил нынешнюю засуху
Сохранение
В Детройте обитает большая популяция фазанов с кольцевой шеей, и они наносят удары Заставить их работать должным образом
Психическое здоровье
Важен ли ты для других? Ответ может предсказать ваше психическое здоровье
Исчезающие виды
Вновь открытые гены красных волков могут помочь сохранить вид
Части периодической таблицы
Части периодической таблицы
Периодические тенденции — электроотрицательность
| 1А | 2А | 3А | 4А | 5А | 6А | 7А | 8А | ||||||||||||
| (1) | (2) | (13) | (14) | (15) | (16) | (17) | (18) | ||||||||||||
| 3Б | 4Б | 5Б | 6Б | 7Б | — | 8Б | — | 1Б | 2Б | ||||||||||
| (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | ||||||||||
| 1 | Х 2,20 | Он н. | |||||||||||||||||
| 2 | Ли 0,98 | Быть 1,57 | Б 2.04 | С 2,55 | Н 3,04 | О 3,44 | Ф 3,98 | Не н. | |||||||||||
| 3 | Нет 0,93 | Мг 1,31 | Ал 1,61 | Си 1,90 | Р 2,19 | С 2,58 | Кл 3,16 | Ар н. | |||||||||||
| 4 | К 0,82 | Са 1,00 | СК 1,36 | Ти 1,54 | В 1,63 | Кр 1,66 | Мн 1,55 | Fe 1,83 | Со 1,88 | Ni 1,91 | Медь 1,90 | Цинк 1,65 | Га 1,81 | Гэ 2. | Как 2,18 | Se 2,55 | руб. 2,96 | Кр 3,00 | |
| 5 | руб. руб. 0,82 | Ср 0,95 | Д 1,22 | Зр 1,33 | № 1,60 | Пн 2,16 | ТК 1,90 | Ру 2,20 | Рх 2,28 | Пд 2,20 | Аг 1,93 | CD 1,69 | В 1,78 | Сн 1,96 | Сб 2,05 | Те 2. | я 2,66 | Хе 2,60 | |
| 6 | цезий 0,79 | Ба 0,89 | Ла 1.10 | Хф 1,30 | Та 1,50 | Вт 2,36 | Ре 1,90 | ОС 2,20 | Ир 2,20 | часть 2,28 | Золото 2,54 | рт. 2,00 | Тул 1,62 | Пб 2,33 | Би 2,02 | ПО 2,00 | В 2,20 | Р-н н.д. | |
| 7 | Пт 0,70 | Ра 0,89 | Ас 1.10 | РФ н.д. | Дб н. | Сг н.д. | Бх н.д. | Гс н.д. | Мт н.д. | Дс н.д. | № н.д. | Ууб н.д. | — | Uuq н.д. | — | — | — | — | |
| 6 | Се 1,12 | Пр 1,13 | Нд 1,14 | вечера 1,13 | См 1,17 | ЕС 1,20 | гд 1,20 | Тб 1. | Дай 1,22 | Хо 1,23 | Er 1,24 | ТМ 1,25 | Ыб 1.10 | Лу 1,27 | |||||
| 7 | 1,30 | Па 1,50 | У 1,38 | Нп 1,36 | Пу 1,28 | Ам 1,30 | См 1,30 | Бк 1,30 | См. 1,30 | Эс 1,30 | FM 1,30 | Мд 1,30 | № 1,30 | Лр 1,30 |
Электроотрицательность в единицах Полинга
Данные взяты у Джона Эмсли, Элементы , 3-е издание.
Оксфорд: Clarendon Press, 1998..
Электроотрицательность относится к способности атома притягивать общие
электронов в ковалентной связи. Чем выше значение
электроотрицательность, тем сильнее этот элемент притягивает
общие электроны.Концепция электроотрицательности была введена Линусом Полингом.
в 1932 году; по шкале Полинга фтору присваивается
электроотрицательность 3,98, а остальные элементы масштабируются
относительно этого значения. Другие шкалы электроотрицательности включают шкалу Малликена, предложенную Робертом С. Малликеном в 1919 году.34, в котором
первая энергия ионизации и сродство к электрону усредняются вместе,
и шкала Оллреда-Рохова, которая измеряет электростатическую
притяжение между ядром атома и его валентными электронами.Электроотрицательность изменяется предсказуемым образом в периодическом
стол. Электроотрицательность возрастает снизу вверх в
группы и увеличиваются слева направо по периодам . Таким образом,
фтор — самый электроотрицательный элемент, а франций — один из
из наименее электроотрицательных. (Гелий, неон и аргон не
перечислены в шкале электроотрицательности Полинга, хотя в
По шкале Allred-Rochow гелий имеет самую высокую электроотрицательность.) Тенденции не очень гладкие
среди переходных металлов и внутренних переходных металлов, но
достаточно регулярны для основных элементов группы, и их можно увидеть в
диаграммы ниже.
Разница в электроотрицательности между двумя связанными элементами
определяет, какой тип связи они образуют. Когда атомы с разницей электроотрицательностей больше
чем две единицы соединены вместе, связь, которая образуется,
ионная связь , в которой более электроотрицательный элемент
имеет отрицательный заряд, а менее электроотрицательный элемент имеет
положительный заряд. (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната, в которой одна команда достаточно сильна, чтобы тянуть
веревку от другой команды.) Например, натрий
имеет электроотрицательность 0,93, а хлор имеет
электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное
связь, при которой хлор отбирает электрон у натрия,
образуя катион натрия, Na + и хлорид-анион,
Кл —. Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.Когда атомы с разницей электроотрицательностей менее двух
звенья соединяются вместе, образующаяся связь представляет собой ковалентную связь
связь , в которой электроны являются общими для обоих атомов. Когда два одинаковых атома
делят электроны в ковалентной связи,
между ними нет разницы в электроотрицательности, и
электроны в ковалентной связи являются общими равно — то
есть симметричное распределение электронов
между связанными атомами.Эти связи неполярны.
ковалентные связи . (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната между двумя одинаково сильными командами, в которой
веревка не двигается.) Например, когда два хлора
атомы соединены ковалентной связью, электроны проводят так же, как
много времени близко к одним атомам хлора, как и к другим, и
полученная молекула неполярна:
Когда разница электроотрицательностей находится в диапазоне от 0 до 2,
более электроотрицательный элемент больше притягивает общий
сильно, но недостаточно сильно, чтобы полностью удалить электроны.
образуют ионное соединение. Электроны общие
неравномерно — то есть есть несимметричный
распределение электронов между связанными атомами. Эти
связи называются полярными ковалентными связями.Чем больше
электроотрицательный атом имеет частичный отрицательный заряд ,
д — , потому что
электроны проводят больше времени ближе к этому атому, в то время как меньше
электроотрицательный атом имеет частичный положительный заряд ,
d + , потому что
электроны частично (но не полностью) отрываются от этого
атом. Например, в молекуле хлороводорода
хлор электроотрицательнее водорода на 0,96
единицы электроотрицательности. Общие электроны проводят больше времени
близко к атому хлора, что делает хлорный конец молекулы
очень слабо отрицательное (обозначено на рисунке ниже синим цветом).
заштрихованная область), в то время как водородный конец молекулы очень
слегка положительный (обозначен красной заштрихованной областью), а
полученная молекула полярна:Для молекул с более чем одной ковалентной связью
трехмерная форма молекулы и как устроены полярные связи
ориентированы друг относительно друга, определяет,
молекула полярна.Эта полярность молекул играет большую
роль в определении физических свойств соединений.
Реакционная способность: окислительно-восстановительный
Реакционная способность: окислительно-восстановительный
Реактивность в химии
Реакции восстановления и окисления
РО5. Факторы, влияющие на окислительно-восстановительный потенциал:
Термодинамические циклы
Как правило, ионы очень поздних переходных металлов —
правый конец блока переходных металлов, таких как медь, серебро и золото, имеют высокий восстановительный потенциал.
Другими словами, их ионы легко восстанавливаются. Ионы щелочных металлов — на
очень левый край периодической таблицы, такие как калий или цезий, имеют очень
отрицательные восстановительные потенциалы. Эти ионы очень трудно восстановить.
Эти тенденции неудивительны, поскольку щелочные металлы, как правило,
нижней части шкалы электроотрицательности и обычно находятся в виде катионов, а не
как нейтральные атомы. Поздние переходные металлы относительно
Поздние переходные металлы относительно
в этом случае электроотрицательны, поэтому можно ожидать, что их ионы будут притягиваться
электроны легче, чем ионы щелочных металлов.
Преимущество окислительно-восстановительного потенциала в том, что вы всегда можете посмотреть на него с
любом направлении. Окисление просто противоположно восстановлению. Насколько легко
щелочной металл теряет электрон? Если стандартный потенциал сокращения
лития очень отрицателен, то потенциал окисления иона лития очень
положительный. Если перевести электрон с водорода на литий в гору
катион, то для переноса электрона от атома лития к
протон. Ведь водород более электроотрицателен, чем любой из
щелочи. Конечно, поскольку поздний переходный металл обычно более
электроотрицательны, чем щелочной металл, медь, серебро или золото должны быть более
окисляется хуже, чем натрий или калий.
Таким образом, большие тенденции в окислительно-восстановительной химии неудивительны. Это
Это
просто вопрос перехода электрона на более низкий энергетический уровень на другом атоме.
Если мы посмотрим повнимательнее, то увидим множество
исключения из общей тенденции. Например, в монетной триаде золото
имеет самый положительный восстановительный потенциал, за ним следует серебро, затем медь.
Это прямо противоположно ожиданиям; медь, в верхней части колонны,
должен быть наиболее электроотрицательным и иметь наиболее положительное восстановление
потенциал, не в последнюю очередь. Что происходит в этих случаях?
Происходит нечто большее, чем просто движение электрона.
Помните, что при измерении восстановительного потенциала мы обычно работаем
металлическим электродом в водном растворе ионов.
Что еще происходит в этой реакции? Ну, атом, который получает
восстановленный начинается как ион в воде, но ион в воде не сидит без дела на
свой собственный. Это кислота Льюиса, электрофил. Вода является нуклеофилом,
потенциальный лиганд. Таким образом, ион в растворе на самом деле является координационным
Таким образом, ион в растворе на самом деле является координационным
сложный. Некоторое время он плавает, затем натыкается на катод, где
он подхватывает электрон. Но образовавшийся ион не остается в растворе;
он осаждается на электроде вместе с другими в своем роде. Это
становится частью металлического тела.
Таким образом, здесь происходят три разные вещи: диссоциация лиганда,
перенос электрона и образование твердого тела. Если бы мы могли получить некоторые физические данные
по каждому из этих событий, мы могли бы объяснить, почему эти сокращения
возможности противоречат ожиданиям.
Типы данных, которые у нас есть для этих отдельных шагов, на самом деле могут
лучше соответствуют противоположной реакции. Мы можем оценить энергию, вложенную в
удаление атома металла из твердого тела, потеря электрона из
металла, и связывание воды с полученным ионом. Эти данные взяты из
измерение теплоты парообразования металла, энергии ионизации
металла и энтальпии гидратации металла.
Мы можем использовать эти данные для построения термодинамического цикла. Цикл
описывает альтернативный путь от металлической меди к водному иону Cu(I).
альтернативный путь, если мы его правильно выбрали, должен дать нам довольно
хорошее представление об изменении энтальпии при восстановлении меди.
Беда в том, что все эти данные относятся к газовой фазе. Если они действительно
Применительно к этой ситуации, это было бы так, как если бы атомы металла распылялись в
воздух над электродом, отстреливал свои электроны, захватывая молекулы воды
что проплыло мимо, а затем упало в раствор. Конечно, это
не бывает; мы не видим небольшого блестящего металлического тумана, когда мы
цепь, или маленькие молнии из облака металлических атомов в
электрод, и мы не видим всплеск или шипение или маленькие щупальца пара
когда образующиеся ионы попадают в воду.
Это не имеет значения. Данные, которые у нас есть, по-прежнему очень полезны.
Это потому, что то, на что мы смотрим — разница в энергии между двумя
состояния — это функция состояния. Это означает, что не имеет значения, как мы получаем
Это означает, что не имеет значения, как мы получаем
из одного состояния в другое; общая разница всегда будет одинаковой.
Таким образом, если бы реакция происходила через газовую фазу, изменение энергии было бы
точно так же, как это происходит непосредственно на электроде — решение
интерфейс. Мы можем провести своего рода мысленный эксперимент, используя известные нам данные, и
хотя эти шаги на самом деле не происходят так, как в экспериментах
которые породили данные, они в итоге приведут в нужное место.
Это своего рода воображаемый путь для имитации реакции, о которой мы хотим узнать больше.
использует идею под названием «Закон Гесса». Часто используется для получения информации о
реакции во всей химии.
- Закон Гесса гласит, что энтальпия химического процесса одинакова,
происходит ли процесс в одну стадию или в несколько стадий. - Другими словами, энтальпия является функцией состояния.
Вот данные по меди, серебру и золоту.
| элемент | медь | серебро | золото |
| восстановительный потенциал, E o , В | +0,520 | +0,7996 | +1,83 |
| 1-я энергия ионизации, кДж/моль | 745,5 | 731 | 890 |
| теплота сублимации, кДж/моль | 313 | 265 | 355 |
| энтальпия гидратации, кДж/моль | -593 | -473 | -615 |
| ковалентный радиус, Ангстремы | 1,32 | 1,45 | 1,36 |
Собрав все эти данные вместе, мы сможем улучшить
картина общих энергетических изменений, которые произошли бы во время восстановления или,
точнее, окисление.
Прежде всего следует отметить, что медь имеет более высокую энергию ионизации.
чем серебро. Как и ожидалось, Cu + действительно труднее образовать, чем Ag + , потому что
медь более электроотрицательна, чем серебро. Но подождите минутку — Au + кажется труднее всего сформировать из всех трех.
Как если бы золото было самым электроотрицательным из этих трех элементов, но
это внизу этой колонки.
Золото действительно более электроотрицательно, чем медь или серебро. Брать
посмотрите на диаграмму электроотрицательности ниже.
Есть несколько отклонений от ожидаемых периодических тенденций, но это
один из них, вероятно, связан с явлением, называемым «лантаноидным
сокращение». Обратите внимание на ковалентные радиусы золота и серебра в
таблица выше. Обычно мы ожидаем, что атомы будут увеличиваться в размерах ряд за рядом, так как
заполняются дополнительные слои электронов. Не так для третьего
ряд переходных металлов. Чтобы увидеть возможную причину этого, вы должны
Чтобы увидеть возможную причину этого, вы должны
посмотрите на всю периодическую таблицу и впервые вспомните, что
лантаноиды и актиноиды — две нижние строки-сироты — на самом деле подходят
в середине периодической таблицы. Лантаниды, в частности
(лантан, La, иттербий, Yb), войти
между лютецием (Lu) и гафнием (Hf).
В результате третий ряд переходных металлов содержит гораздо больше
протонов в своих ядрах по сравнению с переходными металлами второго ряда
тот же столбец. В ядре серебра на десять протонов больше, чем у рубидия.
первый атом в том же ряду, что и серебро, но у золота на двадцать четыре атома больше, чем у цезия.
Третий ряд «сжимается» из-за этих дополнительных протонов.
Таким образом, исключительно положительный восстановительный потенциал Au + (и, по
связи, исключительно отрицательный потенциал окисления металлического золота) может быть
результат лантаноидного сжатия.
Как насчет меди по сравнению с серебром? Медь по-прежнему имеет более высокую
электроотрицательнее серебра, но металлическая медь легче окисляется.
Дело не в том, что медь легче отрывается от металлических связей, удерживающих
он в твердом состоянии; теплота парообразования меди немного выше, чем
серебро. Это оставляет увлажнение. На самом деле ион меди имеет
более высокая энтальпия гидратации, чем у серебра; больше энергии высвобождается, когда вода
связывается с медью, чем когда вода связывается с серебром. Разница между
эти два, по-видимому, связаны с сольватацией иона меди, что более
устойчив по отношению к металлу, чем ион серебра.
С чего бы это? Ну, медь меньше, чем серебро.
Простой взгляд на
Закон Кулона напоминает нам, что чем ближе электроны донорного лиганда
связаны с катионом, тем прочнее они будут связаны. Глядя на это
немного по-другому, медь меньше и «тверже», чем серебро, и образует
более прочная связь с водой, которая является «жестким» лигандом.
Полезно взглянуть на цикл закона Гесса для окислительно-восстановительной реакции.
подход, чтобы получить некоторое дополнительное представление о реакции.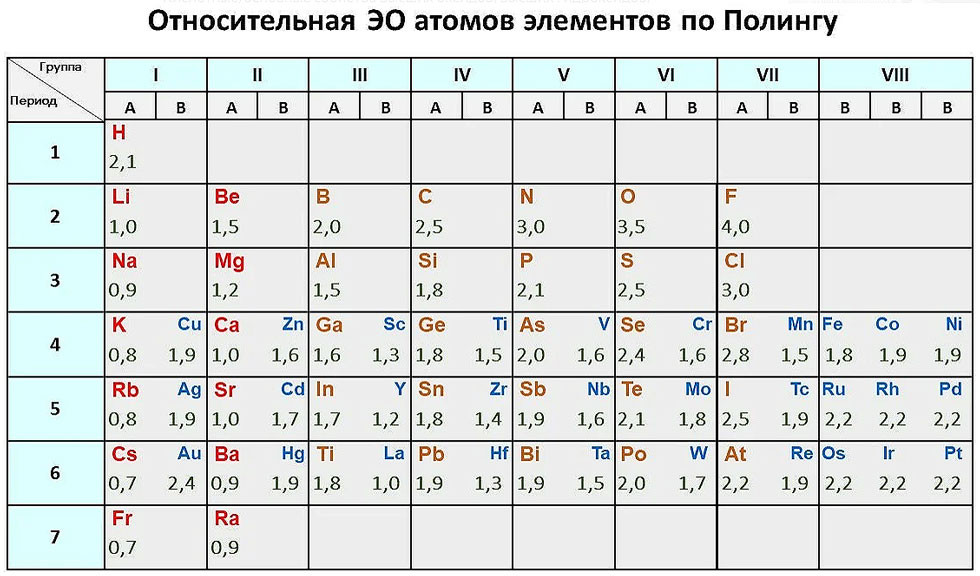 Это позволяет нам использовать
Это позволяет нам использовать
данные для оценки влияния различных аспектов реакции, которые мы не можем
оценивают непосредственно по восстановительному потенциалу, поскольку в окислительно-восстановительной реакции
все эти факторы объединены в одно число.
Проблема RO5.1.
Сравните
восстановительные потенциалы ионов лития, натрия и калия. Не могли бы вы
использовать данные о теплоте парообразования,
энергия ионизации и
энтальпии сольватации, чтобы определить, какие факторы ответственны за
порядке легкости окисления этих металлов?
Проблема RO5.2.
Сравните
восстановительные потенциалы ионов меди, никеля и цинка. Можно ли использовать данные
по теплоте парообразования,
энергия ионизации и
энтальпии сольватации, чтобы определить, какие факторы ответственны за
порядке легкости окисления этих металлов?
Проблема RO5.3.
цикла Борна-Габера — еще один пример термодинамического
циклы по закону Гесса. Эти специальные конструкции используются для
рассчитать энергию решетки ионного твердого тела: количество выделившейся энергии
когда ионы в газовой фазе конденсируются, образуя ионную решетку. Этот
Этот
количество не может быть легко измерено напрямую.
Альтернативный путь в цикле Борна-Габера
воображает, что отдельные ионы в решетке сначала образуются из
отдельные элементы. Теплота образования ионного твердого тела из
элементы обычно известны (или их легко найти в Интернете, герр Борн и герр
любимый инструмент Габера для вечернего расслабления), как и другие физические параметры
такие как энтальпия сублимации, энергия ионизации, сродство к электрону и т.д.
на.
Построить диаграммы для цикла Борна-Габера и
оцените энергию решетки в каждом из следующих случаев.
а) LiCl
б) CaF 2 c)
HgO г) ZnS
Некоторые полезные данные можно найти ниже. Обратите внимание, что
энтальпия является функцией состояния, поэтому энтальпия сублимации примерно равна
энтальпия плавления плюс энтальпия испарения.
| т.пл. (°С) | п.н. (°С) | ΔH сплав (кДж/моль) | ΔH пары (кДж/моль) | ИЭ 1 (кДж/моль) | ИЭ 2 (кДж/моль) | E ea1 (кДж/моль) | E ea2 (кДж/моль) | |
| литий | 180 | 1330 | 3 | 136 | 520 | 7298 | -50 | — |
| кальций | 842 | 1484 | 9 | 155 | 590 | 1155 | — | — |
| цинк | 419 | 907 | 7 | 115 | 906 | 1733 | — | — |
| ртуть | -39 | 356 | 2 | 59 | 1007 | 1810 | 85 | — |
| кислород | -218 | -183 | 0,4 | 7 | 1314 | 3388 | -226 | 879 |
| фтор | -219 | -188 | — | 7 | 1681 | 3374 | -347 | — |
| сера | 115 | 444 | 2 | 45 | 1000 | 2252 | -100 | 435 |
| хлор | -101 | -34 | 6 | 20 | 1250 | 2298 | -368 | — |
Проблема RO5.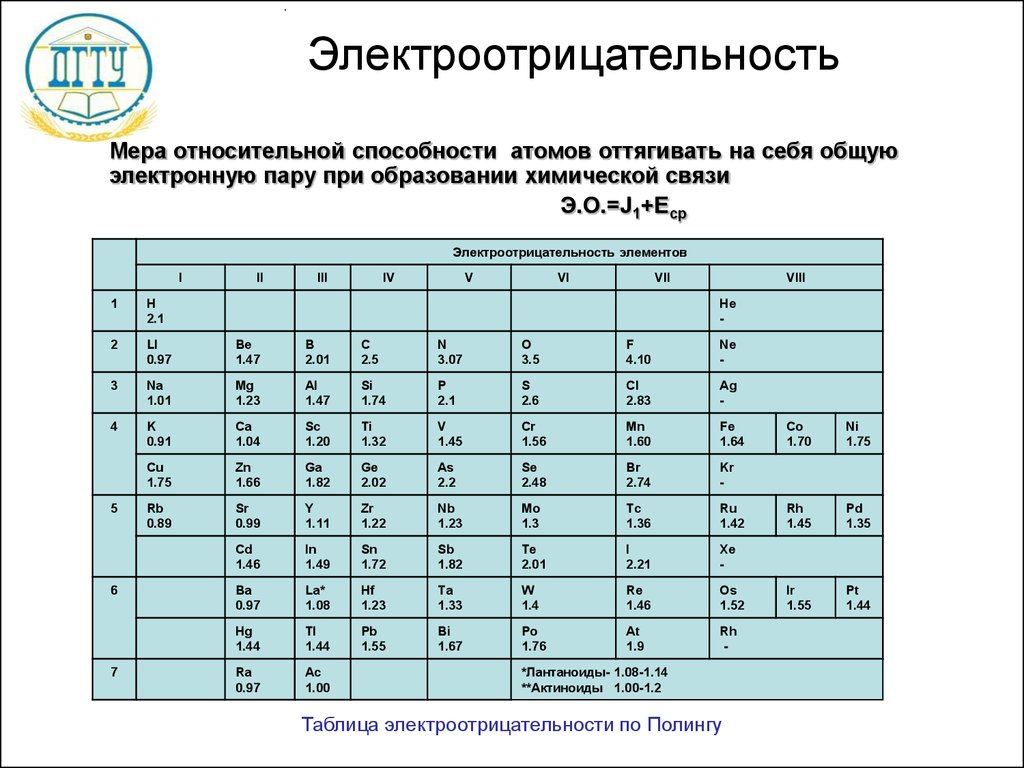 4.
4.
Термодинамические циклы, такие как те, которые мы использовали здесь
обычно используются для определения физических данных в химии.
Например, сила связи является фундаментальной для химии,
но как определить силу связи? Недавний пример взят из
работники Университета Миннесоты (Касс, Ж. Орг. Химия . 2016 ,
81 , 9175-9179), который изучал конкретную связь в фенилциклопропане.
а) Нарисуйте термодинамический цикл, в котором
описанная выше реакция повторяется следующими шагами:
i) фенилциклопропан
ионизируется с образованием протона и аниона фенилциклопропана
ii)
анион фенилциклопропана отдает один электрон
iii) протон приобретает
электрон
b) Чтобы изучить шаг (i), они
в масс-спектрометр вводили гидроксид-ион и фенилциклопропан.
Покажите равновесие, которое получится.
c) Они измерили
прямой ( k f = 2,0 x 10 -9 с -1 ) и обратный ( k r = 1,9 x 10 -11 с 1. 5 с 1
5 с 1
Оцените константу равновесия, K eq .
г) Рассчитайте свободную энергию этой реакции, используя ΔG =
-РТ lnK экв. .
e) Реакцию в (b) также можно разбить на термодинамическую
цикл с:
i) фенилциклопропан ионизируется с образованием протона плюс
фенилциклопропановый анион.
iv) вода ионизируется с образованием протона и гидроксида
ион.
Нарисуйте этот цикл.
е) Бесплатно
энергия стадии (iv) рассчитывается исходя из кислотности газовой фазы воды (ΔG =
383,7 ккал/моль). Вы уже рассчитали свободную энергию (b).
Что такое ΔG
шаг (и)?
г) Для изучения шага (ii) они обработали
аниона фенилциклопропана с различными нейтральными молекулами и искали
появление соответствующих анионов в масс-спектрометре, указывающее на электрон
передача произошла.
Они получили следующие данные:
Компд Х | Сродство к электрону (эВ) | Электронный перенос? |
| SO 2 | 1,107 | да |
| С 6 F 5 Класс | 0,82 | да |
| о-CF 3 C 6 H 4 CN | 0,70 | нет |
| ЧС 2 | 0,51 | № |
Оценить сродство к электрону фенилциклопропила
радикальный.
h) Это числовое значение соответствует восстановительному потенциалу фенилциклопропильного радикала.
в вольтах. Рассчитайте свободную энергию этого переноса электрона, используя ΔG
= — n F E или . (n — число переданных электронов; F — постоянная Фарадея,
23 ккал В -1 моль -1 )
j) Этап (iii) – хорошо установленная величина, сродство к электрону
протона, для которого ΔG = -313,6 ккал/моль.
Рассчитайте энергию диссоциации связи
фенилциклопропан.
Этот сайт написан и поддерживается Крисом П. Шаллером, доктором философии, Колледж Святого Бенедикта / Сент-Джонс
University (при участии других авторов, как уже отмечалось). Это свободно
доступны для использования в образовательных целях.
Структура и реакционная способность в органической, биологической и неорганической химии Криса Шаллера находится под лицензией Creative Commons Attribution-NonCommercial 3.

 д.
д. Химические элементы в порядке возрастания относительной электроотрицательности (X) по Полингу (Pauling)
Химические элементы в порядке возрастания относительной электроотрицательности (X) по Полингу (Pauling) Введите свой запрос:
Введите свой запрос:

 д.
д. д.
д. д.
д. 01
01 10
10 ст.
ст. д.
д. 10
10
