Физические свойства меди таблица 8 класс: Сравните физические свойства меди и серы
Содержание
Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Охарактеризуйте свойства и применение меди. § 22-29, вопрос 4. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Охарактеризуйте свойства и применение меди. § 22-29, вопрос 4. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Интересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Привет, поможете? Охарактеризуйте свойства и применение меди. Приведите соответствующие уравнения реакций.
Приведите соответствующие уравнения реакций.
Лучший ответ
Привет, поможем, конечно, почему бы и нет)
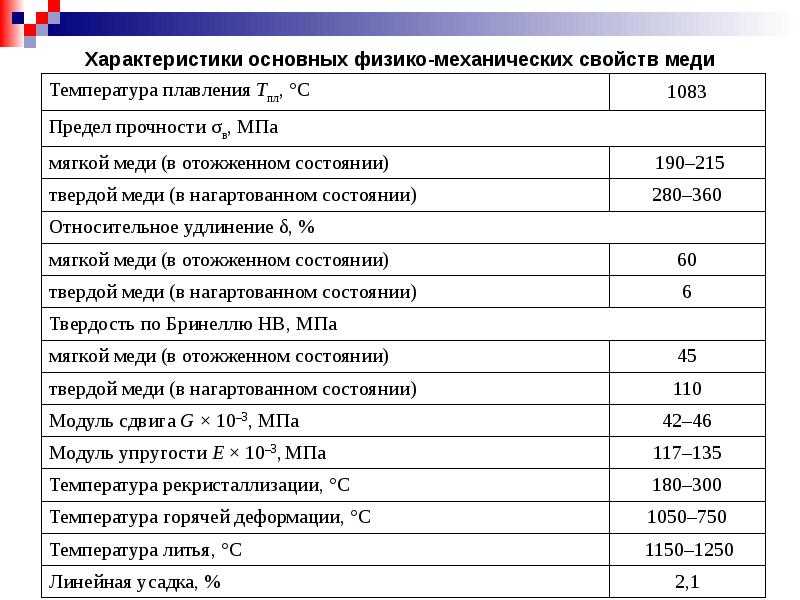
Физические свойства. Металл красноватого цвета, температура плавления 1083 °С, плотность 11,3 г/см3. Очень хороший проводник тепла и электрического тока.
Химические свойства. При нагревании реагирует с кислородом, серой, галогенами.
2Cu + O2 = 2CuO
Cu + S = CuS
Cu +Сl2 = СuСl2
Медь в ряду напряжений находится правее водорода, поэтому не реагирует с кислотами с выделением водорода. Однако при на
гревании медь реагирует с концентрированной серной и азотной кислотами, проявляя восстановительные свойства.
Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2О
Cu + 4НNО3 = Сu(NО3)2 + 2NO2 + 2Н2О
Применение. Медь обладает высокой электропроводностью и поэтому широко применяется в электротехнике для изготовления проводов, контактов, обмоток трансформаторов и электродвигателей и т. п. Медь входит в состав многих сплавов (бронза, латунь), применяемых в машиностроении.
п. Медь входит в состав многих сплавов (бронза, латунь), применяемых в машиностроении.
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее. ..)
..)
Поступление11 классЕГЭНовости
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Q5 Некоторые свойства перечислены в следующей таблице. Различайте металлы и неметаллы на…
Перейти к
- Упражнение
- Растениеводство и управление
- Микроорганизмы: друг и враг
- Синтетические волокна и пластик
- Материалы: металлы и неметаллы
- Уголь и нефть
- Горение и пламя
- Сохранение растений и животных
- Клетка — структура и функции
- Размножение животных
- Достижение подросткового возраста
- Сила и давление
- Трение
- Звук
- Химические эффекты и электрический ток
- Некоторые природные явления
- Свет
- Звезды и Солнечная система
- Загрязнение воздуха и воды
Главная >
Решения НЦЭРТ
Класс 8
Наука
>
Глава 4 — Материалы: металлы и неметаллы
>
Упражнение
>
Вопрос 16
Вопрос 16 Упражнение
В5) Некоторые свойства перечислены в следующей таблице.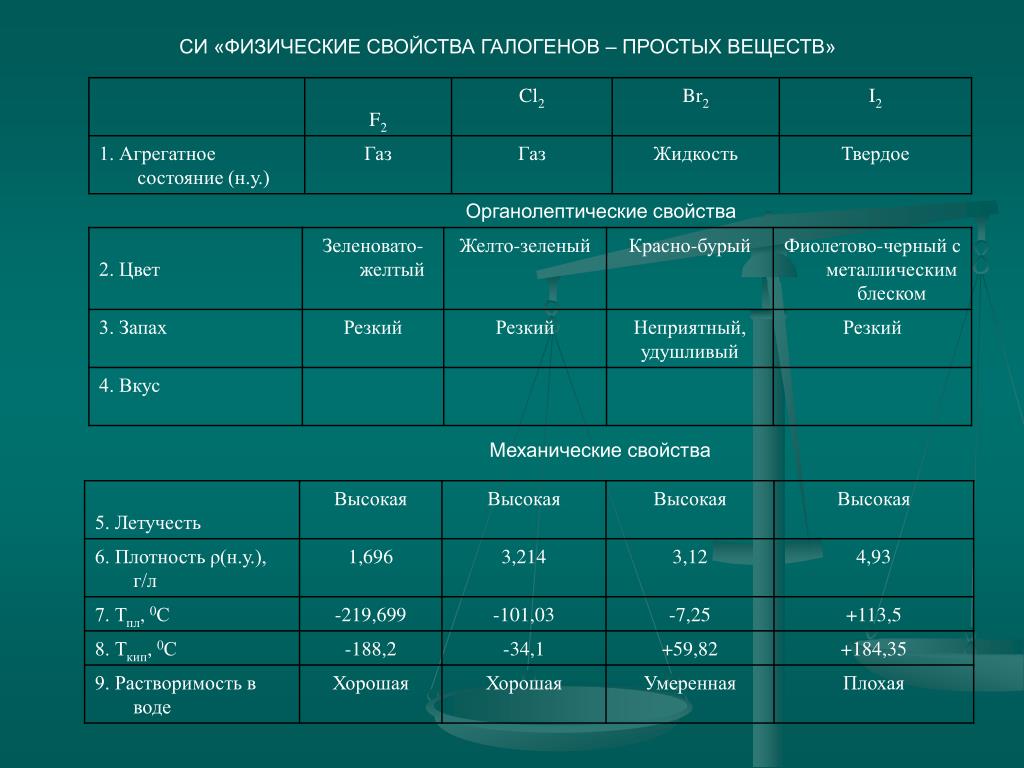 По этим свойствам различают металлы и неметаллы.
По этим свойствам различают металлы и неметаллы.
| Свойства | Металлы | Неметаллы |
|---|---|---|
| Внешний вид | ||
| Твердость | ||
| Пластичность | ||
| Пластичность | ||
| Теплопроводность | ||
| Электропроводка |
Ответ:
Решение 5:
| Свойства | Металлы | Неметаллы |
|---|---|---|
| Внешний вид | Блестящий | Тусклый |
| Твердость | Жесткий | Мягкий |
| Пластичность | Ковкий | Непластичный |
| Пластичность | Ковкий | Непластичный |
| Теплопроводность | Хороший проводник тепла | Плохой проводник тепла |
| Электропроводка | Хороший проводник электричества | Плохой проводник электричества |
Стенограмма видео
«Здравствуйте, все приветствуем вас на домашней книжной сессии Lido для взрослых. Мы собираемся решить научную задачу, поэтому давайте начнем с вопроса в этом вопросе, некоторые свойства перечислены ниже. Таблица различает металлы и неметаллы на основе этих свойств, продаваемых в этой таблице.У нас есть такие свойства, как внешний вид, твердость, подвижность, теплопроводность, поэтому мы должны различать металлы и неметаллы на основе свойств, поэтому давайте начнем с внешнего вида в случае медали. металлическое седло Астрос.
Почему газонные металлы – это доктор.
Металлы твердости тверды, а неметаллы мягки в металлах, податливы в случае неметаллов.
доступность означает, что это моя способность означает место, где Металлы податливы.
Сделанный в листах металл, превращенный в тонкие листы, называется подвижностью.
Некоторые металлы можно сваривать в тонкие листы. Где неметаллы не податливы?
Где неметаллы не податливы?
активность узла
в случае метров, доктор Питер Фрэнсис заплатил, где металл может быть металлом, а неметалл может быть превращен в провода. летний соблазнительный
твердый непластичный
и я вступлю в теплопроводность.
Металлы — очень хорошие проводники тепла Металлы — хорошие проводники тепла. тревожные металлы — это не металлы, грустные или плохие проводники тепла.
Теперь перейдем к проводимости электричества.
Опять же, металлы являются хорошими проводниками тепла, хорошими проводниками электричества, поглощающими электричество, а там, где северные метры, являются 404 проводниками или плохими проводниками электричества. Душа моей подруги толстовки этих свойств металлов классифицируются как твердые податливые податливые податливые хорошие проводники и кит и так почему к неметаллам приходят мягкие податливые и податливые плохие проводники тепла теплопроводность и плохие проводники электричества поэтому мы различаем металлы и неметаллы, основанные на их свойствах, теперь, мой дорогой друг. Надеюсь, вы поняли это решение, если у вас есть какие-либо сомнения, пожалуйста, прокомментируйте ниже, если вам нравится это видео. Пожалуйста, поставьте большой палец вверх и подпишитесь на канал, спасибо всем.»
Надеюсь, вы поняли это решение, если у вас есть какие-либо сомнения, пожалуйста, прокомментируйте ниже, если вам нравится это видео. Пожалуйста, поставьте большой палец вверх и подпишитесь на канал, спасибо всем.»
Связанные вопросы
**Что из нижеперечисленного можно измельчить в тонкие листы?****(а) Цинк****(б) Фосфор****(в) Сера…
Что из нижеперечисленного не является металлом? (а) медь (б) сера (в) алюминий (г) железо
В1) Что из перечисленного можно растолочь в тонкие листы? (а) Цинк (б) Фосфор (в) Сера (г) Бык…
**Назовите нефтепродукт, используемый для покрытия дорог.**
**Какое из следующих утверждений верно?****(а) Все металлы пластичны.****(б) Все неметаллы. ..
..
Q2) Какое из следующих утверждений верно? (a) Все металлы пластичны. (b) Все неметаллы d…
Фейсбук
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнения
Главы
Растениеводство и управление
Микроорганизмы: друзья и враги
Синтетические волокна и пластик
Материалы: металлы и неметаллы
Угля и нефть
Сгорание и пламя
Сохранение растений и животных
Клетка — Структура и функции
Репродукция у животных
Достижение возраста подростка
Сила и давление
Sound
Cemical Chemical
. Эффекты и электрический ток
Эффекты и электрический ток
Некоторые природные явления
Свет
Звезды и Солнечная система
Загрязнение воздуха и воды
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Элементы группы 1: щелочные металлы
Элементы группы 1:
Эти элементы известны как щелочные металлы.
Физические свойства элементов группы 1
1. В таблице показаны некоторые свойства элементов группы 1.
| Element | Proton number | Nucleon number | Density (g cm -3 ) | Hardness (Brinell) | Melting point (°C) | Температура кипения (°C) | Атомный радиус (нм) | Electro negativity |
| Lithium | 3 | 7 | 0. 53 53 | 0.06 | 181 | 1347 | 0.15 | 1.0 |
| Sodium | 11 | 23 | 0.97 | 0.07 | 98 | 886 | 0.19 | 0.9 |
| Potassium | 19 | 39 | 0.86 | 0.04 | 64 | 774 | 0.23 | 0.8 |
| Rubidium | 37 | 85 | 1.53 | 0.03 | 39 | 688 | 0.25 | 0.8 |
| Caesium | 55 | 133 | 1.87 | 0.02 | 28 | 678 | 0.26 | 0.7 |
| Francium | 87 | 223 | 2.40 | ? | 27 | 677 | 0,29 | 0,7 |
2. Общие физические свойства группы 1 Элементы:
- .
 Alkali Elements:
Alkali Elements: - 9
- Alkali Metements
- 9000 40004
- . Alkali Metements
- . свежесрезанный.
- Эти поверхности тускнеют под воздействием воздуха.
- Это связано с тем, что щелочные металлы очень реакционноспособны. Они быстро реагируют с кислородом и водяным паром в воздухе при воздействии.
- Щелочные металлы являются мягкими твердыми веществами и легко поддаются резке.
- Щелочные металлы имеют низкую плотность по сравнению с тяжелыми металлами, такими как железо и медь.
- Щелочные металлы являются хорошими проводниками из тепла и электричества.
- Щелочные металлы имеют низкую температуру плавления и температуру кипения по сравнению с тяжелыми металлами, такими как медь и железо.
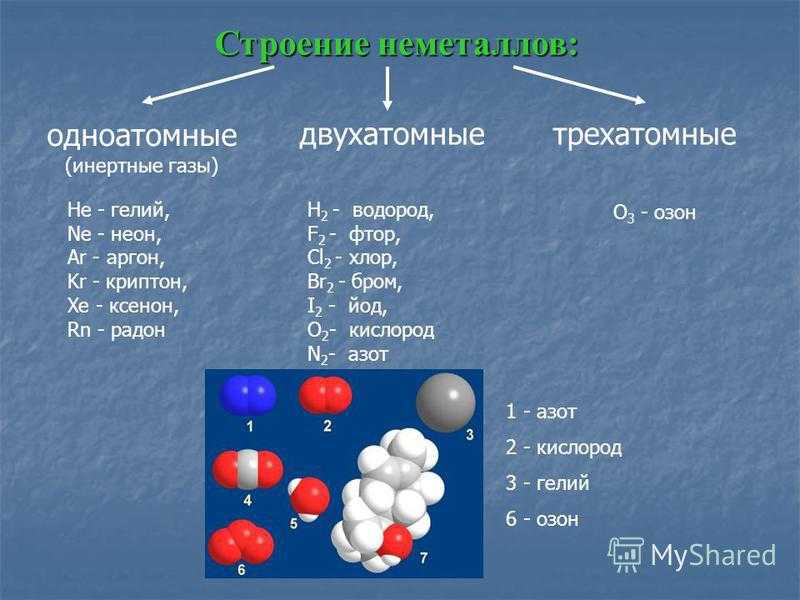
В таблице сравниваются температуры плавления и кипения калия (щелочного металла) и меди (тяжелого металла).
Element Potassium Copper Melting point (°C) 64 1083 Boiling point (°C) 774 2567 3. Тенденция изменения физических свойств
Физические свойства элементов изменяются постепенно при переходе вниз по группе 1 как показано в табл.Group 1 elements Trend of change in the physical properties The atomic radius (atomic size) of alkali metals increases gradually down the group. 
Причина:
число оболочек , занятых электронами , увеличивается на вниз по группе.Хотя щелочные металлы имеют низкую плотность, плотность постепенно увеличивать вниз по группе. Например:
Литий, натрий и калий менее плотны, чем вода. Таким образом, эти металлы плавают на поверхности воды.
Рубидий, цезий и франций плотнее воды. Таким образом, эти металлы тонут в воде.Металлическая связь означает химическую связь, которая удерживает атомы вместе в металле.
Хотя щелочные металлы имеют низкие температуры плавления и кипения, температуры плавления и кипения постепенно снижаются вниз по группе. Причина:
По мере увеличения размера атома вниз по группе металлическая связь между атомами щелочных металлов становится слабее.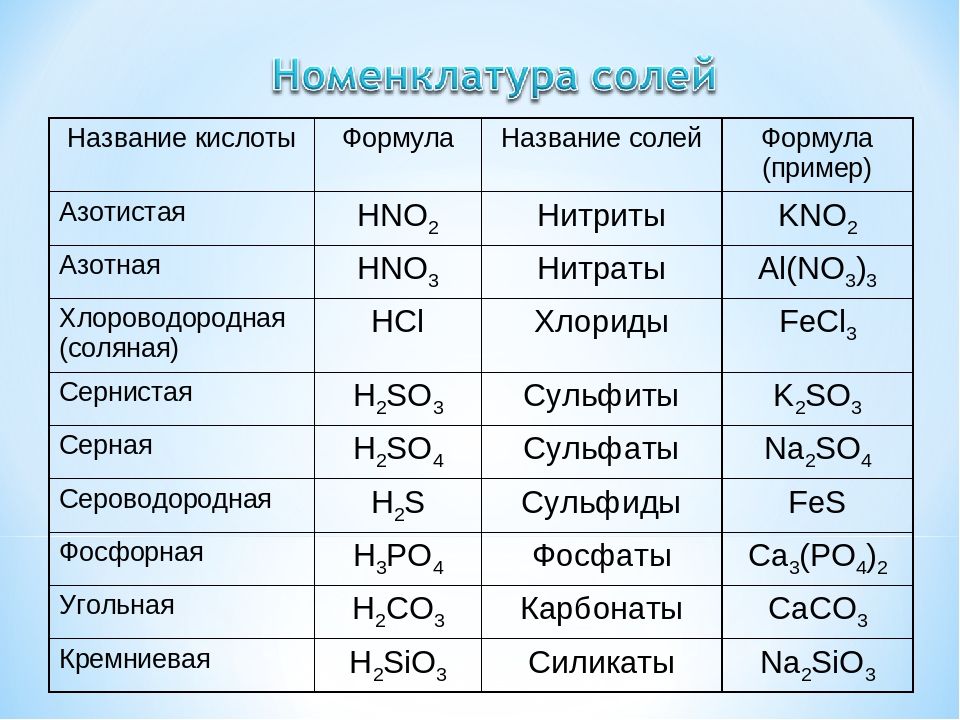 Следовательно, требуется меньше тепловой энергии для преодоления более слабой металлической связи при плавлении или кипении при движении вниз по группе.
Следовательно, требуется меньше тепловой энергии для преодоления более слабой металлической связи при плавлении или кипении при движении вниз по группе.Щелочные металлы становятся мягче вниз по группе. Люди также спрашивают
- Что такое периодическая таблица элементов?
- Физические и химические свойства элементов 18 группы
- Физические и химические свойства элементов 17 группы
- Что вы подразумеваете под переходными металлами?
- Для чего нужна классификация элементов?
- Современная таблица Менделеева и ее значение
- Как Менделеев составил таблицу Менделеева?
- Периодические тренды свойств элементов
- Что такое валентность и атомный радиус?
- Что такое металлические и неметаллические свойства?
Химические Свойства элементов группы 1
1.
 В таблице показано электронное расположение щелочных металлов.
В таблице показано электронное расположение щелочных металлов.Element Electron arrangement Lithium 2.1 Sodium 2.8.1 Potassium 2.8.8.1 Rubidium 2.8.18.8.1 Caesium 2.8.18.18.8.1 Francium 2.8.18.32.18.8.1 2. Сходные химические свойства
- Все щелочные металлы проявляют сходные химические свойства.
- Это связано с тем, что все атомы щелочных металлов имеют один валентный электрон.
3. Реакционная способность
Щелочные металлы очень реакционноспособны.
Хотя щелочные металлы обладают сходными химическими свойствами, они отличаются реакционной способностью.
Реакционная способность щелочных металлов увеличивается при переходе в группу 1. или октетное расположение электронов).более легкий атом щелочного металла высвобождает свой единственный валентный электрон, более реактивный является щелочным металлом.
Объяснение:
Повышение реакционной способности щелочных металлов по группе 1 можно объяснить следующим образом.- Все щелочные металлы имеют один валентный электрон.
- Каждый атом щелочного металла высвобождает один валентный электрон во время химической реакции для достижения стабильный дуплет или октет расположение электронов. Следовательно, образуется ион с зарядом +1.
- При движении вниз по группе 1 атомный размер щелочных металлов увеличивается .

- Одновалентный электрон становится дальше от ядра и экранируется большим количеством внутренних оболочек, содержащих электроны.
- При движении вниз по группе 1 атомный размер щелочных металлов увеличивается .
- Это означает, что эффективный заряд ядра ощущается одним валентным электроном уменьшается на при спуске по группе.
- Это приводит к тому, что силы притяжения между ядром и одновалентным электроном становятся слабее, поэтому одиночный валентный слабее притягивается ядром.
- Следовательно, один валентный электрон может быть легче высвобожден при движении вниз по группе.
- В результате реакционная способность щелочных металлов увеличивается вниз по группе.
4. В качестве восстановителей
- Восстановители являются хорошими донорами электронов в химических реакциях.
- Щелочные металлы являются хорошими восстановителями, потому что одновалентный электрон в атоме каждого щелочного металла может быть легко высвобожден для достижения стабильного электронного расположения благородного газа (хорошего донора электронов).

- Прочность щелочных металлов в качестве восстановителей увеличивается при понижении группы 1.
- Это происходит потому, что одиночный валентный электрон щелочных металлов становится намного легче высвобождаться при движении вниз по группе.
5. Электроположительность
- (a) Определение:
Электроположительность элемента – это мера способности атома отдавать электроны в виде положительных ионов.- Щелочные металлы очень электроположительны.
- Это связано с тем, что атом каждого щелочного металла может легко высвобождать свой единственный валентный электрон, образуя положительный ион.
- Однако Электропозитивность из щелочных металлов увеличивается , когда в группе вниз 1.
Это можно объяснить, как ниже:
- Atomic Размер из Alkali Metals Metals до до до до до до до до до до до .
 франций.
франций. - Одновалентный электрон в самой внешней занятой оболочке становится дальше от ядра и экранируется большим количеством внутренних оболочек, содержащих электроны.
- Итак, силы притяжения между ядром и одновалентным электроном ослабевают при движении вниз по группе 1.
- Это приводит к тому, что одновалентный электрон легче высвобождается при движении вниз по группе 1.
- В результате, электроположительность щелочных металлов увеличивается при движении вниз по группе.
6. Элементы группы 1 проявляют сходные химические свойства в реакциях с
- вода для выделения газообразного водорода и образования гидроксида металла.
- кислород для получения оксидов металлов.
- хлор для производства хлорида металла.

- бром для производства бромида металла.
7. Для предсказания свойств рубидия, цезия и франция
- Рубидий, цезий и франций расположены ниже калия в 1-й группе Периодической таблицы.
- Следовательно, ожидается, что рубидий, цезий и франций будут реагировать с водой, кислородом, хлором или бромом аналогично калию, но эти реакции более энергичны (более реактивны) , чем калий.
- Например:
8. Растворимость солей щелочных металлов.
- Эти соли растворимы в воде. Они растворяются в воде, образуя бесцветные растворы.
9. Меры предосторожности при обращении с элементами группы 1
- Щелочные металлы очень реакционноспособны.
- Щелочные металлы при воздействии на них могут реагировать с кислородом и водяным паром в воздухе.

- Следовательно, щелочные металлы, такие как литий, натрий и калий, должны храниться в парафиновом масле, тогда как рубидий и цезий хранятся в герметичных стеклянных пробирках. Это необходимо для предотвращения их реакции с кислородом и водяным паром в воздухе.
- Следующие меры предосторожности необходимо соблюдать при работе с щелочными металлами.
- Не держите высокореакционноспособные щелочные металлы голыми руками.
- Во время эксперимента наденьте защитные очки и перчатки .
Химические свойства элементов 1 группы Опыт 1
Цель: Исследовать химические свойства металлов 1 группы в их реакциях с водой и кислородом.
Постановка задачи: Как металлы группы 1 реагируют с водой и кислородом?А. Реакции щелочных металлов с водой
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в реакциях с водой.

Переменные:
(a) Управляемая переменная: Различные типы щелочных металлов
(b) Реагирующая переменная: Реакционная способность щелочных металлов
(c) Управляемые переменные: Вода, размер щелочных металлов
Рабочее определение: Щелочной металл, который более энергично и быстро реагирует с водой, является более реакционноспособным металлом. Материалы: Маленькие кусочки лития, натрия и калия, дистиллированная вода, красная лакмусовая бумага и фильтровальная бумага.
Оборудование: Поилки, небольшой нож и щипцы.
Меры предосторожности:
Не прикасайтесь голыми руками к чрезвычайно химически активным щелочным металлам.
Всегда надевайте защитные очки и перчатки.
Процедура:
A. С помощью ножа вырезается небольшой кусочек лития.- Масло с поверхности лития удаляют, прокатывая его по кусочку фильтровальной бумаги.

- Затем литий медленно помещают на поверхность воды в желобе с помощью щипцов, как показано на рисунке.
- Все происходящие изменения записываются.
- Когда реакция прекратится, образовавшийся раствор проверяют красной лакмусовой бумажкой.
- Шаги с 1 по 5 повторяются с использованием натрия и калия соответственно для замены лития.
Observations:
Alkali metal Observation Lithium Lithium moves slowly on the water surface with a soft ‘hiss’ sound. Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет . Натрий Натрий плавится, превращаясь в маленькую сферу, быстро перемещается и случайным образом на поверхности воды с шипящим звуком.  Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет .
Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет .Калий Калий плавится, превращаясь в маленькую сферу, горит сиреневым пламенем, перемещается очень быстро и случайным образом по поверхности воды с шипением и хлопком. Образуется бесцветный раствор , который окрашивает красную лакмусовую бумагу в синий цвет . Обсуждение:
- Щелочные металлы шипят и толкают по поверхности воды, как судно на воздушной подушке. Это из-за выделения газообразного водорода , когда они реагируют с водой.
- Литий, натрий и калий реагируют с водой с образованием бесцветного газа («шипящий» звук) и щелочного раствора (гидроксид металла), который окрашивает красную лакмусовую бумажку в синий цвет.
 Следовательно, литий, натрий и калий обладают сходными химическими свойствами.
Следовательно, литий, натрий и калий обладают сходными химическими свойствами. - Наблюдения также показывают, что реакционная способность щелочных металлов в их реакциях с водой возрастает от лития → натрия → калия.
- Щелочные металлы реагируют с водой с образованием раствора гидроксида металла (щелочного раствора) и газообразного водорода.
B. Реакции щелочных металлов с кислородом
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с кислородом.
Переменные:
(a) Управляемая переменная: Различные типы щелочных металлов
(b) Реагирующая переменная: Реакционная способность щелочных металлов
(c) Управляемые переменные: Газообразный кислород, размер щелочных металлов
Рабочее определение: Щелочь металл, который горит быстрее и энергичнее в кислороде, является более реакционноспособным металлом.
Материалы: Маленькие кусочки лития, натрия и калия, фильтровальная бумага, красная лакмусовая бумага и три наполненных газовых баллона
с газообразным кислородом.
Аппаратура: Пинцет, ложка для газового баллона, маленький нож и горелка Бунзена.
Процедура:- С помощью ножа вырезается небольшой кусочек лития.
- Масло с поверхности лития удаляют, раскатывая его на кусочке фильтровальной бумаги.
- Затем литий нагревают в газовой ложке до тех пор, пока он не начнет гореть.
- Затем ложку газового баллона с горящим литием быстро опускают в газовый баллон, наполненный газообразным кислородом, как показано на рисунке.
- Происходящие изменения записываются.
- Когда реакция прекратится, в газовый баллон наливают 10 см3 дистиллированной воды и хорошо встряхивают.
- Образовавшийся раствор проверяют красной лакмусовой бумажкой.
- Шаги с 1 по 7 повторяются с использованием натрия и калия соответственно для замены лития.
Наблюдения:
Щелочной металл Наблюдение Литий Литий горит медленно красным пламенем с выделением белого дыма, который при охлаждении до комнатной температуры превращается в белое твердое вещество . Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор окрашивает красную лакмусовую бумажку в синий цвет. Натрий Натрий горит быстро и ярко с желтым пламенем и выделяет белый дым, который превращается в белое твердое вещество при охлаждении до комнатной температуры. Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор окрашивает красную лакмусовую бумажку в синий цвет. 
Калий Калий горит очень быстро и ярко с сиреневым пламенем и выделяет белые пары, которые превращаются в белое твердое вещество при охлаждении до комнатной температуры. Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор окрашивает красную лакмусовую бумажку в синий цвет. Обсуждение:
- Литий, натрий и калий сгорают в кислороде соответственно с образованием белых паров , которые затем превращаются в белое твердое вещество (оксид металла). Белое твердое вещество растворяется в воде с образованием щелочного раствора (гидроксида металла). Следовательно, можно сделать вывод, что эти щелочные металлы обладают сходными химическими свойствами.
- Из яркости пламени и скорости горения можно сделать вывод, что реакционная способность щелочных металлов в их реакциях с газообразным кислородом увеличивается из лития → натрия → калия.

- Все щелочные металлы реагируют с газообразным кислородом при нагревании с образованием белых твердых оксидов металлов.
- Образующиеся белые твердые оксиды металлов растворяются в воде с образованием щелочных растворов гидроксидов металлов.
Заключение:
Щелочные металлы проявляют аналогичные химические свойства в своих реакциях с водой или газообразным кислородом. реакционная способность щелочных металлов увеличивает вниз по группе 1. Следовательно, можно принять предложенную гипотезу.Химические свойства элементов 1 группы Опыт 2
Цель: Исследовать химические свойства металлов 1 группы в их реакциях с хлором и бромом.
Постановка задачи: Как металлы группы 1 реагируют с хлором и бромом?
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с хлором или бромом.
Переменные:
(a) Управляемая переменная: Различные типы щелочных металлов
(b) Отвечающая переменная: Реакционная способность щелочных металлов
(c) Управляемые переменные: Хлор и бром, размер щелочных металлов
Рабочее определение: Щелочной металл, который более энергично и быстро реагирует с газообразным хлором или бромом, является более реакционноспособным металлом.
Материалы: Маленькие кусочки лития, натрия и калия, фильтровальная бумага, три газовых баллона, наполненных газообразным хлором, и три газовых баллона, наполненных парами брома.
Аппаратура: Горелка Бунзена, щипцы, ложка для газового баллона и маленький нож.
Меры безопасности:
Газообразный хлор и пары брома ядовиты. При работе с этими галогенами надевайте перчатки и защитные очки.
Процедура:- С помощью ножа вырезается небольшой кусочек лития.

- Масло с поверхности лития удаляют, прокатывая его по кусочку фильтровальной бумаги.
- Затем литий нагревают в газовой ложке до тех пор, пока он не начнет гореть.
- Затем ложку газового баллона с горящим литием быстро опускают в газовый баллон, наполненный газообразным хлором, как показано на рисунке.
- Происходящие изменения записываются.
- Шаги с 1 по 5 повторяются с использованием натрия и калия соответственно для замены лития.
- Шаги с 1 по 6 повторяются с использованием паров брома вместо газообразного хлора.
Observations:
Alkali metal Observation Chlorine gas Bromine vapour Lithium Lithium burns slowly with a красное пламя и высвобождает белый дым , который становится белое твердое вещество в конце реакции. 
Литий горит медленно красным пламенем и выделяет белые пары , которые в конце реакции превращаются в белое твердое вещество . Красновато-коричневые пары брома обесцвечиваются. Натрий Натрий горит быстро и ярко с желтым пламенем и выделяет белый дым который превращается в белое твердое вещество в конце реакции. Натрий горит быстро и ярко желтым пламенем и выделяет белые пары , которые в конце реакции превращаются в белое твердое вещество . Красновато-коричневые пары брома обесцвечиваются.
Калий Калий горит очень быстро и ярко сиреневым пламенем и освобождает белые пары , которые в конце реакции превращаются в белое твердое вещество . 
- .
