Формула скорость коррозии: Скорость коррозии металла | corrosio.ru
Содержание
Коррозия
Коррозия Коррозия представляет собой процесс разрушения металла в результате химических или электрохимических процессов. Электрохимическая коррозия – коррозия металла в электролите. Применительно к процессам водоподготовки электролитом является вода. Не имеет существенного значения и количество влаги. Коррозия возникнет даже в слое влаги толщиной в несколько десятков мкм. Основные процессы при электрохимической коррозии: анодный переход атомов металла в раствор; катодная ассимиляция электронов на катоде. Перенос заряда между катодом и анодом осуществляется электронами или ионами (в растворе).
Коррозия Коррозия представляет собой процесс разрушения металла в результате химических или электрохимических процессов. Электрохимическая коррозия – коррозия металла в электролите. Применительно к процессам водоподготовки электролитом является вода. Не имеет существенного значения и количество влаги. Коррозия возникнет даже в слое влаги толщиной в несколько десятков мкм. Основные процессы при электрохимической коррозии: анодный переход атомов металла в раствор; катодная ассимиляция электронов на катоде. Перенос заряда между катодом и анодом осуществляется электронами или ионами (в растворе). Система «анод–электролит–катод» представляет собой короткозамкнутый гальванический элемент. Главную роль в электрохимической коррозии играют микрогальванические элементы, роль катодов и анодов в которых могут выполнять микровключения примесей металла, отдельные атомы, микропоры оксидной пленки на поверхности металла и т.д. Железо термодинамически неустойчиво в воде и стремится к растворению в ней. Достаточно минимальной неоднородности, чтобы возникла возможность перехода Fe в состояние Fe2+, инициирующего процесс электрохимической коррозии. Металл становится поставщиком электронов и играет роль анода. А кислород перехватывает электроны и играет роль катода. Анод (окисление): Fe>Fe2+ + 2e-. Катод (восстановление): 2Н2О + 2e->Н2 + 2ОН- (нейтральная вода) О2 + 2Н2О+ 4e-> 4ОН- (аэрированная вода) 2Н+ + 2e->Н2 (кислые воды) О2+4Н++ 2e->2 Н2О (кислая, аэрированная вода).
Основные процессы при электрохимической коррозии: анодный переход атомов металла в раствор; катодная ассимиляция электронов на катоде. Перенос заряда между катодом и анодом осуществляется электронами или ионами (в растворе). Система «анод–электролит–катод» представляет собой короткозамкнутый гальванический элемент. Главную роль в электрохимической коррозии играют микрогальванические элементы, роль катодов и анодов в которых могут выполнять микровключения примесей металла, отдельные атомы, микропоры оксидной пленки на поверхности металла и т.д. Железо термодинамически неустойчиво в воде и стремится к растворению в ней. Достаточно минимальной неоднородности, чтобы возникла возможность перехода Fe в состояние Fe2+, инициирующего процесс электрохимической коррозии. Металл становится поставщиком электронов и играет роль анода. А кислород перехватывает электроны и играет роль катода. Анод (окисление): Fe>Fe2+ + 2e-. Катод (восстановление): 2Н2О + 2e->Н2 + 2ОН- (нейтральная вода) О2 + 2Н2О+ 4e-> 4ОН- (аэрированная вода) 2Н+ + 2e->Н2 (кислые воды) О2+4Н++ 2e->2 Н2О (кислая, аэрированная вода).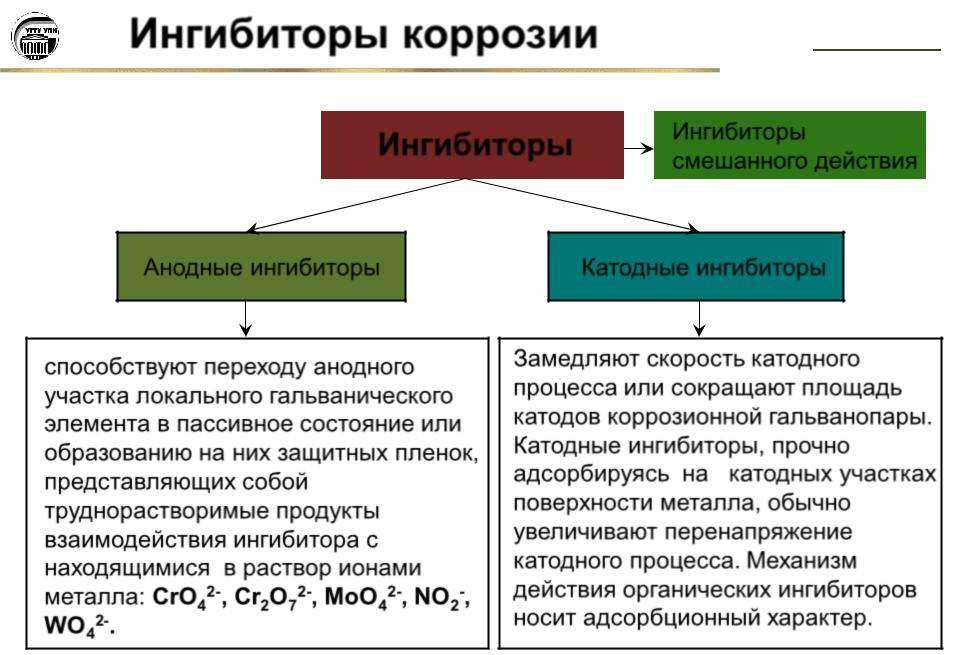 Вторичные реакции: Fe2+ +2ОН->Fe (OH)2; (4.114) 4Fe(OH)2+ О2+2Н2О> 4Fe(OH)3; (4.115) 4Fe(OH)3>Fe2O3 x Н2О (ржавчина). Виды коррозии Коррозия металлов имеет много видов, поэтому очень редко приходится сталкиваться только с одним фактором, вызывающим коррозию. Как правило, на ее возникновение влияют многие параметры, накладывающиеся друг на друга. Условно их можно разделить на два вида: – общая равномерная коррозия, охватывающая всю поверхность металла и приводящая к его утонению; – локальные коррозионные разрушения, к которым относятся язвенная (питтинговая) коррозия, межкристаллитная коррозия, подшламовая, щелевая, коррозия в трещинах, микробиологическая. Проблемы, порожденные коррозией, с одной стороны, приводят к разрушению металла, а с другой – к образованию осадка, нарушающего теплообмен. Параметры, оказывающие основное влияние на коррозию: – низкое значение рН, при котором скорость коррозии возрастает. Резкое уменьшение скорости при рН>10 связано с образованием на стали защитных гидрооксидных пленок железа; – хлориды и сульфаты, являющиеся одним из наиболее важных факторов, определяющих интенсивность локальной коррозии металла; – кислород и углекислота, увеличивающие скорость коррозии; – солесодержание – присутствие в воде растворенных солей, способствующее коррозии, то есть увеличивающее удельную электропроводимость воды; – повышение температуры, которое ускоряет коррозию; – наличие сероводорода – способствует развитию коррозии, он возникает при определенных условиях в результате жизнедеятельности сульфатвосстанавливающих анаэробных бактерий; – состояние поверхности – поскольку процесс коррозии включает этап образования гальванических элементов, а наличие всякой неоднородности способствует появлению анодов и катодов; – контакт различных металлов приводит к образованию электрохимической гальванической пары, где менее благородный металл становится анодом и подвергается коррозии; – общая жесткость и щелочность оказывают эффект ингибирования на процессы коррозии.
Вторичные реакции: Fe2+ +2ОН->Fe (OH)2; (4.114) 4Fe(OH)2+ О2+2Н2О> 4Fe(OH)3; (4.115) 4Fe(OH)3>Fe2O3 x Н2О (ржавчина). Виды коррозии Коррозия металлов имеет много видов, поэтому очень редко приходится сталкиваться только с одним фактором, вызывающим коррозию. Как правило, на ее возникновение влияют многие параметры, накладывающиеся друг на друга. Условно их можно разделить на два вида: – общая равномерная коррозия, охватывающая всю поверхность металла и приводящая к его утонению; – локальные коррозионные разрушения, к которым относятся язвенная (питтинговая) коррозия, межкристаллитная коррозия, подшламовая, щелевая, коррозия в трещинах, микробиологическая. Проблемы, порожденные коррозией, с одной стороны, приводят к разрушению металла, а с другой – к образованию осадка, нарушающего теплообмен. Параметры, оказывающие основное влияние на коррозию: – низкое значение рН, при котором скорость коррозии возрастает. Резкое уменьшение скорости при рН>10 связано с образованием на стали защитных гидрооксидных пленок железа; – хлориды и сульфаты, являющиеся одним из наиболее важных факторов, определяющих интенсивность локальной коррозии металла; – кислород и углекислота, увеличивающие скорость коррозии; – солесодержание – присутствие в воде растворенных солей, способствующее коррозии, то есть увеличивающее удельную электропроводимость воды; – повышение температуры, которое ускоряет коррозию; – наличие сероводорода – способствует развитию коррозии, он возникает при определенных условиях в результате жизнедеятельности сульфатвосстанавливающих анаэробных бактерий; – состояние поверхности – поскольку процесс коррозии включает этап образования гальванических элементов, а наличие всякой неоднородности способствует появлению анодов и катодов; – контакт различных металлов приводит к образованию электрохимической гальванической пары, где менее благородный металл становится анодом и подвергается коррозии; – общая жесткость и щелочность оказывают эффект ингибирования на процессы коррозии. Абсолютное значение каждого из указанных параметров и их сочетание определяет агрессивность воды по отношению к металлу. Для индикации скорости коррозии можно воспользоваться эмпирической формулой, дающей весьма представительные результаты для многих природных жестких вод в диапазоне температур до 80°С. К = 0,008 • t – 0,03, где К – скорость коррозии, г/(м2 • ч) t – температура воды, °С. Эмпирические формулы скорости коррозии стали в диапазоне от 20 до 80°С (по Сухотину А.М. и Беренблит В.М.): в обессоленной воде К = 0,017 • t – 0,18; в воде после водород-натрий-катионирования К = 0,014 • t – 0,18; в воде после натрий-катионирования К = 0,009 • t – 0,18. Глубинный показатель коррозии вычисляется: П = К • 8760 / (1000 • d), (4.118) где К – см. выше; d – плотность стали или чугуна, г/см3; 8760 – количество часов работы в год, ч/г. Ингибиторы коррозии Существует три основных семейства ингибиторов коррозии: хроматы цинка; фосфаты цинка; органофосфаты. Смешанные составы должны быть полифункциональны – так, чтобы увеличить зону оптимального рН, избежать угрозы отложений и замедлить скорость коррозии.
Абсолютное значение каждого из указанных параметров и их сочетание определяет агрессивность воды по отношению к металлу. Для индикации скорости коррозии можно воспользоваться эмпирической формулой, дающей весьма представительные результаты для многих природных жестких вод в диапазоне температур до 80°С. К = 0,008 • t – 0,03, где К – скорость коррозии, г/(м2 • ч) t – температура воды, °С. Эмпирические формулы скорости коррозии стали в диапазоне от 20 до 80°С (по Сухотину А.М. и Беренблит В.М.): в обессоленной воде К = 0,017 • t – 0,18; в воде после водород-натрий-катионирования К = 0,014 • t – 0,18; в воде после натрий-катионирования К = 0,009 • t – 0,18. Глубинный показатель коррозии вычисляется: П = К • 8760 / (1000 • d), (4.118) где К – см. выше; d – плотность стали или чугуна, г/см3; 8760 – количество часов работы в год, ч/г. Ингибиторы коррозии Существует три основных семейства ингибиторов коррозии: хроматы цинка; фосфаты цинка; органофосфаты. Смешанные составы должны быть полифункциональны – так, чтобы увеличить зону оптимального рН, избежать угрозы отложений и замедлить скорость коррозии. Часто включают в состав ингибиторов Скорость коррозии Глубинный показатель коррозии, мм/г. Характеристика интенсивности коррозии Свыше 0,002 до 0,04 Слабая Свыше 0,04 до 0,05 Допустимая Свыше 0,05 до 0,2 Сильная Свыше 0,2 Аварийная ингибитор одной из вышеназванных основных групп или их сочетание; диспергатор; ингибитор коррозии сплавов, содержащих медь (азоловые производные: бензотриазол и др.).
Часто включают в состав ингибиторов Скорость коррозии Глубинный показатель коррозии, мм/г. Характеристика интенсивности коррозии Свыше 0,002 до 0,04 Слабая Свыше 0,04 до 0,05 Допустимая Свыше 0,05 до 0,2 Сильная Свыше 0,2 Аварийная ингибитор одной из вышеназванных основных групп или их сочетание; диспергатор; ингибитор коррозии сплавов, содержащих медь (азоловые производные: бензотриазол и др.).
4. Показатель скорости коррозии
Для
установления скорости коррозии металла
в данной среде обычно ведут наблюдения
за изменением во времени какой-либо
характеристики, объективно отражающей
изменение свойства металла. Чаще всего
в коррозионной практике используют
следующие показатели.
1.
Показатель
изменения массы
— изменение массы образца в результате
коррозии отнесенный к единице поверхности
металла S и к единице времени (например,
г/м ч)
в
зависимости от условий коррозии
различают:
а)
отрицательный показатель изменения
массы
К—m
=
m
/ (S)
где
m
— убыль массы металла за время коррозии
после удаления продуктов коррозии.
б)
положительный показатель изменения
массы
К+m
=
m
/ (S)
где
m
— увеличение массы металла за время
вследствие роста пленки продуктов
коррозии.
Если
состав продуктов коррозии известен, то
можно сделать пересчет от К к К и наоборот
К—m
= К+m
(nok
*AMe
/ nMe
*Aok)
—
где
А и М — атомная и молекулярная масса Ме
и окислителя соответственно; n и n
валентность металла и окислителя в
окислительной среде.
2.Объемный показатель коррозии
Кобь
— объем поглощенного или выделившегося
в процессе газа V отнесенный к единице
поверхности металла и единице времени
(например, см3
/см2
*ч).
Кобъ.
=
V / s *
объем
газа обычно приводят к нормальным
условиям.
3.Показатель сопротивления
Изменение
электрического сопротивления образца
металла за определенное время испытаний
также может быть использован в качестве
показания коррозии (К ).
КR
= (R/Ro) 100% за время
где
R0
и R электрическое сопротивление образца
соответственно до и после коррозии.
У
этого способа есть некоторый недостаток
толщина металла во все время испытаний
должна быть одинаковой и по этой причине
чаще всего определяют удельное
сопротивление, т.е. изменение электрического
сопротивления на единицу площади образца
(см, мм) при длине равной единице. Этот
метод имеет ограничения применения
(для листового металла не более 3мм).
Наиболее точные данные получают для
проволочных образцов. Этот метод не
пригоден для сварных соединений.
4.Механический показатель коррозии
Изменение
какого-либо свойства металла за время
коррозии . Сравнительно часто пользуются
изменением предела прочности. Прочностной
Прочностной
показатель при этом выражается:
Кo=
(в/во)
100% за время t
где
в
изменение предела прочности при
растяжении после коррозии образца в
течении времени ; во
предел прочности до коррозии.
5.Глубинный показатель коррозии
К
— глубина разрушения металла П в единицу
времени (например, мм/год)
Глубина
коррозионного разрушения П может быть
средней или максимальной. Глубинный
показатель коррозии можно использовать
для характеристики как равномерной,
так и неравномерной коррозии (в том
числе и местной) металлов. Он удобен для
сравнения скорости коррозии металла с
различными плотностями. Переход от
массового, токового и объемного к
глубинному возможен при равномерной
коррозии.
Защита металлов от коррозии
Современная
защита металлов от коррозии базируется
на следующих методах:
повышение
химического сопротивления конструкционных
материалов,изоляция
поверхности металла от агрессивной
среды,понижение
агрессивности производственной среды,снижение
коррозии наложением внешнего тока
(электрохимическая защита).
Эти
методы можно разделить на две группы.
Первые два метода обычно реализуются
до начала производственной эксплуатации
металлоизделия (выбор конструкционных
материалов и их сочетаний еще на стадии
проектирования и изготовления изделия,
нанесение на него защитных покрытий).
Последние два метода, напротив, могут
быть осуществлены только в ходе
эксплуатации металлоизделия (пропускание
тока для достижения защитного потенциала,
введение в технологическую среду
специальных добавок-ингибиторов) и не
связаны с какой-либо предварительной
обработкой до начала использования.
При
применении первых двух методов не могут
быть изменены состав сталей и природа
защитных покрытий данного металлоизделия
при непрерывной его работе в условиях
меняющейся агрессивности среды. Вторая
группа методов позволяет при необходимости
создавать новые режимы защиты,
обеспечивающие наименьшую коррозию
изделия при изменении условий их
эксплуатации. Например, на разных
участках трубопровода в зависимости
от агрессивности почвы можно поддерживать
различные плотности катодного тока или
для разных сортов нефти, прокачиваемой
через трубы данного состава, использовать
разные ингибиторы.
Однако
в каждом случае приходится решать каким
из средств или в каком их сочетании
можно получить наибольший экономический
эффект.
Широко
применяются следующие основные решения
защиты металлических конструкций от
коррозии:
Электрохимическая коррозия: причины, типы, скорость протекания
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
- щелевые поражения;
- питтинги;
- межкристаллическое повреждение.
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного.
 На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения. - Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий.
 Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется. На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
- Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах.
 Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → h3.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.
Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным. Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
- Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.

Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
- Электрохимическая. Чаще всего наблюдается в ситуации, когда катодный и анодный процессы начинают замедляться.
- Фазовая. Возникает в том случае, если на поверхности материала формируется новая фаза.
- Концентрационная. Этот процесс появляется в том случае, если есть очень малые показатели скорости отвода продуктов коррозии, а также подхода деполяризатора.
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
Мы используем методику горячего цинкования.
В пользу работы с нами говорит сразу несколько факторов:
- Опыт работы с 2007 года, есть постоянные заказчики.

- Большие производственные площади. Три цеха для горячего цинкования, мощность 120 тысяч тонн в год.
- Универсальность. Работаем со множеством видов изделий благодаря установленной на предприятии самой глубокой ванны в ЦФО – 3,43 метра.
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.
Вернуться к статьям
Поделиться статьей
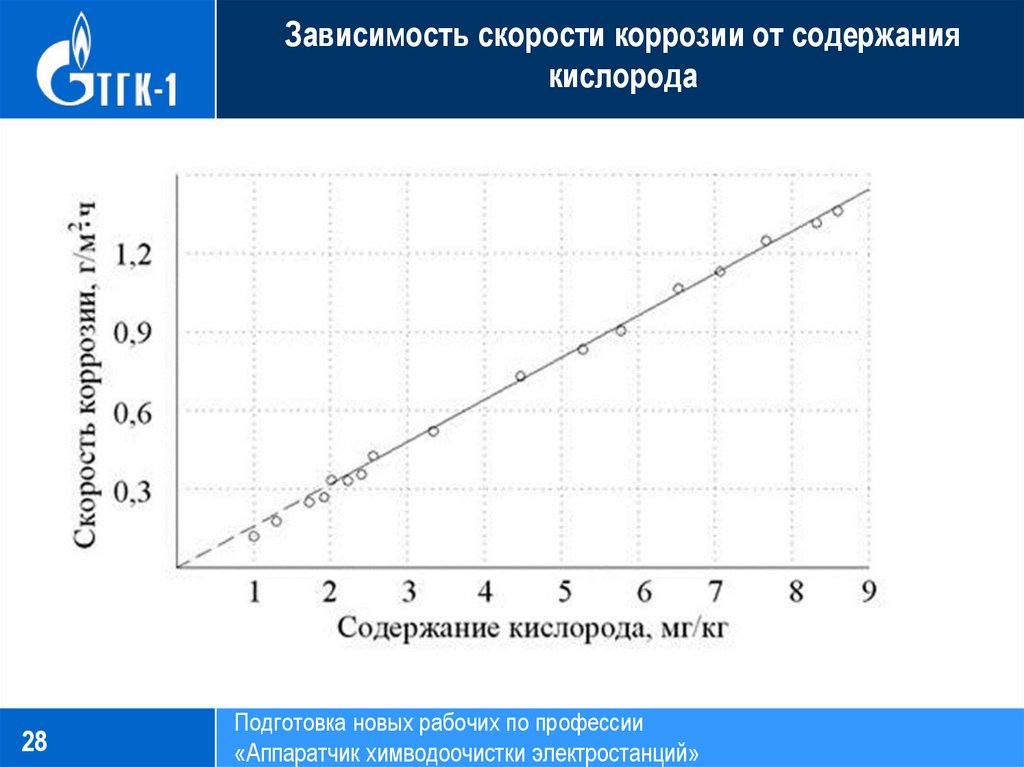
Увеличение — скорость — коррозия — металл
Cтраница 1
Зависимость скорости коррозии стали Х13 в 0 5 % — ной НС1 при 25 С от средней толщины пористых медных и платиновых покрытий.| Зависимость скорости коррозии стали от величины потенциала при катодной поляризации в 3 % — ной HNOa при 25 С / — Ст. З. 2 — сталь Х18Н9. Точки М и N соответствуют потенциалам сталей до катодной поляризации. З. 2 — сталь Х18Н9. Точки М и N соответствуют потенциалам сталей до катодной поляризации.
[1] |
Увеличение скорости коррозии металлов ( дюралюминия в 3 % — ной NaCl, стали Х18Н10Т в морской воде, хрома в растворах кислот, железа и стали Х18Н10Т в HNO3) при их катодной поляризации ( от внешнего источника постоянного тока или контактом с более электроотрицательным металлом) принято называть отрицательным защитным эффектом, который наблюдается у металлов в пассивном состоянии.
[2]
Присутствие оксидов серы в продуктах сгорания вызывает увеличение скорости коррозии металлов. Однако влияние SOZ и SO3 практически не проявляется при больших избытках кислорода. Незначительно влияют оксиды серы на коррозию и при относительно умеренных температурах. При температуре до 540 С скорость коррозии сталей в оксиде серы ( 1У), которого значительно больше содержится в дымовых газах, чем оксида серы ( У1), практически такая же, как в воздухе и кислороде. При 760 С скорость коррозии углеродистых и низколегированных сталей в оксиде серы ( 1У) примерно в два раза выше, чем в воздухе. Например, при 800 С наблюдалось увеличение скорости коррозии в SO3, по сравнению с SO2, примерно в три раза для аустенитных сталей типа Х18Н8, низколегированной стали и хрома.
При 760 С скорость коррозии углеродистых и низколегированных сталей в оксиде серы ( 1У) примерно в два раза выше, чем в воздухе. Например, при 800 С наблюдалось увеличение скорости коррозии в SO3, по сравнению с SO2, примерно в три раза для аустенитных сталей типа Х18Н8, низколегированной стали и хрома.
[3]
| Зависимость скорости коррозии k углеродистой стали ( 0 17 % С от температуры испытания в различных газовых средах.
[4] |
Присутствие оксидов серы в продуктах сгорания вызывает увеличение скорости коррозии металлов. Однако влияние SO2 и SO3 практически не проявляется при больших избытках кислорода. Незначительно влияют оксиды серы на коррозию и при относительно умеренных температурах. При температуре до 540 С скорость коррозии сталей в оксиде серы ( 1У), которого значительно больше содержится в дымовых газах, чем оксида серы ( У1), практически такая же, как в воздухе и кислороде. При 760 С скорость коррозии углеродистых и низколегированных сталей в оксиде серы ( 1У) примерно в два раза выше, чем в воздухе. Например, при 800 С наблюдалось увеличение скорости коррозии в S03, по сравнению с S02, примерно в три раза для аустенитных сталей типа Х18Н8, низколегированной стали и хрома.
При 760 С скорость коррозии углеродистых и низколегированных сталей в оксиде серы ( 1У) примерно в два раза выше, чем в воздухе. Например, при 800 С наблюдалось увеличение скорости коррозии в S03, по сравнению с S02, примерно в три раза для аустенитных сталей типа Х18Н8, низколегированной стали и хрома.
[5]
Видема [111,157] смещение потенциала алюминия от стационарного значения в положительную сторону вызывает увеличение скорости коррозии металла. Это говорит о том, что при температуре 200 С в отличие от комнатных температур, стационарный потенциал алюминия соответствует активной области. При этом достигаются значения потенциала, соответствующие области пассивации, а скорость коррозии алюминия значительно снижается. Аналогичного эффекта можно добиться, поляризуя металл анодно. На основании изложенного можно полагать, что те легирующие компоненты с введением которых скорость коррозии алюминия при низких температурах ( медь, никель, железо и др. ) увеличивалась, при высоких температурах должны способствовать увеличению коррозионной стойкости металла. Приведенные рассуждения подкрепляются следующими экспериментальными данными.
) увеличивалась, при высоких температурах должны способствовать увеличению коррозионной стойкости металла. Приведенные рассуждения подкрепляются следующими экспериментальными данными.
[6]
При этом были использованы гравиметрический и электрохимические методы измерения скорости коррозии, которые показали увеличение скорости коррозии металла. Проведенные механохимиче-ские испытания с, постоянной скоростью нагружения показали, что физико-механических свойства металла в модели пластовой воды отличаются от свойств металла, испытанного на воздухе.
[7]
Основными проблемами, возникающими в системах теплоснабжения, являются: образование накипи на теплопередающих поверхностях и увеличение скорости коррозии металла оборудования. Одним из перспективных направлений решения данных проблем является использование установок магнитной обработки жидкости.
[8]
Сдвиг стационарного потенциала внутренней поверхности трубы в положительную сторону в среде, содержащей сероводород, свидетельствует о накоплении сульфидов железа на поверхности трубы и увеличении скорости коррозии металла вследствие работы гальванопары Fe-FeS. Поэтому измеренная величина разности потенциалов свежеобработанный стальной электрод — внутренняя поверхность трубы при нижнем положении электрода ( зонда) может характеризовать степень анодной поляризации металла.
Поэтому измеренная величина разности потенциалов свежеобработанный стальной электрод — внутренняя поверхность трубы при нижнем положении электрода ( зонда) может характеризовать степень анодной поляризации металла.
[9]
Сдвиг стационарного потенциала внутренней поверхности трубы в положительную сторону в среде, содержащей сероводород, свидетельствует о накоплении сульфидов железа на поверхности трубы и увеличении скорости коррозии металла вследствие работы гальванопары Fe. Поэтому измеренная величина разности потенциалов свежеобработанный стальной электрод — внутренняя поверхность трубы при нижнем положении электрода ( зонда) может характеризовать степень анодной поляризации металла.
[10]
В Америке применяют [5] 20 % — ным холодильником для ный раствор NaCl при рН от 6 5 до 7 2, коррозионных испытаний что объясняется меньшим влиянием температуры на результаты испытаний, а не увеличением скорости коррозии металлов при повышенной концентрации соли.
[11]
Приложение напряжений изгиба ( а 250 МПа) приводит к возрастанию скорости коррозии металла. Необходимо отметить, что степень увеличения скорости коррозии металла от приложения напряжений практически не зависит от величины остаточной деформации. Поскольку в плоском образце при изгибе с напряжением т могут возникать поперечные напряжения, достигающие значения цп ( где ц 0 3 — коэффициент Пуассона), то расчет скорости коррозии производили для двух значений аср: аср а / 3 — нижняя сплошная прямая и Стер ( 1 ц) а / 3 — верхняя сплошная прямая. Таким образом, формула (2.9) может быть использована для инженерной оценки скорости коррозии металлов в зависимости от степени пластической деформации и величины приложенных напряжений.
[12]
| График зависимости скорости КОРРОЗИИ UE ТрубнОЙ СТЭ.
[13] |
Приложение напряжений изгиба ( аи — 250 МПа) приводит к возрастанию скорости коррозии металла.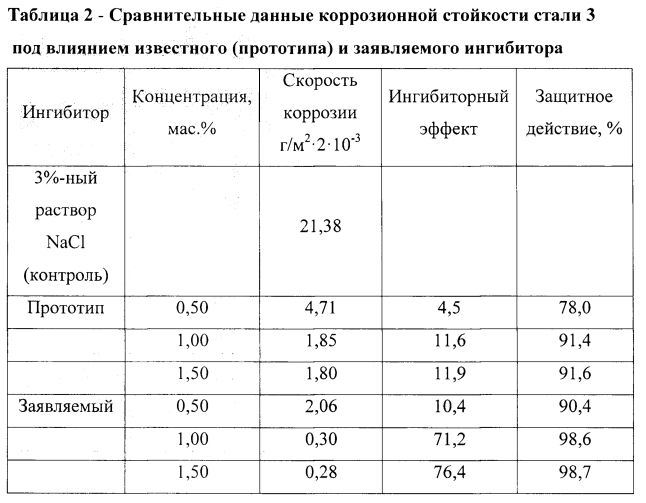 Необходимо отметить, что степень увеличения скорости коррозии металла от приложения напряжений практически не зависит от величины остаточной деформации. Поскольку в плоском образце при изгибе напряжением а могут возникать поперечные напряжения, достигающие значения цст ( где ц 0 3 — коэффициент Пуассона), то расчет скорости коррозии по формуле ( 103) производили для двух значений ТСР: сгсрт / 3 — — нижняя сплошная прямая и аср О — ЬмО / З — верхняя сплошная прямая.
Необходимо отметить, что степень увеличения скорости коррозии металла от приложения напряжений практически не зависит от величины остаточной деформации. Поскольку в плоском образце при изгибе напряжением а могут возникать поперечные напряжения, достигающие значения цст ( где ц 0 3 — коэффициент Пуассона), то расчет скорости коррозии по формуле ( 103) производили для двух значений ТСР: сгсрт / 3 — — нижняя сплошная прямая и аср О — ЬмО / З — верхняя сплошная прямая.
[14]
Приложение напряжений изгиба ( аа 250 МПа) приводит к возрастанию скорости коррозии металла. Необходимо отметить, что степень увеличения скорости коррозии металла от приложения напряжений практически не зависит от величины остаточной деформации. Поскольку в плоском образце при изгибе с напряжением а могут возникать поперечные напряжения, достигающие значения цст ( где ц 0 3 — коэффициент Пуассона), то расчет скорости коррозии производили для двух значений стср: УСр сг / 3 — нижняя сплошная прямая и tfCP ( l jn) a / 3 — верхняя сплошная прямая. Таким образом, формула (2.9) может быть использована для инженерной оценки скорости коррозии металлов в зависимости от степени пластической деформации и величины приложенных напряжений.
Таким образом, формула (2.9) может быть использована для инженерной оценки скорости коррозии металлов в зависимости от степени пластической деформации и величины приложенных напряжений.
[15]
Страницы:
1
2
Методы проведения коррозионных исследований — УТТП
Гравиметрические испытания
Испытания посредством метода поляризационного сопротивления
Обработка результатов экспериментов
С целью подбора ингибитора коррозии для пресных вод, характеризующихся высоким содержанием кислорода (6,0 — 7,0 мг/л), в лабораторных условиях определяли скорость коррозии металла образцов из углеродистой Стали 20 в неингибированной и ингибированной реагентами Аквакор 7202 и Аквакор 7203 воде. Лабораторные испытания выполняли гравиметрическим методом в U-образной ячейке (рис. 1) согласно ГОСТ 9.506-87 и ГОСТ 9.502-82 и методом поляризационного сопротивления по РД 39-3-611-81.
1 – U-образная ячейка; 2 – мешалка; 3 – герметичный привод; 4 – электродвигатель; 5 – образцы; 6 – испытуемая среда; 7 – штатив.
Рисунок 1 – Аппарат для испытаний при атмосферном давлении
Гравиметрические испытания
Сущность гравиметрического метода заключается в определении потери массы металлических образцов за время их пребывания в испытуемой среде. При гравиметрическом методе скорость коррозии характеризуется массовым показателем Km (г/м2⋅час)
где m1 – масса образца до испытания, г; m2 – масса образца после испытания, г; S – площадь поверхности образца, м2; τ – время экспозиции, час.
где a – длина образца, м; b – ширина образца, м; h – толщина образца, м; d – диаметр отверстия, м (рис. 2).
Рисунок 2 – Испытуемый образец
Если изменение массы образца прямо пропорционально глубине проникновения коррозии в условиях общей коррозии, то массовый показатель часто пересчитывают в глубинный, который характеризует утонение образца в единицу времени.
где ПFe – глубинный показатель скорости коррозии, мм/год; 8760 – количество часов в году; 7,87 – плотность железа, г/см3.
где Z – степень защиты металла от коррозии, %; Km0 – скорость коррозии в неингибированной среде, г/м2⋅час; Km – скорость коррозии в ингибированной среде, г/м2⋅час.
Испытания посредством метода поляризационного сопротивления
Исследования выполняются в соответствии с ГОСТ 9.514-99 Ингибиторы коррозии металлов для водных систем. Электрохимический метод определения защитной способности.
Данный метод основан на принципе Штерна-Гири, полученном теоретически, путем дифференцирования уравнения поляризационной кривой вблизи стационарного потенциала коррозии (Δ ≤ 10 — 20 мВ). В общем случае этот принцип читается так: плотность тока коррозии обратно пропорциональна поляризационному сопротивлению поверхности электрода, измеренному вблизи стационарного потенциала коррозии.
Плотность тока коррозии вычисляется по формуле:
где ik — плотность тока коррозии, мА/см2;
Δi — возникающая анодная или катодная плотность тока при смещении потенциала (ΔE) на 10 — 20 мВ, мА/см2;
ba — постоянная, показывающая наклон тафелевого участка анодной поляризационной кривой, мВ;
bk — постоянная, показывающая наклон тафелевого участка катодной поляризационной кривой, мВ;
— коэффициент Sterna-Giri.
Данный метод реализован в коррозиметре «Моникор-2М» посредством которого и проводились коррозионные испытания.
Обработка результатов экспериментов
Статистическую обработку результатов испытаний проводят по ГОСТ 9.502-82 в следующем порядке:
1. Определяют среднее арифметическое значение
где n – количество измерений.
2. Определяют стандартное среднеквадратичное отклонение отдельного измерения Sn, которое является мерой разброса опытных данных и характеризует случайную ошибку метода испытания, по формуле
3. Определяют среднеквадратичное отклонение среднего арифметического значения , которое характеризует точность метода измерения
Определяют среднеквадратичное отклонение среднего арифметического значения , которое характеризует точность метода измерения
Показатель точности исследования ( Е, % ) определяют по формуле
Результаты коррозионных испытаний считаются удовлетворительными, если Е ≤ 10%.
4. Исключают грубые погрешности измерения по максимальному относительному отклонению τ1-p, определяемому по таблице.
Если в силе неравенство
где x – выделяющееся значение;
р – уровень значимости, вычисляемый как разность между 1 и принятой доверительной вероятностью,
то данное измерение необходимо исключить.
5. Определяют двухсторонние доверительные границы случайного отклонения результата наблюдения Δx:
где + Δx – верхняя граница;
— Δx – нижняя граница;
t1 — p/2 – квантиль распределения Стьюдента;
f = n — 1 – число степеней свободы.
6. Определяют защитное действие ингибитора по максимальному, среднему и минимальному значениям скорости коррозии, если скорость коррозии без ингибитора имеет, например, следующий доверительный интервал
Для определения защитного действия ингибитора (Z, %), используют формулу
Окончательное защитное действие ингибитора записывают в виде доверительного интервала
где — защитное действие, определяемое по среднему значению скорости коррозии;
ΔZ — точность определения защитного действия, вычисляемая как
7. Проводят сравнения средних, используя квантили распределения Стьюдента (tрасч и tp, f). Разница между двумя сериями измерений (n1 и n2) является статистически значимой, если tрасч >t p, f.
Урок 9.
 коррозия металлов и её предупреждение — Химия — 11 класс
коррозия металлов и её предупреждение — Химия — 11 класс
Химия, 11 класс
Урок № 9. Коррозия металлов и её предупреждение
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению видов коррозии, особенностям химической и электрохимической коррозии, методам защиты металлических изделий от коррозионного разрушения.
Глоссарий
Анодное покрытие – способ защиты металлического изделия от коррозии, когда защищаемый металл покрывается металлическим покрытием из более активного металла.
Газовая коррозия – разрушение металла в среде агрессивных газов (кислорода, оксида серы, хлороводорода) обычно при высоких температурах.
Гальванокоррозия – вид электрохимической коррозии, при которой два контактирующих металла в среде электролита образуют коррозионный гальванический элемент с возникновением электрического тока между металлами.
Жидкостная коррозия – разрушение металла в жидкостях, не проводящих электрический ток (органические растворители, нефтепродукты).
Ингибиторы – вещества, вводимые в коррозионную среду, в результате чего снижается её окисляющая способность.
Катодная защита – способ защиты металла от коррозии, когда защищаемое металлическое изделие подсоединяется к отрицательному полюсу внешнего источника электрического тока.
Катодное покрытие – способ защиты металла от коррозии, когда металлическое изделие покрывается тонким слоем из менее активного металла.
Коррозия – разрушение металла в результате окислительно-восстановительных реакций между металлом и окружающей средой
Осушение – удаление из окружающей среды влаги для предотвращения возникновения коррозии.
Протекторная защита – способ защиты металла от коррозии, когда к защищаемому металлическому изделию присоединяют кусок другого, более активного металла.
Химическая коррозия – разрушение металла в среде, не проводящей электрический ток.
Электрокоррозия – вид электрохимической коррозии, возникающей в среде электролита под действием внешнего электрического поля.
Электрохимическая коррозия – разрушение металла в среде электролита при контакте двух металлов с образованием коррозионного элемента и возникновением электрического тока.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Коррозия и её виды
Коррозия металлов – процесс разрушения металлического изделия в результате окислительно-восстановительной реакции металла с окружающей средой. В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
Электрохимическая коррозия происходит в среде электролитов, которые хорошо проводят электрический ток. Различают два вида электрохимической коррозии: гальванокоррозия и электрокоррозия. Гальванокоррозия возникает в месте контакта двух металлов, наличия в металле примесей, разной температуры на соседних участках металлов, разной концентрации электролитов в среде, контактирующей с металлом и в случае разной концентрации кислорода на соседних участках металла. Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
Fe0 – 2e → Fe2+. В результате среда становится щелочной, образуется сначала «белая» ржавчина Fe(ОН)2: Fe2+ + 2OH— → Fe(ОН)2↓, которая окисляется кислородом воздуха во влажной среде до трёхвалентного гидроксида железа.
4Fe(ОН)2↓ + 2Н2О + О2 → 4Fe(ОН)3↓, Fe(OH)3 + nh3O → Fe2O3·xh3O (ржавчина).
Если в атмосфере присутствует большое количество кислых газов (СО2, SO2, NO2), то при растворении их в воде образуются кислоты. В кислой среде коррозия идет ещё интенсивнее. В присутствии кислорода на катоде образуется вода, а в бескислородной среде выделяется водород.
На аноде: Fe0 – 2е → Fe2+;
На катоде: О2 + 4Н+ + 4е → 2Н2О
или в бескислородной среде: 2Н+ + 2е → Н20↑.
Ионы железа образуют соли с кислотными остатками образовавшихся при растворении газов кислот. В дальнейшем под действием кислорода воздуха, соли двухвалентного железа окисляются до солей трёхвалентного железа.
Электрокоррозия возникает под действием на металл электрического тока от внешнего источника постоянного тока. Часто она происходит под действием блуждающих токов от рельсов электротранспорта, от плохо изолированных опор линий электропередач. Участок, на который попадает ток от внешнего источника, заряжается отрицательно и становится катодом. На нём происходит восстановление элементов среды. А соседний участок становится анодом, на нём металл окисляется.
Факторы, увеличивающие скорость коррозии
Возникновение коррозионного гальванического элемента увеличивает скорость коррозии. При контакте двух металлов более активный металл отдает электроны менее активному. Возникает электрический ток. Активный металл растворяется и в результате реакции со средой, и за счет передачи электронов менее активному металлу. Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом. Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде. В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом. Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде. В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Методы защиты металлов от коррозии
Одним из распространённых методов защиты металлов от коррозии является нанесение защитных покрытий. Покрытия бывают металлическими и неметаллическими. Если металлическое изделие покрыто слоем более активного металла, покрытие называют анодным. Если покрытие изготовлено из менее активного металла, оно называется катодным. Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Эффективным, но дорогим методом защиты металлов от коррозии является введение в сплав антикоррозионных легирующих добавок: хрома, никеля, молибдена, титана. Для повышения стойкости к коррозии в кислой среде в сплав добавляют кремний.
К методам электрохимической защиты относятся протекторная и катодная защита. Протекторная защита предусматривает закрепление на защищаемом изделии пластин из активного металла: цинка, алюминия, магния. Попадая в агрессивную среду, протектор становится анодом, начинает разрушаться, а металлическое изделие, являясь катодом, не разрушается до полного разрушения протектора. Катодная защита производится путём подсоединения защищаемого металлического изделия к отрицательному полюсу внешнего источника постоянного электрического тока. В результате защищаемый металл приобретает отрицательный заряд и становится катодом. В качестве анода используют вспомогательный кусок металла (железный лом, старый рельс), который заземляют.
Важным направлением предотвращения коррозии металлов является снижение агрессивности окружающей среды. Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
Предотвращение потерь металла от коррозии позволит не только сберечь тонны металла, но и предотвратить аварии на производстве и транспорте, сберечь человеческие жизни.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчёт массы металла, предохраняемого от разрушения за счёт нанесения защитных покрытий
Условие задачи: В результате атмосферной коррозии толщина стального изделия уменьшается на 0,12 мм/год. Потерю какой массы стального изделия плотностью 7750 кг/м3 и площадью 10 м2 можно предотвратить путем нанесения лакокрасочного покрытия, которое сохраняет свои защитные свойства в течение 4 лет? Ответ запишите в виде целого числа в килограммах.
Шаг первый: необходимо перевести скорость коррозии из мм/год в м/год.
Для этого скорость коррозии умножим на 10-3:
0,12·10-3 = 1,2·10-4 (м/год).
Шаг второй: Найдём объём слоя металла, который может быть разрушен коррозией за 1 год. Для этого толщину слоя разрушенного в течение года металла умножим на площадь стального изделия:
1,2·10-4·10 = 1,2·10-3 (м3/год).
Шаг третий: Найдём массу вычисленного объёма металла.
Для этого объём металла умножим на его плотность:
1,2·10-3·7750 = 9,3 (кг/год).
Шаг четвёртый: Найдём массу металла, которая могла бы разрушиться за 4 года. Для этого массу сохранённого за год металла умножим за 4 года:
9,3·4 = 37,2 (кг). Округляем до целого числа, получаем 37 (кг).
Ответ: 37
2. Расчёт массы металла, разрушенного в результате коррозии
Условие задачи: Через железную решётку, предохраняющую от попадания в канализацию крупного мусора, проходит 20 м3 воды в сутки. Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
Шаг первый: найдём объём кислорода, который содержится в 20 м3 воды.
Для этого разделим 20 м3 на 100:
20 : 100 = 0,2 (м3/сутки) = 200 (л/сутки)
Шаг второй: Найдём объём кислорода, который проходит в воде через решётку в течение 6 месяцев.
Для этого объём кислорода, проходящий через решетку в сутки, умножим на 30 дней и на 6 месяцев:
200·30·6 = 36000 (л).
Шаг третий: Найдём объём кислорода, который расходуется на окисление железа. Для этого умножим найденный объём кислорода на 60 и разделим на 100:
(36000·60) : 100 = 21600 (л).
Шаг четвёртый: Запишем уравнение реакции взаимодействия железа с кислородом в нейтральной среде:
2Fe + O2 + 2H2O → 2Fe(OH)2.
Шаг пятый: Найдём массу железа, окисленного 21600 л кислорода.
Для этого составим пропорцию с учётом того, что масса 1 моль железа равна 56 г/моль, а 1 моль газа в нормальных условиях занимает 22,4 л.
2·56 г железа реагирует с 22,4 л кислорода;
х г железа реагирует с 21600 л кислорода.
х = (2·56·21600) : 22,4 = 108000 (г) = 108 кг.
Ответ: 108.
Как рассчитать скорость коррозии?
Изучение коррозии металлов сосредоточено на равновесных условиях и склонности металлов к коррозии, которая связана со стандартными электродными потенциалами металлов. Однако корродирующие системы не находятся в равновесии, и поэтому термодинамические потенциалы не говорят нам о скоростях коррозионных реакций. Кинетика коррозии систем очень сложна и до конца не изучена. Давайте рассмотрим некоторые из основных аспектов кинетики коррозии и посмотрим, как мы можем рассчитать скорость коррозии.
Равномерная скорость коррозии
Количество металла, равномерно корродировавшего с анода или нанесенного гальванопокрытием на катод в водном растворе за определенный период времени, можно определить с помощью уравнения Фарадея общей химии.
Вы знаете?
Майкл Фарадей (1791–1867) — английский ученый, проводивший основные эксперименты в области электричества и магнетизма. Он провел эксперименты, чтобы показать, как ионы соединения мигрируют под действием приложенного электрического тока к электродам противоположной полярности.
Уравнение Фарадея утверждает, что
где
w = масса металла в граммах (г), подвергшегося коррозии или гальванопокрытию в водном растворе за время t в секундах (с)
I = ток в амперах (А)
M = атомная масса металла, г/моль
n = число образующихся или расходуемых в процессе электронов/атом
F = постоянная Фарадея = 96, 500 Кл/моль или 96 500 А·с/моль
Иногда однородная водная коррозию металла выражают через плотность тока I, которую часто выражают в амперах на квадратный сантиметр.
Замена I преобразует приведенное выше уравнение следующим образом:
Как рассчитать массу соединения p…
Включите JavaScript
где
i = плотность тока, А/см 2
A = площадь, ( см 2 , если для длины используется сантиметр)
M = атомная масса металла, г/моль
n = количество электронов/атом, произведенных или израсходованных в процессе
F = постоянная Фарадея = 96, 500 C /моль или 96 500 А · с/моль
Давайте решим примерную задачу для расчета скорости коррозии, используя приведенное выше уравнение.
Пример задачи для расчета скорости коррозии
1. В процессе гальванопокрытия меди используется ток 15 А путем химического растворения (коррозии) медного анода и гальванического покрытия медного катода. Если предположить, что побочных реакций нет, то за какое время из анода вытравится 8,50 г меди?
Ответ:
Время коррозии меди с анода можно определить из приведенного выше уравнения Фрарадея следующим образом:
Запишем его через t
В данном случае из данной задачи имеем
w = 8,5 г
n = 2 для Cu → Cu 2+ + 2e −
F = 96 500 А·с/моль
M = 63,5 г/моль для Cu
I = 15 А
t = ? (в секундах)
Подставим эти значения в приведенное выше соотношение, получим
t = 1722 с
t = 28,7 минут
2. Цилиндрический резервуар из мягкой стали высотой 1 м и диаметром 50 см содержит газированную воду. до уровня
60 см и показывает потерю веса из-за коррозии на 304 г через шесть недель.
(a) Рассчитайте ток коррозии
(b) Рассчитайте плотность тока, связанного с коррозией резервуара.
Предположим, что коррозия внутренней поверхности резервуара равномерна, и что сталь подвергается коррозии так же, как
, как и чистое железо.
Ответ: a
Мы будем использовать следующее уравнение, переписанное из приведенного выше уравнения Фарадея, чтобы найти коррозионный ток: для Fe → Fe 2+ + 2 e −
F = 96 500 А·с/моль
M = 55,85 г/моль для Fe
t = 6 недель = 6×7×24×60 = 3,63×10 6 с
я = ? A
I = 0,289A
Ответ: b
Плотность тока
Площадь корродирующей поверхности бака = площадь бортов + площадь днища
Площадь корродирующей поверхности бака = πDh + 3πr 90 2r 90 2
Площадь корродирующей поверхности бака = π(50 см)(60 см) + π(25 см) 2
Площадь корродирующей поверхности бака = 9420 см 2 + 1962 см 2 = 11,380 см 2
Давайте заменим в вышеуказанной связи I
I = 0,289 A /11,380 CM 2 = 2,53 × 10 2 −5 333333 2 = 2,53 × 1000322 –5 333333333 2 = 2,53 × 1000322 –5 3333 2 = 2,53 × 10 2 2 2 = 2,53 × 10 2 2 2 = 2,53 × 10 2 2 2 = 2,53 × 10 2 2 2 = 2,53 ° 2
Плотность тока 2,53 × 10 −5 А/см 2 .
В экспериментальных работах по коррозии однородная коррозия поверхности металла, подвергающегося воздействию агрессивной среды, измеряется различными способами.
Один из распространенных методов заключается в измерении потери веса образца, подвергшегося воздействию определенной среды, а затем, через определенный период времени, выражении скорости коррозии как потери веса на единицу площади открытой поверхности в единицу времени. Например, однородная поверхностная коррозия часто выражается как потеря веса в миллиграммах на квадратный дециметр в день (мдд).
3. Стенка стального резервуара с газированной водой корродирует со скоростью 54,7 мдд. За какое время толщина стенки уменьшится на 0,50 мм?
Ответ:
Скорость коррозии 54,7 мдд, или 54,7 мг металла корродирует на каждый квадратный дециметр поверхности в сутки.
Скорость коррозии, г/(см 2 ⋅сут) = (54,7 × 10 −3 г) / (100 см 2 ⋅ сут) = 54,7 × 10 см 3 −3 900 2 ⋅день)
Плотность Fe = 7,87 г/см 3 .
Деление скорости коррозии в г/(см 2 ·день) на плотность дает глубину коррозии в день.
Глубина коррозии в сутки = (54,7 × 10 −4 г/(см 2 ⋅сут)) / 7,87 г/см 3
Глубина коррозии в сутки = 0,695 −2 10 9003 4 см/день
Количество дней, необходимое для уменьшения на 0,50 мм, можно получить из соотношения
x = 719дней
Другим широко используемым методом является выражение скорости коррозии через потерю материала по глубине в единицу времени. Примерами скорости коррозии в этой системе являются миллиметры в год (мм/год) и милы (1 мил = 0,001 дюйма) в год (милы/год). Для однородной электрохимической коррозии в водной среде скорость коррозии может быть выражена плотностью тока.
Давайте решим пример по этому методу для расчета скорости коррозии
4. Образец цинка равномерно подвергается коррозии при плотности тока 4,27 × 10 −7 А/см 2 в водном растворе. Какова скорость коррозии цинка в миллиграммах на дециметр в сутки? Реакция окисления цинка Zn → Zn 2+ + 2 e − .
Какова скорость коррозии цинка в миллиграммах на дециметр в сутки? Реакция окисления цинка Zn → Zn 2+ + 2 e − .
Ответ:
Для преобразования плотности тока в мдд мы воспользуемся уравнением Фарадея для расчета миллиграммов коррозии цинка на площади 1 дм 2 /день (мдд).
w = 1,25 мг цинка, который разъедает площадь 1 дм 2 за 1 день
или скорость коррозии 1,25 мдд
Заключение
Мы обсудили, как рассчитать скорость коррозии по уравнению Фарадея, а также решили 4 примера задач по расчету скорости коррозии. Дайте нам знать, что вы думаете об этой статье в разделе комментариев ниже.
Как рассчитать скорость коррозии | Коррозия
Скорость коррозии показана на изображении ниже.
Для расчета скорости коррозии необходимы три основных параметра, а именно: Ток в Единицу Времени (i), Число Электронов (n) и Постоянная Фарадея (F).
Формула для расчета скорости коррозии:
r = i / нФ
Где:
r = скорость коррозии
i = ток в единицу времени (плотность тока)11 n90 число электронов 900 = постоянная Фарадея
Приведен пример;
Найдите скорость коррозии, если сила тока в единицу времени равна 15, число электронов равно 5, а постоянная Фарадея равна 3.
Это означает, что;
i = ток в единицу времени (плотность тока) = 15
n = количество электронов = 5
F = постоянная Фарадея = 3 )(3)
r = 15 / 15
r = 1
Следовательно, скорость коррозии равна 1.
900 Даны электроны и постоянная Фарадея.
i = r (нФ)
Где:
i = ток в единицу времени (плотность тока)
r = скорость коррозии
n = количество электронов
F = постоянная Фарадея
Давайте решим пример;
Найдите силу тока в единицу времени, если скорость коррозии равна 10, число электронов равно 8, а постоянная Фарадея равна 3.
Отсюда следует, что;
r = скорость коррозии = 10
n = количество электронов = 8
F = постоянная Фарадея = 3
i = r (nF)
i = 10 (8)(3)
i = 10 (24)
i = 240
Следовательно, ток в единицу времени равен 240.
9004 Число электронов, когда заданы скорость коррозии, ток в единицу времени и постоянная Фарадея.
n = i / rF
Где:
n = количество электронов
r = скорость коррозии
i = ток в единицу времени (плотность тока)
с F = постоянная 9 Фарадея0003
Давайте решим пример;
Найдите число электронов, если скорость коррозии равна 4, ток в единицу времени равен 20, а постоянная Фарадея равна 2.
Отсюда следует, что;
r = скорость коррозии = 4
i = ток в единицу времени (плотность тока) = 20
F = постоянная Фарадея = 2 (2)
n = 20 / 8
n = 2,5
Следовательно, число электронов равно 2. 5.
5.
Расчет постоянной Фарадея при заданных скорости коррозии, силе тока в единицу времени и количестве электронов.
F = i / rn
Где:
F = постоянная Фарадея
r = скорость коррозии
i = ток в единицу времени (плотность тока) ;
Найдите постоянную Фарадея, если скорость коррозии равна 8, ток в единицу времени равен 16, а число электронов равно 1.
Это означает, что;
r = скорость коррозии = 8
i = ток в единицу времени (плотность тока) = 16
n = количество электронов = 1
F = i / rn
F = 16
( ) (1)
F = 16 / 8
F = 2
Следовательно, Константа Faraday — 2.
Corroris Corresulation — . .
Чтобы получить ответ и вычислить скорость коррозии, используйте калькулятор Nickzom – The Calculator Encyclopedia. Во-первых, вам нужно получить приложение.
Во-первых, вам нужно получить приложение.
Вы можете получить это приложение любым из следующих способов:
Интернет – https://www.nickzom.org/calculator-plus
Чтобы получить доступ к профессиональной версии через Интернет, вам необходимо зарегистрируйтесь и подпишитесь , чтобы иметь полный доступ ко всем функциям.
Вы также можете попробовать демо версия через https://www.nickzom.org/calculator
Android (платная) – https://play.google.com/store/apps/details?id=org.nickzom.nickzomcalculator
Android (бесплатно) – https://play.google.com/store/apps/details?id=com.nickzom.nickzomcalculator
Apple (платно) – https://itunes.apple.com/us/ app/nickzom-calculator/id1331162702?mt=8
После того, как вы получили приложение энциклопедии калькулятора, перейдите к карте калькулятора , , затем нажмите Материалы и металлургия в разделе Машиностроение .
Теперь нажмите на Corrosion под Материалы и металлургическую
Теперь нажмите . ваши значения, чтобы получить ответ для скорости коррозии в соответствии с соответствующим параметром, который является Ток в Единицу Времени (i), Число Электронов (n) и Постоянная Фарадея (F).
Теперь введите соответствующие значения для параметров, как того требует Ток в Единицу Времени (i) – 15 , Число Электронов (n) – 5 8 и 9004 Постоянная Фарадея. (F) это 3 .
Наконец, нажмите «Рассчитать».
0048 Калькулятор Nickzom – Энциклопедия калькулятора вычисляет скорость коррозии, а также представляет формулу, работу и этапы.
Сопротивление линейной поляризации и скорость коррозии – Pine Research Instrumentation Store
Содержание статьи/навигация по разделам
- Абстрактный
- Обзор измерений коррозии и предыстория
- Линейное сопротивление поляризации
- Плотность тока коррозии
- Применение закона Фарадея к коррозии
- Эквивалентный вес
- Расчет скорости коррозии
- Скорость коррозии, выраженная как скорость проникновения
- Скорость коррозии как скорость потери массы
- Измерения потенциала разомкнутой цепи в AfterMath
- Настройка потенциала разомкнутой цепи в AfterMath
- Использование инструментов AfterMath для обнаружения потенциала коррозии
- Измерение сопротивления линейной поляризации и расчеты скорости коррозии в AfterMath
- Настройка измерения LPR
- Определение коррозионного потенциала и линейного сопротивления при коррозионном потенциале
- Определение нормированного сопротивления поляризации
- Определение плотности тока коррозии и скорости коррозии
- Настройка измерения LPR во времени
- Настройка измерения LPR
- Обработка данных LPR после сбора в AfterMath
- Управление осями графика
- Базовый инструмент LPR
- использованная литература
- Приложение: Таблицы коррозии
1 Резюме
Этот документ знакомит с теорией и основами сопротивления линейной поляризации (LPR).
Линейное поляризационное сопротивление (LPR)
измерения и расчет скорости коррозии по данным LPR. Реализация измерений LPR в AfterMath
Загрузки AfterMath
также описывается.
Вернуться к началу
2 Измерения коррозии Обзор и справочная информация
2.1 Линейное поляризационное сопротивление
Поляризационное сопротивление системы, (единицы Ом·см 3 2 900. можно рассчитать или определить экспериментально. Для расчета можно использовать уравнение Штерна-Гири (см. уравнение 1), где — константа пропорциональности для конкретной коррозионной системы, а — плотность тока коррозии (единицы мкА/см 2 ).
| (1) |
можно определить эмпирически из анодного и катодного наклонов графика Тафеля ( и соответственно; см. уравнение 2). Константы Тафеля могут быть оценены экспериментально, оценены или могут быть использованы стандартные значения для данной системы материалов. (Некоторые примеры таблиц типичных констант Тафеля приведены в Разделе 7 этого документа).
уравнение 2). Константы Тафеля могут быть оценены экспериментально, оценены или могут быть использованы стандартные значения для данной системы материалов. (Некоторые примеры таблиц типичных констант Тафеля приведены в Разделе 7 этого документа).
| (2) |
Для экспериментального определения используется электрохимический метод, называемый сопротивлением линейной поляризации (LPR).
Линейное поляризационное сопротивление (LPR)
можно использовать. При измерении LPR зависимость потенциала от плотности тока измеряется относительно потенциала свободной коррозии. Затем рассчитывается наклон кривой плотности потенциального тока в небольшом потенциальном окне (обычно <20 мВ), который эквивалентен . Впоследствии используется для расчета скорости коррозии для исследуемой системы. В зависимости от аналитических потребностей исследователя может быть достаточно определения , так как сопротивление поляризации прямо пропорционально плотности тока коррозии, как показано в уравнении 3.
| (3) |
Имея дополнительную информацию об исследуемой системе, можно использовать для расчета тока коррозии и скорости коррозии. Для экспериментального определения потенциал свободной коррозии ( или ) должен быть сначала определен эмпирически. Потенциал разомкнутой цепи (OCP)
Потенциал разомкнутой цепи (OCP)
измерения можно использовать для легкого определения для любой данной системы. АфтерМатематика
Загрузки AfterMath
проводит электрохимический эксперимент под названием сопротивление линейной поляризации (LPR).
Линейное поляризационное сопротивление (LPR)
который упаковывает измерение OCP для определения с линейной разверткой для определения . Подробные описания выполнения экспериментов LPR в AfterMath для определения и предоставляются далее в этом документе.
Вернуться к началу
2.2 Плотность тока коррозии
Плотность тока коррозии, , представляет собой ток на единицу площади при коррозионном потенциале. Плотность тока коррозии можно использовать для расчета скорости коррозии (см. раздел 2.5). Если уравнение 1 заменить уравнением 2, то плотность тока коррозии в терминах сопротивления поляризации может быть рассчитана на основании эмпирически определенного (см. уравнение 4). Константы Тафеля в уравнении 4 могут быть экспериментально определены или оценены из табличных данных для определенных анодных и катодных реакций. Как уже упоминалось, некоторые константы Тафеля и значения плотности тока для распространенных реакций, основанных на анодной и катодной коррозии, можно найти в Разделе 7 (см. Таблицу 4 и Таблицу 5).
Джонс, Д. А.    Принципы и предотвращение коррозии , 2 изд. Пирсон: река Аппер-Сэдл, Нью-Джерси, 1995.
Стерн и Вейзерт предположили, что экспериментальные значения обычно находятся в диапазоне от 60 мВ до ~ 120 мВ, а значения — в диапазоне от 60 мВ до бесконечности, причем последнее соответствует диффузионному контролю растворенным окислителем.
Стерн, М.; Вейзерт, Э.Д.  Производство ASTM, 1959 г. — Том 59.., 1959 , 32 , 1280.
| (4) |
Вернуться к началу
2.3 Закон Фарадея в применении к коррозии
Закон Фарадея связывает заряд, переносимый во время электрохимического процесса, с количеством материала, подвергающегося этому процессу. Рассмотрим коррозионную полуреакцию некоторых видов (см. уравнение 5).
| (5) |
Изменение массы относится к току, протекающему в уравнении 5. Соотношение определяется законом Фарадея, где – заряд (в единицах Кл), возникающий в результате электролитической реакции в уравнении 5, – количество электронов, переданных за реакцию, представляет собой постоянную Фарадея (96 485 Кл/моль) и представляет собой число молей, прошедших реакцию (см. уравнение 6). Закон Фарадея является основой для преобразования плотности тока коррозии в скорость потери массы или скорость проникновения.
уравнение 6). Закон Фарадея является основой для преобразования плотности тока коррозии в скорость потери массы или скорость проникновения.
| (6) |
Заряд можно определить с точки зрения электрического тока, где ток (в единицах А) и продолжительность (в единицах с) электролиза частиц (см. уравнение 7).
| (7) |
Объединяя уравнения 6 и 7 и переставляя их, можно определить количество молей материала , реагирующего (корродирующего) за заданное время (см. уравнение 8). Преобразование закона Фарадея в эту форму дает основное уравнение для определения скорости коррозии.
| (8) |
Вернуться к началу
2. 4 Эквивалентная масса
4 Эквивалентная масса
Эквивалентная масса, , — термин, используемый в расчетах коррозии. Эквивалентная масса чистых элементов представляет собой отношение атомной массы , к числу переданных электронов , на стадии коррозионного электролиза (см. уравнение 9).
| (9) |
В качестве примера рассмотрим двухэлектронное окисление железа:
| (10) |
С и ,
| (11) |
В то время как эквивалентный вес является простым расчетом для отдельных металлов, сплавы требуют более сложных вычислений. Для сплавов эквивалентный вес представляет собой сумму эквивалентного веса каждого компонента сплава. Пользователи, которым требуется руководство по эквивалентному весу смеси или сплава, могут обратиться к обозначению ASTM G: 102-89..
Пользователи, которым требуется руководство по эквивалентному весу смеси или сплава, могут обратиться к обозначению ASTM G: 102-89..
ASTM  Стандартная практика расчета скорости коррозии и сопутствующей информации на основе электрохимических измерений.   Американское общество по испытаниям и материалам (ASTM) , 2015 .
Это обсуждение эквивалентного веса относится только к однородной коррозии; , т. е. , процесс окисления, который является равномерным по всему электроду и не включает другие типы локальной коррозии, такие как точечная коррозия.
Вернуться к началу
2,5 Расчет скорости коррозии
Скорость коррозии , можно рассчитать с помощью и и модифицированной формы закона Фарадея. Скорость коррозии обычно выражается одним из двух способов: средней скоростью проникновения или скоростью потери массы.
Вернуться к началу
2.5. 1 Скорость коррозии, выраженная как скорость проникновения
1 Скорость коррозии, выраженная как скорость проникновения
Для расчета скорости коррозии с точки зрения скорости проникновения, определения и приведены в уравнениях 4 и 9., соответственно, плотность металла (в единицах г/см 3 ) и константа пропорциональности необходимы (см. уравнение 12). Скорость проникновения может быть рассчитана в нескольких полезных единицах при правильной константе пропорциональности (см. Таблицу 1).
| (12) |
| Скорость проникновения ( ῡ p ) шт. | я корр блок | ρ шт. | κ p значение | κ р шт. |
| миль в год | мкА/см 2 | г/см 3 | 0,1288 | мПа⋅г/(мкА⋅см) |
| мм/год (1) | А/м 2 | кг/м 3 | 327,2 | мм⋅кг/(А⋅м⋅год) |
| мм/год (2) | мкА/см 2 | г/см 3 | 3,27×10 -3 | мм⋅г/(мкА⋅см⋅год) |
Таблица 1. Постоянные значения и единицы для преобразования скорости проникновения коррозии0656, 2015 .
Постоянные значения и единицы для преобразования скорости проникновения коррозии0656, 2015 .
Вернуться к началу
2.5.2 Скорость коррозии как скорость потери массы
Для расчета скорости коррозии в терминах скорости потери массы вводится другая константа пропорциональности , которая объединяется с определениями и формулируется в уравнениях 4 и 9 соответственно (см. уравнение 13). Скорость потери массы может быть рассчитана в нескольких полезных единицах при правильной константе пропорциональности (см. Таблицу 2).
| (13) |
| Скорость потери массы ( ῡ м ) ед. | и корр. шт. | κ м значение | κ м шт. |
| г/(м 2 ⋅день) | А/м 2 | 0,8953 | г/(А⋅сут) |
мг/(дм 2 ⋅день), т. е. , мдд (1) е. , мдд (1) | мкА/см 2 | 0,0895 | мг⋅см 2 /(мкА⋅дм 2 ⋅сут) |
| мг/(дм 2 ⋅день), т.е. , мдд (2) | А/м 2 | 8,953×10 -3 | мг⋅м 2 /(А⋅дм 2 ⋅сут) |
Таблица 2. Постоянные значения и единицы для расчета скорости коррозии как скорости потери массы ASTM  Стандартная практика расчета скорости коррозии и сопутствующей информации на основе электрохимических измерений.   Американское общество по испытаниям и материалам (ASTM) , 2015 .
Вернуться к началу
3 Измерения потенциала разомкнутой цепи в AfterMath
Потенциал разомкнутой цепи
Потенциал разомкнутой цепи (OCP)
контролирует свободную разность потенциалов между рабочим электродом и электродом сравнения при отсутствии внешнего тока в ячейке. Потенциал открытых ячеек (OCP) также называют свободным потенциалом, равновесным потенциалом или коррозионным потенциалом, E корр . Для измерений LPR в AfterMath,
Потенциал открытых ячеек (OCP) также называют свободным потенциалом, равновесным потенциалом или коррозионным потенциалом, E корр . Для измерений LPR в AfterMath,
Линейное поляризационное сопротивление (LPR)
измерение OCP выполняется перед разверткой LPR для определения E corr ; таким образом, нет необходимости выполнять отдельное измерение OCP для определения E corr . Однако оценка E корр. с автономным экспериментом OCP перед началом измерений LPR дает представление о стабильности системы и значении ее коррозионного потенциала.
Выполнение измерения OCP в AfterMath описано ниже. Запустите измерение в течение достаточно длительного периода времени, чтобы найти устойчивый потенциал. Наклон графика зависимости OCP от времени будет близок к нулю (единицы мВ/с). Время достижения устойчивого состояния зависит от электрохимической системы, но обычно требуется несколько минут.
Вернуться к началу
3.1 Настройка потенциала разомкнутой цепи в AfterMath
Запуск измерения OCP в AfterMath выполняется путем выполнения следующих шагов:
- Запустите AfterMath и перейдите к 9004abt8 Выберите Потенциал разомкнутой цепи (OCP) из раскрывающегося меню.
- Введите соответствующие параметры или нажмите «Автозаполнение» (в более ранних версиях может быть написано «Мне повезет»), чтобы заполнить поле параметрами по умолчанию.
- Нажмите Выполните . AfterMath соберет и отобразит данные OCP. В идеале кривая зависимости потенциала от времени должна приближаться к нулевому наклону, что указывает на равновесие между раствором и электродами. Как правило, со временем наблюдается небольшое отклонение потенциала (расхождение 100 мкВ). Это отклонение является нормальным шумом при измерении (см. рис. 1).
- Если изменение потенциала слишком велико, для достижения стабильного измерения могут потребоваться более длительные периоды электролиза (200–500 с или более).
 Если это так, просто увеличьте «период электролиза» и масштабируйте «количество интервалов» вместе с ним, чтобы обеспечить достаточное количество точек данных для измерения.
Если это так, просто увеличьте «период электролиза» и масштабируйте «количество интервалов» вместе с ним, чтобы обеспечить достаточное количество точек данных для измерения.
Рис. 1. Необработанные данные OCP в AfterMath с допустимым шумом
непропорционально подчеркивая шум в отображаемых данных. Ось Y можно отрегулировать, чтобы улучшить внешний вид данных (см. рис. 2). Чтобы настроить масштаб оси Y:
- Дважды щелкните по оси Y графика; появится диалоговое окно Axis Properties , в котором можно изменить ось.
- Под панелью Scale (справа внизу) снимите флажок Auto .
- Ручная настройка границ графика и интервалов.
Рис. 2. Данные OCP в AfterMath с осью потенциала, масштабированной и аппроксимированной линией наилучшего соответствия
В начало
3.2 Использование инструментов AfterMath для определения потенциала коррозии
С помощью графика OCP с поправкой на оси инструменты, встроенные в AfterMath, можно использовать для поиска базовой линии (также называемой наиболее подходящей линией регрессии) по сегменту данных OCP установившегося состояния.
- Щелкните правой кнопкой мыши данные OCP и выберите Добавить инструмент/базовый уровень .
- Должна появиться линия наилучшего соответствия с розовыми и черными точками, определяющими длину линии наилучшего соответствия.
- Выберите розовые контрольные точки и отрегулируйте их в конце графика зависимости потенциала от времени (где потенциал приближается к стационарному отклику).
- Инструмент AfterMath сообщает о результирующем наклоне и пересечении линии наилучшего соответствия. Значение пересечения эквивалентно коррозионному потенциалу E corr (см. рис. 2).
Вернуться к началу
4 Измерение сопротивления линейной поляризации и расчеты скорости коррозии в AfterMath
4.1 Настройка измерения LPR
Измерение LPR в AfterMath состоит из измерения потенциала коррозии, за которым следует измерение потенциала коррозии линейная развертка вокруг этого коррозионного потенциала. Независимое измерение OCP, описанное в разделе 3.1, не является обязательным для выполнения LPR, но дает представление о стабильности и ожидаемом коррозионном потенциале системы. Данные, собранные с помощью измерения LPR, можно проанализировать в AfterMath для определения наклона графика линейного сопротивления и коррозионного потенциала. При наличии соответствующих входных данных об изучаемой системе AfterMath предоставляет исследователю дополнительные функциональные возможности, включая расчеты нормализованного сопротивления поляризации, тока коррозии и скорости коррозии. Измерение LPR в AfterMath обеспечивает гибкость вывода данных в зависимости от потребностей исследователя, как описано ниже.
Независимое измерение OCP, описанное в разделе 3.1, не является обязательным для выполнения LPR, но дает представление о стабильности и ожидаемом коррозионном потенциале системы. Данные, собранные с помощью измерения LPR, можно проанализировать в AfterMath для определения наклона графика линейного сопротивления и коррозионного потенциала. При наличии соответствующих входных данных об изучаемой системе AfterMath предоставляет исследователю дополнительные функциональные возможности, включая расчеты нормализованного сопротивления поляризации, тока коррозии и скорости коррозии. Измерение LPR в AfterMath обеспечивает гибкость вывода данных в зависимости от потребностей исследователя, как описано ниже.
При отсутствии дополнительных данных во время эксперимента AfterMath сообщит о коррозионном потенциале и линейном сопротивлении при коррозионном потенциале. Если указана площадь рабочего электрода, AfterMath сообщит о коррозионном потенциале и нормализованном поляризационном сопротивлении. Предоставляя плотность и эквивалентный вес материала рабочего электрода, а также константы Тафеля исследуемой системы, AfterMath рассчитает и сообщит о коррозионном потенциале, нормализованном поляризационном сопротивлении, плотности тока коррозии и скорости коррозии системы.
Предоставляя плотность и эквивалентный вес материала рабочего электрода, а также константы Тафеля исследуемой системы, AfterMath рассчитает и сообщит о коррозионном потенциале, нормализованном поляризационном сопротивлении, плотности тока коррозии и скорости коррозии системы.
Вернуться к началу
4.1.1 Определение коррозионного потенциала и линейного сопротивления при коррозионном потенциале
Чтобы запустить измерение LPR в AfterMath, необходимо выполнить следующие шаги: В раскрывающемся меню выберите Сопротивление линейной поляризации (LPR). В правой части AfterMath появится окно параметров LPR.

| Параметр | Вход |
| Период OCP | От 10 до 100 секунд |
| Начальный потенциал | от -10 мВ до -20 мВ по сравнению с OCP |
| Окончательный потенциал | от +10 мВ до +20 мВ по сравнению с OCP |
| Скорость развертки | < 1 мВ/с |
| Обнаружение линейной области | «Автоматическое обнаружение» |
| Временной ряд | 1 |
Таблица 3. Общие параметры для измерений LPR
AfterMath выполнит серию измерений, начиная с OCP, а затем продолжит трехсегментную линейную развертку, измеряя ток как функцию приложенного потенциала. Измерения LPR обычно занимают несколько минут. Когда измерение завершено, результирующие данные отображаются в виде графика зависимости напряжения от силы тока. Результирующие данные должны быть линейными (или близкими к линейным), а прямой и обратный свип должны почти перекрывать друг друга (см. рис. 3).
Результирующие данные должны быть линейными (или близкими к линейным), а прямой и обратный свип должны почти перекрывать друг друга (см. рис. 3).
Рисунок 3. Данные измерения LPR без дополнительных входных данных
Помните, что выходные данные, предоставляемые AfterMath для измерений LPR, основаны на информации, предоставленной AfterMath перед экспериментом. Имея только указанные выше входные данные, AfterMath автоматически рассчитает коррозионный потенциал и линейное сопротивление при коррозионном потенциале. Обратите внимание, однако, что нормализация наклона графика напряжение-ток по площади рабочего электрода приводит к сопротивлению поляризации, поэтому наклон пропорционален сопротивлению поляризации. Для автоматического расчета сопротивления поляризации и/или плотности тока коррозии и скорости коррозии в AfterMath исследователь должен предоставить дополнительную информацию до проведения эксперимента (см. разделы 4.1.2 и 4.1. 3 соответственно).
3 соответственно).
В начало
4.1.2 Определение нормализованного поляризационного сопротивления
Чтобы AfterMath автоматически рассчитывал нормализованное поляризационное сопротивление, вкладка Основные параметры должна быть заполнена, как в разделе 4.1.1, и область рабочий электрод должен быть известен. Чтобы добавить площадь рабочего электрода в AfterMath, перейдите на вкладку Basic Parameters , установите флажок рядом с Normalize By Area и укажите площадь поверхности рабочего электрода в AfterMath в строке 9.0048 Ввод Sample Area с соответствующими выбранными единицами измерения (см. рис. 4). Используя эти данные, измерение LPR создаст график зависимости плотности тока от потенциала (см. рис. 5). Обратите внимание, что добавленный инструмент автоматически вычисляет нормализованное сопротивление поляризации, создавая наиболее подходящую линию для данных. При необходимости розовые контрольные точки этого инструмента можно отрегулировать вручную, чтобы улучшить соответствие данным.
Рис. 4. Пример параметров сопротивления линейной поляризации (LPR) в AfterMath
скорость, вкладка Basic Parameters должна быть заполнена, как в разделах 4.1.1 и 4.1.2, но требуется еще больше входных данных. Установите флажок рядом с Автоматически определять скорость коррозии на вкладке Основные параметры и введите плотность образца, эквивалентный вес и константы Тафеля в соответствующих единицах измерения. С предоставленными входными данными измерение LPR создаст график зависимости плотности тока от потенциала, аналогичный рисунку 5. К данным автоматически добавляется линия наилучшего соответствия, и вычисляются поляризационное сопротивление, коррозионный потенциал и скорость коррозии (см. рис. 5). 6). При необходимости розовые контрольные точки этого инструмента можно отрегулировать вручную, чтобы улучшить соответствие данным.
Рисунок 6. График LPR с плотностью тока коррозии и скоростью коррозии
График LPR с плотностью тока коррозии и скоростью коррозии
В начало
4.2 для расширения до LPR с течением времени. Когда серия измерений LPR выполняется с течением времени, AfterMath создает дополнительные графики данных, отображающие параметры коррозии с течением времени. Типы генерируемых графиков определяются информацией, доступной AfterMath об изучаемой системе до сбора данных. По этой причине выгодно предоставить AfterMath соответствующую информацию об изучаемой системе до начала эксперимента, если она доступна. Эти значения могут быть предоставлены на LPR 9Окно 0048 Basic Parameters в нижней правой части панели Corrosion Rate Parameters (подробное обсуждение входных данных системы и выходных данных AfterMath см. на рис. 4 и в разделе 4.1). Чтобы выполнить измерение LPR во времени:
- В AfterMath выберите Linear Polarization Resistance (LPR ) из раскрывающегося меню Experiments .

- Откроется окно Параметры LPR .
- Под Основные параметры , найдите панель Временной ряд в правом верхнем углу и введите количество измерений LPR, которые необходимо получить в Итерации серии LPR .
- Время ожидания между измерениями, а также дополнительное время, необходимое для сбора данных, можно ввести в Время между итерациями .
- Измерения OCP будут выполняться перед каждым разверткой LPR в настройках AfterMath по умолчанию, но это можно изменить в параметрах LPR Режим OCP по желанию.
Измерение LPR во времени может занять несколько часов в зависимости от выбранных параметров. Когда сбор данных завершен, AfterMath отображает данные. Графики будут включать коррозионный потенциал в зависимости от времени, сопротивление поляризации в зависимости от времени, а также отдельные измерения LPR и измерения OCP, которые были собраны и использованы для создания временных графиков. Представлен график зависимости сопротивления поляризации образца от времени, сгенерированный AfterMath (см. рис. 7).
Представлен график зависимости сопротивления поляризации образца от времени, сгенерированный AfterMath (см. рис. 7).
Рис. 7. Зависящие от времени значения поляризационного сопротивления, полученные с помощью измерений LPR в AfterMath с помощью AfterMath. Например, во многих случаях исследователь может просто знать, что он хочет получать данные LPR «каждый 1 час в течение 16 часов». В подобных случаях рабочий лист полезен для визуализации всего экспериментального потока LPR и расчета правильных значений для каждого шага, показанного в AfterMath. Смотрите ссылку здесь:
Калькулятор хронометража AfterMath LPR
В начало
5 Обработка данных LPR после сбора в AfterMath
AfterMath предоставляет инструменты, которые можно использовать для обработки и получения дополнительной информации о данных LPR после их получения. Например, после сбора данных график потенциального тока можно преобразовать в график плотности потенциального тока с помощью встроенных функций AfterMath, или можно рассчитать скорость коррозии на основе существующих данных LPR с помощью инструмента LPR Baseline Tool. AfterMath использует единицы СИ в электрохимических экспериментах, поэтому соответствующие единицы используются и сохраняются вместе с обработанными данными.
AfterMath использует единицы СИ в электрохимических экспериментах, поэтому соответствующие единицы используются и сохраняются вместе с обработанными данными.
В начало
5.1 Управление осями графика
Оси графика LPR потенциал-ток можно преобразовать в AfterMath в график зависимости потенциала LPR от плотности тока (см. рис. 8). Для примера, представленного на рисунке 8, текущие данные были нормализованы к площади электрода 0,20 см 2 , и данные были добавлены к вторичной оси x (в отличие от замены существующей оси x). Чтобы вручную управлять осью такого графика данных, выполните следующие шаги:
- Рассчитать площадь поверхности рабочего (коррозионного) электрода в м 2 .
- Щелкните данные правой кнопкой мыши и выберите Применить преобразование ↓ Простые математические операции .
- В разделе Функция выберите Раздел (/).
- В разделе Параметры/Опции выберите Выполнить операцию только с X-данными .

- Значение операнда должно быть площадью рабочего электрода в м 2 .
- В разделе Operand Unit Selection выберите Area из раскрывающегося меню стандартных единиц.
- Площадь нормализуется, поэтому длина единиц равна 2 . Поэтому в полях рядом с Длина (м) следует читать «2 / 1».
- В разделе Параметры/Опции выберите, следует ли заменить ось X, установив флажок перед Заменить исходную трассу . Если этот флажок не установлен, к существующему графику будут добавлены дополнительные оси. Для этого руководства снимите флажок «Заменить исходную трассировку».
- Щелкните OK .
- На полученной вольтамперограмме метка вторичной оси x теперь должна выглядеть как «Плотность тока (А/м 2 )».
- Чтобы изменить значения по оси x, дважды щелкните значения по оси x, и должно появиться диалоговое окно с надписью Axis Properties .

- В диалоговом окне в разделе Единицы снимите флажок Автоматический выбор единиц , а затем рядом с Единицы/единицы выберите ампер на квадратный сантиметр из выпадающего меню.
- Префикс метрики также можно изменить, выбрав нужный префикс из раскрывающегося списка Единицы/метрики Например, выберите микро и нажмите Применить .
- Единицы на графике теперь должны быть (мкА/см 2 ).
- Масштабом оси также можно управлять с помощью настройки Масштаб .
- Нажмите OK , чтобы сохранить изменения.
Рис. 8. Необработанные данные LPR (красный) и преобразованная плотность тока (синий) в AfterMath
В начало
5.2 и скорость коррозии после сбора данных LPR. Соответствующие константы должны быть предоставлены исследователем инструменту для выполнения этих расчетов. Требуемые значения/константы: 1) площадь рабочего электрода, 2) плотность материала рабочего электрода, 3) эквивалентный вес материала рабочего электрода и 4) константы Тафеля для исследуемой системы. Ниже приведены пошаговые инструкции по использованию инструмента LPR Baseline:
Требуемые значения/константы: 1) площадь рабочего электрода, 2) плотность материала рабочего электрода, 3) эквивалентный вес материала рабочего электрода и 4) константы Тафеля для исследуемой системы. Ниже приведены пошаговые инструкции по использованию инструмента LPR Baseline:
- Щелкните правой кнопкой мыши данные на графике LPR и выберите Добавить инструмент → Базовая линия LPR .
- На графике появится линия наилучшего соответствия со значениями коррозионного потенциала и наклона линейного сопротивления (если не были введены никакие входные данные).
- При необходимости розовые контрольные точки можно отрегулировать для более точного соответствия кривой. Длина базовой линии регулируется путем перетаскивания черных контрольных точек.
- Значения, используемые для расчета инструмента, можно изменить, щелкнув правой кнопкой мыши текстовое поле инструмента и выбрав Properties , затем выберите Baseline Tool Properties .

- Обновите значения в разделе Tafel Data . Обратите внимание, что эти значения зависят от эксперимента и необходимы для расчета скорости коррозии (см. Раздел 2.5 для обсуждения расчетов скорости коррозии).
- Нажмите OK .
- AfterMath сообщает о результирующем сопротивлении поляризации и скорости коррозии в текстовом поле на графике LPR. Если в текстовом поле отображается NaN, необходимо ввести/обновить свойства инструмента.
- Повторите шаги 1–6, чтобы обновить значения в разделе Tafel Data .
После выполнения вышеуказанных шагов график LPR должен быть обновлен текстовым полем, сообщающим расчетный ток коррозии, сопротивление поляризации и скорость коррозии (см. рис. 9).
Рис. 9. Данные LPR в AfterMath с применением инструмента LPR к данным плотности тока
В начало
60519 . Вернуться к началу 7 Приложение: Таблицы коррозии Таблица 4. Кинетические параметры электрода для катодной реакции Jones, D. A.    Принципы и предотвращение коррозии , 2 изд. Pearson: Upper Saddle River, NJ, 1995.
Джонс, Д. А.    Принципы и предотвращение коррозии , 2-е издание, изд. Пирсон: река Аппер-Сэдл, Нью-Джерси, 1995.
Пирсон: река Аппер-Сэдл, Нью-Джерси, 1995. Электрод Раствор и (А/см 2 ) ß c (V) Пт 1N HCl 10 -2 0,03 0,1 н. NaOH 7 × 10 -4 0,11 Пд 0,6 н. HCl 2 × 10 -3 0,03 Пн 1N HCl 10 -5 0,04 Золото 1N HCl 10 -5 0,05 Та 1N HCl 10 -4 0,08 Ш 5N HCl 10 -4 0,11 Аг 0,1 н.  HCl
HCl 5 × 10 -6 0,09 Никель 0,1 н. HCl 8 × 10 -6 0,31 0,12 н. NaOH 4 × 10 -6 0,10 Би 1N HCl 10 -6 0,10 № 1N HCl 10 -6 0,10 Фе 1N HCl 10 -5 0,15 0,52N H 2 SO 4 2 × 10 -5 0,11 0,4% NaCl (pH 1–4) 10 -6 0,10 Медь 0,1 н. HCl 2 × 10 -6 0,12 0,15 н. NaOH 10 -5 0,12 Сб 2N H 2 SO 4 10 -8 0,10 Ал 2N H 2 SO 4 10 -9 0,10 Бе 1N HCl 10 -8 0,12 Сн 1N HCl 10 -7 0,15 CD 1N HCl 10 -6 0,20 Цинк 1N В 2 SO 4 2 × 10 -10 0,12 рт.  ст.
ст. 0,1 н. HCl 7 × 10 -12 0,12 0,1N H 2 SO 4 2 × 10 -12 0,12 0,1 н. NaOH 3 × 10 -14 0,10 Пб 0,01 — 8N HCl 2 × 10 -12 0,12
| Реакция | Электрод | Раствор | и (А/см 2 ) | ß c (V) | ß a (В) |
| Пт | 0,1N В 2 SO 4 | 9 × 10 -11 | 0,10 | — | |
| Пт | 0,1N В 2 SO 4 | 4 × 10 -12 | 0,05 | — | |
| Золото | 0,1 н. NaOH NaOH | 5 × 10 -12 | 0,05 | — | |
| Пт | 1N HCl | 5 × 10 -3 | 0,11 | 0,13 | |
| Медь | 0,001N Cu(NO 3 ) 2 | 10 -9 | — | — | |
| Фе | 0,52N В 2 SO 4 | 10 -7 | — | 0,060 | |
| 0,52N H 2 SO 4 | 10 -10 | — | 0,039 | ||
| 0,63N FeSO 4 | 3 × 10 -9 | — | 0,060 — 0,075 | ||
| 4% NaCl (рН 1,5) | — | — | 0,068 | ||
| 0,3N H 2 SO 4 | — | — | 0,10 | ||
| 0,5M FeSO 4 в 0,1M NaHSO 4 | 3 × 10 -9 | — | 0,030 | ||
| Перхлорат | — | — | 0,030 |
Таблица 5. Кинетические параметры электрода Jones, D.A. Pearson: Upper Saddle River, NJ, 1995.
Кинетические параметры электрода Jones, D.A. Pearson: Upper Saddle River, NJ, 1995.
Вернуться к началу
Стандартная практика расчета скорости коррозии и сопутствующая информация по электрохимическим измерениям
Лицензионное соглашение ASTM
ВАЖНО — ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ЭТИ УСЛОВИЯ ПЕРЕД ВХОДОМ В ЭТОТ ПРОДУКТ ASTM.
Приобретая подписку и нажимая на это соглашение, вы вступаете в
контракт, и подтверждаете, что прочитали настоящее Лицензионное соглашение, что вы понимаете
его и соглашаетесь соблюдать его условия. Если вы не согласны с условиями настоящего Лицензионного соглашения,
немедленно покиньте эту страницу, не входя в продукт ASTM.
1. Право собственности:
Этот продукт защищен авторским правом как
компиляции и в виде отдельных стандартов, статей и/или документов («Документы») ASTM
(«ASTM»), 100 Barr Harbour Drive, West Conshohocken, PA 19. 428-2959 США, если не указано иное
428-2959 США, если не указано иное
прямо указано в тексте отдельных документов. Все права защищены. Ты
(Лицензиат) не имеет прав собственности или иных прав на Продукт ASTM или Документы.
Это не продажа; все права, право собственности и интерес к продукту или документам ASTM
(как в электронном, так и в печатном виде) принадлежат ASTM. Вы не можете удалять или скрывать
уведомление об авторских правах или другое уведомление, содержащееся в Продукте или Документах ASTM.
2. Определения.
A. Типы лицензиатов:
(i) Индивидуальный пользователь:
один уникальный компьютер с индивидуальным IP-адресом;
(ii) Одноместный:
одно географическое местоположение или несколько
объекты в пределах одного города, входящие в состав единой организационной единицы, управляемой централизованно;
например, разные кампусы одного и того же университета в одном городе управляются централизованно.
(iii) Multi-Site:
организация или компания с
независимое управление несколькими точками в одном городе; или организация или
компания, расположенная более чем в одном городе, штате или стране, с центральным управлением для всех местоположений.
B. Авторизованные пользователи:
любое лицо, подписавшееся
к этому Продукту; если Site License также включает зарегистрированных студентов, преподавателей или сотрудников,
или сотрудник Лицензиата на Одном или Множественном Сайте.
3. Ограниченная лицензия.
ASTM предоставляет Лицензиату ограниченное,
отзывная, неисключительная, непередаваемая лицензия на доступ посредством одного или нескольких
авторизованные IP-адреса и в соответствии с условиями настоящего Соглашения использовать
разрешенных и описанных ниже, каждого Продукта ASTM, на который Лицензиат подписался.
A. Конкретные лицензии:
(i) Индивидуальный пользователь:
(a) право просматривать, искать, извлекать, отображать и просматривать Продукт;
(b) право скачивать, хранить или распечатывать отдельные копии
отдельных Документов или частей таких Документов исключительно для собственного использования Лицензиатом.
То есть Лицензиат может получить доступ к электронному файлу Документа (или его части) и загрузить его.
Документа) для временного хранения на одном компьютере в целях просмотра и/или
печать одной копии документа для личного пользования. Ни электронный файл, ни
единственный печатный отпечаток может быть воспроизведен в любом случае. Кроме того, электронный
файл не может распространяться где-либо еще по компьютерным сетям или иным образом. Это
Это
электронный файл нельзя отправить по электронной почте, загрузить на диск, скопировать на другой жесткий диск или
в противном случае разделены. Одна печатная копия может быть распространена среди других только для их
внутреннее использование в вашей организации; его нельзя копировать. Индивидуальный загруженный документ
иным образом не может быть продана или перепродана, сдана в аренду, сдана в аренду, одолжена или сублицензирована.
(ii) Односайтовые и многосайтовые лицензии:
(a) право просматривать, искать, извлекать, отображать и просматривать Продукт;
(b) право скачивать, хранить или распечатывать отдельные копии
отдельных Документов или частей таких Документов для личных целей Авторизованного пользователя.
использовать и передавать такие копии другим Авторизованным пользователям Лицензиата в компьютерной сети Лицензиата;
(c) если образовательное учреждение, Лицензиату разрешается предоставлять
печатная копия отдельных Документов отдельным учащимся (Авторизованные пользователи) в классе по месту нахождения Лицензиата;
(d) право на отображение, загрузку и распространение печатных копий
Документов для обучения Авторизованных пользователей или групп Авторизованных пользователей.
(e) Лицензиат проведет всю необходимую аутентификацию
и процессы проверки, чтобы гарантировать, что только авторизованные пользователи могут получить доступ к продукту ASTM.
(f) Лицензиат предоставит ASTM список авторизованных
IP-адреса (числовые IP-адреса домена) и, если многосайтовый, список авторизованных сайтов.
B. Запрещенное использование.
(i) Настоящая Лицензия описывает все разрешенные виды использования. Любой другой
использование запрещено, является нарушением настоящего Соглашения и может привести к немедленному прекращению действия настоящей Лицензии.
(ii) Авторизованный пользователь не может производить этот Продукт, или
Документы, доступные любому, кроме другого Авторизованного Пользователя, будь то по интернет-ссылке,
или разрешив доступ через его или ее терминал или компьютер; или другими подобными или отличными средствами или договоренностями.
(iii) В частности, никто не имеет права передавать, копировать,
или распространять любой Документ любым способом и с любой целью, за исключением случаев, описанных в Разделе
3 настоящей Лицензии без предварительного письменного разрешения ASTM. Особенно,
за исключением случаев, описанных в Разделе 3, никто не может без предварительного письменного разрешения
ASTM: (a) распространять или пересылать копию (электронную или иную) любой статьи, файла,
или материал, полученный из любого продукта или документа ASTM; (b) воспроизводить или фотокопировать любые
стандарт, статья, файл или материал из любого продукта ASTM; в) изменять, видоизменять, приспосабливать,
или переводить любой стандарт, статью, файл или материал, полученный из любого продукта ASTM;
(d) включать любой стандарт, статью, файл или материал, полученный из любого продукта ASTM или
Документировать в других произведениях или иным образом создавать любые производные работы на основе любых материалов.
получено из любого продукта или документа ASTM; (e) взимать плату за копию (электронную или
иным образом) любого стандарта, статьи, файла или материала, полученного из любого продукта ASTM или
Документ, за исключением обычных расходов на печать/копирование, если такое воспроизведение разрешено
по разделу 3; или (f) систематически загружать, архивировать или централизованно хранить существенные
части стандартов, статей, файлов или материалов, полученных из любого продукта ASTM или
Документ. Включение печатных или электронных копий в пакеты курсов или электронные резервы,
или для использования в дистанционном обучении, не разрешено настоящей Лицензией и запрещено без
Предварительное письменное разрешение ASTM.
(iv) Лицензиат не может использовать Продукт или доступ к
Продукт в коммерческих целях, включая, помимо прочего, продажу Документов,
материалы, платное использование Продукта или массовое воспроизведение или распространение Документов
в любой форме; а также Лицензиат не может взимать с Авторизованных пользователей специальные сборы за использование
Продукт сверх разумных расходов на печать или административные расходы.
C. Уведомление об авторских правах . Все копии материала из ASTM
Продукт должен иметь надлежащее уведомление об авторских правах от имени ASTM, как показано на начальной странице.
каждого стандарта, статьи, файла или материала. Сокрытие, удаление или изменение
уведомление об авторских правах не допускается.
4. Обнаружение запрещенного использования.
A. Лицензиат несет ответственность за принятие разумных мер
для предотвращения запрещенного использования и незамедлительного уведомления ASTM о любых нарушениях авторских прав или
запрещенное использование, о котором Лицензиату стало известно. Лицензиат будет сотрудничать с ASTM
при расследовании любого такого запрещенного использования и предпримет разумные шаги для обеспечения
прекращение такой деятельности и предотвращение ее повторения.
B. Лицензиат должен прилагать все разумные усилия для защиты
Продукт от любого использования, не разрешенного настоящим Соглашением, и уведомляет
ASTM о любом использовании, о котором стало известно или о котором было сообщено.
5. Постоянный доступ к продукту.
ASTM резервирует
право прекратить действие настоящей Лицензии после письменного уведомления, если Лицензиат существенно нарушит
условия настоящего Соглашения. Если Лицензиат не оплачивает ASTM какую-либо лицензию или
абонентской платы в установленный срок, ASTM предоставит Лицензиату 30-дневный период в течение
что бы вылечить такое нарушение. Для существенных нарушений период устранения не предоставляется
связанные с нарушениями Раздела 3 или любыми другими нарушениями, которые могут привести к непоправимым последствиям ASTM.
вред. Если подписка Лицензиата на Продукт ASTM прекращается, дальнейший доступ к
онлайн-база данных будет отклонена. Если Лицензиат или Авторизованные пользователи существенно нарушают
настоящую Лицензию или запрещать использование материалов в любом продукте ASTM, ASTM оставляет за собой право
право отказать Лицензиату в любом доступе к Продукту ASTM по собственному усмотрению ASTM.
6. Форматы доставки и услуги.
A. Некоторые продукты ASTM используют стандартный интернет-формат HTML.
ASTM оставляет за собой право изменить такой формат с уведомлением Лицензиата за три [3] месяца,
хотя ASTM приложит разумные усилия для использования общедоступных форматов.
Лицензиат и Авторизованные пользователи несут ответственность за получение за свой счет
подходящие подключения к Интернету, веб-браузеры и лицензии на любое необходимое программное обеспечение
для просмотра продуктов ASTM.
B. Продукты ASTM также доступны в Adobe Acrobat
(PDF) Лицензиату и его Авторизованным пользователям, которые несут единоличную ответственность за установку
и настройка соответствующего программного обеспечения Adobe Acrobat Reader.
C. ASTM приложит разумные усилия для обеспечения онлайн-доступа
доступны на постоянной основе. Доступность будет зависеть от периодического
перерывы и простои для обслуживания сервера, установки или тестирования программного обеспечения,
загрузка новых файлов и причины, не зависящие от ASTM. ASTM не гарантирует доступ,
и не несет ответственности за ущерб или возврат средств, если Продукт временно недоступен,
или если доступ становится медленным или неполным из-за процедур резервного копирования системы,
объем трафика, апгрейды, перегрузка запросов к серверам, общие сбои сети
или задержки, или любая другая причина, которая может время от времени делать продукт недоступным
для Лицензиата или Авторизованных пользователей Лицензиата.
7. Условия и стоимость.
A. Срок действия настоящего Соглашения _____________ («Период подписки»).
Доступ к Продукту предоставляется только на Период Подписки. Настоящее Соглашение останется в силе
после этого для последовательных Периодов подписки при условии, что ежегодная абонентская плата, как таковая, может
меняются время от времени, оплачиваются. Лицензиат и/или ASTM имеют право расторгнуть настоящее Соглашение.
в конце Периода подписки путем письменного уведомления, направленного не менее чем за 30 дней.
B. Сборы:
8. Проверка.
ASTM имеет право проверять соответствие
с настоящим Соглашением, за свой счет и в любое время в ходе обычной деятельности
часы. Для этого ASTM привлечет независимого консультанта при соблюдении конфиденциальности.
соглашение, для проверки использования Лицензиатом Продукта и/или Документов ASTM. Лицензиат соглашается
разрешить доступ к своей информации и компьютерным системам для этой цели. Проверка
состоится после уведомления не менее чем за 15 дней, в обычные рабочие часы и в
таким образом, чтобы не создавать необоснованного вмешательства в деятельность Лицензиата. Если
проверка выявляет нелицензионное или запрещенное использование продуктов или документов ASTM,
Лицензиат соглашается возместить ASTM расходы, понесенные при проверке и возмещении
ASTM для любого нелицензированного/запрещенного использования. Применяя эту процедуру, ASTM не отказывается от
любое из своих прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности путем
любым другим способом, разрешенным законом. Лицензиат признает и соглашается с тем, что ASTM может внедрять
Лицензиат признает и соглашается с тем, что ASTM может внедрять
определенная идентифицирующая или отслеживающая информация в продуктах ASTM, доступных на Портале.
9. Пароли:
Лицензиат должен немедленно уведомить ASTM
о любом известном или предполагаемом несанкционированном использовании(ях) своего пароля(ей) или о любом известном или предполагаемом
нарушение безопасности, включая утерю, кражу, несанкционированное раскрытие такого пароля
или любой несанкционированный доступ или использование Продукта ASTM. Лицензиат несет исключительную ответственность
для сохранения конфиденциальности своего пароля (паролей) и для обеспечения авторизованного
доступ и использование Продукта ASTM. Личные учетные записи/пароли не могут быть переданы.
10. Отказ от гарантии:
Если не указано иное в настоящем Соглашении,
все явные или подразумеваемые условия, заверения и гарантии, включая любые подразумеваемые
гарантия товарного состояния, пригодности для определенной цели или ненарушения прав
отказываются от ответственности, за исключением случаев, когда такие отказы признаются юридически недействительными.
11. Ограничение ответственности:
В случаях, не запрещенных законом,
ни при каких обстоятельствах ASTM не несет ответственности за любые потери, повреждения, потерю данных или за особые, косвенные,
косвенные или штрафные убытки, независимо от теории ответственности,
возникающие в результате или в связи с использованием продукта ASTM или загрузкой документов ASTM.
Ни при каких обстоятельствах ответственность ASTM не будет превышать сумму, уплаченную Лицензиатом по настоящему Лицензионному соглашению.
12. Общие.
A. Прекращение действия:
Настоящее Соглашение действует до
прекращено. Лицензиат может расторгнуть настоящее Соглашение в любое время, уничтожив все копии
(на бумажном, цифровом или любом носителе) Документов ASTM и прекращении любого доступа к Продукту ASTM.
B. Применимое право, место проведения и юрисдикция:
Это
Соглашение должно толковаться и толковаться в соответствии с законодательством
Содружество Пенсильвании. Лицензиат соглашается подчиняться юрисдикции и месту проведения
в суды штата и федеральные суды Пенсильвании по любому спору, который может возникнуть в соответствии с настоящим
Соглашение. Лицензиат также соглашается отказаться от любых претензий на неприкосновенность, которыми он может обладать.
C. Интеграция:
Настоящее Соглашение представляет собой полное соглашение
между Лицензиатом и ASTM в отношении его предмета. Он заменяет все предыдущие или
одновременные устные или письменные сообщения, предложения, заверения и гарантии
и имеет преимущественную силу над любыми противоречащими или дополнительными условиями любой цитаты, заказа, подтверждения,
или другое сообщение между сторонами, относящееся к его предмету в течение срока действия
настоящего Соглашения. Никакие изменения настоящего Соглашения не будут иметь обязательной силы, если они не будут в письменной форме
Никакие изменения настоящего Соглашения не будут иметь обязательной силы, если они не будут в письменной форме
и подписан уполномоченным представителем каждой стороны.
D. Назначение:
Лицензиат не может назначать или передавать
свои права по настоящему Соглашению без предварительного письменного разрешения ASTM.
E. Налоги.
Лицензиат должен уплатить все применимые налоги,
за исключением налогов на чистый доход ASTM, возникающий в результате использования Лицензиатом Продукта ASTM.
и/или права, предоставленные по настоящему Соглашению.
Материалы – коррозия и допуск на коррозию
Зная ожидаемую общую скорость коррозии и ожидаемый срок службы или срок службы детали, конструктор может рассчитать дополнительную толщину, необходимую для коррозионной стойкости проектируемого технологического оборудования.
После определения толщины стенки, которая соответствует механическим требованиям, таким как давление, температура и вес оборудования, к толщине стенки добавляется дополнительная толщина, называемая «припуском на коррозию», чтобы компенсировать ожидаемую потерю металла в течение срока службы оборудование. Затем, поскольку глубина проникновения очень велика, поправке на коррозию присваивается коэффициент безопасности, равный двум.
Пример..
Стенка резервуара должна иметь толщину 5 мм по механическим соображениям. Проектировщик определил, что скорость коррозии составит 0,4 мм/год, а ожидаемый срок службы резервуара составит 10 лет. Суммарный припуск на коррозию – это скорость коррозии в год (0,4 мм x 10 лет = 4 мм).
Из соображений безопасности допуск на коррозию удвоен до 8 мм.
Расчет допусков на коррозию
Допуски на коррозию определяются не только проектировщиком, но также и особенно государственными или местными органами. Последние часто имеют многолетний опыт работы с местными условиями и особенно с погодными условиями в соответствующем районе.
Последние часто имеют многолетний опыт работы с местными условиями и особенно с погодными условиями в соответствующем районе.
Влажность, температура, дождь, ветер, примеси и время намокания металла влияют на скорость коррозии. Коррозия возникает при относительной влажности воздуха от 70 до 80%. Как правило, коррозионная реакция возможна при температуре выше 0°C и относительной влажности более 80% (поверхность влажная). Примеси воздуха, растворяющиеся в конденсате или дождевой воде, могут ускорить коррозию. Оседание пыли и грязи на поверхности металла ускоряет атмосферную коррозию.
Скорость коррозии выражается в миллиметрах в год поверхностных потерь и используется для обеспечения допуска на коррозию при расчетной толщине оборудования, такого как сосуды и трубопроводы.
Операторы часто используют данные, основанные на историческом опыте работы завода, чтобы помочь им определить соответствующие допуски на коррозию. В качестве альтернативы широко доступны диаграммы коррозии, в которых указаны скорости коррозии для многих комбинаций конструкционных материалов и технологических жидкостей, и обычно для различных температур процесса предоставляется диапазон значений.
В некоторых случаях, особенно при наличии смеси химических веществ, соответствующие данные могут отсутствовать, и для определения пригодности оборудования могут потребоваться испытания на коррозию. Операторы должны быть в состоянии продемонстрировать использование допусков на коррозию в спецификации и конструкции оборудования. Источники используемых данных должны быть прослеживаемыми.
AMPP — The Association for Materials
Protection and Performance
Насколько мне известно, в ASME B31.3 не существует допусков на коррозию. Допуски на коррозию обычно устанавливаются конечным пользователем и в некоторой степени основаны на личных предпочтениях и отраслевых традициях. 1,5 мм для трубопровода является общепринятым стандартом, но вы можете установить допуск на коррозию по своему усмотрению, если только государственное или местное учреждение не приняло и не заменило B31.3. Чтобы указать трубу, добавьте допуск на коррозию к минимальной расчетной толщине и выберите спецификацию трубы, которая равна или больше минимума + допуск на коррозию.
Ниже приведены две таблицы с рекомендациями по припуску на коррозию
| Припуск на коррозию для стальных труб | мм |
| Перегретый пар | 0,3 |
| Насыщенный пар | 0,8 |
| Паровые змеевики в грузовых танках и баках для жидкого топлива | 2,0 |
| Питательная вода для котлов в системах открытого цикла | 1,5 |
| Питательная вода для котлов в системах замкнутого цикла | 0,5 |
| Системы продувки котлов | 1,5 |
| Сжатый воздух | 1,0 |
| Гидравлическое масло | 0,3 |
| Смазочное масло | 0,3 |
| Мазут | 1,0 |
| Термомасло | 1,0 |
| Пресная вода | 0,8 |
| Морская вода | 3,0 |
| Хладагенты, указанные в Разделе 13 | 0,3 |
| Грузовые системы для нефтяных танкеров | 2,0 |
| Грузовые системы для судов, перевозящих сжиженные газы | 0,3 |
Примечания. .
.
- Для труб, проходящих через резервуары, необходимо учитывать дополнительный припуск на коррозию, чтобы учесть внешнюю коррозию.
- Примечание 2. Припуск на коррозию труб, эффективно защищенных от коррозии, может быть уменьшен не более чем на 50 %.
- Примечание 3. Когда коррозионная стойкость легированных сталей подтверждена надлежащим образом, допуском на коррозию можно пренебречь.
| Прибавка на коррозию для труб из цветных металлов | мм |
| Медь | 0,8 |
| Латунь | 0,8 |
| Медно-оловянные сплавы | 0,8 |
| Медно-никелевые сплавы с содержанием Ni менее 10 % | 0,8 |
| Медно-никелевые сплавы с содержанием Ni не менее 10 % | 0,5 |
| Алюминий и алюминиевые сплавы | 0,5 |
Примечания..
- Допуск на коррозию для других материалов будет специально рассмотрен Обществом.
 Если их коррозионная стойкость подтверждена надлежащим образом, допуск на коррозию можно не принимать во внимание.
Если их коррозионная стойкость подтверждена надлежащим образом, допуск на коррозию можно не принимать во внимание. - Примечание 2. В случае сред с высокой коррозионной активностью Общество может потребовать более высокий допуск на коррозию.
Интересные статьи
Допуск на коррозию, общий
Допуск на коррозию — это мера, используемая при техническом обслуживании.
Допуск на коррозию 3,0 мм означает, что, например, толщина стенки без проблем может быть уменьшена на 3,0 мм.
Имейте в виду, это не означает, что достигнута минимальная толщина стенки и срок службы объекта истек.
Пример.. часть оборудования имеет толщину стенки 10 мм с допуском на коррозию 3,0 мм. При толщине стенки 7,0 мм действие требуется, так как указанный припуск на коррозию полностью израсходован.
Обратите внимание, когда припуск на коррозию израсходован почти полностью.
- Какова скорость коррозии. Является ли это линейным или прогрессивным произошло.

- Какая толщина стены была при строительстве.
- Имеются ли базовые измерения.
- Изменились ли условия процесса.
- Возникла эрозия в сочетании с коррозией.
- Можем ли мы получить следующий период проверки.
- Какая необходима толщина стенки конструкции.
- Нужно ли делать перерасчет.
- Мониторинг толщины стенки в процессе (превентивный контроль).
- Необходимо заменить оборудование при следующем отключении.
- Должен быть из того же материала, что и при возможной замене.
- Измерения толщины стенок достоверны.
Краска и температура могут повлиять на результаты измерения. - Произошел ли спад внутренний или внешний, или их комбинация.
- Может ли оборудование оставаться в эксплуатации или оно должно быть выведено из эксплуатации.
Примечания автора…
Мое мнение о припуске на коррозию
- Джентльмен по имени Аллен Хейзен, блестящий студент-химик Массачусетского технологического института в 1888 году, говорит.
 ..
..
«Мне кажется, что увеличение толщины стальных пластин обычно не очень выгодно из-за этого соображения (а именно, что утолщение пластин не устраняет проблему, а просто продлевает срок службы металла), но что деньги лучше потратить на лучшее покрытие и более тщательный осмотр стальных листов, или, другими словами, на предотвращение питтинга вместо того, чтобы пытаться сделать лист достаточно толстым, чтобы питтинг не проходил через него».
Это заявление г-на Хейзена состоит в том, чтобы подумать о припуске на коррозию… или нет? - Только после долгих жизненных испытаний, думаю, можно приблизиться к реальности.
Расчеты зависят от сотен факторов и, по моему мнению, не дают гарантии того, что будет применен надлежащий допуск на коррозию.
Я работал на технологическом предприятии с минимальным сроком службы 15-20 лет.
Спустя 7 лет (вероятнее, раньше) были выявлены первые серьезные проблемы с коррозией, а одной из самых крупных и опытных инжиниринговых компаний завод был спроектирован.
Хорошо, инженерные компании имеют большой опыт и выполнят наилучшую обработку поверхности, но… Если будет найдена правильная спецификация краски, к сожалению, есть много других проблем, которые все еще вызывают коррозию. - Как инжиниринговая компания может гарантировать, что при строительстве нового завода все монтажные швы получат надлежащую обработку поверхности? Нет гарантии !
- Как инжиниринговая компания может гарантировать, что после завершения строительства нового завода вся изоляция будет водонепроницаемой? Нет гарантии !
- Как инжиниринговая компания может гарантировать это… и т.д.
Мы, люди, можем многое, но бессильны против Матери-Природы.
Целостность инфраструктурных материалов и конструкций Октябрь 2009 г.
РАСЧЕТЫ
В этом приложении расчеты, которые использовались для преобразования лабораторных измерений в единицы в тексте,
таблицы и графики приведены в качестве примера.
Пример 1.
 Преобразование веса/площади (коррозия в г/дюйм2) в милы (или мм) Коррозия
Преобразование веса/площади (коррозия в г/дюйм2) в милы (или мм) Коррозия
Проникновение
Данные для образца W48: условия испытаний: 30 циклов, 2 замачивания, 0,5% NaCl и pH 8.
| Типовые данные | Вес (начальный) | Вес (Окончательный) | Зона (Д по Шx2) | Коррозия (вес/дюймы 2 ) |
|---|---|---|---|---|
| Купон W48 | 124, г | 119,02947 г | 34,16 дюйма 2 | 0,1721 г/дюйм 2 |
1 дюйм = 25,4 мм
1 унция = 28,35 г
Перевести в сантиметры:
Преобразовать вес на единицу площади поверхности в пенетрацию (разделить на плотность):
Также:
Преобразование в милы (1 дюйм = 1000 мил):
Скорость проникновения в мм, м, см или милах для коррозии, возникающей на одной поверхности. В
В
в случае коррозии, происходящей с обеих сторон, общая потеря толщины будет удвоена.
Пример 2. Преобразование тока ZRA в кулоны
Где:
I = Ток.
t = Время.
А = Ампер.
с = Секунды.
C = Кулоны.
Регистратор данных ZRA регистрировал усредненный ток (i) каждый час.
Восьмиразрядный аналого-цифровой преобразователь сохранил сумму шести показаний в шестнадцатеричном формате
формат, то есть суммированные восьмибитные показания (от 0 до 255 шестнадцатеричных) суммировались для получения
значение между нулем и 05 FA (hex) и сохраняется.Сохраненные данные были загружены из регистратора на компьютер. Масштабирование было
255 (шестнадцатеричный) = 100 мкА (полная шкала).Макрос Microsoft Excel® преобразует шестнадцатеричное число в десятичное, делит на 6 и масштабирует на
100/255.
Результат: среднее значение тока в мкА в час.
Макрос Microsoft Excel® также суммировал среднечасовые показания тока (в
микроампер) и умножил их на 3600 с, чтобы получить микрокулоны ( i × t = C ).
Пример: Для постоянных показаний с половинной шкалой (50 мкА) в течение 15 дней, переведенных в кулоны:
Обратите внимание, что регистратор данных каждый час записывает значение, равное среднему значению тока. В этом
например, каждый час измеряли 0,18°C. Суммирование (интегрирование) этих почасовых значений за 15 дней
выход 64,8°С.
Пример 3. Преобразование выходного сигнала датчика (мкА) в скорость коррозии (млн/год или мм/год)
Закон электролиза Фарадея:
Где:
м = Масса (г).
I = Ток (А).
t = Время (с).
a = Атомный вес; ( г ).
n = Количество эквивалентов, eq (количество обмененных электронов, для Fe = Fe 2 + + 2e — ).
F = постоянная Фарадея, 96 500 C на эквивалент.
Для выхода 1 мкА в год (напомним, что C=A × s):
Для выхода 1 мкА на площади 1 см 2 и при плотности железа 7,87 г/см 3 :
Уравнение 17 демонстрирует преобразование постоянной или средней плотности тока в милы в год.
или мм в год. Регистратор данных предоставил среднее значение шести текущих измерений за 10 минут.
интервалы каждый час. Эти среднечасовые значения суммированы и представлены в таблице 15.
Пример 4. Сравнение результатов измерения потери массы и датчика с точки зрения проникновения
Зона анода датчика представляет собой двухмерное кольцо между внутренней шайбой r 1 и наружной шайбой с покрытием.
периметр, р 2 :
Чтобы рассчитать потерю массы из загруженного преобразованного выходного сигнала датчика (микроампер),
подставьте C = A × s (т. е. замените It в уравнении 15 на кулоновское значение). Например, используйте первое значение (7 261 мкА) в таблице 15, которое представляет собой часовое значение, требующее преобразования в секунды.
е. замените It в уравнении 15 на кулоновское значение). Например, используйте первое значение (7 261 мкА) в таблице 15, которое представляет собой часовое значение, требующее преобразования в секунды.
(1 ч = 3600 с) следующим образом:
Расчетная потеря массы на единицу площади анода датчика преобразуется в пенетрацию с использованием
плотность железа следующая:
Для кабельного датчика невозможно было провести прямое сравнение с потерей веса с имеющимися данными.
Оценку скорости коррозии (проникновения) проводили на основании площади сенсора и выходного тока.
Расчет площади, где:
| Диаметр анодной проволоки | = 0,08 см. |
| Активная длина | = 2,5 см. |
| Площадь анода π dl = 3,14 × 0,08 см × 2,5 см | = 0,63 см 2 .
|