Характеристика элемента медь: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов / Справочник :: Бингоскул
Содержание
1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
Понятие
переходный элемент обычно используется
для обозначения любого из d-
или f-элементов.
Эти элементы занимают переходное
положение между электроположительными
s-элементами
и электроотрицательными p-элементами.
d-элементы
образуют три переходных ряда — в 4-м,
5-м и 6-м периодах соответственно.
Первый
переходный ряд включает 10 элементов,
от скандия до цинка. Он характеризуется
внутренней застройкой 3d-орбиталей.
Хром и медь имеют на 4s-орбиталях
всего по одному электрону. Дело в том,
что полузаполненные или заполненные
d-подоболочки
обладают большей устойчивостью, чем
частично заполненные.
В
атоме хрома на каждой из пяти 3d-орбиталей,
образующих 3d-подоболочку,
имеется по одному электрону. Такая
подоболочка является полузаполненной.
Cr24 1s22s22p63s23p64s13d5
Для
атома хрома электроно-графическая
формула выглядит так:
Это
явление называется проскок (провал)
электрона.
В
атоме меди на каждой из пяти 3d-орбиталей
находится по паре электронов (аналогичным
образом объясняется аномалия серебра).
Cu29 1s22s22p63s23p64s13d10
Все
d-элементы
являются металлами. Большинство из них
имеет характерный металлический блеск.
По сравнению с s-металлами
их прочность в целом значительно выше.
В частности, для них характерны свойства:
высокий предел прочности на разрыв;
тягучесть; ковкость (их можно расплющить
ударами в листы).
d-элементы
и их соединения обладают рядом характерных
свойств: переменные состояния окисления;
способность к образованию комплексных
ионов; образование окрашенных соединений.
d-элементы
характеризуются также более высокой
плотностью по сравнению с другими
металлами. Это объясняется сравнительно
малыми радиусами их атомов. Атомные
радиусы этих металлов мало изменяются
в этом ряду.
d-элементы
— хорошие проводники электрического
тока, особенно те из них, в атомах которых
имеется только один внешний s-электрон
сверх полузаполненной или заполненной
d-оболочки.
Например,
медь.
Химические
свойства.
Электроотрицательность и энергии
ионизации металлов первого переходного
ряда возрастают в направлении от хрома
к цинку. Это означает, что металлические
свойства элементов первого переходного
ряда постепенно ослабевают в указанном
направлении. Такое изменение их свойств
проявляется и в последовательном
возрастании окислительно-восстановительных
потенциалов с переходом от отрицательных
к положительным значениям.
Хром
— твердый голубовато-белый металл. При
При
высоких температурах горит в кислороде
с образованием Сr2О3,
реагирует с парами воды
2Сr
+ 3Н2O
Сr2О3
+ 3Н2
и
с галогенами, образуя галогениды состава
СrГ3.
Хром (так же, как алюминий) пассивируется
холодными концентрированными Н2SО4
и НNО3.
Однако при сильном нагревании эти
кислоты растворяют хром:
2Сr
+ 6Н2SО4(конц)
= Сr2(SО4)3
+ 3SО2↑
+ 6Н2О,
Сr
+ 6НNО3(конц)
= Сr(NО3)3
+ 3NO2↑
+ 3Н2О.
При
обычной температуре хром растворяется
в разбавленных кислотах (НСl,
Н2SО4)
с выделением водорода, образуя соли
Сr2+.
Обрабатывая их растворы щелочами,
получают желтый осадок гидроксида
хрома (II):
СrСl2
+ 2 NaОН
= Сr(ОН)2↓
+ 2 NaСl.
Соли
Cr3+
сходны с аналогичными солями алюминия.
При действии щелочей на соли Сr3+
выпадает
студнеобразный осадок гидроксида хрома
(III)
зеленого цвета:
Сr2(SО4)3
+ 6 NaОН
= 2 Сr(ОН)3↓
+ 3 Na2SО4,
обладающий
амфотерными свойствами. Он растворяется
как в кислотах с образованием солей
хрома (III)
2
Сr(ОН)3
+ 3 Н2SО4
= Сr2(SО4)3
+ 6 Н2О,
так
и в щелочах с образованием комплексной
соли
Сr(ОН)3
+ 3КОН = К3[Cr(ОН)6].
Наиболее
важными соединениями хрома в высшей
степени окисления +6 хромат калия К2СrО4
и дихромат калия К2Сr2О7.
В
кислой среде ион CrO42-
превращается
в ион Сr2О72-
. В щелочной среде эта реакция протекает
В щелочной среде эта реакция протекает
в обратном направлении:
Железо
На
воздухе в присутствии влаги ржавеет:
4Fе
+ 3O2
+ 6Н2О
= 4Fе(ОН)3.
С
галогенами оно образует галогениды
железа (III)
2Fе
+ 3Вr2
= 2FеВr3,
а
взаимодействуя с соляной и разбавленной
серной кислотами соли железа(II),
так как катион водорода Н+
является слабым окислителем:
Fе
+ Н2SО4
= FеSО4
+ Н2↑.
Концентрированные
(НNО3,
Н2SО4)
пассивируют железо на холоде, однако
растворяют его при нагревании:
2Fе
+ 6Н2SО4(конц)
= Fе2(SО4)3
+ 3SО2↑
+ 6Н2О,
Fе
+ 6НNО3(конц)
= Fе(NО3)3
+ 3NО2↑
+ 3Н2О.
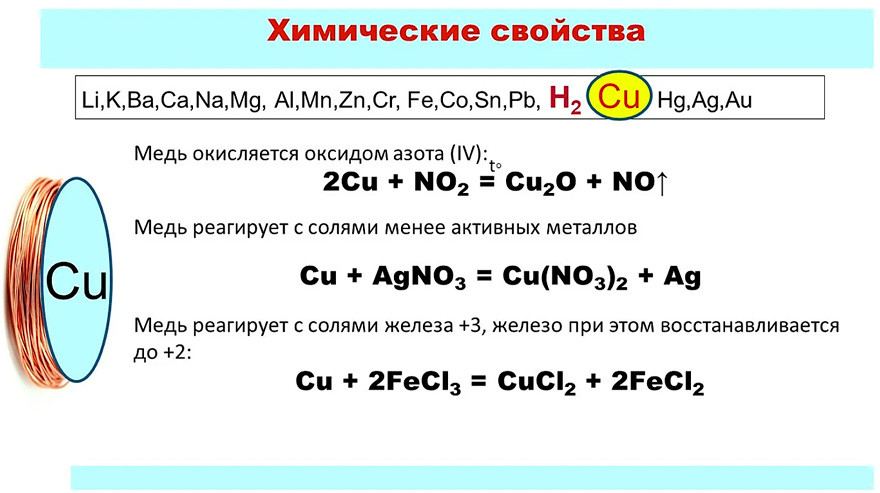
Медь
– довольно мягкий металл красно-желтого
цвета, обладающий наименьшей активностью
среди рассмотренных выше переходных
металлов, которые вытесняют ее из
растворов солей. Медь не реагирует с
соляной и разбавленной серной кислотами
и растворяется только в кислотах –
окислителях:
Сu
+ 2 Н2SО4(конц)
= СuSО4
+ SО2↑
+ 2 Н2О,
Сu
+ 4 НNO3(конц)
= Сu(NО3)2
+ 2 NО2↑
+ 2 Н2О,
3
Cu
+ 8 НNО3(разб)
= 3 Сu(NO3)2
+ 2 NO↑
+ 4 Н2О.
Известны
соединения меди со степенями окисления
+1 и +2, из которых +2 более устойчива.
Ионы
Сu2+
в водном растворе существуют в виде
комплексов гексааквамеди (II)
[Сu(Н2О)6]2+,
придающих раствору сине-голубую окраску.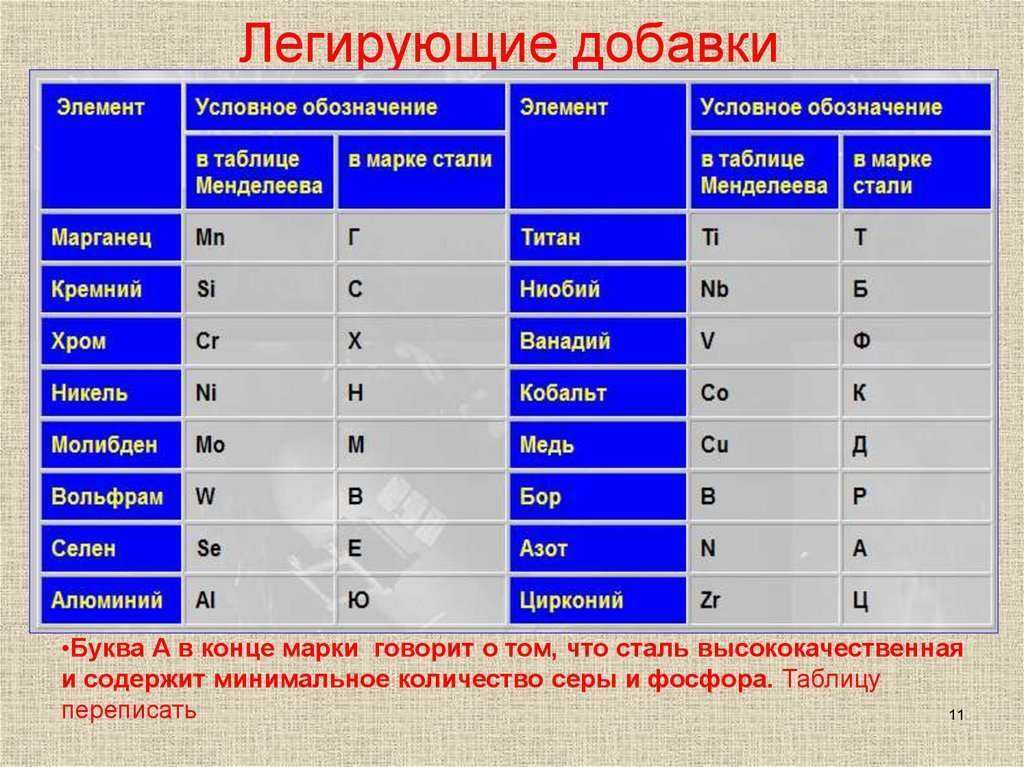
Основная
соль меди – медный купорос CuSO4.5H2O
голубого цвета, но при прокаливании
теряет воду и становится белого цвета,
т.е. окраску раствору придает комплексный
ион. Более точное строение медного
купороса [Cu(H2O)4]SO4
H2O.
Цинк
амфотерный металл. Валентные
электроны атома цинка 4s23d10.
Так как все d-орбитали
у цинка заполнены электронами, все его
соли бесцветны. Это объясняется теорией
кристаллического поля лигандов. В
соединениях проявляет только одну
степень окисления +2.
Взаимодействует
с кислотами:
Zn
+ 2HCl
= ZnCl2
+ H2
Zn
+ H2SO4(разб)
= ZnSO4
+ H2
Zn
+ 2H2SO4(конц)
= ZnSO4
+ SO2
+ 2H2O
4Zn+10HNO3(разб)=4Zn(NO3)2+NH4NO3+3H2O.
Zn
+ 4HNO3(конц)
= Zn(NO3)2
+ 2NO2
+ 2H2O
Взаимодействует
со щелочами: реагирует с растворами
щелочей с образованием гидроксокомплексов,
при сплавлении образует цинкаты:
Zn
+ 2NaOH + 2H2O
= Na2[Zn(OH)4]
+ H2
Zn
+ 2KOH = K2ZnO2
+ H2
2.Физические и химические свойства:
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Самарский
государственный университет»
БИОЛОГИЧЕСКИЙ
ФАКУЛЬТЕТ
КАФЕДРА
ЭКОЛОГИИ, БОТАНИКИ И ОХРАНЫ ПРИРОДЫ
Геохимические
особенности и биогеохимическая роль
меди
Контрольная
самостоятельная работа
Направление
020400 – Биология
Выполнила
студентка 1 курса
Сотникова
Лариса Сергеевна
Подпись_________________
Преподаватель:
Доктор
биологических наук,
профессор
Прохорова
Наталья
Владимировна
Подпись_________________
Оценка_________________
Самара
20__
СОДЕРЖАНИЕ
Введение…………………………………………………………………………2
1. Общая
Общая
характеристика меди как химического
элемента………………………….3
2.Медь
в окружающей природной
среде……………………………………………………7
2.0
Биологическая
роль………………………………………………………….8
2.1
Медь в земной коре и ее структурных
компонентах…………..………….9
2.2
Геохимия
меди…………………………………………………………………………………..10
3.Основные
типы генезиса наиболее крупных
месторождений………………13
4.Получение………………………………………………………………………14
5.Применение……………………………………………………………………15
6.Способы
добычи………………………………………………………………16
7Литература……………………………………………………………………..18
МЕДЬ
(лат. Cuprum), Cu (читается «купрум»), химический
элемент I группы периодической системы
Менделеева, атомный номер 29, атомная
масса 63,546.
1.Общая
характеристика меди.
Природная
медь состоит из двух стабильных нуклидов
63Cu
(69,09% по массе) и 65Cu
(30,91%). Конфигурация двух внешних
электронных слоев нейтрального атома
меди 3s2p6d104s1.
Образует соединения в степенях окисления
+2 (валентность II) и +1 (валентность I),
очень редко проявляет степени окисления
+3 и +4.
В
периодической системе Менделеева медь
расположена в четвертом периоде и входит
в группу IВ, к которой относятся такие
благородные металлы, как серебро (Ag) и
золото (Au).
Радиус
нейтрального атома меди 0,128 нм, радиус
иона Cu+
от 0,060 нм (координационное число 2) до
0,091 нм (координационное число 6), иона
Cu2+
— от 0,071 нм (координационное число 2) до
0,087 нм (координационное число 6). Энергии
последовательной ионизации атома меди
7,726; 20,291; 36,8; 58,9 и 82,7 эВ. Сродство к электрону
1,8 эВ. Работа выхода электрона 4,36 эВ. По
Работа выхода электрона 4,36 эВ. По
шкале Полинга электроотрицательность
меди 1,9; медь принадлежит к числу
переходных металлов. Стандартный
электродный потенциал Cu/Cu2+
0,339 В. В ряду стандартных потенциалов
медь расположена правее водорода (H) и
ни из воды, ни из кислот водорода не
вытесняет.
Простое
вещество медь — красивый розовато-красный
пластичный металл.
Название:
латинское название меди происходит от
названия острова Кипра (Cuprus), где в
древности добывали медную руду;
однозначного объяснения происхождения
этого слова в русском языке нет.
Кристаллическая
решетка металлической меди кубическая
гранецентрированная, параметр решетки
а = 0,36150 нм. Плотность 8,92 г/см3,
температура плавления 1083,4°C, температура
кипения 2567°C. Медь среди всех других
металлов обладает одной из самых высоких
теплопроводностей и одним из самых
низких электрических сопротивлений
(при 20°C удельное сопротивление 1,68·10–3
Ом·м).
В
сухой атмосфере медь практически не
изменяется. Во влажном воздухе на
поверхности меди в присутствии углекислого
газа образуется зеленоватая пленка
состава Cu(OH)2·CuCO3.
Так как в воздухе всегда имеются следы
сернистого газа и сероводорода, то в
составе поверхностной пленки на
металлической меди обычно имеются и
сернистые соединения меди. Такая пленка,
возникающая с течением времени на
изделиях из меди и ее сплавов, называется
патиной. Патина предохраняет металл от
дальнейшего разрушения. Для создания
на художественных предметах «налета
старины» на них наносят слой меди,
который затем специально патинируется.
При
нагревании на воздухе медь тускнеет и
в конце концов чернеет из-за образования
на поверхности оксидного слоя. Сначала
образуется оксид Cu2O,
затем — оксид CuO.
Красновато-коричневый
оксид меди (I) Cu2O
при растворении в бромо- и иодоводородной
кислотах образует, соответственно,
бромид меди (I) CuBr и иодид меди (I) CuI. При
При
взаимодействии Cu2O
с разбавленной серной кислотой возникают
медь и сульфат меди:
Cu2O
+ H2SO4
= Cu + CuSO4
+ H2O.
При
нагревании на воздухе или в кислороде
Cu2O
окисляется до CuO, при нагревании в токе
водорода – восстанавливается до
свободного металла.
Черный
оксид меди (II) CuO, как и Cu2O,
c водой не реагирует. При взаимодействии
CuO с кислотами образуются соли меди
(II):
CuO
+ H2SO4
= CuSO4
+ H2O
При
сплавлении со щелочами CuO образуются
купраты, например:
CuO
+ 2NaOH = Na2CuO2
+ H2O
Нагревание
Cu2O
в инертной атмосфере приводит к реакции
диспропорционирования:
Cu2O
= CuO + Cu.
Такие
восстановители, как водород, метан,
аммиак, оксид углерода (II) и другие
восстанавливают CuO до свободной меди,
например:
CuO
+ СО = Cu + СО2.
Кроме
оксидов меди Cu2O
и CuO, получен также темно-красный оксид
меди (III) Cu2O3,
обладающий сильными окислительными
свойствами.
Медь
реагирует с галогенами, например, при
нагревании хлор реагирует с медью с
образованием темно-коричневого дихлорида
CuCl2.
Существуют также дифторид меди CuF2
и дибромид меди CuBr2,
но дииодида меди нет. И CuCl2,
и CuBr2
хорошо растворимы в воде, при этом ионы
меди гидратируются и образуют голубые
растворы.
При
реакции CuCl2
с порошком металлической меди образуется
бесцветный нерастворимый в воде хлорид
меди (I) CuCl. Эта соль легко растворяется
в концентрированной соляной кислоте,
причем образуются комплексные анионы
[CuCl2]–,
[CuCl3]2–
и [СuCl4]3–,
например за счет процесса:
CuCl
+ НCl = H[CuCl2]
При
сплавлении меди с серой образуетcя
нерастворимый в воде сульфид Cu2S.
Сульфид меди (II) CuS выпадает в осадок,
например, при пропускании сероводорода
через раствор соли меди (II):
H2S
+ CuSO4
= CuS + H2SO4
C
водородом, азотом, графитом, кремнием
медь не реагирует. При контакте с
водородом медь становится хрупкой (так
называемая «водородная болезнь» меди)
из-за растворения водорода в этом
металле.
В
присутствии окислителей, прежде всего
кислорода, медь может реагировать с
соляной кислотой и разбавленной серной
кислотой, но водород при этом не
выделяется:
2Cu
+ 4HCl + O2
= 2CuCl2
+ 2H2O.
С
азотной кислотой различных концентраций
медь реагирует довольно активно, при
этом образуется нитрат меди (II) и
выделяются различные оксиды азота.
Например, с 30%-й азотной кислотой реакция
меди протекает так:
3Cu
+ 8HNO3
= 3Cu(NO3)2
+ 2NO + 4H2O.
С
концентрированной серной кислотой медь
реагирует при сильном нагревании:
Cu
+ 2H2SO4
= CuSO4
+ SO2
+ 2H2O.
Практическое
значение имеет способность меди
реагировать с растворами солей железа
(III), причем медь переходит в раствор, а
железо (III) восстанавливается до железа
(II):
2FeCl3
+ Cu = CuCl2
+ 2FeCl2
Этот
процесс травления меди хлоридом железа
(III) используют, в частности, при
необходимости удалить в определенных
местах слой напыленной на пластмассу
меди.
Ионы
меди Cu2+
легко образуют комплексы с аммиаком,
например, состава [Cu(NH3)]2+.
При пропускании через аммиачные растворы
солей меди ацетилена С2Н2
в осадок выпадает карбид (точнее,
ацетиленид) меди CuC2.
Гидроксид
меди Cu(OH)2
характеризуется преобладанием основных
свойств. Он реагирует с кислотами с
Он реагирует с кислотами с
образованием соли и воды, например:
Сu(OH)2
+ 2HNO3
= Cu(NO3)2
+ 2H2O.
Но
Сu(OH)2
реагирует и с концентрированными
растворами щелочей, при этом образуются
соответствующие купраты, например:
Сu(OH)2
+ 2NaOH = Na2[Cu(OH)4]
Если
в медноаммиачный раствор, полученный
растворением Сu(OH)2
или основного сульфата меди в аммиаке,
поместить целлюлозу, то наблюдается
растворение целлюлозы и образуется
раствор медноаммиачного комплекса
целлюлозы. Из этого раствора можно
изготовить медноаммиачные волокна,
которые находят применение при
производстве бельевого трикотажа и
различных тканей.
МЕДЬ
В ОКРУЖАЮЩЕЙ СРЕДЕ
Среди
загрязнителей биосферы, представляющих
наибольший
интерес
для различных служб контроля ее качества,
металлы (в первую очередь тяжелые, то
есть имеющие атомный вес больше 40)
относятся к числу важнейших. В значительной
В значительной
мере это связано с биологической
активностью многих из них. На организм
человека и животных физиологическое
действие металлов различно и зависит
от природы металла, типа соединения, в
котором он существует в природной среде,
а также его концентрации. Многие тяжелые
металлы проявляют выраженные
комплексообразующие свойства. Так, в
водных средах ионы этих металлов
гидратированы и способны образовывать
различные гидроксокомплексы, состав
которых зависит от кислотности раствора.
Если в растворе присутствуют какие-либо
анионы или молекулы органических
соединений, то ионы этих металлов
образуют разнообразные комплексы
различного строения и устойчивости.
Биологическая
роль
Медь
присутствует во всех организмах и
принадлежит к числу микроэлементов,
необходимых для их нормального развития
(см. Биогенные элементы). В растениях и
животных содержание меди варьируется
от 10–15 до 10–3%. Мышечная ткань человека
содержит 1·10–3% меди, костная ткань —
(1-26)·10–4 %, в крови присутствует 1,01 мг/л
меди. Всего в организме среднего человека
Всего в организме среднего человека
(масса тела 70 кг) содержится 72 мг меди.
Основная роль меди в тканях растений и
животных — участие в ферментативном
катализе. Медь служит активатором ряда
реакций и входит в состав медьсодержащих
ферментов, прежде всего оксидаз,
катализирующих реакции биологического
окисления. Медьсодержащий белок
пластоцианин участвует в процессе
фотосинтеза. Другой медьсодержащий
белок, гемоцианин, выполняет роль
гемоглобина у некоторых беспозвоночных.
Так как медь токсична, в животном
организме она находится в связанном
состоянии. Значительная ее часть входит
в состав образующегося в печени белка
церулоплазмина, циркулирующего с током
крови и деставляющего медь к местам
синтеза других медьсодержащих белков.
Церулопламин обладает также каталитической
активностью и участвует в реакциях
окисления. Медь необходима для
осуществления различных функций
организма — дыхания, кроветворения
(стимулирует усвоение железа и синтез
гемоглобина), обмена углеводов и
минеральных веществ. Недостаток меди
Недостаток меди
вызывает болезни как растений, так и
животных и человека. С пищей человек
ежедневно получает 0,5-6 мг меди.
Сульфат
меди и другие соединения меди используют
в сельском хозяйстве в качестве
микроудобрений и для борьбы с различными
вредителями растений. Однако при
использовании соединений меди, при
работах с ними нужно учитывать, что они
ядовиты. Попадание солей меди в организм
приводит к различным заболеваниям
человека. ПДК для аэрозолей меди
составляет 1 мг/м3,
для питьевой воды содержание меди должно
быть не выше 1,0 мг/л.
Факты о меди – Химия для детей
Пожалуйста, напишите или поделитесь этой статьей!
Электронная почта
ФБ
Медь — это элемент периодической таблицы элементов, который находится в первой строке одиннадцатого столбца таблицы.
Известно, что медь является переходным металлом в силу ее специфических свойств.
Атомный символ меди — Cu, а ее атомный номер — 29. Это означает, что медь имеет 29протонов, 29 электронов, а также 34 нейтрона.
Это означает, что медь имеет 29протонов, 29 электронов, а также 34 нейтрона.
Медь появляется в виде твердого металла при комнатной температуре, как и большинство металлов, и ее температура плавления составляет 1084 градуса Цельсия.
Его температура кипения чрезвычайно высока и составляет 2562 градуса по Цельсию.
Благодаря высокой температуре плавления 1084 градуса мы знаем, что медь стабильна в твердом состоянии при очень высоких температурах.
Характеристики и свойства
Типичная форма меди при комнатной температуре и в чистом виде представляет собой твердый металл оранжево-медного цвета.
Медь особенно известна своей способностью проводить электричество и тепло, что делает ее широко используемой в электропроводке и производстве.
Еще одним дополнительным свойством меди, которое позволяет так часто использовать ее в промышленных условиях, является ее способность изгибаться, перемещаться и преобразовываться в новые формы.
История
Интересно, что медь была одним из первых металлических элементов, которые люди использовали в качестве инструмента.
Однако открытие меди произошло так давно в древней истории, что сегодня мы не знаем, кто был первым человеком, открывшим медь как элемент.
Медь можно найти во внешнем слое земной коры и часто даже в чистом виде, в отличие от других типов металлов, которые необходимо очищать перед использованием.
По этой причине многие древние цивилизации могли использовать его без предварительной очистки.
Причина, по которой медь обычно встречается в чистом виде, заключается в том, что она очень медленно реагирует с кислородом.
Поскольку его реакция медленная и незначительная, он не очень сильно меняется по сравнению с его первоначальной формой на воздухе (за исключением того, что со временем он зеленеет!)
На самом деле, первичная реакция меди на воздухе заключается в изменении цвета от ярко-оранжевого до более темно-коричневого цвета, а при воздействии воды она может корродировать в карбонат зеленого цвета. .
.
Интересно, что Статуя Свободы в Соединенных Штатах полностью сделана из меди, и причина, по которой статуя сегодня кажется зеленой, связана с коррозией от окружающей воды (как на острове).
Статуя Свободы, вид с парома кольцевой линии, Манхэттен, Нью-Йорк
Медь на 100% пригодна для повторного использования, и основное место, откуда мир получает медь, — это переработка или рудники в Чили, Южная Америка.
Как и денежная единица Соединенных Штатов, никель, который на самом деле только частично состоит из никеля, пенни Соединенных Штатов также только частично состоит из меди.
До 1982 года пенни на 95% состояли из меди, но после этого года медь выросла в цене и в цене, поэтому пенни теперь состоят из 97,5% цинка, и только 2% их состава составляют меди.
Веселая викторина!
- Какой химический символ у меди?
- Сколько протонов у меди?
- В какой форме находится медь при комнатной температуре?
- Какого цвета медь?
- Что происходит, когда медь подвергается воздействию воды?
Ответы:
- Cu
- 29
- Цельный металл, но сгибаемый
- Блестящий оранжево-коричневый
- Корродирует и со временем зеленеет
Химия
Медь (Cu) | AMERICAN ELEMENTS®
РАЗДЕЛ 1.
 ИДЕНТИФИКАЦИЯ
ИДЕНТИФИКАЦИЯ
Наименование продукта: Медно-металлический
Номер продукта: Все применимые коды продуктов American Elements, например. CU-M-02, CU-M-03, CU-M-04, CU-M-05, CU-M-06
Номер CAS: 7440-50-8
Соответствующие установленные применения вещества : Научные исследования и разработки
Информация о поставщике:
American Elements
1093 Broxton Ave. Suite 2000
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка +1 800 -424-9300
Международный +1 703-527-3887
РАЗДЕЛ 2. ОПАСНОСТЬ
Классификация вещества или смеси здоровья или окружающей среды в соответствии с регламентом CLP.
Классификация в соответствии с Директивой 67/548/ЕЕС или Директивой 1999/45/ЕС
Неприменимо
Информация об особых опасностях для человека и окружающей среды:
Информация отсутствует.
Опасности, не классифицированные иначе
Информация отсутствует.
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Неприменимо
Пиктограммы опасности
Неприменимо
Сигнальное слово
Неприменимо
Краткая характеристика опасности
Неприменимо
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
0
0
0
Здоровье (острое воздействие) = 8 0 9012 = 8 0 901 Воспламеняемость 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: Неприменимо.
vPvB: не применимо.
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Химическая характеристика: Вещества
CAS# Описание:
7440-50-8 Медь
Идентификационный номер(а):
Номер ЕС: 231-159-6
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общая информация
Нет специальных необходимые меры.
При вдыхании
В случае жалоб обратиться за медицинской помощью.
После контакта с кожей
Обычно продукт не раздражает кожу.
При попадании в глаза
Промыть открытые глаза в течение нескольких минут под проточной водой. Если симптомы сохраняются, обратитесь к врачу.
После проглатывания
Если симптомы сохраняются, обратитесь к врачу.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Отсутствует какая-либо соответствующая информация.
Указание на необходимость немедленной медицинской помощи и специального лечения
Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Специальный порошок для пожаротушения металлов. Не используйте воду.
Неподходящие по соображениям безопасности средства пожаротушения
Вода
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут выделяться следующие вещества:
Оксиды меди
Рекомендации для пожарных
Защитное снаряжение:
Никаких специальных мер не требуется .
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Индивидуальные меры предосторожности, защитное снаряжение и чрезвычайные меры
Не требуется.
Меры предосторожности по защите окружающей среды:
Не допускать попадания материала в окружающую среду без надлежащего разрешения правительства.
Не допускать попадания продукта в канализацию или водоемы.
Не допускать проникновения в землю/почву.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Никаких специальных мер не требуется.
Условия безопасного хранения, включая любые несовместимости
Хранение
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Информация отсутствует.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых контейнерах.
Особое конечное использование(я)
Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Нет дополнительных данных; см. раздел 7.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте: 7440-50-8 Медь (100,0%)
PEL (США) Длительное значение: 1* 0,1** мг/м³ в виде Cu *пыль и туман **дым
REL (США) Долгосрочное значение: 1* 0,1** мг/м³ в виде Cu *пыль и туман **дым
TLV (США) Долговременное значение: 1* 0,2** мг/м³ *пыль и туман; **дым; как Cu
EL (Канада) Длительное значение: 1* 0,2** мг/м³ *пыль и туман; **дым
EV (Канада) Длительное значение: 0,2* 1** мг/м³ в виде меди, *дым;**пыль и туман
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Общие защитные и гигиенические меры
Следует соблюдать обычные меры предосторожности при обращении с химическими веществами.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование: Не требуется.
Защита рук: Не требуется.
Время проникновения материала перчаток (в минутах)
Не определено
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Общая информация
Внешний вид:
Форма: Твердое вещество в различных формах
Цвет: Медного цвета
Запах: Без запаха
Порог запаха: Не определено.
Значение pH: Неприменимо.
Изменение условий
Точка плавления/диапазон плавления: 1083 °C (1981 °F)
Точка/диапазон кипения: 2562 °C (4644 °F)
Температура сублимации/начало: Не определено
Воспламеняемость (твердое, газообразное): Не определено.
Температура воспламенения: не определено
Температура разложения: не определено
Самовоспламенение: не определено.
Опасность взрыва: не определено.
Пределы взрываемости:
Нижний: Не определено
Верхний: Не определено
Давление пара при 20 °C (68 °F): 0 гПа
Плотность при 20 °C (68 °F): 8,94 г/см³ (74,604 фунта/гал) )
Относительная плотность: Не определено.
Плотность паров: Неприменимо.
Скорость испарения: Неприменимо.
Растворимость в/Смешиваемость с водой: Не растворим
Коэффициент распределения (н-октанол/вода): Не определено.
Вязкость:
динамическая: Неприменимо.
Кинематика: Не применимо.
Другая информация
Отсутствует какая-либо соответствующая информация
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Информация отсутствует.
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции неизвестны
Условия, которых следует избегать
Отсутствует какая-либо соответствующая информация.
Несовместимые материалы:
Информация отсутствует.
Опасные продукты разложения:
Оксиды меди
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности для этого вещества.
Значения LD/LC50, важные для классификации:
Пероральная LD50 >5000 мг/кг (мышь)
Раздражение или коррозия кожи: Нет раздражающего действия.
Раздражение или коррозия глаз: Не оказывает раздражающего действия.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность:
EPA-D: Не классифицируется в отношении канцерогенности для человека: недостаточные доказательства канцерогенности для людей и животных или данные отсутствуют.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об онкогенности, и/или канцерогенности, и/или новообразованиях для этого вещества.
Репродуктивная токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
Канцерогенные категории
OSHA-Ca (Управление по безопасности и гигиене труда)
Вещество не указано.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Токсичность для водной среды:
Отсутствует какая-либо соответствующая информация.
Стойкость и способность к разложению
Отсутствует какая-либо соответствующая информация.
Потенциал биоаккумуляции
Отсутствует какая-либо соответствующая информация.
Мобильность в почве
Отсутствует какая-либо соответствующая информация.
Дополнительная экологическая информация:
Общие примечания:
Не допускать попадания материала в окружающую среду без надлежащего разрешения правительства.
Не допускать попадания неразбавленного продукта или больших количеств в грунтовые воды, водоемы или канализацию.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: Неприменимо.
vPvB: не применимо.
Другие неблагоприятные воздействия
Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 13. СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Ознакомьтесь с государственными, местными или национальными нормами для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
Неприменимо
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
Неприменимо
Класс(ы) опасности при транспортировке
DOT, ADR, ADN, IMDG, IATA
Класс
Неприменимо
Группа упаковки
DOT, IMDG, IATA
Неприменимо
Опасности для окружающей среды:
Загрязнитель морской среды (IMDG):
Да (PP)
Да (P)
Special меры предосторожности для пользователя
Неприменимо.
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
Не применимо.
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT):
№
«Типовой регламент ООН»:
—
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законы по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
SARA Раздел 313 (списки конкретных токсичных химических веществ)
7440-50-8 Медь
Предложение 65 штата Калифорния
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Предложение 65 — Токсичность для развития у женщин
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
