Характеристика химического элемента медь: строение атома, получение, физические и химические свойства — урок. Химия, 11 класс.
Содержание
Химические свойства переходных металлов (меди, цинка, хрома, железа)
Что такое химические свойства переходных металлов (меди, цинка, хрома, железа)
Основные химические свойства и характеристики меди, цинка, хрома и железа — переходных металлов, краткая справка:
Медь
химический элемент. символьное обозначение элемента:
Cu
, латинское название
Cuprum
, элемент относится к периоду, группе:
4, 11
, (atomic mass of matter) атомная масса вещества Медь составляет
63,546 (3)
(а.е.м.) плотность элемента:
8,92
г/ см³ (при 20 градусах Цельсия), температура плавления
1083,5
(°C), температура кипения
2595
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Cuprum
Цинк
химический элемент. символьное обозначение элемента:
Zn
, латинское название
Zincum
, элемент относится к периоду, группе:
4, 12
, (atomic mass of matter) атомная масса вещества Цинк составляет
65,409 (4)
(а. е.м.) плотность элемента:
е.м.) плотность элемента:
7,14
г/ см³ (при 20 градусах Цельсия), температура плавления
419,6
(°C), температура кипения
907
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Zincum
Хром
химический элемент. символьное обозначение элемента:
Cr
, латинское название
Chromium
, элемент относится к периоду, группе:
4, 6
, (atomic mass of matter) атомная масса вещества Хром составляет
51,9961 (6)
(а.е.м.) плотность элемента:
7,14
г/ см³ (при 20 градусах Цельсия), температура плавления
1857
(°C), температура кипения
2482
(°C). Первооткрывателем зарегистрирован:
Воклен
, год открытия:
1797
— Chromium
Железо
химический элемент. символьное обозначение элемента:
Fe
, латинское название
Ferrum
, элемент относится к периоду, группе:
4, 8
, (atomic mass of matter) атомная масса вещества Железо составляет
55,845 (2)
(а. е.м.) плотность элемента:
е.м.) плотность элемента:
7,87
г/ см³ (при 20 градусах Цельсия), температура плавления
1535
(°C), температура кипения
2750
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Ferrum
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2.
Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(Nh4)2]Cl и [Cu(Nh4)2]OH.
Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
***
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
***
При недостатке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
***
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
***
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.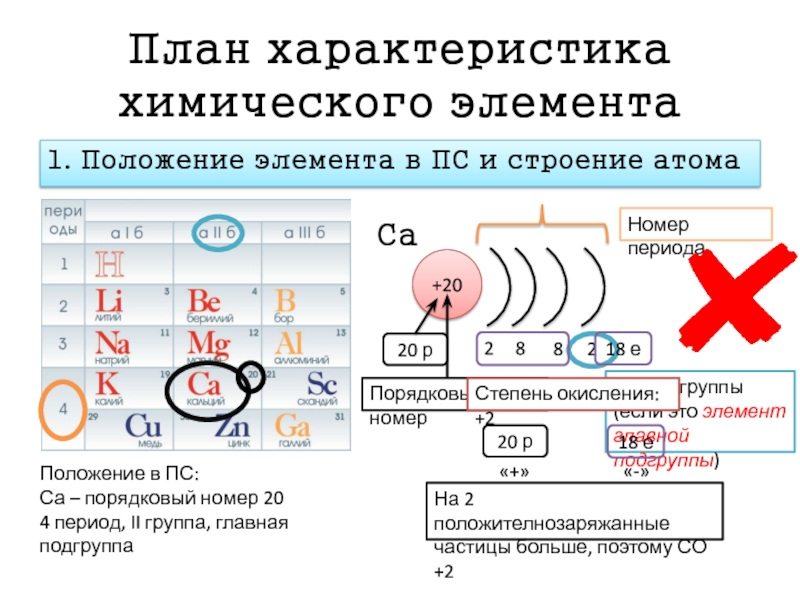
***
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
***
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4h3O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
***
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
***
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
***
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
***
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + h3O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн.
тонн.
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + h3O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
***
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
***
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + h3SO4 (20%) → ZnSO4 + h3↑
Zn + 2HCl → ZnCl2 + h3↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + h3O = ZnO + h3↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2h3SO4 = ZnSO4 + SO2↑ + 2h3O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2h3O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4h3O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5h3O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6h3O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + Nh5NO3 + 3h3O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции. Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑
Zn + Ba(OH)2 + 2h3O = Ba[Zn(OH)4] + h3↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
***
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6h3O → 4Na2[Zn(OH)4] + Nh4↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4Nh4·h3O → [Zn(Nh4)4](OH)2 + h3↑ + 2h3O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.
Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника.
 Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков). - Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
Система охлаждения из меди на тепловых трубках в ноутбуке
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.
Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.
Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
- 25% – розовый;
- 50% – красный.
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.
Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 =ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 =ot=> 2CrF3
2Cr + 3Cl2 =ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 =ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3h3O =ot=> Cr2O3 + 3h3↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3h3O
2Cr + 6h3SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6h3O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18h3O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять h3 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + h3↑
Cr + h3SO4(разб. ) = CrSO4 + h3↑
) = CrSO4 + h3↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы: ****
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.
Сплавы меди и их применение
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
- Бронза – с оловом.
- Латунь – с цинком.
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
| Соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6h3O Fe2O3 + 6HI = 2FeI2 + I2 + 3h3O |
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
***
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме h3SO4 (конц. ) и HNO3 любой концентрации):
) и HNO3 любой концентрации):
Fe + h3SO4 (разб.) = FeSO4 + h3↑
Fe + 2HCl = FeCl2 + h3↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.
Самородок меди
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Медь и цинк – d- элементы
Цель: обобщить и конкретизировать знания учащихся о строении металлов и зависимости строения и свойств
Развивать умения записывать уравнения реакций, характеризующих свойства простых веществ и соединений ими образованных.
Развивать навыки экспериментальных работ, знание правил по ТБ
Развивать логическое мышление.
Воспитывать само-взаимоконтроль, прививать навыки ЗОЖ.
Продолжительность урока 90 минут
Ход урока
I.Организация класса
Проверка готовности к уроку
II. Сообщение темы и определение цели урока
1)Вопросы по периодической системе
Где в п.с. расположены d- элементы?
Что общего в строении d- элементов?
Вывод: у d- элементов плавное изменение свойств, они носят название переходные элементы.
2) Составление электронных формул (на основании ответов учащихся)
|
|
|
|
|
|
|
|
|
|
|
|
Вопрос: Почему у меди переменная степень окисления, а у цинка всегда +2?
3) Посмотрим на ряд активности: цинк металл средней активности, медь -малоактивный.
Как эти элементы встречаются в природе?(в виде соединений- например, сульфиды)
В Казахстане месторождения находятся на Рудном Алтае, Жезказгане, Павлодаре -медь; на Рудном Алтае, Жезказгане, Шымкенте -цинк.
4) Каким способом можно получить чистый металл из соединения?
Физические свойства цинка и меди
Цинк — синевато-белый металл с плотностью при нормальных условиях 7,13 г/см3. Температура плавления у него довольно низкая — всего 419,5 °С. Нагретый до 100—150° цинк становится очень ковким и тягучим, а при 200° настолько хрупким, что его можно истолочь в порошок.[2]
Медь — металл красного, в изломе розового цвета, мягкий, ковкий, tпл.=1083 °С, обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). .[3]
|
| ||||
|
|
|
| ||
|
|
|
| ||
|
|
|
| ||
|
|
|
| ||
|
|
|
| ||
|
| ||||
|
| ||||
|
|
|
| ||
|
|
|
| ||
|
|
|
| ||
|
|
|
| ||
|
|
|
|
|
|
Вопросы к учащимся:
В какие еще реакции вступают гидроксиды меди (II)и цинка? (оба разлагаются при нагревании)
В какие реакции вступают оксиды меди и цинка?
Дома записать уравнения возможных реакций взаимодействия оксидов с различными веществами.
III.Самостоятельная работа с учебником (по группам) стр 189-190
Стр 183-184 Конкурс на самый интересный вопрос (например)
-
Отчего у улитки кровь голубая? -
Почему медь используют в радиотехнике? -
Какая бронза похожа на золото? -
Куда расходуется большая часть полученного цинка? (оцинкование) -
Почему соли меди используют для борьбы с вредителями растений?
IV .Закрепление
Тест d-Элементы
1. d-элементы могут быть в химических реакциях:
а) восстановителем б) окислителем в) восстановителем и окислителем
2. В атомах d–элементов валентные электроны находятся на:
а) s– орбиталях б) p-орбиталях в) d- орбиталях г) s-орбиталях внешнего и d–орбиталях предвнешнего уровня
3. Электронная формула внешнего энергетического уровня атома цинка
Электронная формула внешнего энергетического уровня атома цинка
а)….3d10 4s2 б)…..3d10 4s1 в)…3d8 4s2
4. Для меди в соединениях характерны степени окисления:
а) +8 б)+3 в) +1 г) +2
5. С водными растворами каких солей реагирует цинк:
а) ZnCI2 б) CuSO4 в) AgNO3 г) K2SO4
V. Итоги урока
VI .Домашнее задание пп 7.1; 7.2; 7.3; 7.4; Записать уравнения возможных реакций взаимодействия оксидов меди и цинка с различными веществами; упр 5,6 стр 115
Упр 5,6 стр 190
Список литературы
-
Нурахметов НН; Бекишев КБ Химия учебник для 10 класса ЕМН -
Цинковая промышленность мира Д. В. Черашев аспирант кафедры географии мирового хозяйства географического факультета Московского государственного университета им. М.В. Ломоносова
В. Черашев аспирант кафедры географии мирового хозяйства географического факультета Московского государственного университета им. М.В. Ломоносова -
Медная промышленность мира Д.В. Черашев аспирант кафедры географии мирового хозяйства географического факультета Московского государственного университета им. М.В. Ломоносова
Изучение геологии: медь
Медь — это химический элемент с символом Cu (от латинского: cuprum) и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Он используется в качестве проводника тепла и электричества, в качестве строительного материала и в качестве компонента различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах для измерения температуры. измерение.
измерение.
Медь встречается в природе как чистый металл, и это был первый источник металла, использованный людьми, c. 8000 г. до н.э. Это был первый металл, выплавленный из руды, c. 5000 г. до н.э., первый металл, отлитый в форму, c. 4000 г. до н.э. и первый металл, который был специально сплавлен с другим металлом, оловом, для создания бронзы, c. 3500 г. до н.э.
В римскую эпоху медь в основном добывалась на Кипре, происхождение названия металла от aes cyprium (кипрский металл), позже преобразованного в купрум, от которого слова медь (английский), cuivre (французский) , Koper (голландский) и Kupfer (немецкий) являются производными. Обычно встречающиеся соединения представляют собой соли меди (II), которые часто придают синий или зеленый цвет таким минералам, как азурит, малахит и бирюза, и исторически широко использовались в качестве пигментов. Архитектурные конструкции, построенные из меди (обычно элементы кровли), подвергаются коррозии, образуя зеленую медь (или патину). В декоративном искусстве медь широко представлена как в виде элементарного металла, так и в соединениях в качестве пигментов. Соединения меди также используются в качестве бактериостатических средств, фунгицидов и консервантов для древесины.
В декоративном искусстве медь широко представлена как в виде элементарного металла, так и в соединениях в качестве пигментов. Соединения меди также используются в качестве бактериостатических средств, фунгицидов и консервантов для древесины.
Медь необходима всем живым организмам в качестве пищевого микроэлемента, поскольку она является ключевым компонентом комплекса дыхательных ферментов цитохром-с-оксидазы. У моллюсков и ракообразных медь входит в состав пигмента крови гемоцианина, который у рыб и других позвоночных замещается железокомплексным гемоглобином. У человека медь содержится в основном в печени, мышцах и костях. В организме взрослого человека содержится от 1,4 до 2,1 мг меди на килограмм массы тела. Следовательно, в здоровом человеке весом 60 кг содержится примерно 0,1 г меди. Тем не менее, это небольшое количество имеет важное значение для общего благополучия человека.
Характеристики
Физический
Медь, серебро и золото относятся к 11 группе периодической таблицы и имеют определенные общие свойства: они имеют один s-орбитальный электрон поверх заполненной d-электронной оболочки и характеризуются высокой пластичностью, электро- и теплопроводностью. . Заполненные d-оболочки в этих элементах мало способствуют межатомным взаимодействиям, в которых преобладают s-электроны через металлические связи. В отличие от металлов с незавершенными d-оболочками металлические связи в меди не имеют ковалентного характера и относительно слабы. Это наблюдение объясняет низкую твердость и высокую пластичность монокристаллов меди. В макроскопическом масштабе введение протяженных дефектов в кристаллическую решетку, таких как границы зерен, препятствует течению материала под действием приложенного напряжения, тем самым увеличивая его твердость. По этой причине медь обычно поставляется в мелкозернистой поликристаллической форме, которая обладает большей прочностью, чем монокристаллические формы.
. Заполненные d-оболочки в этих элементах мало способствуют межатомным взаимодействиям, в которых преобладают s-электроны через металлические связи. В отличие от металлов с незавершенными d-оболочками металлические связи в меди не имеют ковалентного характера и относительно слабы. Это наблюдение объясняет низкую твердость и высокую пластичность монокристаллов меди. В макроскопическом масштабе введение протяженных дефектов в кристаллическую решетку, таких как границы зерен, препятствует течению материала под действием приложенного напряжения, тем самым увеличивая его твердость. По этой причине медь обычно поставляется в мелкозернистой поликристаллической форме, которая обладает большей прочностью, чем монокристаллические формы.
Мягкость меди отчасти объясняет ее высокую электропроводность (59,6×106 См/м) и высокую теплопроводность, занимающую второе место (уступая только серебру) среди чистых металлов при комнатной температуре. Это связано с тем, что сопротивление переносу электронов в металлах при комнатной температуре возникает в основном из-за рассеяния электронов на тепловых колебаниях решетки, которые в мягком металле относительно слабы. Максимально допустимая плотность тока меди на открытом воздухе составляет примерно 3,1×106 А/м2 площади поперечного сечения, выше которой она начинает чрезмерно нагреваться.
Максимально допустимая плотность тока меди на открытом воздухе составляет примерно 3,1×106 А/м2 площади поперечного сечения, выше которой она начинает чрезмерно нагреваться.
Медь — один из четырех металлических элементов с естественным цветом, отличным от серого или серебряного, остальные — цезий (желтый), золото (желтый) и осмий (голубоватый). Чистая медь имеет оранжево-красный цвет и на воздухе приобретает красноватый оттенок. Характерный цвет меди обусловлен электронными переходами между заполненными 3d и полупустыми 4s атомными оболочками – разница энергий между этими оболочками соответствует оранжевому свету. Тот же механизм вызывает желтую окраску золота и цезия.
Как и в случае с другими металлами, если медь соприкасается с другим металлом, возникает гальваническая коррозия.
Химический
Медь не вступает в реакцию с водой, но медленно реагирует с кислородом воздуха с образованием слоя коричнево-черного оксида меди, который, в отличие от ржавчины, образующейся на железе во влажном воздухе, защищает нижележащий металл от дальнейшей коррозии (пассивация) . Зеленый слой зелени (карбоната меди) часто можно увидеть на старых медных конструкциях, таких как кровля многих старых зданий и Статуя Свободы. Медь тускнеет под воздействием некоторых соединений серы, с которыми она реагирует с образованием различных сульфидов меди.
Зеленый слой зелени (карбоната меди) часто можно увидеть на старых медных конструкциях, таких как кровля многих старых зданий и Статуя Свободы. Медь тускнеет под воздействием некоторых соединений серы, с которыми она реагирует с образованием различных сульфидов меди.
Изотопы
Существует 29 изотопов меди. 63Cu и 65Cu стабильны, при этом 63Cu содержит примерно 69% встречающейся в природе меди; оба имеют спин 3⁄2. Другие изотопы радиоактивны, причем наиболее стабильным является 67Cu с периодом полураспада 61,83 часа. Было охарактеризовано семь метастабильных изотопов; 68Cu является самым долгоживущим с периодом полураспада 3,8 минуты. Изотопы с массовым числом выше 64 распадаются на β-, тогда как изотопы с массовым числом ниже 64 распадаются на β+. 64Cu, период полураспада которого составляет 12,7 часа, распадается в обоих направлениях.
62Cu и 64Cu имеют важные применения. 62Cu используется в 62Cu-PTSM в качестве радиоактивного индикатора для позитронно-эмиссионной томографии.
Возникновение
Медь образуется в массивных звездах и присутствует в земной коре в количестве около 50 частей на миллион (млн). Он встречается в виде самородной меди, в сульфидах меди халькопирит и халькоцит, в карбонатах меди азурите и малахите, а также в минерале оксида меди (I) куприте. Самая большая обнаруженная масса элементарной меди весила 420 тонн и была обнаружена в 1857 году на полуострове Кевино в Мичигане, США. Самородная медь представляет собой поликристалл, самый большой из когда-либо описанных монокристаллов имеет размеры 4,4 × 3,2 × 3,2 см.
Физические свойства
| Химическая формула | Cu |
| Цвет | Металлик, красный, оранжевый, коричневый | Твердость | 2,5 — 3 |
| Кристаллическая система | Изометрическая |
| SG | 8,9 |
| Прозрачный | Непрозрачный |
| Двойное преломление | Нет |
| Блеск | Металлик |
| 9004 4 Спайность | Нет |
| Класс минералов | Медь |
9000 0 Что такое Медь (Cu)? — Определение из Corrosionpedia
Последнее обновление: 16 августа 2018 г.
Что означает медь (Cu)?
Медь представляет собой элемент переходного металла с химическим символом Cu и атомным номером 29.. Это красновато-оранжевый ковкий металл с высокой тепло- и электропроводностью.
Хорошо известно, что металлическая медь подвергается коррозии на воздухе и в конечном итоге приобретает характерный зеленый цвет при преобразовании в соль меди, такую как карбонат меди (II), основной хлорид меди или ацетат меди (II).
Медь обычно используется для производства проводов, радиаторов, электромагнитов и электродвигателей из-за ее превосходной электрической и теплопроводности, но она также используется в качестве конструкционных компонентов и трубопроводов. Поскольку окисление меди на воздухе обеспечивает защиту от дальнейшей коррозии, в этих применениях медь может иметь преимущества перед другими металлами.
Биологические процессы также сильно зависят от атомов меди, которые способствуют важным реакциям переноса электронов и переноса кислорода.
Реклама
Коррозионпедия объясняет медь (Cu)
Медь из Земли состоит из 69,15% изотопа 63 Cu и 30,85% изотопа 65 Cu, с 3 4 и 36 нейтронов соответственно. Его внешний вид характеризуется как неокисленной блестящей красновато-оранжевой окраской, так и окисленной и модифицированной зеленоватой окраской. Медь склонна к окислению и обычно встречается в Cu + и Cu 2+ степени окисления. Соответствующие соли меди часто окрашены.
Некоторые свойства меди:
- Молекулярная масса: 63,55 г/моль
- Плотность (при 20°C): 8,96 г/см 3
- Температура плавления: 1085°C (1,9 84°F)
- Кипячение точка: 2 562°C (4 643°F)
Медь, типичная для переходных металлов, богата химическими веществами, способна катализировать химические превращения и переносить электроны. Эта реактивность используется в биологии, где специализированные белки используют медь для облегчения аэробного дыхания, подавления опасных окислителей и транспортировки кислорода в моллюсках.

 Взаимодействуют с неметаллами (кроме азота и водорода)
Взаимодействуют с неметаллами (кроме азота и водорода) Со щелочами только амфотерный металл
Со щелочами только амфотерный металл