Характеристика меди по химии: Характеристика меди | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями
Содержание
Характеристика меди | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями
Общая характеристика меди как элемента
Химический знак – Cu.
Относительная атомная масса – 63,546.
В соединениях медь двухвалентна, степень окисления в соединениях с неметаллами равна +2.
Медь как вещество
Способы получения меди:
- Восстановлением из оксида меди(II) при нагревании:
CuO + H2→ Cu + H2O
- Вытеснением из раствора соли более активным металлом:
CuCl2 + 2Al → 3Cu↓ + 2AlCl3
- Электролизным методом:
2CuSO4 + 2H2O → 2Cu↓ + O2↑ + 2H2SO4
- Гидрометаллургическим методом (растворение минералов меди в разбавленной кислоте, например в серной кислоте, и последующее вытеснение металлическим железом):
CuSO4 + Fe → Cu↓ + FeSO4
Физические свойства меди:
- В чистом виде это вязкий, мягкий и ковкий металл красно-розового цвета.

- Не изменяется на воздухе при отсутствии влаги и углекислого газа. Если же в воздухе медь вступает в реакцию с кислородом, водой и углекислым газом, то образуется непрочная патина зелёного цвета – продукт окисления.
- При нагревании тускнеет (образование оксидной пленки).
- Обладает исключительно хорошей тепло- и электропроводностью.
- Температура плавления равна 1084,5°С, температура кипения равна 2540°С.
Химические свойства меди:
Медь – слабый восстановитель (благородный металл). Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия.
Реагирует с концентрированной серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. При нагревании вступает во взаимодействие с галогеноводородами.
Не реагирует с водой, разбавленной хлороводородной кислотой.
1. Реагирует с концентрированной серной и азотной кислотами:
Cu + H2SO4(хол. ) → CuO + SO2↑ + H2O
) → CuO + SO2↑ + H2O
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
2. Окисляется «царской водкой»:
Cu + 2HNO3 + 6HCl → 3CuCl2 + 2NO↑ + 4H2O
3. Окисляется кислородом при нагревании:
4Cu + O2(недост.)→ 2Cu2O
2Cu + O2(изб.)→ 2CuO
4. При комнатной температуре реагирует с галогенами (хлором и бромом) и серой:
Cu + Cl2 → CuCl2
Cu + S → CuS
5. При нагревании вступает во взаимодействие с оксидами неметаллов:
4Cu + SO2→ Cu2S + 2CuO
Cu + 2N2O4→ Cu(NO3)2 + 2NO↑
Применение меди:
Металлообрабатывающая, машиностроительная, химическая, стекольная, военная промышленности, сельское хозяйство и ряд других отраслей – основные потребители меди.
Медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или проводников. Применяют и в различных теплоотводных и теплообменных устройствах: радиаторах охлаждения, кондиционирования и отопления, компьютерных кулерах. В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию. Медь широко применяется как катализатор, как бактерицидное средство и в архитектурном деле.
Источники
1. https://ru.wikipedia.org/wiki.
2. Лидин, Р. А. Химические свойства неорганических веществ / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. – М.: Химия, 2000.
3. Таубе П. Р. От водорода до … / П. Р. Таубе, Е. И. Руденко. – М.: Высшая школа, 1968.
Медь — свойства и характеристики, обзорная статья, реферат, доклад
Медь — это металл 11 группы 4 периода под номером 29 в актуальной периодической таблице. В прошлом этот же элемент находился в подгруппе 1 группы в устаревших таблицах. Плотность меди составляет 8,92 г/см3.
Плотность меди составляет 8,92 г/см3.
Основными ценными качествами Cu является высокая электропроводность и теплопроводность для изготовления проводников. Основным продуктом из этого металла является проволока, также медь выпускают в виде прутков различного сечения и лент для нужд промышленности.
Однако, Cu ценится весьма высоко, поэтому в тех случаях, когда в производстве не требуется высокой тепло и электропроводности от материала, производители предпочитают применять более недорогие сплавы бронзы или латуни. Там где в производстве счёт идёт на десятки тонн металла, легирование Cu недорогими элементами такими как алюминий, железо, свинец позволяет сократить расходы. Поэтому сплавы Cu применяются достаточно широко, а в некоторых областях превосходят чистый Cu по популярности, поскольку они обладают улучшенными характеристиками прочности, ковкости, коррозионной стойкости (особенно сплавы с Al) и более высокой твёрдостью.
Слово медь восходит к слову «мида» которое, на языке племён, населявших Восточную Европу в глубокой древности, обозначало металл вообще. Обозначение Cu (cuprum) восходит к древней латыни, на которой остров Кипр, на котором римляне добывали медь, назывался Cyprus, а металл aes cyproum.
Обозначение Cu (cuprum) восходит к древней латыни, на которой остров Кипр, на котором римляне добывали медь, назывался Cyprus, а металл aes cyproum.
В Северной Америке из самородной меди изготавливали оружие, ещё до заселения континента европейцами. В третьем тысячелетии до н.э. получать Cu стали из смешанных соединений. В Древнем Египте медь уже использовали при строительстве пирамиды Хеопса, для изготовления инструментов, которыми обрабатывали глыбы камня. Примерно в это же время в медь стали добавлять олово, что послужило началом бронзового века. Сегодня купить медь в России можно в интернет-магазине NFmetall.ru
Добыча и сырьё
Содержание меди в земной коре составляет 4,7-5,5*10-3 % от общей массы. В морской воде содержится около 3*10-7 %. Большинство месторождений меди имеют геотермальное происхождение. Богатые запасы меди содержатся на дне морей и океанов в виде отложений 5,7*10-3 % от общей доли.
В природе Cu присутствует в виде смеси двух активных изотопов (атомов с одинаковым химическим номером, но разными массовыми числами). Cu встречается в виде самородков, но чаще – в смешанном виде. Cu производят, в основном, из соединений, которые имеют в составе S (Серу) (их называют сульфидами), либо оксидов (соединений с кислородом), либо из карбонатов (CO3 в основе).
Cu встречается в виде самородков, но чаще – в смешанном виде. Cu производят, в основном, из соединений, которые имеют в составе S (Серу) (их называют сульфидами), либо оксидов (соединений с кислородом), либо из карбонатов (CO3 в основе).
22% меди добывается в Чили, 20% в США, 9% в странах бывшего СНГ, 7,5% в Канаде, и около 5 % в Замбии. Большинство крупных месторождений самородной меди выработано в настоящий момент. Её производят из смешанных руд, содержание меди в которых равняется 0,5-1,2%. 1/3 медной продукции производят из вторсырья.
Основной интерес для добытчиков представляет халькопирит CuFeS2 (более 50% запасов меди). Медь добывают также из сулфидных соединений: халькозина CuxS, ковеллина CuS, Cu5FeS4 бронита, или кислородосодержащих соединений: CuCO3Cu(OH)2 малахита, Cu2O куприта, CuSiO3H2O хризоколла.
Породы содержащие медь добываются в карьерах. Карьеры могут разрабатываться сколом с помощью экскаваторов, а также с применением взрывотехники. Основную массу работы в карьерах выполняют карьерные экскаваторы с ковшами вместительностью до 25м3 и грузовики, способные перевозить до 250 т ценной породы.
Карьеры могут разрабатываться сколом с помощью экскаваторов, а также с применением взрывотехники. Основную массу работы в карьерах выполняют карьерные экскаваторы с ковшами вместительностью до 25м3 и грузовики, способные перевозить до 250 т ценной породы.
Получение меди из смешанных соединений
Для получения чистой руды из смешанных соединений используется пирометаллургический метод, в основе которого лежит воздействие огнём. Перемолотая до частиц размером 0,1-0,2 мм порода проходит ряд процедур очистки:
- пенную флотацию,
- обжиг,
- плавку,
- конвертирование,
- рафинирование.
А теперь обо всём подробнее и по порядку.
Флотационное обогащение
Флотация переводится как плавание на поверхности. Пенная флотация — метод обогащения в металлургии, в процессе которого полезная порода поднимается на поверхность пульпы (смеси молотых минералов и реагентов) пузырьками воздуха подаваемого извне.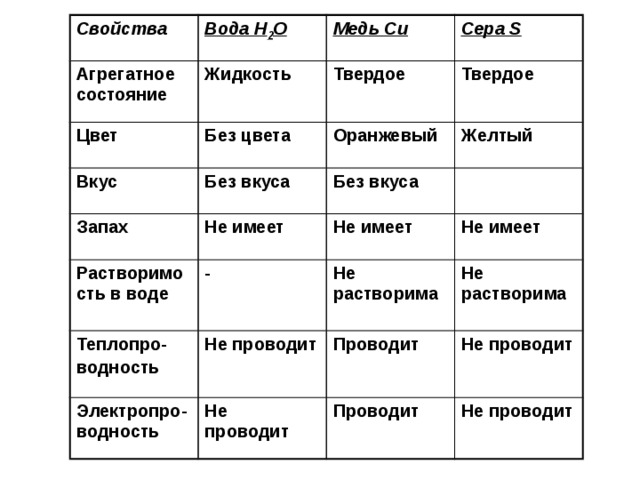 Поднятая смесь образует на поверхности пену, которая снимается с помощью лопатного механизма и отправляется на сушку, а осадок — на переработку для последующего изготовления кирпичей, черепицы и других изделий. В результате данной процедуры содержание меди в концентрате возрастает до 15-20 %.
Поднятая смесь образует на поверхности пену, которая снимается с помощью лопатного механизма и отправляется на сушку, а осадок — на переработку для последующего изготовления кирпичей, черепицы и других изделий. В результате данной процедуры содержание меди в концентрате возрастает до 15-20 %.
Флотационные реагенты создают особые условия на границе раздела пузырьков воздуха и соединений меди. Реагенты-собиратели поднимают на поверхность частицы с Cu. Побочные продукты же набирают массу под действием влаги и не всплывают. Вспениватели создают условия для оптимального пенообразования. Реагенты-модификаторы создают наилучшие условия для отделения схожих элементов от ценных, или осуществляют ряд других функций.
Обжиг Меди
Обжиг производят ниже температуры плавления сырья с целью изменения состава, удаления ненужных соединений и объедения мелких фракций концентрата в более крупные. В зависимости от применяемого концентрата, обжиг бывает стабилизирующим или окислительным. Стабилизирующий обжиг применяется для получения низших оксидов и металлов. Окислительный обжиг производится с целью получения сульфатов или оксидов.
Окислительный обжиг производится с целью получения сульфатов или оксидов.
Плавка Меди
Плавка — способ концентрирования, при котором основная часть или весь концентрат доводится до температуры плавления. При этом образуется несколько несмешиваемых слоёв:
- сплавы оксидов, которые всплывают на поверхность (шлак)
- и верхний слой сульфидов железа и цветных металлов (штейн).
Штейн — это слой основной массы цветных металлов (Cu, Ni, S), солей и других. Иногда в результате плавки, наоборот ценным является шлак. Концентрация меди после плавки составляет более 50%.
Конвертирование
Конвертирование меди проходит в 2 стадии в конвертере (цилиндрической установке, в которую подаётся воздух снизу или на поверхность металла).
На первой стадии удаляются остатки железа с помощью добавления в расплав флюса кремнезёма (SiO2) и подачи кислорода. Шлак кремнезёма составляет 21-30%, остальное — железо. После этой процедуры расплав меди получает название белый матт. На второй стадии белый матт окисляется кислородом и снова происходит разделение. Конечным продуктом конвертации меди является черновая медь.
На второй стадии белый матт окисляется кислородом и снова происходит разделение. Конечным продуктом конвертации меди является черновая медь.
Рафинирование
Рафинирование — окончательная очистка металла от примесей проводится в два этапа: огневым и электролитическим способом.
Огневое рафинирование производится в анодных печах с горизонтальным конвертером. В печь загружается черновая медь, далее следует расплавление, окислительная и восстановительная обработка, разливка. Окислительный процесс подразумевает подачу воздуха в расплав на глубину от 600 до 800 мм. Окисляются примеси с большим сродством кислороду Fe, Al, Ni, Sn, Sb, Zn, Bi, As, а также часть меди до состояния Cu2O. На восстановительном этапе расплав обрабатывают природным газом или парамазутными смесями. В результате химической реакции расплав перемешивается, и из него удаляются газы, а часть окисленного Cu2O восстанавливается. Сплав с содержанием S.
На втором этапе аноды погружаются в коробчатые ванны. Между ними подвешиваются катоды из чистой меди, через которые подаётся электричество. Вся медь переходит из анодов в катоды за 30 дней. Катоды выгружаются партиями через 6-12 дней. Из осадков в электролите же выделяют множество полезных элементов, таких как Золото и Серебро.
Между ними подвешиваются катоды из чистой меди, через которые подаётся электричество. Вся медь переходит из анодов в катоды за 30 дней. Катоды выгружаются партиями через 6-12 дней. Из осадков в электролите же выделяют множество полезных элементов, таких как Золото и Серебро.
Розлив меди и дальнейшая обработка
Полученные катоды из чистой меди уже являются готовой продукцией, но большую часть из них переплавляют в печах и разливают с помощью установки непрерывной разливки сырья в слитки, после чего прокатывают через валки до получения: медной проволоки, листов медных, а так же прутков из меди.
Либо же из печей сплав попадает в карусельные разливочные машины, которые разливают медь в ваербасы для последующего изготовления проволоки.
Химический состав
Медь
Медь
|
|
Факты о меди, символ, открытие, свойства, использование
- Что такое медь
- Where Is It Found
- History
- Copper Identification
- Properties and Characteristics of Copper
- Atomic Data of Copper (Element 29)
- Uses of Copper
- Is It Dangerous
- Interesting Facts
- Cost of Copper ( Элемент Cu)
Что такое Медь
Медь (произношение КОП-ер [2] ), представленная химическим символом или формулой Cu [1] , представляет собой мягкий, ковкий и пластичный элемент, принадлежащий к семейству переходных металлов [3, 4, 7] . Встречающаяся в природе Cu представляет собой смесь двух стабильных изотопов с массовыми числами 63 и 65 [1, 3] . Кроме того, он содержит 24 синтетических радиоактивных изотопа с известным периодом полураспада [3] . В нормальных условиях он стабилен на воздухе, но в раскаленном состоянии реагирует с кислородом с образованием его оксида. Он также реагирует с галогенами и кислотами [21] .
Встречающаяся в природе Cu представляет собой смесь двух стабильных изотопов с массовыми числами 63 и 65 [1, 3] . Кроме того, он содержит 24 синтетических радиоактивных изотопа с известным периодом полураспада [3] . В нормальных условиях он стабилен на воздухе, но в раскаленном состоянии реагирует с кислородом с образованием его оксида. Он также реагирует с галогенами и кислотами [21] .
Символ меди
Где встречается
Этот металл редко встречается в природе в свободном виде. Его основными рудами являются такие минералы, как борнит и халькопирит. Cu выделяют из этих руд плавлением, выщелачиванием и электролизом [1, 3] .
Медный пенни
История
Происхождение названия: Название происходит от старого английского названия «coper», которое, в свою очередь, происходит от латинских слов «Cyprium aes», что означает металл с Кипра [1 ] .
Кто открыл медь: Неизвестно [1] .
Когда было обнаружено: В доисторические времена [1] .
Как это было обнаружено
Исторически медь была первым металлом, обработанным людьми. Открытие того, что он может быть закален добавлением олова для образования сплава бронзы, привело к названию бронзового века, когда он использовался для изготовления монет, столовых приборов и инструментов. Было обнаружено, что медные бусы, раскопанные в северном Ираке, имеют возраст более десяти тысяч лет [1] .
Медь
Обозначение меди | |||
| Атомный номер | 29 [1] | ||
| Номер CAS | 7440-50-8 [1] | ||
| Позиция в периодической таблице | Группа | Период | Блок |
| 11 [1] | 4 [1] | д [1] | |
Где находится медь в периодической таблице
Свойства и характеристики меди
Общие свойства | ||
| Атомная масса | 63,546 атомных единиц массы [1] | |
| Атомный вес | 63. 546 [1] 546 [1] | |
| Массовый номер | 63 [3] | |
| Молярная масса/молекулярная масса | 63,546 г/моль [20] | |
Физические свойства | ||
| Цвет/внешний вид | Оранжево-красный [3] | |
| Блеск | Яркий металлик [3] | |
| Точка плавления/замерзания | 1084,62°C, 1984,32°F [1] | |
| Температура кипения | 2560°C, 4640°F [1] | |
| Плотность | 8,96 г см -3 [1] | |
| Состояние вещества при комнатной температуре (нормальная фаза) | сплошной [1] | |
| Теплопроводность | 385 Вт/(м·К) [8] | |
| Электропроводность | 5,96X10 7 Ш/м [9] | |
| Удельная теплоемкость | 0,385 Дж/г o С [10] | |
| Удельный вес | 8,89 [11] | |
| Удельное сопротивление | 1,72X10 -8 Ом-м [12] | |
| Твердость (шкала Мооса) | 3 [13] | |
| Предел текучести | 40-80 МПа [14] | |
| Прочность на растяжение | 200 МПа [14] | |
| Температурный коэффициент | +0,393%/ o С [15] | |
| Коэффициент линейного расширения | 17X10 -6 / или C [16] | |
Химические свойства | ||
| Степень окисления/степень окисления | +1, +2 , +3, +4 [1] | |
| Воспламеняемость | № [17] | |
Магнитные свойства | ||
| Магнитное упорядочение | Диамагнетик [18] | |
Атомные данные меди (элемент 29)
| Валентные электроны | 1 или 2 [5] | |||||||
| Валентность | +1, +2 [6] | |||||||
| Квантовые числа | ||||||||
| – № | 3 [7] | |||||||
| – ℓ | 2 [7] | |||||||
| – м л | 2 [7] | |||||||
| – м с | -½ [7] | |||||||
| Электронная конфигурация (конфигурация благородных газов) | [Ar] 3d 10 4s 1 [1] | |||||||
| Кристаллическая структура | Гранецентрированный куб [4] | |||||||
| Постоянная решетки | 361. 49, 361.49, 361.49 пм [19] 49, 361.49, 361.49 пм [19] | |||||||
| Атомная структура | ||||||||
| — Количество электронов | 29 [3] | |||||||
| – Количество нейтронов | 34 [3] | |||||||
| — Количество протонов | 29 [3] | |||||||
| Уровни энергии [3] | ||||||||
| — Первый уровень энергии | 2 | |||||||
| — Второй энергетический уровень | 8 | |||||||
| — Третий энергетический уровень | 18 | |||||||
| — Четвертый энергетический уровень | 1 | |||||||
| Радиус атома | ||||||||
| – Атомный радиус | 1,96 Å [1] | |||||||
| – Ковалентный радиус | 1,22 Å [1] | |||||||
| Электроотрицательность (шкала Полинга) | 1,90 [1] | |||||||
| Энергия ионизации (кДжмоль -1 ) [1] | 1-й | 2-й | 3-й | 4-й | 5-й | 6-й | 7-й | 8-й |
745. 482 482 | 1957.919 | 3554.616 | 5536.33 | 7699,5 | 9938 | 13411 | 16017 | |
Электронная конфигурация меди (модель Бора)
Использование меди
- Обычно используется для изготовления монет [1] .
- Для электрического оборудования, такого как двигатели и электропроводка, из-за его высокой электро- и теплопроводности [1] .
- Для строительных целей (таких как водопровод и кровля) и промышленного оборудования (таких как теплообменники) [1] .
- Сульфат меди находит широкое применение в качестве сельскохозяйственного яда и альгицида при очистке воды [1] .
- Соединения меди, например, раствор Фелинга, применяют в химических тестах, выявляющих сахар [1] .
Медная посуда
Опасно ли это
Хотя этот элемент необходим для всех растений и животных, избыточное количество токсично. Приготовление кислой пищи в медной посуде может вызвать отравление. Вот почему медная посуда должна быть облицована, чтобы предотвратить проглатывание опасной зелени (соединений, образующихся при коррозии меди). Взрослому человеку ежедневно требуется около 1,2 миллиграмма меди9.0143 [1, 3] . Вы можете предотвратить дефицит меди, употребляя в пищу продукты с высоким содержанием меди, такие как цельнозерновые продукты, орехи, бобы, картофель, устрицы и другие моллюски [22] .
Приготовление кислой пищи в медной посуде может вызвать отравление. Вот почему медная посуда должна быть облицована, чтобы предотвратить проглатывание опасной зелени (соединений, образующихся при коррозии меди). Взрослому человеку ежедневно требуется около 1,2 миллиграмма меди9.0143 [1, 3] . Вы можете предотвратить дефицит меди, употребляя в пищу продукты с высоким содержанием меди, такие как цельнозерновые продукты, орехи, бобы, картофель, устрицы и другие моллюски [22] .
Медная проволока
Интересные факты
- В отличие от людей, которые используют железо, содержащееся в гемоглобине крови, для переноса кислорода в организме, некоторые ракообразные используют комплексы меди [1] .
- Поверхность меди на воздухе постепенно тускнеет, приобретая тусклый коричневатый цвет [3] .
Металлическая медь
Стоимость меди (элемент Cu)
Чистый металл стоит 9,76 доллара за каждые 100 грамм, а навалом такое же количество стоит 0,66 доллара [3] .
Ссылки
- http://www.rsc.org/periodic-table/element/29/copper
- https://education.jlab.org/itselemental/ele029.html
- https://www.chemicool.com/elements/copper.html
- https://www.lenntech.com/periodic/elements/cu.htm
- https://environmentalchemistry.com/yogi/periodic/Cu.html
- https://www.enotes.com/homework-help/valency-copper-585843
- http://chemistry-reference.com/q_elements.asp?Symbol=Cu
- http://hyperphysics.phy-astr.gsu.edu/hbase/Tables/thrcn.html
- https://www.thoughtco.com/table-of-electrical-resistivity-conductivity-608499
- http://www.iun.edu/~cpanhd/C101webnotes/matter-and-energy/specificheat.html
- https://www.engineeringtoolbox.com/specific-gravity-solids-metals-d_293.html
- https://www.electronics-tutorials.ws/resistor/resistivity.html
- http://periodictable.com/Properties/A/MohsHardness.v.html
- https://www.




 Монель и оружейные металлы также содержат медь. Видимо
Монель и оружейные металлы также содержат медь. Видимо