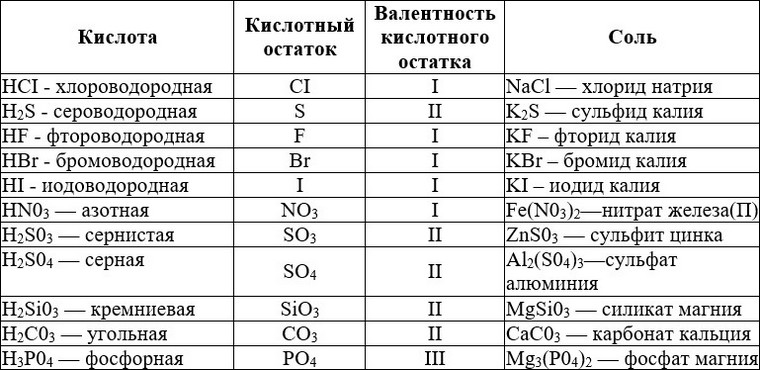
Характерные свойства меди и серы таблица 8 класс: Сравните физические свойства меди и серы
Содержание
Сероводород. Что это такое? Формула, соединения и примеры
Поможем понять и полюбить химию
Начать учиться
Чтобы сдать ОГЭ в 9‑м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает.
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.

Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.

Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
H2S ⇄ H+ + HS−.
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
взаимодействие с активными металлами:
H2S + Mg → MgS + H2;
раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O;
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2S + 2H2O;
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.

Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя.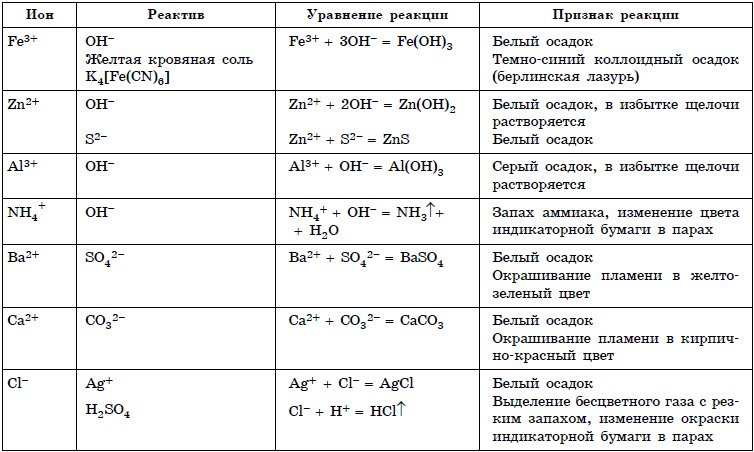 При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O;
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O;
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
H2S + H2SO4 (конц) → S + SO2 + 2H2O.

Вопросы для самопроверки
Охарактеризуйте физические свойства сульфида водорода.
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
Схеме превращений S−2 → S+4 соответствует уравнение:
2H2S + O2 → S + 2H2O
H2SO3 + H2O2 → H2SO4 + H2O
PbS + 4H2O2 → PbSO4 + 4H2O
2H2S + 3O2 → 2SO2 + 2H2O
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.

Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
Верно только А
Верно только Б
Оба верны
Оба неверны
Татьяна Сосновцева
К предыдущей статье
268.9K
Валентность
К следующей статье
Химия углерода
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Строение атома серы и схема электронной оболочки
4. 6
6
Средняя оценка: 4.6
Всего получено оценок: 273.
4.6
Средняя оценка: 4.6
Всего получено оценок: 273.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.
Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Рис. 2. Строение атома.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.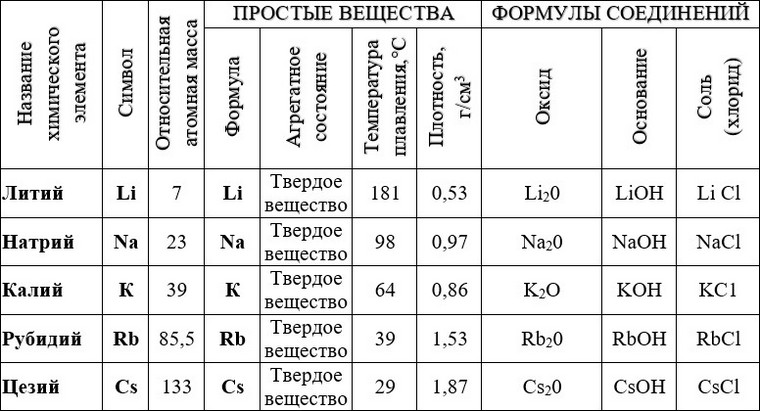
Рис. 3. Сера.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Взаимодействие | Продукты реакции | Пример |
С металлами | Сульфиды | Cu + S → CuS |
С кислородом при 280°С | Оксид серы | – S + O2 → SO2; – 2S + 3O2 → 2SO3 |
С водородом при нагревании | Сероводород | H2 + S → H2S |
С фосфором при нагревании в отсутствии воздуха | Сульфид фосфора | 2P + 3S → P2S3 |
С фтором | Фторид серы | S + 3F2 → SF6 |
С углеродом | Сероуглерод | 2S + C → CS2 |
С кислотами | Кислота | S + 2HNO3 → 2NO + H2SO4 |
Со щёлочью | Сульфиды и сульфиты | 3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 273.
А какая ваша оценка?
Сульфид меди(I) | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Сульфид меди(I)
Номер продукта: КУ1-С-05-И
, КУ1-С-05-Л
, КУ1-С-05-П
, CU1-S-05-ST
Номер CAS: 22205-45-4
Соответствующие установленные области применения вещества: Научные исследования и разработки
Сведения о поставщике:
American Элементы
10884 Weyburn Ave.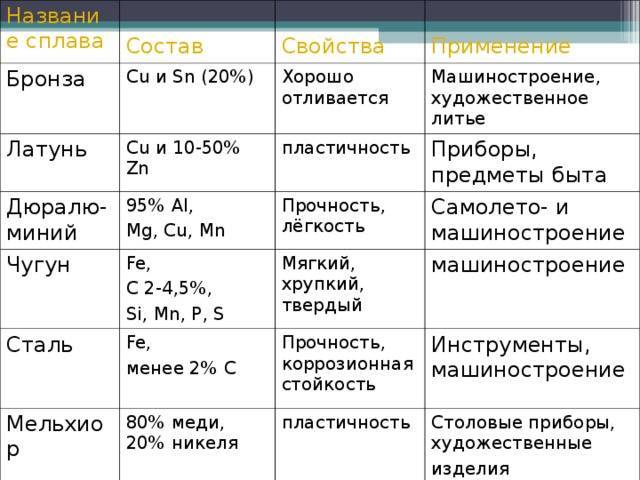
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424 -9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
Вещество не классифицируется в соответствии с Согласованной на глобальном уровне системой (ГХС).
Опасности, не классифицированные иначе
Данные отсутствуют
Элементы маркировки СГС
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Указания на опасность
Н/Д
Классификация WHMIS
Не контролируется
Система классификации
H Рейтинги MIS (шкала 0-4 )
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКЦИОННАЯ СПОСОБНОСТЬ
1
0
1
Здоровье (острое воздействие) = 1
Воспламеняемость = 0
Физическая опасность = 1
Прочее опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
Номер CAS / Название вещества: 22205-45-4 Медь(I) сульфид
Идентификационный номер(а) :
Номер ЕС: 244-842-9
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5.
 МЕРЫ ПОЖАРОТУШЕНИЯ
МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт не воспламеняется. Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Оксиды серы (SOx)
Сероводород
Оксиды меди
Рекомендации для пожарных
Защитное оборудование:
Автономная одежда респиратор.
Наденьте полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Продукт негорючий
Условия для безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Особое конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость движения не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и зараженную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа N95 (США) или PE (EN 143) в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Порошок
Цвет: Черный
Запах: Без запаха
Порог запаха: данные отсутствуют.
pH: нет данных
Точка плавления/диапазон плавления: около 1100 °C (ок. 2012 °F)
2012 °F)
Точка/диапазон кипения: данные отсутствуют
Температура сублимации/начало: данные отсутствуют
Воспламеняемость (твердое вещество, газ): Данные недоступны.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Нет данных
Верхний: данные отсутствуют
Давление пара: неприменимо
Плотность при 20 °C (68 °F): 5,6 г/см 3 (46,732 фунта/галлон)
Относительная плотность: данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): Не растворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация: Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Нет доступных данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Реагирует с сильным окислителем
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Окислители
Опасные продукты разложения:
Оксиды серы (SOx)
Сероводород
Оксид меди
РАЗДЕЛ 11. ИНФОРМАЦИЯ О ТОКСИЧНОСТИ
Информация о токсикологическом воздействии
Острая токсичность:
Воздействие не известно.
Значения LD/LC50, важные для классификации:
Нет данных
Раздражение или коррозия кожи:
Может вызывать раздражение
Раздражение или коррозия глаз:
Может вызывать раздражение
Повышение чувствительности:
Неизвестно о сенсибилизирующих эффектах.
Мутагенность зародышевых клеток:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях для этого вещества.
Канцерогенность:
Данные классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность:
Воздействие не известно.
Специфическая токсичность для системы органов-мишеней — многократное воздействие:
Неизвестно никаких эффектов.
Специфическая токсичность для системы органов-мишеней — однократное воздействие:
Воздействие не известно.
Опасность при вдыхании:
Эффекты неизвестны.
От подострой до хронической токсичности:
Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Биоаккумулятивный потенциал
Нет данных
Мобильность в почве
Данные отсутствуют
Дополнительная экологическая информация:
Избегать передачи в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные воздействия: данные отсутствуют
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Ознакомьтесь с официальными правилами для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация: Утилизация должна производиться в соответствии с официальными правилами
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Класс(ы) опасности при транспортировке
DOT, ADR, ADN, IMDG, IATA
Класс
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Окружающая среда опасности:
Н/Д
Особые меры предосторожности для пользователя
Н/Д
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
Н/Д
Транспорт/Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Элементы маркировки СГС
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Заявления об опасности
Н/Д
Национальные правила
Все компоненты этого продукта перечислены в Законе Агентства по охране окружающей среды США о контроле над токсичными веществами Инвентаризация химических веществ.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
SARA Section 313 (списки конкретных токсичных химических веществ)
22205-45-4 Сульфид меди(I)
Законопроект 65 штата Калифорния
Prop 65 — Химические вещества, вызывающие рак
Вещество не указано.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано в списке
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Использование алюминия, меди, цинка и железа
Земная кора богата минералами и рудами. Некоторые руды оказались ценным ресурсом для человечества. Например, железо, полученное из железной руды (гематита), заложило основу промышленной революции. Алюминий, с другой стороны, был важным стратегическим ресурсом для авиации во время Первой и Второй мировых войн. Несмотря на это, металлический алюминий продолжает доминировать на рынке благодаря своим уникальным свойствам, а также быстрой и экономичной добыче. Металлы составляют 70% всех встречающихся в природе элементов. В природе металлы встречаются как в свободном, так и в смешанном виде. Обычно химически активные металлы существуют в смешанных состояниях в виде оксидов, сульфидов, карбонатов и т.д. Металлы в центре ряда реакционной способности, такие как цинк, железо и свинец, умеренно реакционноспособны и встречаются в земной коре в виде оксидов, сульфидов, карбонатов и т. д.
В природе металлы встречаются как в свободном, так и в смешанном виде. Обычно химически активные металлы существуют в смешанных состояниях в виде оксидов, сульфидов, карбонатов и т.д. Металлы в центре ряда реакционной способности, такие как цинк, железо и свинец, умеренно реакционноспособны и встречаются в земной коре в виде оксидов, сульфидов, карбонатов и т. д.
Алюминий
Алюминий с атомным номером 13 и символом Al является химическим элементом. Алюминий имеет меньшую плотность, чем большинство распространенных металлов, примерно на треть плотности стали. При контакте с воздухом создает на поверхности защитное покрытие из оксида из-за высокого сродства к кислороду. Алюминий имитирует серебро по внешнему виду, как по цвету, так и по способности отражать свет. Он податлив, немагнитен и пластичен.
Свойства алюминия
- Чистый алюминий (99,996 %) мягкий и непрочный; технический алюминий (чистота от 99 до 99,6%) со следовыми уровнями кремния и железа является твердым и прочным.

- Алюминий — пластичный и чрезвычайно ковкий металл, из которого можно вытягивать проволоку или сворачивать в тонкую фольгу.
- Плотность металла составляет всего одну треть плотности железа или меди.
- Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью благодаря образованию толстой прочной оксидной пленки на его поверхности на воздухе.
- Алюминий является отличным проводником тепла и электричества.
- Он имеет примерно половину теплопроводности меди и примерно две трети электропроводности.
- Кристаллизуется в гранецентрированной кубической форме.
- Полностью натуральный алюминий содержит стабильный изотоп под названием алюминий-27.
- Металлический алюминий, а также его оксид и гидроксид безвредны.
Использование алюминия
- Алюминий добавляют в умеренных количествах к некоторым металлам для улучшения их свойств для конкретных целей, таких как алюминиевые бронзы и большинство сплавов на основе магния, или значительные количества других металлов и кремния добавляют к алюминию в сплавы на основе алюминия.

- Металл и его сплавы широко используются в производстве самолетов, строительных материалов, товаров длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводников, химического и пищевого оборудования.
- Рулоны, банки, фольга и другие упаковочные материалы часто изготавливаются из алюминия в упаковочной промышленности.
- Он также содержится в многочисленных предметах повседневного обихода, таких как посуда и часы.
- Алюминий используется в строительной промышленности для изготовления дверей, окон, кабелей и кровли.
- Он используется в транспортной отрасли для изготовления велосипедов, космических кораблей, кузовов автомобилей, самолетов и морского оборудования.
- Многие монеты состоят из сплавов, содержащих алюминий.
- Алюминий также используется в производстве красок, отражающих поверхностей и проводов.
Медь
Медь имеет атомный номер 29 и химический символ Cu. Это пластичный, мягкий, ковкий металл с хорошей тепло- и электропроводностью. Цвет свежеобнаженной чистой меди розовато-оранжевый.
Цвет свежеобнаженной чистой меди розовато-оранжевый.
Свойства меди
- Медь является одним из самых пластичных металлов, то есть она не очень прочная или твердая.
- Холодная обработка значительно повышает прочность и твердость благодаря получению удлиненных кристаллов с такой же гранецентрированной кубической структурой, как у более мягкой отожженной меди.
- В расплавленной меди кислород, азот, двуокись углерода и двуокись серы растворимы и влияют на механические и электрические свойства затвердевшего металла.
- По тепло- и электропроводности чистый металл уступает только серебру.
- Природная медь состоит из двух стабильных изотопов: меди-63 и меди-65.
Использование меди
- Медь используется в качестве проводника тепла и электричества, строительного материала и компонента различных металлических сплавов, включая стерлинговое серебро в ювелирных изделиях, мельхиор в морском оборудовании и монетах, константан в тензодатчиках и датчики температуры.

- Большая часть производимой в мире меди используется в электротехнической промышленности, а остальная часть смешивается с другими металлами для образования сплавов. (С точки зрения технологии гальваническое покрытие также имеет важное значение.)
- Латуни (медь и цинк), бронзы (медь и олово) и нейзильберы представляют собой важные серии сплавов, в которых медь является основным элементом (медь, цинк, и никель, без серебра).
- Существует множество полезных медных и никелевых сплавов, особенно монель; два металла полностью смешиваются.
- Медь также имеет значительную последовательность сплавов с алюминием, известных как алюминиевые бронзы.
- Бериллиевая медь (2% Be) представляет собой уникальный медный сплав, который можно упрочнить путем термической обработки.
- Медь можно найти в различных металлах для чеканки.
Цинк
Цинк — это химический элемент с атомным номером 30 и символом Zn. Цинк является относительно хрупким металлом при нормальной температуре, с серебристо-серым оттенком после удаления окисления. Это первый элемент в группе 12 периодической таблицы (IIB). Цинк в некотором роде химически подобен магнию: оба элемента имеют только одну нормальную степень окисления (+2). Цинк является двадцать четвертым наиболее распространенным элементом в земной коре с пятью стабильными изотопами.
Это первый элемент в группе 12 периодической таблицы (IIB). Цинк в некотором роде химически подобен магнию: оба элемента имеют только одну нормальную степень окисления (+2). Цинк является двадцать четвертым наиболее распространенным элементом в земной коре с пятью стабильными изотопами.
Свойства цинка
- Цинк представляет собой голубовато-белый, глянцевый, диамагнитный металл, хотя большинство товарных марок имеют матовую поверхность.
- Он имеет гексагональную кристаллическую структуру с искаженной гексагональной плотной упаковкой, где каждый атом имеет шесть ближайших соседей в своей плоскости (на расстоянии 265,9 пм) и еще шесть на большем расстоянии 290,6 пм.
Использование цинка
- Металлический цинк в основном используется для защиты от коррозии железа и стали, а также в производстве латуни и сплавов для литья под давлением.
- При контакте с воздухом цинк создает непроницаемое покрытие из своего оксида, что делает металл более устойчивым к обычным атмосферным воздействиям, чем железо, и подвержен коррозии с гораздо меньшей скоростью.

- Кроме того, поскольку цинк окисляется быстрее, чем железо, стальная поверхность защищена, даже если часть ее обнажена через трещины. Для создания цинкового покрытия используется либо горячее цинкование, либо электроцинкование.
- Поверхность свежеотлитого цинка имеет голубоватый оттенок серебра, который постепенно окисляется на воздухе с образованием сероватого защитного оксидного слоя.
- Так называемый первосортный западный сорт (чистота 99,8 %) становится хрупким в холодном состоянии, но при 100°C может сворачиваться в гибкие листы. Высокочистый цинк (чистота 99,99%) пластичен.
- Гексагональная плотноупакованная структура цинка кристаллизуется.
- Когда железо и цинк вместе подвергаются воздействию агрессивной жидкости, они образуют электролитическую ячейку, при этом цинк повреждается преимущественно из-за его более высокого электродного потенциала.
- Эта так называемая жертвенная защита, наряду со значительно более высокой коррозионной стойкостью цинка в воздушной среде, служит основой для цинкования.

Железо
Химический символ железа — Fe, атомный номер — 26. Оно принадлежит к первому переходному ряду и группе 8 периодической таблицы. Это самый распространенный элемент на Земле по массе, опережающий кислород (32,1% и 30,1% соответственно), и он составляет большую часть внешнего и внутреннего ядра планеты. Это четвертый по распространенности элемент в земной коре.
Свойства железа
- Во влажном воздухе ржавеет, но не в сухом.
- Легко растворяется в слабых кислотах.
- Этот металл находится в форме феррита или в -форме при комнатной температуре.
- Он превращается в гамма-железо при температуре около 910°C, которое по своей природе намного мягче.
- Температура плавления 1536°C и температура кипения 2861°C.
- Поскольку это металл, он обладает магнитными свойствами. Быть металлом магнитно по своей природе.
Использование железа
- Он используется в производстве стали, а также в гражданском строительстве, таком как железобетон, балки и т.
 д.
д. - Легированные стали, такие как углеродистые стали, изготавливаются из железа с добавками, такими как никель, хром, ванадий, вольфрам и марганец.
- Из них делают мосты, опоры электропередач, велосипедные цепи, режущие инструменты и стволы винтовок.
- Углерод присутствует в 3–5% чугуна. Он используется в производстве труб, клапанов и насосов.
- Железные катализаторы используются в процессе Габера для получения аммиака.
- Магниты могут быть изготовлены из этого металла, а также его сплавов и соединений.
Концептуальные проблемы
Вопрос 1: Почему железо имеет высокую температуру плавления?
Решение:
Чтобы расплавить или вскипятить металл, необходимо преодолеть притяжение между ионами металла и смещенными электронами. Поскольку такие силы притяжения являются твердыми, металлы имеют высокие температуры плавления и кипения.
Вопрос 2: Каковы свойства железа?
Решение:
Железо — серебристо-серый металл, блестящий, пластичный и ковкий (группа периодической таблицы VIII).
Известно, что он появляется в четырех уникальных кристаллических формах. Железо ржавеет во влажных условиях, но не в сухом воздухе. Быстро растворяется в разбавленных кислотах.
Вопрос 3: Каковы недостатки цинка?
Решение:
Дефицит цинка может нанести вред здоровью, а избыток цинка может иметь противоположные последствия. Наиболее распространенной причиной отравления цинком, которое может вызывать как острые, так и хронические симптомы, является чрезмерное потребление цинка. Тошнота и рвота являются симптомами интоксикации.
Вопрос 4: Как медь влияет на человека?
Решение:
Отравление медью может вызвать воспаление носа, горла и глаз, а также головные боли, боли в животе, головокружение, рвоту и диарею. Чрезмерное поглощение меди может нанести вред печени и почкам, а также привести к смерти. Канцерогенный потенциал меди еще предстоит определить.

