Хим свойства меди: Физико-химические свойства меди обеспечивают ей широкое применение во всех отраслях промышленности.
Содержание
Оксид меди (I)
Оксид меди (I) (гемиоксид меди, окси́д димеди, устар. закись меди) — химическое соединение с формулой Cu2O. Соединение меди с кислородом, основный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Реакции в водных растворах
- 3.2 Реакции при высоких температурах
- 3.3 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
Нахождение в природе
Оксид меди (I) встречается в природе в виде минерала куприта (устаревшие названия: красная медная руда, стекловатая медная руда, рубиновая медь). Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4.
Разновидность куприта с удлиненными нитевидными кристаллами называется халькотрихит (устаревшее название: плюшевая медная руда). Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда».
Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда».
Физические свойства
Оксид меди (I) при нормальных условиях — твёрдое вещество коричнево-красного цвета нерастворимое в воде и этаноле. Плавится без разложения при 1242 °C.
Оксид меди (I) имеет кубическую сингонию кристаллической решётки, пространственная группа P n3m, a = 0,4270 нм, Z = 2.
Химические свойства
Реакции в водных растворах
Оксид меди (I) не реагирует с водой. В очень малой степени (ПР = 1,2⋅10−15) диссоциирует:
- Cu2O + H2O ⇄ 2Cu+ + 2OH−
Равновесие диспропорционирования:
- 2Cu+ ⇄ Cu2+ + Cu
Оксид меди (I) переводится в раствор:
- концентрированной соляной кислотой
- Cu2O + 4HCl ⟶ 2H[CuCl2] + H2O
- концентрированной щёлочью (частично)
- Cu2O + 2OH− + H2O ⇄ 2[Cu(OH)2]−
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
- Cu2O + 4(NH3 ⋅ H2O) ⟶ 2[Cu(NH3)2]OH + 3H2O
- Cu2O + 2NH4+ ⟶ 2[Cu(H2O)(NH3)]+
- путём окисления до солей меди (II) различными окислителями (например, концентрированными азотной и серной кислотами, кислородом в разбавленной соляной кислоте)
- Cu2O + 6HNO3 ⟶ 2Cu(NO3)2 + 2NO2↑ + 3H2O
- Cu2O + 3H2SO4 ⟶ 2CuSO4 + SO2↑ + 3H2O
- 2Cu2O + 8HCl + O2 ⟶ 4CuCl2 + 4H2O
Также оксид меди (I) вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди (II)
- 2Cu2O + 4H2O + O2 ⟶ 4Cu(OH)2↓
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди (I):
- Cu2O + 2HHal ⟶ 2CuHal↓ + H2O (Hal = Cl, Br, I)
- в разбавленной серной кислоте дисмутирует на сульфат меди (II) и металлическую медь
- Cu2O + H2SO4 ⟶ CuSO4 + Cu↓ + H2O
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
- 2Cu2O + 2NaHSO3 ⟶ 4Cu↓ + Na2SO4 + H2SO4
Реакции при высоких температурах
Оксид меди (I) восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C (разложение)
- 2Cu2O →1800∘C 4Cu + O2
- при нагревании в токе водорода, монооксида углерода, с алюминием
- Cu2O + H2 →>250∘C 2Cu + H2O
- Cu2O + CO →250−300∘C 2Cu + CO2
- 3Cu2O + 2Al →1000∘C 6Cu + Al2O3
- при нагревании с серой
- 2Cu2O + 3S →>600∘C 2Cu2S + SO2
- 2Cu2O + Cu2S →1200−1300∘C 6Cu + SO2
Оксид меди (I) может быть окислен до соединений меди (II) в токе кислорода или хлора:
- 2Cu2O + O2 →500∘C 4CuO
- Cu2O + Cl2 →250∘C Cu2Cl2O
Также, при высоких температурах оксид меди (I) реагирует:
- с аммиаком (образуется нитрид меди (I) )
- 3Cu2O + 2NH3 →250∘C 2Cu3N + 3H2O
- c оксидами щелочных металлов и бария (образуются двойные оксиды)
- Cu2O + M2O →600−800∘C 2MCuO
- Cu2O + BaO →500−600∘C BaCu2O2
Прочие реакции
Оксид меди (I) реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди (II)
- Cu2O + 5HN3 →10−15∘C 2Cu(N3)2↓ + H2O + NH3↑ + N2↑
- при комнатной температуре в токе азидоводородной кислоты выпадает осадок азида меди (I)
- Cu2O + 2HN3 →20−25∘C 2CuN3↓ + H2O
Получение
Оксид меди (I) может быть получен:
- нагреванием металлической меди при недостатке кислорода
- 4Cu + O2 →>200∘C 2Cu2O
- нагреванием металлической меди в токе оксида азота (I) или оксида азота (II)
- 2Cu + N2O →500−600∘C Cu2O + N2
- 4Cu + 2NO →500−600∘C 2Cu2O + N2
- нагреванием металлической меди с оксидом меди (II)
- Cu + CuO →1000−1200∘C Cu2O
- термическим разложением оксида меди (II)
- 4CuO →1026−1100∘C 2Cu2O + O2
- нагреванием сульфида меди (I) в токе кислорода
- 2Cu2S + 3O2 →1200−1300∘C 2Cu2O + 2SO2
В лабораторных условиях оксид меди (I) может быть получен восстановлением гидроксида меди (II) (например, гидразином):
- 4Cu(OH)2 + N2H4 ⋅ H2O →100∘C 2Cu2O ↓ + N2↑ + 7H2O
Также, оксид меди(I) образуется в реакциях ионного обмена солей меди (I) с щелочами, например:
- в реакции йодида меди (I) с горячим концентрированным раствором гидроксида калия
- 2CuI + 2KOH ⟶ Cu2O↓ + 2KI + H2O
- в реакции дихлорокупрата (I) водорода с разбавленным раствором гидроксида натрия
- 2H[CuCl2] + 4NaOH ⟶ Cu2O↓ + 4NaCl + 3H2O
В двух последних реакциях не образуется соединения с составом, соответствующим формуле CuOH (гидроксид меди (I) ). Образование оксида меди (I) происходит через промежуточную гидратную форму переменного состава Cu2O ⋅ xH2O.
Образование оксида меди (I) происходит через промежуточную гидратную форму переменного состава Cu2O ⋅ xH2O.
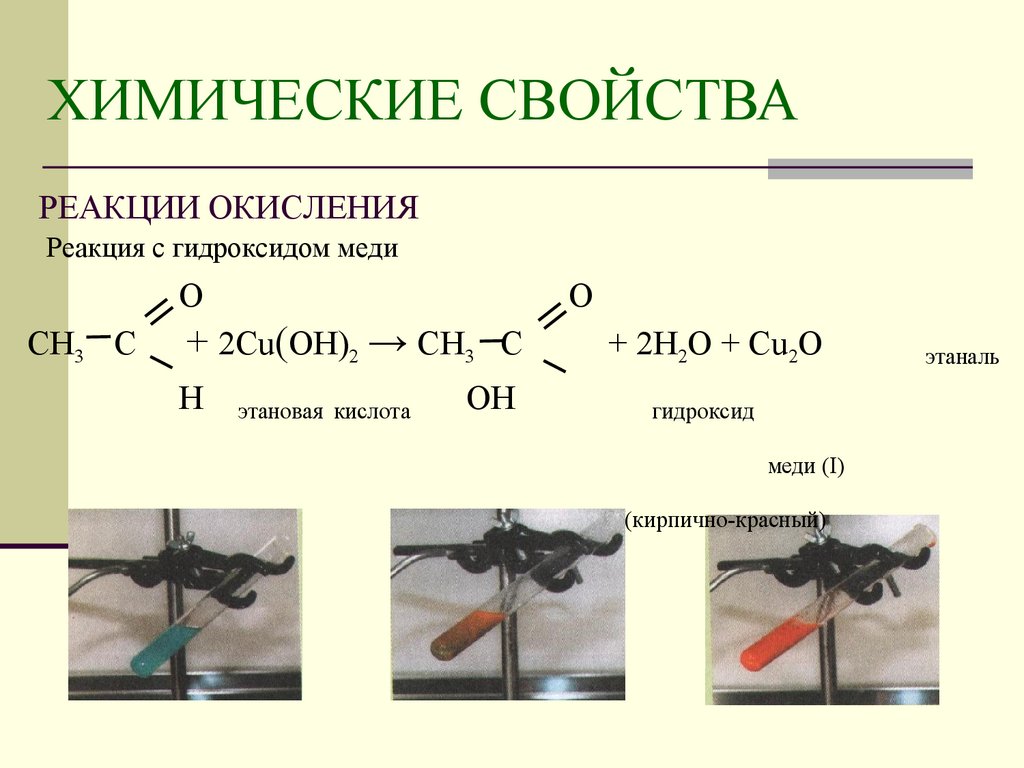
- Окисление альдегидов гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть , то сначала появляется жёлтый осадок гидроксида меди (I):
- R−CHO + 2Cu(OH)2 →t R−COOH + 2CuOH↓ + H2O
- при дальнейшем нагревании желтого осадка гидроксида меди (I) превращается в красный оксид меди (I):
- 2CuOH →tCu2O + H2O
Применение
Оксид меди (I) применяется как пигмент для окрашивания стекла, керамики, глазурей; как компонент красок, защищающих подводную часть судна от обрастания; в качестве фунгицида.
Обладает полупроводниковыми свойствами, используется в меднозакисных вентилях.
Токсичность
Оксид меди (I) — умеренно токсичное вещество: LD50 470 мг/кг (для крыс перорально). Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Очень токсично для водной среды: LC50 для Daphnia magna составляет 0,5 мг/л в течение 48 ч.
Медь. Химия меди и ее соединений — КиберПедия
Медь. Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
· Способы получения
· Химические свойства
Оксид меди (I)
· Химические свойства
Гидроксид меди (II)
· Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 1В группе (или в побочной подгруппе I группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д. И. Менделеева.
И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s 2p
3s 3p 4s 3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.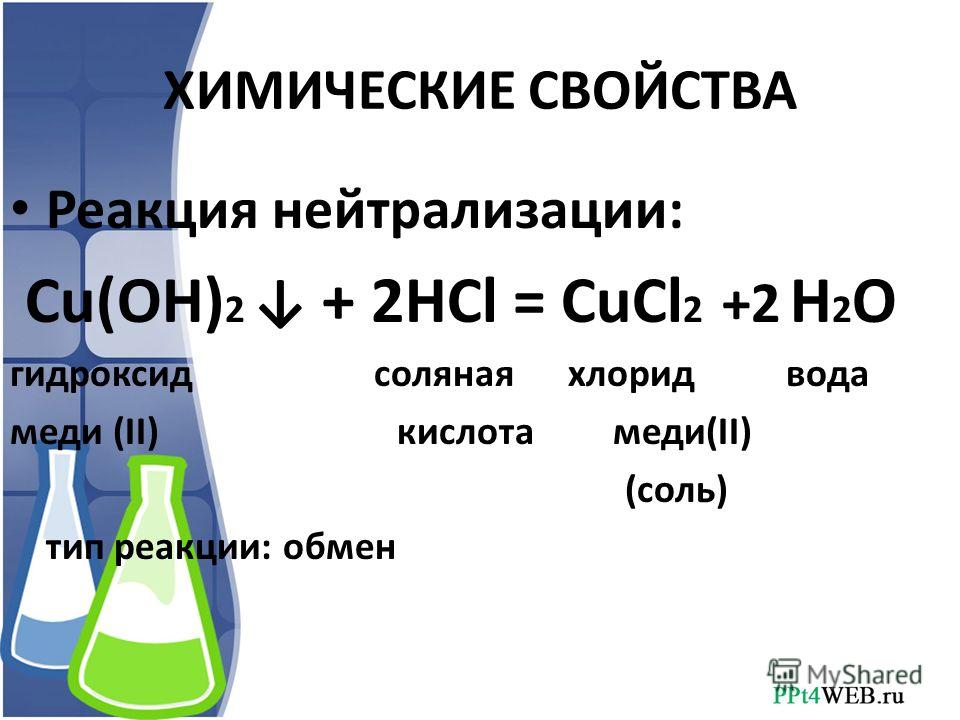
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
· Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
· Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
· Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1. 2. Медь реагирует с серой с образованием сульфида меди (II):
2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
С u + Br2 = CuBr2
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2. 5. Растворы щелочей на медь практически не действуют.
5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Гидроксид меди (II)
Химические свойства
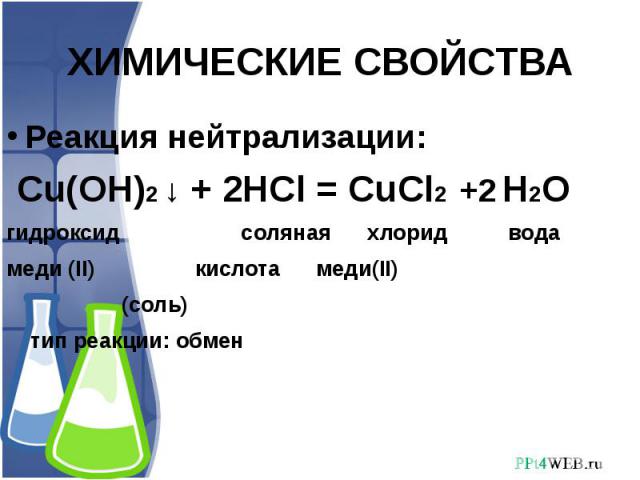
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
С u(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц. гор.) = 4CuSO4 + I2 + H2S + 4H2O
гор.) = 4CuSO4 + I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь. Химия меди и ее соединений
Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
· Способы получения
· Химические свойства
Оксид меди (I)
· Химические свойства
Гидроксид меди (II)
· Химические свойства
Соли меди
Медь
Гидроксид меди (II), характеристика, свойства и получение, химические реакции
Гидроксид меди (II) – неорганическое вещество, имеет химическую формулу Cu(OH)2.
Краткая характеристика гидроксида меди (II):
Гидроксид меди (II) – неорганическое кристаллическое или аморфное вещество ярко-голубого цвета.
Химическая формула гидроксида меди (II) Cu(OH)2.
Не растворяется в воде. Растворимость в воде 0,000673 г/100 мл.
Растворимость в воде 0,000673 г/100 мл.
Не горит. Термически неустойчивый. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается на оксид меди (II) и воду.
Гидроксид меди токсичен.
Физические свойства гидроксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | Cu(OH)2 |
| Синонимы и названия иностранном языке | сopper(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | ярко-голубые кристаллы либо ярко-голубая водная суспензия (аморфное состояние) |
| Цвет | ярко-голубой |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), г/см3 | 3,37 |
| Температура разложения, °C | 70 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 97,561 |
* Примечание:
— нет данных.
Получение гидроксида меди (II):
В лаборатории гидроксид меди (II) получается действием на холоде растворимых гидроксидов металлов на растворимые соли меди в результате следующих химических реакций:
- 1. в результате взаимодействия нитрата меди (II) с гидроксидом натрия:
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 2. в результате взаимодействия сульфата меди (II) и гидроксида калия:
2KOH + CuSO4 → Cu(OH)2 + K2SO4.
При этом гидроксид меди (II) выпадает в осадок.
- 3. в результате взаимодействия нитрата меди (II) с гидроксидом калия:
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 4. в результате взаимодействия сульфата меди (II) с гидроксидом кальция:
Ca(OH)2 + CuSO4 → Cu(OH)2 + CaSO4.
При этом гидроксид меди (II) выпадает в осадок.
- 5. в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
При этом гидроксид меди (II) выпадает в осадок.
Химические свойства гидроксида меди (II). Химические реакции гидроксида меди (II):
Гидроксид меди (II) – слабое основание. Проявляет амфотерные свойства.
Химические свойства гидроксида меди (II) аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида меди (II) с ортофосфорной кислотой:
Cu(OH)2 + H3PO4 → Cu3(PO4)2 + 6H2O.
В результате реакции образуются фосфат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида меди (II) с азотной кислотой:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O.
В результате реакции образуются нитрат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида меди (II) и с другими кислотами.
3. реакция гидроксида меди (II) и сероводорода:
Cu(OH)2 + H2S → CuS + 2H2O.
В результате реакции образуются сульфид меди (II) и вода. В ходе реакции используется суспензия гидроксида меди (II) и насыщенный раствор сероводорода.
4. реакция гидроксида меди (II) и оксида углерода:
2Cu(OH)2 + CO2 → Cu2(OH)2CO3 + H2O.
В результате реакции образуются карбонат-дигидроксид димеди (II) и вода.
5. реакция гидроксида меди (II) и оксида селена:
SeO2 + Cu(OH)2 → CuSeO3 + 2H2O (to).
В результате реакции образуются селенит меди (II) и вода. Реакция протекает при нагревании.
6. реакция гидроксида меди (II) и гидроксида натрия:
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4].
В результате реакции образуется тетрагидроксокупрат натрия.
7. реакция гидроксида меди (II), аммиака и воды:
Cu(OH)2 + 4NH3 + 2H2O → [Cu(NH3)4(H2O)2](OH)2.
В результате реакции образуется гидроксид диакватетрааммин меди (I).
8. реакция гидроксида меди (II) и гидрата аммиака:
Cu(OH)2 + 4(NH3•H2O) → [Cu(NH3)4](OH)2 + 4H2O.
В результате реакции образуются гидроксид тетрааммин меди (II) и вода. Гидрат аммиака используется в ходе реакции в виде концентрированного раствора.
Гидроксид тетрааммин меди (II) имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
9. реакция гидроксида меди (II) с кислородом:
4Cu(OH)2 + O2 ⇄ 4Cu2O3 + 2H2O.
При длительном нахождении на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III). В результате реакции образуется оксид меди (III) и вода.
4Cu(OH)2 + O2 → 4CuО(ОН) + H2O.
При избытке влаги может образоваться гидроксид куприла (III) и вода.
10. реакция термического разложения гидроксида меди (II):
Cu(OH)2 → CuO + H2O (t = 70-90 oC).
В результате реакции образуются оксид меди (II) и вода.
Применение и использование гидроксида меди (II):
Гидроксид меди (II) используется:
– как пигмент при производстве стекол, керамики, красок,
– как катализатор в химической промышленности.
Ссылка на источник
Читайте также
Формула хлорида меди(II) – структура, свойства, применение, примеры вопросов
Хлорид меди(II) является неорганическим соединением и встречается в природе в виде безводного минерала, называемого толбахитом, и обезвоженного эриохальцита. Оба минерала добываются из фумарол. Хлорид меди (II) также известен как дихлорид меди, хлорид меди или дихлорид меди. В безводном виде представляет собой желтовато-коричневый порошок. В дигидрате он выглядит как зеленое кристаллическое твердое вещество.
Оба минерала добываются из фумарол. Хлорид меди (II) также известен как дихлорид меди, хлорид меди или дихлорид меди. В безводном виде представляет собой желтовато-коричневый порошок. В дигидрате он выглядит как зеленое кристаллическое твердое вещество.
Формула хлорида меди(II)
Формула хлорида меди(II): CuCl 2 . Хлорид меди(II) состоит из одного атома меди и двух атомов хлора. Медь — ковкий, пластичный металл, который присутствует в 11-й группе периодической таблицы. Его атомный номер равен 29 и представлен символом Cu. Медь является очень хорошим проводником тепла и электричества. Он используется вместе с различными металлами, такими как золото и серебро, в ювелирных изделиях. Хлор токсичен, едкий газ присутствует в 17-й группе периодической таблицы. Это второй по легкости газ в семействе галогенов. Его атомный номер равен 17 и представлен символом Cl. При комнатной температуре он имеет зеленовато-желтый цвет.
Структура хлорида меди(II)
Структура хлорида меди(II)
Физические свойства хлорида меди(II)
- Молекулярная масса хлорида меди(II) составляет 134,45 г/моль.

- Температура плавления хлорида меди(II) составляет 498°C.
- Температура кипения хлорида меди(II) составляет 993°C.
- Плотность CuCl 2 составляет 3,386 г/см 3 .
Химические свойства хлорида меди(II)
- Хлорид меди(II) вызывает коррозию алюминия.
- Степень окисления хлорида меди(II) +2. Это слабый окислитель, который реагирует с алюминиевой фольгой с образованием водорода, оксида меди(I) и хлорида алюминия.
Использование хлорида меди(II)
- CuCl 2 используется в качестве консерванта древесины, фунгицида, инсектицида и гербицида.
- Используется в чернилах для маркировки белья.
- CuCl 2 используется в производстве сельскохозяйственной химии.
- Также используется для очистки воды.
- Действует как дезодорант (предотвращает неприятный запах) в нефтяной промышленности.
- Окислитель и очищающий агент.

- Дихлорид меди используется в качестве протравы при крашении и печатании текстиля.
- CuCl 2 используется в качестве катализатора в органических и неорганических реакциях. В производстве хлора CuCl 2 действует как катализатор из HCl.
Примеры вопросов
Вопрос 1: Как получают хлорид меди(II)?
Ответ:
Коммерчески Хлорид меди(II) получают хлорированием меди. Химическая реакция хлорирования меди задается формулой хлорида меди?
Ответ:
Заряд хлора в хлориде меди равен -1, и для того, чтобы соединение меди в хлориде меди было стабильным, оно должно иметь заряд +1. Таким образом, заряд меди в хлориде меди равен +1. Поэтому его называют хлоридом меди (I).
Вопрос 3: Найдите молекулярную массу хлорида меди(II)?
Решение:
Атомный вес 1 атома меди = 63,546
Атомный вес 1 атома хлора = 35,453
Молекулярная масса CuCl 2 = 63,546 + (2 × 35,453)
= 134,45
Молекулярная масса хлорида меди(II) составляет 134,45 г/моль.

Вопрос 4: Опасен ли дихлорид меди?
Ответ:
Дихлорид меди опасен для здоровья. Вдыхание CuCl 2 вызывает кашель. Глотание вызывает рвоту и боль. Когда жидкость, содержащая CuCl 2 , вступает в контакт с глазами или кожей, вызывает раздражение.
Вопрос 5: Почему дихлорид меди фиолетовый?
Ответ:
Когда электроны переходят с энергетического уровня t2 на энергетический уровень e, фотоны с длиной волны желтого света поглощаются, и гидратированный хлорид меди приобретает фиолетовый цвет.
Вопрос 6: Хлорид меди(II) используется при приготовлении крекеров?
Ответ:
Да, хлорид меди(II) используется при приготовлении крекеров/фейерверков. Фейерверки, содержащие CuCl 2 придает небу сине-зеленый оттенок и делает небо красочным.
Вопрос 7: Хлорид меди(II) твердый?
Ответ:
Да, хлорид меди(II) твердый. В безводной форме CuCl 2 имеет желтовато-коричневый цвет. Постепенно он поглощает влагу, образуя зелено-голубой дигидрат.
3.5: Различия в веществах: физические и химические свойства
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 182627
Цели обучения
Отделить физические свойства от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом).
Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Таблица \(\PageIndex{1}\): плотности обычных веществ Вещество Плотность при 25°C (г/см3) кровь 1. 035
жировые отложения 0,918 цельное молоко 1,030 кукурузное масло 0,922 майонез 0,910 мед 1,420 Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Рисунок \(\PageIndex{1}\): карандаш (слева) и кольцо с бриллиантом (справа). Оба являются формой углерода, но обладают очень разными физическими свойствами.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывают его способность подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Присутствующие элементы, электроны и связи придают материи потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство.
Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Рисунок \(\PageIndex{2}\): Сильная ржавчина на звеньях цепи возле моста Золотые Ворота в Сан-Франциско; он постоянно подвергался воздействию влаги и солевых брызг, что приводило к разрушению поверхности, растрескиванию и отслаиванию металла. (CC BY-SA 3.0; Marlith).
Химическим свойством железа является его способность соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
Таблица \(\PageIndex{2}\): контрастные физические и химические свойства Физические свойства Химические свойства Металлический галлий плавится при 30 o C. Железный металл ржавеет. Ртуть — очень плотная жидкость. Зеленый банан при созревании становится желтым. Золото блестит. Горит сухой лист бумаги. Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе.
- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
Раствор
«Железо разъедает во влажном воздухе» — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответить
- в
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответить
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- № на стр.
- Включено
- да
- Метки
- химическое свойство
- физическое имущество
- источник-хим-47458
Что происходит, когда медную проволоку помещают в нитрат серебра?
4 апреля 2018 г.
Джессика Клифтон
Джессика Клифтон2020-04-23T13:00:02+01:00
Один из самых увлекательных химических экспериментов — это реакция между нитратом серебра и медной проволокой в воде. Этот эксперимент, характеризующийся фракталоподобными осадками, является ошеломляющим примером простой окислительно-восстановительной реакции.

Когда вы помещаете медную проволоку в раствор нитрата серебра и воды, начинают появляться кристаллы. Они растут на меди и образуют кристаллическую структуру. Но прежде чем мы перейдем к почему это происходит, мы должны сначала взглянуть на задействованные компоненты.
В этом сообщении:
Что такое нитрат серебра?
Нитрат серебра представляет собой едкое химическое соединение с формулой AgNO 3 . Интересно, что ранее он был известен как лунный каустик древними алхимиками, которые связывали серебро с Луной.
Нитрат серебра хорошо растворим в воде и других растворителях. Он также менее чувствителен к свету, чем его родственники из галогенида серебра, и производится путем растворения большого количества серебра в азотной кислоте.
Несмотря на то, что нитрат серебра ядовит при проглатывании, он имеет множество применений в медицине, где используется благодаря своим антисептическим свойствам.
Нитрат серебра также используется в качестве предшественника в большинстве соединений серебра, в том числе используемых в фотографии.
Что такое медь?
Медь (Cu) — один из немногих металлов, который не требует извлечения из руды. Это потому, что его естественная форма пригодна для непосредственного использования.
Медь имеет слабые металлические связи, поэтому это один из самых пластичных металлов. Хотя медь известна своим красноватым цветом, она также известна своим зеленым пигментом — вспомните, например, Статую Свободы.
Этот зеленый слой на самом деле представляет собой защитное покрытие, известное как патина. Он образуется, когда медь подвергается воздействию воздуха в течение длительного периода времени, и обеспечивает защиту от дальнейшей коррозии.
Когда медную проволоку оставляют в водном растворе нитрата серебра, вдоль проволоки начинают скапливаться осадки серебра. Они выглядят как кристаллические фракталы, и позже их можно удалить, высушить и собрать.
Реакция
Когда медную проволоку вводят в водный раствор нитрата серебра, происходит одна реакция замещения. Это когда два элемента в реакции меняются местами, один заменяет другой. Это разновидность окислительно-восстановительной реакции.
В начале эксперимента чистая элементарная форма меди (Cu) окисляется раствором нитрата серебра. Это означает, что он теряет электроны и образует ионы меди. Эти ионы заменяют ионы серебра, присутствующие в водном растворе нитрата серебра, с образованием нового соединения: нитрата меди.
Между тем с нитратом серебра происходит обратный процесс. Вместо того, чтобы терять электроны, ионы серебра в растворе нитрата приобретают электроны по мере восстановления. Это превращает их в их элементарную форму (Ag), которая заменяет элементарную медь. Эта реакция также известна как окислительно-восстановительная реакция, и мы можем выразить ее следующим образом:
Металлическая медь (Cu) + нитрат серебра (AgNO 3 ) = металлическое серебро (Ag) + нитрат меди (CuNO 3 )
Результат
По мере того, как нитрат серебра превращается в его элементарную форму, отложения серебра покрывают поверхность медной проволоки, где они продолжают накапливаться с течением времени.
Это формирует привлекательную кристаллическую структуру вокруг провода.
Иногда кристаллоподобные осадки позже отделяют от меди и используют в фрактальных произведениях искусства.
Раствор в конце эксперимента имеет характерный синий цвет. Это происходит из-за присутствия нитрата меди, который кажется синим из-за его способности поглощать белый свет, проходящий через раствор. Это происходит с большинством переходных металлов.
Посмотрите видео ниже, демонстрирующее, как происходит эта реакция:
На полках ReAgent представлен широкий ассортимент нитрата серебра. От 0,01M раствора до твердого нитрата серебра, все наши химикаты имеют 100% гарантию качества. Посетите наш интернет-магазин, чтобы найти химикат, который подходит именно вам, или свяжитесь с нами сегодня для получения дополнительной информации.





 Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
 035
035
 Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.

 Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
 Нитрат серебра также используется в качестве предшественника в большинстве соединений серебра, в том числе используемых в фотографии.
Нитрат серебра также используется в качестве предшественника в большинстве соединений серебра, в том числе используемых в фотографии.
 Это формирует привлекательную кристаллическую структуру вокруг провода.
Это формирует привлекательную кристаллическую структуру вокруг провода.