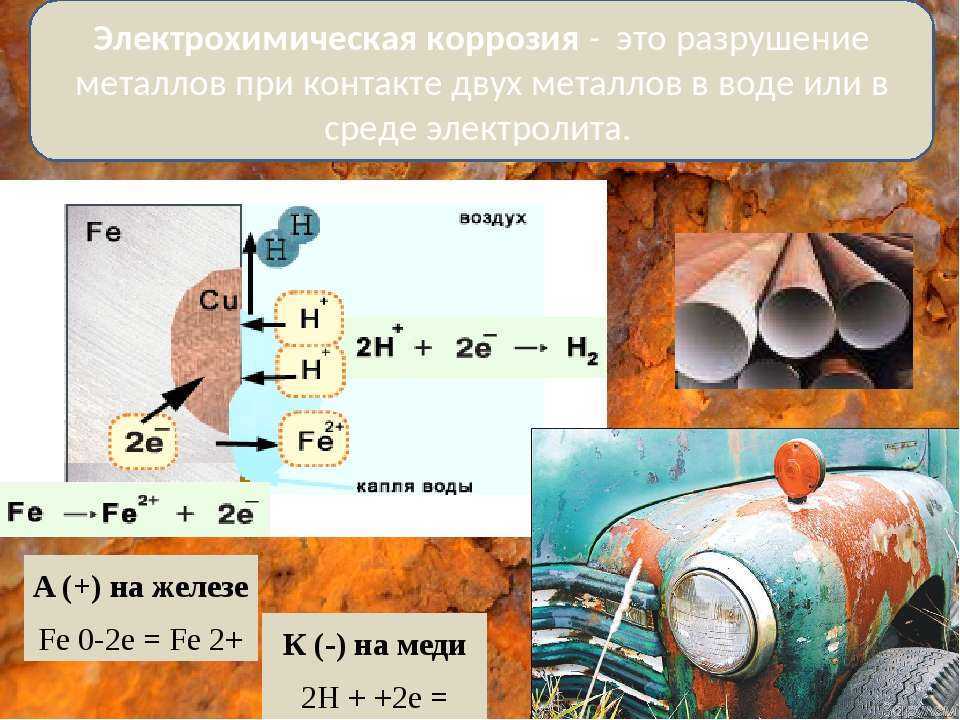
Химическая и электрохимическая коррозия: Химическая коррозия
Содержание
Химическая коррозия — основные виды, факторы формирования, стадии протекания
Химическая коррозия металлов – это опасное явление, способное привести к их полному разрушению. Процесс напрямую связан со способностью материала вступать во взаимодействие со средой, представляющей повышенную химическую опасность.
Среди важных свойств протекания химической коррозии металла – параллельный процесс окисления и восстановления. Ученые не отмечают прямой связи с электрическим током, который потенциально может образовываться или воздействовать на участвующие в реакции материалы.
Если рассматривать первопричину распространения такого процесса, то мы быстро придем к выводу – она кроется в термической нестабильности металлов разных типов.
Они склонные под воздействием окислительных компонентов среды быстро переходить в устойчивое состояние и зачастую это происходит полностью непроизвольно.
Процесс окисления и восстановления при протекании химической коррозии происходит на фоне уменьшения потенциала системы. При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
Ученые определяют основным критерием, который стимулирует самопроизвольный процесс, такой показатель, как изобарно-изотермический потенциал G.
Когда реакция начинает протекать произвольно, он значительно убывает. При этом скорость уменьшения может меняться в зависимости от типа материалов, условий коррозионной среды и ряда других ключевых параметров.
Основные виды химической коррозии
Ученые выделяют два основных типа химической коррозии. Газовая протекает при контакте поверхности металла с газами. Она усиливается по мере изменения температуры среды.
Также химическая коррозия способна активно протекать в жидкостях-электролитах, если для этого формируются необходимые внешние условия.
Рассмотрим особенности обоих описанных процессов более подробно, чтобы понять, как можно создать дополнительную защиту от них.
Газовая коррозия металлов
Научная статистика показывает, что газовая коррозия металлов протекает наиболее часто. При рассмотрении химической порчи она значительно более распространена, чем жидкостное ржавение при контакте с электролитами.
Важный фактор здесь – высокая температура. Если металл сильно нагрет и на него начинает воздействовать газ, происходит разрушение.
Так как уровень температур должен быть достаточно высок, а при обычном использовании создать условия для протекания такой химической коррозии довольно сложно, процесс часто наблюдается в металлургии.
Из-за этого страдает оборудование, используемое при штамповке, ковке, горячей прокатке и других процессах. Без дополнительной защиты длительность использования подобной техники станет значительно меньше.
Опасность представляет и контакт металла с кислородом. Формула реакции, которая запускается в таком случае, выглядит следующим образом: Ме + 1/2О2 – МеО.
Эта реакция имеет четкое окислительное направление, потому напрямую связана с показателями парциального кислородного давления. Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Очень важно понимать, с какой газовой смесью контактирует металл в той области, где вы его используете. Хорошее понимание парциального давления кислорода в смеси даст нам температурный интервал.
Именно в нем будет запускаться окислительный процесс, приводящий к разрушению материала или значительному ухудшению уровня его качества.
Факторы скорости протекания газовой химической коррозии
По мере исследования особенностей процесса протекания химической коррозии, ученые смогли определить важные факторы, которые влияют на ее скорость и другие особенности. К ним относятся такие, как:
- Температура среды, в которую погружен металл.
- Состав сплава и другие особенности металла.
- Особенности газовой среды, ее состав, преобладающие элементы.
- Длительность контактирования материала с коррозийной средой.

- Появляющийся продукт коррозии.
Как и в случае с другими типами коррозийных поражений, большое значение имеет тип и особенности создающейся на поверхности оксидной пленки.
Особенности формирования оксидных пленок при газовой коррозии
Весь процесс формирования оксидной пленки на поверхности металла можно разделить на две крупные стадии:
Абсорбирование молекул кислорода на поверхности металлического изделия
Это происходит на тех участках, которые находятся в непосредственном контакте с атмосферой. Заметно появление ионной связи – атом кислорода забирает у металла по два электрода.
Можно предположить, что формирование очень сильной и стабильной связи при протекании такой реакции связано с попаданием кислорода в особое поле атомов металла.
Когда поверхность материала будет полностью наполнена окислителем, окажется сформирована мономолекулярная пленка. Она имеет склонность к утолщению со временем. Это уменьшает дальнейший контакт с кислородом, но сам опасный коррозийный процесс уже оказывается запущен.
Формирование химического соединения
Это явление характерно для ситуации, в которой происходит активное взаимодействие металла и газа. Из-за воздействия окислительных компонентов сплав начинает активно терять валентные электроны. Стремительно формируются и накапливаются продукты коррозии.
Дальнейшее протекание процесса будет во многом характеризоваться особенностями оксидной пленки. Так если она отличается повышенным уровнем защиты, сам коррозийный процесс будет замедляться.
Виды оксидных пленок
Когда химическая коррозия происходит под действием температуры и газовой среды, могут сформироваться три вида пленок:
- Тонкие. Со стороны заметить их будет невозможно. Они одни из самых не прочных, могут легко стираться под действием механического давления.
- Средние. Могут быть замечены, потому что со стороны металл слегка меняет цвет.
- Толстые. Хорошо заметны невооруженным глазом.
Чтобы не допустить протекание опасных процессов разрушения материала, важно сделать пленку защитной.
Факторы формирования защитной пленки
Оксидная пленка способна оказывать выраженное защитное воздействие на материал. Но для этого требуется, чтобы она соответствовала нескольким важным требованиям:
- Сплошность. На поверхности пленка распределяется ровным слоем, без пор и участков, которые не затронуты ею.
- Хорошее сцепление с поверхностью материала. Это требуется для удержания подобного защитного барьера на месте и исключения ухудшения его свойств.
- Химическая инертность. Пленка будет защищать металл только в том случае, если она вступает в химические реакции с окружающей средой. В противном случае, есть большая опасность, что весь защитный эффект окажется сведен к нулю.
Так как материал будет использоваться на протяжении длительного времени и сложно предсказать, что станет воздействовать на него, большое значение имеет стойкость к износу и повышенный уровень твердости.
Не менее важен и тот факт, чтобы пленка не была пористой и рыхлой. Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
При изучении различных свойств оксидных пленок, ученые особенно пристально рассматривают сплошность. Отмечается, что на нее влияет молекулярный объем. Его показатели должны быть выше атомного объема металла.
Сплошность не ставится на первое место при определении защитных свойств оксидной пленки только для небольшой группы металлов. В их числе щелочно-земельные и щелочные.
При проведении работ по защите от химической коррозии, большое внимание уделяется методу замера толщины. Анализ характеристик происходит на разных стадиях формирования. Большое значение имеют получаемые показатели скорости окисления металла и характер протекания подобного процесса.
Когда окислы оказываются сформированными, специалисты рекомендуют проверить, какую пленку они создали на поверхности, обладает ли она нужными защитными свойствами.
Химическая коррозия в жидкостях-неэлектролитах
Хотя газовая коррозия считается наиболее распространенной, порчу металла при контакте с различными жидкостями-электролитами также не стоит сбрасывать со счетов. Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Их делят на две крупные группы – органические и неорганические. Электролитов, представляющих большую опасность для металла, много – от расплавленной серы и бензола до жидкого брома, спирта, керосина, нефти и других.
Большое значение при протекании химической реакции играет чистота электролита. Когда он полностью чист, взаимодействия не наблюдается. Но стоит только попасть в состав небольшому количеству примесей, реакция начинает развиваться особенно стремительно.
Еще один дополнительный фактор риска – присутствие влаги. Тогда к опасности химической коррозии также прибавляется и угроза электрохимической.
Стадии протекания коррозии в жидкостях-неэлектролитах
Если рассматривать весь процесс более подробно и анализировать, что влияет на скорость химической коррозии, можно выделить несколько стадий ее протекания:
- Контакт окислителя с поверхностью материала.

- Запуск процесса хемосорбции реагента на поверхности.
- Протекание реакции металла и окислителя, формирование оксидной пленки.
Условия среды, состав сплава и самого электролита могут повлиять на протекание нескольких основных процессов. К ним относятся такие, как десорбция оксидов с металлом и диффузия оксидов в неэлектролит. Но оба процесса также могут и не наблюдаться.
Чтобы не допустить запуска коррозии в жидкостях-электролитах, стоит позаботиться о нанесении на поверхность специальных защитных составов. Важно, чтобы на протяжении всего времени использования изделия они полностью сохраняли свою целостность.
Факторы протекания химической коррозии
Большое значение при рассмотрении процесса химической коррозии металлов имеет определение факторов, оказывающих на нее влияние. К ним относятся такие, как:
Температура
Все окислительные процессы протекают быстрее, если температура сильно увеличивается.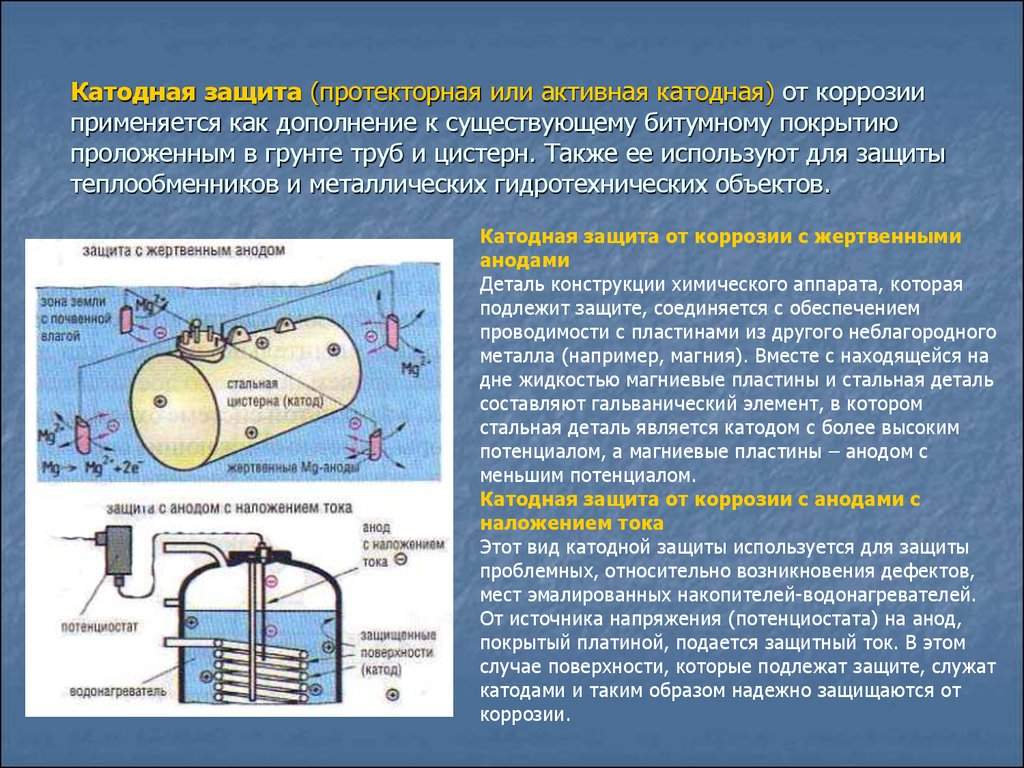
Температурный режим
В особой группе риска оказываются металлические изделия, которые на протяжении определенного времени начинают охлаждаться и нагреваться попеременно. В таком случае сильно страдает защитная пленка. Она начинает трескаться, в местах, где это происходит, металл контактирует со средой, запускается повторное окисление. Новая пленка также формируется на фоне постепенного отслоения старой.
Состав среды
Это относится как к газам, так и к электролитам в жидком виде. Как уже было отмечено выше, даже небольшие загрязнения жидкости могут привести к тому, что скорость коррозийного повреждения станет значительно выше.
Состав сплава
В сплав металла добавляют различные компоненты, которые могут, как затормозить, так и ускорить окисление. К примеру, сильными замедлителями признаны такие добавки, как титан, медь и кобальт. Хорошо влияют на уменьшение скорости протекания процесса хром и алюминий.
Тип обработки поверхности
Ученые во время исследований показали, что гладкая поверхность отличается заметно более высокой устойчивостью к окислению, процесс протекает медленнее. Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Структура материала
Уравнение химической коррозии показывает, что значительное замедление коррозийного процесса характерно для металлов с аустенитной структурой.
Подведем итоги
В этой статье мы рассмотрели виды химической коррозии и то, чем она отличается от электрохимической. При условии соблюдения ряда требований, удается заметно уменьшить риск разрушения металла. К ним относятся такие, как:
- Контроль формирования защитной оксидной пленки.
- Исключение контакта определенных материалов с агрессивными средами.
- Использование дополнительных защитных покрытий.
- Отслеживание состава газовой смеси или электролита.
- Применение металлов с компонентами сплава, замедляющими реакцию.
Соблюдение перечисленных требований позволит значительно увеличить длительность использования вашего металлического изделия.
Вернуться к статьям
Поделиться статьей
|
Навигация: Химическая и электрохимическая коррозия Химическая и электрохимическая коррозия
Коррозия считается электрохимической, если при выходе из металлической решетки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды. Окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединить валентные электроны металла, не удерживая около себя катионы. При электрохимической коррозии удаление атома из металлической решетки (что составляет сущность любого коррозионного процесса) осуществляется в результате двух независимых, но сопряженных, связанных между собой электрическим балансом, электрохимических процессов: анодного (переход сольватируемых катионов металла в раствор) и катодного (связывание окислителем освобождающихся электронов). Следовательно, процесс электрохимической коррозии можно замедлить не только путем торможения анодного процесса, но и воздействия на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов и восстановление растворенного кислорода. Их ча-cjo называют соответственно водородной и кислородной деполяризацией. Анодный и катодный процессы с определенной вероятностью и в той или иной последовательности протекают в любых точках металлической поверхности, где катионы и электроны могут взаимодействовать с компонентами коррозионной среды. Если поверхность однородна, то катодные и анодные процессы равновероятны по всей ее площади. В таком идеальном случае коррозия называется гомогенно-електрохимичеекой, отмечая, таким образом, отсутствие какой-либо неоднородности в распределении вероятности электрохимических процессов в любой точке поверхности, что не исключает термодинамической гетерогенности взаимодействующих фаз. В действительности на, металлических поверхностях существуют участки с различными условиями доставки реагирующих компонентов, с разным энергетическим состоянием атомов или с различными примесями. Проводимость металла очень высока, и при возникновении избыточного заряда электроны практически мгновенно перераспределяются, так что плотность заряда и электрический потенциал металла меняются одновременно по всей его поверхности независимо от того, в каких ее точках электроны освободились после ухода катионов, а в каких захватываются окислителем. В частности это означает, что от мест, где преимущественно протекает анодная реакция, электроны перемещаются в металле к местам протекания катодной. Соответственно раствор вблизи анодных участков получает избыточный положительный заряд растворившихся катионов, а вблизи катодных заряжается отрицательно в результате захвата электронов растворенным окислителем. В растворе эти заряды не перераспределяются так легко, как в металле. Поэтому с повышением скорости процесса потенциал раствора, находящегося в непосредственной близости от анодных участков, становится все более положительным, что затрудняет катодный процесс. Когда такое падение напряжения велико, коррозионную систему удобнее представить в виде системы короткозамкнутых микро-или макрогальванических элементов. В остальных случаях при определении средней по площади- скорости растворения металла современная теория, наряду с вышеизложенной моделью, позволяет также представлять электрохимически гетерогенную поверхность как квазигомогенную. Тогда ей приписывают удельные анодные и катодные характеристики, равные интегрально усредненным ‘по площади значениям одноименных характеристик моделируемой на основе теории подобия гетерогенной поверхности. Графически их изображают на коррозионной диаграмме в виде анодных и катодных поляризационных кривых, которые отображают влияние электродного потенциала на усредненные по площади и выраженные в единицах плотности тока скорости выхода катионов и электронов с данной поверхности в данный электролит. Похожие статьи: Навигация:
Главная → Справочник → Статьи → Блог → Форум
|
|
|
Коррозия металлов. Химическая и электрохимическая коррозия. Защита от коррозии
Химия \
Химия
Страницы работы
5
страниц
(Word-файл)
Посмотреть все страницы
Скачать файл
Содержание работы
Коррозия металлов
Коррозия
– это активное разрушение металлов и сплавов под влиянием окружающей среды. Самопроизвольный
Самопроизвольный
окислительно-восстановительный процесс. Представляет собой окисление металла
при контакте с водой и под воздействием растворённого в ней кислорода (кислородная
коррозия).
Наносит
большой экономический ущерб (выход из строя оборудования, машин, механизмов,
разрушение металлических конструкций, аппаратуры химической промышленности,
контактирующей с агрессивными химическими средами).
Коррозия
Ø
В зависимости от локализации:
o
Сплошная = общая – затрагивает всю поверхность металла
o
Местная = локальная – в отдельных участках
Ø
В зависимости от механизма процесса:
o
Химическая
o
Электрохимическая
Химическая коррозия
Это окисление
металлов без возникновения гальванической пары (например, в аппаратах
химической промышленности или в цилиндрах двигателей внутреннего сгорания). Электрический
ток в системе не возникает. Металлы взаимодействуют с составными частями среды
– газами, растворами неэлектролитов.
Газовая
коррозия – окисление металлов компонентами газовой среды. Наиболее
опасны О2, пары Н2О, СО2, SO2.
Скорость окисления значительно возрастает при высоких температурах (выше 600оС).
Коррозионное
разрушение железа и его сплавов в атмосфере кислорода
На
поверхности железа появляется слой окалины Fe3O4 – смесь оксидов железа (2) и железа (3).
2Fe + O2 = 2FeO
Fe –2e— = Fe2+
| 2
O2 + 4e— = 2O-2
| 1
4Fe + 3O2 = 2Fe2O3
Fe – 3e— = Fe3+ | 4
O2 + 4e-
= 2O-2 | 3
Рыхлая плёнка
оксидов не защищает железо от дальнейшего разрушения. Поэтому при длительной
работе аппарата в условиях высоких температур и в присутствии кислорода железо
полностью окисляется, и аппарат разрушается.
Коррозия
в среде неэлектролитов (в двигателях внутреннего сгорания и в
реактивных двигателях). Примеси серы и её соединений, содержащиеся в топливе,
окисляются до оксида серы (4) и оксида серы (6). Эти вещества вызывают
разрушение металла.
Электрохимическая коррозия
Это разрушение
металла при контакте с раствором электролита с возникновением гальванической
пары. Происходит не только окисление металла, но и возникновение
электрического тока в системе «металл – окружающая среда». Наносит
наибольший вред (разрушение металла).
Разновидности
электрохимической коррозии:
Ø
Атмосферная – протекает на поверхности металла под
действием сконденсированной влаги. Эта влага растворяет примеси из воздуха
(оксиды азота, диоксид серы, хлороводород и др.), которые ускоряют коррозию.
Ø
Почвенная – протекает при контакте металлов с
грунтовыми водами (трубопроводы, кабели, рельсы)
Ø
Морская – протекает при контакте металлов с морской
водой (обшивка судов, оборудование, применяемое в портах)
Электрохимическую
коррозию вызывают:
v
Примеси других металлов и неметаллов. Чем дальше друг от друга в
Чем дальше друг от друга в
ряду напряжений расположены металлы, образующие гальваническую пару, тем выше
скорость коррозии.
v
Неоднородность поверхности металла, на которой образуется
микрогальванический элемент (электролитом является влага).
При
электрохимической коррозии на металле протекают одновременно 2 процесса:
Ø
Анодный – окисление металла М, который в результате
растворяется:
М – ze—
= Mz+
Ø Катодный –
восстановление окислителей – компонентов среды Ох:
Ох + ze— = Red
В качестве
окислителя в водных растворах в кислой среде выступают Н+ (а)
или растворенный в воде кислород воздуха (б).
а) 2Н+
+ 2е- = Н2
б) О2
+ 2Н2О + 4е— = 4ОН—
Металлы,
имеющие положительный стандартный электродный потенциал, подвергаются коррозии
только с участием О2 в средах любой кислотности.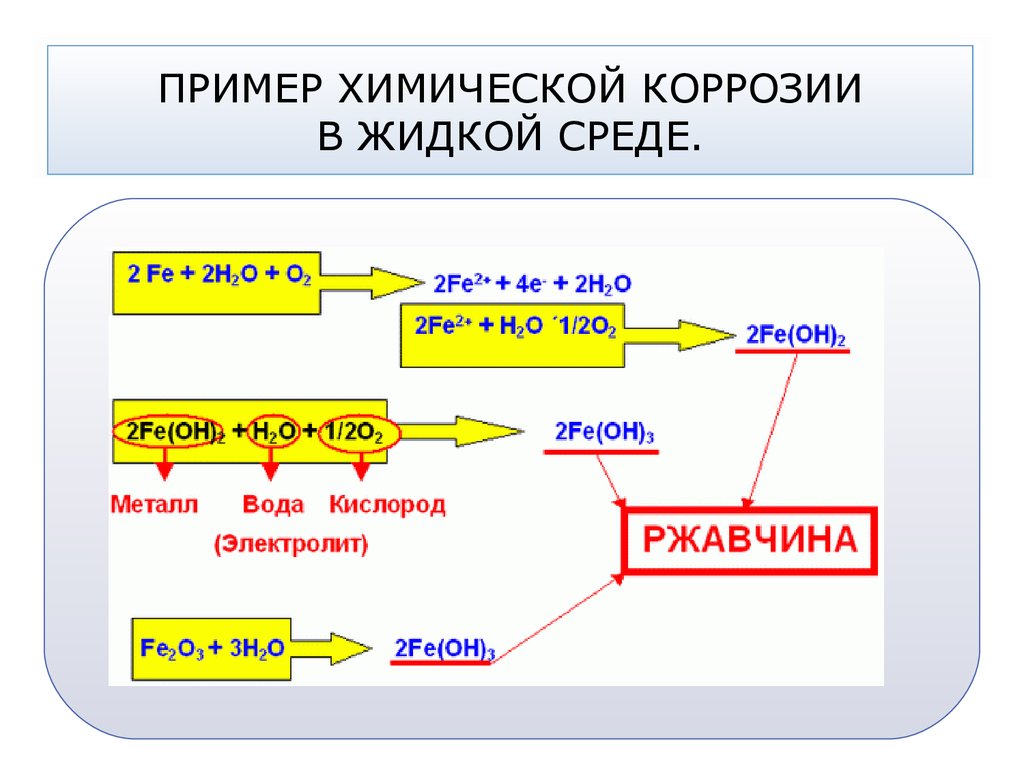 Например, коррозия
Например, коррозия
меди:
Cu – 2e—
= Cu2+ | 2
О2 + 2Н2О + 4е— = 4ОН— | 1
2Cu + O2 + 2H2O = 2Cu(OH)2
Контактная
коррозия происходит в месте контакта 2 разнородных металлов, помещённых
в раствор.
Между двумя
разнородными металлами в месте контакта возникает гальваническая пара. Поток
электронов идёт от более активного металла, стоящего левее в ряду напряжений, к
менее активному металлу, и более активный металл разрушается
(корродирует). Менее активный металл является проводником.
Ø
Химический процесс – окисление более активного металла (Me – ze— = Mez+)
Ø
Электрический процесс – перенос электронов от одного
участка к другому: от более активного металла – анода (донора
электронов) к менее активному – катоду (акцептору
электронов). (При электролизе – наоборот!)
(При электролизе – наоборот!)
Если
железо, из которого изготовлена деталь, содержит примесь менее активного
металла (например, меди), то ионы железа, выходя в раствор, передают электроны
менее активной меди. В дальнейшем возможны 2 пути развития процесса.
1) При
коррозии железных изделий в нейтральной или щелочной среде
железо (анод) окисляется до Fe2+:
Fe0 – 2e— = Fe2+
Кислород,
растворённый в электролите, при этом восстанавливается на меди до ионов ОН—
(кислородная деполяризация катода):
О20 + 2Н2О + 4е— = 4ОН—
(рН > 7)
Далее в
растворе между ними протекают химические реакции, приводящие к образованию
твёрдых рыхлых гидроксидов и оксидов железа (ржавчина), и железо рассыпается в
порошок.
Fe2+ + 2OH— = Fe(OH)2
(2Fe + O2 + 2H2O = 2Fe(OH)2)
4Fe(OH)2 + O2 + 2H2O
= 4Fe(OH)3 (2Fe2O3 . 6H2O)
6H2O)
Постепенно
образуется ржавчина, имеющая переменный состав: Fe2O3 . nH2O
2)
Аналогично протекает коррозия железа в кислотной среде,
например, в воде, содержащей растворённые газы СО2 и SO2 (водородная коррозия):
Fe0 – 2e—
= Fe2+; ионы выходят в раствор,
электроны перемещаются к менее активному металлу
2H+ + 2e— = H20
(pH < 7) — разряжаются на менее активном
металле (водородная деполяризация катода)
Похожие материалы
Информация о работе
Скачать файл
Коррозия металлов | Статья в журнале «Молодой ученый»
Библиографическое описание:
Чепкасова, О. А. Коррозия металлов / О. А. Чепкасова, А. А. Селезнева, А. И. Садилов, С. В. Хмелев. — Текст : непосредственный // Молодой ученый. — 2015. — № 23 (103). — С. 260-261. — URL: https://moluch.ru/archive/103/23845/ (дата обращения: 02.10.2022).
А. Чепкасова, А. А. Селезнева, А. И. Садилов, С. В. Хмелев. — Текст : непосредственный // Молодой ученый. — 2015. — № 23 (103). — С. 260-261. — URL: https://moluch.ru/archive/103/23845/ (дата обращения: 02.10.2022).
В статье рассмотрены основные вопросы процесса коррозионного повреждения металла, виды коррозии и коррозионных разрушений, способы защиты от коррозии.
Ключевые слова: остаточный ресурс, коррозия металлов, защита от коррозии.
Основным критерием оценки остаточного ресурса технического устройства (далее ТУ) являются прочностные характеристики, определяемые расчётами. Расчёт прочностных характеристик зависит от марки материала, геометрических параметров, толщины элементов ТУ. При проектировании ТУ учитываются все эти параметры с учётом допусков, проектной скорости коррозии, сроков и условий эксплуатации.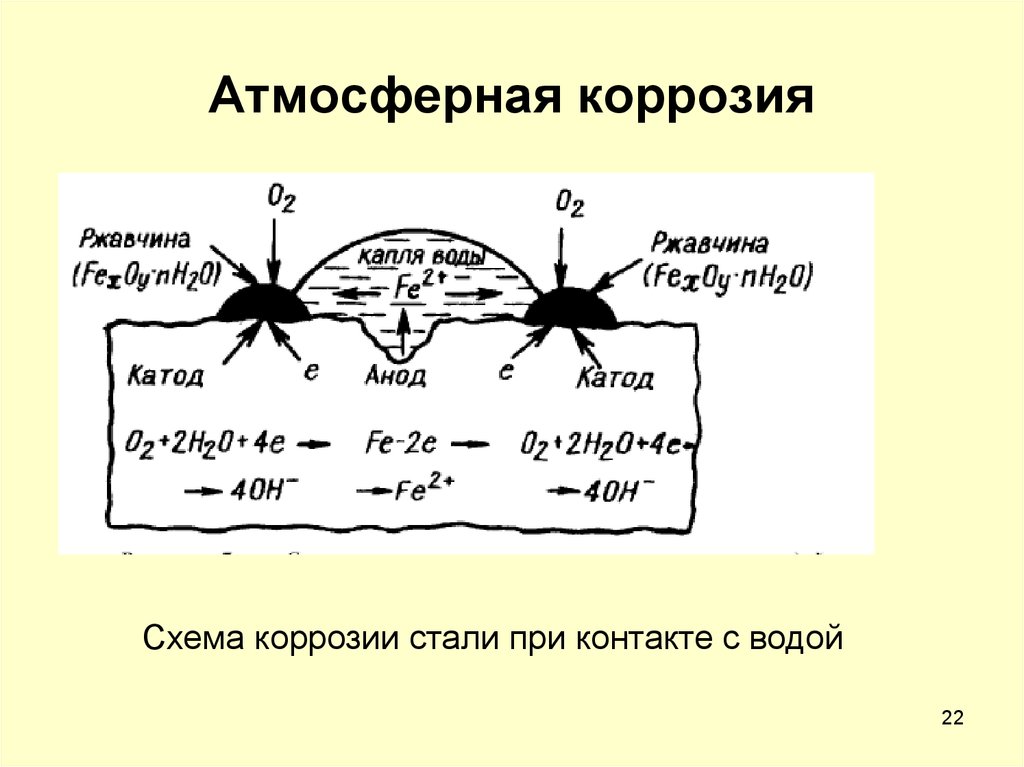 Однако в процессе эксплуатации ключевым фактором, влияющим на пригодность ТУ является коррозионное повреждение металла, скорость которого может отличаться от проектной в несколько раз. Для определения прогнозируемых сроков эксплуатации ТУ необходима оценка скорости коррозии в конкретных условиях эксплуатации, а так же возможность влиять на неё с целью увеличения этих сроков. Для решения этих вопросов необходимо понимание самих процессов протекания коррозии, природы и сути процесса.
Однако в процессе эксплуатации ключевым фактором, влияющим на пригодность ТУ является коррозионное повреждение металла, скорость которого может отличаться от проектной в несколько раз. Для определения прогнозируемых сроков эксплуатации ТУ необходима оценка скорости коррозии в конкретных условиях эксплуатации, а так же возможность влиять на неё с целью увеличения этих сроков. Для решения этих вопросов необходимо понимание самих процессов протекания коррозии, природы и сути процесса.
Коррозия — это разрушение металла под действием окружающей среды. По механизму протекания различают два типа коррозии — химическую и электрохимическую. Химическая коррозия начинает влиять на металл сначала его происхождения. Окалина ее продукт. Взаимодействие металла и окружающей среды протекает постоянно, химические процессы, проходящие при этом взаимодействии можно назвать борьбой за выживание, наша задача свести потери металла в этой борьбе к минимуму.
По характеру агрессивной среды различают атмосферную коррозию, подземную и подводную.
Виды коррозионных разрушений разнообразны — равномерная коррозия, неравномерная, коррозия пятнами, коррозия язвами, подповерхностная коррозия, точечная или питтинговая, структурно-избирательная коррозия, межкристаллитная коррозия (этот самый опасный вид коррозии, обусловленный сложностью выявления). Последствия скрытно протекающих коррозионных процессов зачастую приводят к авариям, которых могло бы и не быть.
Химическая коррозия — это процесс разрушения металла под действием внешней среды, не сопровождаемая образованием электрического тока. Ее разновидность газовая коррозия, представляет собой процесс взаимодействия газов при высокой температуре с металлом. При таком взаимодействии образуется оксидная пленка, на железе она рыхлая, легко отскакивает и не защищает от разрушения.
В отличии от химической — электрохимическая коррозия протекает при контакте металла с раствором электролита. При этом электролитом может являться любая жидкость или газ. Примером электрохимической коррозии может быть атмосферная коррозия. Электрохимическая коррозия, более трудно прогнозируемая, чем химическая, ввиду необходимости учёта множества факторов, зачастую изменяющихся в процессе эксплуатации ТУ. При этом скорость протекания процессов электрохимической коррозии на порядок больше чем при химической коррозии.
Примером электрохимической коррозии может быть атмосферная коррозия. Электрохимическая коррозия, более трудно прогнозируемая, чем химическая, ввиду необходимости учёта множества факторов, зачастую изменяющихся в процессе эксплуатации ТУ. При этом скорость протекания процессов электрохимической коррозии на порядок больше чем при химической коррозии.
В одних случаях на поверхности металла может образоваться плотная оксидная пленка, выполняющая роль защитного слоя. Образовавшаяся оксидная пленка предохраняет металл от разрушения. Это явление широко используется в современной технике, как способ защиты от коррозионных процессов.
Существует немало способов защиты от коррозии. Самый лучший из них создание такого металла, который бы вообще не корродировал. Один из путей создания коррозионностойкого металла — получение особых сплавов, в которые добавляют хром, никель, молибден, титан и другие компоненты. Так называемое легирование. Технология создания таких сплавов трудоемка, и связана с повышенными экономическими затратами. Цена таких материалов выше и не всегда целесообразно применение их в конкретных условиях.
Цена таких материалов выше и не всегда целесообразно применение их в конкретных условиях.
Ингибирование — способ, при котором скорость коррозии снижается, если в агрессивную среду ввести соединения, значительно замедляющие коррозионный процесс. Одним из механизмов ингибирования является адсорбция ингибитора на поверхности защищаемого изделия. Ингибируемые бумаги и пленки применяются при долговременном хранении.
Различают металлические и неметаллические защитные покрытия, изолирующие металл от агрессивной среды. Большие детали или трубы защищают методом металлизации. Плакирование — метод защиты металла от коррозии другим металлом, который устойчив к агрессивной среде.
Трубы газо- и нефтепроводов защищаются комбинированным способом, мазутно-битумное покрытие, ингибированная бумага и одновременно с этим катодная защита. Сущность электрозащиты состоит в том что, на катод, которым является сам трубопровод, накачиваются электроны от внешнего источника тока, и это тормозит коррозию. Анодом в этом случае может служить любой ненужный металл. Так же широко сейчас применяются различные плёнки на основе полиэтилена, внутренняя поверхность так же защищается различными покрытиями на основе керамики. Сварные стыки также защищаются от взаимодействия с перекачиваемой средой различными способами.
Анодом в этом случае может служить любой ненужный металл. Так же широко сейчас применяются различные плёнки на основе полиэтилена, внутренняя поверхность так же защищается различными покрытиями на основе керамики. Сварные стыки также защищаются от взаимодействия с перекачиваемой средой различными способами.
При защите ТУ применяется метод протекторной защиты. Протектор — активный металл, с более отрицательным потенциалом, например цинк, который разрушаясь сам, защищает объект.
Надежным способом зашиты от коррозии, являются гальванические покрытия, которые получают электролизом в водных растворах.
Неметаллические покрытия — это покрытия лаками, красками, различными силикатными эмалями и полимерными материалами. Покрытие силикатными эмалями широко применяется в химической промышленности. Кислотостойкие эмали применяют для покрытия вакуумных аппаратов, резервуаров, реакторов.
Затраты на защиту металла от коррозии оправданы и дают хороший экономический эффект, с учётом снижения затрат на замену непригодного ТУ. Где то, например подземные трубопроводы с агрессивной средой, она просто необходима для безопасной эксплуатации.
Где то, например подземные трубопроводы с агрессивной средой, она просто необходима для безопасной эксплуатации.
При проведении экспертизы промышленной безопасности технических устройств, применяемых на опасных производственных объектах, одной из важнейших задач является определение скорости коррозии и прогнозирование этой скорости на планируемый период эксплуатации. Мероприятия по антикоррозионной защите могут значительно увеличить срок эксплуатации и, как следствие, снизить затраты на замену ТУ.
Литература:
-
Материаловедение и технология металлов. / Ф. Гарифуллин, Г. Фетисов. — Издательство: Оникс. 2009. 624 с. -
Коррозия и защита от коррозии. / Семенова И. В., Флорианович Г. М., Хорошилов А. В. — Издательство: М.: Физматлит. 2002. 335 с.
Основные термины (генерируются автоматически): агрессивная среда, электрохимическая коррозия, коррозия, способ защиты, химическая коррозия, атмосферная коррозия, коррозионное повреждение металла, остаточный ресурс, процесс эксплуатации, скорость коррозии.
Методы защиты коррозии | Статья в журнале «Молодой ученый»
Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды…
Влияние
коррозии на прочность оборудования | Статья в журнале…
Коррозией металлов называют самопроизвольное разрушение металлических материалов вследствие химического или электрохимического взаимодействия их с окружающей средой. Коррозионный процесс протекает на границе раздела двух сред металла и окружающей. ..
..
Методы борьбы с коррозией. Плазменное электролитическое…
осадком, газовая коррозия, коррозионная эрозия, щелевая коррозия и т.д. [4]. Все это приводит к необходимости защиты оборудования от воздействия агрессивных сред, созданию новых и совершенствованию старых способов защиты.
К вопросу оценки
скорости коррозии технических устройств…
В данной работе рассмотрены методы оценки и определения скорости коррозии технологического оборудования в зависимости от условий его эксплуатации при осуществлении технического диагностирования оборудования в нефтеперерабатывающей и нефтехимической…
Способы изменения конструкции устройства для снижения. ..
..
Обработка коррозионной среды. В случае электрохимической коррозии она сводится к уменьшению содержания деполяризаторов
Основные термины (генерируются автоматически): металл, коррозионная среда, слой, материал, коррозия, окружающая среда, схема строения…
Коррозия в судовых парогенераторах | Статья в журнале…
Электрохимическая коррозия. Коррозионный процесс, разрушающий металл, в следствие
Электрохимическая коррозия наблюдается при протекании следующих процессов: − анодного, образование ионов металла в электролите и некомпенсированных электронов
Ингибирование
коррозии стали 20Л в хлоридсодержащих средах
Ключевые слова: коррозионная стойкость, ингибиторы коррозии, скорость коррозии, ингибирующий эффект.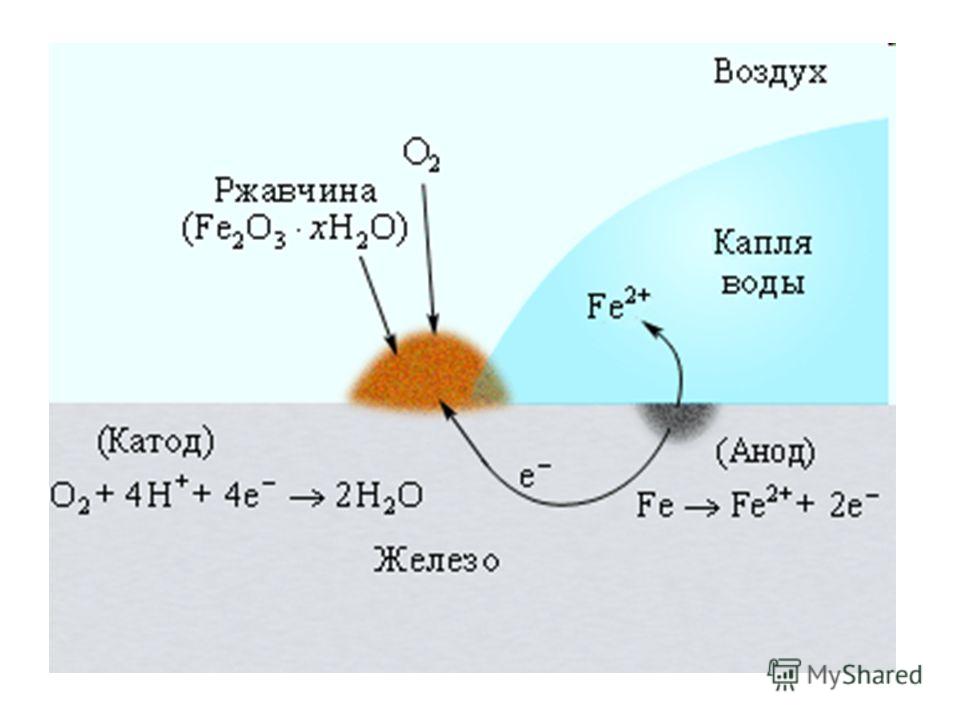
Об эффективной защите сталей в различных агрессивных средах ингибированием коррозионного процесса органическими гетероциклическими соединениями…
Лабораторные
методы измерения и приборы контроля коррозии
Среднее значение глубины коррозионного поражения при равномерной коррозии можно вычислить с помощью массометрического показателя скорости коррозии ; . Где плотность металла, г/см3; 8,76- переводной коэффициент.
Защита кузова легкового автомобиля от коррозии с помощью…
Коррозия — это процесс разрушения твердых тел в результате химических и электрохимических реакций, развивающихся на поверхности предмета при его взаимодействии с окружающей средой.
Скорость коррозийной реакции зависит от ряда причин
Защита кузова автомобиля от коррозии | Статья в журнале…
«Коррозия, ржавление, ржа — это самопроизвольное разрушение металлов и сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой.
Что такое электрохимическая коррозия. Определение и классификация коррозионных процессов. Химическая и электрохимическая коррозия
ГлавнаяРазноеЧто такое электрохимическая коррозия
2.2 Электрохимическая коррозия металлов
Под электрохимической коррозией подразумевают процесс взаимодействия металлов с электролитами в виде водных растворов, реже с неводными электролитами, например, с некоторыми органическими электропроводными соединениями или безводными расплавами солей при повышенных температурах. Делится на электрокоррозию и гальванокоррозию. Из указанных разновидностей рассмотрим лишь гальванокоррозию.
Делится на электрокоррозию и гальванокоррозию. Из указанных разновидностей рассмотрим лишь гальванокоррозию.
2.2.1 Электрохимическая гальванокоррозия. Электрохимическая коррозия – наиболее распространенный вид коррозии металлов. Примером коррозионных процессов электрохимического характера является разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере под адсорбированными пленками влаги, в технических растворах.
Растворенный кислород и ионы водорода – важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим схему этого процесса. Сложность его заключается в том, что на одной и той же поверхности происходят одновременно два процесса, противоположные по своему химическому смыслу: окисление металла и восстановление окислителя. Оба процесса должны протекать сопряженно, чтобы сохранялось равенство числа электронов, отдаваемых металлом и присоединяющихся к окислителю в единицу времени. Только в этом случае может наступить стационарное состояние.
Только в этом случае может наступить стационарное состояние.
Итак, процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие, в значительной степени самостоятельные, электродные процессы:
– анодный процесс – переход металла в раствор в виде ионов (в водных растворах, обычно гидратированных) с оставлением эквивалентного количества электронов в металле:
Ме 0 – nē → Ме n+
– катодный процесс – ассимиляция появившихся в металле избыточных электронов деполяризаторами.
Различают коррозию с водородной и кислородной (или окислительной) деполяризацией. При наличии в растворе газообразного кислорода и невозможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород. Коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла:
O + 4ē +2h4O → 4OH—.
В случае водородной деполяризации на катоде протекает процесс восстановления ионов водорода, находящихся в среде:
2Н++ 2ē + → Н2.
2.3Способы защиты от коррозии
Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью.
2.3.1 Легирование металла – эффективный (хотя обычно дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава обычно вводят компоненты, вызывающие пассивирование металла. В качестве таких компонентов применяются хром, никель, вольфрам и др.
Основное средство защиты металлов от газовой коррозии – легирование такими компонентами, которые улучшают свойства защитных пленок, образующихся при окислении металла. Для стали такими элементами являются хром, алюминий, кремний. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов.
Для стали такими элементами являются хром, алюминий, кремний. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов.
2.3.2 Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Выбор вида покрытия зависит от условий, в которых используется металл.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. В зависимости от величины электродного потенциала защищаемого металла и покрытия, различают катодные и анодные покрытия.
Катодное покрытие – металл покрытия менее активен, чем защищаемый металл. Например, олово хорошо покрывает железо и достаточно стойко против действия разбавленных растворов кислот. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову; анодом здесь является железо, а катодом олово. В этом случае разрушается железо, а олово остается без изменений (рисунок 5).
В случае механического повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову; анодом здесь является железо, а катодом олово. В этом случае разрушается железо, а олово остается без изменений (рисунок 5).
Анодное покрытие – покрытие более активным металлом. Например, покрытие железа цинком (рисунок 4). При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом, а анодом – цинк. Электроны переходят от цинка к железу, цинк разрушается, а железо остается защищенным до тех пор, пока не разрушится весь цинк. На основании вышеизложенного можно сделать вывод о том, что более надежным является анодное покрытие.
а)б)
1 – раствор; 2 – покрытие; 3 – основной материал; 4 – пора
Рисунок 4 – Схема коррозии металла в кислом
растворе при нарушении анодного а) и катодного б) покрытия
К ряду покрытий, получаемых химической обработкой металла, относятся защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных пленок носит в технике общее название оксидирование.
Образование на поверхности металлических изделий защитных оксидных пленок носит в технике общее название оксидирование.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий могут быть неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
2.3.3 Электрохимические методы защиты. Методы электрохимической защиты основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды. К ним относятся катодная защита, называемая также электрозащитой, и протекторная (или анодная) защита.
Катодная защита заключается в том, что защищаемая конструкция А (рисунок 5), находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества В. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла Б (рельс, балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла Б (рельс, балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
Протекторная защита отличается от катодной защиты тем, что для ее осуществления используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор Б (рисунок 6) соединяют с защищаемой конструкцией А проводником электрического тока В. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения защищаемую конструкцию.
Рисунок 5 – Схема катодной Рисунок 6 – Схема анодной
защиты (протекторной) защиты
2.3.4 Изменение свойств коррозионной среды. Изменение свойств коррозионной среды пригодно для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Один из методов состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация). В качестве примера можно привести освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Один из методов состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация). В качестве примера можно привести освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Для замедления коррозии металлических изделий в агрессивную среду вводят вещества, называемые ингибиторами (или замедлителями) коррозии. Это имеет большое значение в тех случаях, когда металл необходимо защищать от разъедания кислотами. В зависимости от вида коррозии, природы металла и раствора применяются различные ингибиторы, действие которых специфично.
2.3.5 Создание рациональных конструкций. Выбор материалов и их сочетаний для данной машины, конечно, диктуется технической и экономической целесообразностью, но должен обеспечивать ее коррозионную устойчивость. Конструктор должен предусмотреть рациональные формы машины, допускающие быструю очистку от грязи; машина не должна иметь мест скопления влаги, которая является возбудителем коррозии.
studfiles.net
Электрохимическая коррозия
Электрохимическая коррозия – это наиболее распространенный тип нарушения целостности металлической структуры. При этом не обязательно погружение детали в электролит. Часто бывает достаточно наличия тонкой пленки на поверхности материала.
Электрохимическая коррозия металлов происходит, в большей степени, в результате повсеместного применения технической и бытовой соли (хлорид калия и натрия). Чаще всего эти вещества используют в зимний период для быстрого устранения льда и снега с улиц городов. Больше всего, как показывает практика, ущерба таким образом наносится подземным коммуникациям и наземному транспорту.
Электрохимическая коррозия наблюдается на деталях машин, конструкций, приборов, находящихся в условиях почвы, грунта, воды (морской или речной), атмосферы, в растворах технического назначения, под воздействием смазочных, охлаждающих продуктов.
Разрушение могут спровоцировать блуждающие токи, которые возникают при утечке части тока из электрической цепи в почву или воду, а оттуда – в элементы конструкций. Там, где происходит обратный выход (из металлов в почву или воду) отмечается разрушение деталей – электрохимическая коррозия. Чаще всего блуждающие токи формируются в местах, где движется наземный транспорт (трамваи, железнодорожные локомотивы на электрической тяге). При этом, как показывают исследования, 1 Ампер за год способен растворить 33,4 кг свинца, 10,7 кг цинка и 9,1 кг железа.
Там, где происходит обратный выход (из металлов в почву или воду) отмечается разрушение деталей – электрохимическая коррозия. Чаще всего блуждающие токи формируются в местах, где движется наземный транспорт (трамваи, железнодорожные локомотивы на электрической тяге). При этом, как показывают исследования, 1 Ампер за год способен растворить 33,4 кг свинца, 10,7 кг цинка и 9,1 кг железа.
Часто в развитии разрушения участвует несколько факторов.
Электрохимическая коррозия представляет собой особый процесс. Сплав (или самостоятельный материал) утрачивает часть имеющихся атомов. Они (атомы) переходят в виде ионов в электролитический раствор. Вместо утраченных металлом частиц появляются электроны, которые заряжают материал отрицательным зарядом. При этом электролит обладает зарядом положительным. Таким образом, электрохимическая коррозия формирует гальваническую пару. Окислительно-восстановительным реакциям в большей степени способствует неоднородность в химической структуре материала. Провоцирующими факторами в формировании анодов и катодов являются и участки остаточной деформации, отсутствие однородности в покрывающих металл защитных пленках.
Провоцирующими факторами в формировании анодов и катодов являются и участки остаточной деформации, отсутствие однородности в покрывающих металл защитных пленках.
Пронаблюдать разрушение деталей можно и в домашних условиях. Для этого потребуются три гвоздя, три стакана с солевым раствором (пищевая соль, растворенная в воде), небольшой кусочек цинка, медная проволока (изоляцию следует устранить).
Первый гвоздь опускается в стакан с солевой смесью. Ко второму следует прикрутить проволоку и также поместить в раствор (во второй стакан). Третий гвоздь опускается в третью емкость. Оставить на двое-трое суток. По истечении этого периода на всех трех гвоздях будет отмечаться ржавчина. Однако в самом плохом состоянии будет гвоздь с проволокой, в лучшем – с цинком. Такая разница связана с различной способностью металлов отдавать электроны.
Для защиты материала применяют метод изменения его потенциала. Следует отметить, что методика не связана с изоляцией. В качестве защиты применяют катодный (анодный) метод.
При этом защищаемую конструкцию, находящуюся в неблагоприятной (например, в почвенной) среде, присоединяют к катоду (заряженному отрицательно электроду) электрического источника. Таким образом, деталь становится катодом. В эту же среду помещают и старую деталь, присоединяя ее к аноду от внешнего источника. Коррозийный процесс приводит к разрушению старого металла, который становится анодом.
Существует также и протекторный тип защиты. В отличие от описанного выше, этот вариант предусматривает применение особого анода – протектора. В его качестве используют более активный, нежели у защищаемой конструкции, металл. В процессе коррозийного разрушения протектор выполняет задачу анода (положительного электрода) и, разрушаясь, предохраняет от нарушения целостности в охраняемой детали.
fb.ru
Электрохимическая коррозия
Электрохимическая коррозия металла может проявиться в тех случаях, когда имеет место граница раздела фаз металл-электролит. Факт проявления коррозии не зависит от природы электролита, будь это сверхчистая вода или расплавленная соль. Не имеет существенного значения и количество электролита — в предельном случае это может быть пленка влаги толщиной в несколько десятков миллимикрон.
Не имеет существенного значения и количество электролита — в предельном случае это может быть пленка влаги толщиной в несколько десятков миллимикрон.
Схема процесса коррозии.Анодный процесс при коррозии всегда заключается в ионизации металла. Металл переходит в раствор в виде гидратированных ионов, при этом в металле остается соответствующее число электронов.
Примерами анодных реакций могут быть:
Fe — 2ē = Fe2+ — окисление железа
Al — 3ē = Al3+- окисление алюминия
В общей форме реакция выглядит так:
Me – nē = Men+, где Me — металл.
Катодный процесс — поглощение появившихся в металле избыточных электронов с помощью так называемых деполяризаторов, которыми могут являться атомы, молекулы, ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных ее участках.
Примерами катодных реакций могут быть следующие:
2Н+ + 2ē → 2Н → Н2 — восстановление ионов водорода в кислой среде.
О2 + 4Н+ + 4ē → 2Н2О — восстановление растворенного кислорода в кислой среде.
О2+2Н2О + 4ē → 4ОН— восстановление растворенного кислорода в нейтральной или щелочной среде.
В общей форме уравнение катодной реакции выглядит так:
D + ē → D, где D – деполяризатор.
Поляризация и ее виды. Коррозия металлов с кислородной и водородной деполяризацией.При прохождении через электрод электрического тока извне происходит смещение его потенциала. Численная величина изменения потенциала вследствие прохождения тока называется поляризацией.
Причина возникновения поляризации состоит в том, что переход зарядов из металла в раствор и перемещение ионов в электролите встречают определенное сопротивление. В зависимости от вызывающих его факторов различают три вида по-
ляризации: концентрационную, активационную и оммическую.
Причиной концентрационной поляризации является разность концентраций ионов в приэлектродном пространстве, следствием чего является изменение потенциала электрода.
Возникновение активационной поляризации обусловлено сопротивлением, возникающим во время катодной реакции присоединения электронов деполяризатором или торможением
при переходе катионов из металлической решетки в раствор. В электрохимии эти процессы называют стадиями, считается, что самая замедленная стадия определяет скорость процесса. Преодоление такого сопротивления требует добавочной активационной энергии, поэтому и поляризация называется активационной.
В электрохимии эти процессы называют стадиями, считается, что самая замедленная стадия определяет скорость процесса. Преодоление такого сопротивления требует добавочной активационной энергии, поэтому и поляризация называется активационной.
Омической поляризацией называется падение потенциала JR, вызываемое электрическим сопротивлением слоя электролита вблизи электрода или слоя продуктов реакции, а также обоих этих слоев одновременно.
В зависимости от направления сдвига потенциала электрода при прохождении постоянного тока различает анодную и катодную поляризации. Анодной поляризацией называется сдвиг потенциала в положительную сторону, катодной поляризацией — его перемещение в отрицательную сторону.
На практике всегда стремятся к увеличению поляризации в коррозионном элементе. Благодаря поляризации металлов скорость коррозии уменьшается в сотни, а то и в тысячи раз.
Явление, противодействующее поляризации электрода, принято называть деполяризацией. Деполяризация (анодная и катодная) ускоряет процесс коррозии.
Среди большого количества реакций катодной поляризации в коррозионных процессах наибольшее значение имеют реакции, в которых в роли, деполяризатора выступает кислород (кислородная деполяризация) или ионы водорода: водородная поляризация).
С водородной деполяризацией протекает коррозия всех
металлов, стоящих левее водорода в ряду напряжений, в кислых средах. В нейтральных средах с водородной деполяризацией протекает коррозия активных металлов, а в щелочных средах — амфотерных металлов.
С кислородной деполяризацией протекает коррозия металлов малой и средней активности в нейтральных средах и в любых средах металлов малой активности, т.е. стоящих в ряду
напряжений после водорода. С кислородной деполяризацией протекает атмосферная и почвенная коррозия. Существенное влияние на скорость коррозии оказывает скорость доставки кислорода к металлу путем диффузии или конвекции, а также такие факторы как перемешивание электролита, глубина погружения корродирующего металла, растворимость кислорода в растворе и т.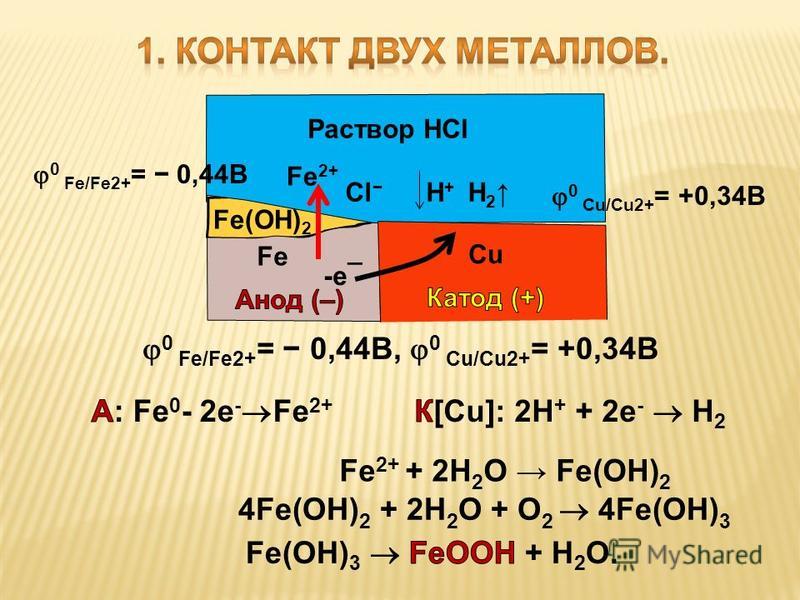 д.
д.
Причины возникновения гальванопар.В процессах электрохимической коррозии можно выделить следующие типы возникновения гальванических пар (т.е. разности потенциалов на поверхности металлов):
1. Практически любой металл содержит примеси других металлов или соединения того же металла. В среде электролита система из основного металла и металла примеси образует большое число гальванопар. Участки с более электроотрицательными потенциалами окажутся анодами (по отношению к внутреннему участку цепи) и будут растворяться, a нa более электроположительных участках (катодах) будут происходить процессы восстановления. Таким образом, одной из причин электрохимической коррозии является возникновение микро — и макрогальваничесхих элементов на поверхности металла.
На рис. 69 представлена схема коррозии железа с включением меди.
Рис.69. Схема коррозии железа с включением меди
Электрохимическая система этой гальванопары в электролите изображается, как и в случае гальванического элемента, схемой
A (-) Fe│h4SO4│Cu (+) K
железо — анод, медь — катод
На аноде: Fe — 2ē = Fe2+
На катоде: 2Н+ + 2ē = Н2
В результате железо разрушается в месте контакта, а на меди выделяется водород.
2. Гальванопары могут возникать и в результате неравномерности аэрации, т.е. неравномерного доступа кислорода к различным участкам поверхности металла. На рис. 70 показана схема коррозии железа при неравномерном доступе кислорода.
Участки поверхности металла, к которым быстрее диффундирует кислород — катодные, к которым затрудняется доступ кислорода – анодные.
На аноде: Fe — 2ē = Fe2+
На катоде: O2 + 2Н2O + 4ē = 4ОН- (в нейтральной среде)
Рис. 70. Схема коррозии железа при неравномерной аэрации
В ходе коррозии химический состав раствора вблизи металлической поверхности подвергается непрерывным изменениям. Результатом этих изменений являются вторичные реакции. Из приведенной выше схемы видно, что вблизи катодного участка происходит подщелачивание и ионы железа могут вступить в реакцию с ионами OН- с образованием гидроокиси железа: Fe2+ + 2OH- → Fe (OH)2
Труднорастворимая гидроокись железа выпадает в осадок. Если процесс протекает в воздушной среде, то гидроокись железа (II) окисляется кислородом воздуха в гидроокись железа (III):
4Fe (OH)2 + O2 + 2h4O → 4Fe (OH)3
Гидроксиды железа неустойчивы и постепенно могут переходить в соответствующие оксиды. Продукты электрохимической коррозии железа, состоящие из гидратированных оксидов, называются ржавчиной.
Продукты электрохимической коррозии железа, состоящие из гидратированных оксидов, называются ржавчиной.
3. Возникновение разности потенциалов может наблюдаться для одного и того же металла, части которого контактируют с электролитом разной концентрации. В растворе с меньшей концентрацией поверхность металла заряжается отрицательно (анод), а в более концентрированном растворе — положительно (катод).
4. Часто детали изделия, выполненные из одного и того же металла и различающиеся только по температуре эксплуатации могут подвергаться электрохимической коррозии. Такие контакты встречаются в промышленных устройствах, соприкасающихся с нагретыми газами или жидкостями, например, в паровых котлах, змеевиках и т.д.
5. Различный уровень механических напряжений в одной и той же детали приводит к возникновению микрогальванопар. Если согнутая металлическая пластинка погружена в коррозионную среду, то на растянутом слое через некоторое время начнут возникать трещины (анод), внутренний слой останется без изменения (катод).
Факторы, влияющие на коррозию.На скорость коррозии влияют различные факторы: природа металла, его структу-
ра и состояние поверхности, химический состав и свойства среды, температура электролита, природа поверхностных оксидных пленок, условия работы изделия, влажность, пыль и др. Например, состав электролита определяет электропроводность и активную концентрацию ионов, участвующих в процессе.
Ускоряют коррозионные процессы во всех случаях и для всех металлов ионы Н+, Сl-, Br-, I-, понижая потенциал растворения металлов. Для амфотерных металлов такую роль играют ионы ОН-.
Присутствие в электролите ионов или полярных молекул, которые могут выступать как лиганды при комплексообразовании и растворять пассивирующие пленки (Сl -, СN -, Nh5), значительно ускоряет коррозионные процессы.
С увеличением температуры скорость коррозии металлов, как правило, возрастает, причем эта зависимость носит экспоненциальный характер. Скорость коррозии стали в НСl, идущая с выделением водорода, удваивается при увеличении температуры на 10°. Однако часто зависимость скорости коррозии от температуры имеет сложный характер (например, в случае, когда процесс коррозии протекает с кислородной деполяризацией). Такое явление наблюдается при коррозии стали в природных водах.
Однако часто зависимость скорости коррозии от температуры имеет сложный характер (например, в случае, когда процесс коррозии протекает с кислородной деполяризацией). Такое явление наблюдается при коррозии стали в природных водах.
Похожие статьи:
poznayka.org
Электрохимическая коррозия — Мегаобучалка
Коррозия и методы защиты от нее
Корро́зия, ржавление, ржа — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде:
Гидроксид железа и является тем, что называют ржавчиной.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров.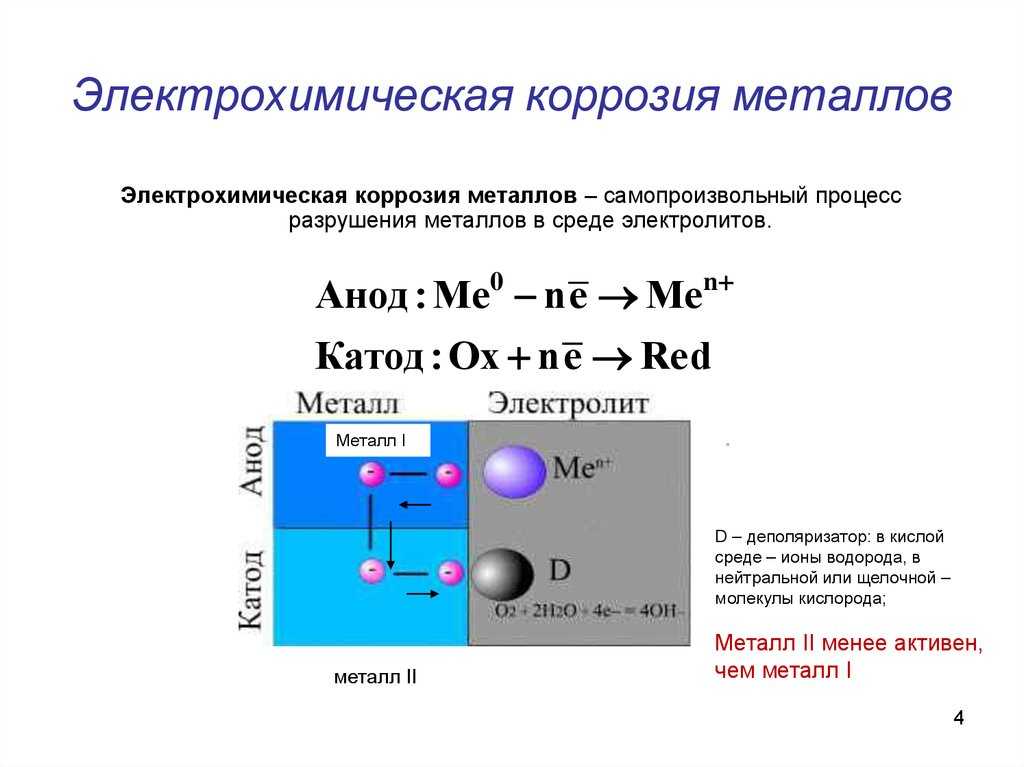 Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Классификация видов коррозии
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
· газовая коррозия;
· атмосферная коррозия;
· коррозия в неэлектролитах;
· коррозия в электролитах;
· подземная коррозия;
· биокоррозия;
· коррозия под воздействием блуждающих токов.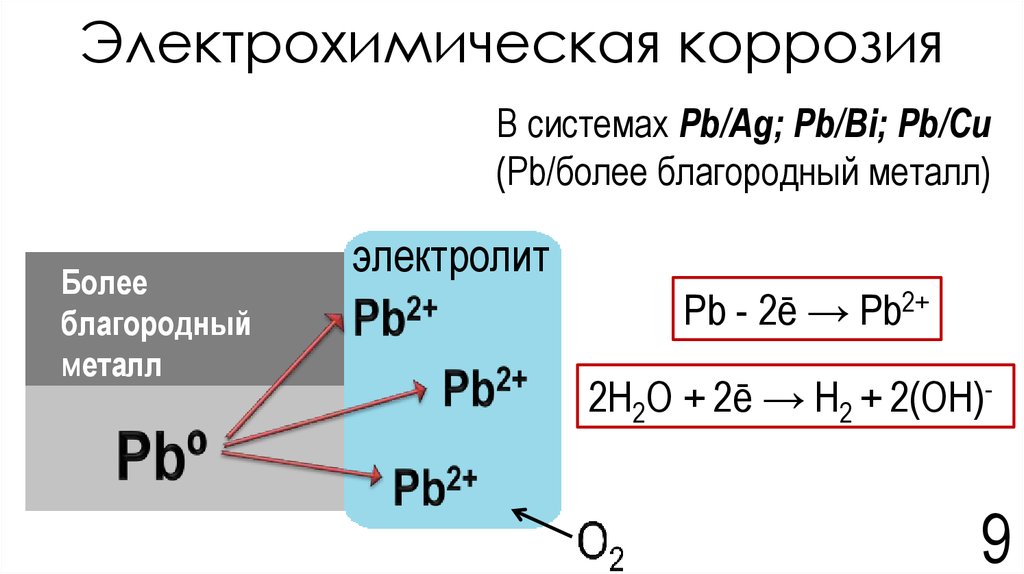
По условиям протекания коррозионного процесса различаются следующие виды:
· контактная коррозия;
· щелевая коррозия;
· коррозия при неполном погружении;
· коррозия при полном погружении;
· коррозия при переменном погружении;
· коррозия при трении;
· межкристаллитная коррозия;
· коррозия под напряжением.
По характеру разрушения:
· сплошная коррозия, охватывающая всю поверхность:
o равномерная;
o неравномерная;
o избирательная;
· локальная (местная) коррозия, охватывающая отдельные участки:
o пятнами;
o язвенная;
o точечная;
o сквозная;
o межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
Главная классификация производится по механизму протекания процесса. Различают два вида:
· химическую коррозию;
· электрохимическую коррозию.
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др. ) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Коррозия металлов
Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Типы коррозии
Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
1.
a)
В некоторых металлах (Zn) катионы легко переходят в раствор; пластины заряжаются отрицательно, а раствор положительно.
б)
Катионы в растворе легко теряют гидратные оболочки и адсорбируются на поверхность металлов: металл +, раствор -.
Вывод: Металлы (рис. а) являются анодами по отношению к водородному электроду, а (рис. б) катодами.
Потенциалы газовых электродовГазовые электроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов.
Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов.
Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов.
Потенциал водородного электрода зависит от РН.
Кислородный электрод:
Потенциал кислородного электрода так же изменяется при изменении
Электрохимическая коррозия
— наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают по следующим причинам:
1. Наличие примесей металлов или других веществ, отличающихся по активности от основного металла.
2. Структурная неоднородность поверхности металла, что определяет наличие участков с разной активностью.
3. Неравномерность распределения деформаций в металле после термической и механической обработки и др.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный — окисление металла:
и катодный — восстановление ионов водорода в кислой среде:
или
молекул кислорода, растворенного в воде, в случае атмосферной коррозии:
Не следует путать электрохимическую коррозию с электрохимической коррозией однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами.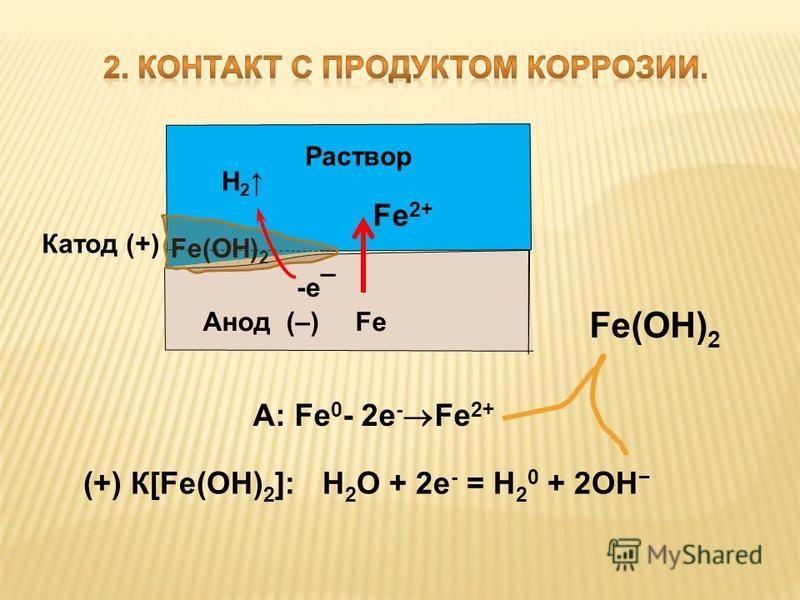 Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
| Гальванический элемент | Микрогальванический элемент |
| Анод-металл с меньшим значением электронного потенциала, катод- с большим. | |
| Перенос электронов проискходит по внешней цепи. | Перенос электронов происходит внутри пластины. |
Ионы перемещаются через ключ.
| Ионы перемещаются по раствору электролита. |
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод:
Левый электрод:
Общая реакция:
Для защиты железных конструкций от коррозии наиболее часто применяют металлическое покрытие из цинка (оцинкованное железо, жесть) или олова (луженое железо, белая жесть). В первом случае цинк является более активным восстановителем, чем железо, так как Ре Ге2+ = = -0,440 В. Поэтому при нарушении покрытия в коррозионных микрогальванических элементах цинк будет анодом и разрушаться, а железо катодом — местом, для осуществления процессов восстановления окислителей среды. Для описания процессов в этой системе на рис. 38.7 следует слева взять более активный металл — цинк (вместо железа), а справа — менее активный — железо (вместо меди) и заменить ионы железа в среде на ионы цинка. Поскольку в данном процессе цинк является анодом, то цинковое покрытие железа называется анодным покрытием.
Поэтому при нарушении покрытия в коррозионных микрогальванических элементах цинк будет анодом и разрушаться, а железо катодом — местом, для осуществления процессов восстановления окислителей среды. Для описания процессов в этой системе на рис. 38.7 следует слева взять более активный металл — цинк (вместо железа), а справа — менее активный — железо (вместо меди) и заменить ионы железа в среде на ионы цинка. Поскольку в данном процессе цинк является анодом, то цинковое покрытие железа называется анодным покрытием.
Таким образом, электрохимическая коррозия металлов — это результат деятельности микрогальванических элементов на их поверхности.
Микрогальваническими элементами может быть объяснена характерная особенность кинетики взаимодействия металлов с кислотами — в течение довольно длительного начального периода скорость растворения металла и выделения водорода возрастает. Это связано с постепенным накоплением на реакционной поверхности тех включений, которые в начале реакции находились не на поверхности.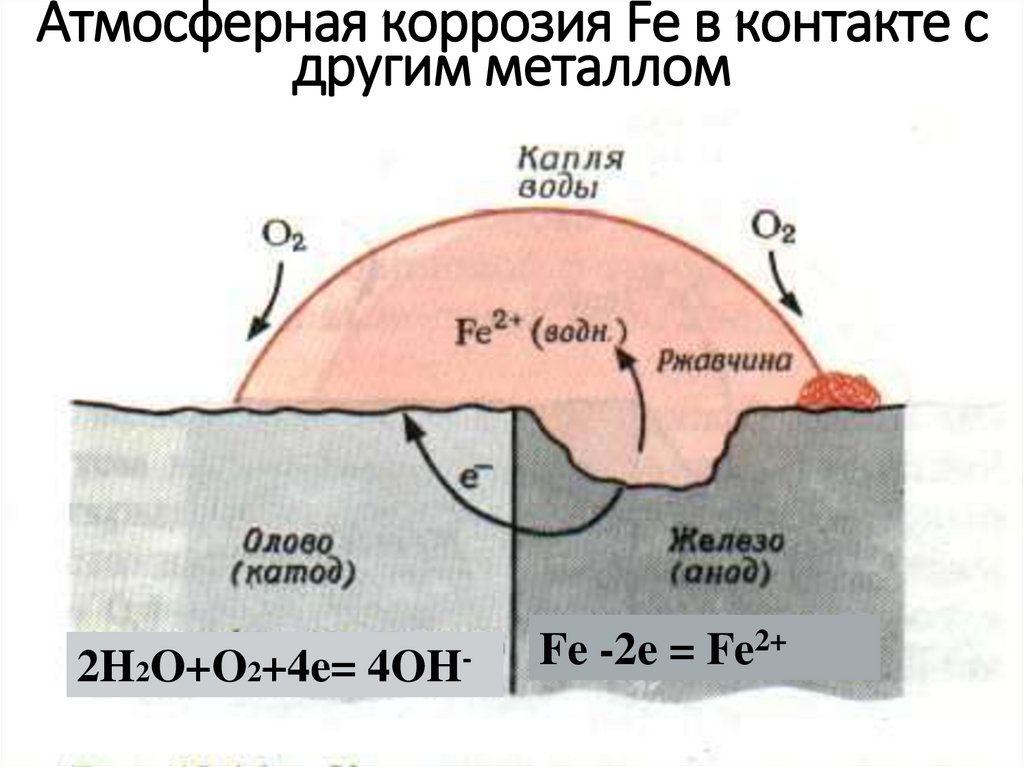
Деполяризация
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим пример коррозии Zn/Fe
В данном случае цинк будет анодом (Zn=-0,76), а железо – катодом (Fe= –0,44). На анодном участке будет происходить:
– окисление
– восстановление
Схема возникающего гальванического элемента выглядит следующим образом:
нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере.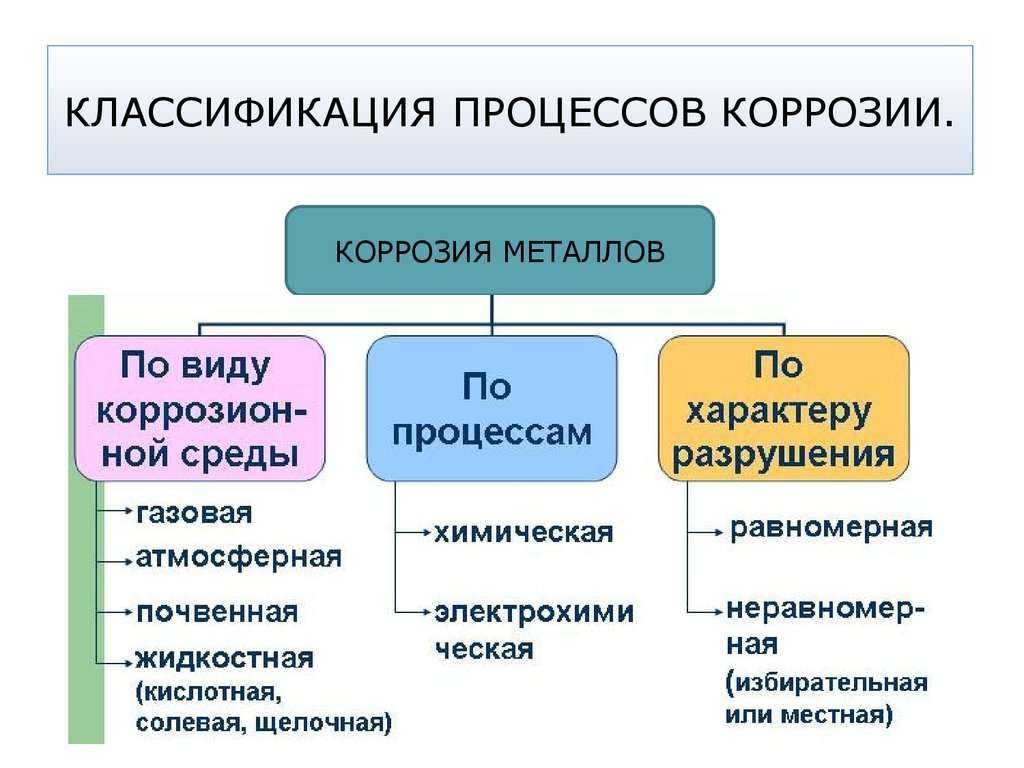 Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
– окисление
– восстановление
Схема короткозамкнутого гальванического элемента:
У поверхности металла в электролите протекают следующие реакции:
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
megaobuchalka.ru
Определение и классификация коррозионных процессов. Химическая и электрохимическая коррозия
При эксплуатации изделий из металлов и их сплавов приходится сталкиваться с явлением разрушения их под действием внешней среды. Разрушение металлов и сплавов вследствие взаимодействия их с окружающей средой называется коррозией.
Коррозия металлов наносит большой экономический ущерб. В результате коррозии выходят из строя оборудование, машины, механизмы, разрушаются металлические конструкции. Особенно сильно подвёргается коррозии оборудованиё, которое контактирует с агрессивными средами, например, растворами кислот, солей.
Коррозионное разрушение может затрагивать всю поверхность металла — сплошная (общая) коррозия, или отдельные участки — местная (локальная) коррозия. В зависимости от механизма процесса различают химическую и электрохимическую химическую коррозию.
Химическая коррозия — это разрушение металла из-за окисления его окислителями, находящимися в коррозионной среде.
Химическая коррозия протекает без возникновения электрического тока в системе. Такой вид коррозии возникает при контакте металлов с неэлектролитами или в газовой среде при высоких температурах (газовая коррозия).
Газовая коррозия встречается довольно часто. С ней мы сталкиваемся при коррозии металлов в печах, выхлопных трубах и т.п. Наиболее опасными для металлов компонентами газовой среды являются кислород, пары воды, оксид углерода (IV), оксид серы (IV). Коррозионное разрушение железа и его сплавов на воздухе обусловлено окислением его кислородом воздуха.
С повышением температуры скорость газовой коррозии возрастает. Наибольший вред приносит электрохимическая коррозия.
Наибольший вред приносит электрохимическая коррозия.
Электрохимической коррозией называется разрушение металла при контакте с электролитами с возникновением в системе электрического тока.
Коррозия — это разрушение металлов в результате химической и электрохимической реакции.
Разрушение (порча), происходящие по физическим причинам не называются коррозией, а известно как эрозия или истирание или износ.
Термин «коррозия» относится только к химическому воздействию на металлы и не распространяется на неметаллические материалы. Пластмассы могут набухать, трескаться; дерево — расслаиваться или гнить.
Ржавление — коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из оксидов железа (гидратированных).
Цветные металлы, следовательно, корродируют, но не ржавеют.
Коррозионная наука.
Так как коррозия включает химическое превращение, для лучшего понимания коррозионных реакций необходимо знать основы химии и особенно электрохимии, так как коррозионные процессы по большой части являются электрохимическими.
Так как структура и состав металла зачастую определяют коррозионное поведение, надо быть знакомым с основами металлургии. Следовательно, химия и металлургия составляют фундамент при изучении коррозии, так же как биология и химия — при изучении медицины.
Коррозионная проблема.
Значение коррозионных исследований определяется тремя аспектами:
1 . Экономический.
Имеет целью уменьшение материальных потерь в результате коррозии трубопроводов, котлов, судов, мостов.
2. Повышение надежности оборудования.
Оборудование в результате коррозии разрушается с катастрофическими последствиями, например: сосуд высокого давления, паровые котлы, контейнера для токсичных материалов.
3. Сохранность металлического фонда.
Мировые ресурсы металла ограниченны, а потери в результате коррозии ведут к дополнительным затратам энергии и воды. И человеческий труд, затрачиваемый на проектирование и реконструкцию.
Причины коррозии металлов:
В природе все металлы (за исключением золота, серебра, металлов платиновой группы и в меньшей степени медь и ртуть) в основном встречаются в виде минералов, таких как сульфиды, силикаты, карбонаты. Для извлечения металла минерал необходимо подвергнуть реакции восстановления, используя в качестве восстановителя какое-либо вещество
Для извлечения металла минерал необходимо подвергнуть реакции восстановления, используя в качестве восстановителя какое-либо вещество
.
Химическое восстановление
Коррозия
Рис 1. Изменение во времени химической энергии при восстановлении оксидов в металлы и в ходе обратной реакции коррозии
2Fе2О3 + ЗС 4Fе + ЗСО2 (гематит)
2ZnО + С 2Zn + СО2
Из графика (рис.1) видно, что металлический Zn энергетически менее стабилен, чем Fе и в атмосферных условиях имеет тенденцию превращаться в сложную смесь из гидроксида и основного карбоната и т.п. Однако, если ржавчина, образующаяся на стали представляет собой рыхлую массу, почти не защищает поверхность металла от проникновения Н2О и О2, то продукты коррозии Zn обладают существенными защитными свойствами, благодаря чему Zn коррозирует медленнее, чем Fе. По этой причине мягкие стали защищают Zn покрытием.
Типы коррозионных разрушений:
I.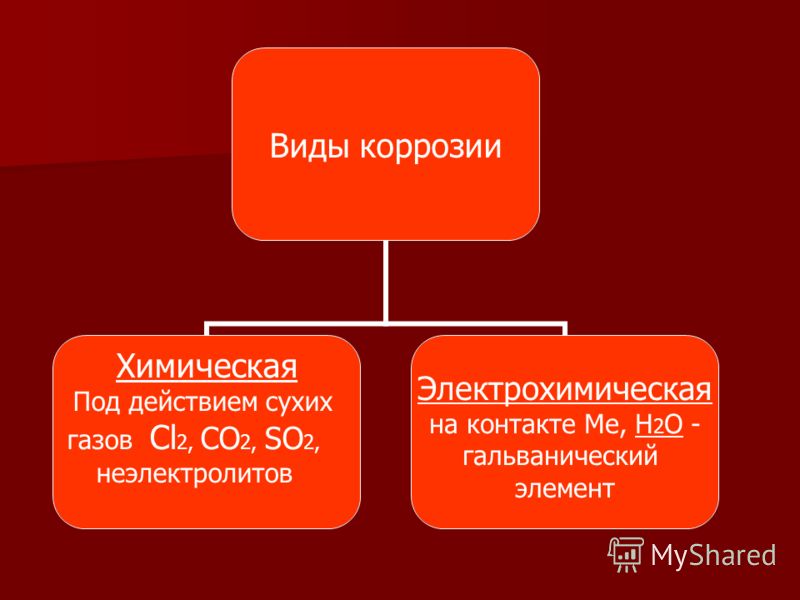 По характеру изменения поверхности металла или степени изменения физико-механических свойств.
По характеру изменения поверхности металла или степени изменения физико-механических свойств.
Различают 5 основных типов коррозии:
1. Равномерная (общая или сплошная) — ржавление железа или потускнение серебра, высокотемпературное окисление металлов.
Скорость равномерной коррозии выражают в разных единицах мм/год или г/м2сутки. Например, сталь в морской воде коррозирует с постоянной скоростью ~ 0,13 мм/год, т.е. 2,5 г/м2сутки.
2. Местная коррозия — разрушение отдельных участков поверхности металла. Она имеет неодинаковую степень разрушения. Наиболее характерными видами местной коррозии являются коррозия в виде пятен, язв, точечная, межкристаллическая. Местная коррозия бывает трех типов:
а) точечная (питинг) — разрушает металл в виде отдельных точечных поражений, перерастающих в сквозные (коррозия нержавеющей стали в морской воде).
б) межкристаллическая коррозия (МКК) — это разрушение на границах зерен, приводящие к потери прочности и пластичности
Межзеренное вещество, действующее как анод, контактирующее с большой поверхностью самих зерен, являющейся катодом. Коррозия протекает быстро, глубоко проникая в металл и приводя иногда к катастрофическим разрушениям. Нержавеющие стали или дюраль подвергнутые неправильной термообработке, склонны к (МКК) в зонах сварки.
Коррозия протекает быстро, глубоко проникая в металл и приводя иногда к катастрофическим разрушениям. Нержавеющие стали или дюраль подвергнутые неправильной термообработке, склонны к (МКК) в зонах сварки.
в) транскристаллитная — рассекающая металл трещиной прямо через зерна. Растрескивание металла под действием периодических или растягивающих напряжений в коррозионной среде называют коррозионной усталостью.
3. Избирательная — коррозия, которой подвержены сплавы, содержащие несколько структурных составляющих.
4. Обесцинкование — это вид разрушения цинковых сплавов, например латуни, при котором преимущественно корродирует цинк, а медь остается на поверхности в виде пористого слоя. Прокорродировавшее, таким образом, изделие нередко сохраняет исходную форму и может показаться не поврежденными, но его прочность и особенно пластичность значительно снижены.
Подвергшаяся обесцинкованию латунная труба способна выдерживать внутреннее давление воды, однако разрушиться при гидравлическом ударе или проведении ремонтных работ.
5. Разрушение окисных пленок на поверхности металлов. При повреждении пленки А12Оз на алюминиевом изделии, находящемся в морской воде, возникает электролит .
Различные внутренние механические напряжения напр. < ненапр. Поэтому в первую очередь будут растворяться напряженные участки металла. Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
II. По механизму реакции взаимодействия с окружающей средой различают:
1. Химическую.
2. Электрохимическую.
Особо выделяют биологическую коррозию идущую под влиянием продуктов жизнедеятельности бактерий и микроорганизмов и радиационную коррозию, протекающую под воздействием радиоактивного излучения.
Электрохимическая коррозия — это разрушение металлов и сплавов под действием жидкостей электролита. Электрохимическая коррозия осуществляется как гальванический процесс за счет разности электрохимических потенциалов различных частей изделия, если оно сделано из разных металлов или за счет разности потенциалов различных участков поверхности одного и того же металла, если он находится в различных концентрациях электролита.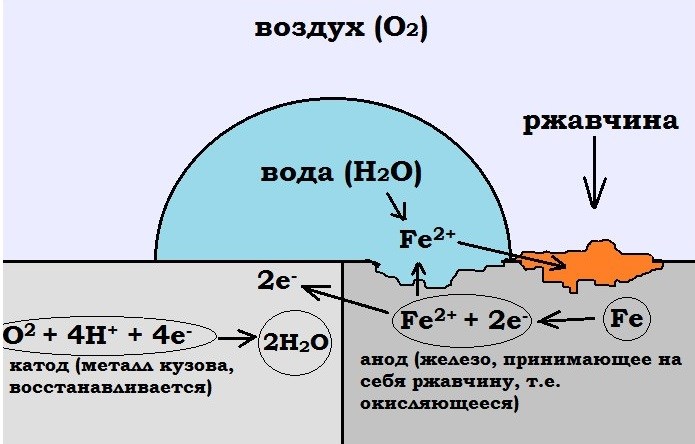
В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому). При этом в результате взаимодействия металла с молекулами воды из коррозионной среды на нем протекают два процесса: окисление металла Ме (анодный процесс) и восстановление окислителей — компонентов среды (катодный процесс). Как правило, в качестве окислителей выступают ионы водорода (коррозия с водородной деполяризацией) или растворенный в воде кислород (коррозия с кислородной деполяризацией). В первом случае при катодном процессе выделяется водород, а во втором образуются гидроксид ионы. Участки поверхности металла, на которых протекают процессы окисления и восстановления, называют соответственно, анодными и катодными. Далее рассмотрим условия, при которых возможно протекание электрохимической коррозии.
Условия возникновения электрохимической коррозии:
1. Контакт двух металлов в электролите.
А: Ме1° — 2е Ме
К: 1) 2Н++ 2е Н2, если рН < 7 (среда кислая)
2) О2 + 2Н2О + 4е 4ОН (среда нейтральная)
При контакте двух разнородных металлов образуется гальванопара в которой разрушается более активный металл.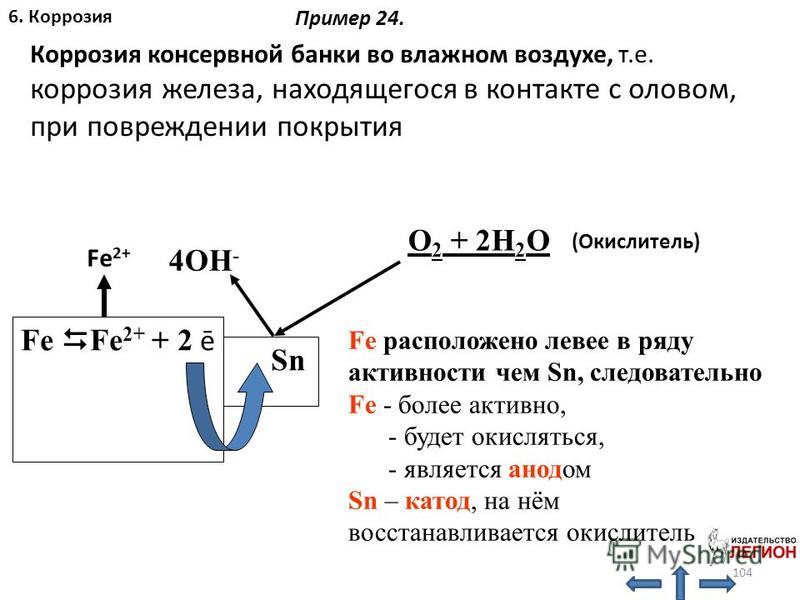 Наибольшая коррозия вблизи места контакта и по мере удаления ослабевает. При этом большую роль играет электропроводность среды. Интенсивность коррозии зависит от разности потенциалов между металлами более активный разрушается тем быстрее, чем больше разность потенциалов контактирующих металлов. Большое влияние оказывает соотношение площадей контактирующих поверхностей. Это связано с тем, что V коррозии определяется не только силой тока, но и плотностью тока (i) i=I/S. Поэтому опасно такое сочетание металла, при котором анод имеет малую площадь, а катод большую (Sан< Sкат). В этом случае анод малой площадью корродирует очень интенсивно.
Наибольшая коррозия вблизи места контакта и по мере удаления ослабевает. При этом большую роль играет электропроводность среды. Интенсивность коррозии зависит от разности потенциалов между металлами более активный разрушается тем быстрее, чем больше разность потенциалов контактирующих металлов. Большое влияние оказывает соотношение площадей контактирующих поверхностей. Это связано с тем, что V коррозии определяется не только силой тока, но и плотностью тока (i) i=I/S. Поэтому опасно такое сочетание металла, при котором анод имеет малую площадь, а катод большую (Sан< Sкат). В этом случае анод малой площадью корродирует очень интенсивно.
Для разработки мероприятий по защите конструкций от контактной коррозии необходимо руководствоваться ГОСТ 9.005-92 «Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов»
При выборе металла должны учитывать:
1. Потенциал, площадь поверхности;
2. Между деталями из разнородных металлов нужно использовать, где это возможно изолирующие прокладки, мастики, герметики;
3. На контакт сопрягаемых деталей следует наносить изолирующее покрытие.
На контакт сопрягаемых деталей следует наносить изолирующее покрытие.
Анод: Fе° — 2е Fе2+
Катод: О2 + 4е + 2Н2О 4ОН
2Fе + О2 + 2Н20 2Fе(ОН)2
4Fе(ОН)2 + О2 + 2Н2О 4Fе(ОН)3
ржавчина Fе(ОН)2 Fе(ОН)3 FеООН
2. Различная аэрация (омывание газами).
То есть это различный доступ кислорода к одной и той же детали, такая коррозия встречается по ватерлинии судов.
А: Fе° — 2е FеC
К: О2 + 4е + 2Н2О 4ОН
В центре капли, куда доступ кислорода мал, разрушается сам металл (становится эта часть поверхности анодом). По периферии, где проникновение О2 будет большим, он адсорбируется на поверхности металла и защищает его от действия электролита.
Вещества, принимающие на катоде электроны, называются деполяризаторами (вещества уменьшающие поляризацию) т.е. в данном случае кислород является деполяризатором. Наличие деполяризаторов усиливает коррозию. В качестве деполяризаторов могут быть и ионы водорода, которые при этом восстанавливаются. Поэтому понижение рН (подкисление) усиливает процесс коррозии.
В качестве деполяризаторов могут быть и ионы водорода, которые при этом восстанавливаются. Поэтому понижение рН (подкисление) усиливает процесс коррозии.
3. Неоднородность поверхности металла.
Неоднородность поверхности металла возникает в результате:
а) повреждения оксидной пленки при изгибе, прессовании.
А: А1 — Зе А1 А: Fе — 2е Fе2+(кислая среда)
К: 2Н++ 2е Н К: 2Н++ 2е Н
Коррозия с водородной деполяризацией, наличие деполяризатора для коррозии вредно. Оксидная пленка разрушается еще ионами NО3-, SО4 , Сl -ионы активаторы.
(-)А1 | Морская вода, О2 | А12О3 (+)
(-)А: А1 — Зе А1
(+)К: О2 + 2Н2О + 4е 4ОН
4А1 + ЗО2 + 6Н2О 4А1(ОН)3
б) Неоднородность металлов и сплавов.
Рассмотрим, контакт двух форм стали, цементита (Fе3С) со
значительным содержанием углерода и перлита с меньшим содержанием углерода. В связи с тем, что потенциал перлита меньше потенциала цементита, в образовавшемся гальваническом элементе протекают реакции. Содержание углерода может уменьшаться в около шовной зоне после сварки.
Содержание углерода может уменьшаться в около шовной зоне после сварки.
(-)перлит | морская вода | цементит (+)
(+) анод Fе° — 2е
катод О2 + 4е + 2Н2О 4ОН
2Fе + О2 + 2Н2О 2Fе(ОН)2
в) Неоднородная обработка металла.
Плохо обработанная поверхность металла – анод, хорошо обработанная — катод. Поэтому, изделия находящиеся в агрессивных средах, должны иметь одинаковую обработку поверхности.
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ или неметаллические включения. Например, железо загрязнено примесями меди. При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
|
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует. Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т. е. меньше рН), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой. Переход металла в пассивное состояние чаще объясняется образованием на его поверхности хемосорбированного слоя атомов кислорода. При этом атомы кислорода могут покрывать как всю поверхность металла, так и часть ее. Пассивации благоприятствуют легирование более легко пассивирующимся металлом, увеличение концентрации пассиваторов около поверхности металла и другие факторы.
В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой. Переход металла в пассивное состояние чаще объясняется образованием на его поверхности хемосорбированного слоя атомов кислорода. При этом атомы кислорода могут покрывать как всю поверхность металла, так и часть ее. Пассивации благоприятствуют легирование более легко пассивирующимся металлом, увеличение концентрации пассиваторов около поверхности металла и другие факторы.
Защитная пленка всегда имеется на поверхности алюминия. Подобные пленки в сухом воздухе образуются также на Ве, Сг, Zn, Та, Ni, Сu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
В первую очередь будут растворяться напряженные участки металла.
Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
Похожие статьи:
poznayka.org
Электрохимическая коррозия — это… Что такое Электрохимическая коррозия?
Электрохимическая коррозия Electrochemical corrosion — Электрохимическая коррозия.
Коррозия, вызванная потоком электронов между катодной и анодной областями металлической поверхности.
(Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО «Профессионал», НПО «Мир и семья»; Санкт-Петербург, 2003 г.)
.
- Electrochemical corrosion
- Electrochemical discharge machining
Смотреть что такое «Электрохимическая коррозия» в других словарях:
электрохимическая коррозия — Взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.… … Справочник технического переводчика
Электрохимическая коррозия — 14.
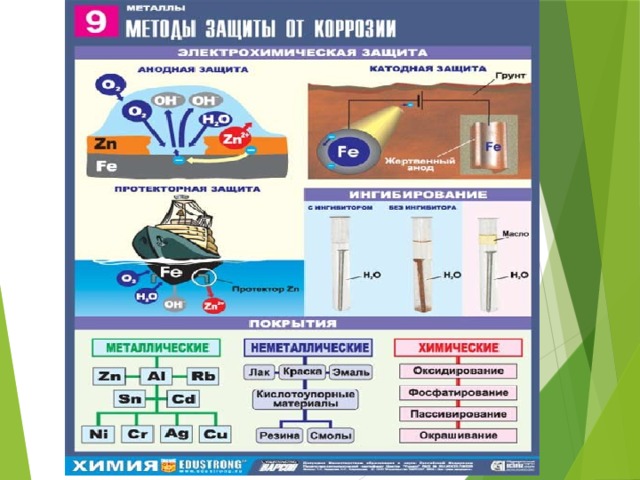 Электрохимическая коррозия Взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорости зависят … Словарь-справочник терминов нормативно-технической документации
Электрохимическая коррозия Взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорости зависят … Словарь-справочник терминов нормативно-технической документацииэлектрохимическая коррозия — elektrocheminė korozija statusas T sritis chemija apibrėžtis Metalo korozija dėl savaiminės elektrocheminės oksidacijos. atitikmenys: angl. electrochemical corrosion; galvanic corrosion rus. электрохимическая коррозия … Chemijos terminų aiškinamasis žodynas
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ — коррозия под действием электролита, при которой ионы металла переходят в раствор и происходит перенос электронов к другим участкам поверхности металла. Основным условием для Э. к. является наличие электролита. Э. к. часто наблюдается в… … Словарь по гидрогеологии и инженерной геологии
Коррозия электрохимическая — – взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорости зависят от электродного… … Энциклопедия терминов, определений и пояснений строительных материалов
Коррозия электрохимическая — Электрохимическая коррозия разрушение металла в результате взаимодействия с коррозионной средой (раствором электролита) или под действием тока от внешнего источника.
 .. Источник: ИНСТРУКЦИЯ ПО ЗАЩИТЕ ЖЕЛЕЗНОДОРОЖНЫХ ПОДЗЕМНЫХ СООРУЖЕНИЙ ОТ… … Официальная терминология
.. Источник: ИНСТРУКЦИЯ ПО ЗАЩИТЕ ЖЕЛЕЗНОДОРОЖНЫХ ПОДЗЕМНЫХ СООРУЖЕНИЙ ОТ… … Официальная терминологияКоррозия блуждающим током — – электрохимическая коррозия металла под воздействием блуждающего тока. [ГОСТ 5272 68] Рубрика термина: Виды коррозии Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги, Ав … Энциклопедия терминов, определений и пояснений строительных материалов
Коррозия внешним током — – электрохимическая коррозия металла под воздействием тока от внешнего источника. [ГОСТ 5272 68] Рубрика термина: Виды коррозии Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
Коррозия контактная — – электрохимическая коррозия, вызванная контактом металлов, имеющих разные стационарные потенциалы в данном электролите. [ГОСТ 5272 68] Рубрика термина: Виды коррозии Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
коррозия блуждающим током — Электрохимическая коррозия металла под воздействием блуждающего тока.
 [ГОСТ 5272 68] Тематики коррозия металлов … Справочник технического переводчика
[ГОСТ 5272 68] Тематики коррозия металлов … Справочник технического переводчика
Книги
- Механика разрушения, Г. П. Черепанов. Книга посвящена механике разрушения широкого класса конструкционных и природных материалов, включая металлы, композиты, горные породы, стекла, полимеры и керамические материалы. Книга состоит… Подробнее Купить за 3559 грн (только Украина)
- Механика разрушения, Черепанов Г.П.. Книга посвящена механике разрушения широкого класса конструкционных и природных материалов, включая металлы, композиты, горные породы, стекла, полимеры и керамические материалы. Книга состоит… Подробнее Купить за 3104 руб
dic.academic.ru
Что такое электрохимическая коррозия. И еще еслив сможете ответить Факторы коррозий (химическая, электрохимическая)
Взаимодействие металла с коррозионной средой (раствором электролита) , при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Электрохимическая коррозия. электрохимическая коррозия является наиболее распространенным типом коррозии металлов. По электрохимическому механизму корродируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей) . В обычных атмосферных условиях и в земле металлы корродируют также по электрохимическому механизму, т. к. на их поверхности имеются капли влаги с растворенными компонентами воздуха и земли. Электрохимическая коррозия является гетерогенным и многостадийным процессом. Ее причиной является термодинамическая неустойчивость металлов в данной коррозионной среде. Учение о электрохимической коррозии ставит главный вопрос — вопрос о скорости коррозии и тех факторов, которые влияют на нее. С электрохимической точки зрения коррозия металла это не просто процесс окисления металла, т. к. этот переход должен сопровождаться сопряженно идущим восстановительным процессом. В результате ионизации освобождаются электроны и роль второго восстановительного процесса состоит в их ассимиляции подходящим окислителем (Д) , образующим устойчивое соединение Ионизация и процесс ассимиляции электронов каким либо элементом среды (обычно Н ионы или О )представляет собой электрохимический процесс. Факторы: факторы коррозии. Внутренние факторы характеризуют влияние на вид и скорость коррозии природы металла (состав, структура и т. д.) . Внешние факторы определяют влияние состава коррозионной среды и условий протекания коррозии (температура, давление и т. д.) .
Факторы: факторы коррозии. Внутренние факторы характеризуют влияние на вид и скорость коррозии природы металла (состав, структура и т. д.) . Внешние факторы определяют влияние состава коррозионной среды и условий протекания коррозии (температура, давление и т. д.) .
touch.otvet.mail.ru
Определение и классификация коррозионных процессов. Химическая и электрохимическая коррозия
При эксплуатации изделий из металлов и их сплавов приходится сталкиваться с явлением разрушения их под действием внешней среды. Разрушение металлов и сплавов вследствие взаимодействия их с окружающей средой называется коррозией.
Коррозия металлов наносит большой экономический ущерб. В результате коррозии выходят из строя оборудование, машины, механизмы, разрушаются металлические конструкции. Особенно сильно подвёргается коррозии оборудованиё, которое контактирует с агрессивными средами, например, растворами кислот, солей.
Коррозионное разрушение может затрагивать всю поверхность металла — сплошная (общая) коррозия, или отдельные участки — местная (локальная) коррозия. В зависимости от механизма процесса различают химическую и электрохимическую химическую коррозию.
Химическая коррозия — это разрушение металла из-за окисления его окислителями, находящимися в коррозионной среде.
Химическая коррозия протекает без возникновения электрического тока в системе. Такой вид коррозии возникает при контакте металлов с неэлектролитами или в газовой среде при высоких температурах (газовая коррозия).
Газовая коррозия встречается довольно часто. С ней мы сталкиваемся при коррозии металлов в печах, выхлопных трубах и т. п. Наиболее опасными для металлов компонентами газовой среды являются кислород, пары воды, оксид углерода (IV), оксид серы (IV). Коррозионное разрушение железа и его сплавов на воздухе обусловлено окислением его кислородом воздуха.
п. Наиболее опасными для металлов компонентами газовой среды являются кислород, пары воды, оксид углерода (IV), оксид серы (IV). Коррозионное разрушение железа и его сплавов на воздухе обусловлено окислением его кислородом воздуха.
С повышением температуры скорость газовой коррозии возрастает. Наибольший вред приносит электрохимическая коррозия.
Электрохимической коррозией называется разрушение металла при контакте с электролитами с возникновением в системе электрического тока.
Коррозия — это разрушение металлов в результате химической и электрохимической реакции.
Разрушение (порча), происходящие по физическим причинам не называются коррозией, а известно как эрозия или истирание или износ.
Термин «коррозия» относится только к химическому воздействию на металлы и не распространяется на неметаллические материалы. Пластмассы могут набухать, трескаться; дерево — расслаиваться или гнить.
Ржавление — коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из оксидов железа (гидратированных).
Цветные металлы, следовательно, корродируют, но не ржавеют.
Коррозионная наука.
Так как коррозия включает химическое превращение, для лучшего понимания коррозионных реакций необходимо знать основы химии и особенно электрохимии, так как коррозионные процессы по большой части являются электрохимическими.
Так как структура и состав металла зачастую определяют коррозионное поведение, надо быть знакомым с основами металлургии. Следовательно, химия и металлургия составляют фундамент при изучении коррозии, так же как биология и химия — при изучении медицины.
Коррозионная проблема.
Значение коррозионных исследований определяется тремя аспектами:
1 . Экономический.
Имеет целью уменьшение материальных потерь в результате коррозии трубопроводов, котлов, судов, мостов.
2. Повышение надежности оборудования.
Оборудование в результате коррозии разрушается с катастрофическими последствиями, например: сосуд высокого давления, паровые котлы, контейнера для токсичных материалов.
3. Сохранность металлического фонда.
Мировые ресурсы металла ограниченны, а потери в результате коррозии ведут к дополнительным затратам энергии и воды. И человеческий труд, затрачиваемый на проектирование и реконструкцию.
Причины коррозии металлов:
В природе все металлы (за исключением золота, серебра, металлов платиновой группы и в меньшей степени медь и ртуть) в основном встречаются в виде минералов, таких как сульфиды, силикаты, карбонаты. Для извлечения металла минерал необходимо подвергнуть реакции восстановления, используя в качестве восстановителя какое-либо вещество
.
Химическое восстановление
Коррозия
Рис 1. Изменение во времени химической энергии при восстановлении оксидов в металлы и в ходе обратной реакции коррозии
2Fе2О3 + ЗС 4Fе + ЗСО2 (гематит)
2ZnО + С 2Zn + СО2
Из графика (рис. 1) видно, что металлический Zn энергетически менее стабилен, чем Fе и в атмосферных условиях имеет тенденцию превращаться в сложную смесь из гидроксида и основного карбоната и т.п. Однако, если ржавчина, образующаяся на стали представляет собой рыхлую массу, почти не защищает поверхность металла от проникновения Н2О и О2, то продукты коррозии Zn обладают существенными защитными свойствами, благодаря чему Zn коррозирует медленнее, чем Fе. По этой причине мягкие стали защищают Zn покрытием.
1) видно, что металлический Zn энергетически менее стабилен, чем Fе и в атмосферных условиях имеет тенденцию превращаться в сложную смесь из гидроксида и основного карбоната и т.п. Однако, если ржавчина, образующаяся на стали представляет собой рыхлую массу, почти не защищает поверхность металла от проникновения Н2О и О2, то продукты коррозии Zn обладают существенными защитными свойствами, благодаря чему Zn коррозирует медленнее, чем Fе. По этой причине мягкие стали защищают Zn покрытием.
Типы коррозионных разрушений:
I. По характеру изменения поверхности металла или степени изменения физико-механических свойств.
Различают 5 основных типов коррозии:
1. Равномерная (общая или сплошная) — ржавление железа или потускнение серебра, высокотемпературное окисление металлов.
Скорость равномерной коррозии выражают в разных единицах мм/год или г/м2сутки. Например, сталь в морской воде коррозирует с постоянной скоростью ~ 0,13 мм/год, т.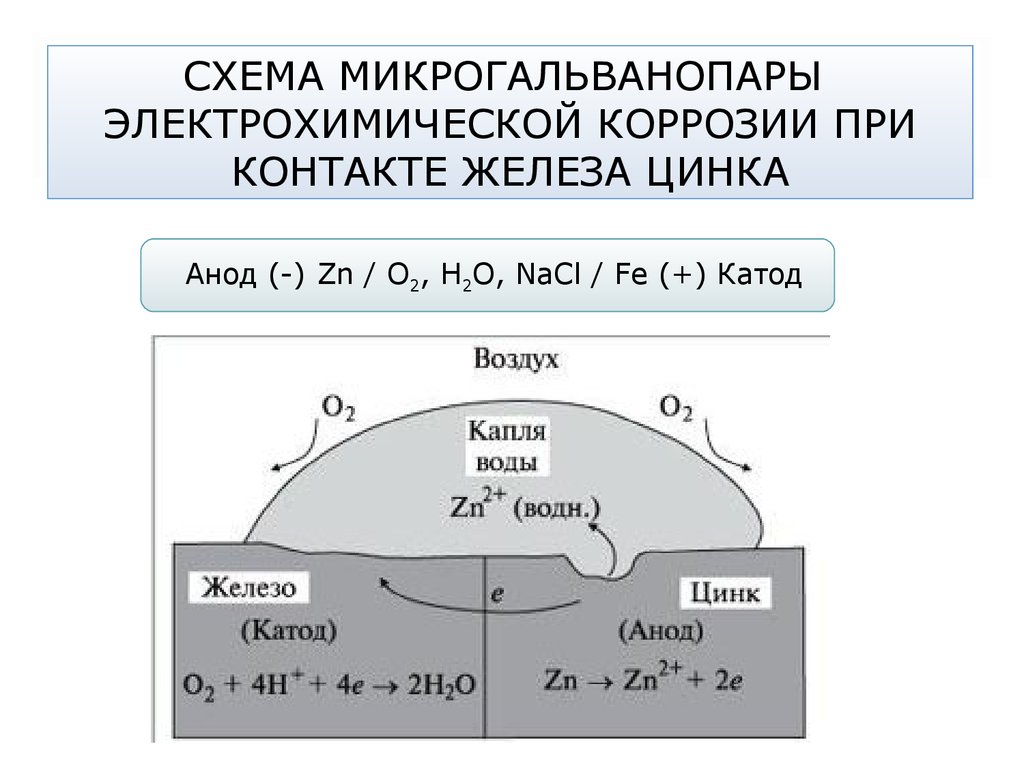 е. 2,5 г/м2сутки.
е. 2,5 г/м2сутки.
2. Местная коррозия — разрушение отдельных участков поверхности металла. Она имеет неодинаковую степень разрушения. Наиболее характерными видами местной коррозии являются коррозия в виде пятен, язв, точечная, межкристаллическая. Местная коррозия бывает трех типов:
а) точечная (питинг) — разрушает металл в виде отдельных точечных поражений, перерастающих в сквозные (коррозия нержавеющей стали в морской воде).
б) межкристаллическая коррозия (МКК) — это разрушение на границах зерен, приводящие к потери прочности и пластичности
Межзеренное вещество, действующее как анод, контактирующее с большой поверхностью самих зерен, являющейся катодом. Коррозия протекает быстро, глубоко проникая в металл и приводя иногда к катастрофическим разрушениям. Нержавеющие стали или дюраль подвергнутые неправильной термообработке, склонны к (МКК) в зонах сварки.
в) транскристаллитная — рассекающая металл трещиной прямо через зерна. Растрескивание металла под действием периодических или растягивающих напряжений в коррозионной среде называют коррозионной усталостью.
3. Избирательная — коррозия, которой подвержены сплавы, содержащие несколько структурных составляющих.
4. Обесцинкование — это вид разрушения цинковых сплавов, например латуни, при котором преимущественно корродирует цинк, а медь остается на поверхности в виде пористого слоя. Прокорродировавшее, таким образом, изделие нередко сохраняет исходную форму и может показаться не поврежденными, но его прочность и особенно пластичность значительно снижены.
Подвергшаяся обесцинкованию латунная труба способна выдерживать внутреннее давление воды, однако разрушиться при гидравлическом ударе или проведении ремонтных работ.
5. Разрушение окисных пленок на поверхности металлов. При повреждении пленки А12Оз на алюминиевом изделии, находящемся в морской воде, возникает электролит .
Различные внутренние механические напряжения напр. < ненапр. Поэтому в первую очередь будут растворяться напряженные участки металла. Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
II. По механизму реакции взаимодействия с окружающей средой различают:
1. Химическую.
2. Электрохимическую.
Особо выделяют биологическую коррозию идущую под влиянием продуктов жизнедеятельности бактерий и микроорганизмов и радиационную коррозию, протекающую под воздействием радиоактивного излучения.
Электрохимическая коррозия — это разрушение металлов и сплавов под действием жидкостей электролита. Электрохимическая коррозия осуществляется как гальванический процесс за счет разности электрохимических потенциалов различных частей изделия, если оно сделано из разных металлов или за счет разности потенциалов различных участков поверхности одного и того же металла, если он находится в различных концентрациях электролита.
В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому). При этом в результате взаимодействия металла с молекулами воды из коррозионной среды на нем протекают два процесса: окисление металла Ме (анодный процесс) и восстановление окислителей — компонентов среды (катодный процесс). Как правило, в качестве окислителей выступают ионы водорода (коррозия с водородной деполяризацией) или растворенный в воде кислород (коррозия с кислородной деполяризацией). В первом случае при катодном процессе выделяется водород, а во втором образуются гидроксид ионы. Участки поверхности металла, на которых протекают процессы окисления и восстановления, называют соответственно, анодными и катодными. Далее рассмотрим условия, при которых возможно протекание электрохимической коррозии.
Условия возникновения электрохимической коррозии:
1. Контакт двух металлов в электролите.
А: Ме1° — 2е Ме
К: 1) 2Н++ 2е Н2, если рН < 7 (среда кислая)
2) О2 + 2Н2О + 4е 4ОН (среда нейтральная)
При контакте двух разнородных металлов образуется гальванопара в которой разрушается более активный металл. Наибольшая коррозия вблизи места контакта и по мере удаления ослабевает. При этом большую роль играет электропроводность среды. Интенсивность коррозии зависит от разности потенциалов между металлами более активный разрушается тем быстрее, чем больше разность потенциалов контактирующих металлов. Большое влияние оказывает соотношение площадей контактирующих поверхностей. Это связано с тем, что V коррозии определяется не только силой тока, но и плотностью тока (i) i=I/S. Поэтому опасно такое сочетание металла, при котором анод имеет малую площадь, а катод большую (Sан< Sкат). В этом случае анод малой площадью корродирует очень интенсивно.
Наибольшая коррозия вблизи места контакта и по мере удаления ослабевает. При этом большую роль играет электропроводность среды. Интенсивность коррозии зависит от разности потенциалов между металлами более активный разрушается тем быстрее, чем больше разность потенциалов контактирующих металлов. Большое влияние оказывает соотношение площадей контактирующих поверхностей. Это связано с тем, что V коррозии определяется не только силой тока, но и плотностью тока (i) i=I/S. Поэтому опасно такое сочетание металла, при котором анод имеет малую площадь, а катод большую (Sан< Sкат). В этом случае анод малой площадью корродирует очень интенсивно.
Для разработки мероприятий по защите конструкций от контактной коррозии необходимо руководствоваться ГОСТ 9.005-92 «Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов»
При выборе металла должны учитывать:
1. Потенциал, площадь поверхности;
2. Между деталями из разнородных металлов нужно использовать, где это возможно изолирующие прокладки, мастики, герметики;
3. На контакт сопрягаемых деталей следует наносить изолирующее покрытие.
На контакт сопрягаемых деталей следует наносить изолирующее покрытие.
Анод: Fе° — 2е Fе2+
Катод: О2 + 4е + 2Н2О 4ОН
2Fе + О2 + 2Н20 2Fе(ОН)2
4Fе(ОН)2 + О2 + 2Н2О 4Fе(ОН)3
ржавчина Fе(ОН)2 Fе(ОН)3 FеООН
2. Различная аэрация (омывание газами).
То есть это различный доступ кислорода к одной и той же детали, такая коррозия встречается по ватерлинии судов.
А: Fе° — 2е FеC
К: О2 + 4е + 2Н2О 4ОН
В центре капли, куда доступ кислорода мал, разрушается сам металл (становится эта часть поверхности анодом). По периферии, где проникновение О2 будет большим, он адсорбируется на поверхности металла и защищает его от действия электролита.
Вещества, принимающие на катоде электроны, называются деполяризаторами (вещества уменьшающие поляризацию) т.е. в данном случае кислород является деполяризатором. Наличие деполяризаторов усиливает коррозию. В качестве деполяризаторов могут быть и ионы водорода, которые при этом восстанавливаются. Поэтому понижение рН (подкисление) усиливает процесс коррозии.
3. Неоднородность поверхности металла.
Неоднородность поверхности металла возникает в результате:
а) повреждения оксидной пленки при изгибе, прессовании.
А: А1 — Зе А1 А: Fе — 2е Fе2+(кислая среда)
К: 2Н++ 2е Н К: 2Н++ 2е Н
Коррозия с водородной деполяризацией, наличие деполяризатора для коррозии вредно. Оксидная пленка разрушается еще ионами NО3—, SО4 , Сl -ионы активаторы.
(-)А1 | Морская вода, О2 | А12О3 (+)
(-)А: А1 — Зе А1
(+)К: О2 + 2Н2О + 4е 4ОН
4А1 + ЗО2 + 6Н2О 4А1(ОН)3
б) Неоднородность металлов и сплавов.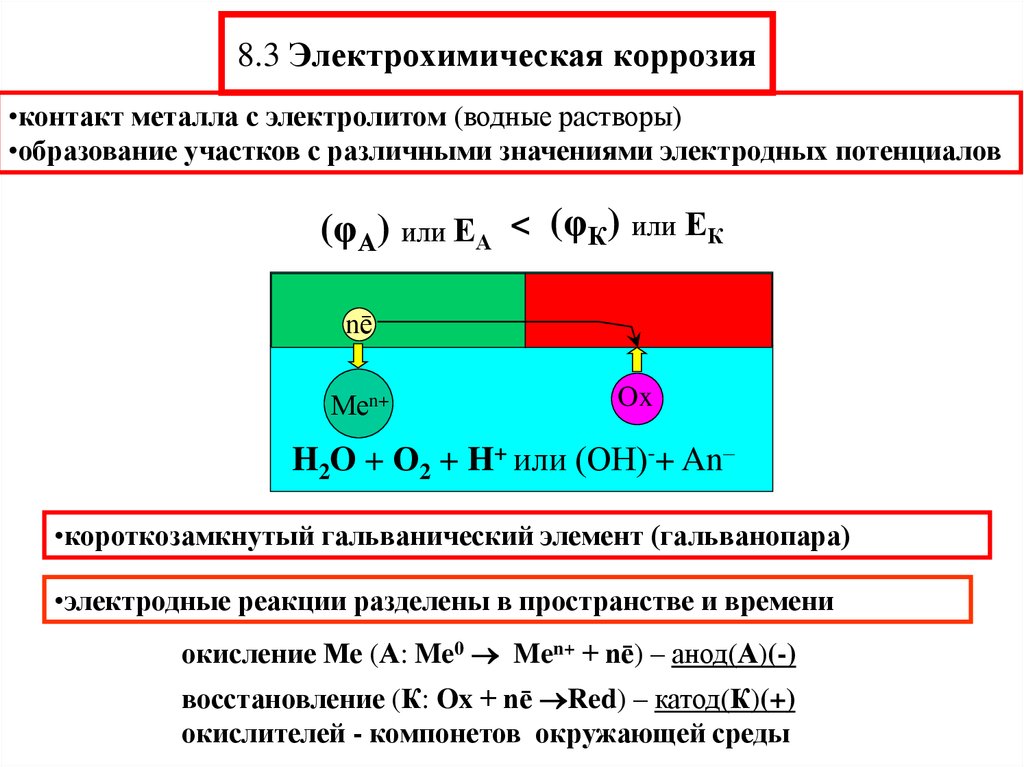
Рассмотрим, контакт двух форм стали, цементита (Fе3С) со
значительным содержанием углерода и перлита с меньшим содержанием углерода. В связи с тем, что потенциал перлита меньше потенциала цементита, в образовавшемся гальваническом элементе протекают реакции. Содержание углерода может уменьшаться в около шовной зоне после сварки.
(-)перлит | морская вода | цементит (+)
(+) анод Fе° — 2е
катод О2 + 4е + 2Н2О 4ОН
2Fе + О2 + 2Н2О 2Fе(ОН)2
в) Неоднородная обработка металла.
Плохо обработанная поверхность металла – анод, хорошо обработанная — катод. Поэтому, изделия находящиеся в агрессивных средах, должны иметь одинаковую обработку поверхности.
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ или неметаллические включения. Например, железо загрязнено примесями меди. При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
|
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует. Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т. е. меньше рН), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой. Переход металла в пассивное состояние чаще объясняется образованием на его поверхности хемосорбированного слоя атомов кислорода. При этом атомы кислорода могут покрывать как всю поверхность металла, так и часть ее. Пассивации благоприятствуют легирование более легко пассивирующимся металлом, увеличение концентрации пассиваторов около поверхности металла и другие факторы.
Защитная пленка всегда имеется на поверхности алюминия. Подобные пленки в сухом воздухе образуются также на Ве, Сг, Zn, Та, Ni, Сu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
В первую очередь будут растворяться напряженные участки металла.
Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
Дата добавления: 2016-10-26; просмотров: 1840; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Типы коррозии в самолетах
Существуют две общие классификации коррозии, которые охватывают большинство конкретных форм: прямое химическое воздействие и электрохимическое воздействие. При обоих типах коррозии металл превращается в металлическое соединение, такое как оксид, гидроксид или сульфат. Процесс коррозии включает в себя два одновременных изменения: металл, подвергшийся воздействию или окислению, подвергается так называемому анодному изменению, а коррозионное вещество восстанавливается и рассматривается как претерпевающее катодное изменение.
Прямая химическая атака
Прямая химическая атака или чисто химическая коррозия – это атака, возникающая в результате прямого воздействия на голую поверхность едких жидких или газообразных веществ. В отличие от электрохимического воздействия, при котором анодные и катодные изменения происходят на измеримом расстоянии друг от друга, изменения при прямом химическом воздействии происходят одновременно в одной и той же точке. Наиболее распространенными агентами, вызывающими прямое химическое поражение самолетов, являются: пролитая аккумуляторная кислота или пары аккумуляторов; остаточные отложения флюса в результате недостаточно очищенных, сварных, паяных или паяных соединений; и захваченные едкие чистящие растворы. [Рисунок 1]
Рисунок 1. Прямая химическая атака в аккумуляторном отсеке меньше проблем. Использование этих закрытых блоков снижает опасность разлива кислоты и паров батареи. Многие типы флюсов, используемых при пайке твердым припоем и сварке, вызывают коррозию, химически разрушая металлы или сплавы, с которыми они используются. Поэтому важно удалять остатки флюса с поверхности металла сразу после операции соединения. Остатки флюса гигроскопичны по своей природе, поглощают влагу и, если их тщательно не удалить, имеют тенденцию вызывать сильную точечную коррозию. Очищающие растворы щелочи в концентрированной форме хранят плотно закрытыми и как можно дальше от самолетов. Некоторые чистящие растворы, используемые для удаления коррозии, сами по себе являются потенциально коррозионными агентами. Поэтому особое внимание должно быть направлено на их полное удаление после использования на летательных аппаратах. Там, где вероятно улавливание чистящего раствора, используйте неагрессивное чистящее средство, даже если оно менее эффективно. Электрохимическая атака Коррозия – это естественное явление, при котором металл подвергается химическому или электрохимическому воздействию, превращая его обратно в металлическое соединение.
Устранение любого из этих условий останавливает электрохимическую коррозию. ПРИМЕЧАНИЕ. Краска может маскировать начальные стадии коррозии. Поскольку продукты коррозии занимают больший объем, чем исходный металл, окрашенные поверхности необходимо часто осматривать на наличие неровностей, таких как вздутия, чешуйки, сколы и комки.
Электрохимическую атаку химически можно сравнить с электролитической реакцией, которая происходит при гальванике, анодировании или в сухих батареях. Все металлы и сплавы электрически активны и имеют определенный электрический потенциал в данной химической среде. Этот потенциал обычно называют «благородством» металла. [Рисунок 3] Чем менее благороден металл, тем легче он подвергается коррозии. Металлы, выбранные для использования в конструкциях самолетов, представляют собой продуманный компромисс прочности, веса, коррозионной стойкости, технологичности и стоимости, сбалансированный с потребностями конструкции.
Составляющие сплава также имеют определенные электрические потенциалы, которые обычно отличаются друг от друга. Воздействие на поверхность сплава проводящей коррозионной среды приводит к тому, что более активный металл становится анодным, а менее активный — катодным, что создает условия для коррозии. Они называются локальными ячейками. Чем больше разница в электрическом потенциале между двумя металлами, тем серьезнее коррозионная атака, если создать надлежащие условия. Условиями для этих коррозионных реакций являются наличие проводящей жидкости и металлов, имеющих разность потенциалов. Если путем регулярной очистки и повторной отделки поверхности удалить среду и устранить мельчайшую электрическую цепь, коррозия не может возникнуть. Это основа эффективной борьбы с коррозией. Электрохимическая атака является причиной большинства форм коррозии конструкции и компонентов самолета. СВЯЗАННЫЕ СТАТЬИ Химические и электрохимические условия при коррозии под напряжением и коррозионно-усталостных трещинахВведение Конструкционные сплавы должны выдерживать как высокие механические нагрузки, так и агрессивные условия окружающей среды при использовании во многих областях. Следовательно, эти материалы могут быть подвержены преждевременному разрушению из-за растрескивания под воздействием окружающей среды (EAC), когда нагрузка и условия окружающей среды достаточно агрессивны. Влияние EAC на характеристики и срок службы конструкционных сплавов можно увидеть во многих областях, таких как нефть и газ, ядерная энергетика, хранение ядерных отходов и аэрокосмическая промышленность. Например, несколько обзоров структурных отказов самолетов и инспекций по разборке пришли к выводу, что усталость и коррозия преобладают в отказах аэрокосмических компонентов 1, 2 с 78% мест коррозионных повреждений, выявленных при разборке, с образованием усталостных трещин. Хотя механизм, с помощью которого происходит ЭАС, анодное растворение, разрыв пленки, растрескивание, усиленное водородом, и испускание дислокаций, вызванное адсорбцией, все еще обсуждается в конструкционных сплавах, особенно для некоторых комбинаций систем материалов и окружающей среды, обычно существуют две вещи. принято: (1) химические и электрохимические условия объемной среды не поддерживаются вниз по трещине, особенно в вершине, и (2) именно напряженное состояние и химические/электрохимические условия, локальные к вершине трещины, контролируют ЭАС, как для статических и монотонно возрастающих нагрузок, таких как коррозионное растрескивание под напряжением (SCC), и циклических нагрузок, таких как коррозионная усталость (CF). Существует несколько математических моделей для оценки химических и электрохимических условий в вершине трещины, 4,5,6,7,8,9,10 , но подавляющее большинство этих моделей было разработано для никелевых и стальных сплавов. Были предприняты экспериментальные попытки измерить химию вершины трещины EAC и электрохимию. 5, 8, 11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26 Хотя унифицированная экспериментальная экспериментальные данные подтверждают теорию о том, что условия в вершине трещины закрыты и не очень хорошо представлены объемной средой. Уже существует несколько обзорных статей по химии вершины трещины и электрохимии SCC, CF или EAC в целом. 27,28,29,30 Самый последний и подробный обзор был написан Тернбуллом в 2001 году и в основном посвящен моделированию. 28 Еще один краткий вводный обзор высокого уровня был написан Тернбуллом в 2013 году, 29 , но в основном представляет собой описание текущего состояния понимания и того, что требуется для углубления знаний в области химии крекинга и электрохимии. Другие обзоры сосредоточены на экспериментах и моделировании, но либо представляют только информацию о pH и электрохимическом потенциале (E) 27 и/или сосредоточиться только на одной системе сплавов и комбинации окружающей среды. Химические/электрохимические реакции, поддерживающие EAC На рисунке 1 представлена общая схема, описывающая химические и электрохимические условия для EAC. В целом ожидается, что область, ближайшая к вершине трещины, в первую очередь поддерживает кинетику анодной реакции, в то время как жирная поверхность и стенки трещины, ближайшие к устью трещины, в основном поддерживают кинетику катодной реакции. Предположение о том, что анодные реакции происходят преимущественно на вершине трещины или вблизи нее, подтверждается тем фактом, что по прогнозам трещина быстро обедняется кислородом по сравнению с объемной средой. 28, 31, 32 В типичных водных электролитах основной катодной реакцией является реакция восстановления кислорода (ORR), которая первоначально может происходить где угодно, но реакции вдоль стенок трещины быстро поглощают и истощают O 2 внутри трещины. Рис. 1 Схема трещины EAC с соответствующими химическими и электрохимическими реакциями и местами реакций. Показано, что химические соединения схематически представляют все обсуждаемые здесь факторы, которые могут создавать непроницаемую среду в вершине трещины, обедненной кислородом 9.0120 2 и сконцентрированы в катионах и анионах Полный размер изображения Предполагается, что анодные реакции, происходящие в вершине трещины или вблизи нее, представляют собой преимущественно анодное растворение, особенно растворение основного элемента. Из-за высоких концентраций ионов металлов в растущих трещинах EAC гидролиз катионов металлов может происходить в среде, близкой к вершине трещины. На рисунке 1 показана типичная реакция гидролиза ионов металлов, и легко увидеть, что гидролиз может иметь большое влияние на pH в трещине, как будет обсуждаться позже. Прямое измерение гидролиза катионов металлов вблизи вершины трещины невозможно, но низкие значения pH, которые будут обсуждаться в следующем разделе, подтверждают, что это происходит. Кроме того, все усилия по моделированию учитывают гидролиз катионов металлов и подтверждают его протекание. Рассмотрение и лечение любых катодных реакций внутренней трещины затруднено. Как правило, в большинстве моделей пренебрегают катодными реакциями, происходящими в среде трещины. Потенциал трещины и pH Исследования показали, что потенциал вершины трещины (E tip ) и pH отличаются от указанных на жирной поверхности. Рис. 2 Схематическое изображение ожидаемого состояния вершины трещины (r ed пунктирная линия ) для алюминиевого сплава. Потенциал по сравнению с электродом SHE. Черная сплошная линия представляет собой реакцию обратимого выделения водорода. Полноразмерное изображение Потенциал В условиях свободной коррозии наконечник E отличается от потенциала жирной поверхности из-за разницы концентраций O 2 и падения ИК-излучения, вызванного высоким анодным током и ионным концентрации в вершине трещины (как ионов металлов из-за растворения, так и анионов из соображений массопереноса, которые будут обсуждаться позже). Ограниченное исследование также установило, что наконечник E является относительно неполяризуемым в зависимости от объемных изменений раствора (т. е. pH, концентрации O 2 , состава электролита и т. д.), когда другие факторы, контролирующие массоперенос, остаются постоянными. Для стали с 3% NiCrMoV, погруженной в моделируемый паровой конденсат при температуре 90 °C, изменение объемного pH и концентрации Cl- мало повлияло на наконечник E . 26 Кроме того, это же исследование показало, что, несмотря на увеличение потенциала поверхностной коррозии жирным шрифтом с увеличением объема O 2 от примерно 0,1 ppb до более 1000 ppb потенциал вершины трещины оставался относительно постоянным с максимальным изменением ~ 90 мВ. 26 Это означает, что хотя падение потенциала ΔE будет изменяться в зависимости от объемной концентрации O 2 ; это происходит только из-за изменений коррозионного потенциала жирной поверхности. Несколько исследователей смоделировали и/или экспериментально определили E вершину и/или ∆E как функцию анодной и катодной поляризации и установили, что вершина трещины не поляризуется, а это означает, что ∆E будет становиться более сильным по мере поляризации. увеличивается. Для CF из стали BS 4360 марки 50D, погруженной в искусственную морскую воду ASTM, изученную Тернбуллом и Феррисом, 4, 8 ∆E увеличилось с ~ 20 мВ (E равно −800 мВ SCE , что приблизительно равно OCP) 4 до ~ 146 мВ, когда -500 мВ SCE нанесли на полужирную поверхность 8 . Катодная поляризация также была исследована Тернбуллом и Феррисом с аналогичными результатами; ∆E увеличилось с ~ 20 мВ до ~ 215 мВ при приложенном потенциале −1200 мВ SCE . Важно отметить, что глубина трещины играет роль. Приведенный выше анализ обычно предполагает длинную трещину. Моделирование и ограниченные экспериментальные усилия подтверждают, что ∆E в небольших очень коротких трещинах (~ 0,2 см и ниже). 4, 8 pHpH в/около вершины трещины определяется балансом между концентрацией ионов металла в результате растворения и гидролиза в вершине трещины, массопереносом и поляризацией трещины (анодной или катодной, которая определяет степень анодных и катодных реакций, протекающих в среде трещины). Таким образом, обычно верно, что объемный рН не оказывает существенного влияния на рН вершины трещины, если только не происходит значительного конвективного перемешивания, как будет обсуждаться в разделе о массопереносе. Здесь будет обсуждаться рН вершины трещины, когда влияние адвекции минимально. В результате высокой концентрации ионов металла в вершине трещины или вблизи нее и последующего гидролиза вершина трещины в условиях свободной коррозии становится кислой, что легко увидеть на примере общей реакции гидролиза, показанной на рис. Кроме того, Смит показал, что pH кончика трещины 3,5–3,9на него не влияли изменения объемного рН путем изменения объемного рН от 2 до 10 путем добавления HCl и NaOH. В целом, экспериментальные данные для сплавов на основе Al и Fe согласуются с предсказаниями модели, устанавливая, что баланс между концентрацией ионов металла и гидролизом контролирует рН вершины трещины и устанавливает кислую среду в вершине трещины в условиях свободной коррозии. Важно отметить, что Тернбулл и соавторы с помощью моделирования и экспериментов показали, что заметно кислый pH вершины трещины в условиях свободной коррозии не развивается для низколегированной стали в морской воде 4, 8, 20, 28 , как можно предположить на основании предыдущего обсуждения. Это связано с ограничением подкисления, основанным на обратимости Fe-электрода, что способствует увеличению кинетики катодной реакции, в частности, восстановлению H + в трещине, противодействующей гидролизу. 4, 8, 20, 28 Хотя Тернбулл и Феррис 8 действительно наблюдали снижение pH вершины трещины с увеличением анодной поляризации, что согласуется с тенденциями и прогнозами, описанными ниже, самое низкое наблюдаемое значение pH было 7,8 при приложенном анодном потенциале. Оба Nguyen et al. и Купер и др. пришли к выводу, что рН вершины трещины контролируется концентрацией Al 3+ ([Al 3+ ]) и последующим гидролизом ионов металлов. 16, 33, 48 Cooper et al. 33 пошел еще дальше, заявив, что все, что изменяет скорость производства ионов металла в вершине трещины, также меняет рН вершины трещины. Таким образом, анодная поляризация жирной поверхности должна способствовать увеличению кинетики анодной реакции в вершине трещины и, следовательно, увеличению вершины трещины [Al 3+ ] и, следовательно, вызывают все более кислую вершину трещины. Для SCC AA7075-T651, погруженного в 1 M NaCl и 1 M Na 2 SO 4 , Nguyen et al. 48 непосредственно наблюдали, что увеличение уровня применяемой анодной поляризации увеличивало вершину трещины [Al 3+ ] и кислотность вершины трещины. Работа этих авторов напрямую поддерживает общепринятую теорию о том, что высокие концентрации ионов металлов, развивающиеся из-за разделения анода (вершины трещины) и катода (устье трещины/жирная поверхность), приводят к образованию кислой вершины трещины, что приводит к восприимчивости EAC. условия и быстрый рост трещины, и все, что увеличивает концентрацию ионов металла в вершине трещины, будет действовать на снижение pH вершины трещины (до предела, определяемого балансом между гидролизом и концентрацией ионов металла) и увеличение скорости роста трещины. 16, 33, 48 Подобно тому, как анодная поляризация усиливает растворение вершины трещины, приводя к снижению рН вершины трещины и увеличению кинетики роста трещины, катодная поляризация жирной поверхности (1) увеличивает кинетику катодной реакции внутри трещина (таким образом увеличивая трещину [OH — ] и/или потребляя H + ), (2) снижает скорость анодного растворения в вершине трещины и, следовательно, (3) снижает концентрацию ионов металла в вершине трещины; таким образом, создавая менее кислую среду вершины трещины. Перенос массОсновными источниками переноса масс внутри трещины являются диффузия, миграция ионов и адвекция в результате конвективного перемешивания. Именно благодаря балансу этих трех факторов можно понять различия между состояниями вершины трещины CF и SCC. Миграция ионов Как было установлено ранее, вблизи вершины трещины могут существовать высокие концентрации ионов металлов. Несколько исследователей представили экспериментальные доказательства, подтверждающие роль миграции ионов, показав, что концентрации Cl − и других анионов в вершине трещины, присутствующие в общем растворе, превышают объемные концентрации. 11, 13, 15, 16, 21, 33 Для SCC 7050 в состояниях T651 и T7541, погруженных в 0,5 M Na 2 CrO 4 + 0,05 NaCl, концентрации были измерены в вершине трещины 8 [Cl 9008] повышен примерно на порядок по сравнению с объемом в восприимчивых к EAC температурах (400–500 мМ вблизи кончика против 50 мМ в объеме). Поскольку вершина трещины концентрируется в катионах, связанных с растворением металла, H + ионов, связанных с гидролизом металлов, и анионов для поддержания электронейтральности; состав основного электролита должен оказывать минимальное влияние на химический состав вершины трещины. Адвекция/конвекция Адвекция (или конвективное смешивание жидкости) происходит из-за общего движения жидкости в трещину и из нее и позволяет в некоторой степени смешивать трещину и объемный электролит. Для SCC адвекция обычно считается незначительной, поскольку устье трещины не открывается и не закрывается. ф Поскольку адвекция происходит из-за общего движения стенок трещины в цикле нагрузки, увеличение f позволяет увеличить вклад адвекции. По мере уменьшения f появляется больше времени для анодного растворения вершины трещины, последующего гидролиза, миграции ионов и диффузии. Следовательно, по мере уменьшения f вершина трещины становится более закрытой, и смешивание с объемной средой играет уменьшенную роль в определении состояния вершины трещины. Р Для постоянного ∆ K увеличение R дает более открытое устье трещины во время полного цикла нагружения, как показано на рис. 3, и более высокое значение K Рис. 3 Схема трещины CF с низким значением R и высоким значением R b при постоянном Δ K 90. ∆ К = К Полноразмерное изображение ∆ K При постоянном R и глубине трещины увеличение ∆ K приводит к тому, что устье трещины становится более открытым ( K Диффузия Из-за закрытого характера трещины диффузия играет меньшую роль в определении химического и электрохимического состава трещин по мере увеличения длины трещины. Меньшая длина трещины (а) (т. е. вершина ближе к поверхности, выделенной жирным шрифтом), предполагающая постоянство R , ∆K, f и глубину надреза, позволяет повысить поляризуемость и увеличить вклад диффузии из объема среде из-за уменьшения диффузионной длины. Поэтому более короткие трещины, как правило, имеют меньший ∆ E и менее закрытая среда. Существующие пробелы в знаниях Несмотря на то, что приведенный выше обзор детализирует имеющиеся на сегодняшний день знания о химических и электрохимических условиях крекинга, остаются некоторые преобладающие пробелы. Как указывалось ранее, некоторые из этих пробелов являются прямым следствием отсутствия экспериментальных данных для проверки и улучшения результатов моделирования. Непосредственное измерение химического и электрохимического состояния раствора трещины редко выполняется из-за трудностей зондирования и/или извлечения электролита из растущей трещины. Первые попытки 11, 15 использовали образцы EAC, которые были заморожены в жидком азоте сразу после тестирования. После замораживания образцы излома разламывали пополам, фильтровальную бумагу или бумагу для измерения рН помещали на поверхность излома, а поверхности излома снова скрепляли, чтобы фильтр/бумага для измерения рН могла поглотить раствор для крекинга при оттаивании. При моделировании химического состава трещин и pH обычно учитывается только гидролиз основного элемента (Al или Fe), а осаждение частиц и металлизация трещины не учитываются. Экспериментальные усилия показали, что катионы других металлов присутствуют в крекинг-электролите после растворения металла вершины трещины; и поэтому некоторые из этих катионов могут подвергаться гидролизу и влиять на рН вершины трещины. Тернбулл и др. включили гидролиз хрома в свое моделирование электрохимии трещин SCC и CF сталей в морской среде. 8, 56 В то время как предположения о скорости растворения хрома и численных решениях гидролиза затрудняли точное предсказание рН вершины трещины, авторы пришли к выводу, что растворение и гидролиз легирующих элементов могут иметь важное значение. Косвенные доказательства важности гидролиза легирующих элементов в среде трещины были отмечены Crane et al. Хотя хорошо известно, что вершина трещины становится сильно концентрированной как по катионам, так и по анионам, результирующее влияние этого не совсем хорошо изучено или отражено в моделях. Известно и показано во многих экспериментальных исследованиях SCC и CF, что пересыщение, приводящее к осаждению продуктов коррозии, происходит в окружающей среде трещины. Обобщение знаний на сегодняшний день и выводы Благодаря моделированию и экспериментам хорошо установлено, что вершина трещины закрыта и не очень хорошо представлена объемными условиями. Несмотря на то, что многое известно о химии крекинга и электрохимии на основе моделирования и экспериментальных работ, все еще существуют некоторые пробелы в знаниях, особенно в отношении понимания и моделирования эффектов концентрированных малых объемов раствора. Доступность данныхСовместное использование данных неприменимо к этой статье, поскольку во время написания этого обзора наборы данных не создавались и не анализировались. Ссылки
Загрузить ссылки Большие проблемы в исследованиях электрохимической коррозии Коррозия – это процесс разрушения или разрушения материала в результате химической реакции между материалом и окружающей средой. По сравнению с другими материалами металлы относительно активны и, вероятно, подвержены коррозии. Таким образом, исследования коррозии в основном касаются механизма повреждения и поведения различных металлов, включая черные и цветные, монокристаллы или нанокристаллы, литые или кованые, а также конструкционные или функциональные сплавы. Он естественным образом развился в различные отрасли на основе сплава (Shreir et al., 1994), такие как коррозия стали, коррозия алюминиевого сплава, коррозия никелевого сплава и т. д. Состав и микроструктура всегда являются наиболее решающими факторами в определении коррозионной стойкости. сплав. В этом аспекте критическим вопросом, который необходимо решить, является то, как на процесс коррозии влияют фазовый состав матрицы, сегрегированный легирующий элемент, структура решетки, кристаллический дефект, ориентация кристаллов, размер зерна, состав вторичной фазы, распределение интерметаллических частиц, пористость, микроструктура. Другим важным аспектом исследования коррозии является сложное влияние факторов окружающей среды на коррозию. Чувствительность коррозионного поведения к факторам окружающей среды привела к различной степени и формам повреждения металлов в различных условиях эксплуатации (Cramer and Covino, 2006). В зависимости от среды, которой подвергаются металлы, коррозию можно легко разделить на различные типы, такие как водная или неводная коррозия, коррозия окружающей среды или высокотемпературная коррозия, кислотная или щелочная коррозия и т. д. В естественной среде атмосферная коррозия, морская вода коррозия и подземная коррозия обычно по-разному воздействуют на металлы. Различные проблемы с коррозией, связанные с условиями обслуживания, также часто возникают в химической, нефтегазовой, трубопроводной, гражданской, автомобильной, аэрокосмической, военной, ядерной и медицинской отраслях. Поскольку большинство факторов окружающей среды, таких как температура, давление, химический состав, концентрация компонентов, значение pH, электрическая или теплопроводность, вязкость и т. В основе исследований коррозии лежит изучение механизма реакции материала с окружающей средой. Именно фундаментальное понимание подробных реакционных процессов, процедур и стадий, а также факторов, влияющих на них, лежит в основе науки о коррозии. Большинство проблем с коррозией в окружающей среде можно отнести к электрохимическим реакциям (Kaesche, 2003), поскольку влага и водная жидкость широко распространены в естественной среде, а электрохимическая реакция обычно протекает быстрее, чем реакции окисления-восстановления в условиях окружающей среды. Коррозионное разрушение, вызванное напряжением, во многих случаях является результатом сложных взаимодействий между напряжением и электрохимическими реакциями; напряжение резко облегчает электрохимический процесс, а последнее резко усиливает повреждающее действие первого. Изучив основные аспекты и суть науки о коррозии, никогда не следует забывать, что конечной целью исследований коррозии является минимизация коррозионного повреждения. В связи с этим большой интерес представляют все методы, способные препятствовать реакции металла с окружающей средой и эффективно замедлять коррозионный процесс. Фактически, катодная защита (Baeckmann et al., 1997), покрытие (Swaraj, 1996), обработка/модификация поверхности (Biestek and Weber, 1976) и ингибитор (Braford, 19).93) методы, которые замедляют коррозию с помощью различных механизмов, имеют долгую историю успешного уменьшения коррозионного повреждения на практике. Из приведенного выше краткого введения можно выделить следующие основные характеристики, которые практически отличают исследования коррозии от других дисциплин материаловедения и техники: (1) Коррозия возникает в сложной системе, на которую одновременно воздействуют факторы окружающей среды и металлургические параметры. . Эти взаимодействующие факторы чрезвычайно усложняют коррозионную систему. Таким образом, невозможно четко определить ключевой влияющий фактор и этап, определяющий скорость, которые управляют фундаментальной кинетикой процесса коррозии. (2) Коррозия — процесс, чувствительный ко времени. Поскольку большинство факторов окружающей среды могут заметно меняться со временем, коррозионные характеристики металла могут быть невероятно разными на разных стадиях. Даже в коррозионной системе с постоянными факторами внешней среды и строго контролируемыми начальными и граничными условиями состояние корродирующей поверхности может меняться во времени за счет растворения металла или отложения продуктов коррозии. Следовательно, различные параметры окружающей среды в сочетании со сложным влиянием факторов окружающей среды делают теоретическое предсказание коррозии чрезвычайно трудным. (3) Отсутствуют методы с высоким разрешением in situ для выявления механизма коррозии. Из-за зависимости коррозии от условий окружающей среды измерения ex situ могут не дать существенной информации о процессе коррозии или могут исказить эту информацию. Помимо этих основных характеристик исследования коррозии и вытекающих из этого трудностей, существует множество сложных вопросов, требующих решения, некоторые из которых стали серьезными препятствиями, критически препятствующими дальнейшему развитию науки о коррозии. (1) Коррозия метастабильных металлов: в то время как наука о материалах распространяется на нанотехнологии и метастабильные микроструктуры, такие как аморфные и нанокристаллические сплавы, современные принципы коррозии, основанные на традиционных кристаллических металлах, начинают сталкиваться с новыми проблемами. Понимание реакции коррозии на поверхности, состоящей из чрезвычайно высокой плотности дефектов, является новой областью в науке о коррозии. Чтобы расширить и углубить знания о коррозии и обеспечить практическое применение инновационных материалов, в первую очередь необходимо решить задачу разработки новых теорий коррозии для высокоактивированной металлической поверхности. (2) Коррозия и защита передовых технических металлов: по мере роста спроса на материалы с некоторыми весьма желаемыми свойствами несколько сплавов, которые изначально считались непригодными для некоторых применений, теперь попадают в короткий список кандидатов. (3) Подробный механизм влияния наноструктуры на коррозию: коррозионная стойкость сплава в основном определяется его поверхностными «слабыми местами». Эти активные центры на поверхности фактически представляют собой кристаллические дефекты, такие как дислокации, двойники, границы зерен, границы раздела фаз, сегрегированные легирующие элементы, осажденные интерметаллиды или примесные включения. (4) Механизм коррозии и технология предотвращения коррозии в экстремальных условиях: к экстремальным условиям относятся чрезвычайно сильные помехи электрических и магнитных полей, облучения, давления, температуры и т. д. Коррозионные повреждения в этих суровых условиях были обнаружены в ядерной, аэрокосмической , газовая / нефтяная и химическая промышленность. Однако до того, как исследователи получат in situ методы, специально разработанные для этих экстремальных условий, их понимание этого вида коррозии не может быть таким всеобъемлющим, как понимание коррозии окружающей среды. Кроме того, из-за суровых условий эксплуатации и ограниченности промышленных методов эксплуатации в этих отраслях отчаянно не хватает экономически эффективных мер по предотвращению коррозии. (5) Понимание, мониторинг и моделирование коррозии in vivo : человеческое тело представляет собой сложную самоподдерживающуюся коррозионную систему. Коррозия in vivo представляет собой процесс биодеградации, происходящий в очень хорошо контролируемой окружающей среде. Измерения коррозии на месте или мониторинг в режиме реального времени без нарушения физиологических реакций внутри человеческого тела затруднены. Сложное влияние физиологических реакций и компонентов жидкости организма на коррозию является еще одним препятствием для понимания in vivo механизм коррозии. Также маловероятно точное моделирование реальной среды in vivo путем имитации жидкости организма и физиологических реакций в лаборатории. (6) Прогнозирование коррозии в реальных условиях: в естественной среде условия спонтанной коррозии не контролируются. Более того, существует множество изменений факторов окружающей среды, которые могут влиять на коррозию, что в значительной степени усложняет коррозионный процесс. Хуже того, неизбежная жизненная деятельность в реальном мире также может влиять на процесс коррозии, что делает поведение коррозии почти непредсказуемым. Например, микробио/бактерии, колонизирующие канализационные системы, образование биопленки на морской инфраструктуре, загрязнение воздуха автомобильными выхлопами и загрязнение почвы/подземных вод бытовыми отходами могут неожиданно ускорить коррозию открытых объектов. . Непредвиденная коррозия инфраструктуры под землей, в бетоне или в воде при определенных обстоятельствах может привести к катастрофе. (7) Механизм перехода состояния поверхности: начало пассивации, инициирование питтинга и разрушение поверхностной пленки являются примерами перехода состояния поверхности. Таких поверхностных изменений на практике гораздо больше. Переход от исходной поверхности к новому стационарному состоянию является переходным процессом. Новое состояние обычно зависит от начальных условий поверхности, которые в конечном итоге могут повлиять на общее коррозионное повреждение. Например, разрыв первоначально сформированной пленки может в значительной степени повлиять на характер роста пленки на более поздней стадии; распределение точечной коррозии на поверхности металла на ранней стадии будет влиять на конечную морфологию коррозии; исходная чистота поверхности стали иногда может определять пассивность стали. (8) Разработка антикоррозионных функциональных покрытий: покрытия могут полностью изменить свойства поверхности металла, что открывает множество новых областей применения металлов. Улучшенная коррозионная стойкость или защитная способность традиционно являются важным требованием для разработки покрытий в технике предотвращения коррозии. Вообще говоря, коррозионная стойкость покрытия зависит от стабильности материала покрытия, целостности и толщины слоя покрытия и адгезии покрытия к металлам. Это также зависит от того, как покрытие реагирует на температуру, нагрузку и истирание в процессе эксплуатации. Антикоррозионное покрытие обычно представляет собой компромисс многих требований. Если новое покрытие может быть электро- или теплоизолирующим или проводящим, противоскользящим или самовыделяющим смазку, супергидрофобным или гидрофильным, избирательно адсорбирующим и поглощающим определенные виды и т. Таким образом, коррозия как процесс разрушения материала, вызванный реакцией материала с окружающей его средой, интенсивно и всесторонне исследовалась. Много достижений было сделано в отношении состава сплава и влияния микроструктуры, влияния факторов окружающей среды, механизма коррозии и методов защиты. Однако детальный механизм коррозии in situ под влиянием множества различных факторов не был всесторонне раскрыт из-за отсутствия 9 высокого разрешения.0198 in situ методы. В настоящее время самая большая трудность в исследованиях коррозии состоит в том, чтобы получить глубокое понимание процесса разложения in situ на корродирующей поверхности, скрытой коррозионной средой. Бекманн В., Швенк В. и Принц В. (1997). Справочник по катодной защите от коррозии , 3-е изд. Хьюстон, Техас: Издательство Gulf Professional. Бистек, Т., и Вебер, Дж. (1976). Электролитические и химические конверсионные покрытия . Редхилл: Portcullis Press Limited. Брафорд, SA (1993). Защита от коррозии . Лондон: Ван Рейнхольд. Крамер, С. Д., и Ковино, Б. С. младший (редакторы) (2006). Справочник по ASM, том 13C: Коррозия: окружающая среда и промышленность . Парк материалов, Огайо: ASTM International. Каеше, Х. (2003). Коррозия металлов, физико-химические основы и современные проблемы . Берлин: Спрингер. Мансфельд Ф. и Берточчи У. (ред.) (2005 г.). Коррозионные испытания и стандарты , 2-е изд. Западный Коншохокен, Пенсильвания: ASTM International. Shreir, L.L., Jarman, A.A., and Burstein, G.T. (eds) (1994). Коррозия-Том 1: Реакции металла/окружающей среды . Бостон, Массачусетс: Баттерворт Хайнеманн. Сварадж, П. (1996). Поверхностные покрытия: наука и технология , 2-е изд. Чичестер: Джон Вили и сыновья. Приборы и методы для испытаний на электрохимическую коррозию Gamry InstrumentsКомпания Gamry находится в авангарде электрохимических испытаний на коррозию с момента нашего основания в 1981 году. Наши клиенты говорят нам, что простота использования и сокращение времени сбора данных являются наиболее важными особенностями их исследований. Gamry Преимущества Преимущества Gamry Исследователи, занимающиеся высокой производительностью или выбором материалов, ищут простые в использовании и надежные системы, которые дадут им правильный ответ. Gamry уже давно известна как лидер рынка, когда речь идет о приборах для испытаний на коррозию. Все потенциостаты Gamry электрически изолированы, что позволяет проводить эксперименты на заземленных элементах, таких как автоклавы. Высокие напряжения соответствия обеспечивают достаточную мощность при работе с резистивными электролитами. Наше аналитическое программное обеспечение позволяет легко обрабатывать данные, составлять отчеты и строить диаграммы. Легко сравнивайте результаты или экспортируйте данные для обработки в другой программе. Gamry Expertise Gamry Instruments производит недорогие электрически изолированные потенциостаты для испытаний на коррозию с 19 лет.89. У нас есть самая полная библиотека методов электрохимической коррозии, включая разработанные/эксклюзивные эксперименты Gamry. Мы также готовы поделиться своим опытом с нашими клиентами. Существуют примечания по применению, которые имеют отношение к специалистам по коррозии и инженерам. У нас также есть специалисты по электрохимии, с которыми можно связаться по электронной почте или по телефону, которые разбираются в испытаниях на коррозию и могут указать вам правильное направление. Если вы новичок в исследованиях коррозии и, в частности, в электрохимических испытаниях на коррозию, вы можете начать с краткого ознакомления с нашими рекомендациями по применению методов коррозии постоянным током и подумать о том, чтобы записаться на краткий курс, подобный тому, который преподается в Университете штата Пенсильвания каждый год. лето. Для тех, кто уже знаком с процессом электрохимической коррозии, ознакомьтесь с нашими рекомендациями по применению, посвященными спектроскопии электрохимического импеданса, и рассмотрите возможность замены Rp/Ec Trend на EFM Trend. РекомендуетсяРекомендуемые системы: Стандартные ASTM G 59, G 61, F 746 или F 2129 Тестирование — интерфейс 1010B, 1010E или 5000E (одно- или многоканальные настройки в зависимости от потребности в пропускной способности), многопортовый, два Satur Электроды сравнения (один резервный). Если вы планируете проводить эксперименты с электрохимическим импедансом, вам идеально подойдут Interface 1010E, Reference 600+, Reference 3000 и Reference 3000AE. Критическая температура точечной коррозии — Любой из вышеупомянутых приборов может проводить эксперименты с критической температурой точечной коррозии, но вам также потребуется контроллер температуры TDC4 (или аналогичный), FlexCell, нагревательный кожух, двигатель мешалки и комплект мешалки. Электрохимическая коррозия Вопросы и ответыЧто такое электрохимическая коррозия? В большинстве случаев коррозия металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита. Коррозия – это химический процесс, при котором материалы портятся как часть процесса окисления. Коррозия обычно возникает, когда металл находится под нагрузкой или в анаэробной или безвоздушной среде. Ионы металлов растворяются и поглощаются деполяризатором, обычно кислородом. Почему коррозия является электрохимическим процессом? Коррозия является электрохимическим процессом, поскольку это процесс, при котором электроны перемещаются из одной области поверхности металла в другую через среду, благоприятную для ионов. Жидкость в той или иной форме обычно действует как электролит, химически реагирующий с металлическими поверхностями. Коррозия обычно происходит со скоростью, определяемой равновесием между противоположными электрохимическими реакциями. Самая медленная химическая реакция между ионами определяет скорость возникновения коррозии. Это происходит из-за тенденции металлов возвращаться в свое естественное состояние, в виде оксида или руды. Одной из реакций является анодная реакция, при которой металл окисляется, высвобождая электроны в металл. В чем разница между химической и электрохимической коррозией? Химическая коррозия возникает во влажных условиях, таких как присутствие электролита или влаги. Электрохимическая коррозия происходит при электрохимическом воздействии агрессивной среды на поверхность металла. Электрохимическая коррозия обычно протекает быстрее, чем химическая. Как правило, это более распространенное и более серьезное заболевание. Какие четыре условия необходимы для возникновения электрохимической коррозии? Четыре компонента, необходимые для электрохимической коррозии: анод, катод, электролит и путь обратного тока. Анодные и катодные реакции Анод- Электрод, на котором гальванические реакции генерируют электроны. Отрицательные ионы разряжаются — образуются положительные ионы. Катод- Электрод, принимающий электроны — разряжаются положительные ионы, образуются отрицательные ионы. Катод защищен от коррозии. В большинстве случаев коррозия металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита. Электролит — проводник, по которому протекает ток. Электролиты включают водные растворы или другие жидкости. Потенциал металла является средством, с помощью которого анодная и катодная реакции поддерживаются в равновесии. Путь обратного тока — Металлический путь, соединяющий анод с катодом. Часто это металлическая подложка. Задайте вопрос нашим специалистамЭлектрохимическая теория коррозии
Коррозия определяется как «разрушение или износ и последующая потеря металлов или сплавов в результате химического или электрохимического воздействия окружающей среды». При простой коррозии и извлечении металлов можно рассматривать как Металл Металлическая руда
Основными факторами, инициирующими коррозию металлов на поверхности воды, а также атмосферный воздух, коррозию металлов. Коррозия металла происходит либо при прямом химическом воздействии, либо при электрохимическом воздействии на металл агрессивной среды. Электрохимическая теория коррозии: Большая часть коррозии происходит на основе электрохимических реакций на поверхности металла, такой тип коррозии известен как мокрая коррозия. Электрохимическая теория коррозии может быть взята в качестве примера железа. Эти аноды и катоды образуются из-за неоднородностей на границе раздела металла и окружающей среды. Неоднородности на поверхности металла могут развиваться из-за нескольких факторов, таких как Таким образом образуются анодная и катодная зоны в присутствии коррозионной среды (например, влаги и т. д.) M Mn+ + ne- Примеры: Fe Fe2+ + 2e-
катодная реакция. Так как в катодной реакции в качестве составляющих коррозионной среды принимают участие, то они более сложны и зависят от характера окружающей среды. Наиболее распространенный тип катодной реакции: 1. Выделение водорода 2. Поглощение кислорода. Катодные реакции:
2H+ +2e- h3
2h3O + 2e- 2OH- + h3
4H+ + O2 + 4e- 2h3O
2h3O + O2 + 4e- 4OH- Ионы металла (Fe2+), выделившиеся на аноде, и некоторые анионы (OH-), образовавшиеся на катоде, диффундируют навстречу друг другу через проводящую среду и образуют продукт коррозии где-то между анодом и катод как 2Fe2+ + 4OH- 2Fe(OH)2 В окислительной среде нерастворимое Fe(OH)2 окисляется до оксида железа по следующей реакции. 4Fe (OH)2 + O2 + 2h3O 2(Fe2O3 . 3h3O) + h3 Если концентрация кислорода ограничена, то Fe(OH)2 превращается в магнитный оксид Fe и известен как черная ржавчина. 3Fe(OH)2 + ½ O2 Fe3O4.3h3O
Виды коррозии: Коррозия на металлах протекает в зависимости от природы металлов и в зависимости от видов окружающей среды по разным механизмам, дающим разные виды коррозии.
Это происходит, когда два разнородных металла соприкасаются друг с другом в агрессивной проводящей среде; возникает разность потенциалов, в результате чего возникает гальванический ток. Эти два металла отличаются своей склонностью к окислению. Металл с более низким электродным потенциалом или более активный металл действует как анод, а металл с более высоким электродным потенциалом действует как катод. Разность потенциалов является основным фактором возникновения коррозии. Анодный металл подвергается коррозии, тогда как катодный металл не подвергается воздействию. Например: Когда железо контактирует с медью, железо с более низким электродным потенциалом действует как анод и подвергается окислению, Fe Fe2+ + 2e- Где медь, имеющая более высокий электродный потенциал, действует как катод и не подвергается воздействию. Скорость гальванической коррозии зависит от разности потенциалов между анодным и катодным металлами, соотношения площадей анода и катода, факторов окружающей среды и склонности металла к пассивации и т. д. Другие, например: когда Fe контактирует с Sn, тогда Fe действует как анод, а Sn действует как катод, но когда Fe контактирует с Zn, Fe действует как катод, тогда как Zn действует как анод.
Дифференциальная аэрационная коррозия возникает, когда металлическая поверхность подвергается воздействию разной концентрации воздуха или кислорода, что приводит к возникновению гальванического элемента и инициированию коррозии. Коррозия водопровода : Это случай дифференциальной аэрационной коррозии, обычно наблюдаемой в стальных резервуарах для воды, океанских кораблях и т. д., в которых часть металла всегда находится под водой ЯЗЫЧНАЯ КОРРОЗИЯ : Питтинговая коррозия представляет собой локальную и ускоренную коррозию. Когда мелкие частицы пыли или воды и т. д. оседают на металле (например, на стали). Часть, покрытая пылью, не будет хорошо вентилируемой по сравнению с открытой поверхностью, поэтому покрытая поверхность становится анодной по отношению к открытой поверхности. В присутствии проводящей среды (влаги) коррозия начинается ниже пылевой части с образованием язвы. КОРРОЗИЯ ПОД НАПРЯЖЕНИЕМ : Коррозия металла под напряжением, образованная совместным воздействием на металл растягивающего напряжения и специфической коррозионной среды. в то время как мелкие трещины проходят через него перпендикулярно направлению растягивающего напряжения. Едкое охрупчивание: Это форма коррозии под напряжением, возникающая в котлах, работающих при высокой температуре и давлении. Очаги едкого охрупчивания на нагруженных частях котлов, таких как трещины, заклепки, изгибы, стыки и т. д. Na2CO3 + h3O 2NaOH + CO2 Щелочная вода проникает через мельчайшие трещины, щели между заклепками и соединениями за счет капиллярного действия. В трещинах вода испаряется, оставляя после себя NaOH. Концентрации NaOH на этих участках постепенно увеличиваются из-за плохой циркуляции воды. Когда концентрация NaOH достигает значения 10%, он воздействует на металл в области напряжения, растворяя его в форме ферроата натрия (Na2FeO2). Ферроат натрия подвергается гидролизу с осаждением магнетита следующим образом 3NA2FEO2 + 4H3O 6NAOH + FE3O4 + H3 6NA2FEO2 + 6H3O + O2 12NAOH + 2FE4O4 , чтобы NAOH восстанавливается в процессе, и его концентрация продолжает увеличивать поддержание требуемой среды. Таким образом, процесс коррозии приводит к образованию трещин и делает металл хрупким из-за отложения продукта. Fe (под нагрузкой)/конц. NaOH / разл. NaOH/ Fe (без стресса) Охрупчивание щелочью можно предотвратить путем добавления таких соединений, как сульфит натрия, таннин, лигнин, фосфаты и т. Факторы, влияющие на скорость коррозии : Несколько факторов, влияющих на скорость коррозии, которые можно разделить на две части
Факторы, воздействующие на металлы:
Продуктом коррозии обычно является оксид металла; характер продукта определяет скорость дальнейшего процесса коррозии.
На скорость коррозии большое влияние оказывают относительные размеры катодной и анодной областей.
Металл с низким перенапряжением водорода на поверхности более подвержен коррозии. Когда катодная реакция представляет собой тип выделения водорода с низким перенапряжением водорода, высвобождение газа h3 происходит легче, поэтому катодная реакция протекает очень быстро, что ускоряет анодную реакцию, следовательно, общий процесс коррозии протекает очень быстро. Если перенапряжение h3 высокое, катодная реакция протекает медленно, следовательно, и коррозионная реакция также замедляется.
Факторы, связанные с коррозионной средой:
Если pH находится в диапазоне от 10 до 3, то для коррозии железа необходимо присутствие кислорода. Если pH равен 3 или ниже 3, в отсутствие воздуха возникает сильная коррозия из-за непрерывного выделения h3 на катоде. Однако такие металлы, как Al, Zn и т. д., подвергаются быстрой коррозии в сильнощелочной среде.
В некоторых случаях при повышении темп. Снижение пассивности, что опять же приводит к увеличению скорости коррозии.
БОРЬБА С КОРРОЗИЕЙ: Коррозия металла – это естественный самопроизвольный процесс, при котором металл превращается в более стабильное соединение, так что борьба с коррозией является более реальной, чем предотвращение коррозии. В целом предотвращение образования гальванических элементов может контролировать коррозию.
Коррозию металлов можно контролировать, изолируя их от агрессивной атмосферы.
Металлическое покрытие: Это покрытие представляет собой нанесение защитного металла на поверхность основного металла. Метод может применяться электроосаждением, газопламенным напылением, плакированием, горячим погружением и т. д.
Одним из важных свойств этого типа покрытия является то, что даже в случае разрыва покрытия основной металл не подвергается коррозии. Гальванизация: Это процесс покрытия основного металла (железа) металлическим цинком (Zn). Этот процесс обычно осуществляется методом горячего погружения.
Лужение лучше всего объясняет катодное покрытие. Лужение: Это процесс покрытия основного металла (железа) оловом (Sn). Это может быть осуществлено методом горячего погружения. Неорганическое покрытие или поверхностное конверсионное покрытие или химическое конверсионное покрытие: При этом поверхностный слой металла в результате химических или электрохимических реакций превращается в стабильное соединение, образующее барьер между основным металлом и коррозионной средой. 1. Анодированное покрытие или анодирование : Фосфатирование : обычно получают на поверхности стали путем преобразования поверхностных атомов металла в их фосфат химическим или электрохимическим способом. Механизм фосфатирования включает следующие этапы.
Фосфатирование всегда указывается как подчеркнутое (под покрытие) перед отделкой, т.к. фосфатирование наряду с коррозионной стойкостью также придает поверхности хорошую адгезию краски. Применение: Грунтовка перед покраской кузовов автомобилей, холодильников, стиральных машин и т. д. ОРГАНИЧЕСКОЕ ПОКРЫТИЕ: Покрытие инертными органическими материалами, такими как краски и лаки, на металлической поверхности для защиты металла, обычно толщина органического покрытия составляет менее 0,4 мм. Функции органического покрытия:
К хорошему органическому покрытию предъявляются определенные требования:
ИНГИБИТОРЫ КОРРОЗИИ : Использование определенных химических веществ, известных как ингибиторы, может снизить скорость коррозии. Ингибиторы замедляют анодные или катодные реакции, образуя защитную пленку на этих участках. Ингибиторы в основном используются для обеспечения защиты систем, в которых коррозионная среда рециркулирует или удерживается в течение длительного времени, таких как двигатель внутреннего сгорания, система рециркуляции воды и т. д. АНОДНЫЕ ИНГИБИТОРЫ : К ним относятся окислители, такие как хроматы, молибдаты, вольфраматы и нитраты. Эти анионы реагируют с ионами металлов, образующимися на аноде в ходе реакции окисления, с образованием соответствующих труднорастворимых солей. Эти соединения осаждаются на анодных участках, образуя защитные пленки, что дополнительно предотвращает анодные реакции. ii) КАТОДНЫЕ ИНГИБИТОРЫ: Они могут действовать путем ингибирования катодной реакции, которая включает выделение водорода или поглощение кислорода. Если катодной реакцией является тип поглощения кислорода, затем добавляя определенный окислительный агент, такой как N2H5 (гидразин), сульфит натрия, эти соединения поглощают кислород как N2H5 + O2 N2 + 2H3O 2NA2 + O2 2NA2SO4 . Катодная защита: 1. Методы расходуемых анодов просты, имеют низкую стоимость установки и не требуют источника питания, но предполагают периодические затраты на замену израсходованных анодов. . Этот метод используется для защиты морских сооружений, резервуаров для хранения воды и других газо- или нефтепроводов. Этот метод прост, может защитить большую площадь металла с низкими затратами на техническое обслуживание, но дорог, потому что требует высокого тока. Анодная защита: При заданном диапазоне приложенного потенциала изучаются наблюдаемые изменения потенциала и соответствующие изменения тока. На начальных стадиях (AB) ток увеличивается при увеличении потенциала, что указывает на растворение металла, поэтому имеет место коррозия. Когда ток достигает критической точки (Icrit), начинается пассивация, которая происходит из-за образования оксидного слоя, и этот потенциал (Ep) называется пассивирующим потенциалом (Ep). Выше Ep вдоль BC ток уменьшается до очень малого значения, называемого пассивирующим током (Ip). Это минимальная защитная плотность тока для поддержания пассивации. В этой точке (C) увеличение потенциала не вызовет коррозии металла, поскольку металл находится в очень пассивном состоянии. Небольшой ток (Ip) достаточен для поддержания пассивности и снижения скорости коррозии. Металлическая конструкция, хранящаяся в подходящей окислительной атмосфере, действует как рабочий электрод (анод). Затем потенциал немного повышают до Ep (пассивирующий потенциал), чтобы началась первоначальная коррозия. Затем потенциал слегка увеличивают до тех пор, пока ток не уменьшится до очень малого значения (Tp), указывающего на пассивацию металла. Теперь потенциал поддерживается на постоянном уровне Ep, а ток поддерживается на уровне Ip. Преимущество этого метода заключается в том, что он требует очень малого тока, но этот метод можно применять только к пассивным металлам, таким как Ti, Ta, Al, Cr и т. д., а также с помощью этого метода скорость коррозии не может быть снижена до нуля. Этот метод обычно применяется при транспортировке кислоты.
Если вы являетесь автором приведенного выше текста и не согласны делиться своими знаниями в целях обучения, исследований и научных исследований (для добросовестного использования, как указано в законе об авторских правах США), отправьте нам электронное письмо, и мы быстро удалит ваш текст. Информация о медицине и здоровье, содержащаяся на сайте, носит общий характер и предназначена исключительно для ознакомления и по этой причине ни в коем случае не может заменить консультацию врача или квалифицированного лица на законных основаниях профессия. Тексты являются собственностью их авторов, и мы благодарим их за предоставленную нам возможность бесплатно делиться со студентами, преподавателями и пользователями Интернета. Их тексты будут использоваться только в иллюстративных образовательных и научных целях. Анализ коррозии и электрохимия — Anderson Materials Evaluation, Inc. Anderson Materials Evaluation, Inc.Принципы коррозии Коррозия возникает, когда поверхность металла вступает в реакцию с окружающей средой. Существуют определенные важные компоненты, которые необходимы для протекания реакции коррозии; анод, катод, электролит с окислителями и некоторое прямое электрическое соединение между анодом и катодом. Типичная ситуация может быть связана с куском металла, имеющим анодную и катодную области на одной поверхности. Если поверхность становится влажной, коррозия может иметь место из-за ионного обмена в поверхностном слое воды между анодом и катодом. M —› M n+ + ne – , где M — атом металла, n — количество электронов, потерянных при анодном окислении. Образовавшиеся катионы металлов (M n+ ) доступны на поверхности металла и становятся продуктами коррозии, такими как оксиды, гидроксиды и т. д. Освобожденные электроны проходят через объемный металл (или другое электрическое соединение с низким сопротивлением) к катоду, где они расходуются катодными реакциями, такими как O 2 + 2H 2 O + 4e – —> 4OH – Примеры из истории нашего анализа коррозии и испытаний:Оценка межкристаллитной коррозии на химическом заводе с помощью металлографии и химического анализа XPS Электрохимическая квалификация биомедицинских имплантируемых устройств Сталь с использованием Графическая коррозия в исследовании серого чугуна , вызванная хлоридом в почве. Эксперименты по поляризации при анализе коррозии проводятся с помощью потенциостата, управляемого компьютером. Постоянный или переменный потенциал постоянного тока (потенциостатический, потенциодинамический соответственно) или постоянный постоянный ток (гальваностатический) прикладывают к интересующему металлу, пока он погружен в электролит. |

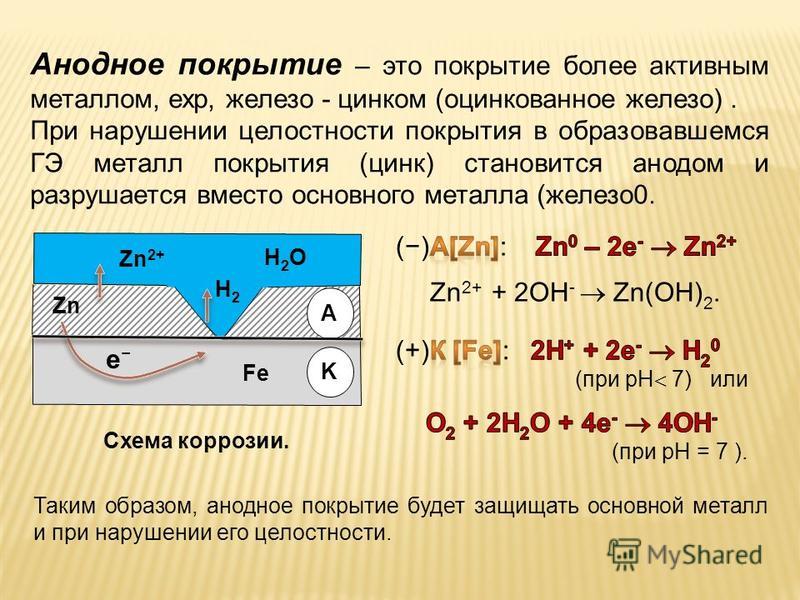

 На таких участках возможно более энергичное протекание анодного или катодного процессов, и коррозия становится гетерогенно-электрохимической.
На таких участках возможно более энергичное протекание анодного или катодного процессов, и коррозия становится гетерогенно-электрохимической. Иначе это можно представить, как вызванное протеканием тока падение напряжения между прианодным и прика-тодным слоями раствора, с учетом которого потенциал металла по отношению к прианодному слою оказывается более отрицательным, а по отношению к прикатодному — более положительным, чем по отношению к объему раствора.
Иначе это можно представить, как вызванное протеканием тока падение напряжения между прианодным и прика-тодным слоями раствора, с учетом которого потенциал металла по отношению к прианодному слою оказывается более отрицательным, а по отношению к прикатодному — более положительным, чем по отношению к объему раствора.
 2: схема действия гальванической пары
2: схема действия гальванической пары
 Следующие четыре условия должны выполняться до возникновения электрохимической коррозии. [Рисунок 2]
Следующие четыре условия должны выполняться до возникновения электрохимической коррозии. [Рисунок 2] Для реакции при этой коррозионной атаке требуется среда, обычно вода, способная проводить слабый электрический ток. Когда металл вступает в контакт с коррозионным агентом, а также связан жидким или газообразным путем, по которому проходят электроны, начинается коррозия, поскольку металл распадается в результате окисления. [Рисунок 2] Во время атаки количество коррозионного агента уменьшается и, если его не обновить или удалить, может полностью вступить в реакцию с нейтрализацией металла. Различные области одной и той же металлической поверхности имеют разные уровни электрического потенциала и, если они соединены проводником, таким как соленая вода, создают ряд коррозионных ячеек, и начинается коррозия.
Для реакции при этой коррозионной атаке требуется среда, обычно вода, способная проводить слабый электрический ток. Когда металл вступает в контакт с коррозионным агентом, а также связан жидким или газообразным путем, по которому проходят электроны, начинается коррозия, поскольку металл распадается в результате окисления. [Рисунок 2] Во время атаки количество коррозионного агента уменьшается и, если его не обновить или удалить, может полностью вступить в реакцию с нейтрализацией металла. Различные области одной и той же металлической поверхности имеют разные уровни электрического потенциала и, если они соединены проводником, таким как соленая вода, создают ряд коррозионных ячеек, и начинается коррозия.

 2 Кроме того, в 2014 году Комитет по ядерному регулированию США (NRC) опубликовал отчет, в котором делается вывод о том, что одной из двух первоочередных задач является понимание коррозионного растрескивания под напряжением (SCC) контейнеров для хранения отработавшего ядерного топлива. 3 Эти конкретные результаты, а также аналогичные результаты в других отраслях промышленности, демонстрируют важность количественной оценки и понимания синергетического вредного воздействия механических нагрузок и достаточно агрессивных сред на уровне механизма.
2 Кроме того, в 2014 году Комитет по ядерному регулированию США (NRC) опубликовал отчет, в котором делается вывод о том, что одной из двух первоочередных задач является понимание коррозионного растрескивания под напряжением (SCC) контейнеров для хранения отработавшего ядерного топлива. 3 Эти конкретные результаты, а также аналогичные результаты в других отраслях промышленности, демонстрируют важность количественной оценки и понимания синергетического вредного воздействия механических нагрузок и достаточно агрессивных сред на уровне механизма. Это утверждение верно независимо от сочетания сплава и окружающей среды, когда существует восприимчивость к EAC. В то время как напряженное состояние перед вершиной трещины хорошо установлено, химические и электрохимические условия внутри трещины точно не определены, что в значительной степени способствует отсутствию согласия в отношении механизма, контролирующего ЭАС. (Хотя установлено, что определенные условия поддерживают рост трещин, а другие сдерживают его, как будет описано здесь).
Это утверждение верно независимо от сочетания сплава и окружающей среды, когда существует восприимчивость к EAC. В то время как напряженное состояние перед вершиной трещины хорошо установлено, химические и электрохимические условия внутри трещины точно не определены, что в значительной степени способствует отсутствию согласия в отношении механизма, контролирующего ЭАС. (Хотя установлено, что определенные условия поддерживают рост трещин, а другие сдерживают его, как будет описано здесь). Поскольку непосредственное измерение химических и электрохимических условий трещины редко выполняется из-за трудностей с зондированием и/или извлечением электролита из приконтурной области, реальным ограничением в продвижении основанных на механизме моделей EAC и использовании их для прогнозирования является доступность экспериментальных данных. параметры.
Поскольку непосредственное измерение химических и электрохимических условий трещины редко выполняется из-за трудностей с зондированием и/или извлечением электролита из приконтурной области, реальным ограничением в продвижении основанных на механизме моделей EAC и использовании их для прогнозирования является доступность экспериментальных данных. параметры. 30 Эта статья дополняет эти обзоры, обобщая все, что известно на сегодняшний день о химических и электрохимических условиях в вершине трещины.
30 Эта статья дополняет эти обзоры, обобщая все, что известно на сегодняшний день о химических и электрохимических условиях в вершине трещины. Из-за ограниченной геометрии трещины и ограниченных перемещений раскрытия трещины диффузия O 2 вниз по трещине после истощения ограничена, что приводит к обедненной среде трещины O 2 . Основным последствием этого O 2 истощение заключается в создании коррозионного потенциала в вершине трещины, который является более отрицательным, чем в устье трещины/жирной поверхности; и поэтому вершина трещины анодно поляризована в условиях свободной коррозии, что приводит к разделению анода и катода, когда анодные реакции в основном происходят в вершине трещины.
Из-за ограниченной геометрии трещины и ограниченных перемещений раскрытия трещины диффузия O 2 вниз по трещине после истощения ограничена, что приводит к обедненной среде трещины O 2 . Основным последствием этого O 2 истощение заключается в создании коррозионного потенциала в вершине трещины, который является более отрицательным, чем в устье трещины/жирной поверхности; и поэтому вершина трещины анодно поляризована в условиях свободной коррозии, что приводит к разделению анода и катода, когда анодные реакции в основном происходят в вершине трещины.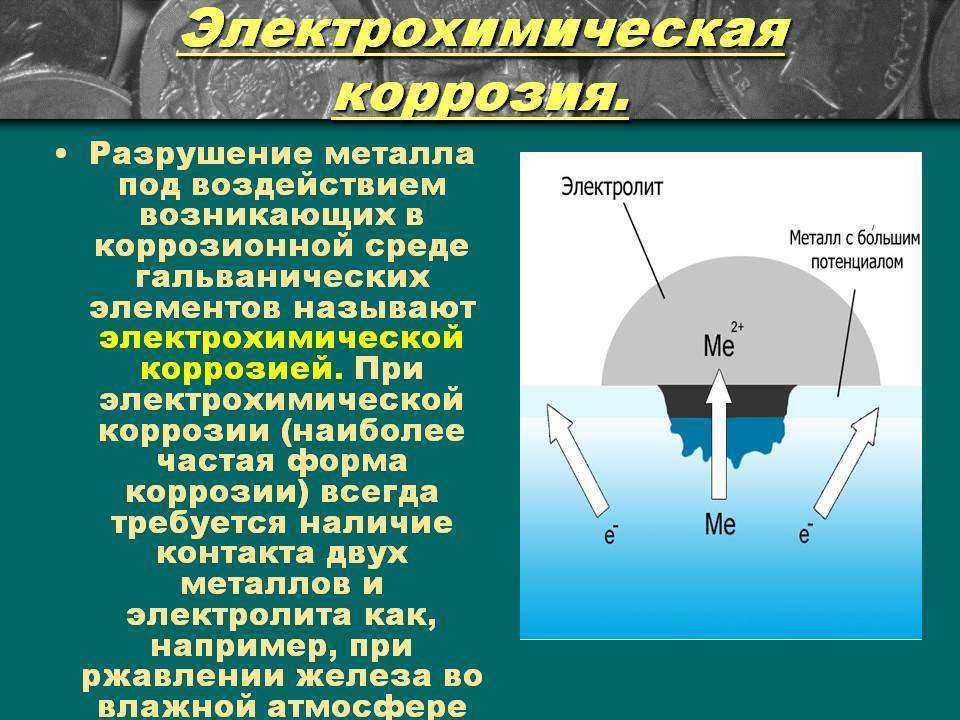 Поскольку чистое определение анодных и катодных реакций в трещине невозможно экспериментально, только измерение частиц, образующихся в результате этих реакций, таких как концентрация ионов металлов в результате анодного растворения, может использоваться для определения того, происходит ли конкретная реакция. Купер и др. 15, 16, 33 непосредственно исследовал химический состав вершины трещины SCC AA7050, сплава Al-Zn-Mg-Cu, и показал, что вершина трещины концентрируется в Al 3+ для склонных к SCC состояний. Уровни 1,5–3,5 M Al 3+ измеряли в объемном растворе 0,5 M Na 2 CrO 4 + 0,05 M NaCl. Также были обнаружены несколько повышенные концентрации Mg 2+ и Zn 2+ . Нгуен и др. также были измерены повышенные концентрации Al 3+ при свободной коррозии и анодной поляризации в трех разных электролитах (1 M NaCl: 0,25–0,4 M, 1 M Na 2 SO 4 : 0,1–0,2 M и 1 M NaNO 3 : 0,05–0,1 M).
Поскольку чистое определение анодных и катодных реакций в трещине невозможно экспериментально, только измерение частиц, образующихся в результате этих реакций, таких как концентрация ионов металлов в результате анодного растворения, может использоваться для определения того, происходит ли конкретная реакция. Купер и др. 15, 16, 33 непосредственно исследовал химический состав вершины трещины SCC AA7050, сплава Al-Zn-Mg-Cu, и показал, что вершина трещины концентрируется в Al 3+ для склонных к SCC состояний. Уровни 1,5–3,5 M Al 3+ измеряли в объемном растворе 0,5 M Na 2 CrO 4 + 0,05 M NaCl. Также были обнаружены несколько повышенные концентрации Mg 2+ и Zn 2+ . Нгуен и др. также были измерены повышенные концентрации Al 3+ при свободной коррозии и анодной поляризации в трех разных электролитах (1 M NaCl: 0,25–0,4 M, 1 M Na 2 SO 4 : 0,1–0,2 M и 1 M NaNO 3 : 0,05–0,1 M). Исследование SCC на латуни 70:30 в гидроксиде аммония выявило повышенные концентрации ионов Cu и Zn в среде трещины, 24 , в то время как другое исследование SCC различных сталей в 3,5% NaCl обнаружило высокое содержание ионов Fe и Mn в электролите трещины. 21
Исследование SCC на латуни 70:30 в гидроксиде аммония выявило повышенные концентрации ионов Cu и Zn в среде трещины, 24 , в то время как другое исследование SCC различных сталей в 3,5% NaCl обнаружило высокое содержание ионов Fe и Mn в электролите трещины. 21  Тернбулл и соавторы устанавливают важность забытых катодных реакций в среде трещины в условиях свободной коррозии, а также катодной поляризации. 4, 8, 20, 28 Как будет объяснено при обсуждении pH, увеличение количества катодных реакций, особенно восстановление H + , встречающиеся в среде трещины, могут привести к более нейтральному pH. Это становится все более важным при катодной поляризации. Кроме того, любой H, образующийся вблизи вершины трещины в результате катодных реакций, который поглощается металлом, может ускорить растворение, как это было обнаружено для сталей. 34 Для механизма водородного крекинга (HEAC), 35,36,37,38,39,40,41,42,43,44,45,46,47 восстановление вблизи вершины трещины критически важно для EAC, так как H поглощается после катодного восстановления H + , который предлагается для охрупчивания металлов, приводящего к EAC.
Тернбулл и соавторы устанавливают важность забытых катодных реакций в среде трещины в условиях свободной коррозии, а также катодной поляризации. 4, 8, 20, 28 Как будет объяснено при обсуждении pH, увеличение количества катодных реакций, особенно восстановление H + , встречающиеся в среде трещины, могут привести к более нейтральному pH. Это становится все более важным при катодной поляризации. Кроме того, любой H, образующийся вблизи вершины трещины в результате катодных реакций, который поглощается металлом, может ускорить растворение, как это было обнаружено для сталей. 34 Для механизма водородного крекинга (HEAC), 35,36,37,38,39,40,41,42,43,44,45,46,47 восстановление вблизи вершины трещины критически важно для EAC, так как H поглощается после катодного восстановления H + , который предлагается для охрупчивания металлов, приводящего к EAC. 4, 5, 8, 15, 16, 19, 20, 23, 25, 26, 33 На рисунке 2 схематически показаны ожидаемые значения наконечника E и условия pH для алюминиевого сплава, потенциал свободной коррозии которого составляет около −775 мВ SCE и уровень падения ИК, аналогичный измеренному Купером и Келли. 15,16,17, 33 Хотя рис. 2 был нарисован для воспроизведения алюминиевого сплава, он применим для любого сплава, когда кривая смещена таким образом, что потенциал, не зависящий от рН, находится на уровне, указывающем на потенциал свободной коррозии с компенсацией для соответствующего количества падения ИК-излучения. Экспериментальные и модельные проверки и объяснения этой схемы описаны в следующем разделе.
4, 5, 8, 15, 16, 19, 20, 23, 25, 26, 33 На рисунке 2 схематически показаны ожидаемые значения наконечника E и условия pH для алюминиевого сплава, потенциал свободной коррозии которого составляет около −775 мВ SCE и уровень падения ИК, аналогичный измеренному Купером и Келли. 15,16,17, 33 Хотя рис. 2 был нарисован для воспроизведения алюминиевого сплава, он применим для любого сплава, когда кривая смещена таким образом, что потенциал, не зависящий от рН, находится на уровне, указывающем на потенциал свободной коррозии с компенсацией для соответствующего количества падения ИК-излучения. Экспериментальные и модельные проверки и объяснения этой схемы описаны в следующем разделе. Цифры представляют собой экспериментальные результаты, опубликованные Купером и Келли 16 для SCC-трещины 7050 в состоянии, близком к Т6, при погружении в 0,5 M Na 2 CrO 4 + 0,05 М NaCl. Цифры со знаком * относятся к объемным условиям, а без — к условиям в вершине трещины. (1) относится к измерениям, проводимым при приложении потенциала разомкнутой цепи, а (2) — к анодной поляризации ~ 200 мВ. Обратите внимание, что наклон кривой вершины трещины при щелочном рН действительно схематичен, поскольку в литературе не было найдено исследований, в которых бы были представлены измерения Е трещины и рН для аналогичного сплава алюминия при катодной поляризации. Наклон в области катодной поляризации кривой оценивается на основе уровней pH, измеренных Nguyen et al. 49
Цифры представляют собой экспериментальные результаты, опубликованные Купером и Келли 16 для SCC-трещины 7050 в состоянии, близком к Т6, при погружении в 0,5 M Na 2 CrO 4 + 0,05 М NaCl. Цифры со знаком * относятся к объемным условиям, а без — к условиям в вершине трещины. (1) относится к измерениям, проводимым при приложении потенциала разомкнутой цепи, а (2) — к анодной поляризации ~ 200 мВ. Обратите внимание, что наклон кривой вершины трещины при щелочном рН действительно схематичен, поскольку в литературе не было найдено исследований, в которых бы были представлены измерения Е трещины и рН для аналогичного сплава алюминия при катодной поляризации. Наклон в области катодной поляризации кривой оценивается на основе уровней pH, измеренных Nguyen et al. 49 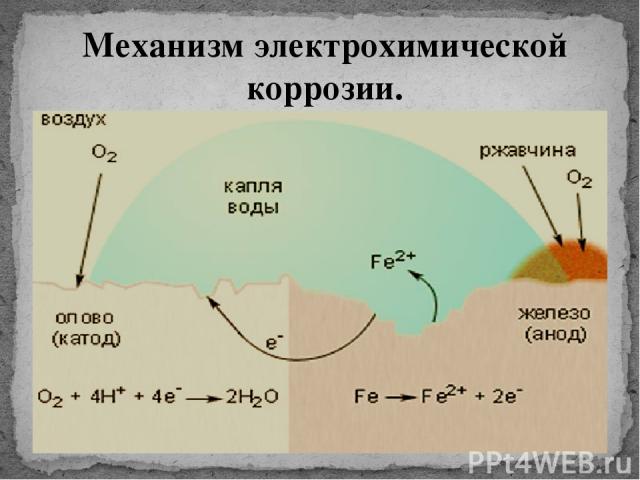 Для SCC AA7050 вокруг состояния T6, погруженного в 0,5 M Na 2 CrO 4 + 0,05 M NaCl была обнаружена измеренная разность потенциалов между кончиком и жирной поверхностью (∆E) ~ 125 мВ. 16 Кроме того, было замечено, что градиент потенциала составлял ~ 1 В/см при измерении E в зависимости от расстояния от вершины трещины, что позволило авторам сделать вывод, что большая часть ∆E изолирована в пределах 3 мм от наконечник трещины. 16, 17 Тернбулл и Феррис смоделировали ∆E для CF стали марки 50D BS 4360, погруженной в искусственную морскую воду ASTM. 4 Для приложенного потенциала на OCP или рядом с ним (~ −800 мВ SCE ) было предсказано ~ 20 мВ ∆E. Скотт и др. 25 также исследовал CF стали BS 4360 марки 50D, погруженной в морскую воду, и обнаружил, что ∆E составляет 90 мВ. En-Hou и Wei 5 смоделировали и экспериментально обнаружили ∆E ~ 125 мВ для CF низкоуглеродистой стали ZG20SiMn, погруженной в пресную воду.
Для SCC AA7050 вокруг состояния T6, погруженного в 0,5 M Na 2 CrO 4 + 0,05 M NaCl была обнаружена измеренная разность потенциалов между кончиком и жирной поверхностью (∆E) ~ 125 мВ. 16 Кроме того, было замечено, что градиент потенциала составлял ~ 1 В/см при измерении E в зависимости от расстояния от вершины трещины, что позволило авторам сделать вывод, что большая часть ∆E изолирована в пределах 3 мм от наконечник трещины. 16, 17 Тернбулл и Феррис смоделировали ∆E для CF стали марки 50D BS 4360, погруженной в искусственную морскую воду ASTM. 4 Для приложенного потенциала на OCP или рядом с ним (~ −800 мВ SCE ) было предсказано ~ 20 мВ ∆E. Скотт и др. 25 также исследовал CF стали BS 4360 марки 50D, погруженной в морскую воду, и обнаружил, что ∆E составляет 90 мВ. En-Hou и Wei 5 смоделировали и экспериментально обнаружили ∆E ~ 125 мВ для CF низкоуглеродистой стали ZG20SiMn, погруженной в пресную воду. В то время как описанные выше литературные результаты показывают большие различия в величине ∆E, все они подтверждают тот факт, что жирный поверхностный потенциал не сохраняется в вершине трещины.
В то время как описанные выше литературные результаты показывают большие различия в величине ∆E, все они подтверждают тот факт, что жирный поверхностный потенциал не сохраняется в вершине трещины. Усилия по моделированию исследовали это, изменяя скорость восстановления кислорода, и обнаружили, что основной эффект заключается в падении потенциала с незначительным влиянием на состояние вершины трещины; хотя неопределенность в соответствующей кинетике восстановления кислорода затрудняла этот анализ. 8
Усилия по моделированию исследовали это, изменяя скорость восстановления кислорода, и обнаружили, что основной эффект заключается в падении потенциала с незначительным влиянием на состояние вершины трещины; хотя неопределенность в соответствующей кинетике восстановления кислорода затрудняла этот анализ. 8  4 Для различных анодных поляризаций AA7050 вблизи состояния Т6 наконечник E оставался на уровне ~ −730 мВ SCE , аналогично наблюдаемому при применении OCP (~ −600 мВ SCE ), для всех уровней анодной поляризации исследовано (до приложенного потенциала −300 мВ SCE ). 16 Это означает, что даже при сильной анодной поляризации 300 мВ вершина трещины оставалась неполяризованной, а ∆E возрастало от –125 мВ при OCP до –425 мВ при –300 мВ SCE . Что касается катодной поляризации, на наконечник E не влияли поляризации менее 100 мВ (приложенные потенциалы от -600 до -700 мВ SCE ). 16 Для приложенных потенциалов от -700 до -800 мВ SCE вершина трещины была поляризована до приложенного потенциала или близко к нему. 16 Для сингулярного потенциала, исследованного ниже −750 мВ SCE , потенциал вершины трещины был несколько более катодным. 16 Исследование стали с содержанием 3 % NiCrMoV, погруженной в искусственный паровой конденсат при температуре 90 °C, показало, что вершина трещины имеет ограниченную поляризацию при значительном анодном потенциале (до 0,0 В SCE ), при этом вершина трещины достигает предельного значения −0,61 мВ SCE .
4 Для различных анодных поляризаций AA7050 вблизи состояния Т6 наконечник E оставался на уровне ~ −730 мВ SCE , аналогично наблюдаемому при применении OCP (~ −600 мВ SCE ), для всех уровней анодной поляризации исследовано (до приложенного потенциала −300 мВ SCE ). 16 Это означает, что даже при сильной анодной поляризации 300 мВ вершина трещины оставалась неполяризованной, а ∆E возрастало от –125 мВ при OCP до –425 мВ при –300 мВ SCE . Что касается катодной поляризации, на наконечник E не влияли поляризации менее 100 мВ (приложенные потенциалы от -600 до -700 мВ SCE ). 16 Для приложенных потенциалов от -700 до -800 мВ SCE вершина трещины была поляризована до приложенного потенциала или близко к нему. 16 Для сингулярного потенциала, исследованного ниже −750 мВ SCE , потенциал вершины трещины был несколько более катодным. 16 Исследование стали с содержанием 3 % NiCrMoV, погруженной в искусственный паровой конденсат при температуре 90 °C, показало, что вершина трещины имеет ограниченную поляризацию при значительном анодном потенциале (до 0,0 В SCE ), при этом вершина трещины достигает предельного значения −0,61 мВ SCE . 26
26  1. Фактически, стабильные значения pH могут быть достигнуты в среде вершины трещины после достижения равновесия между H + и концентрацией ионов металла, как следует из диаграмм состава. По сути, это баланс между концентрацией ионов металла и гидролизом, который регулирует рН в закрытой среде трещины. Кислотная природа вершины трещины была экспериментально подтверждена несколькими исследователями на сплавах как на основе алюминия, так и на основе железа. Нгуен и др. 48 измерил развивающийся рН на вершине трещин SCC в AA7075-T651, подвергнутом воздействию 1 М NaCl, 1 М NaNO 3 и 1 М Na 2 SO 4 . Когда потенциал внешней поверхности поддерживался на уровне OCP, pH в вершине трещины составлял 3,4 как для электролитов NaCl, так и для Na 2 SO 4 . Из-за образования аммиака и отсутствия аниона вершины трещины, реагирующего с Al 3+ в нитратных растворах, 48 рН в NaNO 3 был 9.
1. Фактически, стабильные значения pH могут быть достигнуты в среде вершины трещины после достижения равновесия между H + и концентрацией ионов металла, как следует из диаграмм состава. По сути, это баланс между концентрацией ионов металла и гидролизом, который регулирует рН в закрытой среде трещины. Кислотная природа вершины трещины была экспериментально подтверждена несколькими исследователями на сплавах как на основе алюминия, так и на основе железа. Нгуен и др. 48 измерил развивающийся рН на вершине трещин SCC в AA7075-T651, подвергнутом воздействию 1 М NaCl, 1 М NaNO 3 и 1 М Na 2 SO 4 . Когда потенциал внешней поверхности поддерживался на уровне OCP, pH в вершине трещины составлял 3,4 как для электролитов NaCl, так и для Na 2 SO 4 . Из-за образования аммиака и отсутствия аниона вершины трещины, реагирующего с Al 3+ в нитратных растворах, 48 рН в NaNO 3 был 9. 1. Важно отметить, что этот рН ниже, чем при катодной поляризации и анодной поляризации в NaNO 3 , что согласуется с ожиданиями. Влияние гидролиза на pH вершины трещины было отмечено при исследовании различных типов легированных сталей, подвергавшихся воздействию 3,5% NaCl, где pH основного раствора составлял 6, а pH вблизи вершины трещины для всех исследованных стальных сплавов составлял ~ 3,7. 21 Кроме того, при испытаниях SCC стали AISI 4340, подвергнутой воздействию 3,5 % NaCl при различных значениях pH основного раствора от 1 до 10, pH вершины трещины не зависел от pH основного раствора и во всех случаях был около 3,7. 21 Это согласуется с исследованием КВ трубопроводной стали Х70 в электролите с близким к нейтральному рН, содержащем CaCl 2 , KCl, MgSO 4 и NaHCO 3 , где измерения на месте установили рН ~ 4 в пределах трещина. 49 Смит и др. 13 также показал, что pH внутри трещины для стали 4340, погруженной в 0,6 M NaCl, с объемным pH 5,6 постоянно оставался между 3,5 и 3,9.
1. Важно отметить, что этот рН ниже, чем при катодной поляризации и анодной поляризации в NaNO 3 , что согласуется с ожиданиями. Влияние гидролиза на pH вершины трещины было отмечено при исследовании различных типов легированных сталей, подвергавшихся воздействию 3,5% NaCl, где pH основного раствора составлял 6, а pH вблизи вершины трещины для всех исследованных стальных сплавов составлял ~ 3,7. 21 Кроме того, при испытаниях SCC стали AISI 4340, подвергнутой воздействию 3,5 % NaCl при различных значениях pH основного раствора от 1 до 10, pH вершины трещины не зависел от pH основного раствора и во всех случаях был около 3,7. 21 Это согласуется с исследованием КВ трубопроводной стали Х70 в электролите с близким к нейтральному рН, содержащем CaCl 2 , KCl, MgSO 4 и NaHCO 3 , где измерения на месте установили рН ~ 4 в пределах трещина. 49 Смит и др. 13 также показал, что pH внутри трещины для стали 4340, погруженной в 0,6 M NaCl, с объемным pH 5,6 постоянно оставался между 3,5 и 3,9.
 −500 мВ SCE (OCP составляет ~ −680 мВ SCE при pH 8 20 и ~ −800 мВ SCE при pH 10,2 4 ). 8
−500 мВ SCE (OCP составляет ~ −680 мВ SCE при pH 8 20 и ~ −800 мВ SCE при pH 10,2 4 ). 8 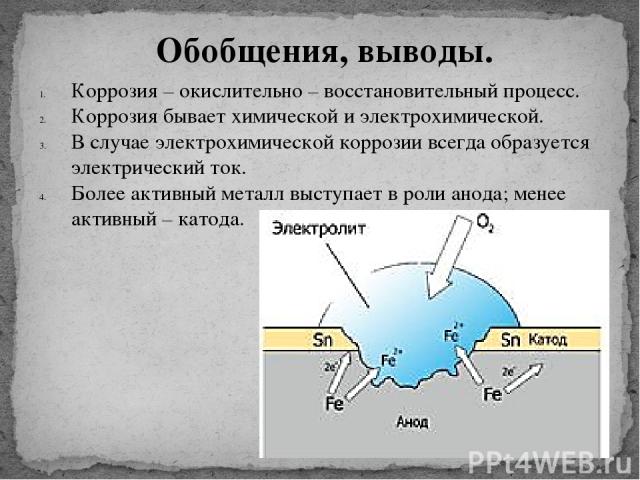 Купер и др. измерили pH вершины трещины во время SCC AA7050, состаренного почти до состояния T6, в 0,5 M Na 2 CrO 4 + 0,05 M NaCl с объемным pH 9,2 и наблюдали все более кислый pH вершины трещины с увеличением анодной поляризации. 16, 33 В частности, рН вершины трещины составлял 4 при поляризации до -0,645 В SCE и 2,5 при поляризации до -0,445 В SCE . 16 Cooper et al., в сотрудничестве с Young et al., коррелировали увеличение приложенной анодной поляризации с соответствующими сдвигами (1) pH кончика трещины от объемного (pH 8,5–9) до очень кислого (pH 4–4). 2.5), (2) [Al 3+ ] от номинальных концентраций до 1,5–3,5 M, и (3) изменения скорости роста трещин (da/dt) от медленного роста трещин инкубационного типа (до 5,5 × 10 -7 мм/с) до активного быстрого роста трещины (до 1 × 10 -4 мм/с). 15, 16, 33, 50, 51 Nguyen также показал увеличение da/dt на стадии II с увеличением анодной поляризации и коррелировал эти изменения с подкислением pH и выше [Al 3+ ].
Купер и др. измерили pH вершины трещины во время SCC AA7050, состаренного почти до состояния T6, в 0,5 M Na 2 CrO 4 + 0,05 M NaCl с объемным pH 9,2 и наблюдали все более кислый pH вершины трещины с увеличением анодной поляризации. 16, 33 В частности, рН вершины трещины составлял 4 при поляризации до -0,645 В SCE и 2,5 при поляризации до -0,445 В SCE . 16 Cooper et al., в сотрудничестве с Young et al., коррелировали увеличение приложенной анодной поляризации с соответствующими сдвигами (1) pH кончика трещины от объемного (pH 8,5–9) до очень кислого (pH 4–4). 2.5), (2) [Al 3+ ] от номинальных концентраций до 1,5–3,5 M, и (3) изменения скорости роста трещин (da/dt) от медленного роста трещин инкубационного типа (до 5,5 × 10 -7 мм/с) до активного быстрого роста трещины (до 1 × 10 -4 мм/с). 15, 16, 33, 50, 51 Nguyen также показал увеличение da/dt на стадии II с увеличением анодной поляризации и коррелировал эти изменения с подкислением pH и выше [Al 3+ ].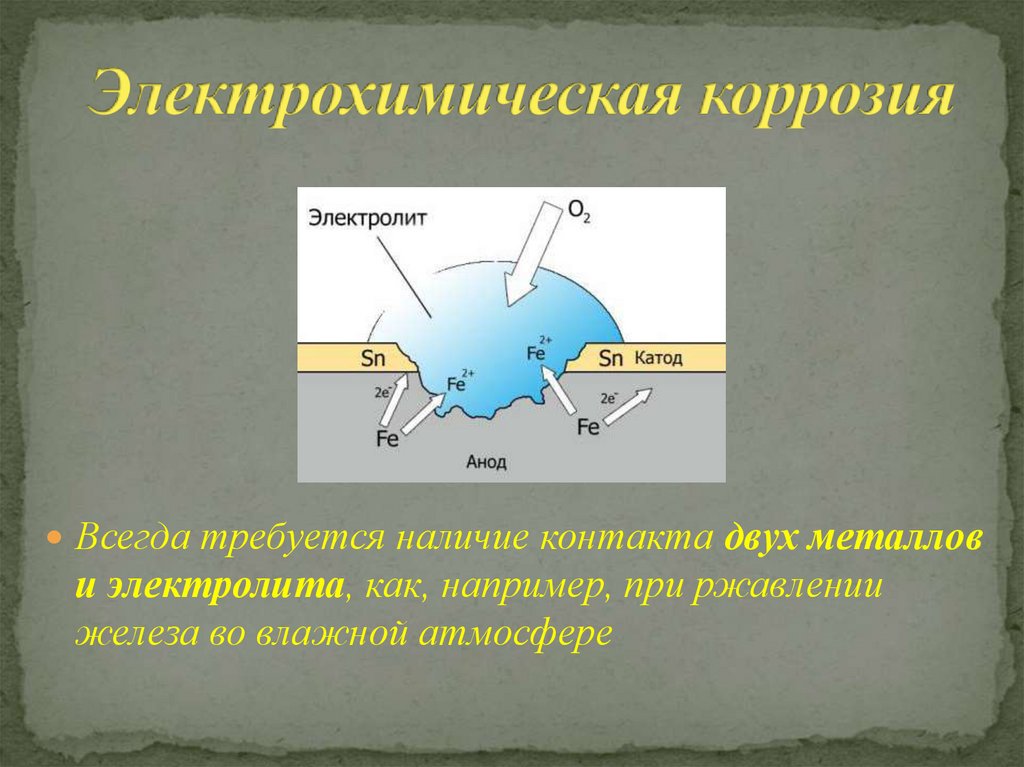 48
48  Нгуен и др. наблюдал основные вершины трещин для SCC 7075-T651 при катодной поляризации при погружении в 1 M NaCl (измеренный pH 9.5 При -0,758 В SHE и 12 при -1,056 В HE , OCP составляет -0,606 В HE ), 1 M N NA 2 SO 4 (измерение PH из 11,5 AT -1.166. SHE , OCP составляет -0,498 V SHE ) и 1M NaNO 3 (измеренный pH 12,5 при –1,184 V SHE , OCP составляет –0,400 V S1HE ). 48 Примечательно, что Нгуен также наблюдал низкий [Al 3+ ] (0,01 M как для NaCl, так и для Na 2 SO 4 электролитов) и относительно низкий уровень II стадии II da/dt при этих уровнях катодной поляризации. . 48 Тернбулл и соавторы смоделировали и экспериментально исследовали сталь марки 5OD BS 4360 в условиях катодной поляризации; 4, 20, 28 и в одном прогнозе модели для 3,5% NaCl и морской воды с O 2 , Mg или HCO 3 − , Turnbull et al.
Нгуен и др. наблюдал основные вершины трещин для SCC 7075-T651 при катодной поляризации при погружении в 1 M NaCl (измеренный pH 9.5 При -0,758 В SHE и 12 при -1,056 В HE , OCP составляет -0,606 В HE ), 1 M N NA 2 SO 4 (измерение PH из 11,5 AT -1.166. SHE , OCP составляет -0,498 V SHE ) и 1M NaNO 3 (измеренный pH 12,5 при –1,184 V SHE , OCP составляет –0,400 V S1HE ). 48 Примечательно, что Нгуен также наблюдал низкий [Al 3+ ] (0,01 M как для NaCl, так и для Na 2 SO 4 электролитов) и относительно низкий уровень II стадии II da/dt при этих уровнях катодной поляризации. . 48 Тернбулл и соавторы смоделировали и экспериментально исследовали сталь марки 5OD BS 4360 в условиях катодной поляризации; 4, 20, 28 и в одном прогнозе модели для 3,5% NaCl и морской воды с O 2 , Mg или HCO 3 − , Turnbull et al. обнаружили, что pH увеличивается для всех объемных сред с диапазона 10–11,5 при поляризации вблизи OCP (~ –800 мВ SCE при pH 10,2) до диапазона 10,8–12,5 при поляризации до –1100 мВ SCE . 4 (точное значение pH в этих диапазонах зависит от конкретной среды). Важно отметить, что в этом исследовании Тернбулла 4 рассматривался диапазон катодной поляризации от -800 до -1100 мВ SCE и приписывался контроль pH вершины трещины различным буферным реакциям в зависимости от состава электролита; но, тем не менее, уменьшенный вклад гидролиза ионов металлов из-за катодной поляризации допускает развитие основного рН вершины трещины. Экспериментальные результаты этого же исследования 4 подтвердил увеличение pH с увеличением катодной поляризации; хотя абсолютное значение pH немного отличалось от результата модели, что было связано с растворением вершины трещины и гидролизом, что привело к несколько более низкому pH, чем предсказано в модели.
обнаружили, что pH увеличивается для всех объемных сред с диапазона 10–11,5 при поляризации вблизи OCP (~ –800 мВ SCE при pH 10,2) до диапазона 10,8–12,5 при поляризации до –1100 мВ SCE . 4 (точное значение pH в этих диапазонах зависит от конкретной среды). Важно отметить, что в этом исследовании Тернбулла 4 рассматривался диапазон катодной поляризации от -800 до -1100 мВ SCE и приписывался контроль pH вершины трещины различным буферным реакциям в зависимости от состава электролита; но, тем не менее, уменьшенный вклад гидролиза ионов металлов из-за катодной поляризации допускает развитие основного рН вершины трещины. Экспериментальные результаты этого же исследования 4 подтвердил увеличение pH с увеличением катодной поляризации; хотя абсолютное значение pH немного отличалось от результата модели, что было связано с растворением вершины трещины и гидролизом, что привело к несколько более низкому pH, чем предсказано в модели. 4 Аналогичная работа Turnbull et al. 20 на стали BS 4360 5OD, погруженной в морскую воду, показало повышение уровня pH вершины трещины с 7,3 до 8,5 при OCP до 13,0 при катодной поляризации при −1100 мВ SCE (OCP ~ 680 мВ SCE при рН ~ 8). 20 Turnbull 28 содержит подробный обзор различных моделей, разработанных для оценки pH вершины трещины, среди прочего, особенно в условиях катодной поляризации, когда pH вершины трещины в большей степени зависит от баланса возрастающих внутренних катодных реакций с потреблением H + и подкисление крэка за счет растворения и гидролиза металла.
4 Аналогичная работа Turnbull et al. 20 на стали BS 4360 5OD, погруженной в морскую воду, показало повышение уровня pH вершины трещины с 7,3 до 8,5 при OCP до 13,0 при катодной поляризации при −1100 мВ SCE (OCP ~ 680 мВ SCE при рН ~ 8). 20 Turnbull 28 содержит подробный обзор различных моделей, разработанных для оценки pH вершины трещины, среди прочего, особенно в условиях катодной поляризации, когда pH вершины трещины в большей степени зависит от баланса возрастающих внутренних катодных реакций с потреблением H + и подкисление крэка за счет растворения и гидролиза металла. Для поддержания электронейтральности должна происходить ионная миграция отрицательно заряженных ионов (например, Cl —, OH — и т. д.) к вершине трещины, что приводит к тому, что вершина трещины концентрируется как в катионах, так и в анионах. Для SCC миграция ионов может быть особенно мощной, поскольку материал находится в условиях статической нагрузки, когда адвекция исключена.
Для поддержания электронейтральности должна происходить ионная миграция отрицательно заряженных ионов (например, Cl —, OH — и т. д.) к вершине трещины, что приводит к тому, что вершина трещины концентрируется как в катионах, так и в анионах. Для SCC миграция ионов может быть особенно мощной, поскольку материал находится в условиях статической нагрузки, когда адвекция исключена. 15, 16, 33 Аналогично, повышенный CrO 4 2− . 4 2– концентраций были обнаружены в вершине трещины (2–3 М у вершины против 0,5 М в объеме). 15 В устойчивых к EAC состояниях, которые имеют низкую скорость роста трещин (da/dt) по сравнению с чувствительными к EAC состояниями, также были обнаружены повышенные концентрации анионов. 15 Однако для устойчивых к ЭАС состояний повышение концентрации анионов не сохраняется так далеко в следе за трещиной, а в случае Cl − , не достигал таких высоких концентраций. 15 Для сенсибилизированной нержавеющей стали 304L, подвергшейся воздействию воды, имитирующей кипящую воду реактора, Peng et al. наблюдались Cl − и SO 4 2− в вершине трещины (1,01 м.д. Cl − и 0,50 млн. объемная среда. 12
15, 16, 33 Аналогично, повышенный CrO 4 2− . 4 2– концентраций были обнаружены в вершине трещины (2–3 М у вершины против 0,5 М в объеме). 15 В устойчивых к EAC состояниях, которые имеют низкую скорость роста трещин (da/dt) по сравнению с чувствительными к EAC состояниями, также были обнаружены повышенные концентрации анионов. 15 Однако для устойчивых к ЭАС состояний повышение концентрации анионов не сохраняется так далеко в следе за трещиной, а в случае Cl − , не достигал таких высоких концентраций. 15 Для сенсибилизированной нержавеющей стали 304L, подвергшейся воздействию воды, имитирующей кипящую воду реактора, Peng et al. наблюдались Cl − и SO 4 2− в вершине трещины (1,01 м.д. Cl − и 0,50 млн. объемная среда. 12  При этом наличие или отсутствие вида в общем растворе будет иметь значение. Например, было обнаружено, что добавление пассивирующих ингибиторов, таких как хромат или молибдат, при их наличии в достаточных количествах замедляет рост трещин в EAC 39, 52, 53, 54 для различных алюминиевых сплавов. Подробное описание ингибирования EAC выходит за рамки этой статьи, но для получения дополнительной информации можно обратиться к ссылкам. 39, 52,53,54 Абсолютное значение объемной концентрации оказывает минимальное влияние, поскольку вершина трещины концентрируется из-за миграции ионов, вызванной реакциями трещины и необходимостью поддержания электронейтральности.
При этом наличие или отсутствие вида в общем растворе будет иметь значение. Например, было обнаружено, что добавление пассивирующих ингибиторов, таких как хромат или молибдат, при их наличии в достаточных количествах замедляет рост трещин в EAC 39, 52, 53, 54 для различных алюминиевых сплавов. Подробное описание ингибирования EAC выходит за рамки этой статьи, но для получения дополнительной информации можно обратиться к ссылкам. 39, 52,53,54 Абсолютное значение объемной концентрации оказывает минимальное влияние, поскольку вершина трещины концентрируется из-за миграции ионов, вызванной реакциями трещины и необходимостью поддержания электронейтральности. С другой стороны, во время CF адвекция происходит за счет циклического нагружения и разгрузки, что вызывает смещение стенок трещины, что приводит к перекачиванию свежего электролита из объема в трещину. В результате условия МВ могут быть менее тяжелыми, чем при плоскоклеточном раке. Факторами, влияющими на конвективное перемешивание, являются частота усталостного нагружения ( f ), диапазон интенсивности напряжений (∆ К = К
С другой стороны, во время CF адвекция происходит за счет циклического нагружения и разгрузки, что вызывает смещение стенок трещины, что приводит к перекачиванию свежего электролита из объема в трещину. В результате условия МВ могут быть менее тяжелыми, чем при плоскоклеточном раке. Факторами, влияющими на конвективное перемешивание, являются частота усталостного нагружения ( f ), диапазон интенсивности напряжений (∆ К = К  Обратите внимание, что вклад ∆ K в адвекцию, по прогнозам, будет незначительным 4, 8 , но ∆ K будет обсуждаться здесь там, где уместны другие параметры CF. Также важно отметить, что длина трещины играет роль в определении серьезности, с которой эти способствующие факторы изменяют химический состав вершины трещины. Оценки моделирования подтверждают, что более длинные трещины имеют более закрытую среду, поскольку роль диффузии для компенсации адвекции уменьшается по мере увеличения длины трещины.
Обратите внимание, что вклад ∆ K в адвекцию, по прогнозам, будет незначительным 4, 8 , но ∆ K будет обсуждаться здесь там, где уместны другие параметры CF. Также важно отметить, что длина трещины играет роль в определении серьезности, с которой эти способствующие факторы изменяют химический состав вершины трещины. Оценки моделирования подтверждают, что более длинные трещины имеют более закрытую среду, поскольку роль диффузии для компенсации адвекции уменьшается по мере увеличения длины трещины. Поэтому следует отметить, что приближаясь к f нуля должны давать условия вершины трещины SCC. Тернбулл и Феррис предсказывают критическое значение f ~ 1 Гц, ниже которого адвекцией можно пренебречь; 4 , но поскольку количество времени в течение цикла нагрузки продолжает увеличиваться с уменьшением f , эффект f сохраняется ниже 1 Гц. Тернбулл и Феррис показали, что рН изменяется при увеличении f от 0,1 до 1 Гц. 4 Увеличение f также увеличивает ∆E, 4 что может быть связано с возрастающим вкладом восстановления кислорода в пределах одного цикла в устье трещины. 55
Поэтому следует отметить, что приближаясь к f нуля должны давать условия вершины трещины SCC. Тернбулл и Феррис предсказывают критическое значение f ~ 1 Гц, ниже которого адвекцией можно пренебречь; 4 , но поскольку количество времени в течение цикла нагрузки продолжает увеличиваться с уменьшением f , эффект f сохраняется ниже 1 Гц. Тернбулл и Феррис показали, что рН изменяется при увеличении f от 0,1 до 1 Гц. 4 Увеличение f также увеличивает ∆E, 4 что может быть связано с возрастающим вкладом восстановления кислорода в пределах одного цикла в устье трещины. 55  Поскольку более низкое значение R приводит к более полному закрытию трещины, перемешивание основного электролита и электролита вершины трещины усиливается за счет увеличения вклада адвекции. Таким образом, более низкий R , как ожидается, будет иметь химический состав вершины трещины, который менее окклюзирован. Хотя более низкий R также создает более узкую трещину, что приводит к увеличению падения IR вниз по трещине; и, следовательно, повышенный ∆E. Более высокое значение R позволяет использовать больший объем раствора трещины для той же площади поверхности стенки трещины, что может повлиять на степень катодных реакций, протекающих в трещине. Тернбулл и др. 8 смоделировал влияние R на ∆ E в условиях свободной коррозии, показав ∆E 30 мВ для R , равное 0,1, и 1 мВ для 0,8. Аналогичное изменение ∆ E наблюдалось при катодной поляризации. 4 Тернбулл и др. 20 экспериментально подтвердили, что низкий уровень R приводит к наибольшему ∆E.
Поскольку более низкое значение R приводит к более полному закрытию трещины, перемешивание основного электролита и электролита вершины трещины усиливается за счет увеличения вклада адвекции. Таким образом, более низкий R , как ожидается, будет иметь химический состав вершины трещины, который менее окклюзирован. Хотя более низкий R также создает более узкую трещину, что приводит к увеличению падения IR вниз по трещине; и, следовательно, повышенный ∆E. Более высокое значение R позволяет использовать больший объем раствора трещины для той же площади поверхности стенки трещины, что может повлиять на степень катодных реакций, протекающих в трещине. Тернбулл и др. 8 смоделировал влияние R на ∆ E в условиях свободной коррозии, показав ∆E 30 мВ для R , равное 0,1, и 1 мВ для 0,8. Аналогичное изменение ∆ E наблюдалось при катодной поляризации. 4 Тернбулл и др. 20 экспериментально подтвердили, что низкий уровень R приводит к наибольшему ∆E. Тернбулл смоделировал влияние R на химию трещин, установив, что более высокое содержание R создает более закрытую среду трещины и более низкое .0198 R сохраняет объемный химический состав глубже в трещину. 31
Тернбулл смоделировал влияние R на химию трещин, установив, что более высокое содержание R создает более закрытую среду трещины и более низкое .0198 R сохраняет объемный химический состав глубже в трещину. 31  Таким образом, падение IR и, следовательно, ∆E должны уменьшаться с увеличением ∆ K . Моделирование установило, что увеличение ∆ K с 10 до 40 МПа√м для стали при OCP в морской воде приводит к уменьшению ∆ E с ~ 60 мВ до ~ 16 мВ для трещины длиной 2 см. 8 Этот вывод был экспериментально подтвержден в другом исследовании Turnbull et al. 20 рабочий. Не прогнозируется значительное влияние ∆ K о доливке электролита.
Таким образом, падение IR и, следовательно, ∆E должны уменьшаться с увеличением ∆ K . Моделирование установило, что увеличение ∆ K с 10 до 40 МПа√м для стали при OCP в морской воде приводит к уменьшению ∆ E с ~ 60 мВ до ~ 16 мВ для трещины длиной 2 см. 8 Этот вывод был экспериментально подтвержден в другом исследовании Turnbull et al. 20 рабочий. Не прогнозируется значительное влияние ∆ K о доливке электролита. Тернбулл смоделировал вклад диффузии и адвекции в контроль химического состава трещин во время CF и показал, что при коротких длинах трещин, ниже критического значения, диффузия доминирует в установлении химического состава трещин; в то время как для больших длин трещины, превышающей критическое значение, преобладают перенос и адвекция ионов и приводят к закрытой среде вершины трещины. 31 Тернбулл и др. смоделировали влияние глубины трещины на ∆E для конструкционной стали в морской воде и не обнаружили ∆E при OCP (-690 мВ SCE ) и анодная поляризация для очень коротких трещин (2,5 × 10 −2 см). Однако для трещины глубиной 2 см ∆ E составляло 35 мВ при OCP и 80 мВ при анодной поляризации 90 мВ. 8 Для стали в морской воде при катодной поляризации −1100 мВ SCE Turnbull et al. 4 наблюдали увеличение ∆E от 0 В для трещины размером 2,5 × 10 −2 см до ~ 70 мВ для трещины длиной 2 см. Интересно, что благодаря совместным усилиям по изучению SCC из 7050 в восприимчивом к SCC и стойком состояниях исследователи определили критический приложенный переходный потенциал, ниже которого диффузия может играть роль в снижении развития агрессивных состояний вершины трещины.
Тернбулл смоделировал вклад диффузии и адвекции в контроль химического состава трещин во время CF и показал, что при коротких длинах трещин, ниже критического значения, диффузия доминирует в установлении химического состава трещин; в то время как для больших длин трещины, превышающей критическое значение, преобладают перенос и адвекция ионов и приводят к закрытой среде вершины трещины. 31 Тернбулл и др. смоделировали влияние глубины трещины на ∆E для конструкционной стали в морской воде и не обнаружили ∆E при OCP (-690 мВ SCE ) и анодная поляризация для очень коротких трещин (2,5 × 10 −2 см). Однако для трещины глубиной 2 см ∆ E составляло 35 мВ при OCP и 80 мВ при анодной поляризации 90 мВ. 8 Для стали в морской воде при катодной поляризации −1100 мВ SCE Turnbull et al. 4 наблюдали увеличение ∆E от 0 В для трещины размером 2,5 × 10 −2 см до ~ 70 мВ для трещины длиной 2 см. Интересно, что благодаря совместным усилиям по изучению SCC из 7050 в восприимчивом к SCC и стойком состояниях исследователи определили критический приложенный переходный потенциал, ниже которого диффузия может играть роль в снижении развития агрессивных состояний вершины трещины.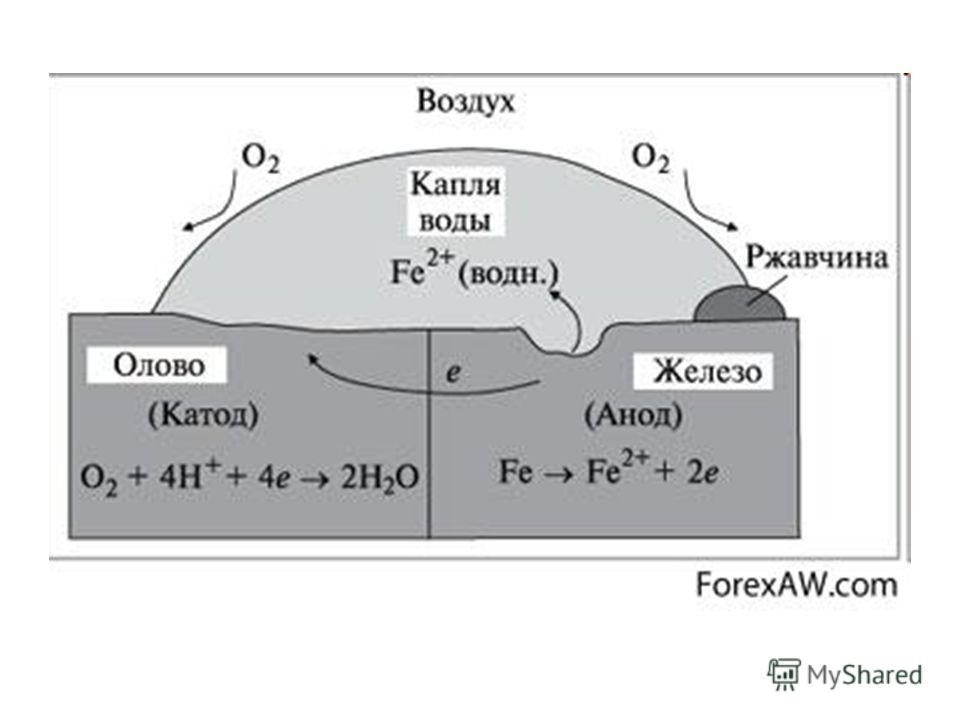 16,17,18, 50, 51 Зависимость длины трещины от этого критического переходного потенциала не исследовалась.
16,17,18, 50, 51 Зависимость длины трещины от этого критического переходного потенциала не исследовалась.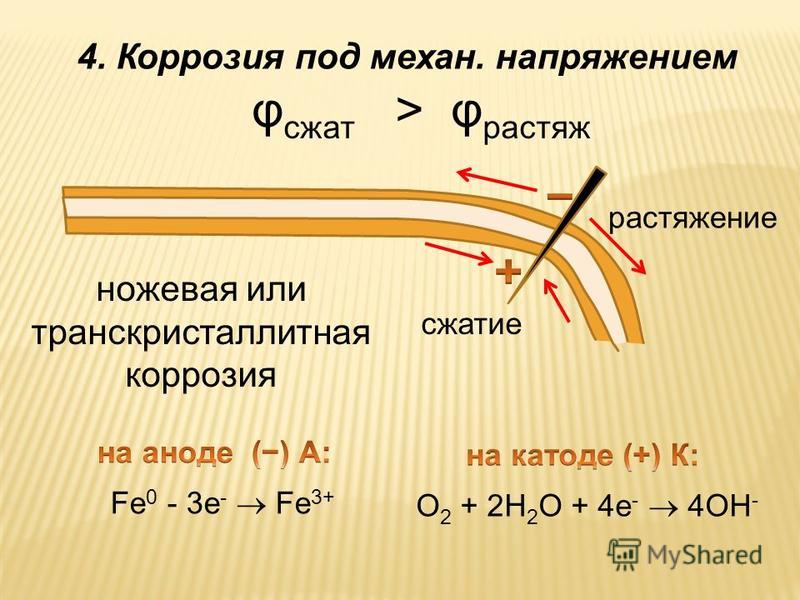 Электролит, собранный фильтровальной бумагой, затем анализировали с помощью капиллярного электрофореза. Несмотря на свою полезность, этот подход не позволяет непосредственно исследовать электролит трещины мгновенно на месте и предполагает, что электролит в разных местах трещины не будет смешиваться при оттаивании и впитывании в фильтровальную бумагу. Кроме того, невозможно получить информацию об электрохимическом потенциале, который является одной из основных переменных, контролирующих движущую силу окружающей среды для растрескивания. В более продвинутых попытках использовались отверстия, просверленные в образцах механики разрушения. 12, 14, 15, 16, 33 Отверстия в основном просверливались в задней части образца в плоскости излома, но в некоторых исследованиях просверливали серию отверстий сверху вниз, чтобы можно было взять пробы вдоль следа трещины и в разная глубина трещин. Когда трещина встречается с просверленным отверстием, можно взять небольшое количество электролита и проанализировать его, как правило, с помощью капиллярного электрофореза.
Электролит, собранный фильтровальной бумагой, затем анализировали с помощью капиллярного электрофореза. Несмотря на свою полезность, этот подход не позволяет непосредственно исследовать электролит трещины мгновенно на месте и предполагает, что электролит в разных местах трещины не будет смешиваться при оттаивании и впитывании в фильтровальную бумагу. Кроме того, невозможно получить информацию об электрохимическом потенциале, который является одной из основных переменных, контролирующих движущую силу окружающей среды для растрескивания. В более продвинутых попытках использовались отверстия, просверленные в образцах механики разрушения. 12, 14, 15, 16, 33 Отверстия в основном просверливались в задней части образца в плоскости излома, но в некоторых исследованиях просверливали серию отверстий сверху вниз, чтобы можно было взять пробы вдоль следа трещины и в разная глубина трещин. Когда трещина встречается с просверленным отверстием, можно взять небольшое количество электролита и проанализировать его, как правило, с помощью капиллярного электрофореза. Эти исследования имеют разные ограничения; некоторые пробуют только вершину трещины и не получают информации по следу, и большинство не измеряет потенциал трещины. В одном исследовании, в котором отбирались образцы трещин разной длины, трещины приостанавливались и промывалась система между событиями роста и отбора проб, 12 очищает окклюзированную среду и может снизить насыщение ионами и жесткость pH на вершине трещины. Наиболее полное экспериментальное исследование на сегодняшний день было выполнено Cooper and Kelly 15, 16, 33 по SCC 7050-T6 в растворах хлорида натрия. В целом, самые последние экспериментальные работы показывают, что измерение, мониторинг и изменение химических и электрохимических условий трещины возможны, а последние достижения в области микроэлектродов предлагают усовершенствования. Но поскольку в ограниченных экспериментальных попытках используются различные комбинации металлического сплава/окружающей среды и индивидуальные методы, целостных знаний, необходимых для точной настройки строгой модели, не существует.
Эти исследования имеют разные ограничения; некоторые пробуют только вершину трещины и не получают информации по следу, и большинство не измеряет потенциал трещины. В одном исследовании, в котором отбирались образцы трещин разной длины, трещины приостанавливались и промывалась система между событиями роста и отбора проб, 12 очищает окклюзированную среду и может снизить насыщение ионами и жесткость pH на вершине трещины. Наиболее полное экспериментальное исследование на сегодняшний день было выполнено Cooper and Kelly 15, 16, 33 по SCC 7050-T6 в растворах хлорида натрия. В целом, самые последние экспериментальные работы показывают, что измерение, мониторинг и изменение химических и электрохимических условий трещины возможны, а последние достижения в области микроэлектродов предлагают усовершенствования. Но поскольку в ограниченных экспериментальных попытках используются различные комбинации металлического сплава/окружающей среды и индивидуальные методы, целостных знаний, необходимых для точной настройки строгой модели, не существует.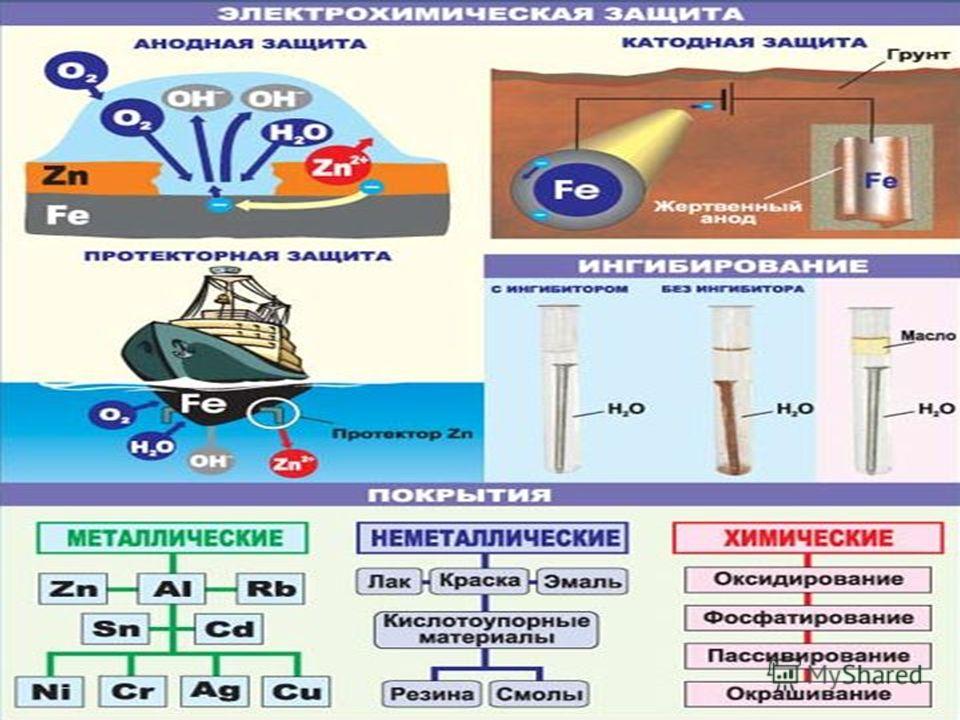 Как отмечает Тернбулл, это серьезное ограничение, сдерживающее прогресс в этой области. 29
Как отмечает Тернбулл, это серьезное ограничение, сдерживающее прогресс в этой области. 29  57 для сплавов Al-Mg, где добавление MgCl 2 к массовым концентрированным растворам для имитации трещин AlCl 3 было сделано для оценки влияния растворения и гидролиза Mg на pH трещины для сенсибилизированных сплавов Al 5xxx с высоким содержанием магния. Было обнаружено, что добавление MgCl 2 снижал pH основного раствора ниже 1. Недавно были опубликованы теории о влиянии катионов металлов на поверхности трещин и влиянии на pH вершины трещины и кинетику роста трещины 58, 59 , но их нельзя проверить, так как это не было включено в моделей и трудно поддается экспериментальному обнаружению.
57 для сплавов Al-Mg, где добавление MgCl 2 к массовым концентрированным растворам для имитации трещин AlCl 3 было сделано для оценки влияния растворения и гидролиза Mg на pH трещины для сенсибилизированных сплавов Al 5xxx с высоким содержанием магния. Было обнаружено, что добавление MgCl 2 снижал pH основного раствора ниже 1. Недавно были опубликованы теории о влиянии катионов металлов на поверхности трещин и влиянии на pH вершины трещины и кинетику роста трещины 58, 59 , но их нельзя проверить, так как это не было включено в моделей и трудно поддается экспериментальному обнаружению. Также возможно образование солевых пленок на вершине трещины и по ее следу. К сожалению, экспериментальные методы не позволяют определить наличие фактической солевой пленки, поскольку большинство экстрагированных растворов имеют небольшой объем и должны быть разбавлены, чтобы получить больший объем раствора для анализа. Как отмечает Тернбулл, моделирование еще не способно отразить эффекты концентрированных растворов. 28 Таким образом, мало что известно об изменениях и влиянии вязкости раствора, осажденных солевых пленках, вызывающих снижение кинетики растворения, и любой дегидратации из-за комплексообразования молекул воды. Некоторая работа была проделана по ямам и/или расщелинам в областях понимания солевых пленок и использования градиентов активности вместо градиентов концентрации. Хотя работа над ямками и щелями может служить отправной точкой для понимания высококонцентрированного крекинг-электролита, здесь она обсуждаться не будет.
Также возможно образование солевых пленок на вершине трещины и по ее следу. К сожалению, экспериментальные методы не позволяют определить наличие фактической солевой пленки, поскольку большинство экстрагированных растворов имеют небольшой объем и должны быть разбавлены, чтобы получить больший объем раствора для анализа. Как отмечает Тернбулл, моделирование еще не способно отразить эффекты концентрированных растворов. 28 Таким образом, мало что известно об изменениях и влиянии вязкости раствора, осажденных солевых пленках, вызывающих снижение кинетики растворения, и любой дегидратации из-за комплексообразования молекул воды. Некоторая работа была проделана по ямам и/или расщелинам в областях понимания солевых пленок и использования градиентов активности вместо градиентов концентрации. Хотя работа над ямками и щелями может служить отправной точкой для понимания высококонцентрированного крекинг-электролита, здесь она обсуждаться не будет. Это связано с тем, что диффузия О 2 в трещину затруднена и растущая трещина быстро обедняется О 2 , что приводит к разделению анода и катода. Таким образом, обедненная вершина трещины O 2 станет основным местом анодной реакции, а устье трещины будет служить основным местом катодной реакции. Анодное растворение, происходящее в основном в вершине трещины, может привести к высокой концентрации ионов металла, что приводит к гидролизу, который подкисляет вершину трещины. Баланс между концентрацией ионов металла и последующим гидролизом, массопереносом (включая миграцию ионов, диффузию и адвекцию) и поляризацией трещины (анодной или катодной) определяет химические и электрохимические условия в вершине трещины. Прогнозируется, что в условиях свободной коррозии и анодной поляризации вершина трещины станет более кислой, в то время как при катодной поляризации вершина трещины станет более щелочной. Из-за высоких концентраций анионов и катионов в среде трещины существует падение ИК-излучения вниз по трещине, и вершина трещины относительно неполяризуема.
Это связано с тем, что диффузия О 2 в трещину затруднена и растущая трещина быстро обедняется О 2 , что приводит к разделению анода и катода. Таким образом, обедненная вершина трещины O 2 станет основным местом анодной реакции, а устье трещины будет служить основным местом катодной реакции. Анодное растворение, происходящее в основном в вершине трещины, может привести к высокой концентрации ионов металла, что приводит к гидролизу, который подкисляет вершину трещины. Баланс между концентрацией ионов металла и последующим гидролизом, массопереносом (включая миграцию ионов, диффузию и адвекцию) и поляризацией трещины (анодной или катодной) определяет химические и электрохимические условия в вершине трещины. Прогнозируется, что в условиях свободной коррозии и анодной поляризации вершина трещины станет более кислой, в то время как при катодной поляризации вершина трещины станет более щелочной. Из-за высоких концентраций анионов и катионов в среде трещины существует падение ИК-излучения вниз по трещине, и вершина трещины относительно неполяризуема.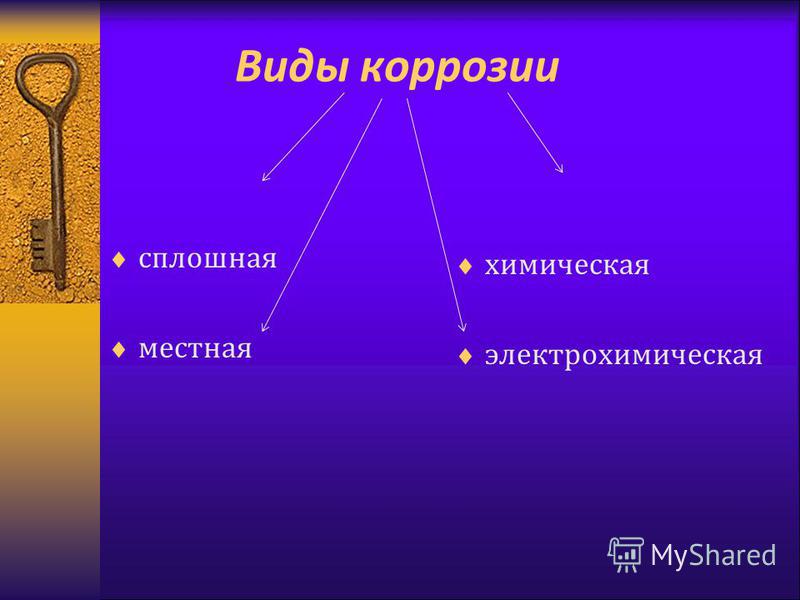 Это ∆E между вершиной и жирной поверхностью становится более экстремальным в ситуациях, которые способствуют растворению вершины трещины (анодная поляризация) или более тесной трещине (низкое R). Миграция ионов способствует возникновению агрессивных и закрытых условий в вершине трещины, облегчая миграцию анионов из объема раствора в качестве средства поддержания электронейтральности. Диффузия для противодействия этому градиенту концентрации минимальна и играет роль в установлении условий в вершине трещины только при очень малых длинах трещины. Когда встречаются условия циклической нагрузки, закрытому характеру вершины трещины можно противодействовать адвекцией; хотя роль адвекции уменьшается с уменьшением f и увеличение R.
Это ∆E между вершиной и жирной поверхностью становится более экстремальным в ситуациях, которые способствуют растворению вершины трещины (анодная поляризация) или более тесной трещине (низкое R). Миграция ионов способствует возникновению агрессивных и закрытых условий в вершине трещины, облегчая миграцию анионов из объема раствора в качестве средства поддержания электронейтральности. Диффузия для противодействия этому градиенту концентрации минимальна и играет роль в установлении условий в вершине трещины только при очень малых длинах трещины. Когда встречаются условия циклической нагрузки, закрытому характеру вершины трещины можно противодействовать адвекцией; хотя роль адвекции уменьшается с уменьшением f и увеличение R. Достижения в экспериментальных методах для экспериментального исследования и изменения химии трещин и электрохимии, увеличение количества таких экспериментов для получения более подробных и контролируемых экспериментальных данных, а также сотрудничество в области экспериментов и моделирования позволят добиться прогресса в понимании. Прогресс в моделировании и характеристике химии крекинга и электрохимии может принести пользу различным областям, но одной из важных областей, нуждающихся в этих знаниях, является проверка точного механизма (механизмов), управляющего EAC. Механизм, управляющий EAC в водной среде, все еще активно обсуждается. Документы, в которых аргументируется один из двух основных предложенных механизмов, HEAC и разрыв пленки — анодное растворение, датируются 19 веком.70-х и 1980-х годов. Поскольку ЭАС в воде происходит в результате электрохимических и механических процессов, локализованных вблизи вершины трещины, знание химических и электрохимических условий в вершине трещины имеет жизненно важное значение для понимания механизма, управляющего ЭАС.
Достижения в экспериментальных методах для экспериментального исследования и изменения химии трещин и электрохимии, увеличение количества таких экспериментов для получения более подробных и контролируемых экспериментальных данных, а также сотрудничество в области экспериментов и моделирования позволят добиться прогресса в понимании. Прогресс в моделировании и характеристике химии крекинга и электрохимии может принести пользу различным областям, но одной из важных областей, нуждающихся в этих знаниях, является проверка точного механизма (механизмов), управляющего EAC. Механизм, управляющий EAC в водной среде, все еще активно обсуждается. Документы, в которых аргументируется один из двух основных предложенных механизмов, HEAC и разрыв пленки — анодное растворение, датируются 19 веком.70-х и 1980-х годов. Поскольку ЭАС в воде происходит в результате электрохимических и механических процессов, локализованных вблизи вершины трещины, знание химических и электрохимических условий в вершине трещины имеет жизненно важное значение для понимания механизма, управляющего ЭАС. Определение механизма (механизмов) позволило бы создать модели прогнозирования срока службы на основе первых принципов и улучшить наше понимание кинетики роста трещины EAC, влияния осажденных или осажденных поверхностных пленок и металлов и торможения роста трещины.
Определение механизма (механизмов) позволило бы создать модели прогнозирования срока службы на основе первых принципов и улучшить наше понимание кинетики роста трещины EAC, влияния осажденных или осажденных поверхностных пленок и металлов и торможения роста трещины.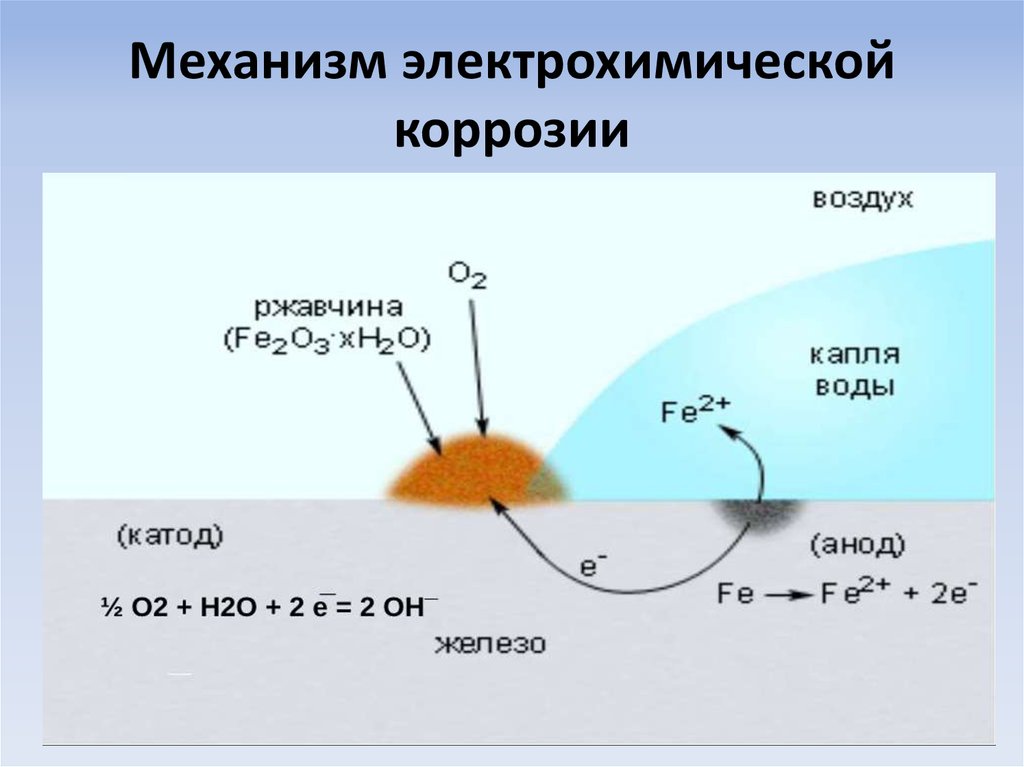 S.N.R.C. Определение и приоритизация потребностей в технической информации, влияющих на потенциальное регулирование длительного хранения и транспортировки отработавшего ядерного топлива . Отчет № ML14043A402. (2014).
S.N.R.C. Определение и приоритизация потребностей в технической информации, влияющих на потенциальное регулирование длительного хранения и транспортировки отработавшего ядерного топлива . Отчет № ML14043A402. (2014). Коррос. науч.
Коррос. науч.  соц.
соц.  J. Nucl. науч. Технол.
J. Nucl. науч. Технол.  А.
А.  Коррос. науч.
Коррос. науч. 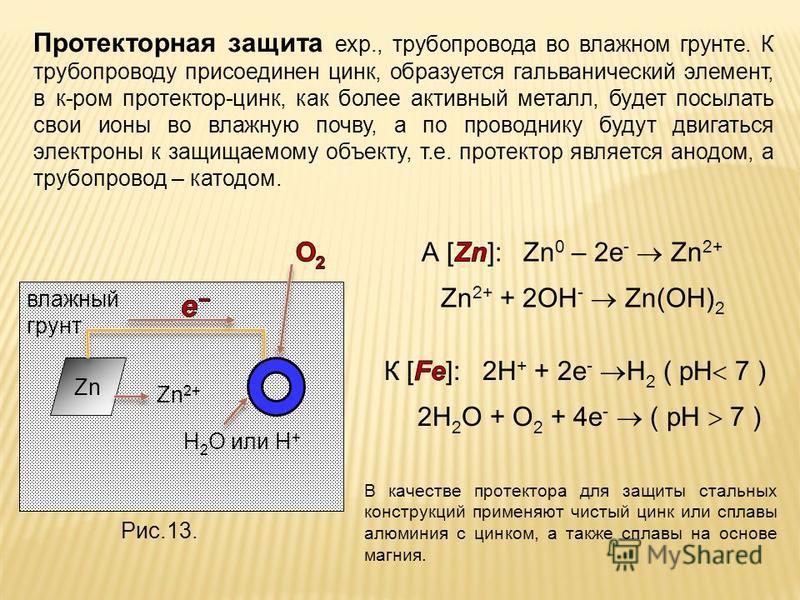 Коррос. науч.
Коррос. науч. 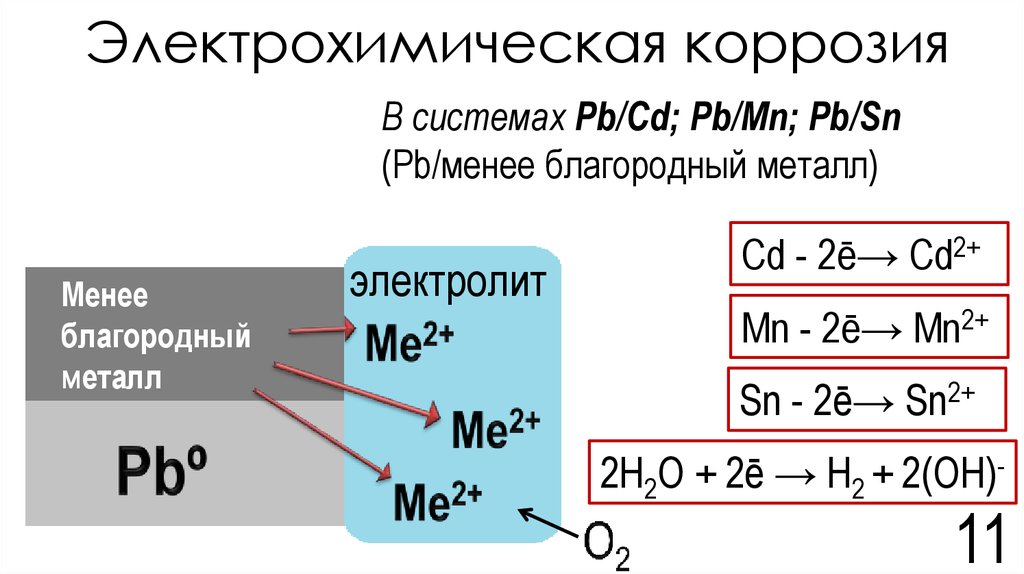 ).
).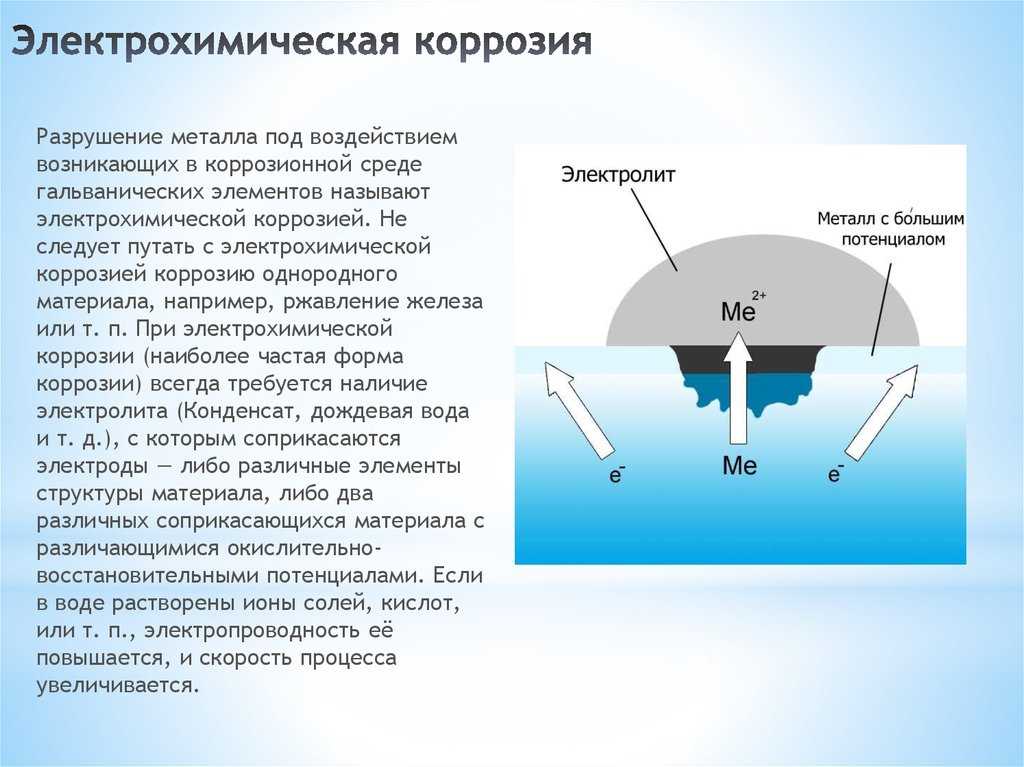
 Коррос. инж., наук. Технол.
Коррос. инж., наук. Технол. 
 B., Kelly, R.G. & Gangloff, R.P. Химический контроль межкристаллитного коррозионного растрескивания под напряжением в сенсибилизированном Al-Mg. Коррозия
B., Kelly, R.G. & Gangloff, R.P. Химический контроль межкристаллитного коррозионного растрескивания под напряжением в сенсибилизированном Al-Mg. Коррозия  Это незаменимая область исследований в области материаловедения и инженерии, поскольку коррозионная стойкость характеризует стабильность или долговечность материала, что является одним из наиболее важных характеристик материала при применении.
Это незаменимая область исследований в области материаловедения и инженерии, поскольку коррозионная стойкость характеризует стабильность или долговечность материала, что является одним из наиболее важных характеристик материала при применении. плотность трещин, уровень примесей и состояние поверхности.
плотность трещин, уровень примесей и состояние поверхности. д., могут прямо или косвенно взаимодействовать и постоянно или непостоянно влиять на процесс коррозии, прогнозирование долгосрочных коррозионное поведение довольно сложно. Выявление ключевого влияющего фактора и понимание его влияния на кинетику коррозии должно быть предметом исследования в этом аспекте.
д., могут прямо или косвенно взаимодействовать и постоянно или непостоянно влиять на процесс коррозии, прогнозирование долгосрочных коррозионное поведение довольно сложно. Выявление ключевого влияющего фактора и понимание его влияния на кинетику коррозии должно быть предметом исследования в этом аспекте. Даже при высоких температурах коррозию расплавленной соли также можно описать как электрохимический процесс. Таким образом, электрохимия является одним из наиболее актуальных предметов исследования коррозии (Mansfeld and Bertocci, 2005). Чтобы получить представление об основной области науки о коррозии, следует уделить первоочередное внимание изучению подробных электрохимических механизмов и созданию моделей интерфейса металл-электролит.
Даже при высоких температурах коррозию расплавленной соли также можно описать как электрохимический процесс. Таким образом, электрохимия является одним из наиболее актуальных предметов исследования коррозии (Mansfeld and Bertocci, 2005). Чтобы получить представление об основной области науки о коррозии, следует уделить первоочередное внимание изучению подробных электрохимических механизмов и созданию моделей интерфейса металл-электролит.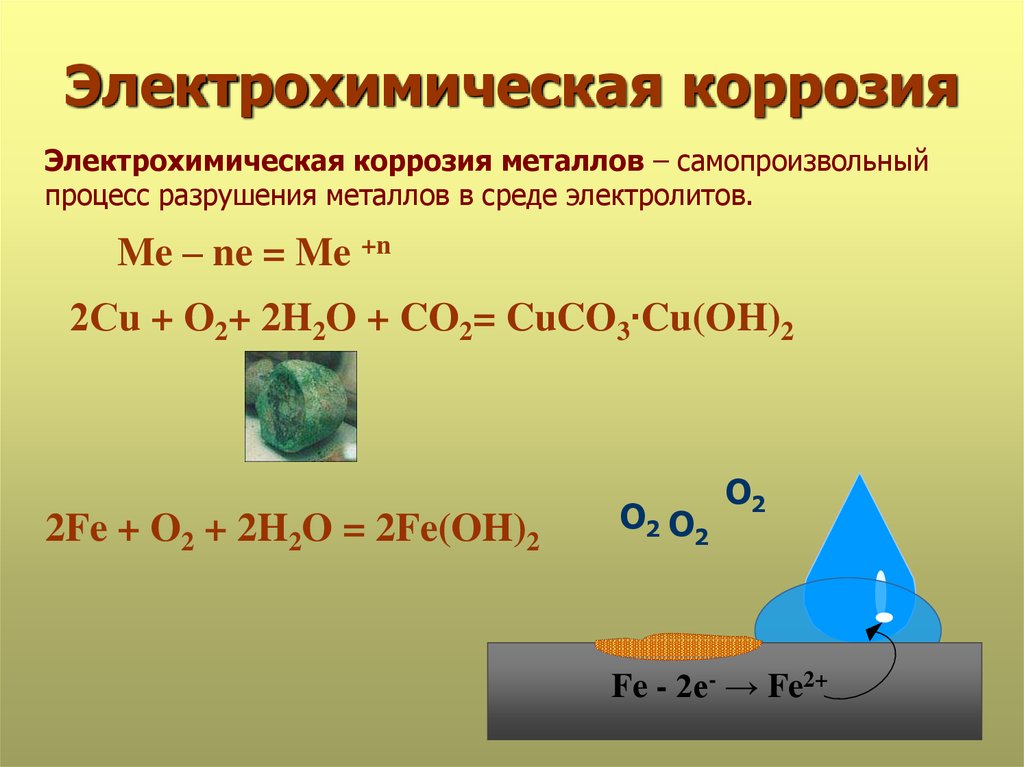 Они создали важное продолжение науки о коррозии, которая более или менее пересекается с наукой о поверхностях и покрытиях, технологиями и инженерией. Хотя технологические инновации являются центральной темой в этой области, очень желательны научные прорывы. Инновации в предотвращении коррозии часто появляются, когда новые идеи, методы и результаты других дисциплин внедряются в эту прикладную область исследований коррозии.
Они создали важное продолжение науки о коррозии, которая более или менее пересекается с наукой о поверхностях и покрытиях, технологиями и инженерией. Хотя технологические инновации являются центральной темой в этой области, очень желательны научные прорывы. Инновации в предотвращении коррозии часто появляются, когда новые идеи, методы и результаты других дисциплин внедряются в эту прикладную область исследований коррозии. Следовательно, многие коррозионные явления не поддаются теоретическому объяснению. Исследования коррозии в некоторых случаях должны опираться на значительный объем эмпирических знаний.
Следовательно, многие коррозионные явления не поддаются теоретическому объяснению. Исследования коррозии в некоторых случаях должны опираться на значительный объем эмпирических знаний.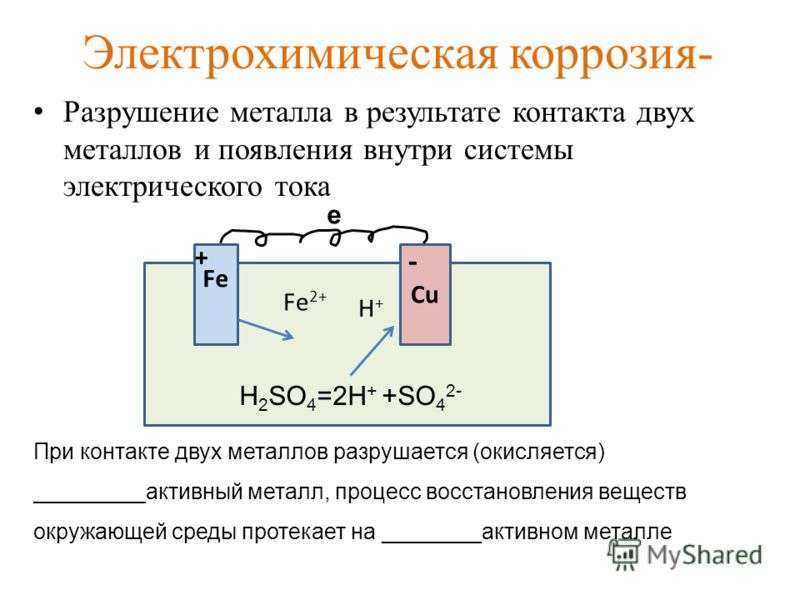 В настоящее время большинство передовых инструментов, обычно используемых для характеристики микроструктуры и состава поверхности металла на наноуровне, должны работать в высоком вакууме, или требуют тщательной предварительной обработки/подготовки образца, или требуют добавления некоторых вспомогательных частиц для провоцируют дополнительные реакции в коррозионной системе. Они не могут производить настоящие in situ возникает из-за ненарушенной коррозионной поверхности в агрессивных средах. Ожидается, что некоторые новые появляющиеся методы с высоким разрешением in situ , например, специально разработанная электролитная ячейка, которая может быть установлена в SEM или TEM, станут доступными для большинства исследователей коррозии при изучении микроструктуры и состава корродирующей поверхности в жидкие среды.
В настоящее время большинство передовых инструментов, обычно используемых для характеристики микроструктуры и состава поверхности металла на наноуровне, должны работать в высоком вакууме, или требуют тщательной предварительной обработки/подготовки образца, или требуют добавления некоторых вспомогательных частиц для провоцируют дополнительные реакции в коррозионной системе. Они не могут производить настоящие in situ возникает из-за ненарушенной коррозионной поверхности в агрессивных средах. Ожидается, что некоторые новые появляющиеся методы с высоким разрешением in situ , например, специально разработанная электролитная ячейка, которая может быть установлена в SEM или TEM, станут доступными для большинства исследователей коррозии при изучении микроструктуры и состава корродирующей поверхности в жидкие среды. Успешное решение этих критических проблем может значительно продвинуть эту область. Например, следующие темы особенно сложны и могут заинтересовать исследователей, занимающихся коррозионной наукой.
Успешное решение этих критических проблем может значительно продвинуть эту область. Например, следующие темы особенно сложны и могут заинтересовать исследователей, занимающихся коррозионной наукой. Например, сплавы Mg изначально были слишком активны, чтобы быть популярными конструкционными материалами, но теперь высокое соотношение прочности и веса делает их привлекательными в автомобильной промышленности в качестве материалов-кандидатов для автомобилей следующего поколения. Эти типы материалов обычно имеют коррозионное поведение, отличное от традиционных сплавов, и существующие знания и технологии защиты от коррозии и защиты не могут быть непосредственно применены к ним. Важно и сложно продолжать дальнейшее развитие существующих принципов и методов коррозии для покрытия этих передовых технических сплавов.
Например, сплавы Mg изначально были слишком активны, чтобы быть популярными конструкционными материалами, но теперь высокое соотношение прочности и веса делает их привлекательными в автомобильной промышленности в качестве материалов-кандидатов для автомобилей следующего поколения. Эти типы материалов обычно имеют коррозионное поведение, отличное от традиционных сплавов, и существующие знания и технологии защиты от коррозии и защиты не могут быть непосредственно применены к ним. Важно и сложно продолжать дальнейшее развитие существующих принципов и методов коррозии для покрытия этих передовых технических сплавов.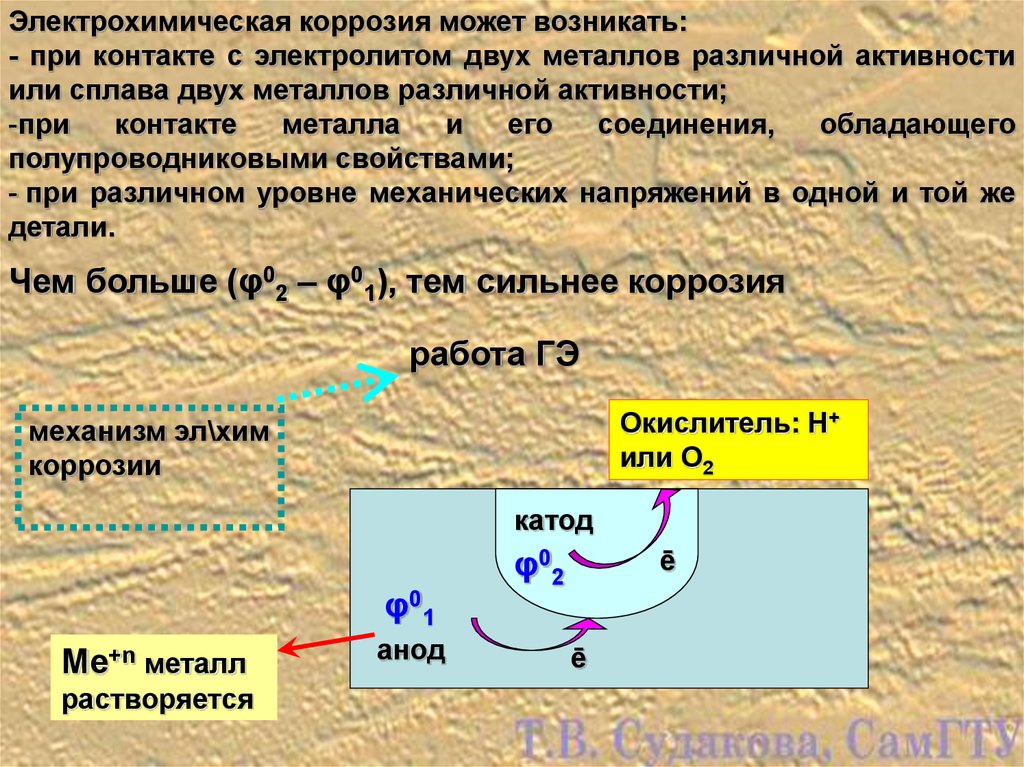 Понимание деталей коррозионной реакции в этих местах, очевидно, является неизбежным шагом в решении центральной проблемы науки о коррозии. К сожалению, эти дефекты обычно находятся в наномасштабе. Выявить механизм микрокоррозии в этих дефектных участках до получения 9 высокого разрешения — большая проблема.0198 in situ экспериментальных методов освоены учеными-коррозионистами.
Понимание деталей коррозионной реакции в этих местах, очевидно, является неизбежным шагом в решении центральной проблемы науки о коррозии. К сожалению, эти дефекты обычно находятся в наномасштабе. Выявить механизм микрокоррозии в этих дефектных участках до получения 9 высокого разрешения — большая проблема.0198 in situ экспериментальных методов освоены учеными-коррозионистами. Поскольку этот вид коррозии может в конечном итоге угрожать общественной безопасности, ученый-коррозионист обязан принять вызов, чтобы улучшить понимание коррозии в экстремальных условиях и разработать более эффективные методы предотвращения.
Поскольку этот вид коррозии может в конечном итоге угрожать общественной безопасности, ученый-коррозионист обязан принять вызов, чтобы улучшить понимание коррозии в экстремальных условиях и разработать более эффективные методы предотвращения. Таким образом, исследование механизма биоразложения и процесса коррозии in vivo в лаборатории останется сложной задачей в исследованиях коррозии.
Таким образом, исследование механизма биоразложения и процесса коррозии in vivo в лаборатории останется сложной задачей в исследованиях коррозии. Чтобы снизить риск, прогнозирование коррозионных характеристик в естественных условиях считается большой проблемой в исследованиях коррозии. В этом аспекте создание долгосрочной базы данных о коррозии является важной задачей, а компьютерное моделирование может стать подходом, который может привести к прорыву в прогнозировании коррозии.
Чтобы снизить риск, прогнозирование коррозионных характеристик в естественных условиях считается большой проблемой в исследованиях коррозии. В этом аспекте создание долгосрочной базы данных о коррозии является важной задачей, а компьютерное моделирование может стать подходом, который может привести к прорыву в прогнозировании коррозии.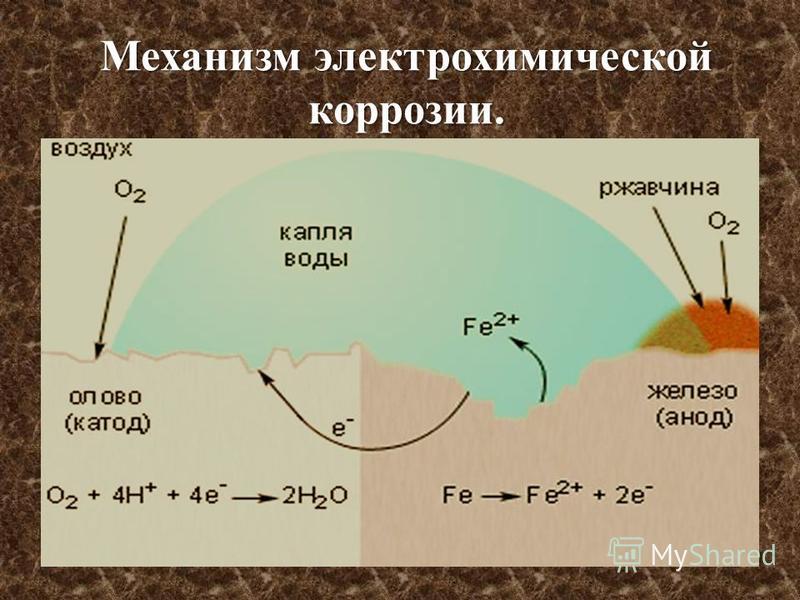 Очень интересно узнать, как, когда и где внезапно начинается переход. Предсказать появление перехода на металлической поверхности сложно, но это сложная цель, которую необходимо решить при исследовании коррозии.
Очень интересно узнать, как, когда и где внезапно начинается переход. Предсказать появление перехода на металлической поверхности сложно, но это сложная цель, которую необходимо решить при исследовании коррозии. д., оно найдет гораздо более широкое применение. себя, а также значительно расширить применение металлических компонентов/деталей в промышленности. Однако у такого покрытия будет слишком много противоречивых требований, чтобы идти на компромисс. Его изобретение и разработка не только сложны, но и интересны.
д., оно найдет гораздо более широкое применение. себя, а также значительно расширить применение металлических компонентов/деталей в промышленности. Однако у такого покрытия будет слишком много противоречивых требований, чтобы идти на компромисс. Его изобретение и разработка не только сложны, но и интересны. Вокруг этого есть по крайней мере восемь больших проблем на передовых рубежах исследований коррозии. Оспаривание этих актуальных тем может привести к прорыву в области науки о коррозии.
Вокруг этого есть по крайней мере восемь больших проблем на передовых рубежах исследований коррозии. Оспаривание этих актуальных тем может привести к прорыву в области науки о коррозии.
 Выполнение тестирования ASTM очень просто благодаря нашему стандартному списку экспериментов: сопротивление поляризации, потенциодинамический анализ, циклическая поляризация и т. д. Наш мастер последовательности позволяет объединить эксперименты, нажать кнопку «Пуск» и вернуться к ним, когда закончите.
Выполнение тестирования ASTM очень просто благодаря нашему стандартному списку экспериментов: сопротивление поляризации, потенциодинамический анализ, циклическая поляризация и т. д. Наш мастер последовательности позволяет объединить эксперименты, нажать кнопку «Пуск» и вернуться к ним, когда закончите.
 Gamry рекомендует электрохимический мультиплексор ECM8, если требуется повышенная пропускная способность по более низкой цене. Обратите внимание, что мультиплексор запускает эксперименты последовательно, а не одновременно. Для очень устойчивых к коррозии систем (очень низкая скорость коррозии) Gamry рекомендует Reference 600+ из-за его слаботочных характеристик (минимальный диапазон полной шкалы 60 пА).
Gamry рекомендует электрохимический мультиплексор ECM8, если требуется повышенная пропускная способность по более низкой цене. Обратите внимание, что мультиплексор запускает эксперименты последовательно, а не одновременно. Для очень устойчивых к коррозии систем (очень низкая скорость коррозии) Gamry рекомендует Reference 600+ из-за его слаботочных характеристик (минимальный диапазон полной шкалы 60 пА).
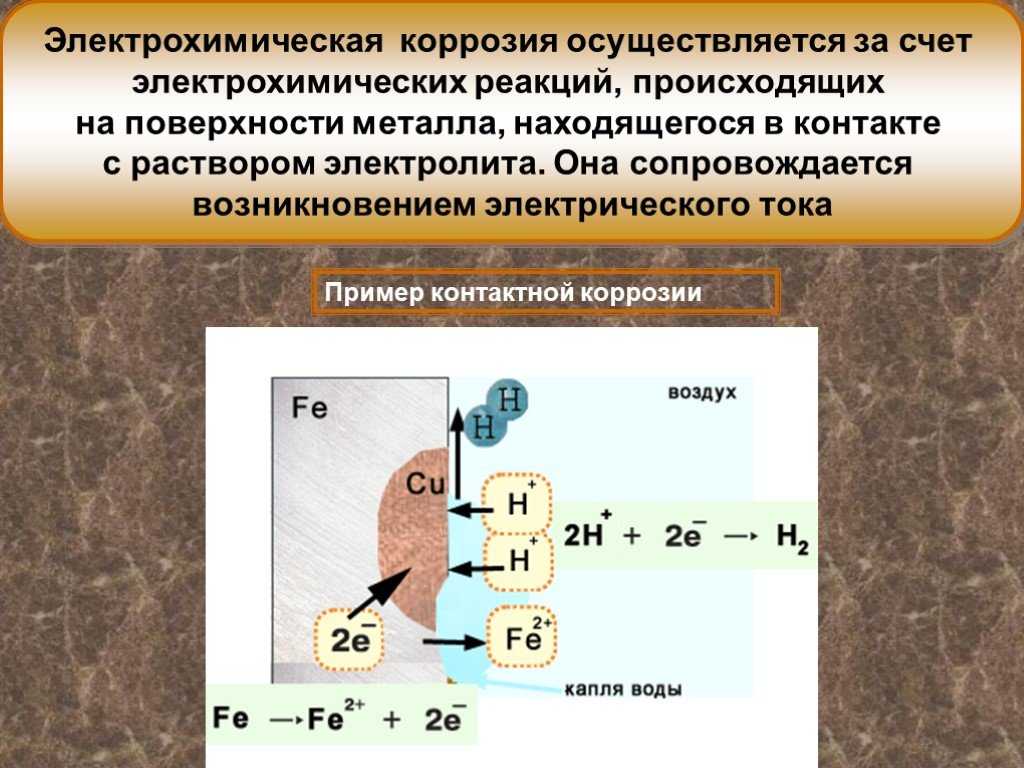
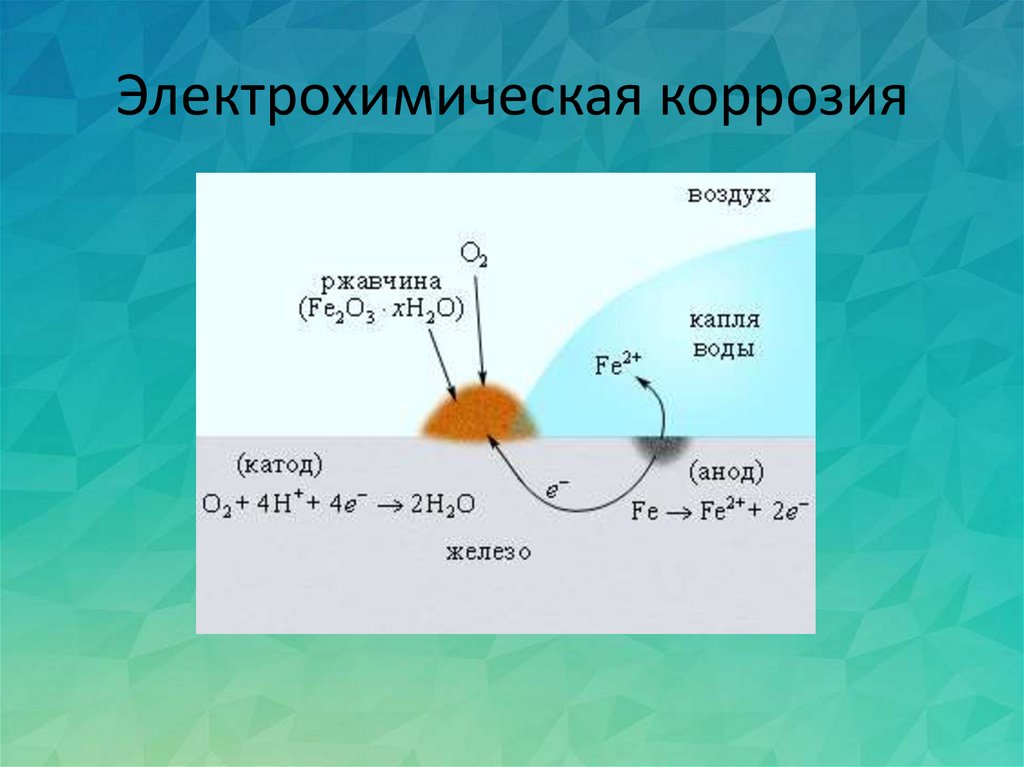 Коррозия происходит на аноде.
Коррозия происходит на аноде.


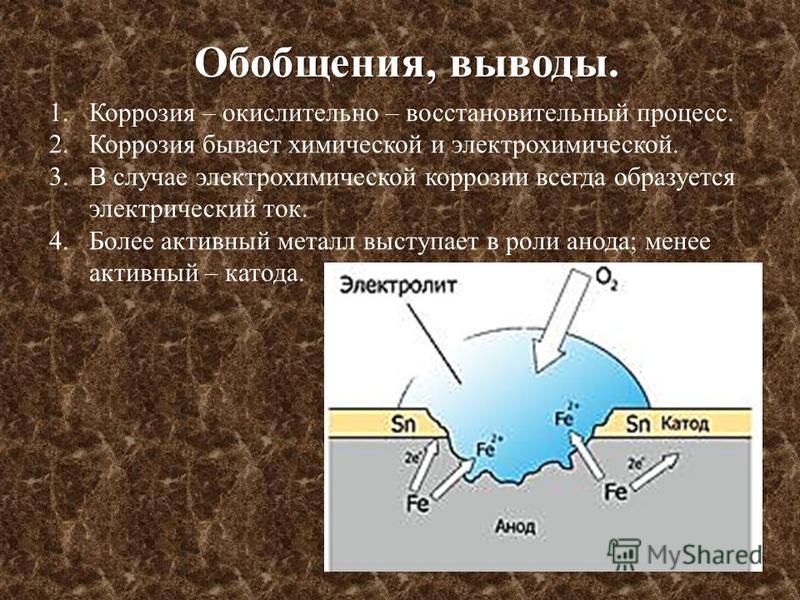
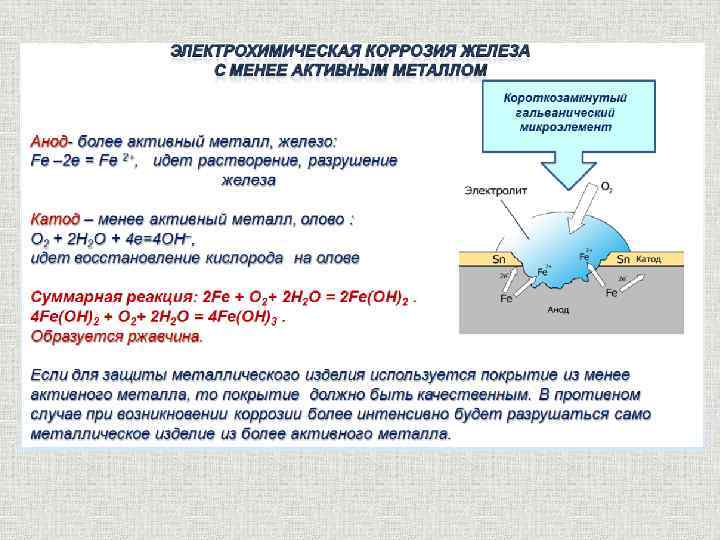

 Часть металла, подверженная воздействию более низкой концентрации кислорода, действует как анод, а часть металла, подвергающаяся воздействию более высокой концентрации, действует как катод, так что область с низким содержанием кислорода подвергается коррозии.
Часть металла, подверженная воздействию более низкой концентрации кислорода, действует как анод, а часть металла, подвергающаяся воздействию более высокой концентрации, действует как катод, так что область с низким содержанием кислорода подвергается коррозии. 
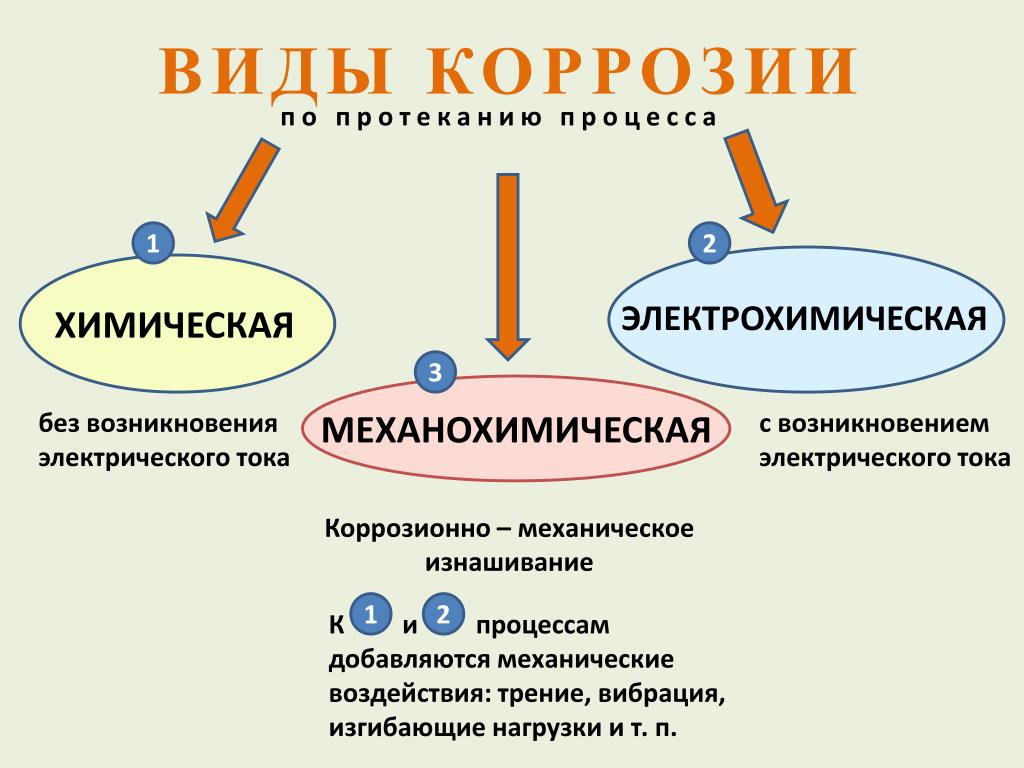 После образования питтинга коэффициент коррозии увеличивается, так как из-за образования меньшей анодной и большей катодной площадей происходит интенсивная коррозия.
После образования питтинга коэффициент коррозии увеличивается, так как из-за образования меньшей анодной и большей катодной площадей происходит интенсивная коррозия. 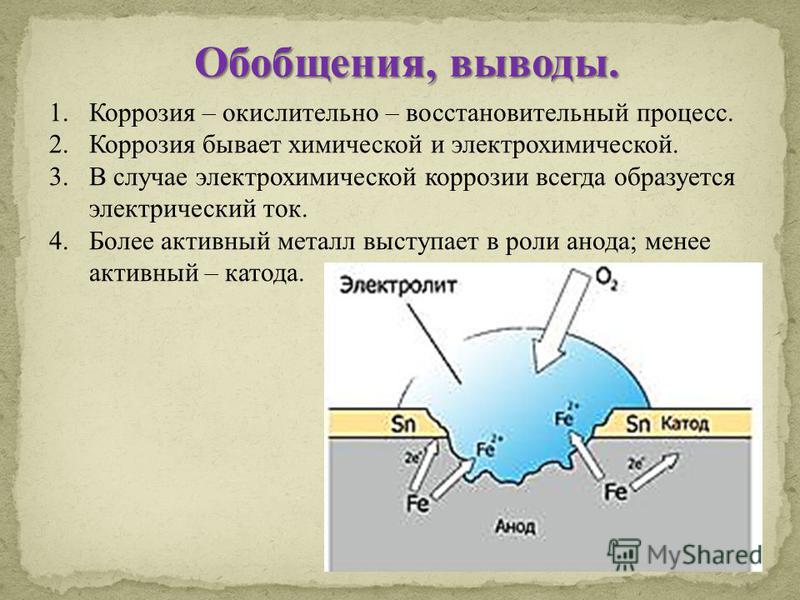

 д., которые блокируют трещины, тем самым предотвращая проникновение щелочи.
д., которые блокируют трещины, тем самым предотвращая проникновение щелочи. д.
д. д.
д.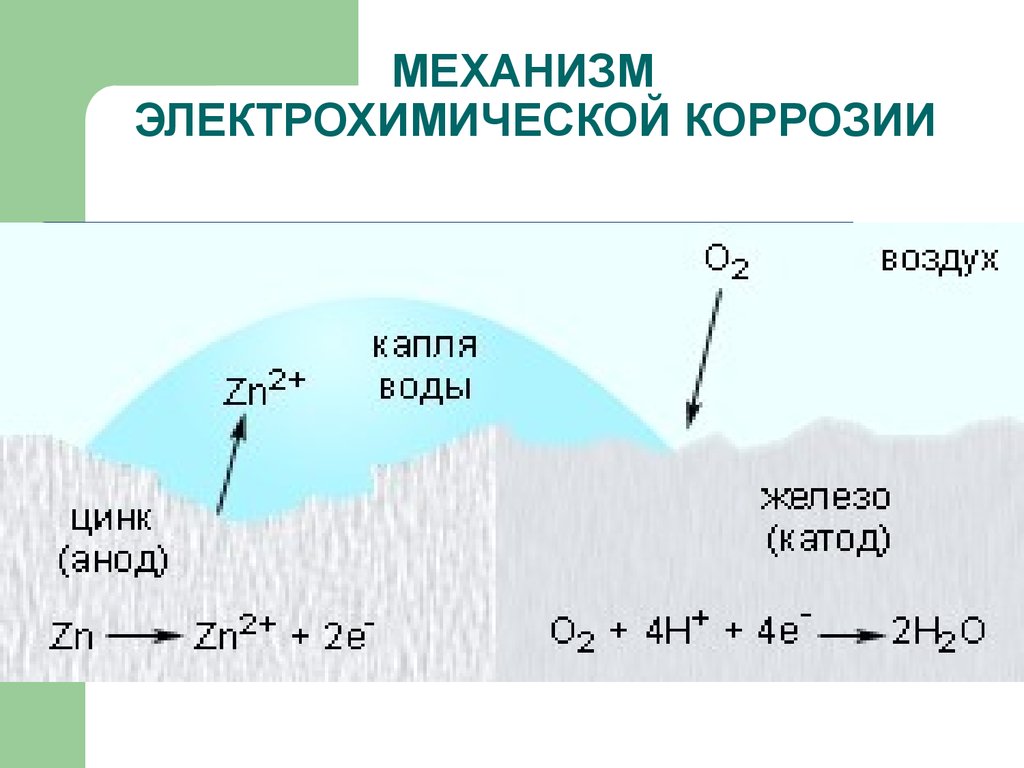 С другой стороны, если Zn покрывается Fe, то при наличии нескольких точечных отверстий создается большая анодная площадь и меньшая катодная площадь, поскольку Fe является катодным по отношению к цинку, поэтому скорость коррозии очень низкая.
С другой стороны, если Zn покрывается Fe, то при наличии нескольких точечных отверстий создается большая анодная площадь и меньшая катодная площадь, поскольку Fe является катодным по отношению к цинку, поэтому скорость коррозии очень низкая. При рН больше 10 коррозия железа идет очень слабо из-за образования защитного покрытия из гидроокисей железа.
При рН больше 10 коррозия железа идет очень слабо из-за образования защитного покрытия из гидроокисей железа. Обычно это связано с увеличением конц. Ионов растворенных металлов вблизи электрода или также из-за анодной пассивности. Катодная поляризация уменьшает катодную реакцию, тем самым препятствуя соединению катодного реагента и электрона. Для того, чтобы коррозия продолжалась, и анодная, и катодная реакции должны протекать одновременно, если какая-либо из реакций протекает медленнее, то скорость коррозии медленнее. Использование деполяризаторов снижает поляризационный эффект, следовательно, скорость коррозионной реакции увеличивается.
Обычно это связано с увеличением конц. Ионов растворенных металлов вблизи электрода или также из-за анодной пассивности. Катодная поляризация уменьшает катодную реакцию, тем самым препятствуя соединению катодного реагента и электрона. Для того, чтобы коррозия продолжалась, и анодная, и катодная реакции должны протекать одновременно, если какая-либо из реакций протекает медленнее, то скорость коррозии медленнее. Использование деполяризаторов снижает поляризационный эффект, следовательно, скорость коррозионной реакции увеличивается.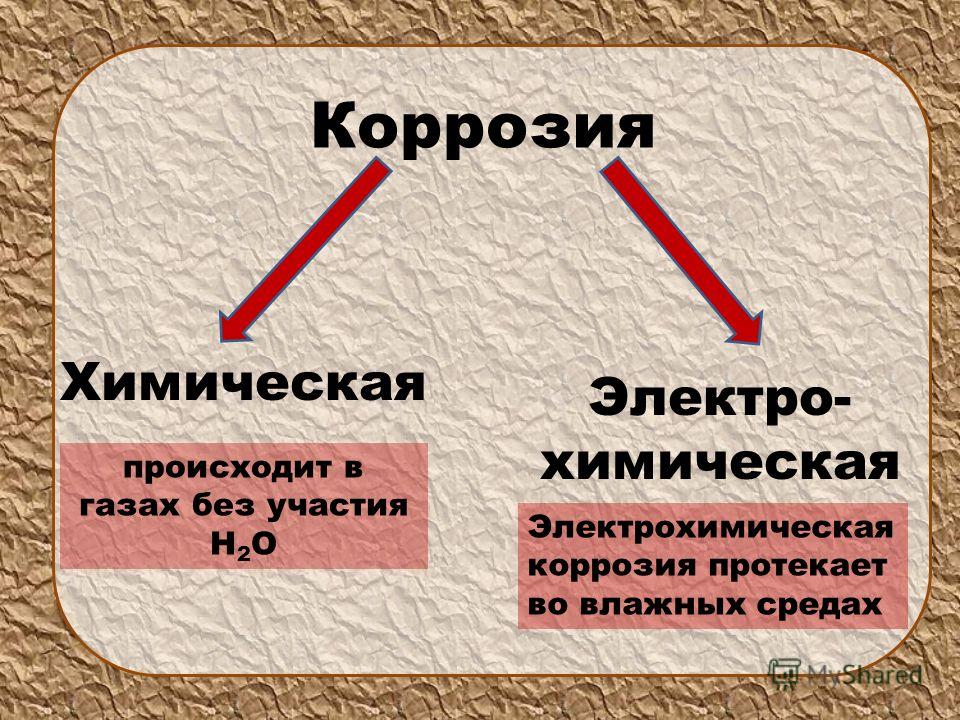 Это можно сделать, покрыв металл (основной металл) слоем другого металла. Этот процесс известен как покрытие металлом.
Это можно сделать, покрыв металл (основной металл) слоем другого металла. Этот процесс известен как покрытие металлом.  Открытая часть основного металла является катодной по отношению к металлу покрытия, и металл покрытия подвергается коррозии только там, защищая основной металл. Защита есть, пока есть покрытие. Гальванизация является одним из лучших способов анодирования.
Открытая часть основного металла является катодной по отношению к металлу покрытия, и металл покрытия подвергается коррозии только там, защищая основной металл. Защита есть, пока есть покрытие. Гальванизация является одним из лучших способов анодирования.
 Затем обработали разбавителем. h3SO4, для удаления ржавчины и уплотняющих отложений, в завершение хорошо промывается водой и сушится на воздухе. Затем его пропускают через флюс ZnCl2 и Nh5Cl (расплавленный), так что расплавленная оловянная банка должным образом прилипает к поверхности металла, затем основной металл пропускают через резервуар, содержащий расплавленное олово.
Затем обработали разбавителем. h3SO4, для удаления ржавчины и уплотняющих отложений, в завершение хорошо промывается водой и сушится на воздухе. Затем его пропускают через флюс ZnCl2 и Nh5Cl (расплавленный), так что расплавленная оловянная банка должным образом прилипает к поверхности металла, затем основной металл пропускают через резервуар, содержащий расплавленное олово.  Эти типы покрытий отличаются от металлических покрытий, поскольку они являются неотъемлемой частью самого металла и в дополнение к коррозионной стойкости обеспечивают повышенную электрическую изоляцию, а также физический вид металла. В поверхностном конверсионном покрытии важны два типа:
Эти типы покрытий отличаются от металлических покрытий, поскольку они являются неотъемлемой частью самого металла и в дополнение к коррозионной стойкости обеспечивают повышенную электрическую изоляцию, а также физический вид металла. В поверхностном конверсионном покрытии важны два типа: В первые десять минут потенциал увеличивают от 0 до 40 В и при 40 В продолжают анодирование в течение примерно 20 минут, после чего повышают потенциал от 40 В до 50 В и поддерживают на уровне 50 В в течение 5 минут, получается непрозрачный оксидный слой толщиной 2-8 микрометров. Если требуется большая толщина, в качестве электролита используется 10% серная кислота при 220°С с плотностью тока около 160 миллиампер/см2 при 24 В, получается бесцветный слой толщиной 25 микрометров. После этого изделие должно быть должным образом окрашено и, наконец, обработано кипяченой водой, содержащей сульфат кобальта или никеля или ацетат для повышения коррозионной стойкости.
В первые десять минут потенциал увеличивают от 0 до 40 В и при 40 В продолжают анодирование в течение примерно 20 минут, после чего повышают потенциал от 40 В до 50 В и поддерживают на уровне 50 В в течение 5 минут, получается непрозрачный оксидный слой толщиной 2-8 микрометров. Если требуется большая толщина, в качестве электролита используется 10% серная кислота при 220°С с плотностью тока около 160 миллиампер/см2 при 24 В, получается бесцветный слой толщиной 25 микрометров. После этого изделие должно быть должным образом окрашено и, наконец, обработано кипяченой водой, содержащей сульфат кобальта или никеля или ацетат для повышения коррозионной стойкости. 3. Ускорители, такие как нитраты, нитриты, перекись водорода и рН обычно в диапазоне 1,8-3,2, если процесс иммерсионного типа. Если процесс типа распыления, то PH находится в пределах от 3,2 до 7,8, а температура поддерживается на уровне 35°C.
3. Ускорители, такие как нитраты, нитриты, перекись водорода и рН обычно в диапазоне 1,8-3,2, если процесс иммерсионного типа. Если процесс типа распыления, то PH находится в пределах от 3,2 до 7,8, а температура поддерживается на уровне 35°C.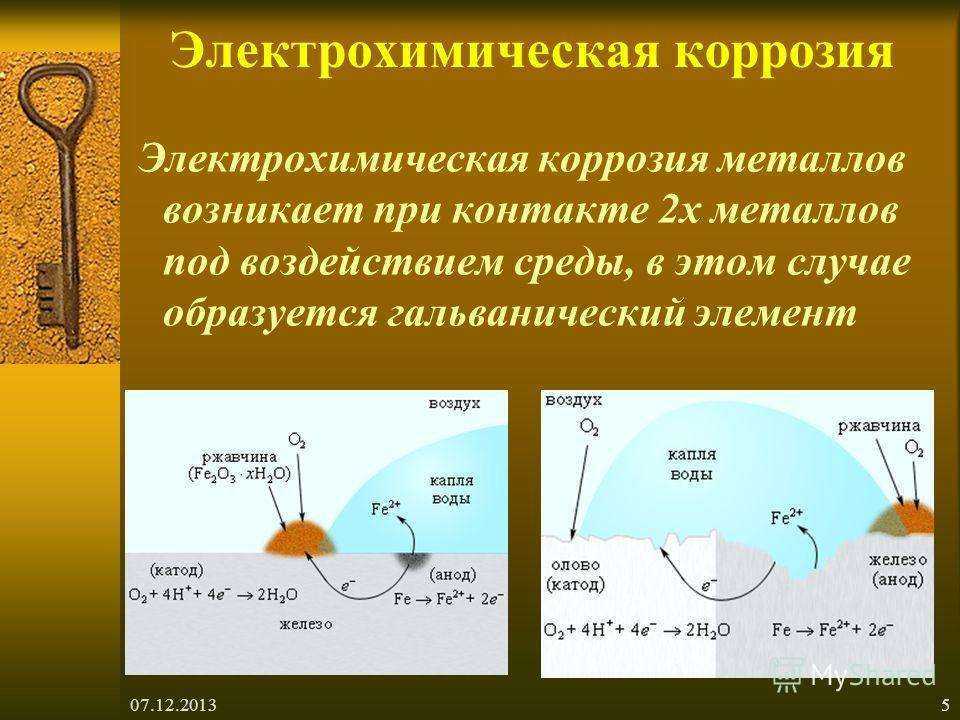


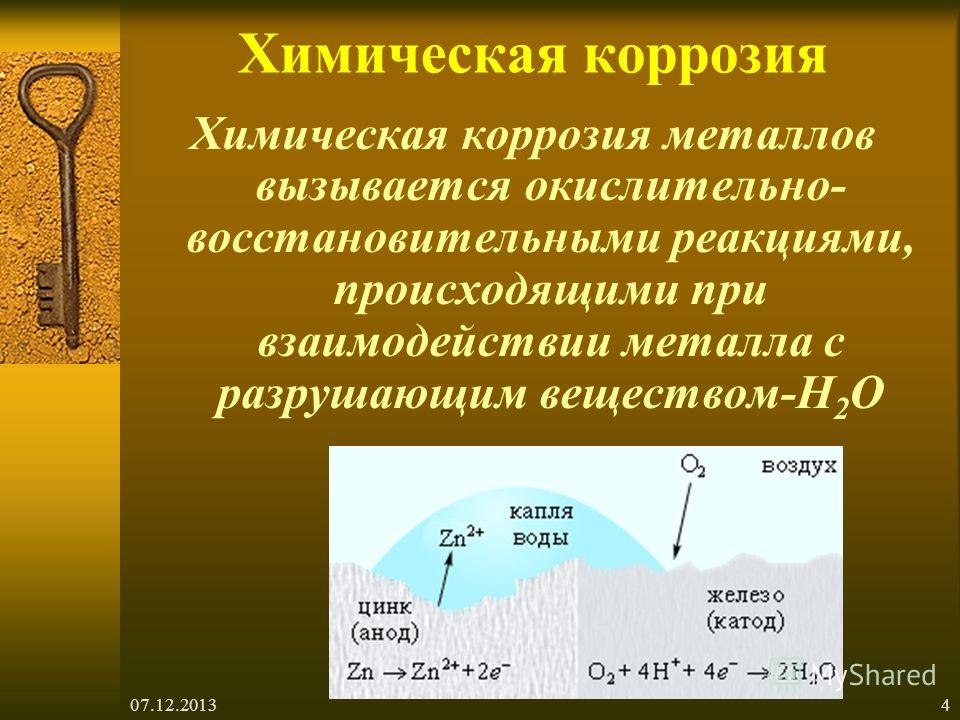
 В противном случае реакция замедляется добавлением неорганических ингибиторов, таких как сульфаты цинка, магния, марганца и т. д. Они реагируют с ионами ОН- (которые высвобождаются на катоде), образуя нерастворимые гидроксиды, которые образуют защитную пленку на катодной поверхности и, следовательно, скорость коррозии снижается. Ингибиторы коррозии имеют определенные ограничения
В противном случае реакция замедляется добавлением неорганических ингибиторов, таких как сульфаты цинка, магния, марганца и т. д. Они реагируют с ионами ОН- (которые высвобождаются на катоде), образуя нерастворимые гидроксиды, которые образуют защитную пленку на катодной поверхности и, следовательно, скорость коррозии снижается. Ингибиторы коррозии имеют определенные ограничения  Метод расходуемого анода:
Метод расходуемого анода: 
 Потенциал, необходимый для роста оксидной пленки и защиты металла, может быть получен из кривой потенциал-ток.
Потенциал, необходимый для роста оксидной пленки и защиты металла, может быть получен из кривой потенциал-ток. Это электронное устройство, которое поддерживает постоянный потенциал металла относительно вспомогательного платинового электрода сравнения и каломельного электрода сравнения.
Это электронное устройство, которое поддерживает постоянный потенциал металла относительно вспомогательного платинового электрода сравнения и каломельного электрода сравнения.