Химическая и электрохимическая коррозия: Ошибка 403 — доступ запрещён
Содержание
Виды коррозии, защита и хранение металлических изделий
Несоблюдение правил хранения может привести к порче продукции. Гарантия производителя на изделия из оцинкованной стали предоставляется только в том случае, если соблюдены все условия транспортировки, хранения и монтажа изделий.
Основой оцинкованных изделий служит стальной лист, на котором под внешним воздействием атмосферы возможно возникновение коррозии. Чтобы этого избежать тонколистый стальной прокат обработан несколькими защитными слоями: цинковым и несколькими полимерными покрытиями, которые препятствуют прямому контакту стали с внешней средой.
Если оцинкованная сталь подвергается воздействию влаги (дождь, роса, конденсат) в среде, где не хватает кислорода, то вода быстро реагирует с цинком и постепенно разъедает покрытие. Наиболее распространённые условия, в которых появляется белая ржавчина, — изделия хранятся в заводской упаковке и/или плотно прижатыми друг к другу.
Физико-химические процессы разрушения металла
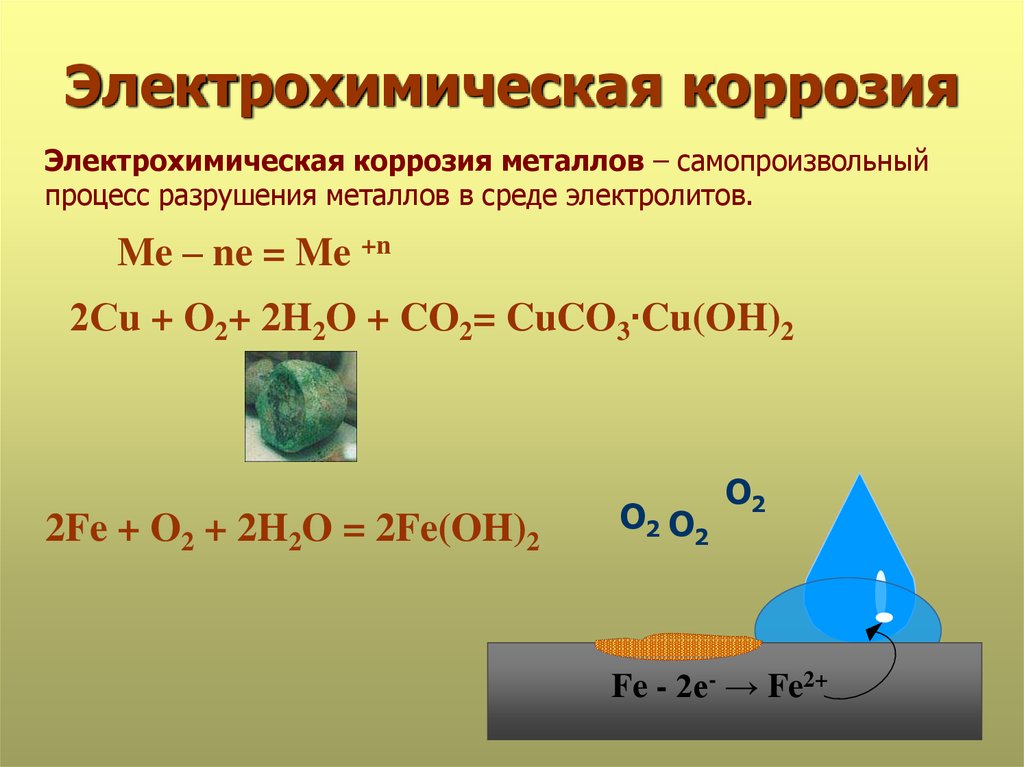
Коррозия — это самопроизвольно протекающий процесс разрушения металла, вследствие химического или электрохимического взаимодействия металла с окружающей средой.
Различают химическую и электрохимическую коррозию.
Химическая коррозия — коррозия металла в газовой и жидкостной среде, не проводящей ток. Коррозия этого вида состоит в окислении металла в результате непосредственного его химического взаимодействия с окружающей средой. В таких средах, как воздух, продукты сгорания каменного угля и других видов топлива (нефть, бензин, керосин, смазочные масла) обычно развивается химическая коррозия.
Но наличие даже небольших количеств влаги в указанных веществах может в большей или меньшей степени сообщить коррозии электрохимический характер. Химическая коррозия в чистом виде — достаточно специфическое явление, преобладающее в средах, достаточно закрытых для окружающего природного воздействия. Большое практическое значение имеет электрохимическая коррозия.
Большое практическое значение имеет электрохимическая коррозия.
Электрохимическая коррозия
Электрохимическая коррозия имеет характер анодного окисления металла, которое может протекать по двум различным механизмам:
– гальванокоррозия — окисление металла, являющегося анодом самопроизвольно возникающей гальванической цепи;
– электрокоррозия — окисление металла, являющегося анодом своеобразной электролизной системы, самопроизвольно возникающей под влиянием тока от внешнего источника.
Гальванокоррозия
При гальванокоррозии основная масса металла обычно играет роль анода. В качестве материала катода могут служить самые разнообразные вещества, но обязательно являющиеся электронными проводниками. Сюда относятся более электронофильные металлы, чем анод. Например, по отношению к железному аноду такими металлами являются Sn, Pb, Cu, Hg, Ag и т.п. Роль катодов может выполнять и ряд электропроводящих неметаллических материалов, среди которых назовём ржавчину, зёрна графита, угля, цементита (карбида железа Fe3C), шлаковые включения в металл и т. д.
д.
Процессы, протекающие при гальванокоррозии, рассмотрим на двух примерах, представляющих практический интерес: коррозию железа в контакте: а) с цинком и б) с оловом во влажном воздухе.
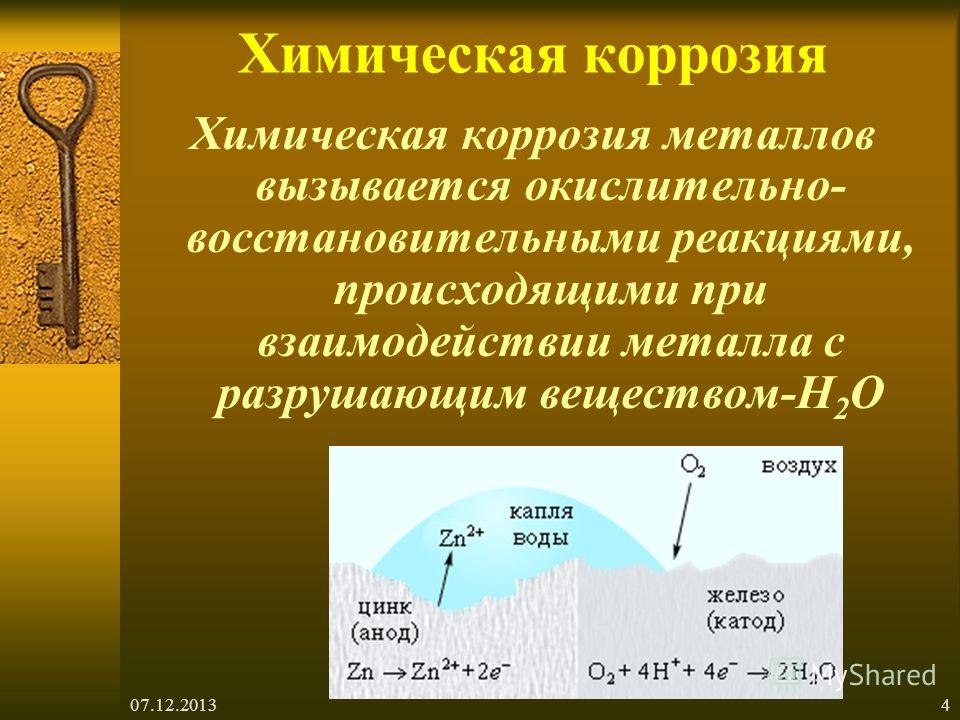
а) Коррозионный процесс в гальванопаре Zn/Fe. Цинк, как сравнительно более химически активный металл, подвергается анодному окислению и переходит в состояние ионов.
Реакция на аноде**: 2Zn – 4e- → 2Zn** (окисление).
Реакция на катоде: 2h3O + O2 + 4e- → 4OH’ (восстановление).
Вторичная реакция: 2Zn** + 4OH’ → 2Zn(OH)2.
В процессе работы коррозионной гальванопары Zn/Fe окисляется, разрушается цинк. За счёт электронов последнего железо предохраняется от коррозии.
б) Коррозионный процесс в гальванопаре Sn/Fe. В данном случае железо более химически активный металл, чем олово. Катодом гальванопары будет олово, а анодом — железо.
Реакция на аноде**: 2Fe – 4e- → 2Fe** (окисление).
Реакция на катоде: 2h3O + O2 + 4e- → 4OH’ (восстановление).
Они приводят к образованию бурой ржавчины.
Таким образом, в процессе работы рассматриваемой гальванопары окисляется и разрушается железо, а олово остается без изменения.
На практике подобные явления встречаются при коррозии оцинкованного и луженого железа. В случае нанесения на железо менее химически активного металла (Sn, Cu, Ni, Cr, Ag, Au), для придания поверхности декоративных и других полезных свойств, защита железа происходит путем его изоляции от внешней среды. При повреждении внешнего защитного слоя начинают протекать описанные реакции и железо ржавеет.
Коррозионные элементы могут возникать во всех случаях, когда в присутствии электролита соприкасаются металлы, различающиеся между собой электродными потенциалами.
Особо нужно отметить влияние температуры. Повышение температуры ускоряет физические и химические процессы.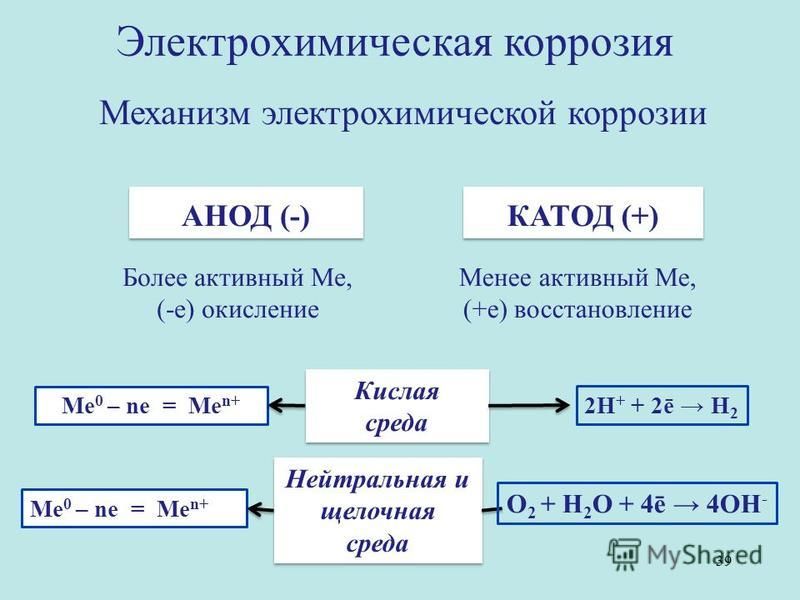 В водной среде это особенно заметно при температуре около 60°С. При температуре около 70°С в гальванопаре Zn/Fe может произойти изменение потенциала цинка, в результате чего цинковое покрытие становится катодам, а железо анодом. Отмечают, что изменению полярности цинка способствуют низкое содержание в воде кислорода и высокое бикарбонатов. В таких условиях коррозировать будет железо.
В водной среде это особенно заметно при температуре около 60°С. При температуре около 70°С в гальванопаре Zn/Fe может произойти изменение потенциала цинка, в результате чего цинковое покрытие становится катодам, а железо анодом. Отмечают, что изменению полярности цинка способствуют низкое содержание в воде кислорода и высокое бикарбонатов. В таких условиях коррозировать будет железо.
Электрокоррозия
К электрокоррозии относятся случаи электрохимической коррозии металлов, протекающие под влиянием электрического тока от внешнего источника. Здесь в основе явления, как уже отмечалось, лежит самопроизвольно возникающий процесс электролиза. В качестве примера рассмотрим электрокоррозию под влиянием так называемых блуждающих токов.
Металлические листы с полимерным покрытием, сложенные в пачку, представляют собой электрический конденсатор, где металлическая основа листа представляет собой обкладки конденсатора, а полимерное покрытие — диэлектрический слой между обкладками. В следствие неравномерности нагрева листов, воздействия внешних источников энергии и других факторов окружающей среды между различными листами пачки могут возникать разности электрического потенциала.
В следствие неравномерности нагрева листов, воздействия внешних источников энергии и других факторов окружающей среды между различными листами пачки могут возникать разности электрического потенциала.
В воде любого типа в большем или меньшем количестве содержатся растворенные соли, коллоидные и взвешенные вещества, живые микроорганизмы, в воду попадают частицы пыли и дыма. Поэтому при изучении поведения цинка и цинковых покрытий в водных средах воду следует рассматривать как коррозионный электролит. Если торцевую часть листов с разностью электрических потенциалов поместить в раствор соли, которым могут являться атмосферные осадки и конденсат, то возникает естественный процесс электролиза. На одном из листов, на его торцевой части, будет происходить анодное окисление металла, т.е. его коррозия.
Состав электролита, в особенности величина его рН, существенно влияет на скорость коррозии. Так, повышение концентрации Н’-ионов (кислая среда), как правило, резко убыстряет разрушение металла.
Повышение концентрации ОН’-ионов (щелочная среда) в электролите замедляет коррозию таких металлов, как Fe, Mg в следствии образования гидроокисных защитных плёнок.
У металлов Al, Zn, Pb повышение щелочности среды на разрушение этих металлов действует убыстряющим образом т.к. гидроокиси этих металлов растворимы в щелочах. Описанная особенность этих металлов является причиной такого явления как белая ржавчина.
Белая ржавчина на цинковом покрытии
Цинк — сравнительно реактивный металл, он активно реагирует с кислотами и щелочами. Лучше всего он проявляет свои антикоррозионные свойства в рН нейтральной среде. Долговечность цинкового покрытия зависит от формирования оксидно-карбонатной пленки. После окончательного формирования оксидно-карбонатной пленки уровень коррозии цинковых покрытий становится очень низким — не более двух микрон в год в нейтральной среде.
Химические реакции, требуемые для формирования этой плёнки, занимают некоторое время (от нескольких недель до нескольких месяцев):
1. Фаза окисления 2Zn + O2 = 2ZnO
Фаза окисления 2Zn + O2 = 2ZnO
2. Фаза гидратации 2Zn = 2h3O + O2 = 2Zn(OH)2
3. Карбонизации 5Zn(OH)2 = 2CO2 + 2ZnCO3.3Zn(OH)2 + 2h3O
На последнем этапе окончательно формируется трудно растворимый основной карбонат цинка, который обеспечивает надежную антикоррозионную защиту цинковому слою при негативном воздействии влаги. В условиях относительно сухой среды протекают все три реакции, и на поверхности оцинкованного изделия формируется оксидно-карбонатная плёнка, будучи почти непроницаемой для кислорода и влаги, резко ограничивает дальнейший процесс взаимодействия цинка с кислородом.
Иное происходит, если изделие свежеоцинкованное или на нём присутствуют места без сформированного плёночного покрытия (в частности, срезы профилированной продукции) хранится в условиях, когда на него воздействует дождь, роса, конденсат, а подвод углекислого газа и кислорода, способствующего образованию плотной оксидно-карбонатной пленки затруднен. В этом случает происходят только фазы окисления и гидратации. В результате получаются гидроксид и оксид цинка — вещества в виде белого порошка, обладающие низкой адгезионной способностью к поверхности, легко пропускающие кислород к цинку, допускающие его последующее окисление и развитие процессов образования белой ржавчины.
В этом случает происходят только фазы окисления и гидратации. В результате получаются гидроксид и оксид цинка — вещества в виде белого порошка, обладающие низкой адгезионной способностью к поверхности, легко пропускающие кислород к цинку, допускающие его последующее окисление и развитие процессов образования белой ржавчины.
Еще одним случаем, представляющим опасность образования белой ржавчины, являются участки соприкасающихся между собой поверхностей оцинкованных изделий с уже окончательно сформировавшейся оксидно-карбонатной плёнкой. В этих местах задерживается дождевая влага (или конденсируется влага из воздуха при нахождении изделий на воздухе при температуре ниже точки росы), а испаряется она в последнюю очередь. Во всех природных водах присутствует углекислота, которая может находиться в воде в виде растворенного газа СО2 и недиссоциированных молекул Н2СО3 или ионов НСО3- и СО3в2-. Углекислота и присутствующие в воде нитраты, сульфаты, хлориды без доступа кислорода разрушают образующуюся на поверхности цинка оксидно-карбонатную пленку и тем самым усиливают коррозию, приводящую к образованию белой ржавчины.
При очень длительном хранении (от полугода) оцинкованных изделий с полимерным покрытием в неблагоприятных условиях, оксид и гидроксид цинка — вещества в виде белого порошка может выделяться и на поверхности полимерного покрытия (в особенности на обратной стороне листа, который как правило покрыт только грунтовым полимерным слоем).
В благоприятных (для белой ржавчины) условиях разъедание цинка может происходить при уровнях коррозии в 20–50 раз больших, чем обычно предполагается.
Условия хранения и эксплуатации
Из всего вышеизложенного можно сделать следующие выводы.
Цинковое покрытие стальных изделий хорошо работает как защитный слой в нейтральной сухой или влажной воздушной среде и при кратковременном воздействии воды со свободным доступом кислорода. При таких условиях работает эффект гальванопары Zn/Fe — эффект оксидно-карбонатной пленки. Такие условия соответствуют нормальным условиям эксплуатации изделий.
В случае долговременного нахождения стальных оцинкованных изделий, сложенных в пачку, в водной среде при ограниченном доступе кислорода и повышенной температуре (более 70°С), начинают протекать реакции, при которых защитные эффекты перестают работать. Происходит активное разрушение защитного слоя. Как правило, такие негативные условия складываются при неправильном хранении изделий. При нарушении условий хранения риск поражения коррозией значительно выше, чем при неправильной эксплуатации или монтаже.
Правила хранения оцинкованных изделий:
• Изделия хранятся в заводской упаковке НЕ более 1 (одной) недели с даты поставки. Пачки в заводской упаковке укладываются на ровное место на бруски с шагом 0,5 м.
• При необходимости хранения профилированной продукции более 1 (одной) недели ее размещают под навесами или в крытых неотапливаемых, сухих помещениях без прямого воздействия солнечных лучей и осадков (в соответствии с ГОСТ 7566).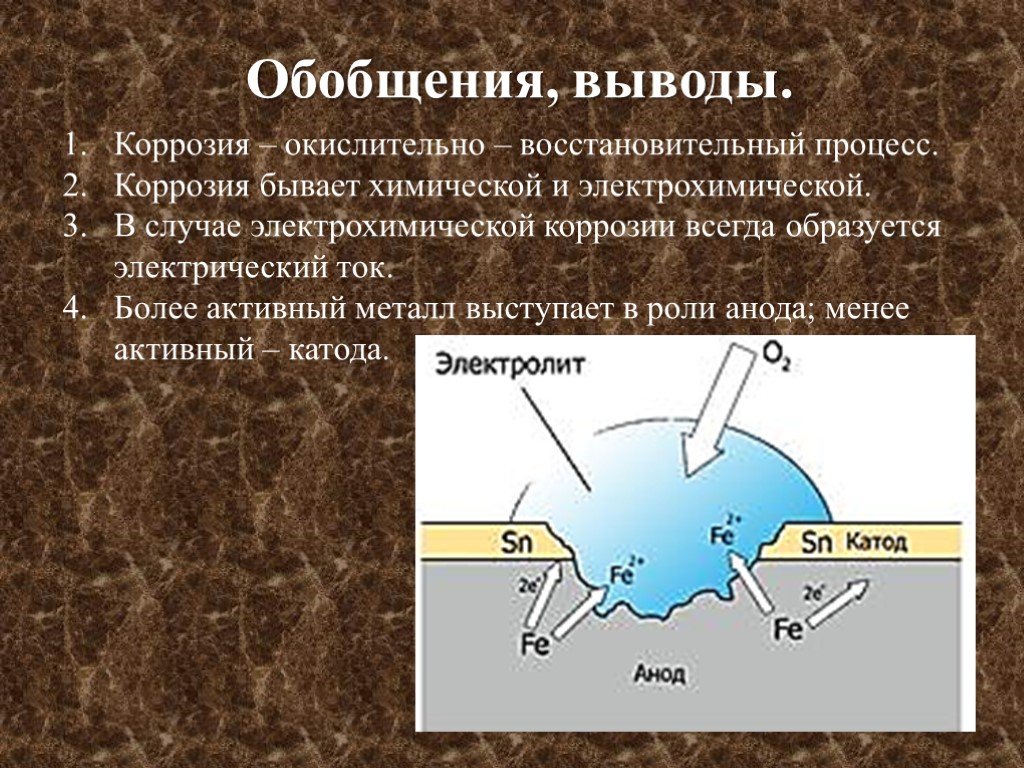
Изделия следует распаковать (снять заводскую упаковку), расположить на ровной поверхности и переложить каждый лист одинаковыми рейками (штабель высотой до 70 см).
• Хранение на открытом воздухе допускается только на период монтажных работ. Изделия должны быть расположены под небольшим наклоном в 3° так, чтобы между ними обеспечивались свободная циркуляция воздуха и слив воды.
• Максимальный срок хранения во всех вышеперечисленных условиях не должен превышать 2 (двух) месяцев с даты поставки.
Используемая литература:
- «Общая химия» учебники и учебные пособия для высших сельскохозяйственных учебных заведений. А.Г. Кульман. Издательство «Колос» 1968.
- «Курс общей химии» учебник для студентов вузов. Коровин Н.В., Масленникова Г.Н., Гуськова Л.Г. и др. под ред. Коровина Н.В. Высш. школа 1981.
- «Защита от коррозии, старения и биоповреждений машин, оборудовани и сооружений» Справочник в 2т.
 Т1. Под ред. Герасименко А.А. М. Машиностроение. 1987.
Т1. Под ред. Герасименко А.А. М. Машиностроение. 1987. - «Основы учения о коррозии и защите металлов» Дж. Скалли. Перевод с английского проф. А.В. Шрейдера. Издательство «Мир», Москва 1978.
- СТБ 1527-2005 «Профили металлические холодногнутые для наружной облицовки фасадов зданий и комплектующие изделия к ним».
- СТБ 1382-2003 «Профили металлические холодногнутые для кровель и комплектующие изделия к ним».
- ГОСТ 7566-2018 «Металлопродукция. Правила приемки, маркировка, упаковка, транспортирование и хранение».
Коррозия металлов
Коррозия металлов
Коррозией называется разрушение металлов и сплавов под действием окружающей среды. Подавляющее большинство металлов, применяемых в технике, в различной степени подвержено коррозии.
Коррозия обычно начинается с поверхности и затем распространяется в глубину металла, вследствие чего ухудшаются его механические свойства. Среда, в которой протекают коррозионные процессы, оказывает большое влияние на их характер, в связи с чем различают два основных вида коррозии: химическую и электрохимическую.
Среда, в которой протекают коррозионные процессы, оказывает большое влияние на их характер, в связи с чем различают два основных вида коррозии: химическую и электрохимическую.
Химическая коррозия возникает в результате воздействия на металлы жидкостей, сухих газов, которые не являются проводниками электрического тока (бензин, масла, смолы, газы и т. п.). При химической коррозии на поверхности металлов образуются пленки окислов. Такие пленки некоторых металлов (алюминий, хром, молибден) обладают высокой прочностью и предохраняют металл от разрушения. Пленки окислов железа и других черных металлов непрочны. Местные разрушения этих пленок окислов и являются причиной дальнейшего протекания коррозии, проникающей в металл на большую глубину.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Окисление металлов при повышенных температурах с образованием на их поверхности окалины является типичным видом химической коррозии.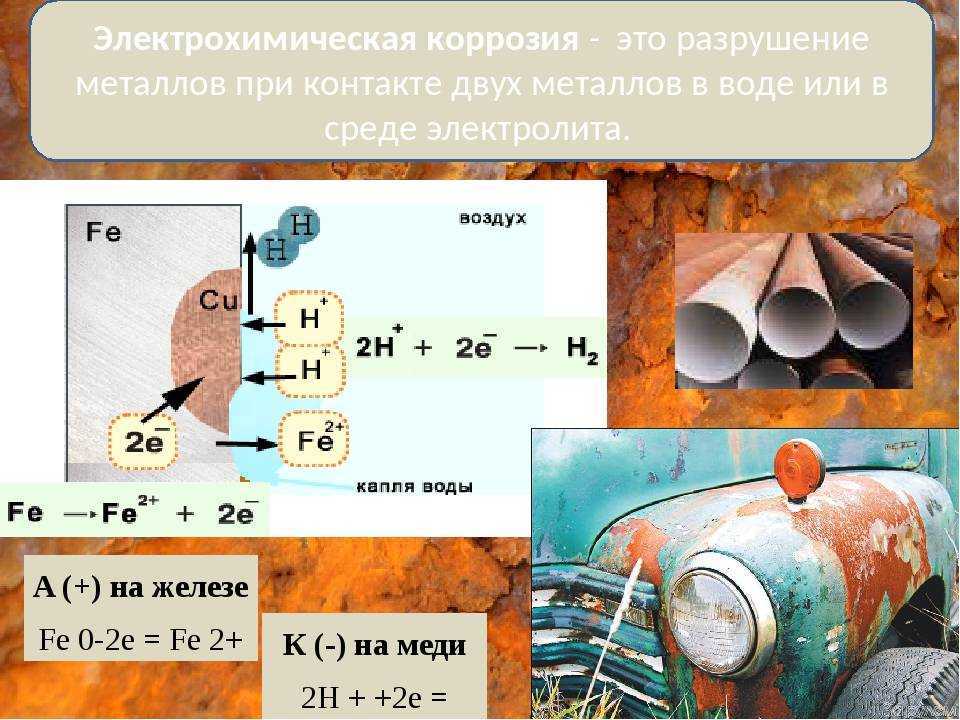
Электрохимическая коррозия является результатом воздействия на металлы различных электролитов — кислот, щелочей, растворов солей и воды с растворенными в ней газами и примесями. Все эти жидкости, являются хорошими проводниками тока.
Одним из наиболее распространенных видов электрохимической коррозии является атмосферная коррозия металлов, сущность которой заключается в следующем. Из физики известно, что пластинки, изготовленные из разнородных металлов и соединенные между собой, при погружении в электролит образуют гальванические пары. При этом металл, обладающий более высоким электрическим потенциалом, будет являться катодом, а металл с более низким потенциалом — анодом.
В промышленности наибольшее применение имеют сплавы, а не чистые металлы. Состав сплавов не является однородным. Например, перлитная сталь состоит из зерен феррита и цементита и других примесей, в результате чего получается множество гальванических пар, в которых зерна феррита являются катодом, а зерна цементита — анодом.
При соприкосновении с влажным воздухом на поверхности стали появляется влага в виде водяной пленки, которая является в данном случае электролитом. При. этом появляются токи, являющиеся основной причиной коррозии металла. Следовательно, электрохимическая коррозия отличается от химической тем, что при ней происходят электрохимические процессы вследствие возникновения токов.
Защита металлов от коррозии. Коррозия металлов причиняет огромные убытки народному хозяйству. Основными металлами в машиностроении и в других отраслях народного хозяйства являются черные, т. е. сталь и чугун. Они обладают слабой стойкостью против коррозии, вследствие чего выходит из строя большое количество деталей из черных металлов.
Металлические изделия защищают от коррозии различными способами: металлическим и неметаллическим покрытием, созданием на их поверхности окисных пленок и легированием металлов и сплавов.
Для защиты металлов и сплавов от коррозии неметаллическими покрытиями поверхность изделия окрашивают различными красками, покрывают лаками и пр.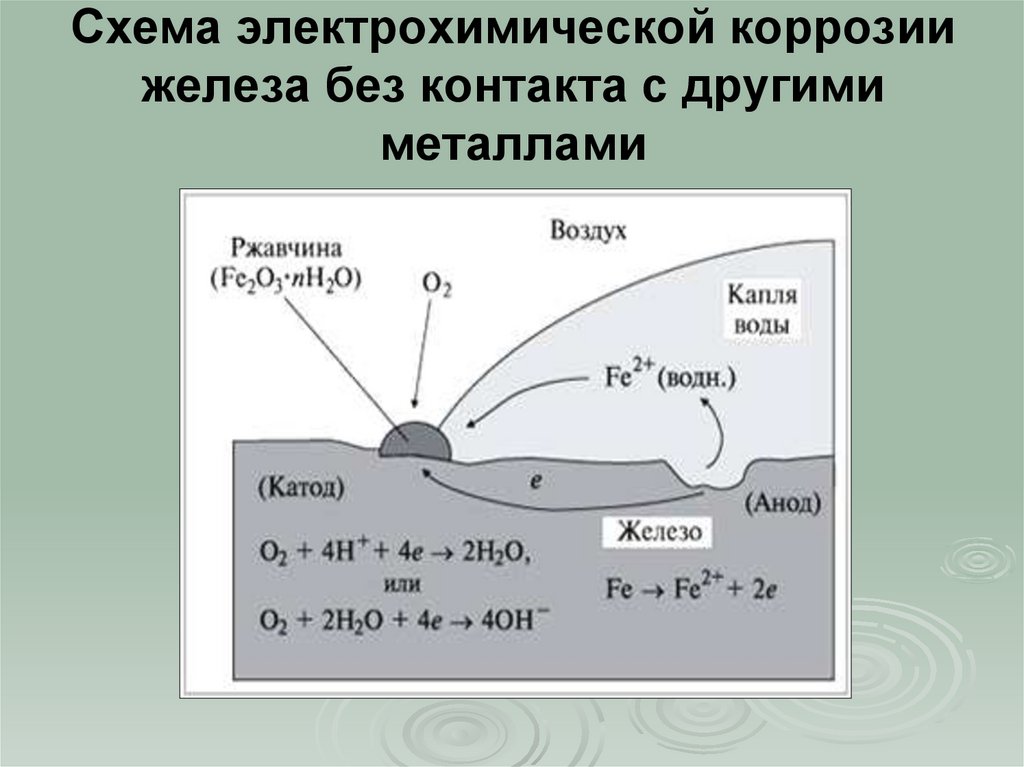
Легирование металлов и сплавов осуществляют введением хрома, никеля, алюминия, кремния и других элементов, повышающих сопротивление коррозии.
—
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с коррозионной средой.
Виды коррозии. Коррозия металлов и сплавов начинается с их поверхности и постепенно распространяется в глубь материала. При этом внешний вид металлов изменяется: они теряют блеск, их поверхность становится неровной, изъеденной. Часто коррозия металлов сопровождается снижением их механической прочности, твердости и другими явлениями. Примером коррозии металлов может служить ржавление железа под воздействием влажного воздуха, в результате чего на поверхности металлов образуется бурый слой ржавчины.
В зависимости от состояния коррозионной среды, вида металла и условий их взаимодействия на поверхности металла образуются различные химические соединения, так называемые продукты коррозии. Они могут быть в виде пленок и наростов с плотной и рыхлой структурой, прочно приставших к поверхности металла или легко удаляемых с него.
Они могут быть в виде пленок и наростов с плотной и рыхлой структурой, прочно приставших к поверхности металла или легко удаляемых с него.
Пленки, особенно если они плотные (беспористые), могут тормозить дальнейший процесс коррозии, а в некоторых случаях надежно защищать металл от разрушения. Например, пленка, образовавшаяся на алюминии при воздействии кислорода воздуха, защищает его от дальнейшей коррозии. При образовании защитной пленки металл теряет способность к химическим взаимодействиям с окружающей средой, т. е. переходит в пассивное состояние. Но достаточно удалить защитную пленку и коррозия металла начинается снова.
Рис. 1. Виды коррозии:
а — сплошная (равномерная) коррозия, б — местная, в — межкристал-лнтная; 1 — металл, 2, 3 — продукты коррозии, 4 — трещины
В зависимости от характера протекания коррозионного процесса, состояния коррозионной среды, природы металла и действующих на него напряжений (изгибающих, сжимающих, ударных, растягивающих) наиболее часто встречаются три вида коррозии: сплошная, местная и межкристаллитная.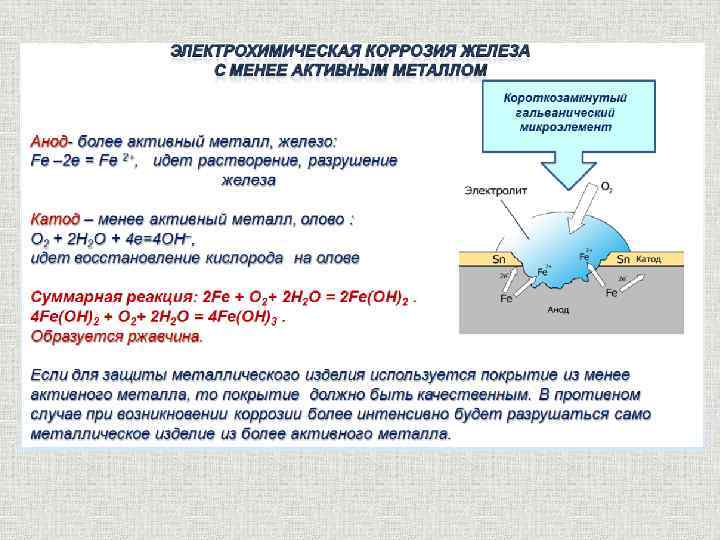
Сплошная коррозия, охватывающая всю поверхность металла, подразделяется на равномерную и неравномерную.
Равномерная коррозия протекает с одинаковой скоростью по всей поверхности металла, а неравномерная протекает с неодинаковой скоростью на различных участках поверхности металла.
Равномерная коррозия происходит в большинстве случаев на открытом воздухе.
При коррозии этого вида металл разрушается равномерно по всей поверхности конструкции или аппарата. Если с поверхности металла удалить слой ржавчины, то можно увидеть, что его поверхность стала шероховатой. При более длительном воздействии воздуха углубления в металле увеличиваются.
Местная коррозия — это коррозия, охватывающая отдельные участки поверхности металла. Такая коррозия подразделяется на подповерхностную, точечную, сквозную и коррозию пятнами.
Местная коррозия возникает при наличии в металле загрязнений (шлаков и др.), внутренних напряжений, вследствие вмятин, наклепа; при грубой структуре и неоднородности поверхности металла; неравномерном действии коррозионной среды; при неравномерной аэрации поверхности металла.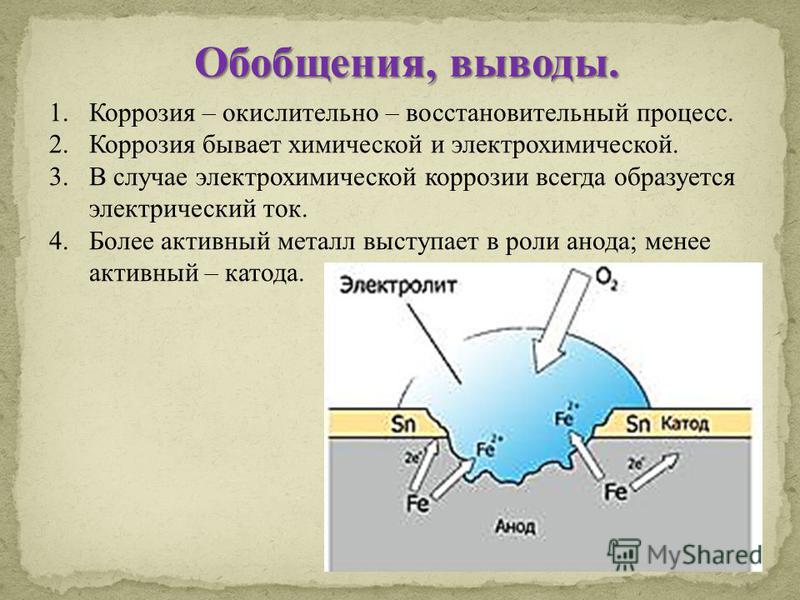
Коррозия вследствие неравномерной аэрации часто возникает на тех участках металла, которые менее доступны воздействию кислорода, чем остальная поверхность. Такими участками являются царапины, раковины, заклепочные швы конструкций и т. п.
Местная коррозия на отдельных участках металла резко снижает его механическую прочность, что приводит к преждевременному разрушению оборудования и металлических конструкций, нарушению герметичности емкостей и трубопроводов.
Межкристаллитная коррозия распространяется по границам кристаллов-зерен, составляющих металл, и нарушает между ними связь. Это вызывает снижение механической прочности материала. Особенностью коррозионного разрушения этого вида является то, что коррозия распространяется глубоко внутрь металла, не изменяя внешнего вида металлической конструкции. Межкристаллитная коррозия чаще всего поражает конструкции, изготовленные из нержавеющей стали и алюминиевых сплавов. Разрушение конструкции происходит внезапно в результате резкого падения прочности металла или сплава.
Межкристаллитная коррозия обычно возникает в зоне сварных швов. Это объясняется тем, что при термической обработке нержавеющих сталей (высокохромистых) при высокой температуре — (1000—1110 °С) и последующем относительно быстром охлаждении происходят изменения состава металла по границам кристаллов за счет образования карбидов, т. е. соединений железа с углеродом, обладающих меньшей устойчивостью к коррозионным средам по сравнению с хромом.
Склонность алюминиевых сплавов к межкристаллитной коррозии объясняется образованием по границам зерен соединений менее коррозионностойких, чем основная часть зерен металла.
Часто можно наблюдать, что металл одновременно подвергнут нескольким видам коррозии. Равномерная коррозия, например, сопровождается местной и т. д.
Типы коррозии. В зависимости от вида коррозионной среды коррозия металла может происходить химическим или электрохимическим путем.
Химическая коррозия возникает при действии на металлы сухих газов при высоких температурах или жидких неэлектролитов (жидкостей, не проводящих электрический ток). К химической коррозии относится также разрушение металла кислородом сухого воздуха и другими газами (углекислым, сернистым) при отсутствии паров воды.
К химической коррозии относится также разрушение металла кислородом сухого воздуха и другими газами (углекислым, сернистым) при отсутствии паров воды.
При химической коррозии происходит взаимодействие коррозионной среды с поверхностью металла, в результате которого продукты коррозии (пленки, окислы, окалина) образуются непосредственно на том участке поверхности металла, где происходит его разрушение.
Электрохимическая коррозия возникает при взаимодействии металла с жидкой коррозионной средой (растворами электролитов, т. е. жидкостями, проводящими электрический ток), влажными газами, расплавленными солями и щелочами. Электролитами служат растворы кислот, солей или щелочей. При электрохимической коррозии разрушение металла связано с возникновением и перетеканием электрического тока с одних участков металла на другие.
Чтобы понять сущность электрохимической коррозии, рассмотрим некоторые явления, лежащие в основе этого процесса. Если в сосуд с разбавленной серной кислотой опустить два разнородных металла, например медь и цинк, и соединить их проводником, то по нему потечет электрический ток. Полученный источник тока называется гальваническим элементом.
Полученный источник тока называется гальваническим элементом.
Возникновение электрического тока в гальваническом элементе объясняется следующим. В растворе серной кислоты (электролите) молекулы вещества распадаются на части, которые называются ионами. Ионы каждого химического вещества несут определенный химический заряд: положительный (катион) или отрицательный (анион).
При погружении цинковой пластинки в электролит между кислотой и металлом возникает взаимодействие, в результате которого цинк постепенно-переходит в раствор. При этом каждый атом цинка оставляет-на металлической пластинке два электрона, а сам становится в растворе положительным ионом.
Цинковая пластинка, обогащаясь электронами, приобретает отрицательный электрический заряд. Слой электролита, непосредственно прилегающий к пластинке, заряжается при этом положительно. Между пластинкой и раствором кислоты возникает разность потенциалов (электрических зарядов).
Освободившиеся на цинковой пластинке (аноде) электроны текут по внешнему проводнику к медной пластинке (катоду). Электрическая цепь’ замыкается через электролит, в котором ионы переносят ток. В результате работы гальванического элемента цинковая пластинка (анод) постепенно разрушается.
Электрическая цепь’ замыкается через электролит, в котором ионы переносят ток. В результате работы гальванического элемента цинковая пластинка (анод) постепенно разрушается.
Электрохимическая коррозия металла напоминает постепенное растворение анода гальванического элемента.
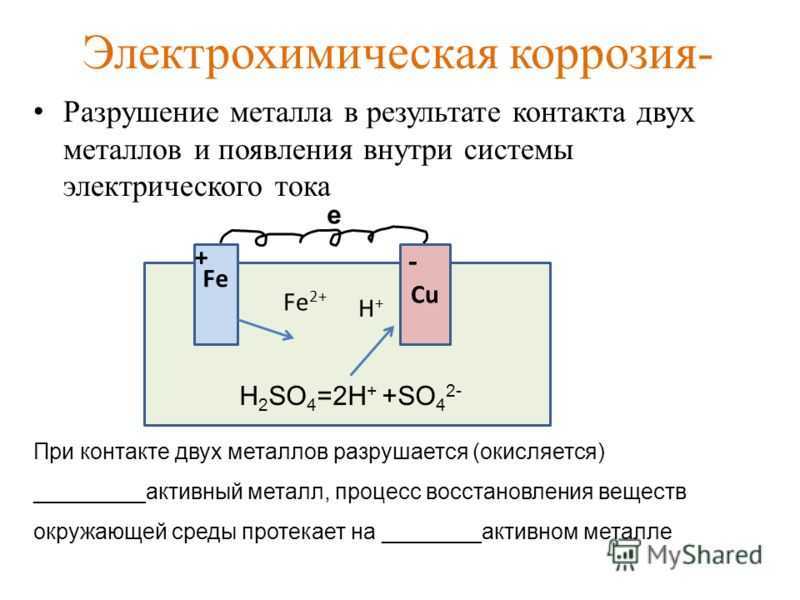
При эксплуатации химического оборудования под действием электролита происходит разрушение металла в результате образования гальванических элементов. Например, в химическом аппарате, изготовленном из нескольких различных металлов, при действии электролита у мест сопряжения этих металлов создаются условия для возникновения гальванического элемента, в результате работы которого металл разрушается и переходит в раствор.
В отличие от обычного гальванического элемента, где электроды соединены проводником, в гальваническом элементе, возникающем при коррозии химической аппаратуры, электроды соединены между собой непосредственно.
При изготовлении металлических аппаратов и строи, тельных конструкций всегда учитывают возможность возникновения электрохимической коррозии от соединения различных металлов.
Недопустимо, например, соединять без изолирующих прокладок алюминий с медными сплавами или с нержавеющими сталями.
Причиной возникновения электрохимической коррозии в металлическом аппарате или конструкции может служить также физическая неоднородность металла. Например, коррозия часто возникает в местах расположения сварных и заклепочных швов. Это объясняется тем, что при сварке металла в результате его нагревания на сравнительно небольшом участке происходит изменение структуры металла. При действии коррозионной среды этот участок по отношению к основному металлу конструкции становится анодом и начинает разрушаться. Такой же процесс возникает, если в конструкции есть заклепочные швы: заклепки становятся анодами по отношению к основному металлу и образуют с ним гальванический элемент.
Очень часто металл разрушается в результате возникновения на его поверхности микрогальваноэлементов, что происходит из-за его химической или физической неоднородности. Например, цинк, применяемый для различных технических целей, в своем составе содержит ряд примесей различных металлов и в том числе медь. Так как-растворимость меди в цинке ограничена, то при содержании ее в цинке выше определенной нормы медь выделяется в виде отдельных мелких включений. В результате этого на поверхности цинка возникают мельчайшие, невидимые глазу гальваноэлементы, в которых катодами являются частицы меди, а анодами — цинк. При работе микроэлемента цинк переходит в электролит, что в конечном счете приводит к полному разрушению цинковой пластинки.
Так как-растворимость меди в цинке ограничена, то при содержании ее в цинке выше определенной нормы медь выделяется в виде отдельных мелких включений. В результате этого на поверхности цинка возникают мельчайшие, невидимые глазу гальваноэлементы, в которых катодами являются частицы меди, а анодами — цинк. При работе микроэлемента цинк переходит в электролит, что в конечном счете приводит к полному разрушению цинковой пластинки.
Обычно конструкционная сталь, из которой изготовляют химическую аппаратуру, технологические и строительные конструкции, также отличается химической неоднородностью. Эта неоднородность обусловливает низкую коррозионную стойкость стали в коррозионных средах и вызывает необходимость в осуществлении мероприятий по защите оборудования и конструкций от коррозии.
Коррозионная стойкость. Не все металлы и сплавы в одинаковой степени разрушаются коррозионными средами. Одни разрушаются быстрей, другие в тех же условиях оказываются устойчивыми к действию коррозии в течение длительного времени.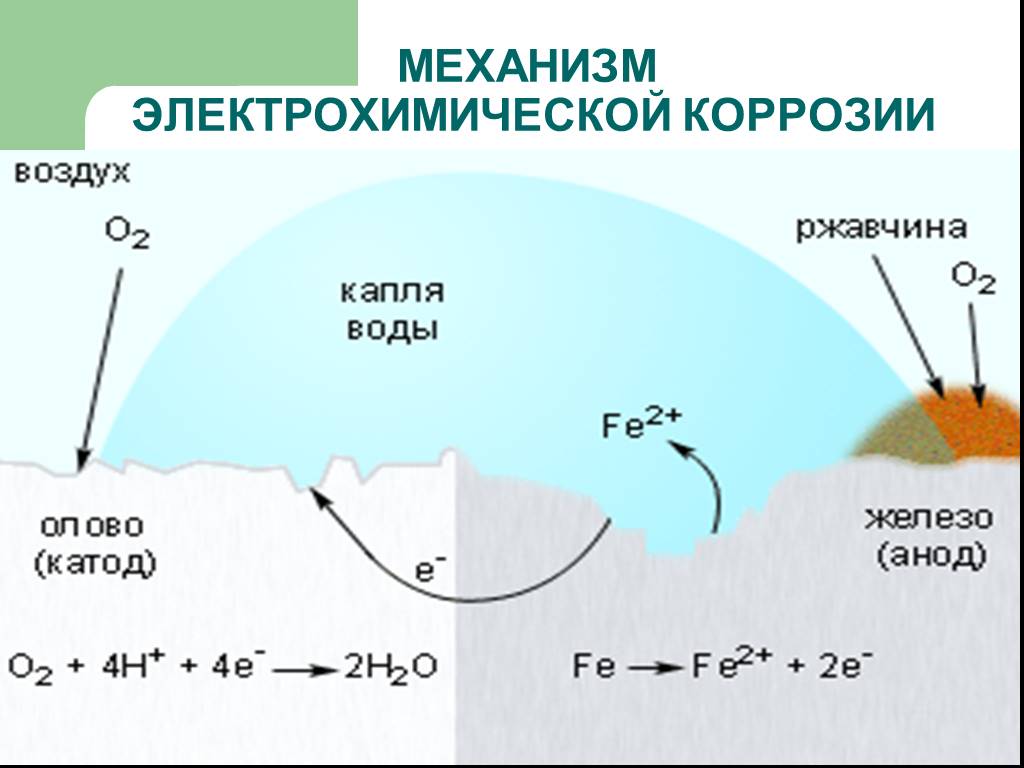 Однако нет металлов совершенно не подвергающихся коррозии. Например, одним из наиболее устойчивых металлов является платина, но и она при погружении в смесь азотной и соляной кислот разрушается. Алюминий устойчив к воздействию крепкой азотной кислоты (поэтому его используют для изготовления цистерн и хранилищ под азотную кислоту), но если в алюминиевые аппараты залить соляную кислоту или щелочные растворы, то они очень быстро разрушат этот металл.
Однако нет металлов совершенно не подвергающихся коррозии. Например, одним из наиболее устойчивых металлов является платина, но и она при погружении в смесь азотной и соляной кислот разрушается. Алюминий устойчив к воздействию крепкой азотной кислоты (поэтому его используют для изготовления цистерн и хранилищ под азотную кислоту), но если в алюминиевые аппараты залить соляную кислоту или щелочные растворы, то они очень быстро разрушат этот металл.
Способность металла сопротивляться коррозионному воздействию среды, называется коррозионной стойкостью. Она определяется качественно и количественно (скоростью коррозии в данных условиях, группой или баллом >по принятой шкале).
Одним из основных методов испытания металла на коррозионную стойкость является массовый метод. При испытании этим методом определяют разность массы образца металла до и после коррозии. Результаты испытаний относят к единице поверхности металла (м2, см2) и единице времени (час, сутки, год и т. д.). Таким образом, коррозионные потери могут быть выражены в г/см2-ч\ г/м2-день и т. д. Однако массовый метод не учитывает плотности металла. В результате этого при одной и той же потере массы для разных металлов уменьшение сечения металла будет (различным.
д. Однако массовый метод не учитывает плотности металла. В результате этого при одной и той же потере массы для разных металлов уменьшение сечения металла будет (различным.
При коррозии, сосредоточенной на небольших участках металла, массовый метод неприменим. В этом случае глубину проникновения коррозии определяют с помощью специальных методов.
Для более точного определения коррозионной стойкости металла полученные данные массового метода приводят к показателю, который характеризует уменьшение толщины металла (проникновение коррозии в глубину металла), например в мм/год.
Коррозия: Электрохимическая | Машиностроение
Коррозия окружает нас повсюду, в нашей повседневной жизни, тихо работает и идет своим чередом. Коррозия — это ухудшение свойств материала из-за реакции с окружающей средой. NACE определяет коррозию как «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой». и другие материалы также подвержены коррозии.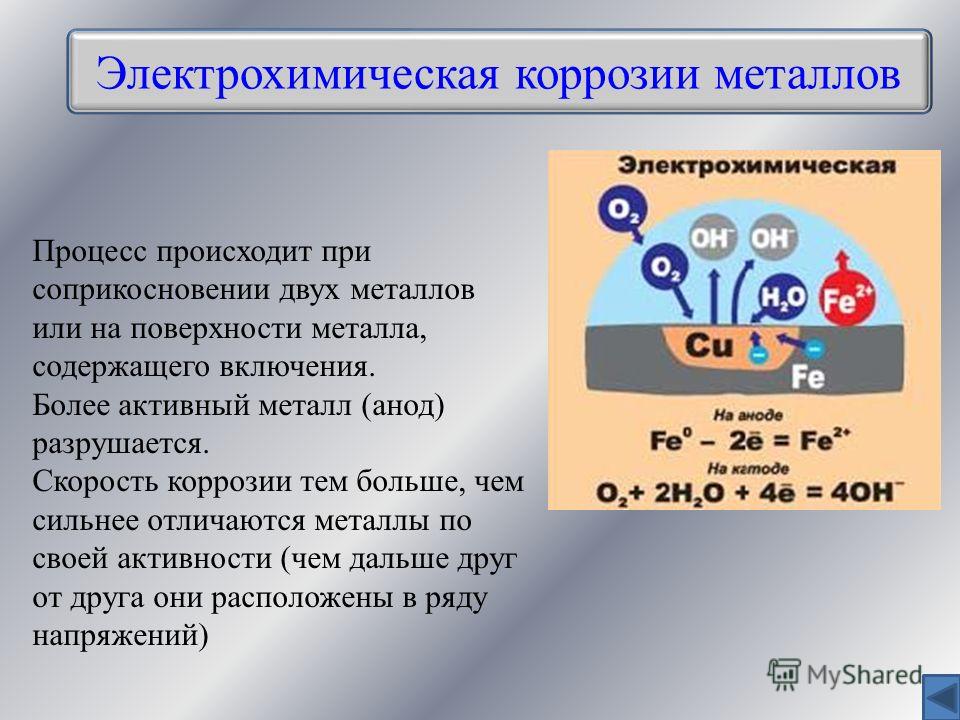
Последствия коррозии можно увидеть повсюду: на наших домах, на детских площадках, на наших автомобилях, зданиях и мостах. Если его не остановить, это может привести к серьезным авариям, таким как обрушение моста I-35W в Миннеаполисе 1 августа 2007 г., в результате которого 13 человек погибли и 145 получили ранения 2 , или рейс Aloha 243, у которого в середине полета произошла взрывная декомпрессия, оторвавшая часть. фюзеляжа, в результате чего один член экипажа погиб и 65 пассажиров и членов экипажа получили ранения 3 .
Коррозия также имеет финансовые последствия. В США коррозия вызывает ежегодные убытки в размере 47,9 млрд долларов в коммунальном хозяйстве, 29,7 млрд долларов в транспортной отрасли, 22,6 млрд долларов в инфраструктуре, 20,1 млрд долларов в государственных структурах и 17,6 млрд долларов в производстве и обрабатывающей промышленности 4 . Это составляет 275,7 миллиардов долларов в год из-за коррозии, при этом самые большие затраты приходятся на системы питьевой воды и канализации на 36 миллиардов долларов и увеличиваются 5 .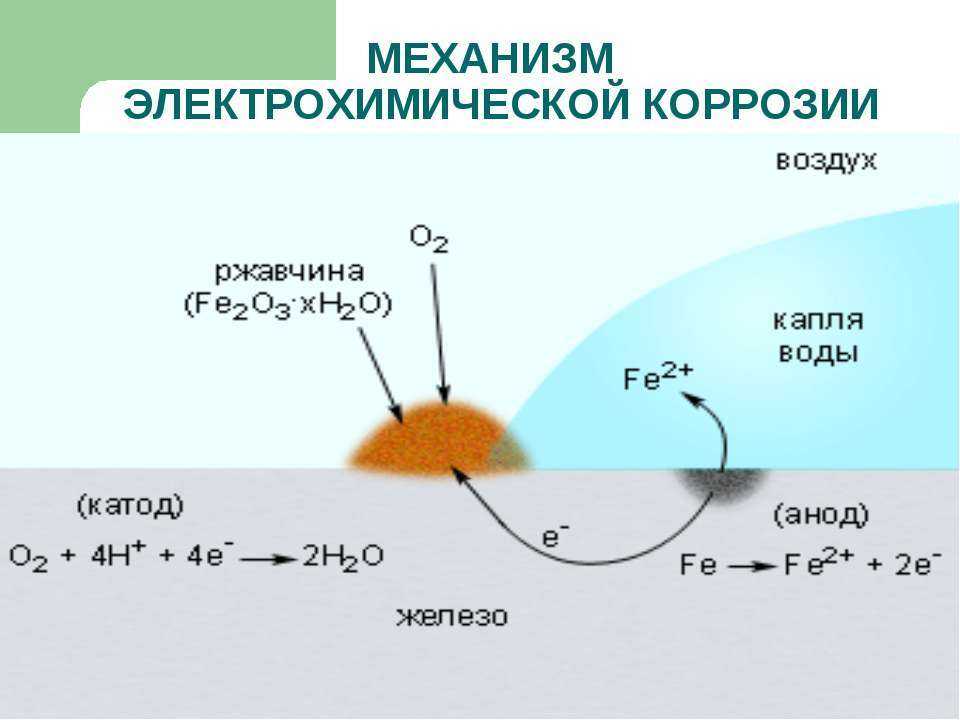
Исследования коррозии показали нам, что существует два основных механизма коррозии: электрохимическое и химическое окисление. Оба этих типа имеют множество форм и разветвлений, некоторые из них более выражены, чем другие, но механизм, с помощью которого они разлагают вещество или материал, всегда можно проследить до одного из этих двух типов. В этой части статьи мы рассмотрим механизм электрохимической коррозии и ее наиболее распространенные формы.
Электрохимическая коррозия
Электрохимическая коррозия — это процесс, в результате которого металл возвращается в состояние окисления с наименьшей энергией. Чтобы правильно понять электрохимическую коррозию, нужно понять, как находят руды и превращают их в металл.
Необработанные руды берутся из природы, где некоторые из них находятся в химическом соединении с другими элементами в термодинамически стабильном состоянии. Например, железо встречается вместе с оксидами, гидратами и сульфидами. Чтобы извлечь или очистить железо, энергия (тепло) нагнетается в руду, чтобы превратить ее в металл. Это приводит к тому, что железная руда восстанавливается и становится термодинамически нестабильной. Фундаментальные законы термодинамики диктуют, что нестабильная система в конечном итоге возвращается к своей стабильной форме, равновесию.
Это приводит к тому, что железная руда восстанавливается и становится термодинамически нестабильной. Фундаментальные законы термодинамики диктуют, что нестабильная система в конечном итоге возвращается к своей стабильной форме, равновесию.
Однако некоторые металлы уже встречаются в природе в металлической форме, например, золото, и поэтому уже стабильны в металлической форме, поэтому золото не подвергается коррозии. Это не означает, что только те металлы, которые встречаются в природе в чистом металлическом виде, являются единственными, которые не подвергаются коррозии, есть руды, которые при окислении дают металл, который не подвергается коррозии, разница в том, что количество энергия (тепло), необходимая для окисления руды, в этом случае минимальна.
Нестабильные металлы становятся стабильными в течение многих лет в результате электрохимической коррозии, если их не защитить. Для возникновения электрохимической коррозии необходимо наличие коррозионной ячейки. Коррозионная ячейка представляет собой комбинацию четырех элементов: анода, катода, электролита и металлического пути, соединяющего анод и катод. Без любого из этих четырех элементов коррозии не будет, все элементы должны присутствовать. Современные исследования показали, что кислород может сильно влиять на коррозию, и эксперты часто считают его очень важным элементом, утверждая, что в некоторых формах коррозии кислород является последним завершающим этапом для достижения истинного состояния с самой низкой энергией.
Без любого из этих четырех элементов коррозии не будет, все элементы должны присутствовать. Современные исследования показали, что кислород может сильно влиять на коррозию, и эксперты часто считают его очень важным элементом, утверждая, что в некоторых формах коррозии кислород является последним завершающим этапом для достижения истинного состояния с самой низкой энергией.
- На аноде происходит фактическая потеря металла. Ионизируясь в электролите, ионы высвобождают электроны в ходе сложной серии химических реакций с образованием оксида железа (Fe2O3) и кислорода. Оксид железа — это то, что мы обычно называем ржавчиной.
- Катод является чрезвычайно важным элементом коррозионной ячейки, поскольку он определяет скорость коррозии. Электроны с анода перемещаются к катоду и задерживаются там. Чем больше электронов может разместить катод, тем быстрее будет корродировать анод. Это основная взаимосвязь между анодом и катодом в коррозионной ячейке.
- Электролит также является важным элементом коррозионной ячейки, поскольку это раствор, который окружает анод и катод.
 Электролит также влияет на скорость коррозии, поскольку проводимость электролита либо позволяет электронам свободно перемещаться от анода к катоду, либо ограничивает их поток, тем самым снижая скорость коррозии.
Электролит также влияет на скорость коррозии, поскольку проводимость электролита либо позволяет электронам свободно перемещаться от анода к катоду, либо ограничивает их поток, тем самым снижая скорость коррозии. - Металлический путь — это то, что некоторые могут назвать внутренней цепью, поскольку она обеспечивается металлом, в котором находятся анод и катод. Металлический путь замыкает цепь коррозии.
Кислород считается важным фактором коррозии, так как без кислорода коррозия замедляется и в конце концов прекращается. Кислород отвечает за реакцию с ионами водорода, которые высвобождаются на катоде из-за аккомодации электронов. При недостатке кислорода ионы водорода накапливаются на катоде и препятствуют аккомодации электронов, останавливая процесс коррозии. Это явление называется поляризацией 6 .
Хотя электрохимическая коррозия относится к механизму коррозии, она может проявляться во многих формах. Наиболее распространены гальваническая, точечная и щелевая коррозия.
Гальваническая коррозия
Гальваническая коррозия возникает, когда два разных металла погружаются в раствор и соединяются металлическим путем. Примером может служить железный корабль с алюминиевыми винтами. Электролит — это море, а металлическая дорожка — это настоящая конструкция корабля. Анод и катод определяются из гальванического ряда. В таблице 1 показана упрощенная гальваническая серия.
Из таблицы 1 видно, что на железном корабле алюминиевые гребные винты будут наиболее активным металлом или анодом и, следовательно, будут подвергаться коррозии. Следует отметить, что чем дальше друг от друга находятся два металла в гальваническом ряду, тем выше будет скорость коррозии.
В этом конкретном случае также стоит обратить внимание на размер анода и размер катода. Чем больше катод, тем больше электронов он может принять от анода, заставляя его ионизироваться с большей скоростью, что приводит к гораздо более быстрой коррозии. Эта зависимость между ними является линейной: чем больше разница в размерах между катодом и анодом, тем быстрее будет корродировать анод.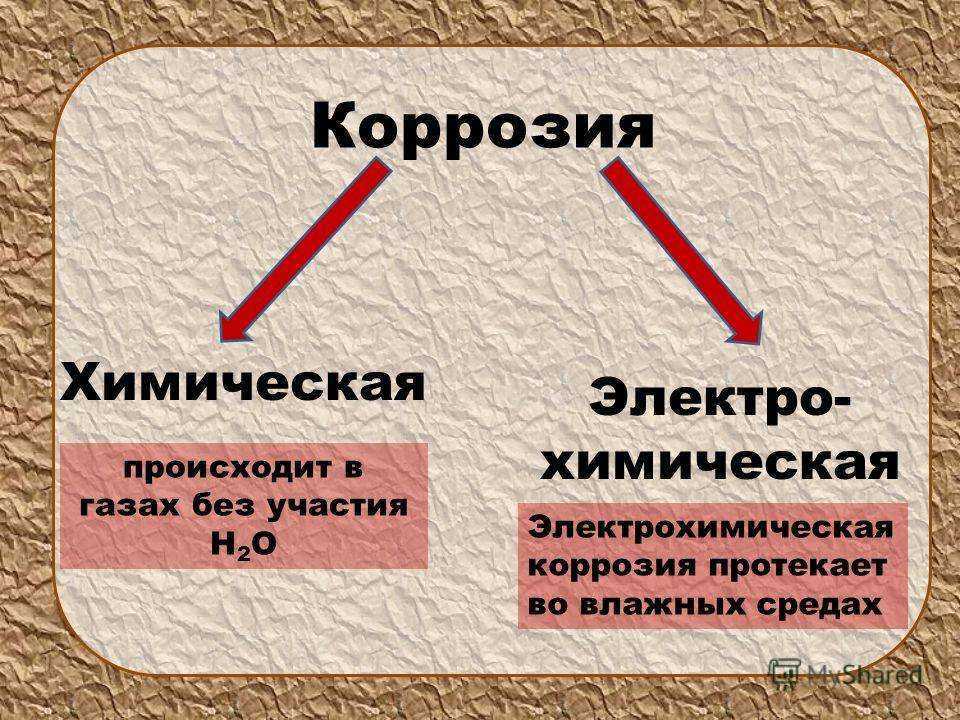 Это применимо только в том случае, если катод больше анода. Если анод больше катода, скорость коррозии замедляется. Следовательно, отношение теперь обратное.
Это применимо только в том случае, если катод больше анода. Если анод больше катода, скорость коррозии замедляется. Следовательно, отношение теперь обратное.
Точечная коррозия
Точечная коррозия – это форма коррозии, которая часто связана с соотношением размеров между анодом и катодом, описанным выше. Наиболее распространенной причиной питтинга является неоднородность металлов. Иногда металлы непостоянны по своему содержанию, в них могут входить горшечные металлы или другие крупинки легкокорродирующих металлов. Если в металле есть включения такого рода, которые являются более анодными, чем остальной металл, эти примеси корродируют быстрее и вызывают язвы. Обратное также возможно, примеси могут быть катодными по отношению к остальной части металла, это вызовет ямки в окружающей примеси области.
Неоднородность — не единственная причина точечной коррозии. Защитные покрытия могут сломаться и обнажить часть подложки, которую они должны были защищать. Это приводит к тому, что остальная часть металла с покрытием действует как катод, а небольшая несплошность становится анодом. В соответствии с соотношением размеров между анодом и катодом скорость коррозии на этом маленьком аноде будет высокой, что приведет к образованию язв.
В соответствии с соотношением размеров между анодом и катодом скорость коррозии на этом маленьком аноде будет высокой, что приведет к образованию язв.
Щелевая коррозия
Это особая форма коррозии, которая возникает в очень маленьких трещинах на металлах. Щелевая коррозия — очень интересная форма, потому что в какой-то момент она включает один из двух основных механизмов: электрохимический и химический. Щелевая коррозия часто локализуется в местах застоя электролита. К таким местам часто относятся соединения внахлест, под прокладками и под изоляцией. В этих местах щелевая коррозия обычно начинается как электрохимическая коррозия с попаданием в щель электролита. Из-за небольшого размера щели кислород, необходимый для поддержания электрохимической коррозии, вскоре истощается, и электролит становится кислым. Это происходит за счет гидролиза ионов металлов, вызванного электрохимической коррозией 9.0003 7 . В этот момент тип или механизм коррозии представляет собой химическую атаку.
Хотя создание коррозионной ячейки может показаться трудным процессом, это происходит с большей легкостью, чем предполагалось. Электрохимическая коррозия может произойти везде, она может взаимодействовать не с одним металлом, а также проникать внутрь бетона и разъедать арматурные стержни. Вся наша инфраструктура подвержена коррозии. Многие другие формы коррозии можно наблюдать в промышленных условиях, однако, как уже объяснялось, все эти формы восходят к электрохимическим. Эти другие формы могут включать нитевидную, атмосферную и прокатную коррозию.
Электрохимическая коррозия является наиболее распространенным механизмом в современной промышленности, и ее последствия можно измерить с точки зрения экономики, здоровья, безопасности и даже культуры. Этот механизм коррозии может существовать внутри наших тел, в кардиостимуляторах, он может привести к падению мостов, разрыву газопроводов и даже к ржавчине культурных сооружений, таких как статуя Свободы, если о них не заботиться должным образом. Электрохимическая коррозия — это сила, с которой необходимо считаться в современном мире, и ее необходимо решать как таковую. В следующем выпуске мы рассмотрим механизм химического окисления и его наиболее распространенные формы.
Электрохимическая коррозия — это сила, с которой необходимо считаться в современном мире, и ее необходимо решать как таковую. В следующем выпуске мы рассмотрим механизм химического окисления и его наиболее распространенные формы.
См. также Коррозия: Химическое окисление
1 VanDelinder, L.S. изд. Основы коррозии — введение, глава 1, объем и язык коррозии. Национальная ассоциация инженеров по коррозии, стр. 14, 1984
2 Фроммер, Фредерик и Лоуи, Джоан. «Дефекты конструкции моста могут быть не такими редкими, как предполагалось» USA Today. 25 декабря 2010 г.
3 Кристофф, Сьюзен. «Усталостный отказ самолета Aloha Flight 243: как циклическая нагрузка и коррозия вызвали отказ во время полета», Suite 101. 27 декабря 2010 г.
4 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Стоимость коррозии. 28 декабря 2010 г.
5 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Стоимость коррозии. 28 декабря 2010 г.
Стоимость коррозии. 28 декабря 2010 г.
6 Мангер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка. Национальная ассоциация инженеров по коррозии, стр. 21, 1984
7 Томпсон, Нил. «Хронология расщелины». Коррозия-Доктора. 28 декабря 2010 г.
Есть ли у вас опыт и знания по темам, упомянутым в этом содержании? Вам следует подумать о том, чтобы внести свой вклад в нашу редакционную команду CFE Media и получить признание, которого вы и ваша компания заслуживаете. Нажмите здесь, чтобы начать этот процесс.
Испытания на электрохимическую коррозию — TCA Lab / Alfa Chemistry
Методы электрохимической коррозии необходимы для прогнозирования срока службы металлических компонентов, используемых в электронной, химической и нефтехимической, строительной и других отраслях промышленности. Эксперты в T,C&A Lab предоставляет множество стандартных тестов ASTM и ISO, а также индивидуальные тесты в соответствии с потребностями клиентов. Эти услуги по тестированию могут помочь предотвратить вредное взаимодействие между различными металлами и окружающей средой.
Эти услуги по тестированию могут помочь предотвратить вредное взаимодействие между различными металлами и окружающей средой.
Наша лаборатория может помочь вам
Решения для испытаний, которые мы предоставляем, включают, но не ограничиваются:
Испытание потенциала точечной коррозии из нержавеющей стали
Электрохимическое испытание при критической температуре точечной коррозии
0031
Potentiodynamic anodic polarization measurements
Potentiodynamic polarization resistance measurements
Corrosion rate measurement and calculation
Galvanic corrosion test
Measurement of corrosion potentials
Electrochemical impedance test
Cyclic потенциодинамические измерения поляризации
Требования к образцам
Образцы для испытаний на электрохимическую коррозию должны быть электрическими проводниками и должны быть достаточно малы, чтобы поместиться в поляризационной ячейке. Компоненты можно тестировать как целиком, так и в виде небольшой секции. Металлические купоны изготавливаются специально для некоторых испытаний.
Компоненты можно тестировать как целиком, так и в виде небольшой секции. Металлические купоны изготавливаются специально для некоторых испытаний.
Standards we test to
| ISO 16773 | Electrochemical Impedance Spectroscopy (EIS) on Coated and Uncoated Metallic Specimens |
| ASTM F2129 | Standard Test Method for Conducting Cyclic Potentiodynamic Polarization Measurements to Determine the Corrosion Susceptibility of Маленькие имплантаты |
| ASTM G102 | Standard Practice for Calculation of Corrosion Rates and Related Information from Electrochemical Measurements |
| ASTM G5 | Standard Reference Test Method for Making Potentiodynamic Anodic Polarization Measurements |
| ASTM G59 | Standard Test Method для проведения потенциодинамических измерений сопротивления поляризации |
| ASTM G61 | Стандартный метод испытаний для проведения циклических потенциодинамических поляризационных измерений локальной восприимчивости к коррозии сплавов на основе железа, никеля или кобальта |
| ASTM G71 | Standard Guide for Conducting and Evaluating Galvanic Corrosion Tests in Electrolytes |
| ASTM G82 | Standard Guide for Development and Use of a Galvanic Series for Predicting Galvanic Corrosion Performance |
| ASTM G5 | Стандартный эталонный метод испытаний для проведения потенциодинамических измерений анодной поляризации |
| ASTM G150 | Стандартный метод испытаний для электрохимических испытаний нержавеющих сталей и родственных сплавов при критической температуре точечной коррозии |
| ASTM G108 | Стандартный метод испытаний для электрохимической реактивации (EPR) для обнаружения сенсибилизации AISI Type 304 и 304L NENSELSEL ALLELS |
| ASTM G69 | |
| ASTM G69 |