Химический элемент медь: Мегаэнциклопедия Кирилла и Мефодия
Содержание
Медь | Электрод-Сервис
Медь — элемент одиннадцатой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Физические свойства
- 5 Изотопы меди
- 6 Получение
- 6.1 Пирометаллургический метод
- 6.2 Гидрометаллургический метод
- 6.3 Электролизный метод
- 7 Химические свойства
- 7.1 Возможные степени окисления
- 7.2 Простое вещество
- 7.3 Соединения меди(I)
- 7.4 Соединения меди(II)
- 7.5 Соединения меди(III) и меди(IV)
- 7.6 Аналитическая химия меди
- 8 Применение
- 8.
 1 В электротехнике
1 В электротехнике - 8.2 Теплообмен
- 8.3 Для производства труб
- 8.4 Сплавы
- 8.4.1 Сплавы на основе меди
- 8.4.2 Сплавы, в которых медь значима
- 8.4.3 Ювелирные сплавы
- 8.5 Соединения меди
- 8.6 Другие сферы применения
- 8 Применение
- 9 Стоимость
- 10 Биологическая роль
- 10.1 Токсичность
- 10.2 Бактерицидность
- 10.3 Органолептические свойства
- 11 Производство, добыча и запасы меди
- 11.1 Современные способы добычи
- 11.1.1 Влияние на экологию
- 12 Интересные факты
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий.
Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий.
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришел на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр. ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία
Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
Самородная медь
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно.
В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно.
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси).
Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси).
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Кристаллы меди
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Основная статья: Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu и 65Cu с распространённостью 69,1 и 30,9 атомных процентов соответственно. Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
Возможные степени окисления
Диаграмма Пурбе для меди
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С «царской водкой»:
С концентрированной горячей соляной кислотой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Медный купорос
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724-0,0180 мкОм·м), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Теплообмен
Система охлаждения из меди на тепловых трубках в ноутбуке
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы
Сплавы на основе меди
Латунная игральная кость, рядом слиток меди и цинк
Статуэтка, отлитая из бронзы
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью.
Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.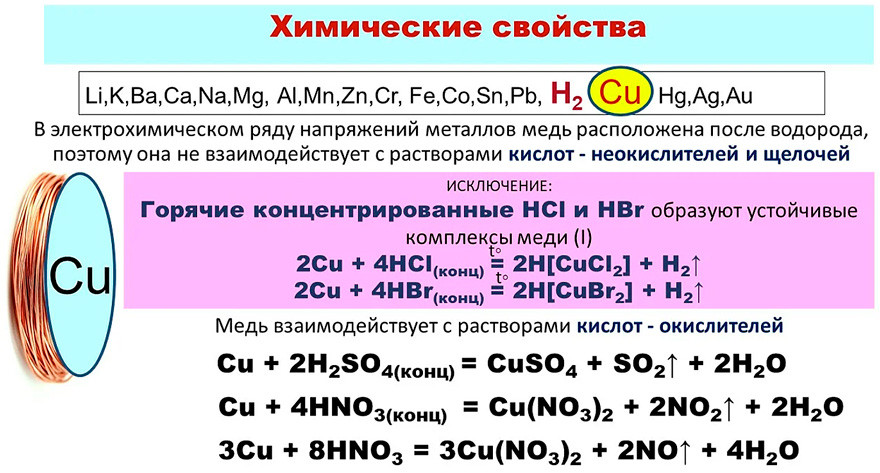
Сплавы, в которых медь значима
Повреждённая пожаром дюралевая деталь дирижабля Гинденбург (LZ 129)
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006.
Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм.
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов (London Metal Exchange) цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долл. в феврале 2011 г.
долл. в феврале 2011 г.
На 2011 год стоимость меди составляет около $8900 за тонну.
Продукты, богатые медью.
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта.
Было признано, что медь не является причиной расстройств пищеварительного тракта.
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»).
Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»).
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
См. также: Список стран по выплавке меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
Компания | тыс. тонн | % |
Норильский никель | 425 | 45 % |
Уралэлектромедь | 351 | 37 % |
Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское». Мировое производство меди в 2007 году составляло 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
- Чили (5,560 млн т в 2007 г.
 и 5,600 млн т в 2008 г.),
и 5,600 млн т в 2008 г.), - США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков.
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов, не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).

- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов.
История открытия меди
05.04.2010
Медь – один из самых известных и самых полезных для человечества металлов. Пусть с точки зрения эстетов, он и не входит в самую известную тройку «благородных» (золото, серебро, бронза), зато очень много хорошего об этом полезном ископаемом могут рассказать представители самых разных профессий: металлурги, ювелиры, физики, химики, фармацевты и многие другие специалисты.
Сфера использования меди чрезвычайно обширна. Ее применение в разных областях тяжелой и легкой промышленности и отдельных отраслях современной науки, весьма разнообразно. Более того – количество ситуаций, когда медь незаменима, растёт наперегонки с техническим прогрессом, а вот способы медедобычи остаются неизменными на протяжении множества веков. Возможности меди (и все ее свойства, включая целебное) были открыты нашими предками еще в античный период. С тех пор в нашем мире изменилось практически все, начиная от мировоззрения людей и заканчивая социально-экономическим строем, а медь как приносила людям пользу, так и продолжает ее приносить.
Возможности меди (и все ее свойства, включая целебное) были открыты нашими предками еще в античный период. С тех пор в нашем мире изменилось практически все, начиная от мировоззрения людей и заканчивая социально-экономическим строем, а медь как приносила людям пользу, так и продолжает ее приносить.
Латинское название этого металла — Cuprum — имеет очень красивую историю, берущую своё начало в древнегреческой мифологии. Согласно верованиям древних греков, люди получили этот металл от Афродиты, богини любви и плодородия. Легенда гласит, что Афродита, родившаяся в пене прибрежных волн, вышла на берег острова Кипр, который она немедленно взяла под свое покровительство, показав его жителям залежи столь необходимого для них металла. Разумеется, в этом красивом сказании есть определенная доля истины — именно Кипр, где в древности был расположен один из самых известных алтарей поклонения Венере, издревле был богат залежами меди. Так что древние киприоты и впрямь обогащались на добыче этого металла, а имя острова дало научное название этому элементу — купрум.
Конечно же, на самом деле медь начали применять задолго до того, как в ареале Эгейского моря сложилась древнегреческая цивилизация. Эпоха открытия и применения меди — это примерно VI–IV тысячелетие до нашей эры, обширный период, который археологи и историки считают промежуточным звеном между «каменным веком» и «бронзовым». Согласно исследованиям ученых, наши далекие предки сначала применяли слитки меди, которые были ими ошибочно приняты за камни. Изначально медные самородки обрабатывались так же, как простые камни — по ним ударяли другими камнями, дабы изменить их форму и размер. Медные слитки отказывались раскалываться на части, но отлично деформировались. Этот метод обработки, получивший название «холодная ковка», был достаточно энергозатратным, но весьма распространенным. В отличие от «горячей ковки», то есть, нагревания меди, делавшей металл пластичным, но впоследствии хрупким, медные изделия, созданные путем холодной ковки, выдерживали очень многое. Этим же и объясняется преимущество медного оружия перед каменным: металлическое оружие можно было починить, в то время как каменное не подлежало ремонту и реставрации. Более того: как только люди выяснили, что медным орудием рубить деревья куда удобнее, чем деревянным, вместе с добычей меди произошел резкий скачок и в развитии деревообрабатывающей промышленности.
Более того: как только люди выяснили, что медным орудием рубить деревья куда удобнее, чем деревянным, вместе с добычей меди произошел резкий скачок и в развитии деревообрабатывающей промышленности.
Чуть позже медь начали использовать не только в тогдашней оружейной и сельскохозяйственной промышленности. Из меди начали изготавливать и посуду, и украшения, и прочие столь необходимые в хозяйстве предметы. Любопытный факт: ученым-археологам удалось реконструировать один из способов изготовления медной посуды, бытовавший примерно в V тысячелетии до нашей эры. Для того, чтобы изготовить из слитка меди таз, древним мастерам нужно было стучать огромным молотом по медному диску, размещенному на специально приготовленных для этого деревянных блоках определенной формы.
Раскопки ученых-историков на территории Анатолии (ныне — Анталия, средиземноморское побережье Турции), Египта, Ирана, Месопотамии принесли новые сведения как о применении меди, так и о способах ее обработки, бытовавших в те далекие времена. Как оказалось, нашим далеким предкам пришлось довольно долго экспериментировать для того, чтобы обработанная путем горячей ковки медь не теряла своих качеств и не становилась хрупкой. Способы обработки меди, состоящие из разных сочетаний литья и ковки, варьировались и шлифовались на протяжении веков. Разумеется, за этот период возросло мастерство специалистов, которые начали не только изготовлять из меди оружие, посуду и украшения, но и освоили метод чеканки.
Как оказалось, нашим далеким предкам пришлось довольно долго экспериментировать для того, чтобы обработанная путем горячей ковки медь не теряла своих качеств и не становилась хрупкой. Способы обработки меди, состоящие из разных сочетаний литья и ковки, варьировались и шлифовались на протяжении веков. Разумеется, за этот период возросло мастерство специалистов, которые начали не только изготовлять из меди оружие, посуду и украшения, но и освоили метод чеканки.
Известно, что медь высоко ценилась жителями Древнего Египта. После расшифровки множества клинописных папирусов стал известен способ обработки меди в эпоху правления Рамзеса II. (1300–1200 гг. до н. э.) Древние египтяне загоняли воздух в плавильные печи с помощью мехов, а древесный уголь добывали из акации и финиковой пальмы. Это создавало внутри печей идеальную температуру для обработки медных слитков и их очищения от посторонних примесей.
Чем выше был спрос на медь, тем больше росла популярность горячей ковки. Для борьбы с коварной хрупкостью полученных таким способом медных изделий, мастера начали добавлять в раскаленную медь иные металлы, образуя различные сплавы. В какой-то момент в плавильной печи произошло случайное соединение меди и олова. Получившийся сплав обладал куда более полезными качествами и требовал совсем иной, менее затратной обработки. Это вещество, получившее название «бронза», дало толчок для начала следующей эпохи, так называемого «бронзового века», начавшегося примерно в III тысячелетии до нашей эры. В этот период изделия из бронзы частично вытеснили медь в определенных сферах тогдашней тяжелой промышленности, но рост добычи меди (столь необходимой для изготовления бронзы) резко увеличился.
В какой-то момент в плавильной печи произошло случайное соединение меди и олова. Получившийся сплав обладал куда более полезными качествами и требовал совсем иной, менее затратной обработки. Это вещество, получившее название «бронза», дало толчок для начала следующей эпохи, так называемого «бронзового века», начавшегося примерно в III тысячелетии до нашей эры. В этот период изделия из бронзы частично вытеснили медь в определенных сферах тогдашней тяжелой промышленности, но рост добычи меди (столь необходимой для изготовления бронзы) резко увеличился.
Особой популярностью медь пользовалась у древних греков. К примеру, жители знаменитой Трои, воспетой в «Илиаде» Гомера, превратили свой город в крупнейший центр развития тогдашней металлургии, причем на благородных свойствах этого металла росло состояние как ремесленников, так и купцов.
Разумеется, в эпоху древнегреческой цивилизации (и красивого мифа о дарах Афродиты) медь использовали как оружейники и ювелиры, так и врачи. В медицинских трактатах эпохи античности много говорится о целебном влиянии медных изделий на человеческий организм. В частности, о том, что воины, облаченные в медные доспехи, куда меньше устают, а их боевые раны заживают быстрее, нежели у их коллег, облаченных в бронзу.
В медицинских трактатах эпохи античности много говорится о целебном влиянии медных изделий на человеческий организм. В частности, о том, что воины, облаченные в медные доспехи, куда меньше устают, а их боевые раны заживают быстрее, нежели у их коллег, облаченных в бронзу.
Другие античные источники были посвящены влиянию медных изделий на различные достоинства мужского организма. Специальные медные украшения, предназначенные специально для укрепления «мужского духа» пользовались большой популярностью у самых разных слоев древнегреческого населения. Известно, что знаменитейшая царица Клеопатра, хорошо разбиравшаяся в тогдашних новейших медицинских открытиях, предпочитала медные браслеты любым украшениям из золота и серебра, а философ и драматург Аристотель, заявлявший об общеукрепляющем действии меди на организм, часто засыпал с медным шариком в руке
Металл, принесший столько пользы древним грекам, в том числе и жителям Кипра, окрестившим его «купрумом», не остался без внимания и на других этапах развития нашей цивилизации. И в Средние века, и в эпоху Возрождения медь объемы добычи меди неуклонно росли, а лучшие умы тех времен открывали все новые способы ее применения. Самое удивительное, что техника добычи и обработки меди потом стала использоваться и при работе с другими материалами, в частности, с железом и сталью. Сейчас спрос на медь особенно высок среди компаний, специализирующихся на изготовлении различных приборов бытового и электротехнического назначения.
И в Средние века, и в эпоху Возрождения медь объемы добычи меди неуклонно росли, а лучшие умы тех времен открывали все новые способы ее применения. Самое удивительное, что техника добычи и обработки меди потом стала использоваться и при работе с другими материалами, в частности, с железом и сталью. Сейчас спрос на медь особенно высок среди компаний, специализирующихся на изготовлении различных приборов бытового и электротехнического назначения.
описание элемента, свойства и применение © Геостарт
Рубрика:
Строительные материалы
Металлическая медь издавна используется человечеством в самых разных областях жизни. Двадцать девятый элемент из периодической таблицы Д. И. Менделеева , находящийся между никелем и цинком, обладает интересными характеристиками и свойствами. Этот элемент обозначается символом Cu. Это один из немногих металлов с характерной окраской, отличной от серебристого и серого цветов.
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение , являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Физические свойства металла
Пожалуй, невозможно понять, что такое металлическая медь, не разобравшись в ее свойствах, основных характеристиках и особенностях.
При контакте с воздухом этот металл становится желтовато-розового цвета. Этот неповторимый золотисто-розовый оттенок обусловливается возникновением на поверхности металла оксидной пленки. Если эту пленку удалить, медь приобретет выразительный розовый цвет с характерным ярким металлическим блеском.
Удивительный факт: тончайшие медные пластинки на просвет имеют вовсе не розовый, а зеленовато-голубой или, иначе говоря, морской цвет.
В форме простого вещества медь обладает следующими характеристиками:
- удивительной пластичностью;
- достаточной мягкостью;
- тягучестью.

Чистая медь без наличия каких-либо примесей превосходно поддается обработке — ее с легкостью можно прокатить в пруток или лист либо вытянуть в проволоку, толщина которой будет доведена до тысячных долей миллиметра. Добавление примесей в этот металл повышает его твердость.
Помимо упомянутых физических характеристик, этот химический элемент обладает высокой электропроводностью. Эта особенность главным образом определила применение металлической меди.
Среди основных свойств этого металла стоит отметить его высокую теплопроводность. По показателям электропроводности и теплопроводности медь является одним из лидеров среди металлов. Более высокими показателями по этим параметрам обладает только один металл — серебро.
Нельзя не принимать во внимание тот факт, что показатели электро- и теплопроводности меди относятся к разряду базовых свойств. Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
- мышьяка;
- железа;
- олова;
- фосфора;
- сурьмы.

Каждая из этих примесей в сочетании с медью оказывает на нее определенное влияние, в результате которого значения тепло- и электропроводности заметно понижаются.
Помимо всего прочего, металлическая медь характеризуется невероятной прочностью, высокой температурой плавления, а также высокой температурой кипения. Данные действительно впечатляют. Температура плавления меди превышает одну тысячу градусов Цельсия! А температура кипения составляет 2570 градусов Цельсия.
Этот металл относится к группе металлов-диамагнетиков. Это значит, что его намагничивание, как и у ряда других металлов, происходит не по направлению внешнего магнитного поля, а против него.
Еще одной немаловажной характеристикой можно назвать отличную устойчивость этого металла к коррозии. В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
Химические свойства элемента
Данный элемент является малоактивным. При контакте с сухим воздухом в обычных условиях медь не начинает окисляться. Влажный воздух, напротив, запускает окислительный процесс, при котором образуется медный карбонат (II), являющийся верхним слоем патины. Практически моментально этот элемент реагирует с такими веществами, как:
При контакте с сухим воздухом в обычных условиях медь не начинает окисляться. Влажный воздух, напротив, запускает окислительный процесс, при котором образуется медный карбонат (II), являющийся верхним слоем патины. Практически моментально этот элемент реагирует с такими веществами, как:
- сера;
- селен;
- галогены.
Кислоты, не обладающие окислительными свойствами, не способны оказывать на медь влияние. Кроме того, она никак не реагирует при контакте с такими химическими элементами, как:
- азот;
- углерод;
- водород.
Кроме уже отмеченных химических свойств, для меди характерна амфотерность. Это значит, что в земной коре она способна образовать катионы и анионы. Соединения этого металла могут проявлять как кислотные свойства, так и основные — это напрямую зависит от конкретных условий.
Области и особенности применения
В древние времена металлическая медь использовалась для изготовления самых разных вещей. Умелое применение этого материала позволило древним людям обзавестись:
Умелое применение этого материала позволило древним людям обзавестись:
- дорогой посудой;
- украшениями;
- инструментами, имеющими тонкое лезвие.
Сплавы меди
Говоря о применении меди, нельзя не упомянуть о ее значении в получении различных сплавов, в основу которых ложится именно этот металл . К таким сплавам относятся:
- бронза ;
- латунь.
Две эти разновидности явяются основными видами медных сплавов. Первый бронзовый сплав был создан на Востоке еще за три тысячелетия до нашей эры. Бронза по праву может считаться одним из величайших достижений металлургов древности. По сути, бронза — это соединение меди с прочими элементами. В большинстве случаев в роли второго компонента выступает олово. Но вне зависимости от того, какие элементы входят в сплав, основным компонентом всегда является медь. Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Помимо бронзы и латуни, этот химический элемент участвует в создании сплавов с другими металлами, среди которых алюминий, золото, никель, олово, серебро, титан, цинк. Медные сплавы с неметаллами, такими как кислород, сера и фосфор, используются гораздо реже.
Отрасли промышленности
Ценные свойства медных сплавов и чистого вещества способствовали их использованию в таких отраслях, как:
- электротехника;
- электромашиностроение;
- приборостроение;
- радиоэлектроника.
Но, разумеется, это еще не все области применения этого металла. Он является высокоэкологичным материалом. Именно поэтому он используется при строительстве домов. Например, кровельное покрытие, выполненное из металлической меди, благодаря своей высочайшей коррозийной устойчивости обладает сроком службы более сотни лет, не требуя при этом особого ухода и покраски.
Еще одна область использования этого металла — ювелирная отрасль. В основном он применяется в форме сплавов с золотом. Изделия из медно-золотого сплава характеризуются повышенной прочностью, высокой стойкостью. Такие изделия на протяжении долгого времени не деформируются и не истираются.
Соединения металлической меди выделяются высокой биологической активностью. В мире флоры этот металл имеет важное значение, так как он участвует в синтезе хлорофилла. Участие данного элемента в этом процессе позволяет обнаружить его в числе компонентов минеральных удобрений для растений.
Роль в организме человека
Нехватка этого элемента в человеческом организме может оказать негативное влияние на состав крови, а именно ухудшить его. Восполнить дефицит этого вещества можно при помощи специально подобранного питания. Медь содержится во многих продуктах питания, поэтому составить полезный рацион по душе не составит труда. Для примера, одним из продуктов, в составе которых имеется этот элемент, является обычное молоко.
Но составляя насыщенное этим элементом меню, не следует забывать о том, что переизбыток его соединений может привести к отравлению организма. Поэтому, насыщая организм этим полезным веществом, очень важно не переусердствовать. И касается это не только количества потребляемых продуктов.
К примеру, пищевое отравление может вызвать использование медной посуды. Приготовление пищи в такой посуде крайне не рекомендуется и даже воспрещается. Связано это с тем, что в процессе кипячения в пищу поступает значительное количество этого элемента, что может привести к отравлению.
В запрете на медную посуду есть одна оговорка. Использование такой посуды не представляет опасности в том случае, если ее внутренняя поверхность имеет оловянное покрытие. Только при выполнении этого условия использование медных кастрюлек не несет угрозы пищевого отравления.
Помимо всех перечисленных отраслей применения, распространение этого элемента не обошло стороной и медицину. В сфере лечения и поддержания здоровья он применяется в качестве вяжущего вещества и антисептика. Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
В сфере лечения и поддержания здоровья он применяется в качестве вяжущего вещества и антисептика. Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
автор Смирнова Любовь |
Химический элемент меди с первой ионизацией Векторное изображение
Химический элемент меди с первой ионизацией Векторное изображение
лицензионные векторы
Химические векторы
ЛицензияПодробнее
Стандарт
Вы можете использовать вектор в личных и коммерческих целях.
Расширенный
Вы можете использовать вектор на предметах для перепродажи и печати по требованию.
Тип лицензии определяет, как вы можете использовать этот образ.
| Станд. | Расшир. | |
|---|---|---|
| Печатный/редакционный | ||
| Графический дизайн | ||
| Веб-дизайн | ||
| Социальные сети | ||
| Редактировать и изменить | ||
| Многопользовательский | ||
| Предметы перепродажи | ||
| Печать по запросу |
Способы покупкиСравнить
Плата за изображение
$ 14,99
Кредиты
$ 1,00
Подписка
$ 0,69
Оплатить стандартные лицензии можно тремя способами. Цены составляют долларов США долларов США.
Цены составляют долларов США долларов США.
| Оплата с помощью | Цена изображения |
|---|---|
Плата за изображение $ 14,99 Одноразовый платеж | |
Предоплаченные кредиты $ 1 Загружайте изображения по запросу (1 кредит = 1 доллар США). Минимальная покупка 30р. | |
План подписки От 69 центов Выберите месячный план. Неиспользованные загрузки автоматически переносятся на следующий месяц. | |
Способы покупкиСравнить
Плата за изображение
$ 39,99
Кредиты
$ 30,00
Существует два способа оплаты расширенных лицензий. Цены составляют долларов США долларов США.
| Оплата с помощью | Стоимость изображения |
|---|---|
Плата за изображение $ 39,99 Оплата разовая, регистрация не требуется. | |
Предоплаченные кредиты $ 30 Загружайте изображения по запросу (1 кредит = 1 доллар США). | |
Дополнительные услугиПодробнее
Настроить изображение
Доступно только с оплатой за изображение
$ 85,00
Нравится изображение, но нужны лишь некоторые модификации? Пусть наши талантливые художники сделают всю работу за вас!
Мы свяжем вас с дизайнером, который сможет внести изменения и отправить вам изображение в выбранном вами формате.
Примеры
- Изменить текст
- Изменить цвета
- Изменение размера до новых размеров
- Включить логотип или символ
- Добавьте свою компанию или название компании
файлов включены
Загрузка сведений…
- Идентификатор изображения
- 42818476
- Цветовой режим
- RGB
- Художник
- Бобровое
В их стихии
News Story
Химики Нью-Йоркского университета делятся своими фаворитами в честь 150-летия периодической таблицы
Читаете это с мобильного телефона? Ваш телефон содержит не менее 30 различных природных элементов, включая литий. Или, может быть, вы пьете сельтерскую воду — соединение двух элементов (углерода и кислорода в виде углекислого газа), растворенное в двух других элементах (водород и кислород в виде воды).
Или, может быть, вы пьете сельтерскую воду — соединение двух элементов (углерода и кислорода в виде углекислого газа), растворенное в двух других элементах (водород и кислород в виде воды).
Химические элементы, из которых состоит все вокруг нас, — повод для празднования каждый день, но 2019 год особенный, потому что он отмечает 150-летие периодической таблицы. Разработан русским ученым Дмитрием Менделеевым в 1869 году.(с вкладом многих других ученых до и после Менделеева), знакомый плакат на стенах кабинета химии начинался как новый способ сортировки и классификации элементов.
В периодической таблице Менделеев упорядочил 63 элемента, известных в 1869 году, по их атомному весу, сгруппировав элементы со сходными свойствами. Он также предусмотрительно оставил на столе свободные места, чтобы предвидеть элементы, которые еще не были обнаружены.
Менделеев что-то уловил — за последующие полтора века ученые добавили много новых элементов в пробелы в таблице, доведя сегодня количество элементов до 118. Как отметило ранее в этом году Американское химическое общество, «изменения в периодической таблице продолжаются и по сей день и, вероятно, продолжат удивлять нас в будущем. Совсем недавно, в 2016 году, четыре последних пробела в периоде 7 — элементы 113, 115, 117 и 118 — были официально заполнены». Как и многие элементы, два из новейших названы в честь мест, где проводились исследования по созданию элементов: московий и теннессин.
Как отметило ранее в этом году Американское химическое общество, «изменения в периодической таблице продолжаются и по сей день и, вероятно, продолжат удивлять нас в будущем. Совсем недавно, в 2016 году, четыре последних пробела в периоде 7 — элементы 113, 115, 117 и 118 — были официально заполнены». Как и многие элементы, два из новейших названы в честь мест, где проводились исследования по созданию элементов: московий и теннессин.
В честь 150-летия периодической таблицы NYU News попросил группу химиков Нью-Йоркского университета назвать свои любимые элементы и рассказать нам, почему они их любят. От лития (№ 3) до галлия (№ 31) — вот их выбор.
Литий
Литий — мой самый любимый элемент в наши дни. Это один из самых легких элементов, и он невероятно преображает. Все наши сотовые телефоны и компьютеры оснащены литий-ионными аккумуляторами, а Нобелевская премия по химии в этом году была присуждена за разработку литий-ионных аккумуляторов.
В моей лаборатории мы хорошо знакомы с этим элементом, поскольку разрабатываем методы, которые позволяют нам заглянуть внутрь батарей, чтобы определить, хорошо ли они работают, и получить подсказки о том, как улучшить батареи, продлить срок их службы и обеспечить их безопасность. .
.
Углерод
Дирк Траунер, Дженис Катлер, профессор химии
Мне нравится углерод, потому что правила, по которым связываются атомы углерода, очень просты, но структуры, которые можно создать с их помощью (и несколькими более легкими и тяжелыми второстепенными актерами), такой разнообразный. После одной лекции студенты могут предложить молекулы, которые никогда раньше не создавались и о которых даже не думали, но которые, скорее всего, стабильны. Вы можете поставить ферму (и свою карьеру) на углерод!
Азот
Нед Симан, Маргарет и Герман Сокол, профессор химии
Азот
Азот. Это элемент, который присущ двум семантофоретическим молекулам [которые несут информацию] биологии, нуклеиновым кислотам и белкам. Без азота биология в основном состоит из сахара и жира.
Кремний
Кит Верпель, Маргарет и Герман Сокол Профессор медицинской химии
Кремний
Кремний. Он есть почти во всем: в камнях, песке, компьютерах, в этих маленьких пакетиках, которые вы найдете внутри обуви. Этот элемент больше всего похож на углерод, но он настолько не похож на углерод, что приводит к неожиданному химическому поведению, которое может оказаться действительно полезным. И просто для протокола: нет, я не думаю, что может существовать жизнь в том виде, в каком мы ее знаем, на основе кремния вместо углерода.
Этот элемент больше всего похож на углерод, но он настолько не похож на углерод, что приводит к неожиданному химическому поведению, которое может оказаться действительно полезным. И просто для протокола: нет, я не думаю, что может существовать жизнь в том виде, в каком мы ее знаем, на основе кремния вместо углерода.
Кальций
Марк Уолтерс, доцент кафедры химии
Кальций
Сейчас мой любимый элемент — кальций. Это вещество нашей геосферы в виде компонента известняковых и гипсовых минералов и нашей биосферы в виде костей, зубов, ракушек и даже яичной скорлупы. Это дает нам основу и структуру. Но не только мы… Как компонент портландцемента и облицовочного гипса (гипсокартон), он также служит для изготовления оболочек и жилья для людей.
Это компонент мела, который до появления маркеров сухого стирания служил для улучшения структуры наших идей и выражений, произнесенных или без слов набросанных на чистом листе.
Железо
Энди Гамильтон, профессор химии и президент Нью-Йоркского университета
Утюг
Большинство химиков-органиков обычно говорят, что их любимым элементом является углерод из-за его роли в качестве основного строительного элемента жизни. Но для меня больше всего интересен элемент железа (Fe). Железо — это элемент, который даже в биологических условиях может иметь доступ к нескольким степеням окисления для выполнения ряда критических функций.
Но для меня больше всего интересен элемент железа (Fe). Железо — это элемент, который даже в биологических условиях может иметь доступ к нескольким степеням окисления для выполнения ряда критических функций.
В состоянии Fe 2+ его можно найти (в окружении моей любимой молекулы — порфиринового кольца) в гемоглобине. Эта замечательная комбинация Fe 2+ и порфирина придает крови ярко-красный цвет, а также способность Fe 2+ связываться с кислородом (O 2 ) и транспортировать его по телу. Опасные эффекты угарного газа (СО) связаны с его способностью еще более прочно связываться с Fe 2+ в гемоглобине и препятствовать доступу к живительной молекуле кислорода.
Железо совершает циклы между состояниями Fe 2+ и Fe 3+ в цитохромных белках, одной из важнейших ролей которых в жизни является перенос электронов по клетке. Смертельный яд цианид (CN — ) связывается с Fe 2+ в цитохроме точно так же, как O 2 или CO в гемоглобине, блокируя этот цикл и полностью разрушая пути управления энергией в живых клетках.
Наконец, доступ железа к Fe 4+ и Fe 5+ состояний окислительного фермента цитохрома Р450. Этот белок действует в печени как природный отбеливатель, часто очищая все нежелательные беспорядки, которые находятся внутри живых организмов, включая нас!
Медь
Джеймс Кэнэри, профессор и заведующий кафедрой химии
Медь
Я фанат элемента меди. Он не только красив, когда блестит, но и демонстрирует удивительно разнообразную химию. Он был обнаружен 11 000 лет назад и назван в честь Кипра. Медный век (энеолит) на Ближнем Востоке — один из моих любимых периодов в истории. Это необходимый элемент для всего живого на земле. В своей естественной металлической форме он обладает высокой проводимостью и пластичностью, что делает его идеальным материалом для проводов.
В ходе нашего исследования мы обнаружили, что он может заставить молекулу, имеющую хиральность, подобную резиновой перчатке, выворачиваться наизнанку, что приводит к противоположной хиральности. Точно так же, как когда вы выворачиваете инсайт из резиновой перчатки для левой руки, и он подходит к вашей правой руке, мы можем сделать то же самое с молекулами.
Точно так же, как когда вы выворачиваете инсайт из резиновой перчатки для левой руки, и он подходит к вашей правой руке, мы можем сделать то же самое с молекулами.
Если элемент теряет один электрон, он приобретает один положительный заряд, образуя медь(I). Бесцветная медь (I) является ключевым игроком в живых организмах для захвата, хранения и транспортировки кислорода в клетке. В крови человека эту роль выполняет железо, но медь(I) очень часто встречается в такой роли у многих организмов. Медь(I) также используется в органической химии для некоторых реакций, которые удивительны с точки зрения того, что они делают, и их эффективности.
Если металлическая медь теряет два электрона, она остается с двумя положительными зарядами на каждый атом меди, медь(II). Соединения меди (II) обычно имеют синий цвет. Он любит растворяться в воде, и реакции, связанные с присоединением/диссоциацией к/от меди (II), могут быть очень быстрыми. Медь (III) также известна, но она очень реакционноспособна и ее нелегко наблюдать.
Меня поразило то, что медь(0), медь(I) и медь(II) настолько отличаются друг от друга, что кажутся разными элементами. Все в них отличается — их внешний вид, их стабильность и их реактивность.
Галлий
Майк Уорд, Джулиус Сильвер, Рослин С. Сильвер и Энид Сильвер Уинслоу, профессор химии
Галлий
Моим любимым элементом должен быть галлий — атомный номер 31, простое число, окруженный алюминием, германием, индием и цинком в периодической таблице, и более редкий, чем золото. Его предсказал в 1871 году не кто иной, как Дмитрий Менделеев, назвавший его «экаалюминием». Затем он был обнаружен в 1875 году Полом Эмилем Лекоком де Буабодраном, который назвал его в честь «галлии», что на латыни означает Галлия, иначе известная как Франция, его родная страна.
Чем так интересен галлий? Он плавится при температуре около 30 ° C (86 ° F), что немного выше комнатной температуры. Это свойство было ключом к дешевому салонному трюку, когда галлий, выкованный в ложки для чайного сервиза, неожиданно плавился при использовании! Отсюда его появление на обложке книги «Исчезающая ложка: и другие правдивые рассказы о безумии, любви и истории мира из Периодической таблицы элементов » Сэма Кина. Тем не менее, галлий — это не просто объект для игр: он во многих отношениях превосходит кремний при использовании в электронных приложениях.
Тем не менее, галлий — это не просто объект для игр: он во многих отношениях превосходит кремний при использовании в электронных приложениях.
Избранные статьи
Медь – элемент, на который мы можем положиться : Дайджест химической промышленности
Медь оказалась одним из самых «востребованных» элементов, начиная с того момента, когда она была первым металлом, которым люди манипулировали, и до того, как она стала важным металлом в промышленности. . Это металл, который служит человечеству в самых разных областях — от изготовления украшений до оружия и от проведения электричества до доказательства своей эффективности в качестве антибактериального средства.
В этой статье наш специальный корреспондент объясняет, что медь — это нечто большее, чем просто блестящий элемент!
Медь, блестящий красноватый элемент, был первым металлом, который обрабатывали и изготавливали люди. Он играл важную роль в истории человечества примерно с конца каменного века и до сегодняшнего информационного века. Сегодня он занимает третье место среди самых потребляемых промышленных металлов в мире после железа и алюминия.
Сегодня он занимает третье место среди самых потребляемых промышленных металлов в мире после железа и алюминия.
Когда они думают о меди, большинство людей, вероятно, представляют себе монеты, кухонную утварь, электропроводку или даже Статую Свободы, одну из самых известных международных достопримечательностей и самую большую в мире статую, облицованную медью. Сотни медных листов, покрывающих ее внешнюю поверхность, изначально имели блестящий красновато-коричневый цвет, отражающий естественный цвет меди. С годами он приобрел сине-зеленый цвет, который мы видим сегодня. Это потому, что медь имеет тенденцию менять цвет после длительного воздействия. Сначала он реагирует с кислородом воздуха с образованием оксидов, а затем они реагируют с углекислым газом и серой с образованием карбоната меди, сульфида меди и сульфата меди. Именно эти соединения образуют внешнюю защитную сине-зеленую патину, которая фактически предохраняет лежащую под ней медь от коррозии.
Возможно, мы не всегда осознаем это, но каждый день мы взаимодействуем с медью разными способами. На самом деле, это один из элементов, от которого мы больше всего зависим. От включения электрических гаджетов в наших домах и офисах и просмотра телевизора до обращения с монетами, приготовления пищи или звонков с наших мобильных телефонов, во время каждого из этих и многих других повседневных действий мы используем медь. Во многих странах, таких как США и Великобритания, не только электрические провода, но и почти все трубы для питьевой воды также сделаны из меди.
На самом деле, это один из элементов, от которого мы больше всего зависим. От включения электрических гаджетов в наших домах и офисах и просмотра телевизора до обращения с монетами, приготовления пищи или звонков с наших мобильных телефонов, во время каждого из этих и многих других повседневных действий мы используем медь. Во многих странах, таких как США и Великобритания, не только электрические провода, но и почти все трубы для питьевой воды также сделаны из меди.
История на протяжении веков
Ключевой причиной раннего открытия и значительного использования меди в древние времена было то, что медленно реагируя с другими веществами, металл встречался в природе в довольно заметных количествах в чистом виде. Древние цивилизации впервые использовали медь для изготовления украшений, инструментов и монет. Многие из этих объектов, некоторые из которых датируются 8000 г. до н.э., были обнаружены.
Одним из недостатков металла было то, что он был слишком мягким для изготовления оружия и инструментов. Затем, около 3500 г. до н.э., жители Месопотамии обнаружили, что медь при смешивании с оловом образует гораздо более твердое вещество — бронзу. Этот технологический прогресс привел к концу медного или энеолитического века и началу бронзового века. Новый сплав был не только тверже, но также мог коваться и формоваться посредством ковки или плавиться и заливаться в полые формы для изготовления отливок различной формы.
Затем, около 3500 г. до н.э., жители Месопотамии обнаружили, что медь при смешивании с оловом образует гораздо более твердое вещество — бронзу. Этот технологический прогресс привел к концу медного или энеолитического века и началу бронзового века. Новый сплав был не только тверже, но также мог коваться и формоваться посредством ковки или плавиться и заливаться в полые формы для изготовления отливок различной формы.
Римляне использовали медь и бронзу для изготовления водопроводных труб и фитингов, доспехов, шлемов, оружия, такого как мечи и копья, украшения, декоративные предметы и части музыкальных инструментов. Египтяне использовали медь для изготовления водопроводных труб примерно в то же время, что и римляне. Они также использовали медь и бронзу для изготовления зеркал, бритв, украшений, гирь и противовесов. Монеты из меди использовались римлянами, греками, китайцами и другими цивилизациями.
Латунь, сплав меди и цинка, была обнаружена около 1400 г. до н.э., но ее применение было ограниченным. Римляне использовали его для изготовления монет, золотых шлемов и украшений. Латунь начала широко использоваться примерно с 18 века после того, как был найден метод извлечения чистого цинка.
Римляне использовали его для изготовления монет, золотых шлемов и украшений. Латунь начала широко использоваться примерно с 18 века после того, как был найден метод извлечения чистого цинка.
Свойства
Химический символ меди Cu происходит от латинского названия металла cuprum, которое само происходит от латинской фразы Cyprium aes, что означает «металл с Кипра». Древние римляне получали большую часть запасов меди с Кипра.
Интересной особенностью меди является то, что помимо золота, это единственный металл, который не имеет естественного серебристого или серого цвета, а имеет блестящий красноватый оттенок.
Будучи пластичным, он может быть вытянут в проволоку и может быть легко обработан, изготовлен или отлит в любую желаемую форму. Только серебро имеет более высокую тепло- и электропроводность, чем медь. Но, учитывая, насколько дорого серебро, для всех практических целей медь является наиболее рентабельным электрическим проводником в периодической таблице.
Несмотря на некоторую нереактивность, медь может образовывать сплавы, которые тверже, чем она сама или металлы, с которыми она сочетается. Когда он химически соединяется с атомами других элементов, он образует различные промышленно полезные соединения, которые являются либо медными (медь I: ионы меди с зарядом +1), либо медными (медь II: ионы меди с зарядом +2). соединения меди обычно более стабильны.
Самый практичный металл цивилизации
Медь на протяжении всей истории оказалась исключительно полезным металлом. Одна из причин его постоянного и широкого использования заключается в том, что его можно перерабатывать без каких-либо потерь физических или химических свойств.
Медь в основном используется в строительстве зданий и производстве электрического и электронного оборудования. Около трех четвертей произведенной меди используется для передачи и производства электроэнергии, электропроводки, электрических и электронных изделий и телекоммуникаций. Медь также используется для изготовления посуды с медным дном, поскольку она нагревается равномерно.
Медь также используется для изготовления посуды с медным дном, поскольку она нагревается равномерно.
До сегодняшнего дня во многих странах, таких как Великобритания, США и даже Индия, для чеканки монет используется медь и ее сплавы. В новых индийских монетах достоинством в десять рупий медь является основным металлом. Точно так же монеты в 10, 20 и 50 евро равны 89.% медь. Примерно три десятилетия назад американские монеты в один цент на 98% состояли из меди. В настоящее время они изготавливаются из чистого цинка с медным покрытием.
Кстати, еще несколько десятилетий назад пуговицы и значки на униформе полицейских в США и Великобритании изготавливались из меди. Хотя, согласно популярному мифу, это было происхождение сленгового термина для полицейских — «копперы», позже сокращенного до «полицейские» — языковые эксперты говорят, что это прозвище, вероятно, произошло от старого английского слова «коп», что означало «схватить». .
В наше время медь играет ключевую роль в электрических и гибридных транспортных средствах. По мнению некоторых экспертов в этой области, содержание меди в автомобилях будущего может быть втрое больше, чем сегодня.
По мнению некоторых экспертов в этой области, содержание меди в автомобилях будущего может быть втрое больше, чем сегодня.
Антимикробные свойства меди еще больше расширили область ее применения. Когда-то его использовали для покрытия днищ кораблей из-за его свойства подавлять рост бактерий, ракушек и других форм жизни. Сегодня он вплетается в ткани, используемые для изготовления антимикробных продуктов, таких как носки для борьбы с грибком стопы, а также используется в медицине. Например, больницы используют его для покрытия поверхностей, к которым часто прикасаются, таких как дверные ручки, поручни кроватей и кнопки вызова, чтобы предотвратить распространение внутрибольничных инфекций.
Медные сплавы также имеют множество применений в электротехнике и для изготовления промышленного оборудования.
Несколько десятилетий назад медные браслеты стали популярным средством от артрита. В 2013 году контролируемое двойное слепое научное исследование в Великобритании пришло к выводу, что они не имеют значимого терапевтического эффекта.
Двумя наиболее промышленно важными соединениями меди являются: 1) сульфат меди (CuSO4), используемый в основном в сельскохозяйственных целях в качестве пестицида, гермицида, кормовой добавки и добавки к почве, а также в медицине в качестве фунгицида, бактерицида и вяжущего средства; и 2) хлорид меди (CuCl2), используемый в качестве консерванта для древесины, протравы в полиграфической и красильной промышленности, пигмента для стекла и керамики, а также в качестве дезинфицирующего средства.
В настоящее время ученые исследуют возможность использования меди для производства футуристической электронной бумаги, носимых биосенсоров и другой «мягкой» электроники.
Необходимый микроэлемент
Медь, присутствующая во всех тканях нашего тела, помогает правильно использовать железо, помогает щитовидной железе нормально функционировать, поддерживает здоровье костей, сохраняет миелиновую оболочку, защищающую наши нервы, и имеет решающее значение. для катализа образования гемоглобина. Поскольку это жизненно важный микроэлемент, мы должны включить его в свой рацион.
Поскольку это жизненно важный микроэлемент, мы должны включить его в свой рацион.
Такие продукты, как бобы, злаки, картофель, листовые овощи и спаржа, являются хорошими источниками меди.
2019 – Будет ли King Copper продолжать безраздельно править ?
За последние несколько десятилетий спрос на медь быстро растет из-за того, что многие развивающиеся страны, особенно Китай и Индия, становятся более промышленно развитыми. Растущий спрос привел к тому, что цена на медь в последнее время выросла в четыре раза, и прогнозы о том, что «King Copper» еще больше укрепит свои позиции спроса в этом году.
Тем временем применение меди продолжает расширяться по мере открытия новых аспектов ее полезности в различных отраслях промышленности, от фармацевтики до электроники.
Ссылки
- Стефани Паппас: Факты о меди – LiveScience, 12 сентября 2018 г., https://www.livescience.com/29377-copper.html
- Крис Вудфорд: Медь – ExplainThatStuff.
 com, 4 сентября 2019 г., https://www.explainthatstuff.com/copper.html
com, 4 сентября 2019 г., https://www.explainthatstuff.com/copper.html - К. Клэйборн Рэй: научный взгляд на медь – The New York Times, 23 января 2017 г., https://www.nytimes.com/2017/01/23/science/copper-bracelets-arthritis.html
- Жан-Марк Бёлен: Справочник по меди, Часть 2: Медь — ключ к современной эпохе — ускорение науки, 14 июля 2015 г., https://www.thermofisher.com/blog/metals/copper-compendium-part-2- медь-это-ключ-в-современной-эпохе/
- Ускорение науки: 8 забавных фактов о меди — ThermoFisher.com, https://www.thermofisher.com/content/dam/tfs/ATG/CAD/CAD%20Marketing%20Material/CAD%20Marketing%20Images/Infographics/Infographic- Медь.pdf
- Vin Calcutt: Introduction to Copper: Applications – Innovations, август 2001 г., https://www.copper.org/publications/newsletters/innovations/2001/08/intro_to_copper.html
- Теренс Белл: Древняя история меди – TheBalance.com, 30 декабря 2018 г., https://www.thebalance.com/copper-history-pt-i-2340112
- Стив Майлон: Медь – Мир химии, 30 декабря 2009 г.


 и 5,600 млн т в 2008 г.),
и 5,600 млн т в 2008 г.),



 com, 4 сентября 2019 г., https://www.explainthatstuff.com/copper.html
com, 4 сентября 2019 г., https://www.explainthatstuff.com/copper.html