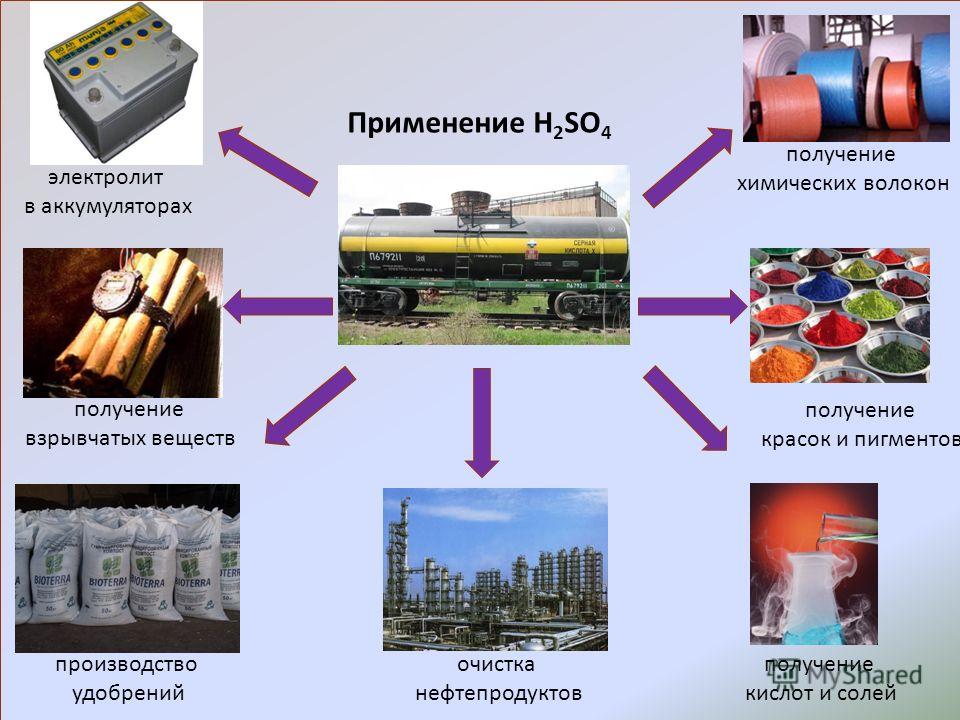
Каковы области применения воды углекислого газа алюминия меди: Каковы области применения: а) воды: б) углекислого газа; в) алюминия; г) меди; д) серебра?
Содержание
Алюминий и сплавы. Свойства.
Свойства алюминия
Алюминий и его сплавы имеют малую плотность 2,64— 2,89 г/см3. Прочностные же свойства зависят от легирования, термической обработки, степени деформирования и могут достигать высоких значений. По прочности многие алюминиевые сплавы не уступают конструкционным сталям.
Чистый алюминий (суммарное содержание примесей не более 0,05%) имеет гранецентрированную кубическую решетку с параметрами 4,04 А. Температура его плавления 659,8—660,2° С, температура кипения 1800—2500° С.
Для сплавов алюминия электропроводность составляет 30—50% электропроводности меди, а для чистого алюминия 62—65% электропроводности меди.
Алюминий окисляется с образованием окисной пленки Аl203, которая защищает его от дальнейшего окисления,Химический состав деформируемых и литейных алюминиевых сплавов по ГОСТам 4784—65 и 2685—63.
Из алюминиевых сплавов в основном изготовляют конструкции, работающие при сравнительно низких температурах не свыше 350° С. Так дуралюмин используют для работы при температурах не более 200° С, сплавы типа В95 до 125° С, авиали до 80—100° С при длительной работе и до 200° С при кратковременной. Специальные сплавы САП (спеченный алюминиевый порошок) применяют и для работы при более высоких температурах. До температуры 100° С кратковременные механические свойства меняются мало. Обращает внимание высокое относительное удлинение алюминиевых сплавов при низких температурах.
Так дуралюмин используют для работы при температурах не более 200° С, сплавы типа В95 до 125° С, авиали до 80—100° С при длительной работе и до 200° С при кратковременной. Специальные сплавы САП (спеченный алюминиевый порошок) применяют и для работы при более высоких температурах. До температуры 100° С кратковременные механические свойства меняются мало. Обращает внимание высокое относительное удлинение алюминиевых сплавов при низких температурах.
Характеристики длительной прочности термически не упрочняемых сплавов обычно ниже, чем термически упрочняемых.
Длительные выдержки сплавов типа авиаль при температурах свыше 80—100° С приводят к их упрочнению и снижению пластических свойств. Исследованиями, проведенными авторами, установлено, что относительное удлинение снижается при указанных условиях с 20—25% (исходное состояние после закалки и естественного старения) до 1—2%. Подобное ухудшение свойств, при которых возможно хрупкое разрушение конструкций, является существенным препятствием применения сплавов такого типа для работы при температурах выше 80° С.
Циклическая прочность
Циклическая прочность деформируемых сплавов при симметричном изгибе на базе 5*108циклов составляет 3,5 кГ/мм2 для сплава А ДМ, 4,2—6,3 кГ/мм2 для сплава АДН, 5—6,5 кГ/мм2 для сплава АМцАМ, 15 кГ/мм2 для сплава В95.
Области применения литейных сплавов различны. Сплавы группы I рекомендуют для литья в песчаные формы, кокиль и для литья под давлением. Сплав АЛ22 обычно применяют в закаленном состоянии, а сплав АЛ23 и АЛ29 — в литом. Сплавы группы II имеют высокие литейные свойства благодаря наличию в сплавах двойной эвтектики, которая уменьшает также литейную усадку и склонность к образованию горячих трещин. Сплавы AЛ2, АЛ4 и АЛ9 обладают повышенной коррозионной стойкостью, поэтому их применяют для изделий, работающих во влажной и морской средах. С целью получения заданных механических свойств отливки подвергают термической обработке по различным режимам.
Сплавы группы III обладают высокими механическими свойствами, особенно пределом текучести и повышенной жаропрочностью. У этих сплавов пониженные литейные свойства и коррозионная стойкость, кроме того, они склонны к образованию горячих трещин. Для выполнения отливок сложной формы такие сплавы не рекомендуют. Сплав АЛ7 применяют для деталей, испытывающих средние нагрузки и температуры не свыше 200° С. Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
У этих сплавов пониженные литейные свойства и коррозионная стойкость, кроме того, они склонны к образованию горячих трещин. Для выполнения отливок сложной формы такие сплавы не рекомендуют. Сплав АЛ7 применяют для деталей, испытывающих средние нагрузки и температуры не свыше 200° С. Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
Сплавы группы IV применяют для всех способов литья. По литейным свойствам они менее технологичны, чем сплавы II.
Сплавы группы V применяют для самых разнообразных деталей, работающих при высоких температурах. К этой группе относятся также самозакаливающиеся сплавы.
Механические свойства
Механические свойства всех вышеуказанных, литейных сплавов зависят от режимов термической обработки, определяющей структурное и фазовое состояние сплавов.
Высокая коррозионная стойкость алюминия объясняется образованием окисиой пленки Аl203. Коррозионная стойкость алюминия зависит от влияния агрессивной среды на растворимость защитной окисной пленки, от чистоты обработки поверхности и режима термической обработки. Чистый алюминий обладает высокой стойкостью в сухом и влажном воздухе. В азотной кислоте концентрации 30—50% при увеличении температуры скорость коррозии алюминия возрастает. При концентрации азотной кислоты выше 80% коррозия резко снижается. Алюминий обладает высокой стойкостью в разбавленной серной кислоте и в концентрированной при 20° С. Средние концентрации серной кислоты (более 40%) наиболее опасны для алюминия. При комнатных температурах алюминий устойчив в фосфорной и уксусных кислотах. Такие, как муравьиная, щавелевая, трихлоруксусная и другие хлороорганические кислоты значительно разрушают алюминий. В растворах едких щелочей окисная пленка алюминия растворяется. Растворы углекислых солей калия и натрия оказывают меньшее влияние на скорость коррозии алюминия.
Коррозионная стойкость алюминия зависит от влияния агрессивной среды на растворимость защитной окисной пленки, от чистоты обработки поверхности и режима термической обработки. Чистый алюминий обладает высокой стойкостью в сухом и влажном воздухе. В азотной кислоте концентрации 30—50% при увеличении температуры скорость коррозии алюминия возрастает. При концентрации азотной кислоты выше 80% коррозия резко снижается. Алюминий обладает высокой стойкостью в разбавленной серной кислоте и в концентрированной при 20° С. Средние концентрации серной кислоты (более 40%) наиболее опасны для алюминия. При комнатных температурах алюминий устойчив в фосфорной и уксусных кислотах. Такие, как муравьиная, щавелевая, трихлоруксусная и другие хлороорганические кислоты значительно разрушают алюминий. В растворах едких щелочей окисная пленка алюминия растворяется. Растворы углекислых солей калия и натрия оказывают меньшее влияние на скорость коррозии алюминия.
Алюминий при температурах до 300° С обладает хорошей стойкостью в жидких металлических средах, например, натрии.
Коррозионная стойкость алюминия в воде и водяном паре при повышенных температурах (выше 200° С) зависит от чистоты алюминия. Если происходит движение среды, то скорость коррозии повышается в 10—60 раз.
Основными видами коррозии алюминиевых сплавов является межкристаллитная коррозия и коррозия под напряжением. Для повышения коррозионных свойств применяют защитные покрытия, такие, как плакирование, оксидные пленки, лакокрасочные покрытия, смазки, хромовые или никель-хромовые гальванические покрытия.
Технология производства
Технология производства и термическая обработка могут оказывать существенное влияние на коррозионные свойства сплавов. Сплавы АД, АД1, АМц, АМг2 и АМгЗ мало чувствительны к методам производства. Коррозионная стойкость сплавов АМг5, АМгб во многом зависит от методов производства. У этих сплавов при длительном нагреве на 60—70° С проявляется склонность к межкристаллитной коррозии и коррозии под напряжением.
Сплавы Д1, Д18, Д16 и типа В95 имеют пониженную коррозионную стойкость.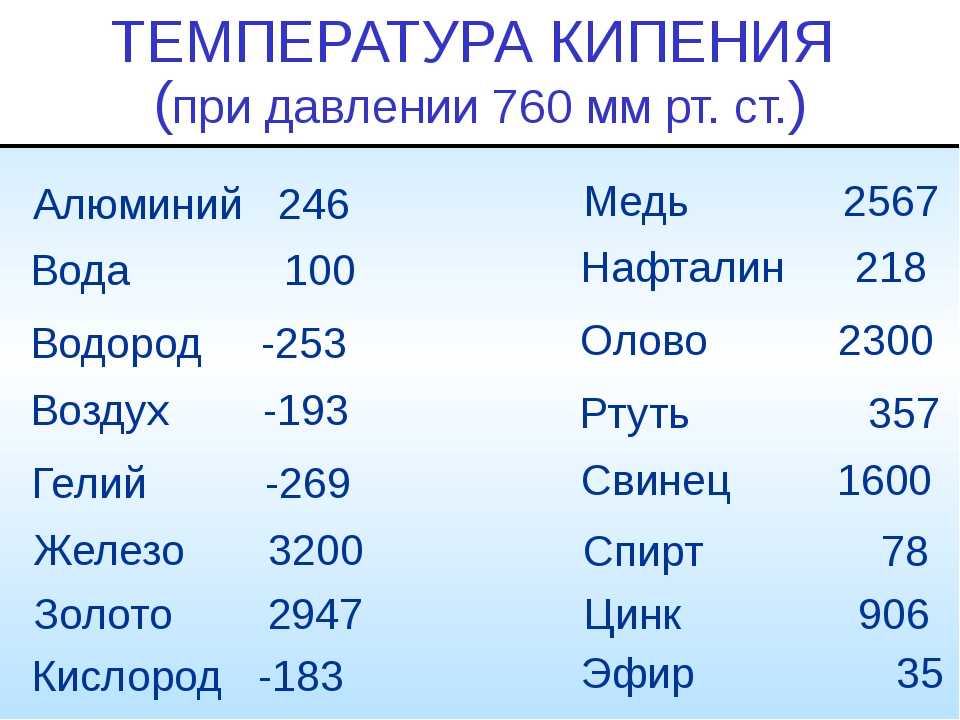 Подобные сплавы применяют с соответствующей защитой от коррозии. Сплавы типа авиаль обладают высокой коррозионной стойкостью в воде высокой чистоты с добавлением углекислого газа при температурах до 100° С.
Подобные сплавы применяют с соответствующей защитой от коррозии. Сплавы типа авиаль обладают высокой коррозионной стойкостью в воде высокой чистоты с добавлением углекислого газа при температурах до 100° С.
При изучении влияния облучения на некоторые характеристики алюминия установлено, что после облучения интегральным потоком 1,1 х 1019 нейтрон/см2 при 80° С критическое напряжение сдвига увеличивается в 5 раз. При этом электросопротивление алюминия повышается на 30%. Влияние облучения на электрическое и критическое сопротивления сдвигу снимается при температуре около 60° С.
Из разработанных свариваемых, термически обрабатываемых, самозакаливающихся при сварке сплавов, наиболее характерны сплавы системы Аl—Zn—Mg. Однако, обладая удовлетворительными прочностными свойствами, они склонны к коррозии под напряжением и замедленному разрушению. Такая склонность вызвана переходом от зонной к фазовой стадии старения даже при комнатных температурах эксплуатации сварных соединений. Поэтому сплавы системы Аl—Zn-Mg можно применять в условиях низких температур, исключающих переход к фазовому старению при низком уровне сварочных напряжений. Содержание цинка и магния должно быть при этом минимальным.
Поэтому сплавы системы Аl—Zn-Mg можно применять в условиях низких температур, исключающих переход к фазовому старению при низком уровне сварочных напряжений. Содержание цинка и магния должно быть при этом минимальным.
Высокая стойкость
К самозакаливающимся сплавам относится сплав 01911, по химическому составу он является среднелегированным сплавом системы Аl—Zn-Mg. Высокая стойкость против коррозии под напряжением обеспечивается суммарным содержанием цинка и магния до 6,5% и дополнительным введением марганца, хрома, меди и циркония. Причем медь ухудшает свариваемость сплава, поэтому для его сварки применяют проволоку марки 01557, аналогичную по химическому составу сплаву АМг5, но с добавкой циркония й хрома. Сплавы Д20 и АК8 достаточно прочны, но имеют низкую общую коррозионную стойкость. Они обладают высокой стойкостью против коррозии под напряжением и замедленного разрушения.
Перспективными являются спеченные сплавы. К числу жаростойких относятся сплавы типа САП, которые можно применять для конструкций, работающих при температурах до 400—500° С. САП содержит до 13% тугоплавкой окисной фазы, поэтому температура плавления его очень высокая (2000° С).
САП содержит до 13% тугоплавкой окисной фазы, поэтому температура плавления его очень высокая (2000° С).
Из сплавов САП-1 (6,0—9,0% А1203) и САП-2 (9,1 — 13,0% А1203) изготовляют такие же полуфабрикаты, как из алюминиевых сплавов. Сплав САП-3 применяют только для прессованных полуфабрикатов. Наибольшая масса прессованных полуфабрикатов до 400 кг. Размеры изготовляемых листов 1000 X Х7000 мм при толщине от 0,8 до 10 мм.
Сплавы имеют высокие прочностные свойства. Так у сплава САП-1 при 20° С ов = 35 кГ/мм2, а у САП-3 40 кГ/мм2. Подобными свойствами обладает сплав САС-1 (25—30% Si и 7% Nі), получаемый из распыленного порошка. Он износостоек, достаточно прочен (<та = 25,0-28,0 кГ/мм2), имеет коэффициент линейного расширения, близкий к стали, и высокий модуль упругости.
Сплавы САС-1 и САП не склонны к коррозии под напряжением и замедленным разрушениям. Сплав САП можно применять при сравнительно высоких температурах эксплуатации. При сварке этих сплавов обычно применяют присадочную проволоку марки АМг6.
При сварке этих сплавов обычно применяют присадочную проволоку марки АМг6.
Материалы с сатйа: http://ruswelding.com
Свойства гидроксида натрия и применение вещества в промышленности и быту
Гидроксид натрия является неорганическим токсичным соединением, которое широко применяется при изготовлении различных продуктов ежедневного пользования, в промышленных и бытовых целях.
Основные свойства гидроксида натрия
Наименование неорганического соединения произошло из физических и химических свойств едкого натра, который оказывает сильно разъедающее действие при соприкосновении с различными поверхностями, включая кожу, бумагу, ткани и другие органические вещества. В технических сферах вещество также именуют каустической содой, применение которой распространяется на область быта, промышленность.
Физические свойства гидроксида натрия
По физическим свойствам едкий натр – твердый реагент белого цвета, который плавится при температуре выше 322 градусов. Характеризуется сильной гигроскопичностью. При взаимодействии с воздухом «расплывается» из-за активного поглощения паров воды. При взаимодействии с водой – растворяется, выделяя тепло из-за образования гидратов. Полученный раствор получается мылким.
Характеризуется сильной гигроскопичностью. При взаимодействии с воздухом «расплывается» из-за активного поглощения паров воды. При взаимодействии с водой – растворяется, выделяя тепло из-за образования гидратов. Полученный раствор получается мылким.
Химические свойства гидроксида натрия
При взаимодействии с воздухом образует гидраты различного состава, которые при нагревании начинают разлагаться. Вещество хорошо распадается при сочетании с растворами и проявляет свойства щелочей.
Легко вступает в реакции с некоторыми веществами, включая:
- Кислоты.
- Кислотные и амфотерные оксиды и гидроксиды.
- Галогены.
Под воздействием высокой температуры может вступать в реакцию с металлами, а при смешивании с солями – образовывать гидроксиды. В ходе реакции с монооксидом углерода образуется формиат натрия.
Меры безопасности (класс опасности)
Каустик входит в группу пожаробезопасных и не взрывоопасных веществ, но в то же время едким и коррозионно-активным реактивом. Из-за чего веществу был присвоен 2 класс опасности. При взаимодействии с кожными покровами образуется сильнейший ожог, со слизистой носа, глаз — тяжелые заболевания, включая полную потерю зрения. При использовании реагента надевают средства индивидуальной защиты: очки, перчатки и химостойкие костюмы.
Из-за чего веществу был присвоен 2 класс опасности. При взаимодействии с кожными покровами образуется сильнейший ожог, со слизистой носа, глаз — тяжелые заболевания, включая полную потерю зрения. При использовании реагента надевают средства индивидуальной защиты: очки, перчатки и химостойкие костюмы.
Хранение и перевозка
При транспортировке реагента используют II и III группы упаковок. Если же необходима совместная упаковка, используют марки MP15 (II группа упаковки), MP19 (III группа упаковки). Для перевозки используют транспорты 2 или 3 категории.
Для хранения используют герметичную тару, которую помещают в сухое складское помещение. Рядом с веществом нельзя хранить кислоты, включая органические, легкие металлы и их сплавы.
Применение гидроксида натрия
На производственные и бытовые цели распространяется использование:
- натра едкого чешуированного;
- натра едкого гранулированного;
- диафрагменного твердого;
- ртутного, химического или диафрагменного раствора.

Применение едкого натра распространяется на множество областей:
- Получение бумаги.
-
Каустик участвует в получении бумаги и картона, искусственного волокна и древесно-волоконных плит. Также применение распространяется на делигнификацию целлюлозы. - Изготовление бытовой химии.
-
В данной области применения каустическая сода необходима, чтобы провести омыление жиров, которые используются в мыльной продукции, шампунях и других моющих растворах. - Отрасль химического производства.
-
В химии каустик используется с целью нейтрализации действия кислоты или оксидов. Используется в качестве катализатора при проведении химических опытов, анализе для титрования, получении чистых металлов или травлении алюминия. В переработке нефти необходим для получения масел. - Получение биодизельного топлива.
-
В этой области каустик выступает в роли щелочного катализатора, который добавляется к смеси органических масел и спирта.
- Для прочистки инженерных коммуникаций.
-
При устранении трубных застоев едкий натр выступает растворителем. Агент расщепляет скопление мусора и обеспечивает его дальнейшее движение по коммуникации. - В военной сфере.
-
В данной области едкий натр используется, чтобы дегазировать и нейтрализовать действие отравляющих веществ. Реагент применяется при сборке изолирующих приборов для дыхания, где едкий натр выступает в роли очистителя воздуха от примесей углекислого газа. - В текстильном производстве.
-
В текстильном деле каустик используется для мерсеризации хлопкового и шерстяного сырья. При непродолжительном воздействии едким веществом, растительное волокно становится более прочным, блестящим и шелковистым. - В поварском деле.
-
Использование каустика в приготовлении блюд позволяет быстро очистить овощи и фрукты от кожуры. Также применяется для получения некоторых видов сладостей, напитков и шоколада.
- В косметологических процедурах.
-
При помощи каустика удается избавиться от папиллом, бородавок и огрубевших частиц кожи. - В проявлении фотоснимков.
При проявке фотографий едкий натр ускоряет процесс, что позволяет в разы сократить время на обработку фотоматериалов.
Чтобы купить гидроксид натрия, свяжитесь с нами по телефону или заполните форму на сайте.
Реакция углекислого газа с водой | Эксперимент
В этом эксперименте учащиеся используют собственный выдыхаемый воздух для исследования реакции между углекислым газом и водой. Они наблюдают образование слабой кислоты по изменению цвета кислотно-щелочного индикатора
Это относительно краткое и прямое исследование реакции углекислого газа и воды на простом уровне, которое должно занять не более 15 минут.
При реакции углекислого газа с водой образуется слабая кислота. Углекислый газ, присутствующий в выдыхаемом воздухе, вдувают в колбу, содержащую индикатор, чувствительный к небольшим изменениям рН в соответствующем диапазоне шкалы рН, и последующее изменение цвета наблюдают и регистрируют. Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Если учащиеся еще не знакомы с составом вдыхаемого и выдыхаемого воздуха, этот эксперимент может служить частью последовательности изучения темы дыхания и дыхания во вводном курсе естественных наук с использованием надлежащего элементарного подхода к соответствующей химии.
Для учащихся, которые уже рассмотрели тему дыхания и дыхания и знают, что двуокись углерода является важным компонентом выдыхаемого воздуха, основное внимание в этом эксперименте можно перенести на характер химической реакции (другими связанными темами могут быть кислотные дождь, газожидкостные реакции или индикаторы).
Уравнение реакции между углекислым газом и водой может быть введено для соответствующих учащихся.
Оборудование
Аппарат
- Защита глаз
- Коническая колба, 250 см 3 , 2 шт.
- Индикаторные флаконы с пипетками, 3 шт.

Химикаты
- Этанол (IDA – Промышленный денатурированный спирт) (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ)
- Индикаторный раствор тимолфталеина (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Индикаторный раствор фенолового красного (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Раствор гидроксида натрия, 0,4 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), маленький флакон с пипеткой
- Дистиллированная (или деионизированная) вода, 125 см 3 , 2 шт.
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Красный индикатор фенола – см. CLEAPSS Hazcard HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).
 Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется.
Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется. - Тимолфталеиновый индикатор – см. карточку опасности CLEAPSS HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA). Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.
- Этанол (IDA – Промышленный денатурированный спирт), CH 3 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ) – см. CLEAPSS Hazcard HC040A.
- Раствор гидроксида натрия, NaOH (водн.
 ), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
Процедура
Источник: Королевское химическое общество
Активность 1
- Место около 125 см 3 воды в 250 см 3 Conical Clask.
- Добавьте в воду пять или шесть капель индикатора тимолфталеина.
- Добавьте ровно столько раствора гидроксида натрия (около двух или трех капель), чтобы получился синий цвет.
- Аккуратно поговорите или подуйте в колбу, т.е. добавьте углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
Действие 2
- Поместите примерно 125 см 3 воды в 250 см 3 коническую колбу.
- Добавьте в воду одну или две капли фенолового красного.
- Добавьте две капли раствора гидроксида натрия, чтобы получить красный раствор.

- Говорите или осторожно дуйте в колбу – т.е. добавить углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
Вопросы к классу
- Почему изменение цвета не происходит мгновенно?
- По какой причине перед каждым экспериментом добавляют несколько капель раствора гидроксида натрия (NaOH)?
Ответы на вопросы
- Количество углекислого газа в каждом вдохе невелико, поэтому для реакции со щелочью требуется много вдохов.
- Для обеспечения слабой щелочности раствора в начале и для нейтрализации любого CO 2 или любой другой изначально присутствующей кислоты.
Учебные заметки
Соломинки не нужны для вдувания выдыхаемого воздуха в колбу; достаточно просто дышать или говорить в колбу, чтобы индикатор изменил цвет.
Индикатор феноловый красный меняет цвет с желтого на красный в диапазоне рН 6,8–8,4. Тимолфталеин (также можно использовать альтернативный бромтимоловый синий) меняет цвет с синего (щелочной) на бесцветный (кислотный) в диапазоне рН 9. .3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
.3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
Со временем достаточное количество углекислого газа из дыхания учащихся растворяется и образует в растворе достаточно кислоты, чтобы изменить цвет индикатора:
CO 2 (водн.) + H 2 O(л) ⇌ H + (водн.) + HCO 3 – (водн.)
CO 2 также реагирует с NaOH. Эта реакция дает менее щелочной Na 2 CO 3 :
2NaOH(водн.) + CO 2 (г) → Na 2 CO 3 (водн.) + H 2 O(ж)
Равновесие между углекислым газом и водой можно обратить нагревание слабокислого раствора чуть ниже температуры кипения. С повышением температуры растворимость углекислого газа в воде уменьшается, и он уносится в атмосферу. Поэтому концентрация растворенного диоксида углерода падает, что приводит к смещению равновесия влево и изменению цвета индикатора обратно на красный. При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, 2016 г. Глава 6: Химические изменения
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 6.5
Ключевые понятия
- Катализатор — это вещество, которое помогает реагентам в химической реакции реагировать друг с другом быстрее.

- Катализатор фактически не становится частью продуктов реакции.
Резюме
Учащиеся смотрят видео и выполняют быстрое задание, чтобы увидеть, что катализатор может увеличить скорость распада (разложения) перекиси водорода. Затем учащиеся будут использовать соль в качестве катализатора реакции между алюминиевой фольгой и раствором сульфата меди II. Студенты познакомятся с концепцией, согласно которой катализатор увеличивает скорость химической реакции, но не включается в продукты реакции.
Цель
Учащиеся смогут определить катализатор как вещество, которое увеличивает скорость химической реакции, но не входит в состав продуктов реакции.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки. При использовании перекиси водорода следуйте всем предупреждениям на этикетке. После того, как учащиеся выполнили задание с раствором сульфата меди II и алюминиевой фольгой, дайте содержимому чашки испариться. Поместите небольшое количество твердого вещества в бумажное полотенце и выбросьте в мусорное ведро или используйте метод утилизации, требуемый местным законодательством.
После того, как учащиеся выполнили задание с раствором сульфата меди II и алюминиевой фольгой, дайте содержимому чашки испариться. Поместите небольшое количество твердого вещества в бумажное полотенце и выбросьте в мусорное ведро или используйте метод утилизации, требуемый местным законодательством.
Материалы для каждой группы
- Градуированный цилиндр (50 мл или 100 мл)
- Перекись водорода (3%)
- Дрожжи
- 2 палочки для эскимо
- Моющий раствор
- Пипетка
- Маленькая чашка
- Прозрачный пластиковый стаканчик
- Раствор сульфата меди II (в чашке)
- Соль
- Алюминиевая фольга (5 см × 5 см)
- Термометр
Примечания о материалах
Сульфат меди II можно приобрести у различных поставщиков химикатов, включая Sargent Welch, номер продукта WLC94770-06, или Flinn Scientific, номер продукта C0110.
Покажите учащимся две демонстрации и попросите их найти доказательства того, что в результате химических реакций образуется газ.

Скажите учащимся, что вы покажете им видеозапись двух демонстраций, в которых водяной пар и газообразный кислород образуются в результате одной и той же химической реакции. Поскольку газы невидимы, попросите студентов внимательно следить за доказательствами образования газа.
Спроецируйте видео «Зубная паста слона».
Вспенивание показывает, что газы (кислород и водяной пар) образуются очень быстро. Количество пены, образующейся за определенный период времени, является способом измерения скорости реакции.
Проецируйте видео «Джинн в бутылке».
Пар, выходящий из бутылки, представляет собой водяной пар, который конденсируется на выходе из бутылки. Кислород тоже выходит из баллона, но его не видно.
Спросите учащихся:
- Как определить, что в результате химической реакции образуется газ?
- Вспенивание зубной пасты для слонов означает, что выделяется газ. Выделение газа является признаком того, что произошла химическая реакция.
 Водяной пар в демонстрации джинна в бутылке также показывает производство газа.
Водяной пар в демонстрации джинна в бутылке также показывает производство газа.
Скажите учащимся, что этот урок посвящен ускорению химических реакций. Некоторые реакции протекают очень медленно, но можно добавить химические вещества, называемые катализаторами, чтобы ускорить их. Обе эти демонстрации опирались на катализатор.
Опишите, как при разложении перекиси водорода образуется газообразный кислород в обоих видеороликах.
Сообщите учащимся, что в обеих демонстрациях используется 30-процентный раствор перекиси водорода. Обычно перекись водорода, которую вы можете купить в магазине, содержит только 3% перекиси водорода. Объясните учащимся, что химическая формула перекиси водорода: H 2 O 2 . Укажите, что перекись водорода не очень стабильна и сама по себе распадается на воду и кислород. Такое изменение представляет собой химическую реакцию, называемую разложением. Разложение перекиси водорода происходит медленно и обычно незаметно.

Спроектируйте изображение Разложение перекиси водорода.
Объясните, что перекись водорода разлагается с образованием воды и кислорода в соответствии с этим химическим уравнением:
Скажите учащимся, что эта химическая реакция происходит сама по себе и что даже энергия света в комнате может ускорить разложение перекиси водорода. Вот почему перекись водорода продается в непрозрачных контейнерах.
Скажите учащимся, что в видеоролике вещество (перманганат калия или двуокись марганца) использовалось для ускорения разложения перекиси водорода. Несмотря на то, что это ускорило реакцию, само вещество не изменилось во время реакции. Вещество, увеличивающее скорость реакции, но не входящее в состав продуктов реакции, называется катализатором.
Спросите учащихся:
- Ваш учитель показал вам демонстрацию, где к перекиси водорода добавляется катализатор, и образуется большое количество газообразного кислорода. Если катализатор участвует в химической реакции, то почему он не включен в химическое уравнение как продукт?
- Катализатор не попадает в продукты, поэтому не включается в химическую реакцию.

- Что делает катализатор в химической реакции?
- Катализаторы ускоряют реакцию, но не меняются в ходе реакции.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Предложите учащимся использовать дрожжи для катализа разложения перекиси водорода.
Вопрос для изучения
Может ли другое вещество катализировать разложение перекиси водорода?
Материалы для каждой группы
- Градуированный цилиндр
- Перекись водорода (3%)
- Дрожжи
- Палочка для эскимо
- Моющий раствор
- Пипетка
Подготовка учителя
Приготовьте раствор моющего средства, добавив 1 чайную ложку жидкого моющего средства на 2 столовые ложки воды.
 Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.
Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.Процедура
Добавьте 10 мл перекиси водорода в градуированный цилиндр. Добавьте 1 каплю раствора моющего средства. Осторожно встряхните и наблюдайте за раствором на наличие пузырьков.
Объясните учащимся, что моющее средство добавляется только для образования пузырей в случае образования газа. Поскольку при распаде перекиси водорода образуется газообразный кислород, появление пузырьков указывает на то, что перекись водорода разрушается или разлагается. Отсутствие пузырьков свидетельствует о том, что вырабатывается не так много газообразного кислорода.
Используйте конец палочки от эскимо, чтобы добавить небольшое количество дрожжей в перекись водорода в градуированном цилиндре и взболтать.
- Поставьте градуированный цилиндр на стол и следите за появлением пузырьков.
- Держите мерный цилиндр, чтобы увидеть, есть ли какие-либо изменения в температуре.
Ожидаемые результаты
До добавления дрожжей пузырьков не наблюдается. После добавления дрожжей пузырьки заставят пену двигаться вверх по градуированному цилиндру. Кроме того, градуированный цилиндр должен быть немного теплее, потому что при разложении перекиси водорода выделяется энергия. Изменения энергии в химических реакциях будут более подробно исследованы в главе 6, уроке 7.
Обсудите наблюдения учеников.
Спросите учащихся:
- Какие у вас есть признаки того, что в этом упражнении произошла химическая реакция?
- Бульканье. Скажите учащимся, что изменение температуры также является признаком возможной химической реакции. Эндотермические и экзотермические химические реакции будут рассмотрены в главе 6, уроке 7.
- Что является катализатором в этой деятельности?
- Вещество в дрожжах.
- Какие у вас есть доказательства того, что перекись водорода быстрее разлагается при добавлении дрожжей?
- Пузырьки газообразного кислорода образовались после добавления дрожжей.

- Когда вы пишете химическое уравнение для этой реакции, должны ли дрожжи включаться в химическое уравнение в качестве продукта?
- Объясните учащимся, что катализатор в дрожжах не попадает в продукты, а является веществом, которое ускоряет разложение. Иногда катализатор пишут над или под стрелкой в химическом уравнении, но он никогда не включается в состав реагентов или продуктов.
Как правило, катализаторы работают, создавая место, где реагенты могут собираться вместе для реакции. Объясните учащимся, что клетки дрожжей и других организмов содержат катализатор под названием каталаза . Благодаря нормальным клеточным процессам живые существа производят перекись водорода в своих клетках. Но перекись водорода — это яд, поэтому клеткам нужен способ очень быстро его расщепить. В клетках содержится каталаза, которая очень быстро расщепляет перекись водорода. Каждую секунду одна молекула каталазы может катализировать расщепление миллионов молекул перекиси водорода.

Студенты могут продолжить изучение влияния каталазы на перекись водорода, добавив кусочек сырого свежего картофеля в небольшое количество перекиси водорода.
Предложите учащимся назвать изменения, происходящие при взаимодействии сульфата меди II с кусочком алюминиевой фольги.
Примечание: это реакция между сульфатом меди II и алюминием. Медь называется «медь II», потому что медь может образовывать различные типы ионов. Он может потерять один электрон и быть просто Cu + или он может потерять два электрона и быть Cu 2+ . Этот тип иона меди называется медью II. Также «сульфат» в сульфате меди II также является ионом. Этот ион состоит из более чем одного атома. Это один из многоатомных ионов, обсуждавшихся в главе 4, уроке 3. Ион сульфата состоит из атома серы, связанного с четырьмя атомами кислорода, и рассматривается как один ион (SO 4 2− ).
Есть несколько интересных аспектов реакции между сульфатом меди II и алюминием, но она отличается от других реакций, с которыми до сих пор сталкивались учащиеся.
 В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию. Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает.
В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию. Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает.Соль можно считать катализатором реакции, но она играет иную роль, чем большинство катализаторов. Сульфат меди II и алюминий реагируют очень медленно, потому что алюминий покрыт очень тонким слоем потускнения (оксид алюминия). Эту реакцию можно ускорить, если удалить или повредить слой оксида алюминия. Добавление соли делает это и позволяет электронам алюминия реагировать с ионами меди в растворе, превращая их в металлическую медь.
Вопрос для изучения
Что является катализатором в следующем упражнении?
Материалы для каждой группы
- Раствор сульфата меди II (в чашке)
- Прозрачный пластиковый стаканчик (пустой)
- Соль
- Кусок алюминиевой фольги
- Термометр
- Палочка для эскимо
Подготовка учителя
Приготовьте раствор сульфата меди II, добавив 20 г сульфата меди II в 200 мл воды.
 Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).
Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).Процедура
- Поместите кусок алюминиевой фольги в пустую чашку. Пальцами или палочкой от мороженого плотно прижмите фольгу, чтобы она лежала ровно и закрывала дно чашки.
- Добавьте весь раствор сульфата меди II в чашку с алюминиевой фольгой.
- Осторожно взболтайте раствор в течение нескольких секунд и дайте ему постоять. Следите за алюминием на наличие пузырей или изменения цвета.
Используйте палочку от эскимо, чтобы поместить небольшое количество соли в раствор сульфата меди II. Аккуратно взболтайте раствор в течение нескольких секунд и дайте ему постоять. Следите за появлением пузырьков или изменением цвета.
- Осторожно поместите термометр в чашку и посмотрите, изменится ли температура.
Ожидаемые результаты
До добавления соли пузырьки и изменение цвета отсутствуют.
 После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри. Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.
После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри. Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.Обсудите наблюдения учеников.
Спросите учащихся:
- Откуда вы знаете, что при помещении куска алюминиевой фольги и хлорида натрия в раствор сульфата меди II происходит химическая реакция?
- Возникло пузырение, изменение цвета, повышение температуры и образование другого твердого вещества.
- Что является катализатором в этой деятельности?
- Соль.
- Чем добавление соли к алюминию похоже на добавление дрожжей к перекиси водорода?
- Оба могут рассматриваться как катализаторы. Добавление дрожжей помогает перекиси водорода быстрее разлагаться, а добавление соли помогает алюминию реагировать с сульфатом меди II.

