Катодная защита автомобиля от коррозии своими руками: Катодная защита автомобиля от коррозии своими руками 🦈 avtoshark.com
Содержание
Катодная защита автомобиля от коррозии своими руками
Автовладельцу, который задумывается о хорошем состоянии и товарном виде своего автомобиля, очень важен вопрос защиты кузова от ржавчины. Вы, скорее всего, замечали, что купить подержанный автомобиль с идеальным лакокрасочным покрытием очень трудно. Конечно, это зависит от эксплуатации и года выпуска. В приведенной статье рассмотрена катодная защита кузова автомобиля от коррозии, этот способ также называется электрохимической защитой. Оглавление: Где применяется катодная защита от коррозии?
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Катодная антикоррозийная защита кузова автомобиля
- Катодная защита от коррозии – все особенности методики
- Защита от коррозии.
Спасет и трактор, и автомобиль
- Катодная защита кузова авто — эффективный способ защиты авто от коррозии!
- Катодная защита кузова автомобиля от коррозии. Все о ее эффективности
- Электрохимические способы защиты автомобиля от коррозии
- Электроическая защита от коррозии — кто пользовал?
- Катодная защита от коррозии – все особенности методики
- Защищаем кузов своего автомобиля от коррозии. Описание методик и практические советы.
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: фильм о электрохимической защите авто
Катодная антикоррозийная защита кузова автомобиля
Забыли пароль? Форум Общие форумы Общие вопросы Электроическая защита от коррозии — кто пользовал? Страница 1 из 3 1 2 3 Последняя К странице: Показано с 1 по 20 из Электроическая защита от коррозии — кто пользовал? Опции темы Подписаться на эту тему…. Собственно сабж. Сообщение от. Катодная защита автомобиля от коррозии Многим автолюбителям известно, что достаточно появиться небольшой царапине — и ржавчина начинает прямо-таки поглощать автомобиль.
Собственно сабж. Сообщение от. Катодная защита автомобиля от коррозии Многим автолюбителям известно, что достаточно появиться небольшой царапине — и ржавчина начинает прямо-таки поглощать автомобиль.
И бороться с ней весьма трудно. Какие только хитрости ни придумывают автомобилисты — различные покрытия, мастики, антикоры Да вот беда: чтобы обработать с должным качеством все наиболее поражаемые места, приходится порой разбирать весь автомобиль. Такая операция занимает немало времени, да и требует постоянного контроля. Кроме того, в процессе эксплуатации происходит постепенное разрушение покрытий. Из-за вибраций при движении появляются микротрещины, под ударами камней или песка краска откалывается.
Поэтому вполне понятно желание автомобилистов приобрести чудо-прибор: один раз потратился и навсегда защитил кузов от ржавчины. Метод катодной защиты от коррозии уже давно применяется на самых разнообразных объектах. Например, на кораблях устанавливают специальные протекторы, которые, растворяясь в морской воде, обеспечивают защиту корпуса судна.
Подземные трубопроводы перед укладкой обрабатывают антикоррозийными составами и обматывают специальной лентой. На определенном расстоянии от трубопровода закапывают анод электрод — металлическую болванку, к которой подключают «плюс» источника постоянного тока, а к самой трубе — «минус». Благодаря разности потенциалов между электродом и защищаемым металлом в цепи образующегося электролита влага, соль и т.
На аноде происходит освобождение электронов — реакция окисления, и саморастворение катода прекращается [1, 2]. При катодной поляризации металлу нужно сообщить такой отрицательный потенциал, при котором его окисление становится термодинамически маловероятным.
Для железа и его сплавов полная защита от коррозии достигается при потенциале 0, Дальнейший сдвиг потенциала мало влияет на степень защиты. Плотность защитного тока должна быть в пределах Кроме того, со временем на металле за счет концентрационной поляризации по кислороду наблюдается дополнительное смещение потенциала в отрицательную сторону, что позволяет периодически выключать устройство при ремонте автомобиля, зарядке аккумулятора и т.
Устройство защиты от коррозии состоит из электронного блока и защитных электродов. На корпусе электронного блока размещают световую индикацию работы устройства. Устройство позволяет поддерживать значение потенциала влажных участков поверхности кузова на уровне, необходимом для полной остановки и прекращения коррозийных процессов за счет разрушения защитных электродов.
В качестве защитных электродов анодов могут использоваться как разрушающиеся материалы нержавеющая сталь, алюминий , требующие замены через В качестве неразрушающихся электродов можно применять карбоксил, магнетит, графит или платину. Защитные электроды выполняются в виде прямоугольных либо круглых пластин площадью Катодная защита автомобиля от коррозии На рисунке приведена схема простого антикоррозийного устройства, которое может успешно справляться с явлениями коррозии.
Конечно, в простейшем виде устройство катодной защиты может состоять из защитных электродов и проводов, подключаемых непосредственно на «плюсовую» клемму аккумулятора. Однако здесь трудно контролировать возможное короткое замыкание электродов с кузовом автомобиля и его работу в целом. Для этого в устройстве в цепь делителя напряжения R1, R2, R3 включен светодиод VD1, который в рабочем режиме светится ровным светом, потребляя незначительный ток от аккумулятора около 2 мА.
Однако здесь трудно контролировать возможное короткое замыкание электродов с кузовом автомобиля и его работу в целом. Для этого в устройстве в цепь делителя напряжения R1, R2, R3 включен светодиод VD1, который в рабочем режиме светится ровным светом, потребляя незначительный ток от аккумулятора около 2 мА.
Если вдруг один из защитных электродов замыкается на кузов автомобиля, светодиод VD1 прекращает светиться. В этом случае необходимо найти-и устранить замыкание. При повышенной влажности кузова светодиод VD1 может в небольших пределах изменять свое свечение, что указывает на работу катодной защиты.
Кроме того, данное устройство имеет высокую надежность, поскольку дает при коротком замыкании выхода с кузовом ток перегрузки не более При установке и монтаже устройства следует помнить, что: — один защитный электрод защищает площадь с радиусом около 0, Электронный блок устанавливается в любом месте автомобиля и присоединяется к общей схеме электрооборудования автомобиля. При этом необходимо, чтобы электронный блок оставался включенным даже при отключенном общем электрооборудовании автомобиля.
В целом устройство потребляет не больше чем часы автомобиля и гарантирует длительную эффективную работу даже при сильно разряженном аккумуляторе. Еще одна Электрическая схема простейшего устройства приведена на рис.
Верхний по схеме вывод резистора R1 соединен с положительным выводом аккумулятора, нижний по схеме вывод резистора R2 соединен с отрицательным выводом. Потенциал U должен быть равен защитному потенциалу, при котором прекращается процесс коррозии.
К точке 1 делителя необходимо припаять длинные провода в изоляции , к другим концам которых припаять стальные пластины—аноды. Каждый анод представляет собой пластину из низкоуглеродистой стали прямоугольной формы размерами примерно 2х2 см.
Для защиты можно использовать и внешние аноды, о чем будет сказано далее. Предлагаемое устройство превращает корпус автомобиля в катод, который в процессе эксплуатации будет восстанавливаться за счет окисления анодов. Конструкция устройства — произвольная. Катодная защита автомобиля от коррозии А вот так вот устройство реализовано в реале, использлована заглушка кнопки Катодная защита автомобиля от коррозии Р и с.
Установка электродов в этих точках наиболее эффективна:1 — коробчатые усилители брызговиков, 2 — места крепления фар и подфарников, 3 — нижняя часть передней панели, 4 — полости за щитками-усилителями передних крыльев, 5 — внутренние поверхности дверей и порогов, 6, 7 — передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 — фартук задней панели.
Igor 28rus. Осмотр авто. Подберу и перегоню авто,в любую точку РФ. Перегон любой колесной спецтехники. Подробней ознакомится можно в дневнике. Toyota Wish г. Сообщение от Lehinskii. Если на раму, допустим, поставить, достаточно ли эффективно? А покрывать ее всю — занятие хлопотное, если самому и дорогое, если не самому. Вот и хотел узнать, может кто такое использовал на машине и как оно работает.
Кабы ни у кого ничего не ржавело, не было бы кучи тем, особенно от сафареводов — как защитить раму от коррозии. В общем никто ничего не знает.
Жизнь слишком коротка, чтобы ездить на скучных автомобилях! Надо ездить только на новых автомобилях,тут плохого не посоветуют.
Бензоэлектроинструмент в наличии,под заказ. Расходные материалы. Я прозрел, братья! Сейчас же скорей в ближайший салон ЛАДА. Вован сказал — хорошая машина. Значит надо брать! Да будет так Только вольцваген! Сообщение от YevgenUfa. Вы же так никогда не убъётесь.
Ну хоть какой-то пользователь откликнулся! Сообщение от Samik. Нормально описано все. Это Вам надо получше изучить физику и химию. Описанные устройства действуют. Единственно платить за такое не стоит. Электроны бегут не по воздуху, а по поверхности, покрытой влагой, замешанной на солях, — то есть электролите.
Когда автомобиль сухой, то нет и коррозии. Электрохимическую защиту ставил еще в 90 годах на — тогда даже наборы продавали с пластинами специальными. Реально помогало только в окрестности пластин, при том, что у пластин все время сгнивали контакты то есть теория работает. А поскольку в места, подверженные коррозии пластины ставить и проверять их состояние сложно, я бы предпочел луженый кузов. Кстати метал покрытый, например, свинцовым суриком, создает также электрохимический эффект.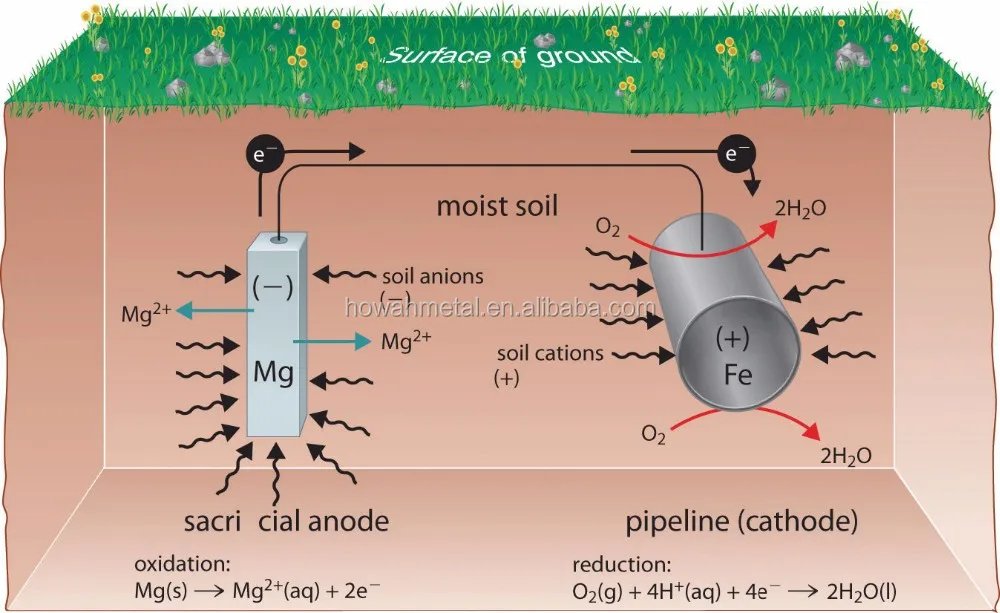
Страница 1 из 3 1 2 3 Последняя К странице:. Двигатель ZAZ шанс 1. Пятничная подборка видео: пенсионер…. Toyota Mirai больше не переднеприводный…. Безумное ДТП в Кемеровской области…. УАЗ Патриот год Sochinec Toyota Corolla год Sergei. Skoda Rapid год saddler. Татьяна Елисеева: на Формуле….
Катодная защита от коррозии – все особенности методики
В данной статье изложен электрохимический способ. Смотрите также классические методы защиты кузова автомобиля от коррозии. Почти все автомобили сделаны из железа. А железо, как известно, имеет свойство ржаветь. Поэтому проблемам защиты кузова автомобиля от коррозии все производители автомобилей уделяют пристальное внимание. Всевозможные грунтовки, стойкие краски, специальные сорта стали — всё направлено на борьбу с коррозией.
Катодная защита автомобиля от коррозии. Многим . а теперь своими словами расскажите смысл всей этой халабуды. У вас что.
Защита от коррозии. Спасет и трактор, и автомобиль
Забыли пароль? Форум Общие форумы Общие вопросы Электроическая защита от коррозии — кто пользовал? Страница 1 из 3 1 2 3 Последняя К странице: Показано с 1 по 20 из Электроическая защита от коррозии — кто пользовал? Опции темы Подписаться на эту тему….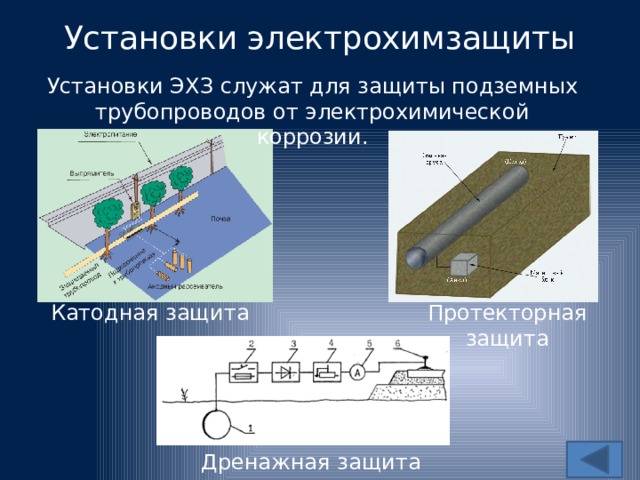 Собственно сабж. Сообщение от.
Собственно сабж. Сообщение от.
Катодная защита кузова авто — эффективный способ защиты авто от коррозии!
Помощь Запомнить? Расширенный поиск. Форум Наш клуб Курилка Катодная защита от коррозии автомобиля «Нержавейка». Для новичков форума. Страница 1 из 2 1 2 Последняя К странице: Показано с 1 по 20 из
Одним из часто применяемых методов электрохимической защиты разнообразных конструкций из металлов от ржавления является катодная защита.
Катодная защита кузова автомобиля от коррозии. Все о ее эффективности
By Antony , May 16, in Автомобильная электроника. Собственно вот схема. Я в электронике полный 0, друзей кто разбирается нету, не знаю что значат все эти прямоугольнички и палочки со стрелочками на ней, некоторые из обозначений нашел в википедии, но приписаные к ним цифорки понять не смог, интернет мне на их поиск ничего толком не выдал. Но не знаю что мне нужно купить, где это может продаваться, и что как и с чем Мы принимаем формат Sprint-Layout 6! Экспорт в Gerber из Sprint-Layout 6.
Электрохимические способы защиты автомобиля от коррозии
Календарь Пользователи Поиск Помощь. Здравствуйте, гость Вход Регистрация. АлександрС — 7. And — 2. Elperegrino — 1. Zmey — 1. Zmey — 2. DrVovik —
Катодная защита применяется на судах и не от корозии а от Применимо для автомобилей: т.к. он не закопан в землю и не плавает в.
Электроическая защита от коррозии — кто пользовал?
Возникновение коррозии — одна из самых распространённых причин выхода автомобиля из строя. Под действием ржавчины поверхность кузова машины очень быстро приходит в негодность и разрушается. Поэтому защита кузова от коррозии — одна из самых важных и обязательных задач, стоящих перед каждым владельцем автомобиля.
Катодная защита от коррозии – все особенности методики
В помощь автолюбителю. Металл подвержен образованию и гниению ржавчины, и кузов автомобиля — не исключение. В большинстве случаев, на появление очагов коррозии автомобилисты реагируют лишь поле того, как они становятся заметными. На распространения и скорость появления воздействует влажность — в сыром климате с туманами и постоянными дождями кузов повреждается весьма скоро.
На распространения и скорость появления воздействует влажность — в сыром климате с туманами и постоянными дождями кузов повреждается весьма скоро.
Защищать машину от ржавчины следует на протяжении всего времени ее эксплуатации.
Защищаем кузов своего автомобиля от коррозии. Описание методик и практические советы.
Коррозия — наиболее распространенная причина разрушения металлических поверхностей вашего автомобиля. Продукт коррозионного процесса — это ржавчина — оксид железа. Коррозия металла не останавливается ни на секунду — она начинается в момент рождения автомобиля и распространяется по кузову, днищу, что неизменно приведет в негодность автомобиль, если ничего с этим не делать. Электрохимическая защита автомобиля от коррозии — один из лучших вариантов уберечь свою машину от ржавения. Зачастую виновниками появления коррозии выступают вода и дорожные реагенты, используемые дорожными службами в холодный период. Таким образом, железо в сочетании с соленым раствором, который создается в результате, подвергается разрушительному влиянию коррозии. Осевшая грязь выполняет роль губки, притягивая молекулы воды из воздуха.
Осевшая грязь выполняет роль губки, притягивая молекулы воды из воздуха.
Принцип анодной защиты от коррозии — это принцип некой жертвенности. Пластины, выполненные из цинка, алюминия или меди, устанавливаются в местах, где коррозионные процессы наиболее активны, и перетягивают губительный процесс окисления на себя — в данном случае корпус автомобиля является анодом. Протекторы зачастую устанавливают в зоне крепления брызговиков, на внутренних поверхностях порожков и т. Вот и прошел испытуемый год.
Катодная защита кузова авто — эффективный способ защиты авто от коррозии!
Защищать машину от ржавчины следует на протяжении всего времени ее эксплуатации. Так уж заложено в природе, что все металлические изделия подвержены агрессивному химическому воздействию окружающей среды. Сегодня поговорим о коррозии, которая быстро разрушает металл, а также о том, как эффективно ей противостоять. Для противодействия данной неприятности используются разные методы, и одним из наиболее эффективных способов считается катодная защита автотранспорта от ржавчины.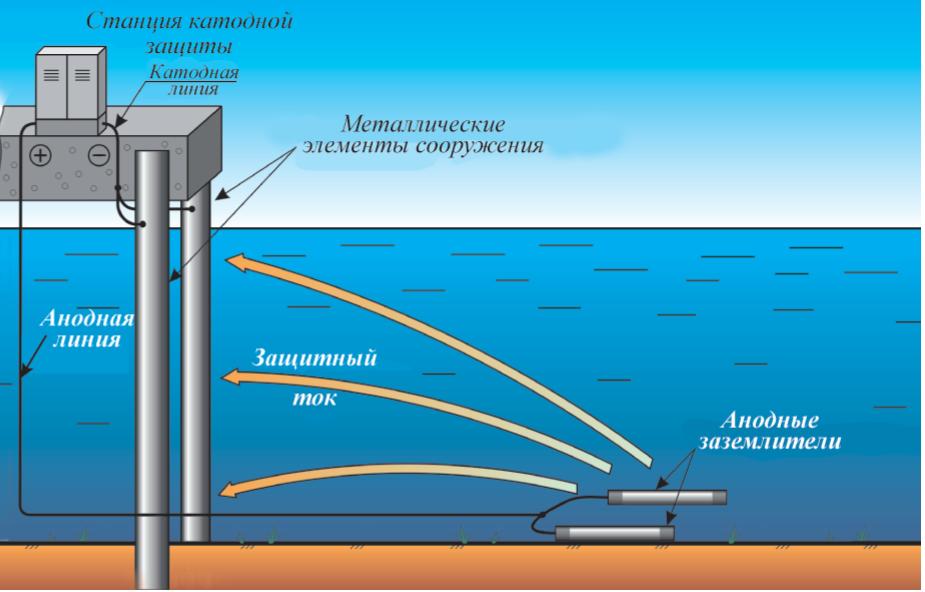
Обработка всевозможными антикоррозийными препаратами дает только временный эффект. А когда железо подвергается еще и сварочным действиям, тогда спасти ослабевший металл (на участке сварочного шва) не получится ни у одного средства. Однако есть одно исключение. Это катодная защита от коррозии.
Катодная защита авто в действии
В этой статье вы узнаете о том, что такое катодная защита кузова, на чем она базируется, а также об основных преимуществах использования такой защиты. Следует отметить, что этот вид защиты кардинально отличается от всех остальных видов антикоррозийной защиты. В сравнении с остальными вариантами (Мовилем, мастикой и т.д.), катодный вариант защиты является высокотехнологичным.
Принцип действия указанного метода базируется на разнице полей анода и катода. В частности, катодная защита кузова предусматривает применение автомобильного кузова в качестве катода. Для этого к кузову автомобиля присоединяется минусовый контакт. А в качестве анода (плюсового контакта) используется любой материал, способный проводить ток (например, обычная железная пластина).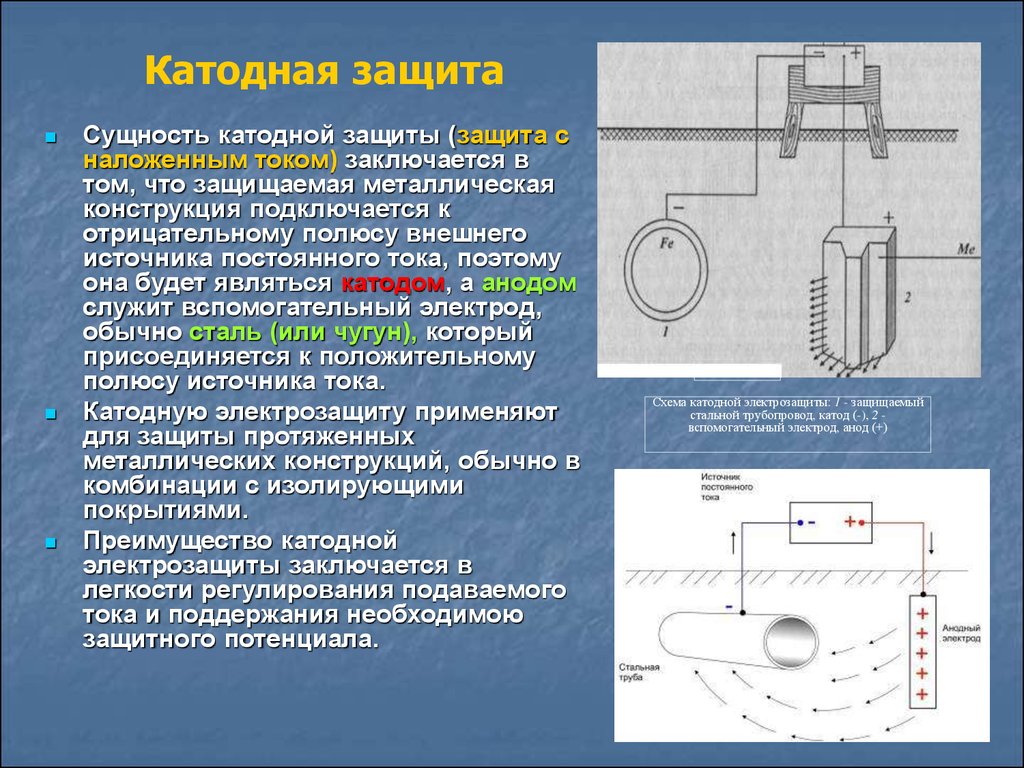 По образовавшейся цепи протекает слабый ток, что приводит к разрушению анода. При этом сам кузов машины (выступающий в роли катода) находится под защитой, и поэтому не подвергается воздействию коррозии.
По образовавшейся цепи протекает слабый ток, что приводит к разрушению анода. При этом сам кузов машины (выступающий в роли катода) находится под защитой, и поэтому не подвергается воздействию коррозии.
Как правило, в качестве источника питания применяется стандартный автомобильный аккумулятор. Благодаря тому, что по цепи идет ток низкого напряжения, есть возможность поддерживать защиту даже при очень слабом заряде АКБ.
Что можно задействовать в качестве анода?
Самым элементарным и эффективным вариантом считается такой способ, при котором в качестве анода применяется обычный железный гараж. В этом случае все очень просто. Нужно только подключиться к одной из его стенок.
Когда же автотранспорт хранится на улице, тогда самым результативным методом защиты станет применение особых резино-металлических компонентов. В народе они известны как антистатики. Кроме того, по периметру машины обязательно следует натянуть проволоку и посредством резистора подсоединить к ней авто.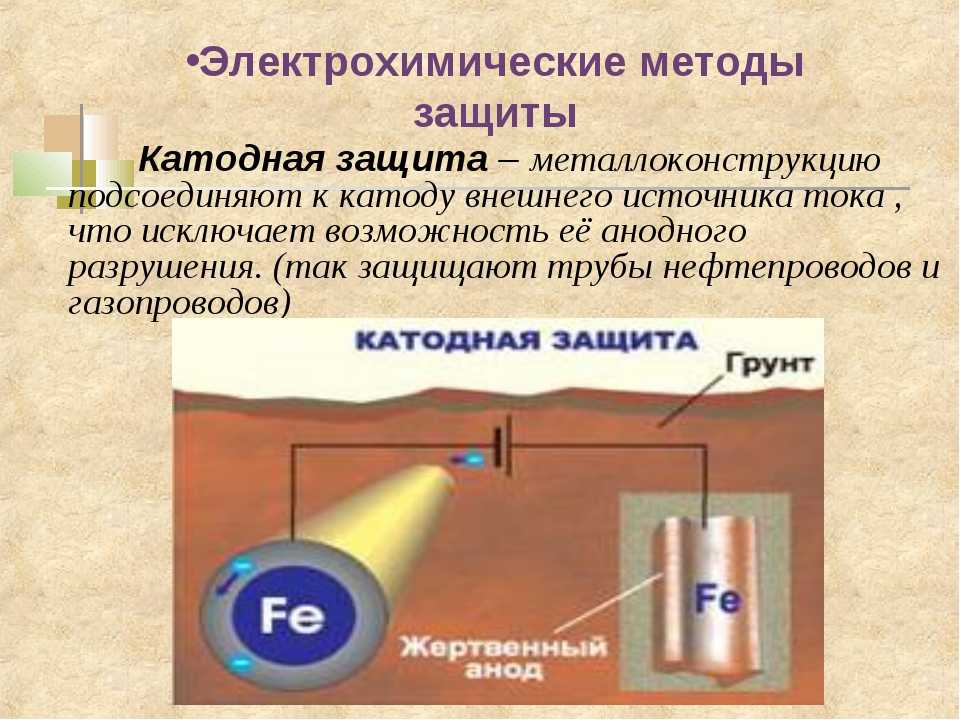 Подобный вариант гарантирует защиту днища автомобиля даже в тех случаях, когда машина хранится на улице, а не внутри гаража.
Подобный вариант гарантирует защиту днища автомобиля даже в тех случаях, когда машина хранится на улице, а не внутри гаража.
Нужно отметить и такой важный момент, что в зимний сезон года катодная защита от коррозии действует лишь при тщательной очистке машины от различных реагентов, которыми обильно посыпаются наши дороги. Когда на транспортном средстве будет слой грязи (содержащий реагенты), тогда катодная защита попросту станет бесполезной перед такой сильной химической «атакой» на ваш автомобиль.
Текст: vopros-avto.ru
Коррозия
Цель обучения
- Понять процесс коррозии.
Коррозия Гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. представляет собой гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, при воздействии воздуха ржавчина железа, потускнение серебра, а также медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной .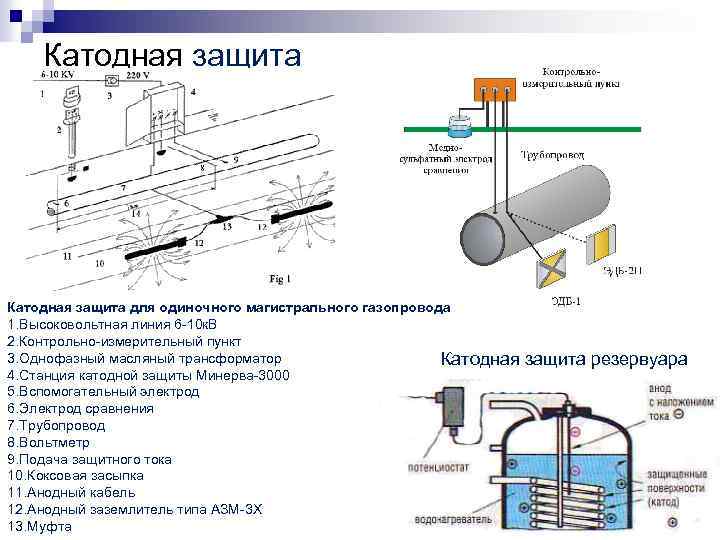 Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Обратите внимание на шаблон
Коррозия — это гальванический процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (Fe 2 O 3 · x H 2 O), известный как ржавчина , не обеспечивать плотную защитную пленку (рис. 19.17 «Ржавчина, результат коррозии металлического железа»). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой.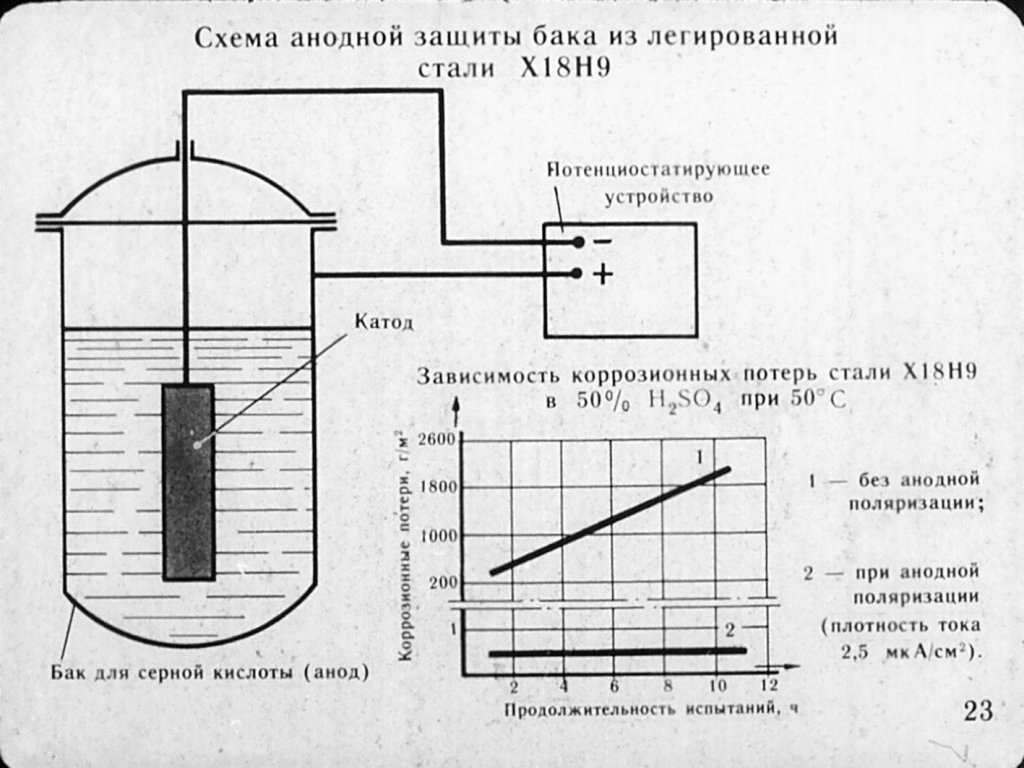 Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, насыщенное кислородом, не будет ржаветь из-за отсутствия воды.
Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, насыщенное кислородом, не будет ржаветь из-за отсутствия воды.
Рис. 19.17 Ржавчина, результат коррозии металлического железа
Железо окисляется до Fe 2+ (водн.) на анодном участке на поверхности железа, который часто является примесью или дефектом решетки. Кислород восстанавливается до воды в другом месте на поверхности железа, которое действует как катод. Электроны переходят от анода к катоду через электропроводящий металл. Вода является растворителем для Fe 2+ , который производится изначально и действует как солевой мостик. Ржавчина (Fe 2 O 3 · x H 2 O) образуется при последующем окислении Fe 2+ кислородом воздуха.
В процессе коррозии металлическое железо действует как анод в гальваническом элементе и окисляется до Fe 2+ ; кислород восстанавливается до воды на катоде. Соответствующие реакции следующие:
Уравнение 19.96
катод: O2(г)+4H+(водн.)+4e−→2h3O(ж) E°=1,23 В
Уравнение 19.97
анод: Fe(s)→ Fe2+(водн.)+2e- E°=-0,45 В
Уравнение 19.98
Суммарно: 2Fe(s) + O2(g)+4H+(aq)→2Fe2+(aq)+2h3O(l) E°=1,68 V
Ионы Fe 2+ , образующиеся в реакции затем окисляются кислородом воздуха с образованием нерастворимого гидратированного оксида, содержащего Fe 3+ , как представлено в следующем уравнении:
Уравнение 19.99
4Fe 2+ (водн.) + O 2 (г) + (2 + 4 x )H 2 O → 2Fe 2 O 3 · x H 2 O + 4H + (водн. )
)
Знак и величина E ° для процесса коррозии (уравнение 19.98) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 M H + ). В нейтральных условиях движущая сила несколько меньше, но все же заметна ( E = 1,25 В при pH 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивают достаточно низкий уровень pH для увеличения скорости реакции, как и кислотные дожди. (Для получения дополнительной информации о кислотных дождях см. главу 4 «Реакции в водном растворе», раздел 4.7 «Химия кислотных дождей».) Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с нижележащим металлом. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому разрушению (рис. 19)..18 «Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа»).
19)..18 «Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа»).
Рисунок 19.18 Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа
Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности при большем воздействии воздуха (катод), при этом металлическое железо окисляется до Fe 2+ (водн.) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2+ (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, который часто находится далеко от анода. Электрохимическое взаимодействие между катодным и анодным участками может привести к образованию большой ямки 9.0009 под окрашенная поверхность, что в конечном итоге приводит к внезапному выходу из строя с небольшим видимым предупреждением о том, что произошла коррозия.
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется.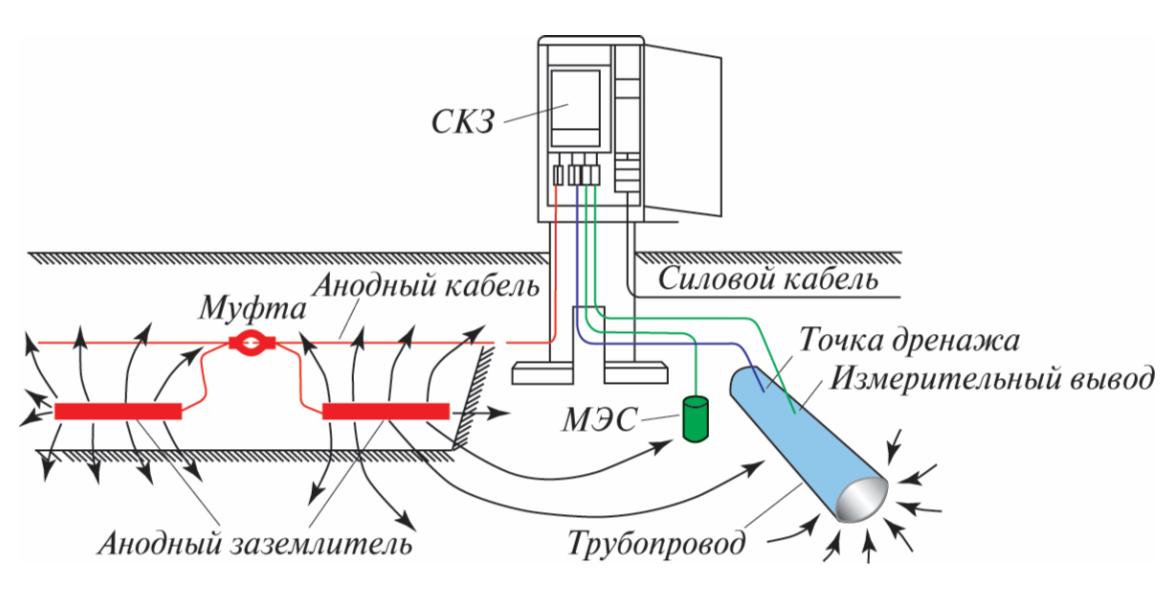 Краны и некоторые внешние детали автомобилей, например, часто покрывают тонким слоем хрома с помощью электролитического процесса, который будет обсуждаться в разделе 19.7 «Электролиз». Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле сделаны из стали, покрытой тонким слоем олова. Ни хром, ни олово сами по себе не устойчивы к коррозии, но оба образуют защитные оксидные покрытия.
Краны и некоторые внешние детали автомобилей, например, часто покрывают тонким слоем хрома с помощью электролитического процесса, который будет обсуждаться в разделе 19.7 «Электролиз». Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле сделаны из стали, покрытой тонким слоем олова. Ни хром, ни олово сами по себе не устойчивы к коррозии, но оба образуют защитные оксидные покрытия.
Как и в случае с защитной краской, царапины на защитном металлическом покрытии могут вызвать коррозию. Однако в этом случае присутствие второго металла может фактически увеличить скорость коррозии. Значения стандартных электродных потенциалов для Sn 2+ ( E ° = -0,14 В) и Fe 2+ ( E ° = -0,45 В) в таблице 19.2 «Стандартные потенциалы для выбранных полувосстановительных Реакции при 25°С показывают, что Fe окисляется легче, чем Sn. В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис. 19)..19 «Гальваническая коррозия»). Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода.
В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис. 19)..19 «Гальваническая коррозия»). Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода.
Рисунок 19.19 Гальваническая коррозия
Если железо находится в контакте с более устойчивым к коррозии металлом, таким как олово, медь или свинец, другой металл может действовать как большой катод, который значительно увеличивает скорость восстановления кислорода. Поскольку восстановление кислорода связано с окислением железа, это может привести к резкому увеличению скорости окисления железа на аноде. Гальваническая коррозия, вероятно, возникает всякий раз, когда два разнородных металла соединяются напрямую, позволяя электронам передаваться от одного к другому.
Одним из способов избежать этих проблем является использование более легко окисляемого металла для защиты железа от коррозии. В этом подходе, называемом катодной защитой , более реактивный металл, такой как Zn ( E ° = -0,76 В для Zn 2+ + 2e — → Zn), становится анодом, а железо становится катодом. Это предотвращает окисление железа и защищает железный объект от коррозии. Реакции, протекающие в этих условиях, следующие:
Уравнение 19.100
катод: O 2 (г) + 4e − + 4H + (водн.) → 2H 2 O(ж)
Уравнение 19.101
анод: Zn(тв) → Zn 2+ (водн.) + 2e −
Уравнение 19.102
в целом: 2Zn(тв) + O2(г)+4H+(водн.)→2Zn2+(водн.)+2h3O( l)
Более активный металл вступает в реакцию с кислородом и в конечном итоге растворяется, «жертвуя» собой для защиты железного предмета. Катодная защита является принципом, лежащим в основе оцинкованная сталь , которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков. В аналогичной стратегии расходуемые электроды Электрод, содержащий более реактивный металл, прикрепляется к металлическому объекту для предотвращения коррозии этого объекта. с использованием магния, например, используются для защиты подземных резервуаров или труб (рис. 19.20 «Использование расходуемого электрода для защиты от коррозии»). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Катодная защита является принципом, лежащим в основе оцинкованная сталь , которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков. В аналогичной стратегии расходуемые электроды Электрод, содержащий более реактивный металл, прикрепляется к металлическому объекту для предотвращения коррозии этого объекта. с использованием магния, например, используются для защиты подземных резервуаров или труб (рис. 19.20 «Использование расходуемого электрода для защиты от коррозии»). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Рисунок 19.20 Использование расходуемого электрода для защиты от коррозии
Соединение магниевого стержня с подземным стальным трубопроводом защищает трубопровод от коррозии. Поскольку магний ( E ° = -2,37 В) гораздо легче окисляется, чем железо ( E ° = -0,45 В), стержень Mg действует как анод в гальваническом элементе.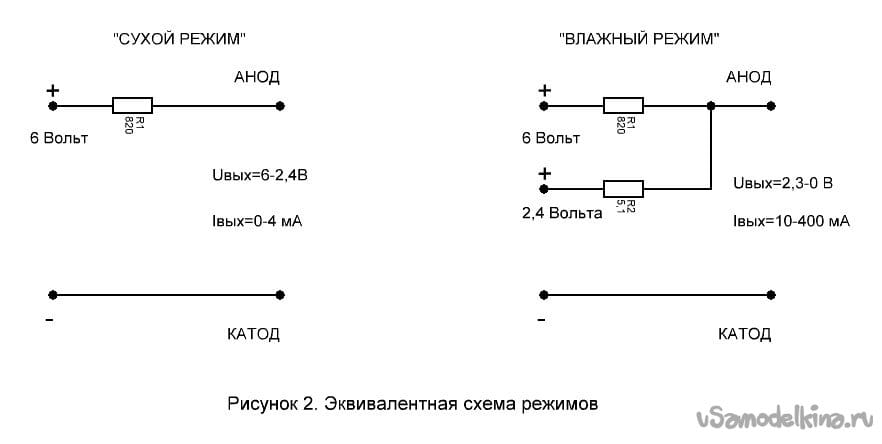 Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2+ на аноде, анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они пополняют запасы протонов, потребляемых при восстановлении кислорода. Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2+ на аноде, анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они пополняют запасы протонов, потребляемых при восстановлении кислорода. Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Пример 13
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий примерно 7–10 % олова).
- Какая реакция коррозии может возникнуть, если судно погрузить в морскую воду? Что такое E ° ячейка ?
- Как можно предотвратить появление этой коррозии?
Дано: идентификация металлов
Запрошено: коррозионная реакция, E ° ячейка и профилактические меры
Стратегия:
A Напишите реакции, протекающие на аноде и катоде. Из них напишите общую реакцию клетки и вычислите E ° ячейка .
Из них напишите общую реакцию клетки и вычислите E ° ячейка .
B Основываясь на относительной окислительно-восстановительной активности различных веществ, предложите возможные профилактические меры.
Решение:
A Согласно таблице 19.2 «Стандартные потенциалы для некоторых полуреакций восстановления при 25°С» и медь, и олово являются менее активными металлами, чем железо (т. е. имеют более высокие положительные значения Е °, чем железо). Таким образом, если олово или медь входят в электрический контакт морской воды с железом в присутствии кислорода, возникает коррозия. Поэтому мы ожидаем, что бронзовый пропеллер будет действовать как катод, на котором O 2 уменьшается, а железные винты будут выступать в роли анодов, на которых растворяется железо:
катод: O2(т)+4H+(водн.
 )+4e-→2h3O(л)Экатод°=1,23 Ванод:Fe(тв)→Fe2++2e-Еанод°=-0,45 В целом: 2Fe(т)+ O2(г )+4H+(aq)→2Fe2+(aq)+2h3O(l)Ecell°=1,68 V
)+4e-→2h3O(л)Экатод°=1,23 Ванод:Fe(тв)→Fe2++2e-Еанод°=-0,45 В целом: 2Fe(т)+ O2(г )+4H+(aq)→2Fe2+(aq)+2h3O(l)Ecell°=1,68 VСо временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке убывания затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение 19)..102).
Упражнение
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме — из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще должен делать сантехник, пока ты дома?
Ответ:
- Нет, если только вы не планируете продавать дом в ближайшее время, потому что соединения труб Cu/Fe приведут к быстрой коррозии.
- Любые существующие соединения Pb/Fe должны быть тщательно проверены на наличие коррозии железных труб из-за соединения Pb-Fe; менее активный Pb будет служить катодом для восстановления O 2 , способствуя окислению более активного поблизости Fe.
Резюме
Разрушение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией . Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл.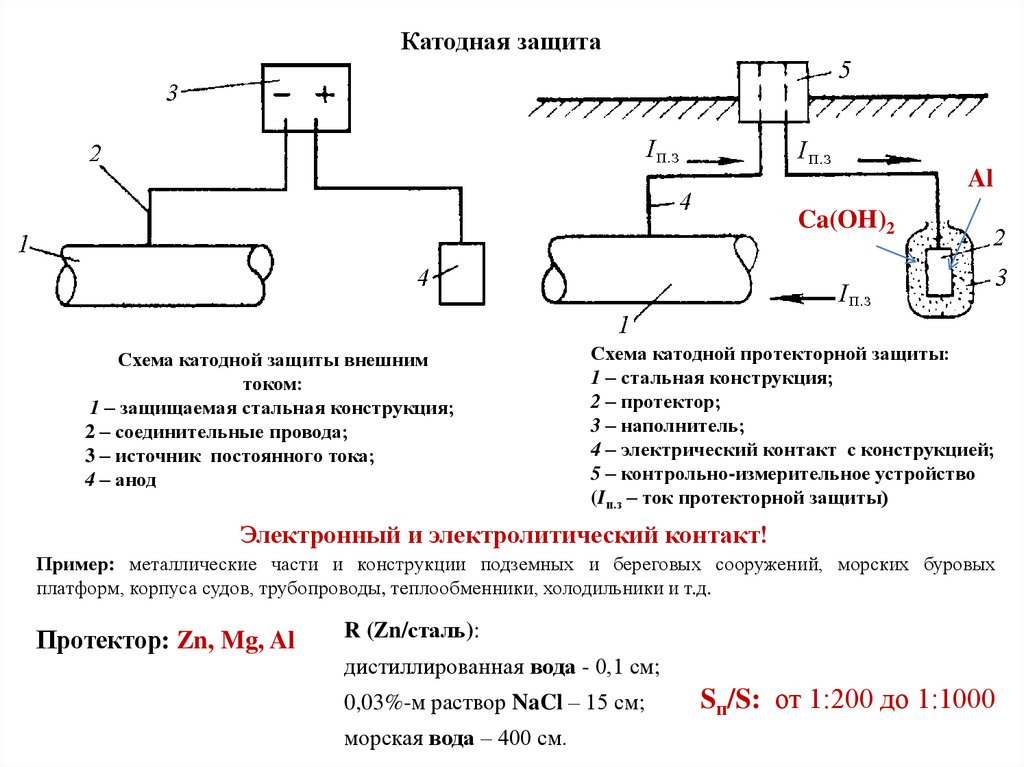 В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
Key Takeaway
- Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты.
Концептуальные проблемы
Ожидаете ли вы, что изогнутый гвоздь будет подвергаться коррозии быстрее или медленнее, чем прямой гвоздь? Почему?
Что это означает, когда металл описывается как покрытый расходуемым слоем? Отличается ли это от гальванической защиты?
Почему производителям автомобилей важно наносить краску на металлическую поверхность автомобиля? Почему этот процесс особенно важен для автомобилей в северном климате, где на обледенелых дорогах используется соль?
Ответить
- Краска
предотвращает прямой контакт кислорода и воды с металлом, что предотвращает коррозию.
 Краска более необходима, поскольку соль является электролитом, повышающим проводимость воды и облегчающим протекание электрического тока между анодным и катодным участками.
Краска более необходима, поскольку соль является электролитом, повышающим проводимость воды и облегчающим протекание электрического тока между анодным и катодным участками.
Что такое коррозия и как защититься от нее
Каждый год коррозия машин, зданий и оборудования обходится американской промышленности примерно в 7 миллиардов долларов. Коррозия является дорогостоящей проблемой. Но, поняв его первопричины, можно предпринять эффективные шаги для его предотвращения и борьбы с ним.
Существует несколько видов затрат на коррозию, которые должны учитывать заводчане:
• Прямая потеря или повреждение металлических конструкций из-за коррозии. Примером может служить резервуар для горячей воды, который подвергся коррозии и должен быть утилизирован.
• Затраты на техническое обслуживание, связанные с коррозией. В эту область попадает любая металлическая поверхность, которую необходимо красить каждые несколько лет для борьбы с коррозией.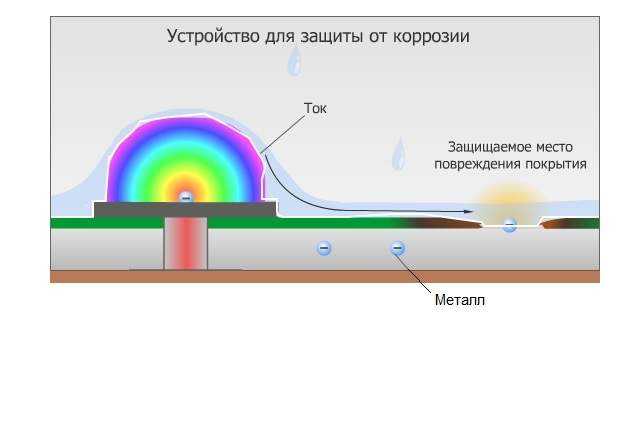
• Косвенные потери в результате коррозии. Эти потери могут быть результатом утечек и пожаров. Взрывы, связанные с утечкой, перебоями в подаче электроэнергии, остановкой оборудования и потерями рабочей силы, также косвенно являются результатом коррозии.
Первый шаг к контролю этих затрат требует понимания того, что такое коррозия и что ее вызывает.
Что такое ржавчина?
При коррозии железа или стали образуется оксид железа, или то, что мы называем ржавчиной. Сталь в основном состоит из железной руды. В своем естественном состоянии железная руда очень похожа на ржавчину: темно-красная и мелкозернистая, с тенденцией удерживать влагу.
Железная руда является стабильным веществом до тех пор, пока она не будет преобразована в железо или сталь, естественно более слабые элементы. Когда сталь подвергается воздействию влаги и кислорода, она сразу же начинает возвращаться к своему естественному состоянию. Несмотря на принятые защитные меры, большая часть стали, произведенной в этом столетии, уже проржавела до состояния оксида, своего естественного состояния.
Для существования коррозии необходимы три элемента: защищенный металл, корродированный металл и проводящая ток среда между ними. Когда два разнородных металла соприкасаются, один из них становится защищенным металлом, а другой корродирующим. Операторы установки могут распознавать условия окружающей среды, способствующие коррозии.
Например:
• Если на стальной трубе используются оцинкованные фитинги, оцинкованные (цинковые) фитинги подвергаются коррозии, а сталь остается защищенной.
• Сталь или другие металлы под нагрузкой подвергаются коррозии, в то время как ненагруженная сталь защищена от коррозии. Вот почему вы видите ржавчину на стали.
• Свежеобрезанная сталь быстрее подвергается коррозии. Резьба, нарезанная на трубе, всегда ржавеет первой.
Даже если кусок стали не соприкасается с другим металлом, ни под нагрузкой, ни в свежем состоянии, он будет ржаветь под воздействием погодных условий. Это связано с тем, что сталь не совсем однородна по составу — небольшие различия в плотности и составе могут возникать в пределах одного куска стали, что приводит к коррозии.
Третьим компонентом, необходимым для коррозии стали, является электролит. Обычно это жидкость или водосодержащее вещество, которое проводит ток коррозии от защищаемого металла к корродированному металлу. Наиболее распространенным токопроводящим веществом является вода. Дождь, роса, влажность воздуха и т. д. — все это служит эффективными электрическими проводниками. Сталь очень медленно подвергается коррозии в пустынном климате, где влажность низкая, а осадки редки. В районах с высокой влажностью и частыми дождями защита стали имеет решающее значение. Операторы установок узнают некоторые из следующих сред, в которых электрический ток ускоряет процесс коррозии:
• Добавление соли в воду значительно повышает ее способность проводить ток. Таким образом, сталь, подвергающаяся воздействию морской воды или соляного тумана, будет корродировать быстрее, чем сталь в пресной воде. Атмосферная коррозия больше проявляется в районах вблизи океанов из-за воздействия соленого воздуха. Концентрированные солевые растворы, например, используемые в пищевой промышленности, вызывают сильную коррозию.
Концентрированные солевые растворы, например, используемые в пищевой промышленности, вызывают сильную коррозию.
• Промышленные дымы и пары содержат кислоты, щелочи и другие химические вещества, которые служат проводниками тока. Следовательно, атмосферная коррозия в промышленных районах более выражена, чем в сельской местности.
• Почва, глина и земляные материалы также являются хорошими проводниками электричества. Трубопроводы и другая сталь, зарытая в землю, будут подвержены коррозии, если не будут защищены. Так же, как почвы значительно различаются по составу, они также различаются по своей электропроводности: одни почвы вызывают более сильную коррозию, чем другие.
Защита от коррозии
Чтобы сделать использование стали и других металлов практичным в строительстве и производстве, необходимо применять некоторые методы защиты от коррозии. В противном случае срок службы стали и других металлов будет ограничен, что приведет к снижению эффективности и увеличению стоимости обслуживания.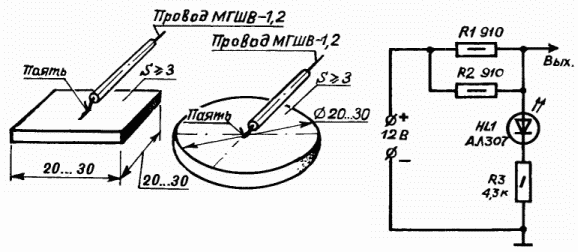 Существует несколько эффективных способов остановить коррозию:
Существует несколько эффективных способов остановить коррозию:
1. Впечатанный ток. С помощью подходящего токогенерирующего оборудования и средств управления можно воспроизвести ток, равный по силе корродирующему току, но протекающий в противоположном направлении. Этот тип защиты обычно ограничивается трубопроводами, заглубленными резервуарами и т. д. и требует тщательного проектирования и компоновки. При неправильном использовании подаваемый ток может способствовать коррозии.
2. Жертвенные металлы. Сталь можно защитить, поместив рядом с разнородным металлом. Например, если цинк или магний находятся в непосредственном контакте со сталью, они защищают сталь от коррозии. Здесь цинк и магний служат жертвенными металлами, которые не только защищают область непосредственного контакта, но и защищают за пределами металла в каждом направлении. Защита от ржавчины жертвенными металлами обычно используется в нескольких формах:
• Цинковые или магниевые блоки часто используются для защиты корпусов кораблей, внутренней части резервуаров для воды и других подводных поверхностей.
• Часто выполняется полное покрытие стали защитным металлом. Оцинкованная сталь, например, это сталь, покрытая цинком. Цинк является жертвенным и защитит базовую сталь.
• Покрытия с высоким содержанием цинка могут быть нанесены на стальную поверхность для обеспечения катодной защиты. Покрытия с высоким содержанием цинка состоят из 85-95% металлического цинка в подходящем связующем. Частицы цинка, нанесенные при окраске, защищают сталь.
3. Грунтовки. Грунтовки и готовые покрытия защищают металлические поверхности, создавая барьер между сталью и корродирующими элементами. Они также предотвращают попадание влаги на поверхность стали. Покрывающая пленка защищает нижележащие металлические подложки тремя способами:
• Покрытия могут замедлять скорость диффузии воды и кислорода из окружающей среды к поверхности металла. Это замедляет процесс коррозии.
• Пленка краски может замедлить скорость диффузии продуктов коррозии с поверхности металла через пленку краски.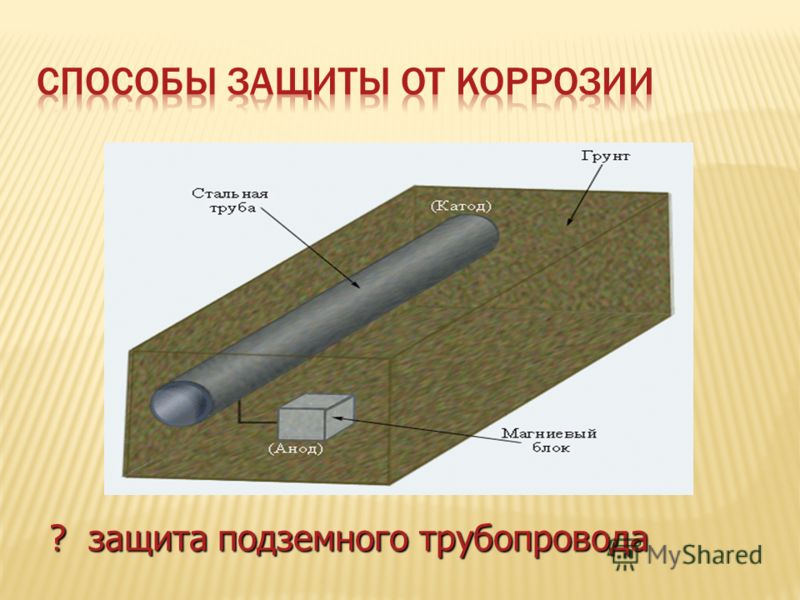 Это также замедляет процесс коррозии.
Это также замедляет процесс коррозии.
• Антикоррозионные пигменты, содержащиеся в качественных грунтовках, изменяют поверхностные свойства основного металла. В результате металл приобретает высокое электрическое сопротивление. Различные пигменты осуществляют эту реакцию по-разному. Грунтовки поглощают и связывают влагу, чтобы она не вступала в реакцию со сталью.
Как выбрать антикоррозионное покрытие
Принимая во внимание следующие критерии, можно определить наиболее эффективный тип антикоррозионного покрытия, необходимого для конкретного проекта.
Качество покрытия/нанесение — Какой уровень антикоррозионной краски необходим? Насколько важно, чтобы краска была устойчивой к выцветанию и/или истиранию? Как часто вы планируете перекрашивать? Есть ли предпочтение нанесения: кисть/валик или распыление?
Эстетика — Какие материалы будут покрыты? Насколько важно, чтобы лакокрасочное покрытие выглядело привлекательно? Важно ли сохранение цвета?
Цена — Как правило, более качественная краска увеличивает цену. Учитываются ли заявки на подкраску при оценке затрат на техническое обслуживание? Какова стоимость выбранной краски? Как часто его нужно будет перекрашивать?
Учитываются ли заявки на подкраску при оценке затрат на техническое обслуживание? Какова стоимость выбранной краски? Как часто его нужно будет перекрашивать?
Экологические нормы — Каковы местные экологические нормы для красок и покрытий? Соответствует ли краска этим стандартам? Как процесс покраски повлияет на окружающую среду? С июня 2002 года правительство США введет в действие правила, направленные на снижение количества загрязняющих веществ в краске для повышения защиты окружающей среды. Новые пределы содержания летучих органических соединений (ЛОС) упадут до 450 граммов на литр краски. В Калифорнии, Аризоне, Нью-Йорке и Нью-Джерси последуют более жесткие ограничения, сводящие к минимуму объемы твердых веществ до уровня 340 граммов на литр.
Покрытия
Существует три основных типа покрытий, используемых при ремонтной окраске. В зависимости от качества, цены, применения и эстетических требований операторы установки могут выбрать подходящее покрытие из следующих:
• Алкидные эмали — Алкидные эмали предназначены для внутренних и наружных поверхностей в умеренных и тяжелых условиях. Это покрытие обеспечивает надежную коррозионную стойкость на срок до 3-5 лет. Алкидные эмали обеспечивают глянцевый цвет, устойчивы к выцветанию, могут наноситься кистью, валиком или распылителем. • Эпоксидные покрытия — Эпоксидные покрытия используются для внутренних или наружных поверхностей в промышленных условиях, где сохранение цвета и блеск не важны. Качество покрытия будет лучше, чем у алкидной эмали, так как оно выдерживает суровые промышленные условия. Эпоксидные покрытия лучше всего наносить распылением, но также можно использовать кисти и валики.
Это покрытие обеспечивает надежную коррозионную стойкость на срок до 3-5 лет. Алкидные эмали обеспечивают глянцевый цвет, устойчивы к выцветанию, могут наноситься кистью, валиком или распылителем. • Эпоксидные покрытия — Эпоксидные покрытия используются для внутренних или наружных поверхностей в промышленных условиях, где сохранение цвета и блеск не важны. Качество покрытия будет лучше, чем у алкидной эмали, так как оно выдерживает суровые промышленные условия. Эпоксидные покрытия лучше всего наносить распылением, но также можно использовать кисти и валики.
• Полиуретановые покрытия — Полиуретановое покрытие является краской самого высокого качества из всех трех вариантов. Он выдерживает самые суровые условия и может прослужить до 10 лет. Он обеспечивает сильное сохранение цвета и блеска и устойчив к истиранию. Полиуретановые покрытия наносятся методом напыления.
Заключение
Краски работают, потому что они замедляют коррозию, уменьшая скорость тока в процессе электрохимической коррозии.

 Спасет и трактор, и автомобиль
Спасет и трактор, и автомобиль