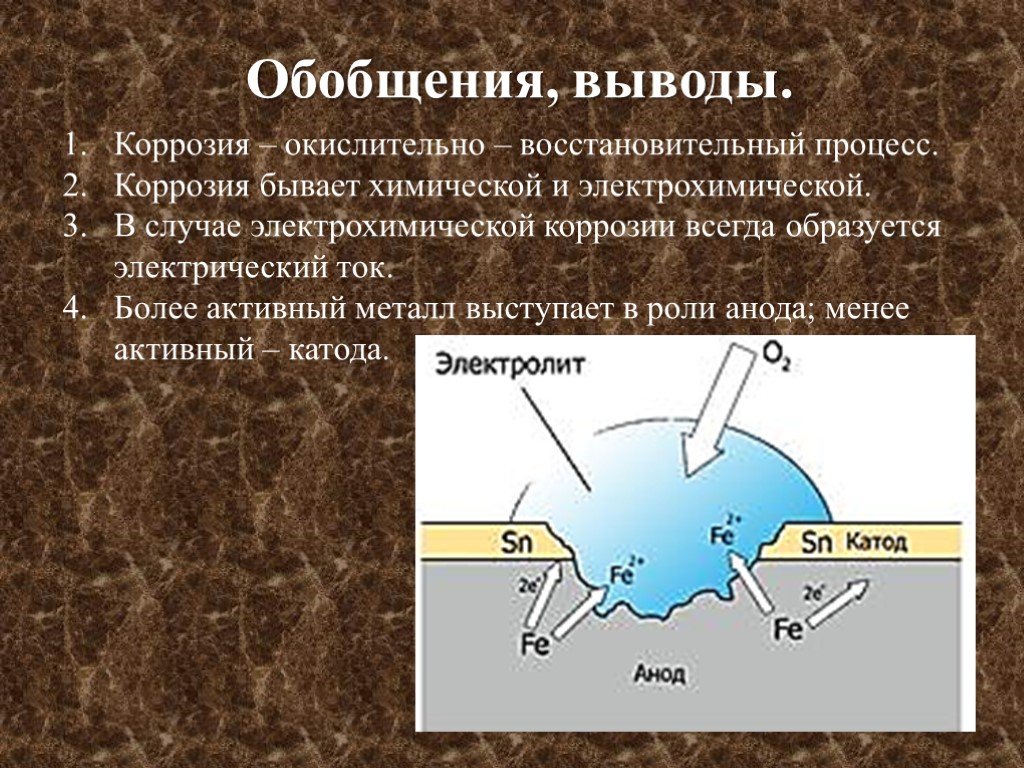
Коррозия электрохимическая и химическая: Химическая коррозия
Содержание
Электрохимическая и химическая коррозия
1.Электрохимическая
коррозия
Разрушение металла
под воздействием возникающих в
коррозионной среде гальванических
элементов называют электрохимической
коррозией. Не следует путать с электрохимической
коррозией коррозию однородного
материала, например, ржавление железа
или т. п. При электрохимической
коррозии (наиболее частая форма коррозии)
всегда требуется наличие электролита
(Конденсат, дождевая вода и т. д.), с
которым соприкасаются
— либо различные элементы структуры
материала, либо два различных соприкасающихся
материала с различающимися окислительно-
потенциалами. Если в воде растворены
ионы солей, кислот, или т. п., электропроводность
её повышается, и скорость процесса
увеличивается.
При соприкосновении
двух металлов с различными окислительно-
потенциалами и погружении их в раствор
электролита, например, дождевой воды
с растворенным углекислым газом CO2,
образуется гальванический элемент, так
называемый коррозионный элемент. Он представляет
Он представляет
собой не что иное, как замкнутую
гальваническую ячейку. В ней происходит
медленное растворение
материала с более низким окислительно-
потенциалом; второй электрод в паре,
как правило, не корродирует. Этот вид
коррозии особо присущ металлам с высокими
отрицательными потенциалами. Так, совсем
небольшого количества примеси на поверхности
металла с большим редокспотенциалом
уже достаточно для возникновения коррозионного
элемента. Особо подвержены риску места
соприкосновения металлов с различными
потенциалами, например, сварочные швы
или заклёпки.
Если растворяющийся
электрод коррозионно-стоек, процесс коррозии
замедляется. На этом основана, например,
защита железных изделий от коррозии путём
оцинковки — цинк имеет более отрицательный
потенциал, чем железо, поэтому в такой
паре железо восстанавливается, а цинк
должен корродировать. Однако в связи
с образованием на поверхности цинка оксидной
плёнки процесс коррозии сильно замедляется.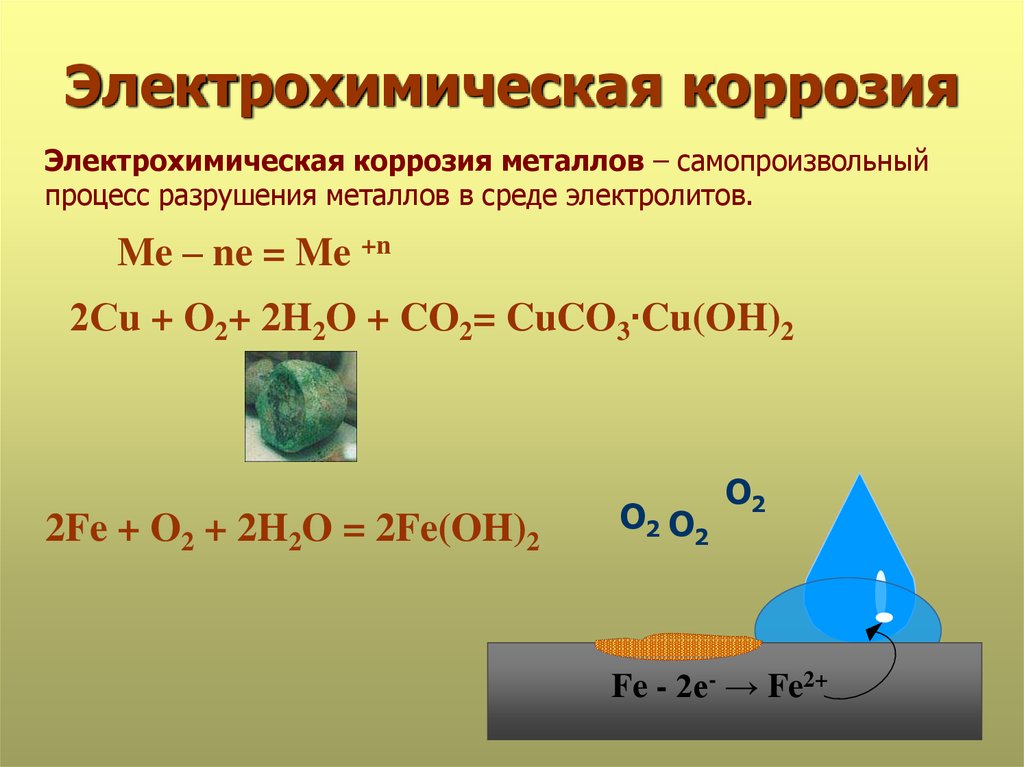
Химическая
коррозия
Химическая коррозия
— взаимодействие поверхности металла
с коррозионно-активной средой, не сопровождающееся
возникновением электрохимических
процессов на границе фаз. В этом
случае взаимодействия окисление металла
и восстановление окислительного компонента
коррозионной среды протекают в
одном акте. Например, образование
окалины при взаимодействии материалов
на основе железа при высокой температуре
с кислородом:
4Fe + 3O2 → 2Fe2O3
При электрохимической
коррозии ионизация атомов металла и восстановление
окислительного компонента коррозионной
среды протекают не в одном акте и их скорости
зависят от электродного потенциала металла
(например, ржавление стали в морской воде).
2.
Поляризация электродных
процессов.
В большинстве
случаев электрохимической
металлов основными
ее явлениями является поляризация.
Явление поляризации
проявляется в смещении значений
равновесных (обратимых) электродных
потенциалов электродов коррозионного
гальванического
элемента. Измерение потенциалов
Измерение потенциалов
показывает, что потенциал анода
становится более положительным
а потенциал катода — более отрицательным:
jа’ = jа + Djа,
(7.10)
jk’ = jk + Djk,
(7.11) где jа’, jk’- эффективные электродные
потенциалы;
Явление поляризации
– следствие отставания электродных
процессов (анодного и катодного) от
перетока электронов с анодных на катодные
участки.
Причины
анодной поляризации.
Причины анодной
поляризации состоят в
а) торможение анодной
электрохимической реакции, приводящее
к возникновению
поляризации, называемой перенапряжением
ионизации металла (Djа)э.х.;
б) торможение транспорта
ионов металла от его поверхности
объем раствора, приводящая к возникновению
концентрационной поляризации (Djа)конц;
в) переход металла
в пассивное состояние(Djа)п.
Таким образом, результирующее
смещение электродного потенциала представляет
собой следующую сумму:
Djа
= (Djа)э.х.+ (Djа)конц + (Djа)п,
(7.12) причем слагаемое (Djа)п оказывает
решающее влияние на величину Djа.
3. Морская
коррозия металлов
Портовые сооружения,
причалы, суда, оборудование морских
нефтепроводов подвержены воздействию
морской коррозии.
Присутствие в
морской воде ионов хлора, т.е.
ионов-активаторов, делает эту
среду высоко коррозионно-
Соленость морской
воды определяют в промиллях (%о). Промил-лей
называется количество твердых веществ
в граммах, растворенное в 1000 г морской
воды, при условии, что все галогены заменены
эквивалентным количеством хлора, все
карбонаты переведены в оксиды, органические
вещества сожжены. В этом случае 1%о = = 0,1
мае.%. Средняя соленость воды в океане
3-3,5 %о. Но она значительно колеблется в
различных водных бассейнах.
В морской воде содержится
большое количество микроорганизмов,
способствующих ускорению коррозии
и обрастанию соприкасающихся с
водой металлоконструкций.
Cl препятствует
образованию пассивных пленок на поверхности
металлов. Высокая электропроводность
исключает проявление омического торможения.
Увеличение скорости
потока ведет к усилению коррозии
вследствие улучшения аэрации поверхности
металла. Кроме того, высокие скорости
потока способствуют эрозионному разрушению
металла.
Повышенное содержание
кислорода в поверхностных
воды вызывает усиленную коррозию в
области ватерлинии судов, на участках
гидросооружений, находящихся близко
к поверхности или периодически
омываемых водой (рис. 6.6).
Для защиты судовых
конструкций чаще всего используют
алюминий с легирующими добавками,
например, цинком или лантаном. Алюминиевые
покрытия в сочетании с лакокрасочными
покрытиями обладают высокой стойкостью
в морской воде, имеют повышенную
стойкость к эрозии.
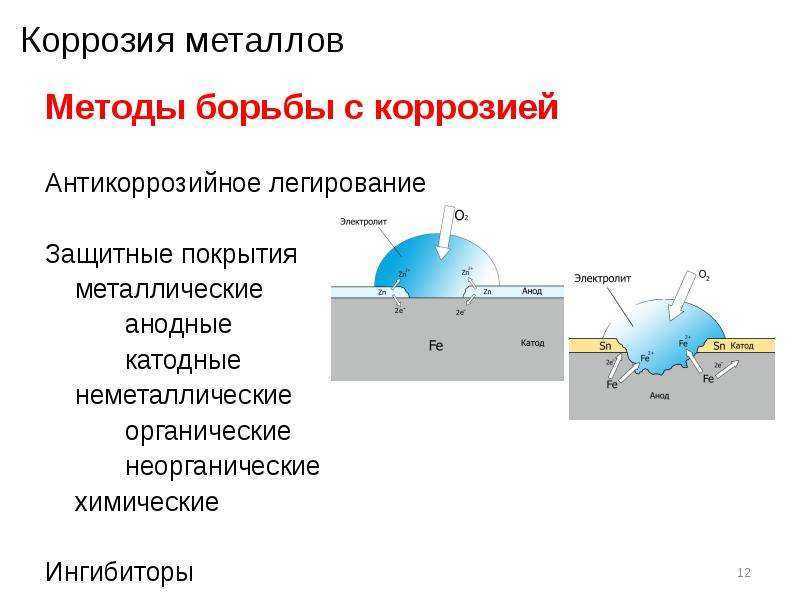
Для борьбы с морской
коррозией широко используют электрохимическую
защиту (ГОСТ 26301-85 и ГОСТ 26251-84). Защита
подводной части
судов осуществляют автоматическими
системами катодной защиты.
4.
Сероводородная коррозия
Сероводород H2S
является агрессивным газом, провоцирующим
кислотную коррозию, которую в этом случае
называют сероводородной коррозией. Растворяясь
в воде, он образует слабую кислоту, которая
может вызвать точечную коррозию в присутствии
кислорода или диоксида углерода.
Сероводород реагирует
почти со всеми металлами, образуя
сульфиды, которые по отношению к
железу играют роль катода и образуют
с ним гальваническую пару. Разность
потенциалов этой пары достигает 0,2–0,48
В. Способность сульфидов к
микрогальванических пар со сталью
приводит к быстрому разрушению технологического
оборудования и трубопроводов.
Бороться с сероводородной
коррозией чрезвычайно трудно: несмотря
на добавки ингибиторов кислотной
коррозии, трубы из специальных марок
нержавеющей стали быстро выходят
из строя. И даже полученную из сероводорода
И даже полученную из сероводорода
серу перевозить в металлических
цистернах можно в течение
ограниченного срока, поскольку
цистерны преждевременно разрушаются
из-за растворенного в сере сероводорода.
При этом происходит образование
полисульфанов HSnH, которые более коррозионно-активны,
чем сероводород.
Сероводород, присоединяясь
к непредельным соединениям, образует
меркаптаны, которые являются агрессивной
и токсичной частью сернистых
соединений — химическими ядами.
Именно они значительно ухудшают
свойства катализаторов: их термическую
стабильность, интенсифицируют процессы
смолообразования, выпадения и отложения
шлаков, шлама, осадков, что вызывает
пассивацию поверхности катализаторов,
а также усиливают коррозийную
активность материала технологических
аппаратов.
1.Электрохимическая
коррозия
Разрушение металла
под воздействием возникающих в
коррозионной среде гальванических
элементов называют электрохимической
коррозией. Не следует путать с электрохимической
коррозией коррозию однородного
материала, например, ржавление железа
или т. п. При электрохимической
п. При электрохимической
коррозии (наиболее частая форма коррозии)
всегда требуется наличие электролита
(Конденсат, дождевая вода и т. д.), с
которым соприкасаются
— либо различные элементы структуры
материала, либо два различных соприкасающихся
материала с различающимися окислительно-
потенциалами. Если в воде растворены
ионы солей, кислот, или т. п., электропроводность
её повышается, и скорость процесса
увеличивается.
При соприкосновении
двух металлов с различными окислительно-
потенциалами и погружении их в раствор
электролита, например, дождевой воды
с растворенным углекислым газом CO2,
образуется гальванический элемент, так
называемый коррозионный элемент. Он представляет
собой не что иное, как замкнутую
гальваническую ячейку. В ней происходит
медленное растворение
материала с более низким окислительно-
потенциалом; второй электрод в паре,
как правило, не корродирует. Этот вид
Этот вид
коррозии особо присущ металлам с высокими
отрицательными потенциалами. Так, совсем
небольшого количества примеси на поверхности
металла с большим редокспотенциалом
уже достаточно для возникновения коррозионного
элемента. Особо подвержены риску места
соприкосновения металлов с различными
потенциалами, например, сварочные швы
или заклёпки.
Если растворяющийся
электрод коррозионно-стоек, процесс коррозии
замедляется. На этом основана, например,
защита железных изделий от коррозии путём
оцинковки — цинк имеет более отрицательный
потенциал, чем железо, поэтому в такой
паре железо восстанавливается, а цинк
должен корродировать. Однако в связи
с образованием на поверхности цинка оксидной
плёнки процесс коррозии сильно замедляется.
Химическая
коррозия
Химическая коррозия
— взаимодействие поверхности металла
с коррозионно-активной средой, не сопровождающееся
возникновением электрохимических
процессов на границе фаз. В этом
В этом
случае взаимодействия окисление металла
и восстановление окислительного компонента
коррозионной среды протекают в
одном акте. Например, образование
окалины при взаимодействии материалов
на основе железа при высокой температуре
с кислородом:
4Fe + 3O2 → 2Fe2O3
При электрохимической
коррозии ионизация атомов металла и восстановление
окислительного компонента коррозионной
среды протекают не в одном акте и их скорости
зависят от электродного потенциала металла
(например, ржавление стали в морской воде).
2.
Поляризация электродных
процессов.
В большинстве
случаев электрохимической
металлов основными
ее явлениями является поляризация.
Явление поляризации
проявляется в смещении значений
равновесных (обратимых) электродных
потенциалов электродов коррозионного
гальванического
элемента. Измерение потенциалов
показывает, что потенциал анода
становится более положительным
а потенциал катода — более отрицательным:
jа’ = jа + Djа,
(7. 10)
10)
jk’ = jk + Djk,
(7.11) где jа’, jk’- эффективные электродные
потенциалы;
Явление поляризации
– следствие отставания электродных
процессов (анодного и катодного) от
перетока электронов с анодных на катодные
участки.
Причины
анодной поляризации.
Причины анодной
поляризации состоят в
а) торможение анодной
электрохимической реакции, приводящее
к возникновению
поляризации, называемой перенапряжением
ионизации металла (Djа)э.х.;
б) торможение транспорта
ионов металла от его поверхности
объем раствора, приводящая к возникновению
концентрационной поляризации (Djа)конц;
в) переход металла
в пассивное состояние(Djа)п.
Таким образом, результирующее
смещение электродного потенциала представляет
собой следующую сумму:
Djа
= (Djа)э.х.+ (Djа)конц + (Djа)п,
(7. 12) причем слагаемое (Djа)п оказывает
12) причем слагаемое (Djа)п оказывает
решающее влияние на величину Djа.
Белорусский государственный университет транспорта — БелГУТ (БИИЖТ)
Как поступить в БелГУТ
Как получить место
в общежитии БелГУТа
Как поступить иностранному гражданину
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 | 2 | 3 | 4 | 5 Дата : 2022-11-05 | 6 Дата : 2022-11-06 | |
7 | 8 | 9 | 10 | 11 | 12 Дата : 2022-11-12 | 13 |
14 | 15 | 16 Дата : 2022-11-16 | 17 | 18 | 19 Дата : 2022-11-19 | 20 |
21 | 22 | 23 | 24 | 25 | 26 Дата : 2022-11-26 | 27 |
28 | 29 | 30 | ||||
Все анонсы
- Заседание совета университета.
 ..
.. - Олимпиада по технологии очистки сточных вод…
- С Днем Октябрьской революции!…
- Региональный научно-исторический семинар «Гомельщи…
- 12 ноября — ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ ЭЛЕКТРОТЕХНИЧЕСКО…
- Онлайн турнир по Dota 2
- Конференция «Молодежь. Образование. Общество»…
- Билеты на фестиваль по бальным танцам «GOMEL OPEN»…
- I международная научно-техническая конференция сту…
- 29 октября — ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ ФАКУЛЬТЕТА ПГС…
Анонсы
Университет
Абитуриентам
Студентам
Конференции
Приглашения
Заседание совета университета…
Олимпиада по технологии очистки сточных вод…
С Днем Октябрьской революции!…
Региональный научно-исторический семинар «Гомельщи…
Новости
Университет
Международные связи
Спорт
Воспитательная работа
Жизнь студентов
Новости подразделений
Университет
Серьёзный разговор «Пожарная безопасность и правила поведения в чрезвы. ..
..
08 ноября 2022
Спорт
Победа боксёров БелГУТа!
07 ноября 2022
Университет
На митинге, посвященном 105-й годовщине Великой Октябрьской революции…
07 ноября 2022
Студенческая жизнь
Волонтеры Студенческого совета БелГУТа – участники проекта «Волонтерск…
06 ноября 2022
Университет
Курсы повышения квалификации для инженерно-технических работников дист…
05 ноября 2022
Воспитательная работа
Наведение порядка на мемориале «Партизанская криничка»…
04 ноября 2022
Университет
Победа в Республиканской блиц-олимпиаде. ..
..
04 ноября 2022
Университет
Университетский конкурс на лучшее знание английского языка…
04 ноября 2022
Университет
Повышение квалификации по теме «Основы проектирования баз данных и SQL…
04 ноября 2022
Другие новости
- Визит в Туркменистан — расширение сотрудничества с железными дорогами …
- Встреча с участковым инспектором ИДН ОВД по профилактике преступлений,…
- Дискуссионная площадка с представителями Лиги коммунистической молодеж…
- Новый номер газеты «Вести БелГУТа»
- Победы наших футболистов!
- Обсуждение законопроекта о Всебелорусском народном собрании подходит к…
- Поздравляем с присвоением ученого звания доцента…
- Активисты БРСМ БелГУТа на встрече с Валентином Ивановичем Чепеловым.
 ..
.. - Экскурсия для будущих архитекторов
- Визит в Узбекистан заведующего кафедрой «Техническая физика и теоретич…
- «Молодежь — за урожай». На повестке дня – морковь…
КУДА ПОСТУПАТЬ
Все факультеты
БелГУТ на Доске почета
Достижения университета
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
Коррозия и другие электрохимические аспекты биоматериалов
Обзор
. 1994;22(3-4):139-251.
Кей Джей Банди
1
принадлежность
- 1 Факультет биомедицинской инженерии, Тулейнский университет, Новый Орлеан, LA 70118, США.
PMID:
8598129
Обзор
Кей Джей Банди.
Crit Rev Biomed Eng.
1994.
. 1994;22(3-4):139-251.
Автор
Кей Джей Банди
1
принадлежность
- 1 Факультет биомедицинской инженерии, Тулейнский университет, Новый Орлеан, LA 70118, США.
PMID:
8598129
Абстрактный
Металлические материалы широко используются в качестве ортопедических имплантатов, стоматологических материалов, чувствительных элементов биоэлектродов и других приложений. Электрохимическое поведение этих биоматериалов представляет интерес по целому ряду причин. Коррозионная стойкость материала имплантата влияет на его функциональные характеристики и долговечность и является основным фактором, определяющим биосовместимость. К числу аспектов, влияющих на биосовместимость, относятся количество и формы высвобождаемых продуктов коррозии и их расположение в организме после высвобождения. Принципы электрохимии очень полезны для понимания факторов, влияющих на коррозионную стойкость, а также служат основой для многих биосенсоров, измеряющих концентрацию различных химических соединений (включая выделяемые продукты коррозии и встречающиеся в природе вещества). Многие методы электрохимических измерений использовались для изучения биоматериалов в течение многих лет (например, измерение кривой поляризации), в то время как другие (например, методы полярографии и импеданса переменного тока) стали применяться совсем недавно. Данная работа посвящена четырем основным темам. Во-первых, это природа окружающей среды тела, поскольку она влияет на электрохимические явления in vivo, то есть на химические, механические, биологические и биоэлектрические явления, которые влияют на поведение и характеристики биоматериалов.
Коррозионная стойкость материала имплантата влияет на его функциональные характеристики и долговечность и является основным фактором, определяющим биосовместимость. К числу аспектов, влияющих на биосовместимость, относятся количество и формы высвобождаемых продуктов коррозии и их расположение в организме после высвобождения. Принципы электрохимии очень полезны для понимания факторов, влияющих на коррозионную стойкость, а также служат основой для многих биосенсоров, измеряющих концентрацию различных химических соединений (включая выделяемые продукты коррозии и встречающиеся в природе вещества). Многие методы электрохимических измерений использовались для изучения биоматериалов в течение многих лет (например, измерение кривой поляризации), в то время как другие (например, методы полярографии и импеданса переменного тока) стали применяться совсем недавно. Данная работа посвящена четырем основным темам. Во-первых, это природа окружающей среды тела, поскольку она влияет на электрохимические явления in vivo, то есть на химические, механические, биологические и биоэлектрические явления, которые влияют на поведение и характеристики биоматериалов. Второй касается методологии — методов, используемых для измерения коррозии и определения концентрации, соответствующей среды (лаборатория, клеточная культура, in vivo и т. д.) и возникающих экспериментальных проблем. Третьей рассматриваемой темой являются накопленные знания о характеристиках сплавов имплантатов в различных областях применения, например, о формах коррозии, которым они подвержены, и т. д. Наконец, усовершенствования, которые могут произойти в будущем в отношении как материалов, так и методологии испытаний считается.
Второй касается методологии — методов, используемых для измерения коррозии и определения концентрации, соответствующей среды (лаборатория, клеточная культура, in vivo и т. д.) и возникающих экспериментальных проблем. Третьей рассматриваемой темой являются накопленные знания о характеристиках сплавов имплантатов в различных областях применения, например, о формах коррозии, которым они подвержены, и т. д. Наконец, усовершенствования, которые могут произойти в будущем в отношении как материалов, так и методологии испытаний считается.
Похожие статьи
Оптимизация биоматериала при тотальном эндопротезировании диска.
Hallab N, Link HD, McAfee PC.
Халлаб Н. и др.
Позвоночник (Фила Па, 1976). 2003 г., 15 октября; 28 (20): S139-52. doi: 10.1097/01.BRS.0000092214.87225.80.
Позвоночник (Фила Па, 1976). 2003.PMID: 14560185
Коррозионное поведение сплава Ti-15Mo для зубных имплантатов.

Кумар С., Нараянан Т.С.
Кумар С. и др.
Джей Дент. 2008 июль; 36 (7): 500-7. doi: 10.1016/j.jdent.2008.03.007. Epub 2008 12 мая.
Джей Дент. 2008.PMID: 18468762
Электрохимическая стабильность и коррозионная стойкость сплавов Ti-Mo для биомедицинских применений.
Оливейра NT, Гуастальди AC.
Оливейра Н.Т. и соавт.
Акта Биоматер. 2009 Январь; 5 (1): 399-405. doi: 10.1016/j.actbio.2008.07.010. Epub 2008 25 июля.
Акта Биоматер. 2009 г..PMID: 18707926
Биоповреждение и коррозия металлических имплантатов и протезов.
Лопес Г.Д.
Лопес ГД.
Медицина (B Aires). 1993;53(3):260-74.
Медицина (B Aires). 1993.PMID: 8114635
Обзор.
Испанский.Проблема коррозии зубных имплантатов: обзор.

Олмедо Д.Г., Тасат Д.Р., Дуффо Г., Гульельмотти М.Б., Кабрини Р.Л.
Олмедо Д.Г. и соавт.
Акта Одонтол Латиноам. 2009;22(1):3-9.
Акта Одонтол Латиноам. 2009.PMID: 19601489
Обзор.
Посмотреть все похожие статьи
Цитируется
Коррозия металлических биоматериалов: обзор.
Элиаз Н.
Элиаз Н.
Материалы (Базель). 201928 января; 12 (3): 407. дои: 10.3390/ma12030407.
Материалы (Базель). 2019.PMID: 30696087
Бесплатная статья ЧВК.Обзор.
Механические и микроструктурные свойства систем фиксации, применяемых в челюстно-лицевой хирургии.
Мендес М.Б., Медейрос Р.С., Лаурия А., Марчиори Э., Савазаки Р., Лопес Э.С., Морейра Р.
 В.
В.
Мендес М.Б. и соавт.
Оральный челюстно-лицевой хирург. 2016 март; 20(1):85-90. doi: 10.1007/s10006-015-0532-3. Epub 2015 13 ноября.
Оральный челюстно-лицевой хирург. 2016.PMID: 26563099
Влияние декстрозы и липополисахарида на коррозионное поведение сплава Ti-6Al-4V с гладкой поверхностью или обработанного двойным кислотным травлением.
Faverani LP, Assunção WG, de Carvalho PS, Yuan JC, Sukotjo C, Mathew MT, Barao VA.
Фаверани Л.П. и др.
ПЛОС Один. 2014 26 марта; 9 (3): e93377. doi: 10.1371/journal.pone.0093377. Электронная коллекция 2014.
ПЛОС Один. 2014.PMID: 24671257
Бесплатная статья ЧВК.Разработка имплантируемых медицинских устройств: с инженерной точки зрения.
Юнг Ю.Х.
Юнг Ю. Х.
Х.
Int Neurourol J. 2013 Sep;17(3):98-106. doi: 10.5213/inj.2013.17.3.98. Epub 2013 30 сентября.
Международный нейроурол Дж. 2013.PMID: 24143287
Бесплатная статья ЧВК.Обзор.
Лазерная обработка поверхности Ti6Al4V в газообразном азоте: коррозионная стойкость в физиологическом растворе.
Сингх Р., Чоудхури С.Г., Тивари С.К., Дахотре Н.Б.
Сингх Р. и др.
J Mater Sci Mater Med. 2008 март; 19(3):1363-9. doi: 10.1007/s10856-007-3263-7. Epub 2007 4 октября.
J Mater Sci Mater Med. 2008.PMID: 17914613
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC).
 (Журнальная статья)
(Журнальная статья)
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). (Журнальная статья) | ОСТИ.GOV
перейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
Вурхис, Дж. Д.
- Дата публикации:
- Исследовательская организация:
- Стэнфордский университет, Калифорния
- Организация-спонсор:
- USDOE
- Идентификатор ОСТИ:
- 4688749
- Номер АНБ:
- НСА-26-018154
- Тип ресурса:
- Журнальная статья
- Название журнала:
- Дж.
 Электрохим. соц. 119: № 2, 219–22 (февраль 1972 г.).
Электрохим. соц. 119: № 2, 219–22 (февраль 1972 г.).
- Дополнительная информация журнала:
- Прочая информация: ориг. Дата получения: 31-DEC-72
- Страна публикации:
- Страна неизвестна/код недоступен
- Язык:
- Английский
- Тема:
- N50110* — Металлы, керамика и другие материалы — Керамика и металлокерамика — Коррозия, эрозия и поверхностные явления; АНОДЫ; ЦЕРИЯ СУЛЬФАТЫ; КОРРОЗИЯ; ФЕРРИЦИАНИДЫ; СЕРНАЯ КИСЛОТА; КАРБИДЫ ВОЛЬФРАМА; ВОЛЬТАМЕТРИЯ; КАРБИДЫ ВОЛЬФРАМА/коррозия сульфатом церия или феррицианидом в серной кислоте; КАРБИДЫ ВОЛЬФРАМА/коррозия серной кислотой, потенциостатико-кулонометрические исследования на аноде; СЕРНАЯ КИСЛОТА/коррозионное воздействие на карбид вольфрама, потенциостатико-кулонометрические исследования; ФЕРРИЦИАНИДЫ/Коррозионное воздействие на карбид вольфрама в серной кислоте, потенциостатически-кулонометрические исследования; СУЛЬФАТЫ ЦЕРИЯ/коррозионное воздействие на карбид вольфрама в серной кислоте, потенциостатико-кулонометрические исследования на
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Voorhies, J D. ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/Код недоступен: N. p., 1972.
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/Код недоступен: N. p., 1972.
Веб. дои: 10.1149/1.2404164.
Копировать в буфер обмена
Voorhies, J D. ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/код недоступен. https://doi.org/10.1149/1.2404164
Копировать в буфер обмена
Вурхис, Дж. Д., 1972.
«ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC)». Страна неизвестна/код недоступен. https://doi.org/10.1149/1.2404164.
Копировать в буфер обмена
@статья{osti_4688749,
title = {ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC).},
автор = {Вурхис, Дж.
