Коррозия электрохимическая примеры: Электрохимическая коррозия
Содержание
АКВА Композит — Виды коррозии, электрохимическая коррозия, химическая, атмосферная, газовая, щелевая коррозия
Основные виды коррозии и способы борьбы с ней
Коррозия – это разрушение металлов под воздействием окружающей среды.
Различают два типа коррозии — химическая коррозия и электрохимическая коррозия.
Под термином «химическая коррозия» понимают процессы, протекающие без участия электрического тока. В процессе химической коррозии на поверхности металла образуются различные химические соединения в виде пленок (оксида, сульфиды и др.) Пример химической коррозии – окисление поверхности стали при термической обработке или при гидравлических испытаниях.
Иногда пленка, образовавшаяся на металле в результате химической коррозии, служит препятствием для дальнейшего разрушения металла — имеет место пассивация — так происходит, например, у таких металлов, как свинец, олово, алюминий, никель и хром. На поверхности стали и чугуна пленка образуется непрочная, тонкая, она растрескивается и ведет к дальнейшей коррозии.
На поверхности стали и чугуна пленка образуется непрочная, тонкая, она растрескивается и ведет к дальнейшей коррозии.
«Электрохимическая коррозия» протекает в присутствии электрического тока. Примеры такого типа коррозии – появление ржавчины на корпусах судов, стальной арматуре гидравлических сооружений, трубопроводах.
Методы борьбы с коррозией
| Вид коррозии | Метод борьбы с коррозией |
| углекислотная (провоцируется растворенной в воде углекислотой) | Необходимо связывание растворенной углекислоты в воде и(или) паро-газовой фазе. Для паровых котлов рекомендуем использовать реагент для водоподготовки Boilex |
| атмосферная (металлические детали и конструкции на воздухе) | Пленкообразующие ингибиторы коррозии типа Protecsol |
| контактная электрохимическая (разные виды металлов в электролите) | Использование специальных реагентов. содержащих ингибиторы коррозии для разнородных материалов,например Performax 1300 содержащих ингибиторы коррозии для разнородных материалов,например Performax 1300 |
| питтинговая (точечная коррозия, вызываемая, как правило, растворенным кислородом) | Снижение концентрации растворенного кислорода. Реагенты Rutrol 3550 или Amersite |
| щелевая коррозия (сочетание неоднородности коррозионной среды и гидравлических условий) | Снижение концентрации коррозионно активных газов (Drewcore, Amersite, либо применение пленкообразующих ингибиторов коррозии (CIL, Amercore) |
| биологическая коррозия (под слоем биологических отложений) | Удаление биологических отложений и использование в дальнейшем биоцидов и биодиспергаторов (например, сочетание Biosperce 250 и Enviroplus 8100) |
| подшламовая коррозия (под слоем минеральных или оксидных отложений) | Удаление минеральных отложений и использование в дальнейшем ингибиторов коррозии |
ПЕРЕЙТИ В КАТАЛОГ
КОНТАКТЫ
ОПРОСНЫЙ ЛИСТ
В зависимости от характера и места распространения коррозии ее подразделяют на местную, сплошную и межкристаллитную. Сплошная коррозия охватывает всю поверхность металлической детали, после чего деталь разрушается. Несмотря на столь печальные перспективы, сплошная коррозии довольно легко по сравнению с другими видами контролируется и поддается оценке.
Сплошная коррозия охватывает всю поверхность металлической детали, после чего деталь разрушается. Несмотря на столь печальные перспективы, сплошная коррозии довольно легко по сравнению с другими видами контролируется и поддается оценке.
На отдельных частях металлического изделия может возникать местная коррозия. Она более опасна, так как распространяется, как правило, не в ширину, а в глубину, разрушая нижележащие слои и приводя к поломке и разрушению изделия. Чаще всего местная коррозия возникает там, где имели место механические или другие повреждения поверхности детали.
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов. Скорость коррозии. Методы защиты металлов от коррозии.
Коррозией называется разрушение металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия приводит к большим потерям металлов в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и пр. Безвозвратные потери металлов от коррозии составляют 10% от ежегодного их выпуска. По ориентировочным подсчетам, мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Однако, затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему.
Различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких как, например, сернистая нефть и др.
Газовая коррозия протекает по схеме: n Me + m/2O2 = MenOm;
Коррозию в серусодержащих неэлектролитах можно выразить схемой: Me + S = MeS.
Электрохимическая коррозия может протекать: а) в водных растворах электролитов, то есть солей, кислот и щелочей; б) в атмосфере любого влажного газа; в) в почве.
В воде обычно содержится растворенный кислород, способный к восстановлению по схеме: О2 + 4Н+ + 4е = 2 Н2О, или в нейтральной среде: 2Н2О +О2 + 4е = 4ОН— (1);
Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению: 2Н+ + 2е = Н2 или (в нейтральной среде) Н2О + 2е = Н2 + ОН—(2). Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Потенциал, отвечающий электродному процессу (1), равен 1,229в – 0,059рН. В нейтрально среде он равен около 0,8в. Следовательно, растворенный в воде или нейтральных растворах кислород будет окислять те металлы, потенциал которых меньше, чем 0,8в. Эти металлы расположены в ряду напряжений, начиная от его начала, до серебра.
Потенциал электродного процесса (2) в нейтральной среде равен приблизительно –0,41в. Следовательно, ионы водорода в нейтральных водных растворах могут окислить только те металлы, потенциал которых меньше, чем 0,41в. Это металлы от начала ряда напряжений до кадмия.
Пример 1. Рассмотрим электрохимическую коррозию железа в кислой среде.
На анодных участках происходит окисление железа: (а) Fe – 2e = Fe+2;
На катодных участках происходит восстановление водорода: 2Н+ + 2е = Н2.
Пример 2. Если гвоздь вбить во влажное дерево, то коррозии подвергается (покрывается ржавчиной) та его часть, которая находится внутри дерева. Это объясняется тем, что влага древесины содержит растворенный кислород, то есть, происходит коррозия железа по схеме:
Если гвоздь вбить во влажное дерево, то коррозии подвергается (покрывается ржавчиной) та его часть, которая находится внутри дерева. Это объясняется тем, что влага древесины содержит растворенный кислород, то есть, происходит коррозия железа по схеме:
(а) Fe –2e = Fe2+; (к) О2 + 2Н+ + 4е = 2Н2О;
Продуктами коррозии являются вода и оксид железа (II), который в присутствии кислорода окисляется до оксида трехвалентного железа Fe2O3.
Кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксидную пленку, которая препятствует взаимодействию этих металлов с водой. Поэтому количество металлов, которые может окислить водород в нейтральной среде, еще меньше.
Таким образом, вода, содержащая растворенный кислород (в воде его обычно содержится от 0 до 14 мг/л), значительно опаснее в коррозионном отношении, чем вода, способная окислять металлы только за счет ионов водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде: атмосфере или растворе. Могут иметь место различные случаи электрохимической коррозии.
Атмосферная коррозия – это коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы и, в первую очередь, кислород. Скорость атмосферной коррозии зависит от многих факторов. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты (например, СО2 или SО2). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию в них влаги.
Коррозия в грунте (почвенная коррозия) приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный кислород. В зависимости от состава грунтовых вод, а также минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Контактная коррозия протекает, когда два металла в различными потенциалами соприкасаются друг с другом либо в влажной среде, либо при наличии влаги, конденсирующейся из воздуха. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Пример 3. Хром находится в контакте с медью. Какой из металлов будет окисляться, если эта пара металлов попадет в кислую среду? Составьте схему образующегося при этом гальванического элемента.
Хром более активный металл, чем медь (потенциал хрома равен –0,744в, а меди +0,337в), поэтому в образующейся гальванической паре он будет анодом, а медь – катодом. Хромовый анод растворяется: (а) 2Cr – 6e = 2Cr3+;
на медном катоде выделяется водород: (к) 6Н+ + 6е = 3Н2.
Схема образующегося гальванического элемента:
(-) 2Cr/Cr3+//HCl/(Cu)3H2/6H+ (+)
Основным отличием процессов контактной электрохимической коррозии от процессов, происходящих в гальваническом элементе, является отсутствие внешней электрической цепи. Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
На поверхности металла могут быть участки, на которых катодные процессы протекают быстрее (катализируются). Такие участки называют катодными. На других участках будет происходить анодное растворение металла, поэтому они называются анодными участками. Катодные и анодные участки имеют очень малые размеры, однако, они чередуются и образуют коррозионные микроэлементы.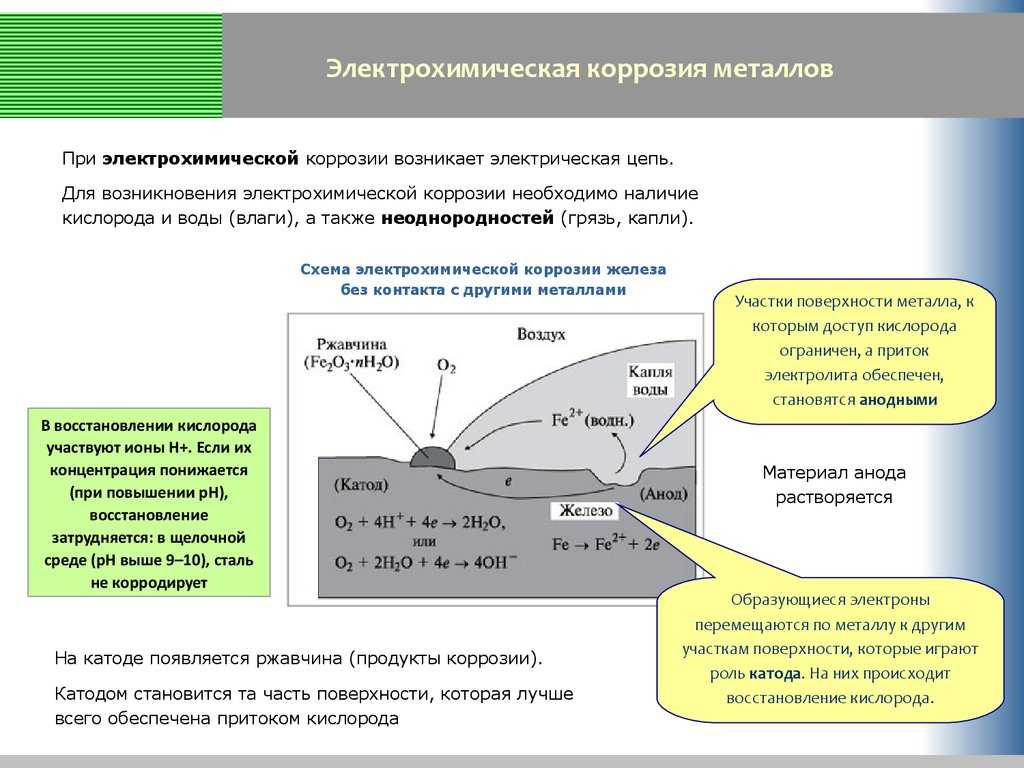 Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Пример 4. Атмосферная коррозия алюминия в нейтральной среде протекает по схеме:
(а) 2Al – 6e = 2Al 3+; (к) 3Н2О + 3е = 3Н2 + 3ОН—. Продуктами коррозии являются в данном случае водород и гидроксид алюминия.
Пример 5. Медь не вытесняет водород из разбавленных кислот вследствие того, что ее потенциал более положительный, чем потенциал водорода. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но и от природы растворенных в воде веществ и температуры. Так, в случае контакта железо-цинк, последний интенсивно коррозирует при комнатной температуре, но в горячей воде полярность металлов изменяется, и коррозировать начинает железо.
Для защиты от коррозии и предупреждения ее применяются различные методы. К важнейшим из них относятся следующие методы:
1) Легирование металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию основного металла и повышение его устойчивости к коррозии.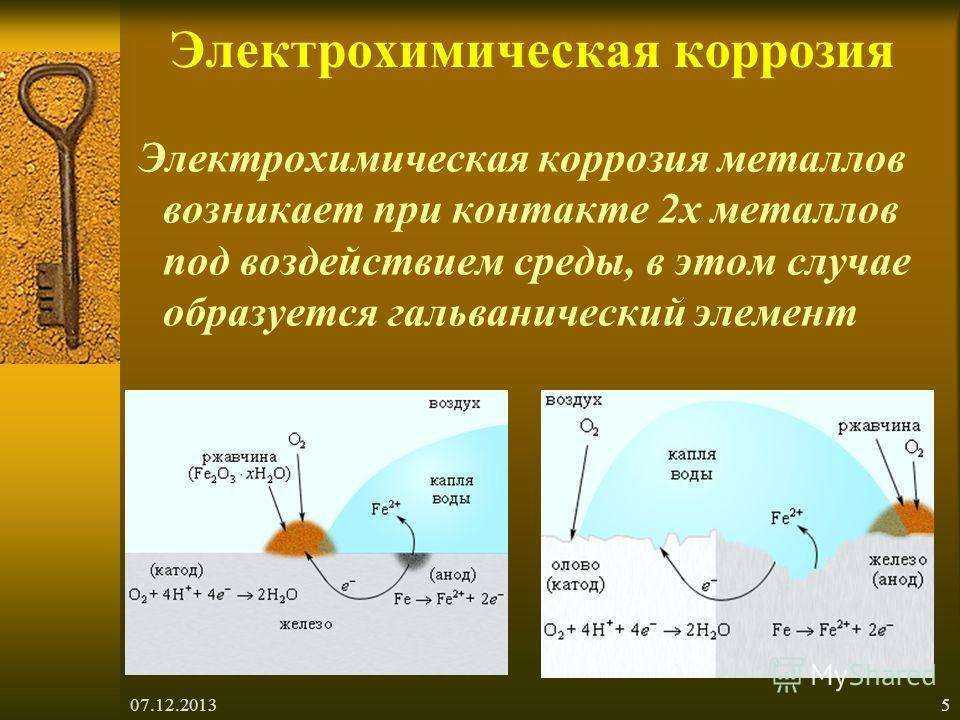 В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
2) Защитные покрытия. Слои различных материалов, создаваемые на поверхности металлических изделий и сооружений для защиты от коррозии называются защитными покрытиями. Материалами для защитных покрытий могут быть как чистые металлы цинк, кадмий, алюминий, никель, медь, хром, серебро, так и их сплавы (бронза, латунь и др.).
Защитные покрытия делятся на катодные и анодные покрытия. К катодным покрытиям относятся такие металлические покрытия, потенциалы которых имеют более положительное значение, чем потенциал основного металла. Примерами катодного покрытия на стальных изделиях являются медь, серебро, никель. При повреждении покрытия или при наличии в нем пор возникает коррозионный элемент, в котором основной материал служит анодом и растворяется (коррозирует), а материал – катодом, на котором выделяется водород или поглощается кислород.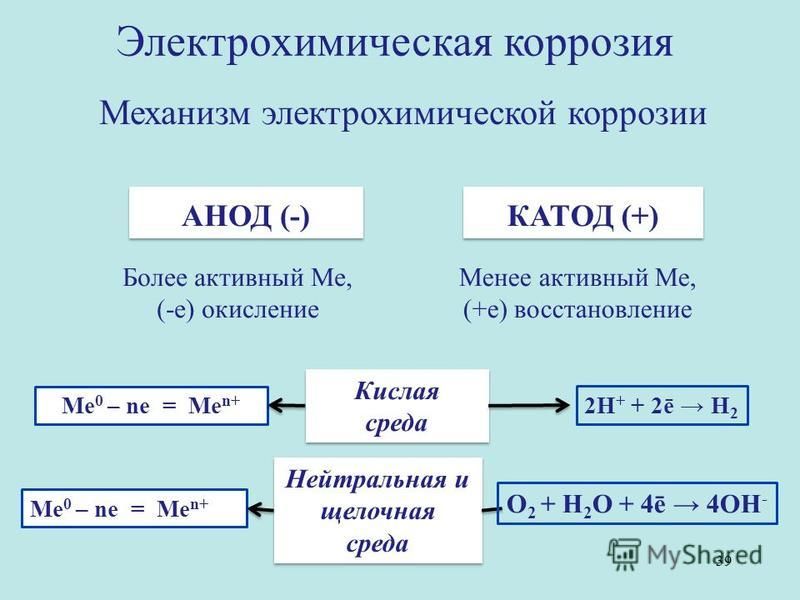 Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинковое покрытие на стальных изделиях. При повреждении покрытия анодом будет служить металл покрытия, а основной металл, в качестве катода, разрушению подвергаться не будет. Потенциалы металлов зависят от состава растворов, поэтому, например, покрытие стали оловом (лужение) в растворе серной кислоты является катодным, а в растворе органических кислот – анодным.
Пример 6. Железное изделие покрыли кадмием. Какое это покрытие – катодное или анодное? Составьте уравнения анодного и катодного процессов коррозии этого изделия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случае?
Кадмий (потенциал –0,403в) менее активный металл, чем железо, (потенциал –0,440в) и в случае образование коррозионного элемента будет служить катодом поэтому данное покрытие является катодным. При коррозии происходит анодное растворение железа:
При коррозии происходит анодное растворение железа:
(а) Fe – 2e = Fe2+;
Катодным процессом в случае атмосферной коррозии во влажном воздухе будет восстановление кислорода:
(к) H2O +O2 + 4e = 4OH—;
Продуктами коррозии в данном случае являются гидроксид железа.
В кислой среде происходит катодное восстановление ионов водорода:
(к) 2Н+ +2е = Н2.
Продуктами коррозии в этом случае являются хлорид железа (II) и водород.
Пример 7. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Составьте уравнения анодного и катодного процессов коррозии и укажите, какие продукты коррозии образуются.
Ржавчиной быстрее покроется железная пластинка, покрытая медью, так как в паре железо (потенциал –0,440в) – медь (потенциал +0,337в) железо является анодом и разрушается по схеме:
(а) Fe – 2e = Fe2+;
На катоде происходит восстановление растворенного в воде кислорода по схеме:
(к) H2O + O2 + 4e = 4OH—;
Продуктами коррозии является гидроксид железа.
В паре железо-олово (потенциал +0,150в) железо также является более активным металлом, а, следовательно, анодом. Анодный процесс состоит в окислении железа по схеме:
(а) Fe –2e = Fe2+;
Вместе с этой лекцией читают «5 Сетевые модели».
Катодный процесс протекает аналогично предыдущему. Продуктами коррозии является гидроксид железа.
ЭДС первого коррозионного элемента равен +0,337 – (-0,440) = +0,777 в. ЭДС второго коррозионного элемента равен +0,150 – (-0,440) = +0,590 в. Следовательно, в первом случае коррозия железа будет протекать быстрее.
3) Электрохимическая защита. Этот метод защиты от коррозии основан на торможении анодных или катодных реакций коррозионных процессов. К защищаемой конструкции присоединяют металл с более отрицательным электродным потенциалом, чем потенциал металла конструкции. Этот металл называется протектором, а защита от коррозии – протекторной защитой. При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
Используется также катодная или анодная поляризация за счет приложенного извне тока. Сущность катодной защиты заключается в том, что защищаемое изделие присоединяется к отрицательному полюсу внешнего источника постоянного тока и становится вследствие этого катодом. Анодом обычно служит стальной вспомогательный электрод, который растворяется. Анодную защиту применяют к металлам, способным легко пассивироваться (образовывать оксидную пленку) при смещении их потенциала в положительную сторону.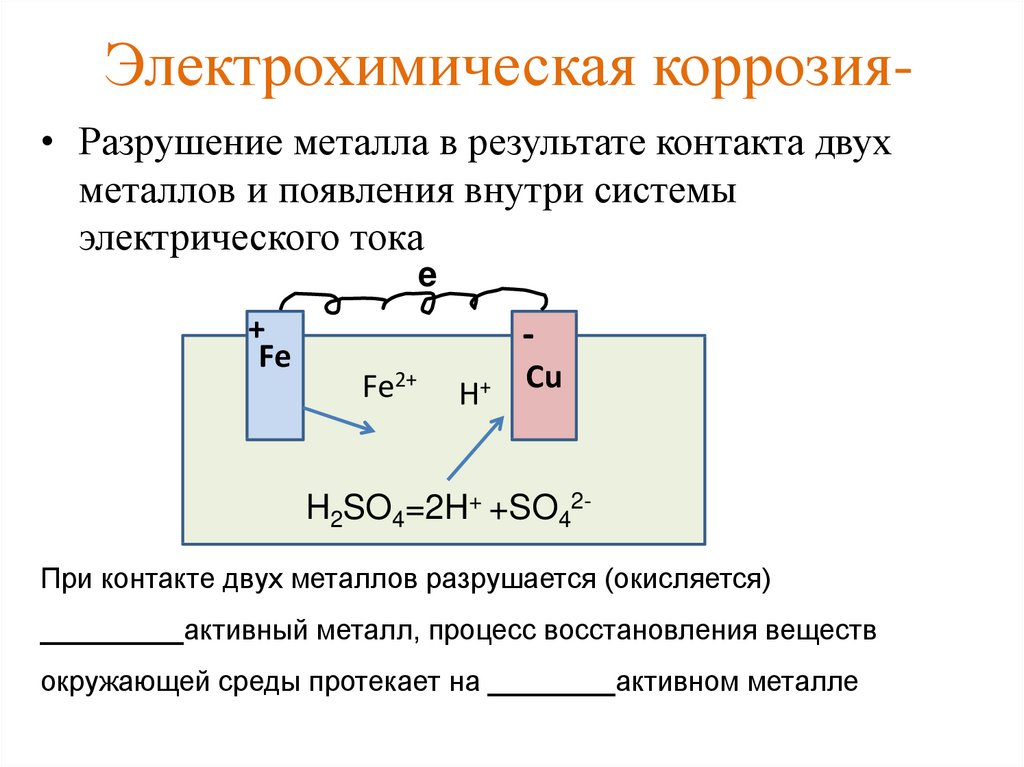 Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
4) Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию в ней компонентов, опасных в коррозионном отношении. В нейтральных средах, например, коррозия протекает обычно с поглощением кислорода. Кислород удаляют кипячением или вытеснением его из раствора при помощи инертного газа (барботаж инертным газом) или восстанавливают соответствующими реагентами (сульфиты, гидразин). Агрессивность кислых сред можно снизить подщелачиванием (нейтрализацией).
Для защиты от коррозии широко применяют вещества, при добавлении которых в соответствующую среду значительно уменьшается скорость коррозии. Такие вещества называются ингибиторами коррозии. По составу ингибиторы делятся на органические и неорганические. Так как активность ингибиторов зависит от рН среды, их также делят на кислотные, щелочные и нейтральные. По механизму действия ингибиторы можно разделить на анодные, катодные и экранирующие. Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Гальваническая коррозия – причины, примеры, предотвращение и часто задаваемые вопросы
Гальваническая коррозия также известна как биметаллическая коррозия или разнородная коррозия. В процессе гальванической коррозии металлы помещаются в электролит с другим металлом. Из-за участия двух металлов она называется биметаллической коррозией. Коррозия обычно относится к разрушению металла в присутствии кислорода и влаги, тогда как гальваническая коррозия включает разрушение одного металла и защиту другого металла, помещенного вместе с драгоценным металлом. Здесь есть одна вещь, которую следует отметить. Два металла должны электрохимически отличаться друг от друга, поэтому это обозначается как разнородная коррозия.
Здесь есть одна вещь, которую следует отметить. Два металла должны электрохимически отличаться друг от друга, поэтому это обозначается как разнородная коррозия.
ПРИЧИНЫ ГАЛЬВАНИЧЕСКОЙ КОРРОЗИИ
Каждый гальванический элемент функционирует благодаря разности потенциалов. Эта разность потенциалов вызывает поток электронов внутри клетки. Способность металлического электрода терять электроны и окисляться известна как окислительный потенциал. Чем больше окислительный потенциал, тем легче металл отдает свои электроны. Противоположным окислительному потенциалу является восстановительный потенциал. Это способность иона металла в растворе захватывать электроны и восстанавливаться. На основе окислительного потенциала металлов устроен электрохимический ряд.
Элементы в верхней части ряда легче окисляются, поэтому велика вероятность потери электронов. Весь механизм зависит от потенциалов окисления двух металлов при гальванической коррозии. Разница в окислительном потенциале двух металлов является движущей силой гальванической коррозии.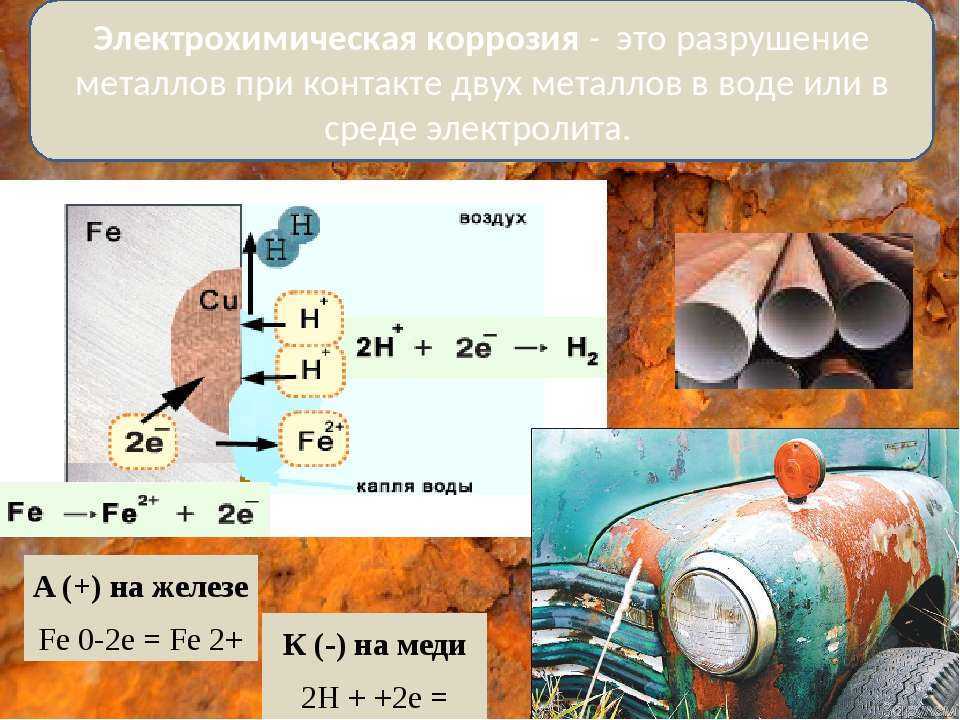
Когда два металлических электрода помещают в электролит и замыкают цепь, соединяя металл проволокой, то в этой точке происходит процесс коррозии. Металлы с более высоким потенциалом окисления начнут действовать как анод и будут продолжать терять электроны, тогда как металлы с более низким потенциалом окисления начнут действовать как катод соответственно. Активность металлов основана на электрохимическом ряду. Таким образом, ток течет от более активного металла (анод) к менее активному металлу (катод).
ПРИМЕРЫ ГАЛЬВАНИЧЕСКОЙ КОРРОЗИИ
Несколько пар металлов, которые подвергаются гальванической коррозии, приведены ниже-
1. ЦИНК КАК АНОД И МЕДЬ КАК КАТОД любая соль, такая как сульфат меди, тогда цепь замыкается. Теперь цинк начинает окисляться из-за его высокого окислительного потенциала по сравнению с катодом. Таким образом, цинк медленно начинает разъедать и образовывать ионы цинка. Ионы меди, с другой стороны, начинают приобретать электроны и восстанавливаются, поэтому они защищены. Процесс продолжается до полного растворения цинкового электрода. Ионы водорода, присутствующие в электролите, также восстанавливаются до газообразного водорода и видны в виде пузырьков на катоде.
Процесс продолжается до полного растворения цинкового электрода. Ионы водорода, присутствующие в электролите, также восстанавливаются до газообразного водорода и видны в виде пузырьков на катоде.
Реакция на аноде
Zn——-> Zn+2 + 2e-
Реакция на катоде
2H++2e———-> H₂↑
Другие примеры —
2. СТАЛЬ И АЛЮМИНИЙ
Когда сталь и алюминий помещаются в электролит, алюминий будет действовать как анод и начнет корродировать, тогда как сталь будет защищена.
ПРЕДОТВРАЩЕНИЕ ГАЛЬВАНИЧЕСКОЙ КОРРОЗИИ
Гальваническая коррозия не требуется во многих местах, поэтому ее необходимо предотвращать. Существуют различные методы предотвращения гальванической коррозии.
Некоторые из них приведены ниже.
1. ИЗБЕГАЙТЕ ГАЛЬВАНИЧЕСКОЙ СОЕДИНЕНИЯ
Это означает, что два металла, которые могут подвергаться гальванической коррозии, нельзя помещать вместе, иначе один из двух металлов подвергнется коррозии. Мы уже видели несколько примеров таких металлов. Избегайте использования металлов, электрохимически отличающихся друг от друга.
Мы уже видели несколько примеров таких металлов. Избегайте использования металлов, электрохимически отличающихся друг от друга.
2. ИСПОЛЬЗОВАНИЕ ИЗОЛЯЦИОННОГО МАТЕРИАЛА
Если два разных металла держать вместе, то между ними необходимо использовать изоляционные материалы, которые предотвратят образование цепи и поток электронов.
3. КРАСКА
Краска создает барьер, покрывая металл, что также является способом предотвращения гальванической коррозии.
4. ИЗБЕГАЙТЕ БОЛЬШОГО КАТОДА И МАЛЕНЬКОГО АНОДА.
Это также снижает разнородную коррозию.
Гальваническая коррозия начинается, когда металлы неодинаковы, если присутствует электролит или если цепь замыкается. Всех этих условий необходимо избегать, чтобы предотвратить гальваническую коррозию.
Гальваническая коррозия – SSINA
Когда два различных металла связаны вместе в атмосфере или воде , вероятность развития гальванической коррозии можно предсказать с помощью «гальванического ряда».
Фото предоставлено: Boba Jovanovic на Unsplash
Определение
Когда два разных металла или сплава погружаются в коррозионный раствор или постоянно контактируют с влагой, у каждого из них возникает коррозионный потенциал. При наличии условий для гальванической коррозии более благородный металл станет катодом, а более активный металл станет анодом. Измеряемый ток может протекать между анодом и катодом. Если это произойдет, скорость коррозии анода в рабочей среде увеличится, а скорость коррозии катода уменьшится. Повышенная коррозия анода называется «гальванической коррозией».
Гальваническая коррозия иногда используется для продления срока службы материалов (например, цинковые покрытия на углеродистой стали и цинковые аноды в водонагревателях), но, если ее не учитывать и существуют правильные условия, она может привести к неожиданным отказам.
Требования к гальванической коррозии:
Для возникновения гальванической коррозии необходимы три элемента.
- Два металла с разным коррозионным потенциалом
- Прямой электрический контакт металл-металл
- Проводящий раствор электролита (например, вода) должен регулярно соединять два металла. Раствор электролита создает «проводящую дорожку». Это может произойти при регулярном погружении в воду, конденсации, дожде, воздействии тумана или других источников влаги, которые увлажняют и соединяют два металла.
При отсутствии любого из этих элементов гальваническая коррозия невозможна. Если, например, не допустить прямого контакта между двумя металлами (пластмассовая шайба, пленка краски и т. д.) или если на токопроводящем пути имеется какое-либо другое прерывание, гальваническая коррозия невозможна, и каждый металл будет корродировать со своей нормальной скоростью в эта сервисная среда. На рис. 1 показаны примеры условий, не отвечающих всем требованиям гальванической коррозии.
Рисунок 1
Рисунок 1: Примеры биметаллических комбинаций, когда гальваническая коррозия невозможна
Примеры биметаллических комбинаций, когда гальваническая коррозия невозможна
Коррозию можно предсказать с помощью «гальванического ряда».
