Коррозия это химическое явление почему: Коррозия металлов — урок. Химия, 9 класс.
Содержание
Коррозия металла.
Коррозия металла.
Хроники одной московской школы середины 80-х.
Это не рассказ про известную в эпоху «Перестройки» метал рок-группу и её лидера — Паука. Это рассказ именно про коррозию, как химическое явление в школьной интерпретации. Шёл 1984 или 1985 год нашего десятого класса в московской школе N 557. В моде тогда было всё новое, в том числе и в процессе школьного обучения. В то время одним из лидеров нестандартного преподавания школьного предмета у нас была «химичка» — Голикова Галина Михайловна. В тот раз ей пришло в голову устроить необычный открытый урок, при этом сильно не отходя от текущей темы по химии. Только начали тогда изучать коррозию металлов. «Химичка» решила устроить настоящий суд над этой самой враждебной железу и народному хозяйству коррозией, пригласив на открытый урок директора школы и районное учебное начальство.
Любой суд в любой стране должен иметь характерные особенности. Должен присутствовать не только судья, но и свидетели, судебный эксперт и, конечно, адвокат. Свидетелей по делу преступления «коррозии» набрали много, ну насколько хватило: у самой «химички» собственных идей, быстрых предложений по делу коррозии самих учеников класса и, с точки зрения Галины Михайловны, — достойных докладчиков-свидетелей из класса. Один свидетель-прокурор обвинял бы несносную коррозию в перерасходе краски для защиты народнохозяйственных объектов. Другой – в перерасходе дефицитных кадров по окраске тех самых объектов, третий — в краже народнохозяйственного железа. Ну и так далее. Химичка назначила «свидетелей» из числа тех, кто смог бы выучить и достойно без боязни пересказать текст относительно чужой аудитории. Экспертом – и это тогда было очевидно – назначила лучшего на тот момент химика школы (Сергея К.). Ну а вашему покорному слуге досталась неблагодарная (на первый взгляд) роль адвоката. Мне было предложено творчески развивать мысль о том, что коррозия это, во-первых, естественный природный процесс, во-вторых – убийца мусора. Я тогда слишком творчески подошел к этому вопросу.
Свидетелей по делу преступления «коррозии» набрали много, ну насколько хватило: у самой «химички» собственных идей, быстрых предложений по делу коррозии самих учеников класса и, с точки зрения Галины Михайловны, — достойных докладчиков-свидетелей из класса. Один свидетель-прокурор обвинял бы несносную коррозию в перерасходе краски для защиты народнохозяйственных объектов. Другой – в перерасходе дефицитных кадров по окраске тех самых объектов, третий — в краже народнохозяйственного железа. Ну и так далее. Химичка назначила «свидетелей» из числа тех, кто смог бы выучить и достойно без боязни пересказать текст относительно чужой аудитории. Экспертом – и это тогда было очевидно – назначила лучшего на тот момент химика школы (Сергея К.). Ну а вашему покорному слуге досталась неблагодарная (на первый взгляд) роль адвоката. Мне было предложено творчески развивать мысль о том, что коррозия это, во-первых, естественный природный процесс, во-вторых – убийца мусора. Я тогда слишком творчески подошел к этому вопросу. Так как намечался приход на урок и районного начальства, то предварительно (за счет других тем) на уроках химии начали проводить репетиции открытого суда над коррозией. Свидетели и судья всё заучивали назубок обвинения, эксперт апофигично рассказывал что-то, что простым смертным понять было сложно. Я же каждую тренировку выдавал новую версию защиты, изменяя текст по собственному усмотрению. Мне всегда нравилось выступать на публике, если тема была и мне интересна, и допускалась возможность импровизации. Галина Михайловна позволяла в тот раз говорить мне всё, что можно.
Так как намечался приход на урок и районного начальства, то предварительно (за счет других тем) на уроках химии начали проводить репетиции открытого суда над коррозией. Свидетели и судья всё заучивали назубок обвинения, эксперт апофигично рассказывал что-то, что простым смертным понять было сложно. Я же каждую тренировку выдавал новую версию защиты, изменяя текст по собственному усмотрению. Мне всегда нравилось выступать на публике, если тема была и мне интересна, и допускалась возможность импровизации. Галина Михайловна позволяла в тот раз говорить мне всё, что можно.
Подготовились, отрепетировали, но комиссия из района долго не шла. И явилась, когда уже многие стали слова подзабывать. Но тот день наступил! На задних партах разместились директор школы Карсавина Т.И. и кто-то из района. Класс гужевался ближе к середке комнаты. Выступающие – ближе к столу «химички» перед «сценой» (была у нас как бы сцена перед доской в химклассе). Вёл суд, судил, засуживал тогда эту коррозию Шура К. Как помню: очень он волновался, проговаривал фразы по два раза, был напряжен. Ответственность несколько его напрягала. Всё начали!! Пошли свидетели обвинения, потом возник вопрос: «Что за зверь это такой – «Коррозия»? Поэтому пошел химик-эксперт, который с помощью заумных непонятных таблиц авторитетно объяснил это «суду» и прочим присутствующим. Через полчаса дошла очередь и до меня. Система судебная требовала, чтобы даже и такого монстра защищал адвокат.
Как помню: очень он волновался, проговаривал фразы по два раза, был напряжен. Ответственность несколько его напрягала. Всё начали!! Пошли свидетели обвинения, потом возник вопрос: «Что за зверь это такой – «Коррозия»? Поэтому пошел химик-эксперт, который с помощью заумных непонятных таблиц авторитетно объяснил это «суду» и прочим присутствующим. Через полчаса дошла очередь и до меня. Система судебная требовала, чтобы даже и такого монстра защищал адвокат.
Я втянул воздуха побольше в грудь и начал. Начал с того, что коррозия — это естественный природный процесс, против которого не попрёшь, который сильно не исправишь, как ни старайся. А природа мудра, зачем её действия полностью изничтожать. Тут ходил на грани — ещё немного и выпал бы из принятого тогда материализма в религию, что тогда совсем не приветствовалось. Но остановился и перешел на загнивающий уже тогда Запад и экологию. Не знаю, как сейчас, но в то время особенно Южная Европа, как сообщалось, активно загрязняла Средиземноморье использованными консервными банками. И кто-то из европейцев подсчитал, что если бы не коррозия, то горы бы выброшенного на побережье железа показались бы над поверхностью воды. Это был сильный аргумент в пользу обиженной многими коррозии, которая активно «боролась» за экологию во всем мире, не смотря на общественный строй в государстве. Хотя могла бы – и это её минус – активнее бороться только на нашей территории. Плакаты я тогда не подготовил, поэтому носился около школьной доски с мелом, зарисовывая ужасающие картинки моря с консервными банками и неблагополучные по экологии пляжи Средиземноморья. Зря старался! Коррозия уже была заранее осуждена, и теперь предстояло вынести только формальный приговор. Что Шура К. и сделал. А мне от этого, как помню, как то стало обидно даже: уж как я старался, оправдывал! Но против любой системы не попрёшь! Через пару дней Галина Михайловна успокоила немного меня, сказав, что районной комиссии и директору очень нравились: и моё раскованное своеобразное выступление, и легкость в подаче материала.
И кто-то из европейцев подсчитал, что если бы не коррозия, то горы бы выброшенного на побережье железа показались бы над поверхностью воды. Это был сильный аргумент в пользу обиженной многими коррозии, которая активно «боролась» за экологию во всем мире, не смотря на общественный строй в государстве. Хотя могла бы – и это её минус – активнее бороться только на нашей территории. Плакаты я тогда не подготовил, поэтому носился около школьной доски с мелом, зарисовывая ужасающие картинки моря с консервными банками и неблагополучные по экологии пляжи Средиземноморья. Зря старался! Коррозия уже была заранее осуждена, и теперь предстояло вынести только формальный приговор. Что Шура К. и сделал. А мне от этого, как помню, как то стало обидно даже: уж как я старался, оправдывал! Но против любой системы не попрёшь! Через пару дней Галина Михайловна успокоила немного меня, сказав, что районной комиссии и директору очень нравились: и моё раскованное своеобразное выступление, и легкость в подаче материала. А её саму присудили к передаче этого опыта проведения урока на районный уровень.
А её саму присудили к передаче этого опыта проведения урока на районный уровень.
Что касается меня, то после такого погружения в химические и биологические процессы нашей матушки-природы, я стал более трепетно относиться к её потребностям и действиям. И даже плесени порой перепадает от меня лишний кусочек хлеба на пропитание. А та, в свою очередь, помогает мне порой маркировать плохой хлебушек, который заполонил прилавки современной Москвы. А, возможно даже, что наш урок прослушали и западные шпионы: с тех пор пляжи в Южной Европе стали гораздо чище!
18.04.2020
306
©
Батарин Владислав
Теги:
При выполнении скрипта возникла ошибка. Включить расширенный вывод ошибок можно в файле настроек .settings.php
Урок «Коррозия металлов»
Тема урока: «Коррозия металлов».
Цель урока: создание условий для восприятия и первичного закрепления нового учебного материала, осмысление связей и отношений в объектах изучения.
Планируемые результаты
Готовность и способность обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию;
сформированность ценности здорового и безопасного образа жизни;
эмоционально-ценностное видение окружающего мира;
осознанное, уважительное отношение к ценностям Родины;
наличие опыта экологически ориентированной рефлексивно-оценочной и практической деятельности в жизненных ситуациях (готовность к исследованию природы, знания значения коррозии при выборе материала для конструкции сооружений, изготовления деталей техники и быта).
Метапредметные результаты
Межпредметные понятия: овладение обучающимися основами читательской компетенции, приобретение навыков работы с информацией.
Регулятивные УУД
Умение самостоятельно определять цели обучения, ставить и формулировать новые задачи в учебе и познавательной деятельности;
обучающиеся смогут: ставить цель деятельности на основе определенной проблемы и существующих возможностей, выдвигать версии решения проблемы, формулировать гипотезы, предвосхищать конечный результат;
формулировать учебные задачи как шаги достижения поставленной цели деятельности; обосновывать целевые ориентиры и приоритеты ссылками на ценности, указывая и обосновывая логическую последовательность шагов.
обучающиеся научатся определять совместно с учителем и сверстниками критерии планируемых результатов и критерии оценки своей учебной деятельности
Познавательные УУД
Умение определять понятия, создавать обобщения, устанавливать аналогии. выявлять причины и следствия явлений; строить рассуждение от частных явлений к общим закономерностям;
строить рассуждение на основе сравнения явлений, выделяя при этом общие признаки; излагать полученную информацию;
объяснять явления, процессы, связи и отношения, выявляемые в ходе познавательной и исследовательской деятельности.
Коммуникативные УУД
Умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками;
работать индивидуально и в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учета интересов; формулировать, аргументировать и отстаивать свое мнение.
Предметные результаты
научится:
соблюдать правила безопасности и охраны труда при работе с учебным оборудованием и веществами;
понимать смысл основных химических терминов: химическое и физическое явление электрический ток, строение атома, химическая реакция, коррозия;
распознавать проблемы, которые можно решить при помощи химических методов; анализировать этапы проведения исследований и интерпретировать результаты наблюдений и опытов проводить опыт и формулировать выводы;
проводить исследование зависимостей протекания химических реакций методом наблюдений и имеющихся знаний по предмету, при этом фиксировать результаты полученной зависимости физических величин в виде устных отчетов, делать выводы по результатам исследования.
Тип урока: комбинированный.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод.
Оборудование: компьютер, проектор, презентация «Коррозия. Защита металлов от коррозии», лабораторное оборудование и реактивы.
Ход урока
Учитель: Вспомним, какую тему, какие вещества мы с вами изучаем.
Ученики: Мы изучаем тему: «Металлы».
Учитель: Для того чтобы изучать дальше, мы повторим свойства металлов.
Учащимся предлагается тестовое здание.
1. В химических реакциях металлы играют роль:
а) окислителей;
б) восстановителей;
в) окислителей и восстановителей.
2. Неактивные металлы с водой:
а) реагируют при нагревании;
б) не реагируют;
в) реагируют при нормальных условиях.
3. К активным металлам относятся:
а) Cu, Ag, Hg, Pb;
б) Ca, Be, Ni, Ba;
в) Ca, Na, Li, Ba.
4. С кислородом воздуха легко взаимодействуют:
а) железо, цинк, медь;
б) золото, ртуть, платиновые металлы;
в) калий, кальций, франций.
5. С хлороводородной кислотой взаимодействуют при н.у.:
а) литий, кальций, железо;
б) серебро, магний, медь;
в) цинк, ртуть, никель.
6. Какие из указанных металлов являются более активными, чем железо:
а) Ba, Al, Zn;
б) Cu, Hg, Ag;
в) Al, Zn, Cu.
7 С водой с образованием растворимого гидроксида взаимодействует:
а) К; б)Zn; в)Pb; г)Ag.
8.В электротехнике используют следующее физическое свойство меди и алюминия:
а) теплопроводность; б) ковкость;
в) пластичность; г) электропроводность.
9 С раствором серной кислотой не будет взаимодействовать:
а) Сu; б) Fe; в) Al; г)Zn.
10.С соляной кислотой взаимодействуют при н.у.
а) алюминий, кальций, железо;
б) серебро, магний, медь;
в) цинк, ртуть, никель.
11. Способы получения металлов:
а) гидрометаллургия; б) пирометаллургия;
в).электрометаллургия; г)все ответы верны
После выполнения задания, поменялись листочками и проверяем
Один ученик решает задачу у доски.
II. Актуализация знаний.
Вопрос учителя. Почему металлы в природе чаще встречаются не в чистом виде, а в форме химических соединений?
(При образовании химического соединения, атом металла завершает свой внешний энергетический уровень.)
Учитель. Стремление металла к завершению энергетического уровня может причинить ущерб хозяйственной деятельности человека. В качестве примера я приведу историю, случившуюся с одним американским миллионером.
III. Изучение новой темы.
Задача. В 20-е годы ХХ в. с одним американским миллионером произошла неприятная история. По его заказу была построена роскошная яхта “Зов моря”. Для обшивки корпуса яхты использовался сплав никеля с медью, известный под названием монель-металл. Этот сплав отличался чрезвычайно высокой стойкостью во многих агрессивных средах, в том числе и в морской воде. Другие детали корпуса судна были изготовлены из специальных нержавеющих сталей, т.е. материалов, содержащих железо. Но когда яхту спустили на воду, она полностью вышла из строя. Объясните, что послужило причиной гибели яхты.
Молодцы! Сегодня на уроке мы остановимся только на самопроизвольном разрушении металлов в результате взаимодействия их с окружающей средой, то есть с явлениями, изображенными на слайде.
Учитель: Как часто вы встречаетесь с явлением разрушения металлов?
Ученики: Приводят примеры. )
)
Учитель: А как называется это явление?
Ученики: ржавление, коррозия
Учитель: Итак, мы сегодня изучаем процесс коррозии металлов.
Постановка учебной задачи
У меня для вас еще одно задание. Составьте, пожалуйста, вопросы к теме, для этого используйте вопросы, написанные на доске. (Каждой группе по вопросу, которые у них написаны на листах, которые лежат на столах)
Учащиеся записывают вопросы, они вывешиваются на доске.
что?, почему?, как?, какая?, для чего? Составьте, пожалуйста, вопросы к теме «Коррозия металлов и способы защиты от неё» используя данные вопросительные слова.
— Что такое коррозия металлов?
— Почему возникает коррозия металлов?
— Как возникает коррозия металлов? (Как защитить металл от коррозии?)
— Какая бывает коррозия?
— Для чего надо изучать коррозию?
Учитель: Скажите, пожалуйста, какова будет цель нашего урока?
Ученики: Получить ответы на поставленные вопросы.
Мы должны выяснить:
1) Что такое коррозия металлов?
2) Какова роль коррозии в жизни человеческого общества и зачем ее изучать?
3) Какие виды коррозии бывают?
4) Как протекает этот процесс?
5) Какие способы защиты от нее существуют?
Изучение нового материала.
1. Определение коррозии
Одна группа по словарю.
Вторая работает с учебником.
Учитель: Коррозия представляет собой разрушение металлов вследствие взаимодействия их с внешней (коррозионной) средой. Этот термин происходит от латинского слова corrosio – разъедание. Коррозия – страшный бич промышленности, строительства, транспорта. Ежегодно из-за коррозии безвозвратно теряется 10… 12 % черных металлов. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, – это яркий пример коррозии.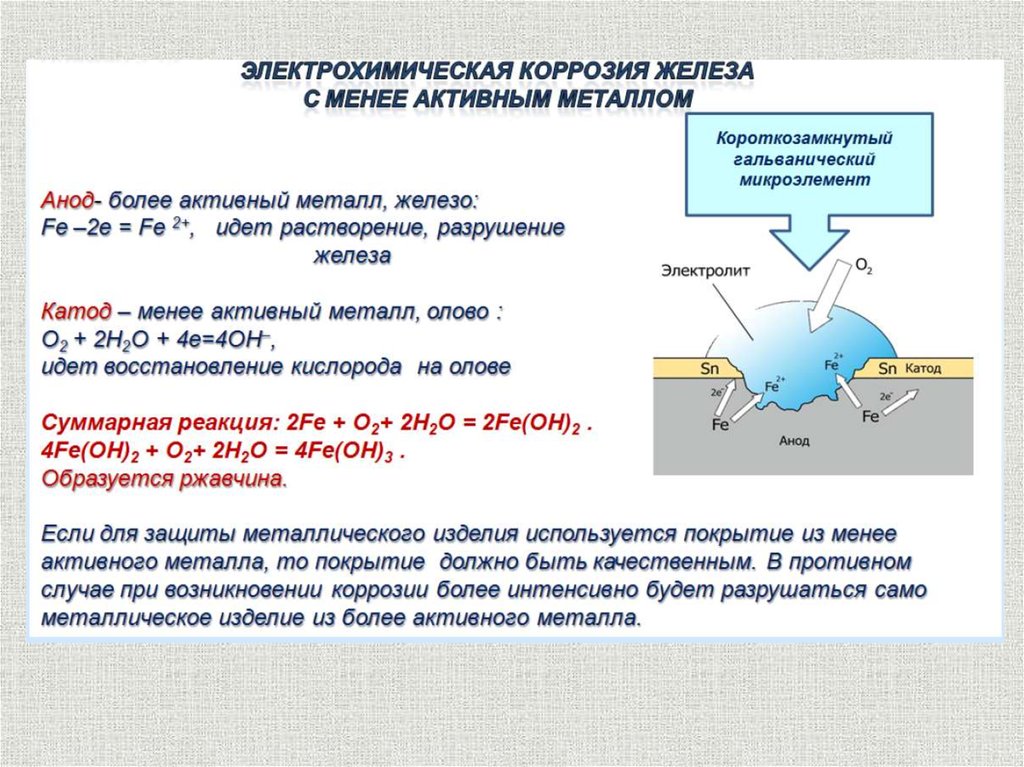 Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Многие металлические предметы, которые мы используем в быту, не подвергаются видимой коррозии, в то время как потерянный ключ быстро ржавеет. Понятно, что с коррозией надо бороться. Но, чтобы победить ее, нужно знать причины и механизмы ее протекания. Как вы думаете, почему металлы коррозируют? Что может происходить с металлом при коррозии? Коррозия причиняет огромный ущерб, и мы повседневно замечаем следы ее опустошительного действия. Только потери стали из-за коррозии во всем мире оцениваются в сотни миллиардов долларов в год. Помимо этого коррозия причиняет огромный не поддающийся учету ущерб, связанный с выходом из строя коррозирующих деталей, машин, оборудования и сооружений. А загрязнения окружающей среды, вызванные утечкой газа, нефти и других опасных веществ из трубопроводов из-за коррозии, что отрицательно воздействует на здоровье и жизнь людей.
Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Многие металлические предметы, которые мы используем в быту, не подвергаются видимой коррозии, в то время как потерянный ключ быстро ржавеет. Понятно, что с коррозией надо бороться. Но, чтобы победить ее, нужно знать причины и механизмы ее протекания. Как вы думаете, почему металлы коррозируют? Что может происходить с металлом при коррозии? Коррозия причиняет огромный ущерб, и мы повседневно замечаем следы ее опустошительного действия. Только потери стали из-за коррозии во всем мире оцениваются в сотни миллиардов долларов в год. Помимо этого коррозия причиняет огромный не поддающийся учету ущерб, связанный с выходом из строя коррозирующих деталей, машин, оборудования и сооружений. А загрязнения окружающей среды, вызванные утечкой газа, нефти и других опасных веществ из трубопроводов из-за коррозии, что отрицательно воздействует на здоровье и жизнь людей.
В ноябре 2007 года в Керченском заливе во время сильного шторма затонуло 12 судов. Все они были насквозь проржавевшими. Один из них — танкер “Волгонефть-139” разломился пополам. В море вылилось 2000 т мазута. В результате погибло 35000 птиц, несколько десятков километров береговой линии оказались загрязненными. Предварительный ущерб равен 30 млрд. рублям. Самое страшное, что погибли люди. Причиной этого экологического бедствия явился не только шторм, но и человеческий фактор: такие суда нельзя допускать к эксплуатации!
Все они были насквозь проржавевшими. Один из них — танкер “Волгонефть-139” разломился пополам. В море вылилось 2000 т мазута. В результате погибло 35000 птиц, несколько десятков километров береговой линии оказались загрязненными. Предварительный ущерб равен 30 млрд. рублям. Самое страшное, что погибли люди. Причиной этого экологического бедствия явился не только шторм, но и человеческий фактор: такие суда нельзя допускать к эксплуатации!
Все осознают, что с коррозией надо бороться. А чтобы ее победить нужно, знать причины и механизмы ее протекания. Как вы думаете, почему металлы корродируют?
Ученики: Вероятно, металлы переходят в стабильное состояние, переходя в состав химических соединений, т.е. превращаются в ионы.
Учитель: Вы абсолютно правы, с химической точки зрения коррозией называют самопроизвольный процесс разрушения металлов и изделий из них под химическим воздействием окружающей среды, при этом металлы окисляются и переходят в устойчивые формы существования.
Учитель: Продолжит рассказ по теме, привлекая детей работать с рисунком учебника.
Учитель: Сделайте вывод об условии возникновения коррозии.
Ученики: Первое условие возникновения коррозии — это наличие окислителя в окружающей среде.
Учитель: Железо под воздействием O2 , H2О постепенно корродирует. Этот процесс является окислительно-восстановительным, где металл является восстановителем. Коррозия железа может быть описана упрощенным уравнением
4Fe + 3O2 + 6H2О = 4 Fe(OH) 3
Fe0-3е= Fe+3 восстановитель
O02+4 е=2O-2 окислитель
Учитель: В этих опытах мы выяснили роль кислорода воздуха в коррозии железа.
Реакция с медью (демонстрационный опыт)
Учитель: Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования основной гидрооксид меди
Запишем вывод: Кислород является одним из агрессивных факторов коррозии. При этом происходит химическая коррозия.
При этом происходит химическая коррозия.
Давайте дадим определение понятию “химическая коррозия”.
Обратитесь к записям, почему медь, железо корродируют?
Ученики: Окисляются кислородом. Вступают в химическую реакцию
Учитель: Какой процесс лежит в основе этого типа коррозии?
Ученики: Химическая реакция
Учитель: А теперь соедините все вместе, и получится понятие – химическая коррозия
Химическая коррозия — это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды .
Учитель: А подвергается ли коррозии алюминий? И каково значение этого процесса?
Многие металлы, в том числе и довольно активные (например, алюминий) при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха. Значит, этот процесс коррозии полезен.
При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха. Значит, этот процесс коррозии полезен.
4Al + 3O2 → 2 Al2O3
Учитель: Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования основной гидрооксид меди
Не потвергается коррозии химически чистое железо.
Более полутора тысяч лет назад в Индии была изготовлена железная колонна весом в 6,5 т, высотой 7,3 м, диаметром у основания 41,6 см, у верха 29,5 см, стоящая ныне на одной из площадей индийской столицы. Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии.
Ученики: Металлы – восстановители. Они могут только отдавать электроны. Значит Me0 – ne = Me+n
По характеру взаимодействия металла и среды коррозия бывает химическая и электрохимическая.
В обоих случаях протекает окислительно-восстановительная реакция, в ходе которой металл окисляется, а окислитель внешней среды – восстанавливается. Различие заключается в том, что при химической коррозии электроны переходят от металла к окислителю непосредственно, а при электрохимической коррозии окислительно-восстановительная реакция разбивается на полуреакции окисления и восстановления. Электроны переходят по металлу от восстановителя к окислителю. Поток электронов направлен от более активного металла (анод (+)) к менее активному металлу (катод (-)) и коррозии подвергается, более активный металл. Чем левее в ряду напряжений стоят металлы, тем выше скорость коррозии.
Разрушение металла без появления электрического тока, под действием среды – химическая коррозия.
К электрохимической относятся все случаи коррозии в среде электролита, она встречается значительно чаще
Выполнение лабораторного опыта (работав парах). ТБ.
ТБ.
Опыт 1. Коррозия в условии контакта разных металлов.
а) В две пробирки налейте по 2-3 мл 2н раствора соляной кислоты и внесите по одной грануле цинка. Наблюдайте выделение газа в пробирках.
б) В одну из пробирок введите медную проволоку, не касаясь кусочка цинка. Взаимодействует ли медь с кислотой?
В) Приведите медную проволоку в соприкосновение с цинком. Как изменилась скорость реакции? Обратите внимание на накопление пузырьков газа на поверхности медной проволоки. Объясните наблюдаемые явления.
Опыт 2. Влияние поверхности металла на скорость коррозии.
2) В две пробирки налейте по 1 мл раствора серной кислоты (1:5). Опустите в одну пробирку новую гранулу цинка, в другую – гранулу цинка, смоченную предварительно раствором медного купороса, т.е. загрязненную. Убедитесь, что металлы чистые и загрязненные корродируют с разной скоростью.
Опыт 3. Коррозия в среде электролита.
Налейте в пробирку 2 мл 2н раствора соляной кислоты и опустите в неё алюминиевую проволочку. Идёт реакция? Добавьте в пробирку небольшое количество кристаллического хлорида натрия. Запишите наблюдения. Сделайте вывод о влиянии стимулятора коррозии на скорость процесса.
А теперь давайте мы с вами вернемся к рассказу « Зов моря». И объясним причину разрушения корабля.
Итак, мы выяснили, что такое коррозия, в чем ее сущность, от чего зависит, знаем, что она приносит громадный ущерб человечеству. Осталось познакомиться со способами защиты от коррозии. Защита металлов от коррозии – очень важная задача.
Великий Гете сказал: «Просто знать – еще не все, знания нужно уметь использовать». Как защитить металлы от коррозии?
Способы защиты металлов от коррозии.
Учащимся даны задания. Необходимо представить способы защиты металла от коррозии, предоставленные на выставке.
Необходимо представить способы защиты металла от коррозии, предоставленные на выставке.
Задание группе:
Задание первой группе:
Рассмотрите образцы выданных вам металлических изделий, определите: какой основной способ защиты металла от коррозии применялся в этих случаях. (Изделия, покрытые неметаллической защитной пленкой).
Прочитайте в учебнике и приложении описание этого способа, определите его эффективность, с точки зрения экономиста и технолога.
Встречали ли вы этот способ защиты металлов у себя дома, в школе, на улице?
Приготовьте короткий рассказ об этом способе защиты для класса.
Рассмотрите образцы выданных вам металлических изделий, определите: какой основной способ защиты металла от коррозии применялся в этих случаях. (Изделия покрытые металлическими покрытиями)
Прочитайте в учебнике и приложении описание этого способа, определите его эффективность, с точки зрения экономиста и технолога.
Встречали ли вы этот способ защиты металлов у себя дома, в школе, на улице?
Приготовьте короткий рассказ об этом способе защиты для класса.
Все способы защиты металлов необходимо записать в конспект
Ученики: Записывают в опорный конспект
Нанесение на поверхность металлов защитных пленок: лака, краски, эмали,
Покрытие их слоем других металлов.
Использование нержавеющих сталей
Создание контакта с более активным металлом – протектором
Применение ингибиторов
Катодная защита
3 этап. Первичная проверка усвоения знаний.
Разбираем результаты демонстрационных опытов, записываем уравнения, рассматривая их как окислительно-восстановительные процессы (работа в группах), предоставляем результаты работы в группах. По окончании работы еще раз делаются выводы.
По окончании работы еще раз делаются выводы.
4 этап. Контроль знаний.
Что такое «коррозия»? Какие факторы способствуют замедлению коррозии металлов?
На стальной крышке поставлена медная заклепка. Что разрушится раньше – крышка или заклепка? Почему?
Какие виды коррозии вам известны?
Почему луженный (покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Какие факторы, способствуют усилению коррозии?
Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются Cu или Zn, Al или Fe? Почему?
Перечислите способы борьбы с коррозией?
Почему на оцинкованном баке на месте царапины цинк разрушается, а железо не ржавеет?
3. В домашней мастерской всегда много инструментов, запчастей и материалов, которые в основном изготовлены из металлов и их сплавов. Но вот беда — при хранении металлические изделия подвергаются коррозии. Укажите условия хранения металлических изделий, которые продлят срок их службы.
В домашней мастерской всегда много инструментов, запчастей и материалов, которые в основном изготовлены из металлов и их сплавов. Но вот беда — при хранении металлические изделия подвергаются коррозии. Укажите условия хранения металлических изделий, которые продлят срок их службы.
4.Требуется скрепить железные детали. Какими заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа? Ответ обоснуйте.
5.Как называются вещества, замедляющие коррозию?
6.Введение, каких элементов в сталь повышает ее коррозионную стойкость?
7.К стальному днищу машины была предложена протекторная защита. Какой металл для этого лучше применить: Zn, Cu или Ni?
8.Почему многие изделия быстрее корродирует вблизи предприятий?
9.Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
10. В стихотворении Вадима Шефнера « Пустырь» есть такие строчки:
В стихотворении Вадима Шефнера « Пустырь» есть такие строчки:
«Коррозия – рыжая крыса. Грызет металлический лом»
Что это за рыжая крыса? Всегда ли результат коррозии имеет рыжий цвет?
11.Как вы думаете, какие процессы могли привести к разрушению одно из «Семи чудес Света» Колосса Родосского, если он представлял собою гигантскую статую бога Солнца (Гелиоса), простоявшую всего 66 лет. Известно, что при создании его отпечатанные бронзовые листы были укреплены на железном каркасе? Почему следует учитывать местоположение Колосса (он был установлен на острове Родос в Средиземном море).
IV. Подведение итога урока
Итак, на сегодняшнем уроке мы с вами изучили один из важнейших вопросов химической промышленности – коррозию металлов. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить, на что и направлена современная химическая наука.
Рефлексия
Что нового вы узнали сегодня на уроке?
Где могут понадобиться полученные вами знания?
Что ещё Вы хотели бы узнать по этой теме?
Спасибо за урок. До свидания
IV. Подведение итогов урока, домашнее задание – 2 мин.
Д/з: §13, упр.1, 2,.
Химия коррозии железа по сути является электрохимической
Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , включите JS , чтобы это приложение заработало.
Получение изображения
Пожалуйста, подождите…
Предыдущий вопросСледующий вопрос
Вопрос :
Ответ :
Связанный ответ химия коррозии железа по существу является электрохимическим явлением. Объясните реакции, происходящие при коррозии железа в атмосфере.
Объясните реакции, происходящие при коррозии железа в атмосфере.
Другие вопросы и ответы по теме
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. 3
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 k ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. S HARES
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 k НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. ПОДЕЛИТЬСЯ 90 013
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ 9 0013
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3.0k НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. ПОДЕЛИТЬСЯ 90 013
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. НРАВИТСЯ
3,0 тыс. ПРОСМОТРОВ
1,5 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. ПОДЕЛИТЬСЯ
3,0 тыс. ПРОСМОТРОВ 9 0013
1.5k SHARES
Отказ от ответственности
Вопросы, размещенные на сайте, создаются исключительно пользователями , Doubtnut не владеет и не контролирует характер и содержание этих вопросов. Doubtnut не несет ответственности за какие-либо расхождения относительно дублирования контента по этим вопросам.
Коррозия – Химия
Электрохимия
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Давать определение коррозии
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии
Коррозия обычно определяется как разрушение металлов в результате электрохимического процесса. Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общая стоимость коррозии в Соединенных Штатах значительна и оценивается более чем в полтриллиона долларов в год.
Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общая стоимость коррозии в Соединенных Штатах значительна и оценивается более чем в полтриллиона долларов в год.
Статуя Свободы: изменение цвета
Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по высоте, осанке и уникальному сине-зеленому цвету ([ссылка]). Когда эта статуя была впервые доставлена из Франции, ее внешний вид не был зеленым. Он был коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно окислялась на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем к оксиду меди(II), который имеет черный цвет
\(\text{2Cu}\left(s\right)+\phantom{\rule{0. 2em}{0ex }}\frac{1}{2}{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{\rule{0.2em }{0ex}}{\text{Cu}}_{2}\text{O}\left(s\right)\phantom{\rule{5em}{0ex}}\left(\text{red}\right )\)
2em}{0ex }}\frac{1}{2}{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{\rule{0.2em }{0ex}}{\text{Cu}}_{2}\text{O}\left(s\right)\phantom{\rule{5em}{0ex}}\left(\text{red}\right )\)
\({\text{Cu}}_{2}\text{O}\left(s\right)+\phantom{\rule{0.2em}{0ex}}\frac{1}{ 2}\phantom{\rule{0.2em}{0ex}}{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{ \rule{0.2em}{0ex}}\text{2CuO}\left(s\right)\phantom{\rule{5em}{0ex}}\left(\text{black}\right)\)
Уголь, часто содержащий большое количество серы, широко сжигался в начале прошлого века. В результате триоксид серы, диоксид углерода и вода прореагировали с CuO
\(\text{2CuO}\left(s\right)+{\text{CO}}_{2}\left(g\ справа) + {\ текст {H}} _ {2} \ текст {O} \ влево (l \ вправо) \ фантом {\ правило {0.2em} {0ex}} ⟶ \ фантом {\ правило {0.2em} { 0ex}}{\text{Cu}}_{2}{\text{CO}}_{3}{\text{(OH)}}_{2}\left(s\right)\phantom{\rule {5em}{0ex}}\text{(зеленый)}\)
\(\text{3CuO}\left(s\right)+{\text{2CO}}_{2}\left(g\right ) + {\ text {H}} _ {2} \ text {O} \ left (l \ right) \ phantom {\ rule {0. 2em} {0ex}} ⟶ \ phantom {\ rule {0.2em} {0ex }}{\text{Cu}}_{2}{{\left(\text{CO}}_{3}\right)}_{2}{\text{(OH)}}_{2}\ влево (с \ вправо) \ фантом {\ правило {5em} {0ex}} \ текст {(синий)} \)
2em} {0ex}} ⟶ \ phantom {\ rule {0.2em} {0ex }}{\text{Cu}}_{2}{{\left(\text{CO}}_{3}\right)}_{2}{\text{(OH)}}_{2}\ влево (с \ вправо) \ фантом {\ правило {5em} {0ex}} \ текст {(синий)} \)
\(\text{4CuO}\left(s\right)+{\text{SO}}_{3}\left(g\right)+{\text{3H}}_{2}\text{ O}\left(l\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{\rule{0.2em}{0ex}}{\text{Cu}}_{4}{\text {SO}}_{4}{\text{(OH)}}_{6}\left(s\right)\phantom{\rule{5em}{0ex}}\text{(зеленый)}\)
Эти три соединения ответственны за характерную сине-зеленую патину, наблюдаемую сегодня. К счастью, образование патины создало на поверхности защитный слой, предотвращающий дальнейшую коррозию медной оболочки. Формирование защитного слоя — это форма пассивации, которая обсуждается далее в следующей главе. 9{\ текст {+}} \ влево (вода \ вправо) \)
Количество молекул воды различно, поэтому оно представлено как x . В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Как только краска царапается на окрашенной железной поверхности, возникает коррозия и начинает образовываться ржавчина. Скорость спонтанной реакции увеличивается в присутствии электролитов, таких как хлорид натрия, используемый на дорогах для растапливания льда и снега или в соленой воде.
Один из способов уберечь железо от коррозии — красить его. Слой краски предотвращает контакт воды и кислорода, необходимых для образования ржавчины, с железом. Пока краска остается неповрежденной, железо защищено от коррозии.
Другие стратегии включают сплав железа с другими металлами. Например, нержавеющая сталь — это в основном железо с небольшим количеством хрома. Хром имеет тенденцию собираться вблизи поверхности, где он образует оксидный слой, защищающий железо.
Оцинкованное или оцинкованное железо использует другую стратегию. Цинк легче окисляется, чем железо, потому что у цинка более низкий восстановительный потенциал. Поскольку цинк имеет более низкий восстановительный потенциал, он является более активным металлом. Таким образом, даже если цинковое покрытие поцарапается, цинк все равно окислится раньше железа. Это говорит о том, что этот подход должен работать и с другими активными металлами.
Таким образом, даже если цинковое покрытие поцарапается, цинк все равно окислится раньше железа. Это говорит о том, что этот подход должен работать и с другими активными металлами.
Еще одним важным способом защиты металла является использование его в качестве катода в гальваническом элементе. Это катодная защита, которую можно использовать не только для железа, но и для других металлов. Например, ржавчину подземных резервуаров и труб для хранения железа можно предотвратить или значительно уменьшить, соединив их с более активным металлом, таким как цинк или магний ([ссылка]). Это также используется для защиты металлических частей водонагревателей. Более активные металлы (с более низким восстановительным потенциалом) называются жертвенными анодами, поскольку они изнашиваются по мере их коррозии (окисления) на аноде. Защищаемый металл служит катодом и поэтому не окисляется (корродирует). Когда аноды должным образом контролируются и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Одним из способов защиты подземного резервуара для хранения железа является катодная защита. Использование активного металла, такого как цинк или магний, в качестве анода эффективно превращает резервуар для хранения в катод, предотвращая его коррозию (окисление).
Коррозия – это разрушение металла, вызванное электрохимическим процессом. Ежегодно тратятся большие суммы денег на устранение последствий коррозии или ее предотвращение. Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, образующийся на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо корродирует (образует ржавчину) при воздействии воды и кислорода. Ржавчина, образующаяся на железном металле, отслаивается, обнажая свежий металл, который также подвергается коррозии. Одним из способов предотвращения или замедления коррозии является нанесение покрытия на металл. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны, если их поцарапать. Оцинкованное или гальванизированное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк окислится раньше железа. Еще одним методом защиты металлов является катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (жертвенный анод), электрически соединяется с металлом, который необходимо защитить. Более активный металл является жертвенным анодом и является анодом в гальваническом элементе. «Защищенный» металл является катодом и остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны, если их поцарапать. Оцинкованное или гальванизированное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк окислится раньше железа. Еще одним методом защиты металлов является катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (жертвенный анод), электрически соединяется с металлом, который необходимо защитить. Более активный металл является жертвенным анодом и является анодом в гальваническом элементе. «Защищенный» металл является катодом и остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Какой член каждой пары металлов более подвержен коррозии (окислению)?
(a) Mg или Ca
(b) Au или Hg
(c) Fe или Zn
(d) Ag или Pt
Рассмотрим следующие металлы: Ag, Au, Mg, Ni и Zn. {° }=\text{−0,477 В}\right),\) и тем не менее, когда оба подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа плохая. Объясните это наблюдение.
{° }=\text{−0,477 В}\right),\) и тем не менее, когда оба подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа плохая. Объясните это наблюдение.
Если образец железа и образец цинка вступают в контакт, цинк подвергается коррозии, а железо — нет. Если образец железа соприкасается с образцом меди, железо подвергается коррозии, а медь — нет. Объясните это явление.
Оба примера включают катодную защиту. (Жертвенный) анод — это металл, который подвергается коррозии (окисляется или вступает в реакцию). В случае железа (-0,447 В) и цинка (-0,7618 В) цинк имеет более отрицательный стандартный восстановительный потенциал и поэтому служит анодом. В случае железа и меди (0,34 В) железо имеет меньший стандартный восстановительный потенциал и поэтому подвергается коррозии (служит анодом). 9{°}=\text{−3,04 В},\), который, по-видимому, способен защитить все другие металлы, перечисленные в стандартной таблице потенциалов восстановления?
Хотя восстановительный потенциал лития делает его способным защищать другие металлы, этот высокий потенциал также свидетельствует о том, насколько реактивным является литий; у него будет спонтанная реакция с большинством веществ.
