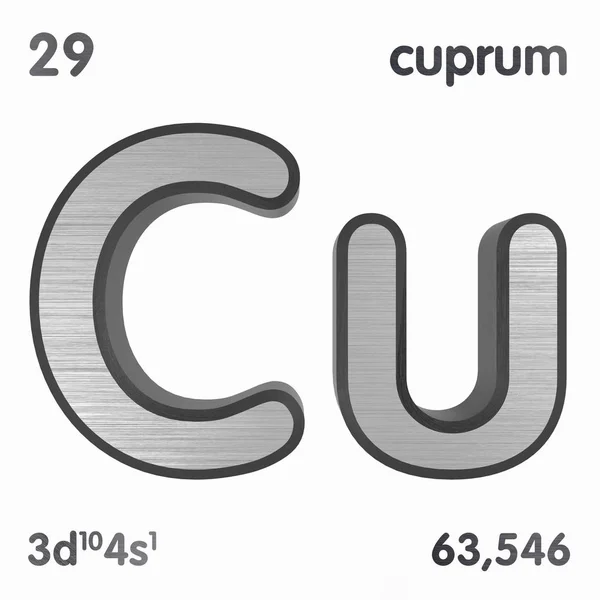
Купрум химия: Что такое купрум в химии? | Ответ на вопрос
Содержание
Медь сернокислая 5-водная Ч — База химической продукции Югреактив
Главная»В помощь технологу»Химическая продукция»Реактивная продукция»Медь сернокислая 5-водная Ч
Медь сернокислая (II) 5-водная
Синонимы: Медь (II) сульфат пятиводная, Медь сернокислая (II) пентагидрат, медный купорос, сульфат меди
Мы предлагаем Медь сернокислую, медь сульфат 5-водную по выгодным ценам с доставкой по всей России.
Спецификация | |
|---|---|
Молекулярный вес | 249,68 |
Плотность | 2,29 г/см3 (20°C) |
Температура плавления | 110С |
Медь сернокислая, «ч» | % |
Основное вещ-во, не менее | 98,5 % |
Нерастворимых в воде веществ, не более | 0,008 % |
Содержание CL, не ,более | 0,005 % |
Содержание N общ. | 0,008 % |
Содержание Fe, не более | 0,02 % |
Содержание SO4, не более | 0,2 % |
Медь сернокислая, «чда» | % |
Основное вещ-во, не менее | 99,0 % |
Содержание меди (Cu), не менее | 25,0 % |
Нерастворимых в воде веществ, не более | 0,005 % |
Содержание хлоридов (CL), не более | 0,001 % |
Содержание N общ., не более | 0,001 % |
Содержание Fe, не более | 0,005 % |
Содержание Pb, не более | 0,005 % |
Содержание Sb, не более | 0,006 % |
Содержание Ni, не более | 0,0005 % |
Содержание Zn, не более | 0,002 % |
Медь сернокислая (II) 5-водная или ее также называют медный купорос, сульфат меди — это синий кристаллический порошок, растворимый в воде, разбавленном спирте и концентрированной соляной кислоте, выветривающиеся на воздухе, легко образует основные сульфаты, двойные соли (шёниты), аммиакаты.
Медь сернокислая (II) 5-водная встречается в природе в виде минералов халькокианита CuSO4, халькантита CuSO4.5h3O, бонаттита CuSO4.3Н2О, бутита CuSO4.7Н2О, брошантита CuSO4.3Сu(ОН)2 и др.
Получение
Медь сернокислую, медный купорос получают в промышленности
• растворением меди и медных отходов в разбавленной серной кислоте при продувании воздуха;
• растворением CuO в серной кислоте;
• сульфатизирующим обжигом сульфидов меди;
• как побочный продукт электролитического рафинирования меди и др.
Применение сульфата меди
Медь сернокислая или Медь (II) сульфат пятиводная широко используют
• как протраву при крашении текстильных материалов,
• для усиления и тонирования отпечатков в фотографии;
• для протравливания семян,
• в гальванотехнике,
• Медный купорос марок «Ч» и «ЧДА» успешно используется в сельском хозяйстве как средство защиты плодово-ягодных, фруктовых, овощных растений и городских зеленых насаждений, то есть как фунгицид; для приготовления добавок вносимых в почву и кормовых добавок для домашних и сельскохозяйственных животных, премиксов, для приготовления бордоской жидкости и бургундской смеси. Возможно применение медного купороса при обработке зерновых культур в процессе хранения и протравке семян перед посевом для уничтожения спор плесневых грибов и др.
Возможно применение медного купороса при обработке зерновых культур в процессе хранения и протравке семян перед посевом для уничтожения спор плесневых грибов и др.
200. Медь. (Cuprum). . Общая химия
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком.
В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80 % всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск, Cu2S; халькопирит, или медный колчедан, CuFeS2; малахит (CuOH)2CO3.
— 553 —
В СССР богатые месторождения медных руд находятся на Урале, в Казахстане и в Закавказье.
Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать ряды с небольшим содержанием меди.
Выплавка меди из ее сульфидных руд или концентратов представляет собою сложный процесс. Обычно он слагается из следующих операций: обжиг, плавка, конвертирование, огневое и электролитическое рафинирование. В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3. Газы, отходящие при обжиге, содержат SO2 и используются для получения серной кислоты.
Получающиеся в ходе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Основной же продукт плавки — жидкий штейн (Cu2S с примесью FeS) поступает в конвертор, где через пего продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая, или сырая, медь.
Основной же продукт плавки — жидкий штейн (Cu2S с примесью FeS) поступает в конвертор, где через пего продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая, или сырая, медь.
Для извлечения ценных спутников ( Au, Ag, Te и др.) и для удаления вредных примесей черновая медь подвергается огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании (см. § 103).
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3. При нагревании на воздухе в интервале температур 200-375°C медь окисляется до черного оксида меди (II) CuO. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди (II), а внутренний — красный оксид меди (I). Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3. При нагревании на воздухе в интервале температур 200-375°C медь окисляется до черного оксида меди (II) CuO. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди (II), а внутренний — красный оксид меди (I). Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п.
Широкое применение в машиностроительной промышленности, а также в электротехнике и других производствах имеют различные сплавы меди с другими металлами. Важнейшими из них являются латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
Важнейшими из них являются латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
— 554 —
Латуни содержат до 45% цинка. Различают простые и специальные латуни. В состав последних, кроме меди и цинка, входят другие элементы, например железо, алюминий, олово, кремний. Латуни находят разнообразное применение. Из них изготовляют трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Некоторые специальные латуни обладают высокой коррозионной стойкостью в морской воде и применяются в судостроении. Латунь с высоким содержанием меди — томпак — благодаря своему внешнему сходству с золотом используется для ювелирных и декоративных изделий.
Медноникелевые сплавы подразделяются на конструкционные и электротехнические. К конструкционным относятся мельхиоры и нейзильберы. Мельхиоры содержат 20-30% никеля и небольшие количества железа и марганца, а нейзильберы 5-35% никеля и 13-45% цинка. Благодаря стойкости против коррозии в воде, в том числе в морской, конструкционные медноникелевые сплавы получили широкое распространение в судостроении и в энергетической промышленности. Из них изготовляют радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской. К электротехническим медноникелевым сплавам относятся константан (40% Ni, 1.5% Mn) и манганин (3% Ni, 12% Mn), обладающие низким температурным коэффициентом электросопротивления и служащие для изготовления магазинов сопротивления, а также копель (43% Ni, 0.5% Mn), применяемый для изготовления термопар.
Из них изготовляют радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской. К электротехническим медноникелевым сплавам относятся константан (40% Ni, 1.5% Mn) и манганин (3% Ni, 12% Mn), обладающие низким температурным коэффициентом электросопротивления и служащие для изготовления магазинов сопротивления, а также копель (43% Ni, 0.5% Mn), применяемый для изготовления термопар.
Бронзы подразделяются по основному входящему в их состав компоненту (кроме меди) на оловянные, алюминиевые, кремнистые и др. Из них оловянные представляют собой самые древние сплавы. На протяжении столетий они занимали ведущее место во многих отраслях производства. Сейчас применение их в машиностроении сокращается. Более широко применяются алюминиевые бронзы (5-10% Al и добавки Fe, Mn, Ni). Бериллиевые бронзы очень прочны и применяются для изготовления пружин и других ответственных деталей.
Все медные сплавы обладают высокой стойкостью против атмосферной коррозии.
В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным мором образует хлорид CuCl2. О взаимодействии меди с кислородом воздуха говорилось выше, При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют.
— 555 —
Однако в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
Летучие соединения меди окрашивают несветящее пламя газовой горелки в сине-зеленый цвет.
Известны соединения, в которых медь имеет степень окисленности один, два и три. Их можно рассматривать как производные соответствующих оксидов: Cu2O, CuO и Cu2O3.
Соединения меди(I), в общем, менее устойчивы, чем соединения меди(II). Оксид Cu2O3 и его производные весьма нестойки.
Оксид Cu2O3 и его производные весьма нестойки.
Соединения меди(I).
Оксид меди(I), или закись меди, Cu2O встречается в природе в виде минерала куприта. Искусственно она может быть получена путем нагревания раствора соли меди(II) со щелочью и каким-нибудь сильным восстановителем, например формалином или глюкозой. При нагревании образуется осадок красного оксида меди(I).
В паре с металлической медью Cu2O применяется в купроксных выпрямителях переменного тока.
При действии на Cu2O соляной кислоты получается бесцветный раствор хлорида меди(I) CuCl. Если разбавить этот раствор водой, то хлорид меди(I) выпадает в виде белого творожистого осадка, нерастворимого в воде. Он может быть получен также кипячением раствора хлорида меди (II) CuCl2 с металлической медью в солянокислой среде:
Соединения меди(II).
Оксид меди(II), или окись меди, CuO — черное вещество, встречающееся в природе (например, в виде минерала тенорита). Его можно легко получить прокаливанием карбоната гидроксомеди(II) (CuOH)2CO3 или нитрата меди(II) Cu(NO3)2. Оксид меди(II) проявляет окислительные свойства. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Его можно легко получить прокаливанием карбоната гидроксомеди(II) (CuOH)2CO3 или нитрата меди(II) Cu(NO3)2. Оксид меди(II) проявляет окислительные свойства. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Гидроксид меди(II) Cu(OH)2 осаждается из растворов солей меди(II) в виде голубой студенистой массы при действии щелочей. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди(II).
Гидроксид меди(II) Cu(OH)2 — очень слабое основание. Поэтому растворы солей меди(II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Важнейшими из солей меди(II) являются следующие.
Сульфат меди(II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет.
— 556 —
Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди(II), если только они не содержат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы. В таком виде он называется медным купоросом (см. стр. 376).
Хлорид меди(II) CuCl2·2H2O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди(II) имеют зеленый цвет, разбавленные — сине-голубой.
Нитрат меди(II) Cu(NO3)2·3H2O. Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди(II).
Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди(II).
Карбонат гидроксомеди(II) (CuOH)2CO3. Встречается в природе в виде минерала малахита, имеющего красивый изумруднозеленый цвет. Искусственно приготовляется действием Na2CO3 на растворы солей меди(II):
Применяется для получения хлорида меди(II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди(II) Cu(CH3COO)2·2H2O. Получается обработкой металлической меди или оксида меди(II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Смешанный ацетат-арсенит меди(II) Cu(CH3COO)2·Cu3(AsO3)2. Применяется под названием париэюская зелень для уничтожения вредителей растений.
Применяется под названием париэюская зелень для уничтожения вредителей растений.
Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зеленых, синих, коричневых, фиолетовых и черных. Все соли меди ядовиты, поэтому медную посуду лудят, т. е. покрывают внутри слоем олова, чтобы предотвратить возможность образования медных солей.
Комплексные соединения меди. Характерное свойство двухзарядных ионов меди — их способность соединяться с молекулами аммиака с образованием комплексных ионов.
Если к раствору сульфата меди приливать раствор аммиака, то выпадает голубой осадок основной соли, который легко растворяется в избытке аммиака, окрашивая жидкость в интенсивный синий цвет. Прибавление щелочи к полученному раствору не вызывает образования осадка гидроксида меди Cu(OH)2 следовательно, в этом растворе так мало ионов Cu2+, что даже при большом количестве ионов ОН- не достигается произведение растворимости Cu(OH)2.
— 557 —
Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами ОН-. В то же время ионы SO42- остаются неизмененными, так как прибавление к аммиачному раствору хлорида бария тотчас же вызывает образование осадка сульфата бария (характерная реакция на SO42-).
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных ионов [Cu(NH3)4]2+, образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы [Cu(NH3)4]2+ связываются с ионами SO42- и из раствора выделяются темносиние кристаллы, состав которых выражается формулой [Cu(NH3)4]SO4·H2O.
Таким образом, при взаимодействии сульфата меди(II) с аммиаком происходит реакция
или в ионной форме:
Ионы, которые, подобно [Cu(NH3)4]2+, образуются путем присоединения к данному иону нейтральных молекул или ионов противоположного знака, называются комплексными ионами. Соли, в состав которых входят такие ионы, получили название комплексных солей. Известны также комплексные кислоты, комплексные основания и комплексные неэлектролиты.
Соли, в состав которых входят такие ионы, получили название комплексных солей. Известны также комплексные кислоты, комплексные основания и комплексные неэлектролиты.
При написании формул комплексный ион обычно заключают в квадратные скобки. Этим отмечается, что при растворении данного соединения в воде комплексный ион практически не диссоциирует.
Подобно сульфату меди(II) реагируют с аммиаком и другие соли двухвалентной меди. Во всех этих случаях получаются темносиние растворы, содержащие комплексные ионы [Cu(NH3)4]2+.
Гидроксид меди(II) тоже растворяется в аммиаке с образованием темно-синего раствора, содержащего ионы [Cu(NH3)4]2+:
Получающийся раствор обладает способностью растворять целлюлозу (вату, фильтровальную бумагу и т. п.) и применяется при изготовлении одного из видов искусственного волокна (см. стр. 480).
Гидроксид меди (II) растворяется также в очень концентрированных растворах щелочей, образуя сине-фиолетовые растворы купритов — солей, содержащих комплексный ион [Cu(OH)4]2-
— 558 —
или в ионной форме:
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы OH-, вследствие чего образуются комплексные анионы, а не катионы. Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди(II) в осадок.
Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди(II) в осадок.
Из других комплексных анионов меди (II) отметим ионы [CuCl4]2-, образующиеся в концентрированных растворах хлорида меди(II) и обусловливающие их зеленую окраску:
При разбавлении растворов водой ионы [CuCl4]2- превращаются в обычные гидратированные ионы меди [Cu(H2O)4]2+ и зеленая окраска растворов переходит в сине-голубую:
Медь принадлежит к числу микроэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для нормальной жизнедеятельности растений. Микроэлементы повышают активность ферментов, способствуют синтезу сахара, крахмала, белков, нуклеиновых кислот, витаминов и ферментов. Микроэлементы вносят в почву с микроудобрениями. Удобрения, содержащие медь, способствуют росту растений на некоторых малоплодородных почвах, повышают их устойчивость против засухи, холода и некоторых заболеваний.
Химия меди — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3722
- Джим Кларк
- Школа Труро в Корнуолле
Медь относится к тому же семейству периодической таблицы, что и серебро и золото, поскольку у каждого из них есть один s-орбитальный электрон поверх заполненной электронной оболочки, которая образует металлические связи. Это сходство электронной структуры делает их похожими по многим характеристикам. Все они обладают очень высокой тепло- и электропроводностью и являются ковкими металлами. Среди чистых металлов при комнатной температуре медь имеет вторую по величине электрическую и теплопроводность после серебра.
Среди чистых металлов при комнатной температуре медь имеет вторую по величине электрическую и теплопроводность после серебра.
Введение
Использование меди восходит к глубокой истории. Медные бусы были найдены на территории современного Ирака, датируемого 9000 годом до нашей эры. Металл относительно легко добывать и очищать, что способствует его раннему и широкому использованию. Однако, будучи мягким, он непригоден для изготовления надежных инструментов и оружия. Первые кузнецы еще за 3000 лет до нашей эры научились сочетать медь с другими металлами для получения более прочных сплавов. Латунь (медь и цинк) и бронза (медь и олово) являются двумя примерами. Символ и название меди происходят от латинского 9.0036 cuprum , что буквально означает «с острова Кипр», ранний источник медной руды.
До 1982 года пенни США были из чистой меди. Теперь они в основном цинковые с тонкой оболочкой из меди. Большая часть добываемой сегодня меди очищается и вытягивается в проволоку для использования в электротехнической промышленности. Значительная часть также используется в производстве водопроводных труб. Медь, конечно же, имеет характерный цвет, который знаком большинству людей. Он является одним из лучших электрических проводников и устойчив к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватое покрытие или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Значительная часть также используется в производстве водопроводных труб. Медь, конечно же, имеет характерный цвет, который знаком большинству людей. Он является одним из лучших электрических проводников и устойчив к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватое покрытие или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Залежи и извлечение меди
Медь встречается как в связанном, так и в свободном состоянии, а также во многих рудах. Важными рудами меди являются медный пирит (\(CuFeS_2\)), куприт и медный глянец. Медные руды в основном находятся на севере Индии. Извлечение меди также включает в себя множество стадий. Руда, используемая для добычи, представляет собой медный колчедан, который измельчается, концентрируется и затем нагревается в присутствии воздуха. При нагревании влага удаляется, а колчедан меди превращается в сульфид железа и сульфид меди.
\[ 2CuFeS_2 + O_2 \rightarrow Cu_2S + 2FeS + SO_2 \]
Доменная печь предназначена для нагрева смеси обожженной руды, порошкообразного кокса и песка. В доменной печи происходят реакции окисления. Сульфид железа образует оксид железа, который соединяется с кремнеземом и образует шлак (\(FeSiO_2\)).
\[ 2FeS + 3O_2 \rightarrow 2FeO + 2SO_2\]
\[ FeO + SiO_2 \rightarrow FeSiO_3\]
Сульфид меди образует закись меди, которая частично превращается в сульфид меди.
\[ Cu_2S + 3 O_2 \rightarrow 2Cu_2O + 2SO_2\]
\[ Cu_2O + FeS \rightarrow Cu_2S + FeO\]
Этот сульфид меди содержит некоторое количество сульфида железа и называется штейном. Штейн удаляют из основного выхода доменной печи. Удаленный штейн переводится в бессемеровский конвертер, который внутри футерован оксидом магния. Этот преобразователь имеет трубы, через которые подается горячий воздух и \(SiO_2\). В этом конвертере \(Cu_2S\) преобразуется в \(Cu_2O\), а \(FeS\) превращается в \(FeO\). Закись железа образует шлак с \(SiO_2\). Образующийся оксид меди реагирует с Cu2S и образует медь.
Закись железа образует шлак с \(SiO_2\). Образующийся оксид меди реагирует с Cu2S и образует медь.
\[ 2Cu_2O + Cu_2S \rightarrow 6Cu + SO_2\]
Образовавшуюся медь необходимо очистить электролизом.
Реакции ионов меди(II) в растворе
Простейшим ионом, который медь образует в растворе, является типичный синий ион гексааквамеди(II) — [Cu(H 2 O) 6 ] 2+ .
Реакции ионов гексааквамеди(II) с ионами гидроксида
Ионы гидроксида (например, из раствора гидроксида натрия) удаляют ионы водорода из водных лигандов, присоединенных к иону меди. Как только ион водорода был удален из двух молекул воды, у вас остался комплекс без заряда — нейтральный комплекс. Он нерастворим в воде, и образуется осадок.
Цветовая маркировка показывает, что это не реакция обмена лиганда. Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе.
В пробирке изменение цвета:
Реакции ионов гексааквамеди(II) с раствором аммиака
Аммиак действует как основание и как лиганд. При небольшом количестве аммиака ионы водорода отрываются от гексааква-иона точно так же, как и в случае с гидроксид-ионом, с образованием того же нейтрального комплекса. 9{2+} + H_2O\]
При небольшом количестве аммиака ионы водорода отрываются от гексааква-иона точно так же, как и в случае с гидроксид-ионом, с образованием того же нейтрального комплекса. 9{2+} + H_2O\]
Примечание
Вы можете удивиться, почему это второе уравнение дается исходя из исходного гексаакваиона, а не нейтрального комплекса. Объяснить, почему осадок снова растворяется, довольно сложно. Полное объяснение вы найдете на странице о реакциях между ионами гексааква и раствором аммиака.
Изменения цвета:
Реакция ионов гексааквамеди(II) с ионами карбоната
Вы просто получаете осадок того, что вы можете представить как карбонат меди(II). 9{2-} + 6H_2O\]
Поскольку реакция обратима, вы получаете смесь цветов из-за обоих комплексных ионов. Цвет иона тетрахлоркупрата (II) можно также описать как оливково-зеленый или желтый. Если к зеленому раствору добавить воду, он снова станет синим.
Реакция ионов гексааквамеди(II) с ионами йодида
Ионы меди(II) окисляют ионы йода до молекулярного йода, и в процессе сами восстанавливаются до йодида меди(I).
9- (aq)\]
Когда раствор тиосульфата натрия вливается из бюретки, окраска йода тускнеет. Когда почти все кончится, добавьте немного раствора крахмала. Он обратимо реагирует с йодом, образуя темно-синий комплекс крахмал-йод, который гораздо легче увидеть.
Медленно добавляйте последние несколько капель раствора тиосульфата натрия, пока не исчезнет синяя окраска. Если вы проследите пропорции реакции с помощью двух уравнений, вы обнаружите, что на каждые 2 моля ионов меди (II), с которыми вы должны были начать, вам нужно 2 моля раствора тиосульфата натрия. Зная концентрацию раствора тиосульфата натрия, легко рассчитать концентрацию ионов меди(II).
Некоторые важные химические вещества меди(I)
Диспропорционирование ионов меди(I) в растворе
Химия меди(I) ограничивается реакцией, которая протекает с участием простых ионов меди(I) в растворе. Это хороший пример диспропорционирования — реакции, при которой что-то окисляется и восстанавливается. Ионы меди (I) в растворе диспропорционируют с образованием ионов меди (II) и осадка меди. Реакция:
Ионы меди (I) в растворе диспропорционируют с образованием ионов меди (II) и осадка меди. Реакция:
Любая попытка получить простое соединение меди(I) в растворе приводит к этому. Например, если вы взаимодействуете с оксидом меди (I) с горячей разбавленной серной кислотой, вы можете ожидать получения раствора сульфата меди (I) и воды. На самом деле вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования.
\[ Cu_2O + H_2SO_4 \rightarrow Cu + CuSO_4 + H_2O\]
Стабилизация степени окисления меди(I)
Мы уже видели, что йодид меди(I) образуется в виде не совсем белого осадка, если добавить раствора иодида калия в раствор, содержащий ионы меди(II). Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Точно так же хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Образование комплексов меди(I) (кроме комплексов с водой в качестве лиганда) также стабилизирует степень окисления меди(I). Например, оба [Cu(NH 3 ) 2 ] + и [CuCl 2 ] — представляют собой комплексы меди (I), которые не диспропорционируют . Хлорсодержащий комплекс образуется при растворении оксида меди(I) в концентрированной соляной кислоте. Вы можете представить, что это происходит в два этапа. Сначала образуется хлорид меди(I): 9-_{(aq)}\]
Вы можете получить белый осадок хлорида меди(I) (упомянутый выше), добавив к этому раствору воду. Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
Авторы и авторство
Эта страница под названием «Химия меди» распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.
- Теги
- медь
- медный пирит
- замена лиганда
Расчет на медь | Природа Химия
Расчет на медь
Скачать PDF
Ваша статья скачана
Карусель с тремя слайдами одновременно. Используйте кнопки «Назад» и «Далее» для перехода по трем слайдам за раз или кнопки с точками в конце для перехода по трем слайдам за раз.
Используйте кнопки «Назад» и «Далее» для перехода по трем слайдам за раз или кнопки с точками в конце для перехода по трем слайдам за раз.
Скачать PDF
- Опубликовано:
- Тибериу Г. Мога 1
Химия природы
том 4 , страница 334 (2012)Процитировать эту статью
5862 Доступ
8 Цитаты
28 Альтметрический
Сведения о показателях
Предметы
- Неорганическая химия
Медь, обычно встречающаяся в повседневной жизни, на первый взгляд может показаться немного неинтересной. Tiberiu G. Moga рассказывает, как наука, тем не менее, не пренебрегла своим обещанием.
Tiberiu G. Moga рассказывает, как наука, тем не менее, не пренебрегла своим обещанием.
Предыстория © GETTY IMAGES
В конце финского эпоса « Калевала » герой Вяйнямёйнен отправляется в небеса, покидая царство смертных на медной лодке. Современные инженеры, кажется, приняли это близко к сердцу: корпуса кораблей облицованы материалами на основе меди, которые подавляют рост бактерий, ракушек и других нежелательных пассажиров. Сосуд Вяйнямёйнена — лишь один из примеров того, как красновато-коричневый блеск меди на протяжении всей истории стимулировал человеческое воображение.
Древним римлянам медь была известна как cuprum в связи с островом Кипр, где добывалась большая часть меди. В настоящее время слово «медь» обычно вызывает в воображении видения копеек, электропроводки или, возможно, Статуи Свободы, которая обязана своим зеленым цветом карбонату меди (II). Но, несмотря на свое, казалось бы, ничем не примечательное присутствие в повседневной жизни, медь постоянно играет активную роль в науке благодаря своим жизненно важным биологическим функциям и разнообразным химическим свойствам. Универсальность меди во многом обусловлена ее способностью осуществлять три различных химических процесса: катализ кислотой Льюиса, процессы с переносом одного электрона и реакции с переносом двух электронов.
Универсальность меди во многом обусловлена ее способностью осуществлять три различных химических процесса: катализ кислотой Льюиса, процессы с переносом одного электрона и реакции с переносом двух электронов.
При кислотном катализе Льюиса ионы Cu + или Cu 2+ объединяют разные молекулы и облегчают химическую реакцию между ними. Известным примером является катализируемое медью циклоприсоединение азид-алкин, известное как клик-химия. В этой реакции один из исходных материалов помечен азидным фрагментом, тогда как другой несет алкиновую группу; два из них сначала координируются с медью, затем ковалентно связываются друг с другом с образованием триазольного кольца 1 . Ни один переходный металл не является столь же эффективным катализатором, как медь, для этой стадии. Благодаря своей надежности и высокой селективности эта клик-реакция широко используется от полного синтеза природных продуктов и их производных до получения и модификации полимеров.
Другим примером катализа кислотой Льюиса, опосредованного ионами меди, является синтез циклических пептидов — класса соединений с многочисленными биологическими приложениями. Например, циклоспорин А и грамицидин S являются антибиотиками; октреотид и кальцитонин действуют на эндокринную систему; а эптифибатид помогает предотвратить образование тромбов и инсульты. Благодаря своему положительному заряду Cu 2+ (наряду с другими ионами) способен связываться с электронными парами атомов кислорода, азота и серы линейных предшественников пептидов, тем самым изгибая их в изогнутые формы, которые легче образуют замкнутые кольцевые структуры 2 .
Механически более сложные, чем кислотный катализ Льюиса, процессы переноса одного электрона, осуществляемые медью — чередование ее форм Cu + и Cu 2+ — незаменимы в биологии. В клеточном дыхании, при котором организм извлекает энергию из глюкозы, участвуют медьсодержащие ферменты митохондриальной мембраны.![]() Эти ферменты окисляют глюкозу и восстанавливают кислород посредством ступенчатого одноэлектронного переноса, также образуя в процессе воду.
Эти ферменты окисляют глюкозу и восстанавливают кислород посредством ступенчатого одноэлектронного переноса, также образуя в процессе воду.
Другие ферменты, которые осуществляют медь-опосредованный перенос одного электрона, включают несколько менее известные, но также важные супероксиддисмутазу и тирозиназу 3 . Супероксиддисмутаза на основе меди и цинка защищает клетки от активных форм кислорода, превращая их в менее токсичную молекулу перекиси водорода, которая впоследствии сама превращается в кислород и воду. Медьсодержащая тирозиназа превращает тирозин в L-дофа, предшественник гормона адреналина, который опосредует реакцию «бей или беги» при остром стрессе. L-допа также используется для лечения болезни Паркинсона; он метаболизируется до дофамина, который обеспечивает связь между нервными клетками головного мозга.
Последним типом распространенного медного катализа являются реакции переноса двух электронов, также называемые реакциями сочетания, которые происходят в три этапа: окислительное присоединение, трансметаллирование и восстановительное отщепление. Сначала Cu(0) разрывает связь углерод-галоген с образованием связи углерод-медь и медь-галоген, при этом окисляясь до Cu 2+ . Затем ион галогенида вытесняется из центра металлической меди нуклеофилом или другой входящей группой. Наконец, связи углерод-медь и медь-нуклеофил расщепляются с образованием связи углерод-нуклеофил, и катализатор Cu(0) регенерируется 4 .
Сначала Cu(0) разрывает связь углерод-галоген с образованием связи углерод-медь и медь-галоген, при этом окисляясь до Cu 2+ . Затем ион галогенида вытесняется из центра металлической меди нуклеофилом или другой входящей группой. Наконец, связи углерод-медь и медь-нуклеофил расщепляются с образованием связи углерод-нуклеофил, и катализатор Cu(0) регенерируется 4 .
Реакции сочетания были впервые популяризированы с использованием палладиевых катализаторов и принесли Хеку, Негиши и Судзуки Нобелевскую премию по химии 2010 года. Эти реакции в настоящее время находят широкое применение в синтезе лекарств и, скорее всего, будут продолжать привлекать внимание. В качестве катализатора медь дает хорошие выходы в мягких условиях реакции и относительно устойчива к ядам, которые могут разрушить другие катализаторы, что делает ее желательной альтернативой палладию.
От синтеза фармпрепаратов до проектирования новых структур в нанотехнологиях 5 , медь постоянно открывается заново в качестве катализатора и универсального строительного блока. Эта тенденция не собирается ослабевать, что, возможно, свидетельствует о том, что использование меди может быть ограничено только чьей-то фантазией.
Эта тенденция не собирается ослабевать, что, возможно, свидетельствует о том, что использование меди может быть ограничено только чьей-то фантазией.
Это эссе было выбрано победителем нашего конкурса писателей, см.
http://go.nature.com/oi187X
Ссылки
Adzima, B.J. et al. Природа Хим. 3 , 256–259 (2011).
Артикул
КАСGoogle Scholar
White, C.J. & Yudin, A.K. Nature Chem. 3 , 509–524 (2011).
Артикул
КАСGoogle Scholar
Липпард, С.Дж. и Берг, Дж.М. Принципы бионеорганической химии (Университетские научные книги, 1994).
Google Scholar
Кар, А. и др.


 , не более
, не более