Масса алюминий: Молярная масса алюминия (Al), формула и примеры
Содержание
Что такое алюминий
Лёгкий, прочный, стойкий к коррозии и функциональный – именно это сочетание качеств сделало алюминий главным конструкционным материалом нашего времени. Алюминий есть в домах, в которых мы живем, автомобилях, поездах и самолетах, на которых мы преодолеваем расстояния, в мобильных телефонах и компьютерах, на полках холодильников и в современных интерьерах. А ведь еще 200 лет назад об этом металле мало что было известно.
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия.
Первые два относятся к корундам – это оксид алюминия (Al2O3) в кристаллической форме. Он обладает природной прозрачностью, а по прочности уступает только алмазам. Пуленепробиваемые стекла, иллюминаторы в самолетах, экраны смартфонов производятся именно с применением сапфира.
А один из менее ценных минералов корунда – наждак используется как абразивный материал, в том числе для создания наждачной бумаги.
На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
Ханс Кристиан Эрстед (1777–1851) – датский физик, почетный член Петербургской академии наук (1830). Родился в городе Рудкёрбинге в семье аптекаря. В 1797 году окончил Копенгагенский университет, в 1806 – стал профессором.
Но каким бы распространенным ни был алюминий, его открытие стало возможным только, когда в распоряжении ученых появился новый инструмент, позволяющий расщеплять сложные вещества на простые, – электрический ток.
И в 1824 году с помощью процесса электролиза датский физик Ханс Кристиан Эрстед получил алюминий. Он был загрязнен примесями калия и ртути, задействованных в химических реакциях, однако это был первый случай получения алюминия.
Используя электролиз, алюминий производят и в наши дни.
Сырьем для производства алюминия сегодня служит еще одна распространенная в природе алюминиевая руда – бокситы. Это глинистая горная порода, состоящая из разнообразных модификаций гидроксида алюминия с примесью оксидов железа, кремния, титана, серы, галлия, хрома, ванадия, карбонатных солей кальция, железа и магния – чуть ли не половины таблицы Менделеева. В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
Бокситы в 1821 году открыл геолог Пьер Бертье на юге Франции. Порода получила свое название в честь местности Ле-Бо (Les Baux), где была найдена. Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – в Гвинее, Австралии, Вьетнаме, Бразилии, Индии и на Ямайке.
Из бокситов получают глинозем. Это оксид алюминия Al2O3, который имеет форму белого порошка и из которого путем электролиза на алюминиевых заводах производят металл.
Производство алюминия требует огромного количества электроэнергии. Для производства одной тонны металла необходимо около 15 МВт*ч энергии – столько потребляет 100-квартирный дом в течение целого месяца.Поэтому разумнее всего строить алюминиевые заводы поблизости от мощных и возобновляемых источников энергии. Самое оптимальное решение – гидроэлектростанции, представляющие самый мощный из всех видов «зеленой энергетики».
Свойства алюминия
Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
В три раза легче железа
Сравним по прочности со сталью
Поддается всем видам механической обработки
Тонкая оксидная пленка защищает от коррозии
Алюминий легко обрабатывается давлением, причем как в горячем, так и в холодном состоянии. Он поддается прокатке, волочению, штамповке. Алюминий не горит, не требует специальной окраски и не токсичен в отличие от пластика.
Очень высока ковкость алюминия: из него можно изготовить листы толщиной всего 4 микрона и тончайшую проволоку. А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
Высокая способность к образованию соединений с различными химическими элементами породила множество сплавов алюминия. Даже незначительная доля примесей существенно меняет характеристики металла и открывает новые сферы для его применения. Например, сочетание алюминия с кремнием и магнием в повседневной жизни можно встретить буквально на дороге – в форме литых колесных дисков, двигателей, в элементах шасси и других частей современного автомобиля. А если добавить в алюминиевый сплав цинк, то, возможно, вы сейчас держите его в руках, ведь именно этот сплав используется при производстве корпусов мобильных телефонов и планшетов. Тем временем ученые продолжают изобретать новые и новые алюминиевые сплавы.
Сегодня существование строительной, автомобильной, авиационной, космической, электротехнической, энергетической, пищевой и других отраслей промышленности невозможно без алюминия. Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Если заменить всю медную проводку в автомобиле
на алюминиево-циркониевую, то его общий
вес уменьшится на 12 кг
По расчетам Международного института алюминия (IAI), в мире накопилось около 400 миллионов тонн алюминия в инфраструктуре, быту, транспорте.
Казалось бы, вышеперечисленный набор характеристик уже сам по себе достаточен для того, чтобы алюминий стал металлом приоритетного выбора в индустрии, однако есть еще одна, не менее значимая характеристика. Использование алюминия может быть бесконечно: этот металл и сплавы из него можно неоднократно переплавлять без утраты механических характеристик. Ученые подсчитали, что 1 кг собранных и сданных в переплавку алюминиевых банок позволяет сэкономить 8 кг боксита, 4 кг различных фторидов и 14 кВт/ч электроэнергии.
Около 75% алюминия, выпущенного за все время существования отрасли, используется до сих пор.
В статье использованы фотоматериалы © Shutterstock и © Rusal.
ICSC 0988 — АЛЮМИНИЙ, ПОРОШОК (пирофорный)
ICSC 0988 — АЛЮМИНИЙ, ПОРОШОК (пирофорный)
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| АЛЮМИНИЙ, ПОРОШОК (пирофорный) | ICSC: 0988 (Ноябрь 2019) |
| CAS #: 7429-90-5 |
| UN #: 1396 (без покрытия) |
| EINECS #: 231-072-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Воспламеняющееся. Образует горючий газ при контакте с водой или влажным воздухом. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. Риск взрыва при контакте с кислотами, спиртом, окисляющими веществами или водой. Образует горючий газ при контакте с водой или влажным воздухом. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. Риск взрыва при контакте с кислотами, спиртом, окисляющими веществами или водой. | НЕ допускать контакта с кислотами, спиртом, окислителями или водой. Замкнутая система, взрывозащищенное (для пыльной среды) электрическое оборудование и освещение. Не допускать оседания пыли. | Использовать сухой песк, специальй порошок. НЕ использовать воду. НЕ использовать двуокись углерода, пену. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. | |
| Кожа | Защитные перчатки. | Промыть кожу большим количеством воды или принять душ. | |
| Глаза | Покраснение. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. СухиеСмести просыпанное вещество в закрытые контейнеры. СухиеСмести просыпанное вещество в закрытые контейнеры. |
Согласно критериям СГС ООН
ОПАСНО
Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных окислителей, сильных оснований, сильных кислот, воды и галогенов. См. химические опасности. Хранить сухим. Хорошо закрывать. | |
| УПАКОВКА | |
| Герметичная. |
| АЛЮМИНИЙ, ПОРОШОК (пирофорный) | ICSC: 0988 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: Al |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
TLV: 1 mg/m3, как TWA; A4 (не классифицируется как канцероген для человека). MAK: (ингаляционная фракция): 4 mg/m3; (вдыхаемая фракция): 1.  5 mg/m3; группа риска для беременности: D 5 mg/m3; группа риска для беременности: D |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Other UN number: UN1309 Aluminium powder, coated, Hazard class 4.1, Pack group II. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС h350; h361 / h328; h361 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Молярная масса алюминия и свойства вещества
- Молярная масса алюминия — что это за химический элемент?
- Как найти молярную массу алюминия?
- Пример использования молярной массы алюминия в задании
- Физические свойства алюминия
- Химические свойства алюминия
- Изотопы алюминия
- Как люди получают алюминий?
- Где используется алюминий?
Алюминий
нашел широкое применение в различных сферах. Свойства алюминиевых сплавов делают их пригодными для использования практически во всех существующих отраслях промышленности. С этим веществом учащиеся сталкиваются при выполнении домашних заданий по химии или лабораторных работ. Поэтому мы создали полезную инструкцию по определению молярной массы Al, так как это самая распространенная задача.
Свойства алюминиевых сплавов делают их пригодными для использования практически во всех существующих отраслях промышленности. С этим веществом учащиеся сталкиваются при выполнении домашних заданий по химии или лабораторных работ. Поэтому мы создали полезную инструкцию по определению молярной массы Al, так как это самая распространенная задача.
Молярная масса алюминия. Что это за химический элемент?
Наименование: Алюминий (Al).
Атомный вес: 26,98.
Молекулярная масса: 26,981539 а.е.м.
Количество атомов: Алюминий содержит только один атом, который состоит из положительно заряженного ядра с 13 протонами, 14 нейтронами внутри и трех электронных оболочек с 13 электронами.
Температура плавления: 660 °C.
Температура кипения: 2518,82 °С.
Молярный объем: 10,0 см³/моль.
Алюминий — легкий и ковкий металл белого цвета, матового серебристого цвета, благодаря тонкой оксидной пленке, которая сразу же покрывает его на воздухе. Он относится к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,9.8154.
Он относится к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,9.8154.
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил квасцовую землю, которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Он назвал оксид алюминия «окись алюминия», что в переводе с латыни означает «вяжущий». В то время металл не был популярен, так как люди не находили его в чистом виде. Лишь в 1855 году в Париже на Всемирной выставке металлический алюминий произвел фурор.
Как найти молярную массу алюминия?
Чтобы найти молярную массу алюминия, нужно следовать алгоритму:
- Подготовьте таблицу Менделеева, чтобы узнать валентность данного элемента и атомные единицы массы.
- Теперь вам нужно написать химическое уравнение. Элемент всего один — Al, поэтому формула соответственно будет содержать только атом алюминия в нашей задаче.
 Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы.
Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы. - Вернитесь к периодической таблице и запишите валентность алюминия. Алюминий в своих соединениях проявляет валентность, равную III. Эти данные понадобятся вам в дальнейших расчетах.
- Зная валентность, можно найти количество молей в алюминии. В нашей задаче атом всего один, и это Al, так что формула будет выглядеть так:
M = Ar, Ar(Al) = Al · 1 моль = 26,98 г/моль.
Если вашим веществом, например, будет сульфат алюминия, то его химическая формула будет выглядеть так: Al2 SO4)3. Как видите, сульфат алюминия содержит три элемента. Следовательно, нужно сложить массы этих элементов и найти моль вещества.
- Вы на пути к финалу — остался всего один шаг. Вам нужно рассчитать массу одного моля алюминия. Можно воспользоваться такой формулой:
м(Ал) = Рр(Ал)/ЧА=27/6,02·1023=4,3·1023г.
Как видите, число 26,98 мы округлили до 27 для удобства расчетов.

Если вы не до конца понимаете алгоритм или затрудняетесь выучить все эти формулы, вы всегда можете воспользоваться помощью нашей службы написания рефератов.
Пример использования молярной массы алюминия в задаче
Знать и находить молярную массу алюминия необходимо при решении различных задач. В качестве помощи при выполнении домашних заданий мы рассмотрим один из них.
Задание: Растворение оксида алюминия.
Решение: С одной стороны масса оксида алюминия равна:
В этой формуле:
- V — объем растворенного оксида алюминия;
- ρ – его плотность;
- h – толщина барьерного слоя;
- S – площадь оксидной пленки.
С другой стороны, масса алюминия в растворе равна:
В этой формуле:
- vAl3 + количество алюминия;
- cAl3+ – концентрация ионных соединений алюминия;
- mAl – молярная масса алюминия;
- Vp – объем раствора;
- mAl3+ – масса алюминия в растворе.

Так как в оксиде алюминия на два атома алюминия приходится три атома кислорода, массу оксида можно выразить через массу металла:
Таким образом, получаем следующие данные:
Предлагаемый список, фосфорная и соляная кислоты могут быть использованы для растворения оксида алюминия:
Это кислая соль, которая образуется, так как кислота взята в большом избытке. В противном случае растворению мешал бы нерастворимый фосфат алюминия AlPO4.
Кремниевая кислота не может быть использована для растворения оксида алюминия, поскольку она сама по себе нерастворима в воде.
Физические свойства алюминия
Металлический алюминий характеризуется высокой электропроводностью, теплопроводностью, устойчивостью к коррозии и морозу, пластичностью. Хорошо поддается штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки.
Алюминий имеет высокое сродство к кислороду и на воздухе покрыт тонкой прочной пленкой оксида алюминия. Эта пленка защищает металл от последующего окисления и обеспечивает хорошие антикоррозионные свойства. Алюминий устойчив к морской, а пресная вода практически не взаимодействует с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Эта пленка защищает металл от последующего окисления и обеспечивает хорошие антикоррозионные свойства. Алюминий устойчив к морской, а пресная вода практически не взаимодействует с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства алюминия
Алюминий является довольно активным амфотерным металлом. В нормальных условиях прочная оксидная пленка определяет его сопротивление. Если оксидная пленка разрушена, алюминий действует как динамичный восстанавливающий металл. При высоких температурах металл взаимодействует с кислородом. При нагревании идут реакции с серой, фосфором, азотом, углеродом, йодом. В обычных условиях металл образует отличное химическое соединение с хлором, бромом, магнием, калием. С водородом реакции нет.
При условии очистки от оксидной пленки происходит интенсивное взаимодействие с водой. Реакции с разбавленными кислотами протекают быстро. Реакции с концентрированными азотной и серной кислотами происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашла способность восстанавливать металлы из оксидов и солей — реакция алюминотермии. Также в результате реакции алюминия (Al), воды (h3O) и хлорида натрия (NaCl), образуется хлорид алюминия (AlCl3), водород (h3), гидроксид натрия (NaOH).
Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашла способность восстанавливать металлы из оксидов и солей — реакция алюминотермии. Также в результате реакции алюминия (Al), воды (h3O) и хлорида натрия (NaCl), образуется хлорид алюминия (AlCl3), водород (h3), гидроксид натрия (NaOH).
Изотопы алюминия
Известно, что в природе алюминий может находиться в виде одного стабильного изотопа 27Al. Массовое число равно 27. Ядро изотопа алюминия 27Al содержит тринадцать протонов и четырнадцать нейтронов. Существуют радиоактивные изотопы алюминия с массовыми числами от 21 до 42, среди которых наиболее долгоживущий изотоп 26Al, имеющий период полураспада 720 тысяч лет.
Как люди получают алюминий?
Алюминий входит в число металлов и занимает третье место среди всех элементов по распространенности в земной коре. Этот реагент составляет примерно 8% земной коры, а алюминий встречается в тканях животных, растений как микроэлемент. В природе встречается в связанном виде в виде горных пород, минералов. Каменная оболочка земли, находящаяся в основании материков, образована именно алюмосиликатами, силикатами.
Каменная оболочка земли, находящаяся в основании материков, образована именно алюмосиликатами, силикатами.
Чаще всего люди получают алюминий из бокситов. Месторождения этого минерала распространены в странах тропической и субтропической зон. При извлечении алюминия из нефелина люди попутно получают также поташ, кальцинированную соду, цемент и удобрения.
Где используется алюминий?
Алюминий используется в металлургии в качестве основы для сплавов и легирующего элемента. Люди используют алюминиевые сплавы в быту, архитектуре и строительстве, судостроении и автомобилестроении, космической и авиационной технике. Химики используют алюминий в производстве взрывчатых веществ. Компании используют анодированный алюминий для изготовления украшений. Нитрат алюминия используется на текстильных фабриках для травления тканей перед окрашиванием, играет жизненно важную роль в дублении кожи и используется для изготовления нитей.
Видео с вопросами: Расчет массы алюминия, полученного в ячейке Холла-Эру, с учетом тока и молярной массы алюминия
Стенограмма видео
Промышленное извлечение
алюминий с использованием ячеек Холла-Эру требует очень большого электрического тока 120
килоампер.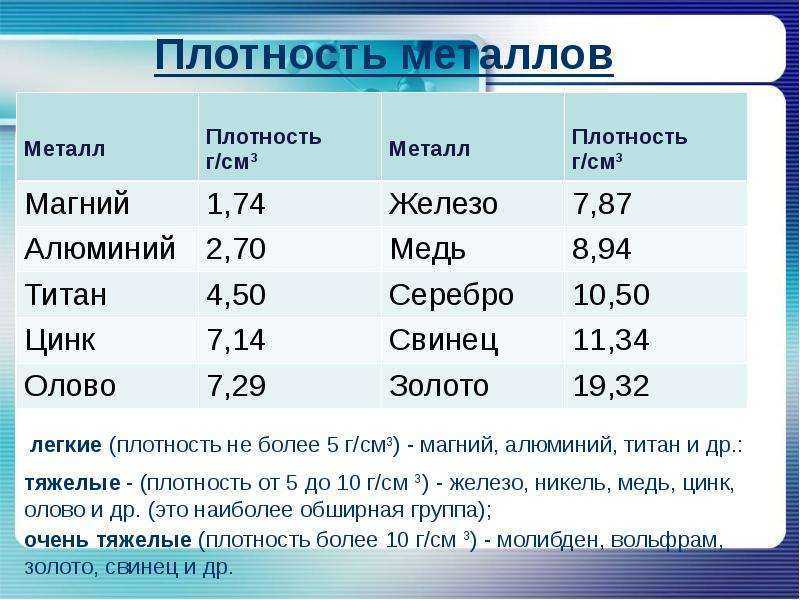 Сколько алюминия производится в год
Сколько алюминия производится в год
час, принимая молярную массу алюминия равной 27,0 граммам на моль и одному фарадею
зарядить как 9,65 умножить на 10 на четыре кулона? Дайте ответ в килограммах
два десятичных знака.
Добыча алюминия – это
электролитический процесс. Ионы алюминия в расплавленной фазе
восстанавливаются до жидкого металлического алюминия. На каждый моль алюминия
ионов, необходимо три моля электронов, и это дает один моль алюминия
металл. Нас спрашивают, сколько алюминия
производится в час. Другими словами, какая масса
производится алюминий?
Дана молярная масса
алюминий. Мы видим, что сначала нам нужно
рассчитать количество молей полученного алюминия. И используя это значение и моляр
масса, тогда мы можем определить массу. Нам не дали количество
молей алюминия, но нам даны другие данные. Нам дан ток, который течет
Нам дан ток, который течет
в килоамперах и истекшее время, равное одному часу. Нам также дано значение одного
фарадей заряда.
Полезное уравнение в электролизе
𝑄 равно 𝐼𝑡, где 𝑄 — переносимый заряд в кулонах, 𝐼 — ток в
ампер, а 𝑡 время в секундах. Нам нужно преобразовать ток в
ампер и время в секундах. Килоампер можно перевести в ампер
путем умножения на этот коэффициент преобразования. Килоампер отменяется, и мы получаем 120 000
ампер. Затем мы можем перевести время в часы
в минуты с использованием этого коэффициента преобразования и минут в секунды с использованием этого преобразования
фактор. Отменяются часы, отменяются минуты и
мы получаем ответ 3600 секунд, что эквивалентно одному часу.
Теперь мы можем рассчитать стоимость
перенесено. Используя наше ключевое уравнение 𝑄 равно
𝐼𝑡, мы можем подставить ток в амперах и время в секундах. Решая, получаем заряд
Решая, получаем заряд
передано за один час, что составляет 432 000 000 кулонов. Следующим шагом является преобразование
количество переданного заряда к числу молей переданных электронов. Существуют различные способы сделать
это. Один из способов — использовать ключевое уравнение
𝑄 равно 𝑛𝐹, где 𝑄 — переданный заряд в кулонах, 𝑛 количество
моли переданных электронов и 𝐹 постоянная Фарадея.
Теперь нам дан один фарадей
заряд как 9,65 умножить на 10 на четыре кулона. Однако постоянная Фарадея равна
то же значение заряда в кулонах, но на один моль переданных электронов. Следовательно, постоянная Фарадея равна
заряд на один моль элементарного заряда. Таким образом, мы можем изменить наш ключ
уравнение для получения 𝑛 равно 𝑄, деленному на 𝐹. Замена суммы начисления
что вытекло за один час, деленное на заряд одного моля элементарного заряда,
что эквивалентно заряду одного моля электронов, мы можем отменить
кулоновские единицы.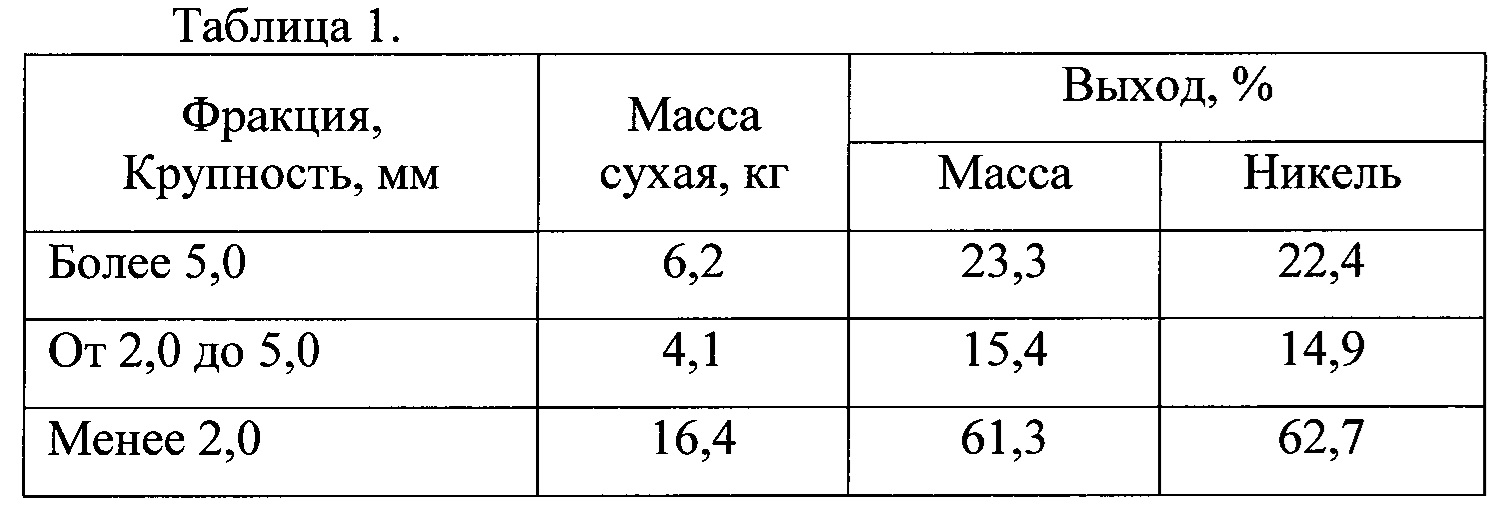 Получаем число молей
Получаем число молей
переносимого за час заряда, что составляет 4476,68 моль.
Давайте освободим место. Следующим шагом является преобразование
молей заряда, переданного молям произведенного алюминия. Из сбалансированного полууравнения мы
известно, что три моля заряда дают один моль алюминия. Но у нас нет трех родинок
электроны или заряд. У нас есть 4476,68 молей
заряд. И это произведет 𝑥 молей
алюминий. Затем мы можем решить это отношение с помощью
взяв количество молей заряда, которое у нас есть, разделив его на три. И мы можем решить для родинок
произведено алюминия, 1,492,23 моль, это значение здесь.
Наконец, мы можем использовать ключ
уравнение количество молей равно массе, деленной на молярную массу, чтобы определить
масса произведенного алюминия. Мы можем изменить ключевое уравнение
и умножьте моли на молярную массу, подставив значение моля, которое мы только что получили
вычислено, 1492,23 моля, умноженное на заданную молярную массу 27,0 грамм на
крот.