Медь характеристика элемента: Электротехническая медь, основные характеристики
Содержание
Химические свойства переходных металлов (меди, цинка, хрома, железа)
Что такое химические свойства переходных металлов (меди, цинка, хрома, железа)
Основные химические свойства и характеристики меди, цинка, хрома и железа — переходных металлов, краткая справка:
Медь
химический элемент. символьное обозначение элемента:
Cu
, латинское название
Cuprum
, элемент относится к периоду, группе:
4, 11
, (atomic mass of matter) атомная масса вещества Медь составляет
63,546 (3)
(а.е.м.) плотность элемента:
8,92
г/ см³ (при 20 градусах Цельсия), температура плавления
1083,5
(°C), температура кипения
2595
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Cuprum
Цинк
химический элемент. символьное обозначение элемента:
Zn
, латинское название
Zincum
, элемент относится к периоду, группе:
4, 12
, (atomic mass of matter) атомная масса вещества Цинк составляет
65,409 (4)
(а. е.м.) плотность элемента:
е.м.) плотность элемента:
7,14
г/ см³ (при 20 градусах Цельсия), температура плавления
419,6
(°C), температура кипения
907
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Zincum
Хром
химический элемент. символьное обозначение элемента:
Cr
, латинское название
Chromium
, элемент относится к периоду, группе:
4, 6
, (atomic mass of matter) атомная масса вещества Хром составляет
51,9961 (6)
(а.е.м.) плотность элемента:
7,14
г/ см³ (при 20 градусах Цельсия), температура плавления
1857
(°C), температура кипения
2482
(°C). Первооткрывателем зарегистрирован:
Воклен
, год открытия:
1797
— Chromium
Железо
химический элемент. символьное обозначение элемента:
Fe
, латинское название
Ferrum
, элемент относится к периоду, группе:
4, 8
, (atomic mass of matter) атомная масса вещества Железо составляет
55,845 (2)
(а. е.м.) плотность элемента:
е.м.) плотность элемента:
7,87
г/ см³ (при 20 градусах Цельсия), температура плавления
1535
(°C), температура кипения
2750
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Ferrum
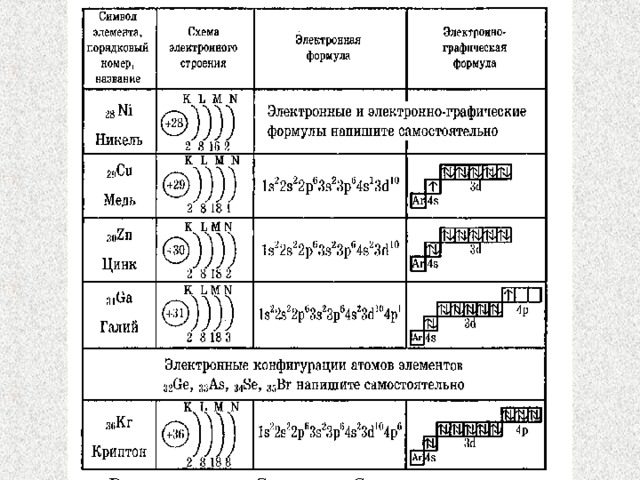
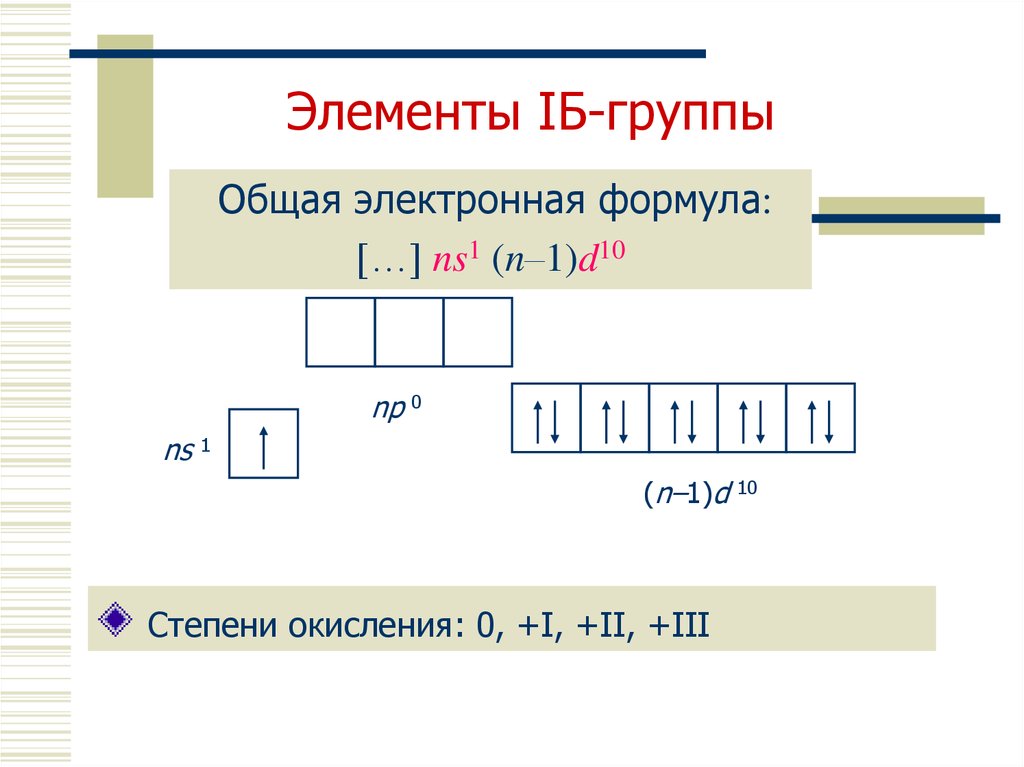
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2.
Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(Nh4)2]Cl и [Cu(Nh4)2]OH.
Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
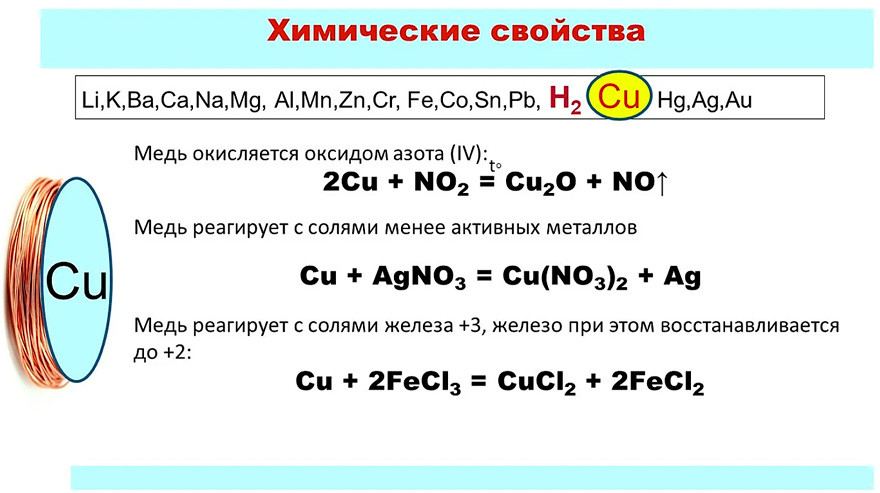
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
***
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
***
При недостатке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
***
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
***
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
***
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
***
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4h3O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
***
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
***
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
***
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
***
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + h3O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн.
тонн.
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + h3O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
***
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
***
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + h3SO4 (20%) → ZnSO4 + h3↑
Zn + 2HCl → ZnCl2 + h3↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + h3O = ZnO + h3↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2h3SO4 = ZnSO4 + SO2↑ + 2h3O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2h3O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4h3O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5h3O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6h3O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + Nh5NO3 + 3h3O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции. Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑
Zn + Ba(OH)2 + 2h3O = Ba[Zn(OH)4] + h3↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
***
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6h3O → 4Na2[Zn(OH)4] + Nh4↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4Nh4·h3O → [Zn(Nh4)4](OH)2 + h3↑ + 2h3O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.
Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника.
 Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков). - Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
Система охлаждения из меди на тепловых трубках в ноутбуке
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.
Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.
Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
- 25% – розовый;
- 50% – красный.
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.
Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева.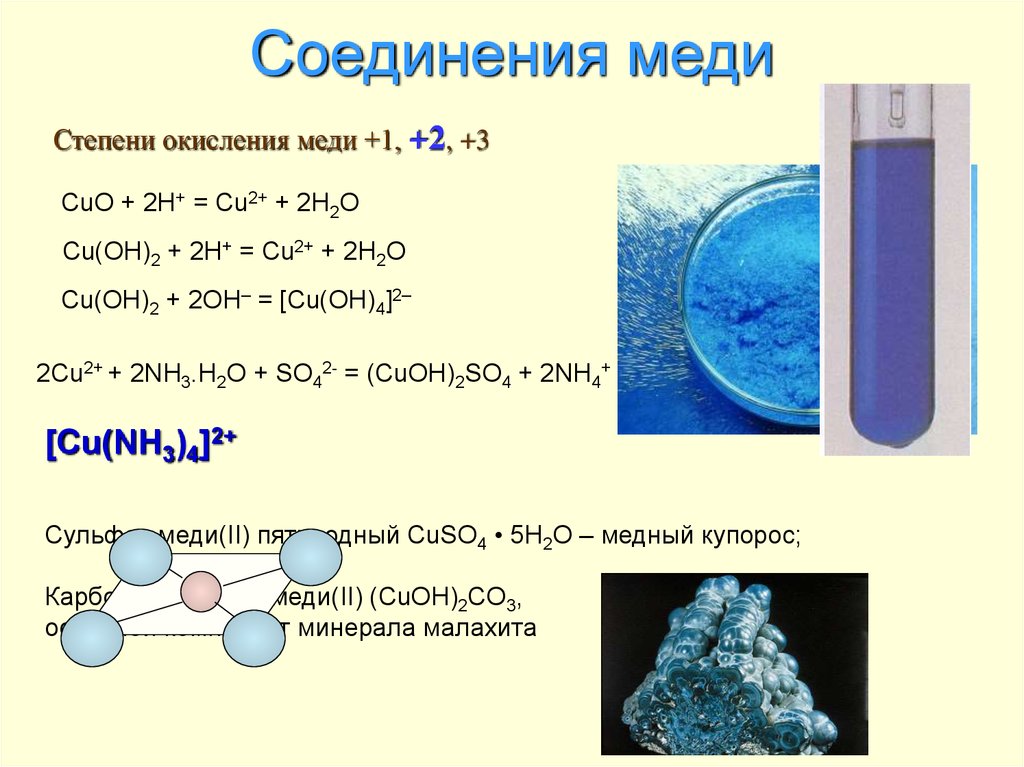 Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 =ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 =ot=> 2CrF3
2Cr + 3Cl2 =ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 =ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3h3O =ot=> Cr2O3 + 3h3↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3h3O
2Cr + 6h3SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6h3O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18h3O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять h3 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + h3↑
Cr + h3SO4(разб.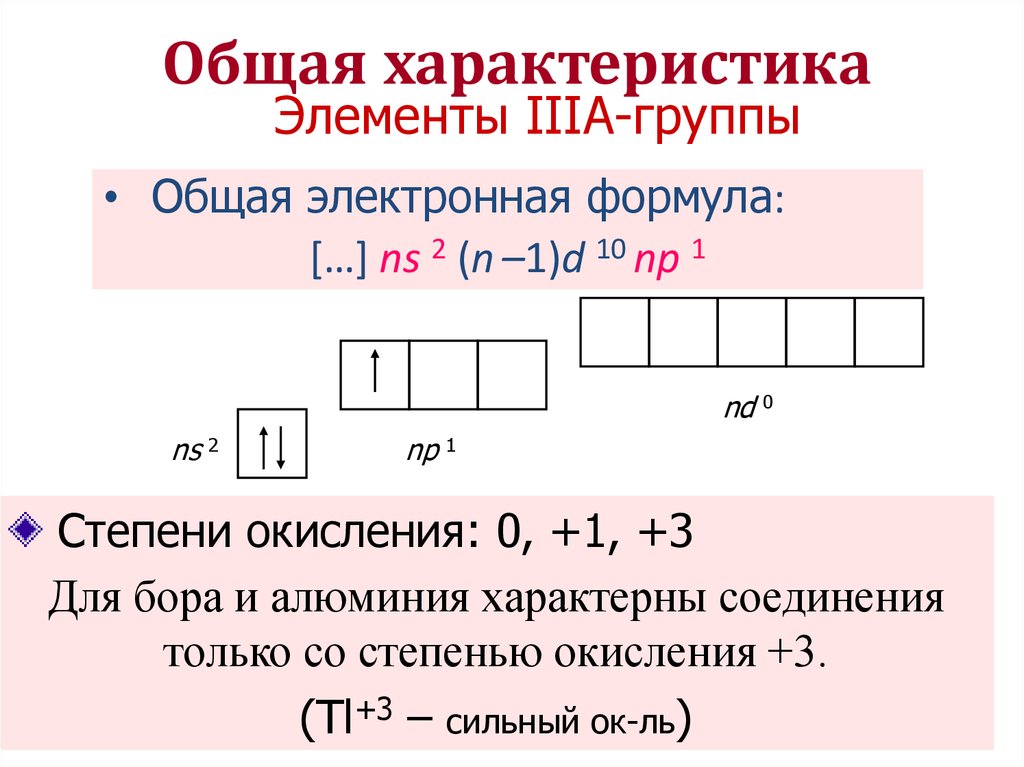 ) = CrSO4 + h3↑
) = CrSO4 + h3↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы: ****
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.
Сплавы меди и их применение
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
- Бронза – с оловом.
- Латунь – с цинком.
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
| Соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6h3O Fe2O3 + 6HI = 2FeI2 + I2 + 3h3O |
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
***
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме h3SO4 (конц. ) и HNO3 любой концентрации):
) и HNO3 любой концентрации):
Fe + h3SO4 (разб.) = FeSO4 + h3↑
Fe + 2HCl = FeCl2 + h3↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.
Самородок меди
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Общая характеристика d-элементов » HimEge.ru
Понятие
переходный элемент
обычно используется для обозначения любого элемента с валентными d- или f-электронами. Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами.
Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами.
d-Элементы принято называть главными переходными элементами. Их атомы характеризуются внутренней застройкой d-подоболочек. Дело в том, что s-орбиталь их внешней оболочки обычно заполнена уже до того, как начинается заполнение d-орбиталей в предшествующей электронной оболочке. Это означает, что каждый новый электрон, добавляемый в электронную оболочку очередного d-элемента, в соответствии с принципом заполнения, попадает не на внешнюю оболочку, а на предшествующую ей внутреннюю подоболочку. Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек.
d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей.
Он характеризуется внутренней застройкой 3d-орбиталей.
Орбиталь 4s заполняется раньше, чем орбиталь 3d,
потому что имеет меньшую энергию (правило Клечковского).
Следует, однако, отметить существование двух аномалий. Хром и медь имеют на своих 4s-орбиталях всего по одному электрону. Дело в том, что
полузаполненные или полностью заполненные подоболочки обладают большей устойчивостью, чем частично заполненные подоболочки.
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов. Аналогичная аномалия наблюдается у серебра.
Все d-элементы являются металлами.
Электронные конфигурации элементов четвертого периода от скандия до цинка:
Хром находится в 4-м периоде, в VI группе, в побочной подгруппе. Это металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. CrO — типичный основный оксид, Cr
Это металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. CrO — типичный основный оксид, Cr
2
O
3
— амфотерный оксид, CrO
3
— типичный кислотный оксид со свойствами сильного окислителя, т. е. рост степени окисления сопровождается усилением кислотных свойств.
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Железо — металл средней активности, в своих соединениях проявляет наиболее характерные степени окисления +2 и +3. Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями. FeO проявляет основные, а Fe
2
O
3
— амфотерные с преобладанием основных свойств.
Медь находится в 4-м периоде, в I группе, в побочной подгруппе. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика. Оксиды меди: Cu2O CuO. Последний и гидроксид меди Cu(OH)2 проявляют амфотерные свойства с преобладанием основных.
Цинк находится в 4-м периоде, во II-группе, в побочной подгруппе. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Оксид и гидроксид цинка являются амфотерными.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21742
Цели обучения
- Понять основные свойства, отличающие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Неблестящий, различных цветов |
| Ковкий и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
| Проведение тепла и электричества | Плохие проводники |
| Оксиды металлов основные, ионные | Оксиды неметаллов кислотные, ковалентные |
| Форма катионов в водном растворе | Образуют анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, образующие положительные ионы за счет потери электронов в ходе химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, ковкие, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы являются твердыми при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (галлий жидкий в жаркие дни).
- Блеск : Металлы обладают способностью отражать свет от своей поверхности и могут полироваться, например, золото, серебро и медь.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле. - Пластичность: Металлы можно вытягивать в проволоку. Например, 100 г серебра можно вытянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут резаться ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на самой внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь являются двумя лучшими проводниками тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Температуры плавления и кипения : Металлы имеют высокие температуры плавления и кипения. У вольфрама самые высокие температуры плавления и кипения, а у ртути самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы представляют собой электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, и обычно теряют электроны (т.е. окисляются ), когда подвергаются химическим реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в с подоболочкой)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 9{-}} \label{1.
 3} \]
3} \]Соединения металлов с неметаллами, как правило, ионные по своей природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\[\ce{Na2O(s) + h3O(l) \rightarrow 2NaOH(aq)}\label{1.4} \]
\[\ce{CaO(s) + h3O(l) \rightarrow Ca(OH)2(aq)} \label{1.5} \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислоты 9{2-}\), таким образом, \(Al_2O_3\).
Пример \(\PageIndex{2}\)
Как вы думаете, будет ли он твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример \(\PageIndex{3}\)
Напишите сбалансированное химическое уравнение для реакции оксида алюминия с азотной кислотой:
Раствор
0
0 Оксид металла + кислота -> соль + вода
\[\ce{Al2O3(s) + 6HNO3(aq) \rightarrow 2Al(NO3)3(aq) + 3h3O(l)} \nonumber \]
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны с образованием анионов во время химических реакций, называются неметаллами.
 Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газообразное (кислород) и твердое тело (углерод). Только бром существует в виде жидкости при комнатной температуре.
- Нековкий и пластичный : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Плохие проводники тепла и электричества.
- Блеск: Не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов обычно ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \(\ce{h3(g)}\), \(\ce{N2(g)}\), \(\ce{O2(g) }\), \(\ce{F2(g)}\), \(\ce{Cl2(g)}\), \(\ce{Br2(l)}\), \(\ce{I2( с)}\).
Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами. Они электроотрицательны по характеру. Неметаллы, реагируя с металлами, имеют тенденцию приобретать электроны (обычно приобретают электронную конфигурацию благородного газа) и становятся анионы:
\[\ce{3Br2(l) + 2Al(s) \rightarrow 2AlBr3(s)} \nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами. Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\[\ce{CO2(g) + h3O(l)} \rightarrow \underset{\text{угольная кислота}}{\ce {h3CO3(aq)}} \nonumber \]
Как вы знаете, газированная вода слабокислая (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\[\ce{CO2(g) + 2NaOH(aq) \rightarrow Na2CO3(aq) + h3O(l)} \nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.
 Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.
Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.Таблица \(\PageIndex{2}\): Элементы, разделенные на металлы, неметаллы и металлоиды. Металлы Неметаллы Металлоиды Золото Кислород Кремний Серебро Углерод Бор Медь Водород Мышьяк Железо Азот Сурьма Меркурий Сера Германий Цинк Фосфор Тенденции металлических и неметаллических свойств
Металлический характер наиболее силен для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер увеличивается с увеличением электроотрицательности и ионизации).
 энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.Неметаллический характер увеличивается снизу вверх и слева направо с наибольшим количеством неметаллических элементов в правом верхнем углу. металлический характер демонстрирует противоположную тенденцию: самый металлический элемент находится внизу слева.
Участники и ссылки
Майк Блабер (Университет штата Флорида)
Бинод Шреста (Университет Лотарингии)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- сплав
- металл
- металлический символ
- металлоид
- неметалл
Является ли медь элементом? — Techiescientist
Медь представляет собой металл розовато-оранжевого цвета, встречающийся в природе в сочетании с другими элементами в форме минералов, таких как малахит, куприт, борнит, азурит и т. д. Однако в природе он также встречается в свободном элементном состоянии. .
Будучи хорошим проводником электричества, медь используется в производстве ряда электроприборов. Также благодаря своему яркому и привлекательному внешнему виду медь используется в производстве украшений и других декоративных изделий.
Натыкались ли вы дома или в другом месте на какие-то изделия из меди и любовались ими, думая, что за материал в них? Вы думали об этом с точки зрения химии? Или, что еще хуже, вы спрашивали других о его функциях, но не могли получить ответ?
Если это произошло, не волнуйтесь.
 Techiescientist здесь, чтобы решить все ваши вопросы.
Techiescientist здесь, чтобы решить все ваши вопросы.Итак, продолжайте читать, чтобы узнать больше о меди…
Является ли медь элементом? Да, Медь — элемент. Медь состоит только из одного типа атомов, т. е. атомов меди, которые не могут быть далее разделены. Он указан в периодической таблице в группе 11 и имеет атомный номер 29. Следовательно, медь является элементом.
Что такое элемент?
Элементы – это основные вещества, присутствующие в чистом виде. Они состоят только из атомов одного типа и не могут быть далее разделены ни на какое другое вещество, кроме своих собственных атомов. Например, медь, кислород, фтор и т. д. Основной единицей элемента является атом.
В периодической таблице перечислены все элементы, открытые учеными на данный момент, и они расположены в соответствии с их характеристиками. Элементы со схожими свойствами помещаются в одну группу. Они представлены своими атомарными символами.
В основном элементы делятся на металлы и неметаллы.

Что такое соединение?
Соединения – это вещества, которые образуются при химическом соединении атомов двух или более элементов вместе в определенных соотношениях. Основной единицей соединения является молекула.
Каждое соединение обладает уникальными физическими и химическими свойствами, которые отличаются от любого из соединяющихся атомов.
Свойства соединения изменяются, если соотношение атомов нарушено. Вот почему соединения представлены их химическими формулами.
Например, вода представлена химической формулой H 2 O, что указывает на то, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Медь – атомный номер, массовое число, атомная диаграмма
Медь является элементом 11 группы и 4 периода периодической таблицы. Он принадлежит к элементам D-блока, также известным как переходные металлы. Положение меди в периодической таблице показано ниже:
Информация, которую мы можем извлечь из приведенного выше рисунка:
• Атомный номер меди 29.

• Атомная масса или массовое число меди 63,546
• Атомный символ меди — Cu.
• Электронная конфигурация меди [Ar]3d 10 4с 1 .
Атомную структуру меди также можно изобразить на основе приведенной выше информации.
Обратите внимание, что количество протонов = количество электронов = атомный номер элемента
В случае меди атомный номер = 29.
Следовательно, количество протонов = количество электронов = 29
Кроме того, Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Следовательно, Количество нейтронов в меди = 63 – 29= 34
С учетом приведенной выше информации атомная модель меди нарисована ниже:
Следовательно, атом меди состоит из 29 протонов и 34 нейтронов в ядре, а 29 электронов вращаются вокруг ядра в различных оболочках.
Почему медь не является соединением?
И элементы, и соединения представляют собой чистые вещества, образованные одним типом повторяющихся единиц, а именно.
 атомы и молекулы.
атомы и молекулы.Элементы — это чистейшая форма материи, состоящая только из атомов одного типа. Эти атомы расположены по определенному образцу и считаются основной единицей элемента. Невозможно далее разделить атомы на более простые объекты.
Периодическая таблица содержит список всех 118 элементов и классифицирует элементы на металлы и неметаллы. Элементы в периодической таблице занимают определенные позиции и идентифицируются по их атомным номерам.
Обычно элементы встречаются в природе в сочетании с другими элементами, такими как минералы, а иногда и в своем естественном состоянии. Например, золото, серебро, натрий и т. д.
С другой стороны, соединения — это вещества, образованные сочетанием двух или более типов атомов. Эти атомы объединены в определенном соотношении и связаны химической связью.
Основной единицей соединений является молекула. Можно дополнительно разделить эти молекулы на составляющие их атомы. Однако для этого требуются строгие химические процессы.
Например, молекулу воды можно разделить на водород и кислород, так как она содержит два атома водорода и один атом кислорода.
Медь относится к 11 группе периодической таблицы и помещается наравне с металлами. Он состоит только из атомов меди, которые составляют его основную единицу. Его нельзя далее разделить на какое-либо более простое вещество, и, следовательно, медь можно правильно назвать элементом.
Является ли медь чистым веществом?
Чистые вещества — это виды материи, состоящие только из частиц одного типа, атомов или молекул. Они имеют однородный состав и, таким образом, обладают специфическими физическими и химическими свойствами.
Кроме того, атомы или молекулы внутри чистого вещества всегда расположены определенным образом, т.е. имеют определенную структуру решетки.
Медь состоит только из атомов меди, которые расположены вместе определенным образом. Эти атомы составляют основную единицу меди и расположены в определенной структуре решетки.

Медь также обладает определенными физическими и химическими свойствами. Так как все эти свойства принадлежат чистым веществам, то Медь, безусловно, является чистым веществом.
Является ли медь смесью?
Смесь состоит из двух или более типов атомов или молекул, смешанных вместе в непостоянных соотношениях.
Смешанные атомы или молекулы не соединяются химически и могут быть легко разделены на составляющие их частицы с помощью простых физических процессов.
Определенной схемы расположения составляющих частиц нет. Физические и химические свойства смеси изменяются с изменением доли одной или нескольких составляющих ее частиц.
Смеси можно дополнительно разделить на гомогенные и гетерогенные смеси.
В гомогенных смесях атомы или молекулы распределены равномерно, из-за чего может быть невозможно визуально отличить их друг от друга. Например, соль в воде.
В гетерогенных смесях количество соединяющихся атомов или молекул не является постоянным по всей смеси, а также составляющие ее частицы можно различить визуально.
 Смесь сахара и соли является примером гетерогенной смеси.
Смесь сахара и соли является примером гетерогенной смеси.В случае меди присутствует только один тип атомов, которые химически связаны друг с другом и не могут быть разделены с помощью физических процессов.
Более того, эти атомы расположены по определенной схеме, что также обуславливает специфические физико-химические свойства меди. 9
Алмаз — это элемент Соединение Чистое вещество
Латунь Смесь
Бензин Однородная смесь
Молоко Однородная смесь
Решетчатая структура меди
Структура решетки элемента также известна как его кристаллическая структура. Он состоит из двух компонентов: решетки Браве и атомов.
Решетка Браве представляет собой пространство, в котором предполагается, что атомы расположены. Обычно его рассматривают в виде куба, в котором атомы располагаются на определенных позициях в определенных количествах.
Атомы внутри решетки Браве расположены под определенным углом и на расстоянии друг от друга.
 Другие параметры внутри этой структуры также остаются постоянными.
Другие параметры внутри этой структуры также остаются постоянными.Атомы в решетке Браве меди организованы в структуру гранецентрированной кубической решетки.
Это становится легко понять, если вы представите куб с маленькими шариками, размещенными в каждом углу этого куба, а также в центре каждой из его граней.
Здесь куб — это решетка Браве, а шарики — это атомы. Следовательно, гранецентрированная кубическая структура решетки меди выглядит следующим образом:
В приведенной выше структуре красные кружки обозначают атомы меди, расположенные под определенным углом и на определенном расстоянии друг от друга.
Свойства меди
Ниже перечислены несколько важных свойств меди:
• Медь представляет собой металл розовато-оранжевого цвета.
• Это очень хороший проводник тепла и электричества, благодаря чему он используется при изготовлении ряда кухонных принадлежностей и электроприборов.
• Температуры плавления и кипения меди составляют 1083 °C и 2595 °C соответственно.