Медь характеристика химического элемента: строение атома, получение, физические и химические свойства — урок. Химия, 11 класс.
Содержание
2.Физические и химические свойства:
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Самарский
государственный университет»
БИОЛОГИЧЕСКИЙ
ФАКУЛЬТЕТ
КАФЕДРА
ЭКОЛОГИИ, БОТАНИКИ И ОХРАНЫ ПРИРОДЫ
Геохимические
особенности и биогеохимическая роль
меди
Контрольная
самостоятельная работа
Направление
020400 – Биология
Выполнила
студентка 1 курса
Сотникова
Лариса Сергеевна
Подпись_________________
Преподаватель:
Доктор
биологических наук,
профессор
Прохорова
Наталья
Владимировна
Подпись_________________
Оценка_________________
Самара
20__
СОДЕРЖАНИЕ
Введение…………………………………………………………………………2
1. Общая
Общая
характеристика меди как химического
элемента………………………….3
2.Медь
в окружающей природной
среде……………………………………………………7
2.0
Биологическая
роль………………………………………………………….8
2.1
Медь в земной коре и ее структурных
компонентах…………..………….9
2.2
Геохимия
меди…………………………………………………………………………………..10
3.Основные
типы генезиса наиболее крупных
месторождений………………13
4.Получение………………………………………………………………………14
5.Применение……………………………………………………………………15
6.Способы
добычи………………………………………………………………16
7Литература……………………………………………………………………..18
МЕДЬ
(лат. Cuprum), Cu (читается «купрум»), химический
элемент I группы периодической системы
Менделеева, атомный номер 29, атомная
масса 63,546.
1.Общая
характеристика меди.
Природная
медь состоит из двух стабильных нуклидов
63Cu
(69,09% по массе) и 65Cu
(30,91%). Конфигурация двух внешних
электронных слоев нейтрального атома
меди 3s2p6d104s1.
Образует соединения в степенях окисления
+2 (валентность II) и +1 (валентность I),
очень редко проявляет степени окисления
+3 и +4.
В
периодической системе Менделеева медь
расположена в четвертом периоде и входит
в группу IВ, к которой относятся такие
благородные металлы, как серебро (Ag) и
золото (Au).
Радиус
нейтрального атома меди 0,128 нм, радиус
иона Cu+
от 0,060 нм (координационное число 2) до
0,091 нм (координационное число 6), иона
Cu2+
— от 0,071 нм (координационное число 2) до
0,087 нм (координационное число 6). Энергии
последовательной ионизации атома меди
7,726; 20,291; 36,8; 58,9 и 82,7 эВ. Сродство к электрону
1,8 эВ. Работа выхода электрона 4,36 эВ. По
Работа выхода электрона 4,36 эВ. По
шкале Полинга электроотрицательность
меди 1,9; медь принадлежит к числу
переходных металлов. Стандартный
электродный потенциал Cu/Cu2+
0,339 В. В ряду стандартных потенциалов
медь расположена правее водорода (H) и
ни из воды, ни из кислот водорода не
вытесняет.
Простое
вещество медь — красивый розовато-красный
пластичный металл.
Название:
латинское название меди происходит от
названия острова Кипра (Cuprus), где в
древности добывали медную руду;
однозначного объяснения происхождения
этого слова в русском языке нет.
Кристаллическая
решетка металлической меди кубическая
гранецентрированная, параметр решетки
а = 0,36150 нм. Плотность 8,92 г/см3,
температура плавления 1083,4°C, температура
кипения 2567°C. Медь среди всех других
металлов обладает одной из самых высоких
теплопроводностей и одним из самых
низких электрических сопротивлений
(при 20°C удельное сопротивление 1,68·10–3
Ом·м).
В
сухой атмосфере медь практически не
изменяется. Во влажном воздухе на
поверхности меди в присутствии углекислого
газа образуется зеленоватая пленка
состава Cu(OH)2·CuCO3.
Так как в воздухе всегда имеются следы
сернистого газа и сероводорода, то в
составе поверхностной пленки на
металлической меди обычно имеются и
сернистые соединения меди. Такая пленка,
возникающая с течением времени на
изделиях из меди и ее сплавов, называется
патиной. Патина предохраняет металл от
дальнейшего разрушения. Для создания
на художественных предметах «налета
старины» на них наносят слой меди,
который затем специально патинируется.
При
нагревании на воздухе медь тускнеет и
в конце концов чернеет из-за образования
на поверхности оксидного слоя. Сначала
образуется оксид Cu2O,
затем — оксид CuO.
Красновато-коричневый
оксид меди (I) Cu2O
при растворении в бромо- и иодоводородной
кислотах образует, соответственно,
бромид меди (I) CuBr и иодид меди (I) CuI. При
При
взаимодействии Cu2O
с разбавленной серной кислотой возникают
медь и сульфат меди:
Cu2O
+ H2SO4
= Cu + CuSO4
+ H2O.
При
нагревании на воздухе или в кислороде
Cu2O
окисляется до CuO, при нагревании в токе
водорода – восстанавливается до
свободного металла.
Черный
оксид меди (II) CuO, как и Cu2O,
c водой не реагирует. При взаимодействии
CuO с кислотами образуются соли меди
(II):
CuO
+ H2SO4
= CuSO4
+ H2O
При
сплавлении со щелочами CuO образуются
купраты, например:
CuO
+ 2NaOH = Na2CuO2
+ H2O
Нагревание
Cu2O
в инертной атмосфере приводит к реакции
диспропорционирования:
Cu2O
= CuO + Cu.
Такие
восстановители, как водород, метан,
аммиак, оксид углерода (II) и другие
восстанавливают CuO до свободной меди,
например:
CuO
+ СО = Cu + СО2.
Кроме
оксидов меди Cu2O
и CuO, получен также темно-красный оксид
меди (III) Cu2O3,
обладающий сильными окислительными
свойствами.
Медь
реагирует с галогенами, например, при
нагревании хлор реагирует с медью с
образованием темно-коричневого дихлорида
CuCl2.
Существуют также дифторид меди CuF2
и дибромид меди CuBr2,
но дииодида меди нет. И CuCl2,
и CuBr2
хорошо растворимы в воде, при этом ионы
меди гидратируются и образуют голубые
растворы.
При
реакции CuCl2
с порошком металлической меди образуется
бесцветный нерастворимый в воде хлорид
меди (I) CuCl. Эта соль легко растворяется
в концентрированной соляной кислоте,
причем образуются комплексные анионы
[CuCl2]–,
[CuCl3]2–
и [СuCl4]3–,
например за счет процесса:
CuCl
+ НCl = H[CuCl2]
При
сплавлении меди с серой образуетcя
нерастворимый в воде сульфид Cu2S.
Сульфид меди (II) CuS выпадает в осадок,
например, при пропускании сероводорода
через раствор соли меди (II):
H2S
+ CuSO4
= CuS + H2SO4
C
водородом, азотом, графитом, кремнием
медь не реагирует. При контакте с
водородом медь становится хрупкой (так
называемая «водородная болезнь» меди)
из-за растворения водорода в этом
металле.
В
присутствии окислителей, прежде всего
кислорода, медь может реагировать с
соляной кислотой и разбавленной серной
кислотой, но водород при этом не
выделяется:
2Cu
+ 4HCl + O2
= 2CuCl2
+ 2H2O.
С
азотной кислотой различных концентраций
медь реагирует довольно активно, при
этом образуется нитрат меди (II) и
выделяются различные оксиды азота.
Например, с 30%-й азотной кислотой реакция
меди протекает так:
3Cu
+ 8HNO3
= 3Cu(NO3)2
+ 2NO + 4H2O.
С
концентрированной серной кислотой медь
реагирует при сильном нагревании:
Cu
+ 2H2SO4
= CuSO4
+ SO2
+ 2H2O.
Практическое
значение имеет способность меди
реагировать с растворами солей железа
(III), причем медь переходит в раствор, а
железо (III) восстанавливается до железа
(II):
2FeCl3
+ Cu = CuCl2
+ 2FeCl2
Этот
процесс травления меди хлоридом железа
(III) используют, в частности, при
необходимости удалить в определенных
местах слой напыленной на пластмассу
меди.
Ионы
меди Cu2+
легко образуют комплексы с аммиаком,
например, состава [Cu(NH3)]2+.
При пропускании через аммиачные растворы
солей меди ацетилена С2Н2
в осадок выпадает карбид (точнее,
ацетиленид) меди CuC2.
Гидроксид
меди Cu(OH)2
характеризуется преобладанием основных
свойств. Он реагирует с кислотами с
Он реагирует с кислотами с
образованием соли и воды, например:
Сu(OH)2
+ 2HNO3
= Cu(NO3)2
+ 2H2O.
Но
Сu(OH)2
реагирует и с концентрированными
растворами щелочей, при этом образуются
соответствующие купраты, например:
Сu(OH)2
+ 2NaOH = Na2[Cu(OH)4]
Если
в медноаммиачный раствор, полученный
растворением Сu(OH)2
или основного сульфата меди в аммиаке,
поместить целлюлозу, то наблюдается
растворение целлюлозы и образуется
раствор медноаммиачного комплекса
целлюлозы. Из этого раствора можно
изготовить медноаммиачные волокна,
которые находят применение при
производстве бельевого трикотажа и
различных тканей.
МЕДЬ
В ОКРУЖАЮЩЕЙ СРЕДЕ
Среди
загрязнителей биосферы, представляющих
наибольший
интерес
для различных служб контроля ее качества,
металлы (в первую очередь тяжелые, то
есть имеющие атомный вес больше 40)
относятся к числу важнейших. В значительной
В значительной
мере это связано с биологической
активностью многих из них. На организм
человека и животных физиологическое
действие металлов различно и зависит
от природы металла, типа соединения, в
котором он существует в природной среде,
а также его концентрации. Многие тяжелые
металлы проявляют выраженные
комплексообразующие свойства. Так, в
водных средах ионы этих металлов
гидратированы и способны образовывать
различные гидроксокомплексы, состав
которых зависит от кислотности раствора.
Если в растворе присутствуют какие-либо
анионы или молекулы органических
соединений, то ионы этих металлов
образуют разнообразные комплексы
различного строения и устойчивости.
Биологическая
роль
Медь
присутствует во всех организмах и
принадлежит к числу микроэлементов,
необходимых для их нормального развития
(см. Биогенные элементы). В растениях и
животных содержание меди варьируется
от 10–15 до 10–3%. Мышечная ткань человека
содержит 1·10–3% меди, костная ткань —
(1-26)·10–4 %, в крови присутствует 1,01 мг/л
меди. Всего в организме среднего человека
Всего в организме среднего человека
(масса тела 70 кг) содержится 72 мг меди.
Основная роль меди в тканях растений и
животных — участие в ферментативном
катализе. Медь служит активатором ряда
реакций и входит в состав медьсодержащих
ферментов, прежде всего оксидаз,
катализирующих реакции биологического
окисления. Медьсодержащий белок
пластоцианин участвует в процессе
фотосинтеза. Другой медьсодержащий
белок, гемоцианин, выполняет роль
гемоглобина у некоторых беспозвоночных.
Так как медь токсична, в животном
организме она находится в связанном
состоянии. Значительная ее часть входит
в состав образующегося в печени белка
церулоплазмина, циркулирующего с током
крови и деставляющего медь к местам
синтеза других медьсодержащих белков.
Церулопламин обладает также каталитической
активностью и участвует в реакциях
окисления. Медь необходима для
осуществления различных функций
организма — дыхания, кроветворения
(стимулирует усвоение железа и синтез
гемоглобина), обмена углеводов и
минеральных веществ. Недостаток меди
Недостаток меди
вызывает болезни как растений, так и
животных и человека. С пищей человек
ежедневно получает 0,5-6 мг меди.
Сульфат
меди и другие соединения меди используют
в сельском хозяйстве в качестве
микроудобрений и для борьбы с различными
вредителями растений. Однако при
использовании соединений меди, при
работах с ними нужно учитывать, что они
ядовиты. Попадание солей меди в организм
приводит к различным заболеваниям
человека. ПДК для аэрозолей меди
составляет 1 мг/м3,
для питьевой воды содержание меди должно
быть не выше 1,0 мг/л.
200. Медь. (Cuprum). . Общая химия
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком.
В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80 % всей добываемой меди.
Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80 % всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск, Cu2S; халькопирит, или медный колчедан, CuFeS2; малахит (CuOH)2CO3.
— 553 —
В СССР богатые месторождения медных руд находятся на Урале, в Казахстане и в Закавказье.
Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать ряды с небольшим содержанием меди.
Выплавка меди из ее сульфидных руд или концентратов представляет собою сложный процесс. Обычно он слагается из следующих операций: обжиг, плавка, конвертирование, огневое и электролитическое рафинирование. В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3. Газы, отходящие при обжиге, содержат SO2 и используются для получения серной кислоты.
В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3. Газы, отходящие при обжиге, содержат SO2 и используются для получения серной кислоты.
Получающиеся в ходе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Основной же продукт плавки — жидкий штейн (Cu2S с примесью FeS) поступает в конвертор, где через пего продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая, или сырая, медь.
Для извлечения ценных спутников ( Au, Ag, Te и др.) и для удаления вредных примесей черновая медь подвергается огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании (см. § 103).
§ 103).
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3. При нагревании на воздухе в интервале температур 200-375°C медь окисляется до черного оксида меди (II) CuO. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди (II), а внутренний — красный оксид меди (I). Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п.
Широкое применение в машиностроительной промышленности, а также в электротехнике и других производствах имеют различные сплавы меди с другими металлами. Важнейшими из них являются латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
— 554 —
Латуни содержат до 45% цинка. Различают простые и специальные латуни. В состав последних, кроме меди и цинка, входят другие элементы, например железо, алюминий, олово, кремний. Латуни находят разнообразное применение. Из них изготовляют трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Некоторые специальные латуни обладают высокой коррозионной стойкостью в морской воде и применяются в судостроении. Латунь с высоким содержанием меди — томпак — благодаря своему внешнему сходству с золотом используется для ювелирных и декоративных изделий.
Медноникелевые сплавы подразделяются на конструкционные и электротехнические. К конструкционным относятся мельхиоры и нейзильберы. Мельхиоры содержат 20-30% никеля и небольшие количества железа и марганца, а нейзильберы 5-35% никеля и 13-45% цинка. Благодаря стойкости против коррозии в воде, в том числе в морской, конструкционные медноникелевые сплавы получили широкое распространение в судостроении и в энергетической промышленности. Из них изготовляют радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской. К электротехническим медноникелевым сплавам относятся константан (40% Ni, 1.5% Mn) и манганин (3% Ni, 12% Mn), обладающие низким температурным коэффициентом электросопротивления и служащие для изготовления магазинов сопротивления, а также копель (43% Ni, 0.5% Mn), применяемый для изготовления термопар.
Бронзы подразделяются по основному входящему в их состав компоненту (кроме меди) на оловянные, алюминиевые, кремнистые и др. Из них оловянные представляют собой самые древние сплавы. На протяжении столетий они занимали ведущее место во многих отраслях производства. Сейчас применение их в машиностроении сокращается. Более широко применяются алюминиевые бронзы (5-10% Al и добавки Fe, Mn, Ni). Бериллиевые бронзы очень прочны и применяются для изготовления пружин и других ответственных деталей.
На протяжении столетий они занимали ведущее место во многих отраслях производства. Сейчас применение их в машиностроении сокращается. Более широко применяются алюминиевые бронзы (5-10% Al и добавки Fe, Mn, Ni). Бериллиевые бронзы очень прочны и применяются для изготовления пружин и других ответственных деталей.
Все медные сплавы обладают высокой стойкостью против атмосферной коррозии.
В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным мором образует хлорид CuCl2. О взаимодействии меди с кислородом воздуха говорилось выше, При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют.
— 555 —
Однако в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
Летучие соединения меди окрашивают несветящее пламя газовой горелки в сине-зеленый цвет.
Известны соединения, в которых медь имеет степень окисленности один, два и три. Их можно рассматривать как производные соответствующих оксидов: Cu2O, CuO и Cu2O3.
Соединения меди(I), в общем, менее устойчивы, чем соединения меди(II). Оксид Cu2O3 и его производные весьма нестойки.
Соединения меди(I).
Оксид меди(I), или закись меди, Cu2O встречается в природе в виде минерала куприта. Искусственно она может быть получена путем нагревания раствора соли меди(II) со щелочью и каким-нибудь сильным восстановителем, например формалином или глюкозой. При нагревании образуется осадок красного оксида меди(I).
В паре с металлической медью Cu2O применяется в купроксных выпрямителях переменного тока.
При действии на Cu2O соляной кислоты получается бесцветный раствор хлорида меди(I) CuCl. Если разбавить этот раствор водой, то хлорид меди(I) выпадает в виде белого творожистого осадка, нерастворимого в воде. Он может быть получен также кипячением раствора хлорида меди (II) CuCl2 с металлической медью в солянокислой среде:
Он может быть получен также кипячением раствора хлорида меди (II) CuCl2 с металлической медью в солянокислой среде:
Соединения меди(II).
Оксид меди(II), или окись меди, CuO — черное вещество, встречающееся в природе (например, в виде минерала тенорита). Его можно легко получить прокаливанием карбоната гидроксомеди(II) (CuOH)2CO3 или нитрата меди(II) Cu(NO3)2. Оксид меди(II) проявляет окислительные свойства. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Гидроксид меди(II) Cu(OH)2 осаждается из растворов солей меди(II) в виде голубой студенистой массы при действии щелочей. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди(II).
Гидроксид меди(II) Cu(OH)2 — очень слабое основание. Поэтому растворы солей меди(II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Важнейшими из солей меди(II) являются следующие.
Сульфат меди(II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет.
— 556 —
Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди(II), если только они не содержат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы. В таком виде он называется медным купоросом (см. стр. 376).
Хлорид меди(II) CuCl2·2H2O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди(II) имеют зеленый цвет, разбавленные — сине-голубой.
Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди(II) имеют зеленый цвет, разбавленные — сине-голубой.
Нитрат меди(II) Cu(NO3)2·3H2O. Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди(II).
Карбонат гидроксомеди(II) (CuOH)2CO3. Встречается в природе в виде минерала малахита, имеющего красивый изумруднозеленый цвет. Искусственно приготовляется действием Na2CO3 на растворы солей меди(II):
Применяется для получения хлорида меди(II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди(II) Cu(CH3COO)2·2H2O. Получается обработкой металлической меди или оксида меди(II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Смешанный ацетат-арсенит меди(II) Cu(CH3COO)2·Cu3(AsO3)2. Применяется под названием париэюская зелень для уничтожения вредителей растений.
Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зеленых, синих, коричневых, фиолетовых и черных. Все соли меди ядовиты, поэтому медную посуду лудят, т. е. покрывают внутри слоем олова, чтобы предотвратить возможность образования медных солей.
Комплексные соединения меди. Характерное свойство двухзарядных ионов меди — их способность соединяться с молекулами аммиака с образованием комплексных ионов.
Если к раствору сульфата меди приливать раствор аммиака, то выпадает голубой осадок основной соли, который легко растворяется в избытке аммиака, окрашивая жидкость в интенсивный синий цвет. Прибавление щелочи к полученному раствору не вызывает образования осадка гидроксида меди Cu(OH)2 следовательно, в этом растворе так мало ионов Cu2+, что даже при большом количестве ионов ОН- не достигается произведение растворимости Cu(OH)2.
Прибавление щелочи к полученному раствору не вызывает образования осадка гидроксида меди Cu(OH)2 следовательно, в этом растворе так мало ионов Cu2+, что даже при большом количестве ионов ОН- не достигается произведение растворимости Cu(OH)2.
— 557 —
Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами ОН-. В то же время ионы SO42- остаются неизмененными, так как прибавление к аммиачному раствору хлорида бария тотчас же вызывает образование осадка сульфата бария (характерная реакция на SO42-).
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных ионов [Cu(NH3)4]2+, образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы [Cu(NH3)4]2+ связываются с ионами SO42- и из раствора выделяются темносиние кристаллы, состав которых выражается формулой [Cu(NH3)4]SO4·H2O.
Таким образом, при взаимодействии сульфата меди(II) с аммиаком происходит реакция
или в ионной форме:
Ионы, которые, подобно [Cu(NH3)4]2+, образуются путем присоединения к данному иону нейтральных молекул или ионов противоположного знака, называются комплексными ионами. Соли, в состав которых входят такие ионы, получили название комплексных солей. Известны также комплексные кислоты, комплексные основания и комплексные неэлектролиты.
При написании формул комплексный ион обычно заключают в квадратные скобки. Этим отмечается, что при растворении данного соединения в воде комплексный ион практически не диссоциирует.
Подобно сульфату меди(II) реагируют с аммиаком и другие соли двухвалентной меди. Во всех этих случаях получаются темносиние растворы, содержащие комплексные ионы [Cu(NH3)4]2+.
Гидроксид меди(II) тоже растворяется в аммиаке с образованием темно-синего раствора, содержащего ионы [Cu(NH3)4]2+:
Получающийся раствор обладает способностью растворять целлюлозу (вату, фильтровальную бумагу и т. п.) и применяется при изготовлении одного из видов искусственного волокна (см. стр. 480).
п.) и применяется при изготовлении одного из видов искусственного волокна (см. стр. 480).
Гидроксид меди (II) растворяется также в очень концентрированных растворах щелочей, образуя сине-фиолетовые растворы купритов — солей, содержащих комплексный ион [Cu(OH)4]2-
— 558 —
или в ионной форме:
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы OH-, вследствие чего образуются комплексные анионы, а не катионы. Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди(II) в осадок.
Из других комплексных анионов меди (II) отметим ионы [CuCl4]2-, образующиеся в концентрированных растворах хлорида меди(II) и обусловливающие их зеленую окраску:
При разбавлении растворов водой ионы [CuCl4]2- превращаются в обычные гидратированные ионы меди [Cu(H2O)4]2+ и зеленая окраска растворов переходит в сине-голубую:
Медь принадлежит к числу микроэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для нормальной жизнедеятельности растений. Микроэлементы повышают активность ферментов, способствуют синтезу сахара, крахмала, белков, нуклеиновых кислот, витаминов и ферментов. Микроэлементы вносят в почву с микроудобрениями. Удобрения, содержащие медь, способствуют росту растений на некоторых малоплодородных почвах, повышают их устойчивость против засухи, холода и некоторых заболеваний.
Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для нормальной жизнедеятельности растений. Микроэлементы повышают активность ферментов, способствуют синтезу сахара, крахмала, белков, нуклеиновых кислот, витаминов и ферментов. Микроэлементы вносят в почву с микроудобрениями. Удобрения, содержащие медь, способствуют росту растений на некоторых малоплодородных почвах, повышают их устойчивость против засухи, холода и некоторых заболеваний.
Соединение против элемента — разница и сравнение
Элементы и соединения представляют собой чистые химические вещества, встречающиеся в природе. Разница между элементом и соединением заключается в том, что элемент представляет собой вещество, состоящее из атомов одного типа, тогда как соединение состоит из разных элементов в определенных пропорциях. Примеры элементов включают железо, медь, водород и кислород. Примеры соединений включают воду (H 2 О) и соли (хлорид натрия — NaCl).
Примеры соединений включают воду (H 2 О) и соли (хлорид натрия — NaCl).
Элементы перечислены в соответствии с их атомным номером в периодической таблице. Среди 117 известных элементов 94 встречаются в природе, такие как углерод, кислород, водород и т. д. 22 созданы искусственно, претерпев радиоактивные изменения. Причиной этого является их нестабильность, из-за которой они подвергаются радиоактивному распаду в течение определенного периода времени, образуя в процессе новые элементы, такие как уран, торий, висмут и т. д. Элементы объединяются в фиксированных соотношениях и образуют стабильные соединения благодаря химическим связям. которые облегчают образование соединений.
Сравнительная таблица
| Соединение | Элемент | |
|---|---|---|
| Определение | Соединение содержит атомы различных элементов, химически объединенных вместе в фиксированном соотношении. | Элемент — это чистое химическое вещество, состоящее из атомов того же типа. |
| Состав | Соединения содержат различные элементы в фиксированном соотношении, расположенные определенным образом посредством химических связей. Они содержат только один тип молекулы. Элементы, входящие в состав соединения, химически связаны. | Элементы содержат только один тип атома. Каждый атом имеет одинаковый атомный номер, то есть одинаковое количество протонов в ядре. |
| Способность к разрушению | Соединение можно разделить на более простые вещества с помощью химических методов/реакций. | Элементы не могут быть разделены на более простые вещества химическими реакциями. |
| Представление | Соединение представлено с использованием его химической формулы, которая представляет собой символы составляющих его элементов и число атомов каждого элемента в одной молекуле соединения. | Элемент представлен с помощью символов. |
| Типы | Можно создать огромное, практически безграничное количество химических соединений. Соединения подразделяются на молекулярные соединения, ионные соединения, интерметаллические соединения и комплексы. | Наблюдено около 117 элементов. Могут быть классифицированы как металлические, неметаллические или металлоидные. |
| Примеры | Вода (h3O), хлорид натрия (NaCl), бикарбонат натрия (NaHCO3) и соляная кислота (HCl) являются примерами соединений. | Водород (H), кислород (O), натрий (Na), хлор (Cl), углерод (C), железо (Fe), медь (Cu), серебро (Ag) и золото (Au) являются примерами элементов. . |
Различия в свойствах
Элементы различаются по названию, символу, атомному номеру, температуре плавления, температуре кипения, плотности и энергии ионизации. В Периодической таблице элементы располагаются в соответствии с их атомным номером, и они сгруппированы в соответствии с аналогичными химическими свойствами и изображаются их символами.
В Периодической таблице элементы располагаются в соответствии с их атомным номером, и они сгруппированы в соответствии с аналогичными химическими свойствами и изображаются их символами.
- Атомный номер – атомный номер обозначается буквой Z и представляет собой количество протонов, присутствующих в ядре атома элемента. Например, углерод имеет 6 протонов в своем ядре, а для углерода Z = 6. Количество протонов также указывает на электрический заряд или количество электронов, присутствующих в ядре, которое определяет химические свойства элемента.
- Атомная масса – буква А обозначает атомную массу элемента, которая представляет собой общее количество протонов и нейтронов в ядре атома элемента. Изотопы одних и тех же элементов различаются атомными массами.
- Изотопы – изотопы элемента имеют одинаковое количество протонов в ядре, но отличаются количеством нейтронов. Встречающиеся в природе элементы имеют более одного стабильного изотопа.
 Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14.
Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14. - Аллотропы – атомы элемента могут образовывать связи друг с другом более чем одним способом, что приводит к различию их химических свойств. Например, углерод связывается в тетраэдр, образуя алмаз, а слои шестиугольников углерода образуют графит.
Соединения состоят из различных элементов в фиксированной пропорции. Например, 1 атом натрия (Na) соединяется с 1 атомом хлора (Cl) с образованием одной молекулы соединения хлорида натрия (NaCl).
Элементы в соединении не всегда сохраняют свои первоначальные свойства и не могут быть разделены физическими средствами. Объединению элементов способствует их валентность. Валентность определяется как количество необходимых атомов водорода, которые могут соединиться с атомом элемента, образующего соединение. Большинство соединений могут существовать в твердом состоянии (достаточно низкие температуры) и могут разлагаться при нагревании. Иногда посторонние элементы задерживаются внутри кристаллической структуры соединений, придавая им неоднородную структуру. Соединения изображаются по их химической формуле, которая соответствует системе Хилла, в которой атомы углерода перечислены первыми, за которыми следуют атомы водорода, после чего элементы перечислены в алфавитном порядке.
Валентность определяется как количество необходимых атомов водорода, которые могут соединиться с атомом элемента, образующего соединение. Большинство соединений могут существовать в твердом состоянии (достаточно низкие температуры) и могут разлагаться при нагревании. Иногда посторонние элементы задерживаются внутри кристаллической структуры соединений, придавая им неоднородную структуру. Соединения изображаются по их химической формуле, которая соответствует системе Хилла, в которой атомы углерода перечислены первыми, за которыми следуют атомы водорода, после чего элементы перечислены в алфавитном порядке.
Визуализация различий
На этом рисунке показаны различия между элементами и соединениями на атомарном уровне. Элементы имеют только 1 тип атомов; соединения имеют более 1. Элементы и соединения являются веществами; они отличаются от смесей, в которых разные вещества смешиваются друг с другом, но не посредством атомных связей.
Визуализация различий между элементами, соединениями и смесями, как гомогенными, так и гетерогенными.
История элементов и соединений
Элементы изначально использовались для обозначения любого состояния материи, такого как жидкость, газ, воздух, твердое тело и т. д. Индийские, японские и греческие традиции относятся к пяти элементам, а именно: воздуху, воде, земле, огню и эфиру. Аристотель концептуализировал новый пятый элемент, названный «квинтэссенцией», который, по-видимому, сформировал небеса. По мере продолжения исследований многие выдающиеся ученые проложили путь к современному пониманию и описанию элементов. Среди них особенно выделяются работы Роберта Бойля, Антуана Лавуазье, Дмитрия Менделеева. Лавуазье первым составил список химических элементов, а Менделеев первым расположил элементы в соответствии с их атомными номерами в периодической таблице. Самое современное определение элемента дано в исследованиях, проведенных Генри Мозли, в которых говорится, что атомный номер атома физически выражается зарядом его ядра.
До 1800-х годов использование термина соединение также могло означать смесь. Именно в 19 веке значение соединения можно было отличить от смеси. Такие алхимики, как Джозеф Луи Пруст, Дальтон и Бертолле, и их исследования различных соединений дали современной химии нынешнее определение соединения. Работа Пруста продемонстрировала миру химии, что соединения состоят из постоянного состава соответствующих элементов.
Именно в 19 веке значение соединения можно было отличить от смеси. Такие алхимики, как Джозеф Луи Пруст, Дальтон и Бертолле, и их исследования различных соединений дали современной химии нынешнее определение соединения. Работа Пруста продемонстрировала миру химии, что соединения состоят из постоянного состава соответствующих элементов.
Номер CAS
Каждое химическое вещество идентифицируется своим уникальным числовым идентификатором – номером CAS (службы химических рефератов). Следовательно, каждое химическое соединение и элемент имеют номер CAS. Это делает поиск элементов и соединений в базе данных более удобным.
Ссылки
- Химический элемент — Википедия
- Химическое соединение — Википедия
- Подписаться
- Поделиться
- Укажите
- Авторы
Поделитесь этим сравнением:
Если вы дочитали до этого места, подписывайтесь на нас:
«Соединение против элемента». Diffen.com. Diffen LLC, н.д. Веб. 20 мая 2023 г. < >
Diffen.com. Diffen LLC, н.д. Веб. 20 мая 2023 г. < >
1.3 Физические и химические свойства — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения в материи как физические или химические
- Определите свойства материи как экстенсивные или интенсивные
Характеристики, отличающие одно вещество от другого, называются свойствами. Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Некоторые физические свойства, такие как плотность и цвет, можно наблюдать, не изменяя физического состояния вещества. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Рисунок
1,18
(а) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
Способность превращаться из одного типа материи в другой (или неспособность изменяться) — это химическое свойство. Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рисунок
1.19
а) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает. (кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Рисунок
1,20
а) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи относятся к одной из двух категорий. Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Химия в повседневной жизни
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 1.21, на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Рисунок
1,21
Алмаз опасности Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки).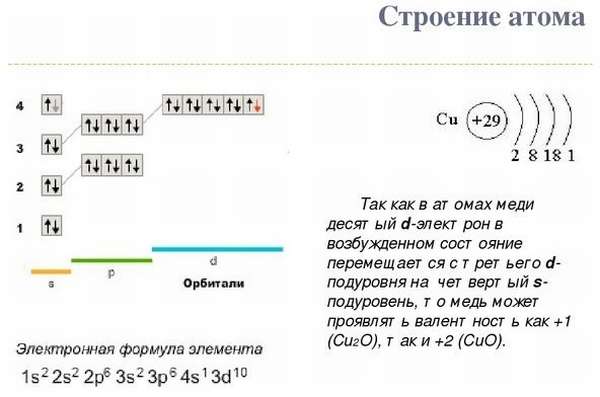 Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы с промежуточной проводимостью).

 Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14.
Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14.