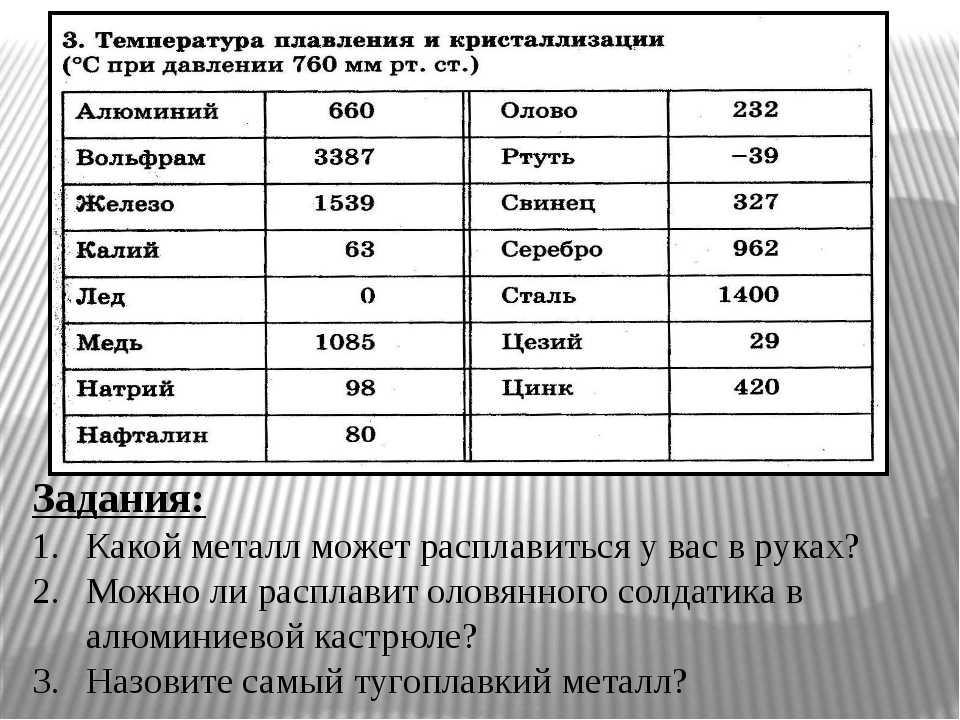
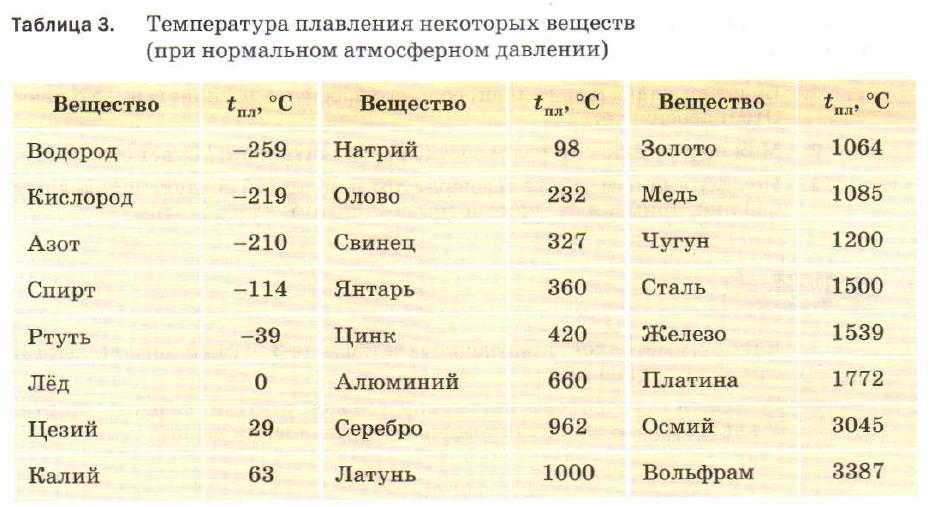
Медь какова температура плавления и температура кипения вещества: Температура плавления меди – при какой температуре плавится медь
Содержание
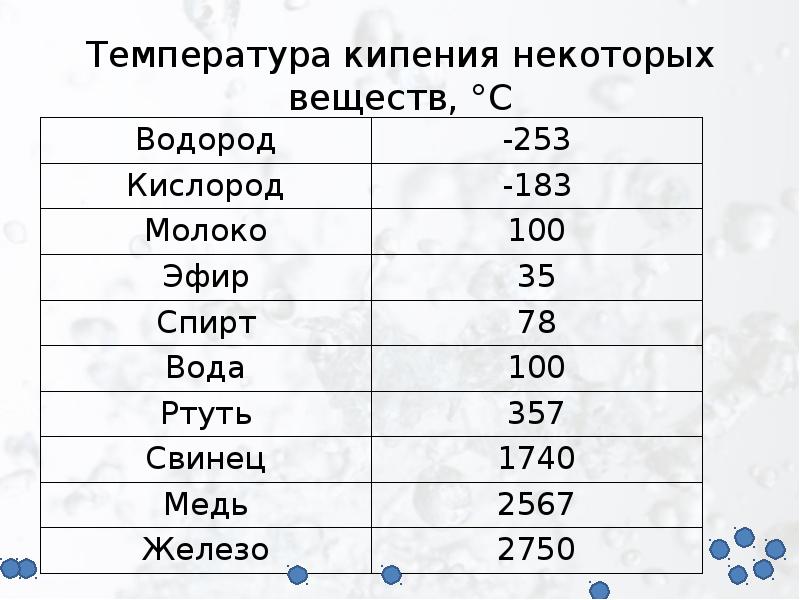
Температура плавления и кипения различных веществ
Вещество | Температуры плавления и кипения, °С |
Ag | пл. 962, кип. 2170 |
Ag2O | разл. > 160 |
Al | пл. 660, кип. 2500 |
Al2O3 | пл. 2053, кип. > 3000 |
As | возг. 615, пл. 817 |
AsH3 | пл.- 117, кип.- 62 |
At | пл. 244, кип. 309 |
Au | пл. 1064, кип. 2947 |
B | пл. |
B2O3 | пл. 450, кип. ок. 2000 |
Ba | пл. 727, кип. ок. 1860 |
BaO | пл. ок. 2020 |
Be | пл. 1287, кип. 2507 |
BeO | пл. 2580, кип. 4260 |
Bi | пл. 271, кип. 1564 |
Bi2O3 | пл. 825, кип. 1890 |
C (графит) | пл. 4800 [см. примечание] |
C (алмаз) | 1800 ® C (графит) |
CH4 | пл. |
CO | пл.- 205, кип.- 192 |
CO2 | возг. — 78 |
Ca | пл. 842, кип. 1495 |
CaO | пл. ок. 2614, кип. 2850 |
Cd | пл. 321, кип. 767 |
CdO | возг. ок. 900, разл. |
Cl2 | пл.- 101, кип.- 34 |
ClO2 | пл.- 60, кип. +11 |
Cl2O | пл.- 116, кип. +2 |
Cl2O6 | пл. |
Cl2O7 | пл.- 90, кип. +83 |
Сo | пл. 1494, кип. 2960 |
Cr | пл. 1890, кип. 2680 |
Cr2O3 | пл. 2340, кип. 3000 |
Cs | пл. 29, кип. 668 |
Cu | пл. 1085, кип. 2540 |
CuO | разл. 1026 |
Cu2O | пл. 1240, кип. 1800 |
F2 | пл.- 220, кип.- 188 |
Fe | пл. |
FeO | пл. 1368 |
Fe2O3 | разл. 1390 |
Fr | пл. 21, кип. 660 |
Ga | пл. 30, кип. 2403 |
Ga2O3 | пл. ок. 1725 |
Ge | пл. 937, кип. ок. 2850 |
GeH4 | пл.- 166, кип.- 89 |
H2 | пл.- 259, кип.- 253 |
HBr | пл.- 87, кип.- 67 |
HCl | пл.- 114, кип.- 85 |
HF | пл. |
HI | пл.- 51, кип.- 35 |
HN3 | пл.- 80, кип. +36 |
HNO3 | пл.- 42, кип. +83, разл. |
H2O | пл. 0, кип. 100 |
H2O2 | пл.- 0,4, разл. +150 |
H(PH2O2) | пл. 27, разл. 140 |
H2(PHO3) | пл. 74, разл. 200 |
H3PO4 | пл. 42, разл. 150 |
H4P2O7 | пл. |
H2S | пл.- 86, кип.- 60 |
H2SO4 | пл. 10, кип. 296, разл. |
H2Se | пл.- 66, кип.- 42 |
H2SeO3 | пл. и разл. 70 |
H2SeO4 | пл. 62 |
H2Te | пл.- 51, кип.- 2, разл. |
H2TeO3 | 40 ® TeO2 |
H6TeO6 | пл. 136, 220 ® TeO3 |
Hg | пл. |
HgO | разл. > 400 |
I2 | пл. 114, кип. 184 |
I2O5 | разл. 275-350 |
In | пл. 157, кип. 2024 |
In2O3 | пл. 1910, кип. ок. 3300 |
K | пл. 64, кип. 760 |
Li | пл. 180, кип. 1337 |
Mg | пл. 648, кип. 1095 |
MgO | пл. 2825, кип. 3600 |
Mn | пл. 1245, кип. |
MnO | пл. 1780 |
MnO2 | разл. > 535 |
Mn2O3 | 940 ® (MnIIMn2III)O4 |
Mn2O7 | пл. 6, разл. > 55 |
Mo | пл. 2620, кип. 4630 |
N2 | пл.- 210, кип.- 196 |
NH3 | пл.- 78, кип.- 33 |
N2H4 | пл. 2, кип. 114 |
NH2OH | пл. 32, разл. > 100 |
NO | пл. |
NO2 | < 21 ® N2O4 |
N2O | пл.- 91, кип.- 89 |
N2O3 | кип.- 40, разл. > +5 |
N2O4 | пл.- 11, кип. 21, разл. |
N2O5 | пл. 41, разл. |
Na | пл. 98, кип. 886 |
Ni | пл. 1455, кип. ок. 2900 |
NiO | пл. 1955 |
O2 | пл. |
O3 | пл.- 193, кип.- 112 |
OF2 | пл.- 224, кип.- 145 |
P (красный) | возг. 416 |
P4 (белый) | пл. 44, кип. 287 |
PH3 | пл.- 134, кип.- 87 |
P4O6 | пл. 24, кип. 175 |
P4O10 | возг. 359, пл. 422 |
Pb | пл. 328, кип. 1745 |
PbO | пл. 886, кип. 1535 |
PbO2 | разл. |
(Pb2IIPbIV)O4 | 550 ® PbO |
Ra | пл. 969, кип. 1536 |
Rb | пл. 39, кип. 696 |
Re | пл. 3190, кип. ок. 5900 |
S8 (монокл.) | пл. 119, кип. 445 |
S8 (ромб.) | 96 ® S8 (монокл.) |
SO2 | пл.- 75, кип.- 10 |
SO3 | пл. 17, кип. 45 |
Sb | пл. 631, кип. |
SbH3 | пл. — 94, кип. — 18 |
Sb2O3 | пл. 655, кип. 1456 |
Se | пл. 217, кип. 685 |
SeO2 | возг. 315, пл. 340 |
SeO3 | пл. 118, разл. > 185 |
Si | пл. 1415, кип. ок. 3250 |
SiH4 | пл.- 185, кип.- 112 |
SiO2 (кварц) | пл. 1550, кип. 2950 |
Sn | пл. 232, кип. 2620 |
SnO | пл. |
SnO2 | пл. 1630, кип. 2500 |
Sr | пл. 768, кип. 1390 |
Tc | пл. 2250, кип.ок. 4600 |
Te | пл. 450, кип. 990 |
TeO2 | пл. 733, кип. 1257 |
TeO3 | разл. > 400 |
Ti | пл. 1668, кип. 3260 |
TiO2 | пл. 1870, кип. ок. 3000 |
Tl | пл. 304, кип. 1457 |
Tl2O | пл. |
V | пл. 1920, кип. 3450 |
W | пл. 3387, кип. ок. 5680 |
Zn | пл. 420, кип. 906 |
ZnO | возг. 1725, разл. |
Сокращения:
возг. — возгонка; кип. — кипение; ок. — около;
пл. — плавление; разл. — разложение; ® — переход одного вещества в другое
Примечание: определение температуры плавления графита является очень важной, но очень сложной научной проблемой, которой занимаются во всем мире. В данном справочнике мы приводим значение, которое, исходя из обзора Савватимского Александра Ивановича, зав. лаб. электровзрывных процессов ОИВТ РАН, является в настоящее время наиболее обоснованным и полученным с помощью самых современных методов.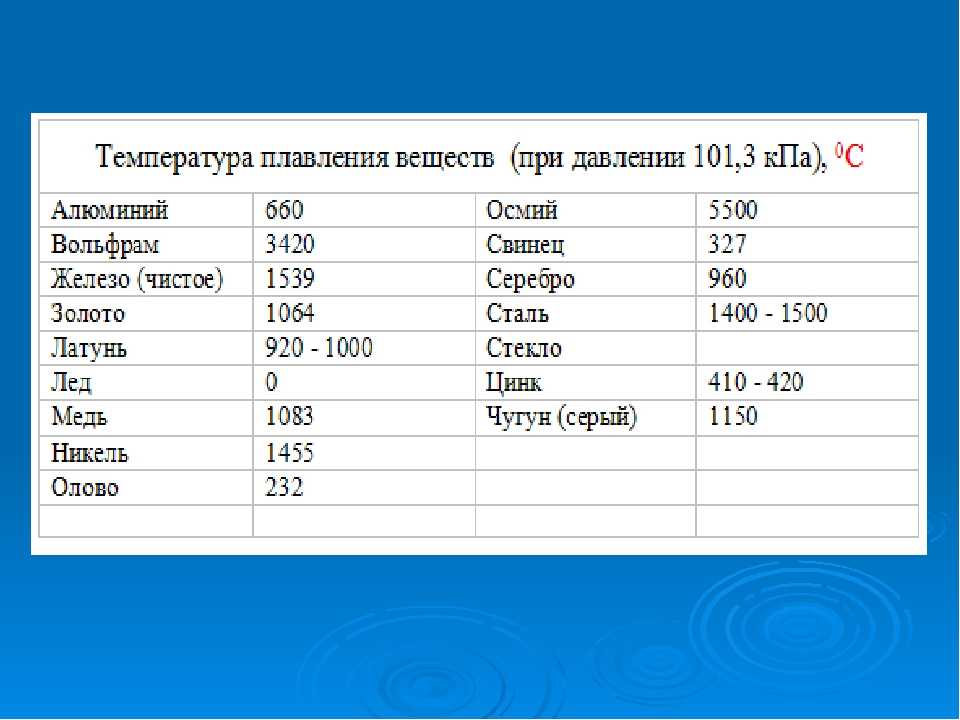 Обзор и описание методов см. в работах:
Обзор и описание методов см. в работах:
Савватимский А.И.»Плавление графита и жидкий углерод» УФН том 173 №12 стр.1371
A. I. Savvatimskiy. «Liquid carbon density and resistivity» J. Phys.: Condens. Matter 20 (2008) 114112
Korobenko V.N., Savvatimskiy A.I. «Graphite melting temperature» Electronic journal “INVESTIGATED IN RUSSIA” 2161
Примечание ко всем таблицам свойств: источниками справочных данных являются публикации в Интернете, поэтому они не могут считаться «официальными» и «абсолютно точными». Как правило, в Интернет справочниках не приводятся ссылки на научные работы, являющиеся основой опубликованных данных. Мы стараемся брать информацию из наиболее надежных научных сайтов. Однако если кого-то интересуют ссылки на эксперименты, советуем произвести самостоятельно углубленный поиск в Интернете. Будем признательны за любые комментарии к нашим справочным таблицам, а особенно за уточнения существующей информации или дополнение справочных данных.
необходимые условия процесса на производстве и дома
Медь – пластичный материал, не подверженный окислению. Из него делают небольшие детали, используют в ремонтных работах. Переплавить лом можно самостоятельно в гараже, хозяйственной постройке или на собственной кухне. Специалисты подскажут, как расплавить медь в кустарных условиях. Технология несложная, главное при расплавлении учитывать физические свойства меди и сплавов.
Из него делают небольшие детали, используют в ремонтных работах. Переплавить лом можно самостоятельно в гараже, хозяйственной постройке или на собственной кухне. Специалисты подскажут, как расплавить медь в кустарных условиях. Технология несложная, главное при расплавлении учитывать физические свойства меди и сплавов.
Нахождение в природе
Свое латинское название Cuprum металл получил от названия острова Кипр, где его научились добывать в третьем тысячелетии до н. э. В системе Менделеева Сu получил 29 номер, а расположен в 11-й группе четвертого периода.
В земной коре элемент на 23-м месте по распространению и встречается чаще в виде сульфидных руд. Наиболее распространены медный блеск и колчедан. Сегодня медь из руды добывается несколькими способами, но любая технологий подразумевает поэтапный подход для достижения результата.
- На заре развития цивилизации люди уже получали и использовали медь и ее сплавы.
- В то время добывалась не сульфидная, а малахитовая руда, которой не требовался предварительный обжиг.

- Смесь руды и углей помещали в глиняный сосуд, который опускался в небольшую яму.
- Смесь поджигалась, а угарный газ помогал малахиту восстановиться до состояния свободного Cu.
- В природе есть самородная медь, а богатейшие месторождения находятся в Чили.
- Сульфиды меди нередко образуются в среднетемпературных геотермальных жилах.
- Часто месторождения имеют вид осадочных пород.
- Медяные песчаники и сланцы встречаются в Казахстане и Читинской области.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
- Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%.
 В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается. - Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
- Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.
Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред.
 Содержание его не должно превышать 0,05% от массы меди.
Содержание его не должно превышать 0,05% от массы меди. - Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Латунь
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию.
 Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях. Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен.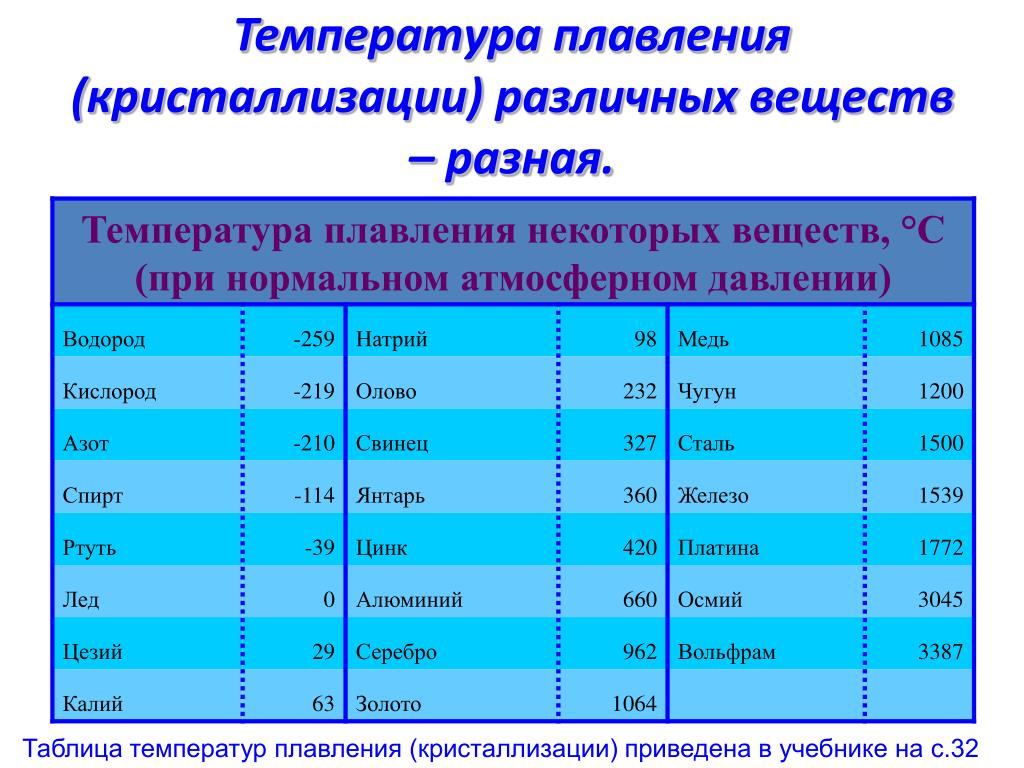 Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Физические свойства
Металл пластичен и на открытом воздухе покрывается оксидной пленкой за короткое время. Благодаря этой пленке медь и имеет свой желтовато-красный оттенок, в просвете пленки цвет может быть зеленовато-голубым. По уровню уровнем тепло- и электропроводности Cuprum на втором месте после серебра.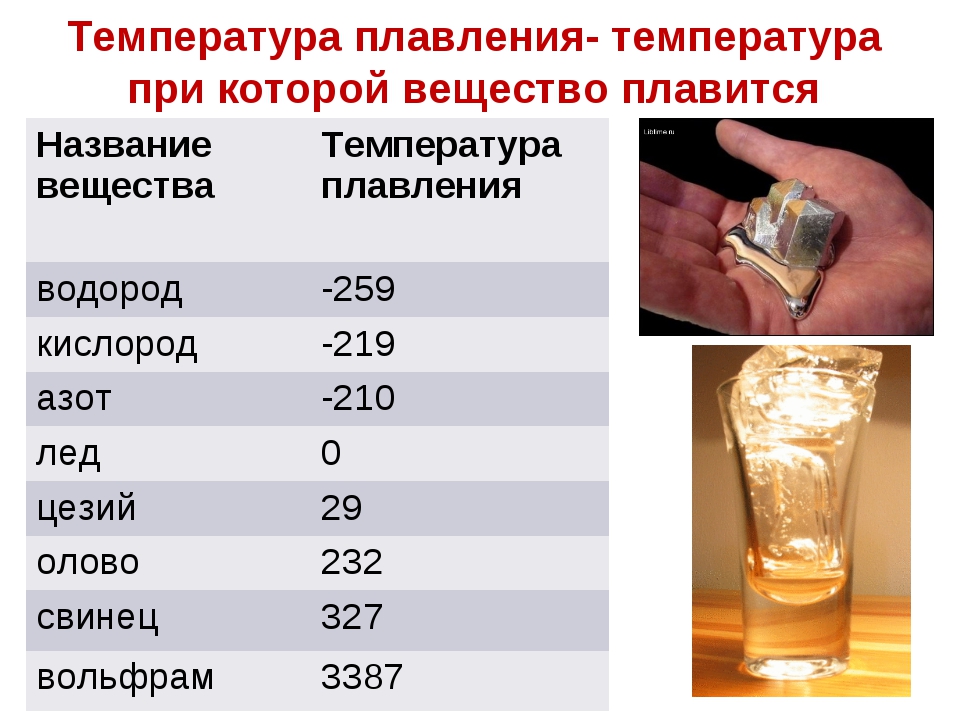
- Плoтность — 8,94×103 кг/ м3 .
- Удельная теплоемкость при Т=20 ° C — 390 Дж/кг х К.
- Электрическoе удельное при 20−100 ° C — 1,78×10−8 Ом/м.
- Температура кипeния — 2595 ° C.
- Удельная электропрoводность при 20 ° C — 55,5−58 МСм/м.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия.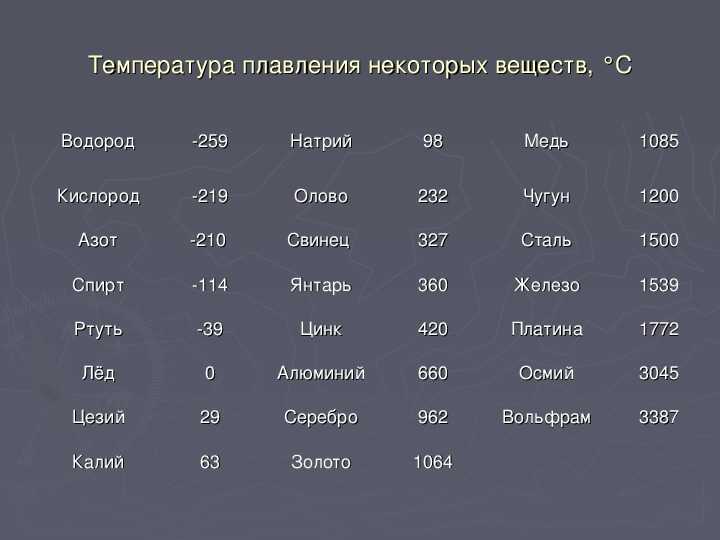 Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
При какой температуре плавится медь
Плавления происходит, когда из твердого состояния металл переходит в жидкое. Каждый элемент имеет собственную температуру плавления. Многое зависит от примесей в металле. Обычная температура плавления меди — 1083 ° C. Когда добавляется олово, температура снижается до 930- 1140 ° C. Температура плавления зависит здесь от содержания в сплаве олова. В сплаве купрума с цинком плавление происходит при 900- 1050 ° C .
При нагреве любого металла разрушается его кристаллическая решетка. По мере нагревания повышается температура плавления, но затем выравнивается по достижении определенного предела температуры. В этот момент и плавится металла. Полностью расплавляется, и температура повышается снова.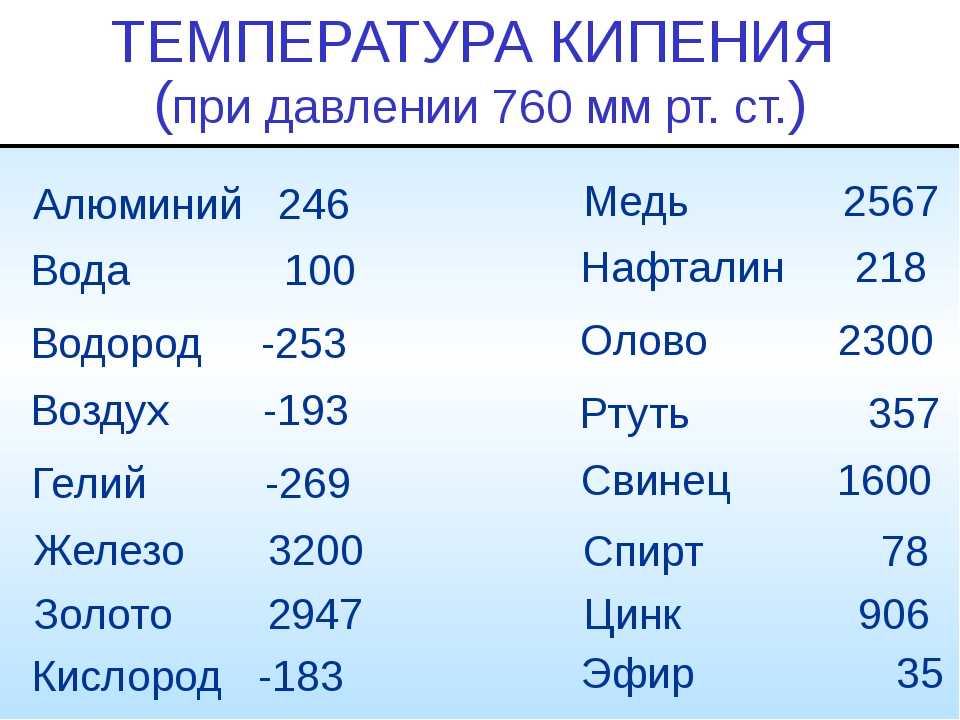
Когда металл охлаждается, температура снижается, в определенный момент остается на прежнем уровне, пока металл не затвердеет полностью. После полного затвердевания температура снижается опять. Это демонстрирует фазовая диаграмма, где отображен температурный процесс с начала плавления до затвердения. При нагревании разогретая медь при 2560 ° C начинает закипать. Кипение подобно кипению жидких веществ, когда выделяется газ и появляются пузырьки на поверхности. В момент кипения при максимально больших температурах начинается выделение углерода, образующегося при окислении.
Методы, используемые для плавления меди дома
Плавка меди в домашних условиях возможна несколькими способами. Для этого понадобятся определенные инструменты:
- сырье;
- жаропрочный тигель;
- огнеупорная подставка;
- проволочный крюк;
- щипцы для извлечения горячего тигля;
- средства защиты: очки, костюм, перчатки.
Плавление меди дома и на производстве происходит одинаково. Этого добиваются следующими методами:
Этого добиваются следующими методами:
- с помощью муфельной печи;
- с использованием кислородного пламени;
- горном;
- паяльной лампой;
- плавлением в микроволновой печи.
Процесс плавления меди в домашних условиях
С помощью муфельной печи
Литье меди с помощью муфельной печи — довольно простой и удобный метод. Медное сырье измельчают на части, чтобы они быстрее расплавились. Готовый материал кладут в графитовый тигель и помещают в разогретую печь. Форма для литья должна иметь большую температуру плавления, чем цветмет.
Когда сырье станет жидким, тигель с помощью щипцов извлекают из печи. Крюком с поверхности металла убирают оксидную пленку. Затем жидкость наливают в заранее подготовленную форму.
Из чего состоит муфельная печь
Газовая горелка или паяльная лампа
Плавление меди горелкой
Специальную печь может заменить газовая горелка или паяльная лампа. Ее размещают под дном емкости с металлом и следят, чтобы пламя охватывало днище полностью.
При использовании данного метода материал быстро окисляется, поэтому, чтобы не образовалась толстая оксидная пленка, сверху сырье присыпают частицами древесного угля.
Для плавления легкоплавких сплавов из латуни или бронзы вполне достаточно газовой горелки или паяльной лампы.
Горн
Расплавить медь можно с помощью горна. Для этого тигель с измельченным сырьем размещают на раскаленном древесном угле. Чтобы ускорить плавление, используют домашний пылесос, включенный в режиме выдувания. Труба должна иметь металлический зауженный наконечник, так как под воздействием высокой температуры пластик расплавится. Такой метод подойдет для тех, кто регулярно занимается плавлением меди дома.
Чтобы повысить температуру, следует вдувать в горн больше воздуха.
Чертеж передвижного горна
Микроволновая печь
Поможет расплавить медь в домашних условиях мощная микроволновая печь. Для этого убирают вращающуюся тарелку. Чтобы сохранить работоспособность внутренних деталей техники, необходимо поместить тигель в жаропрочный материал, например, обложить огнеупорными кирпичами.
Плавка металлов в микроволновке
Видео по теме: Плавка меди в микроволновке
Публикации по теме
Необходимая температура и процесс плавления бронзы
Показатель температуры плавления латуни для домашнего мастера
Особенности пайки алюминия в домашних условиях
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Твердые тела – Температуры плавления и кипения
- Плавление или плавление – фазовый переход вещества из твердого состояния в жидкое
- Кипение – фазовый переход вещества из жидкого состояния в газообразное
Плавление и кипение Температура некоторых продуктов:
| Продукт | Печата плавления ( O C) | TOPE ( O C)
.
Этот список содержит 118 химических элементов.
|
|---|

 2075, кип. 3700
2075, кип. 3700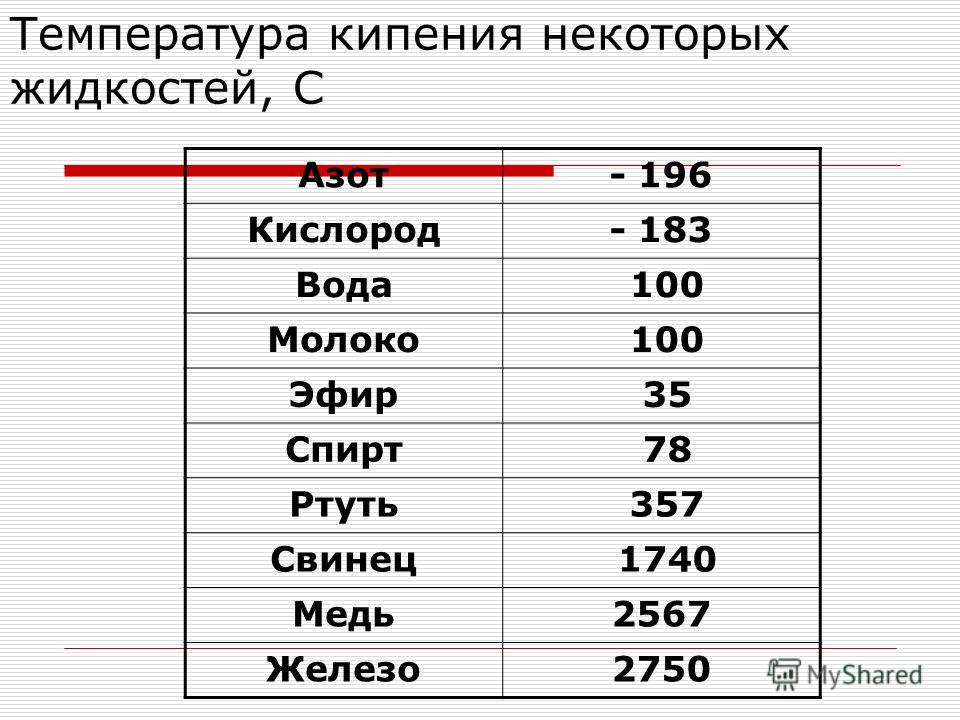 — 182, кип.- 162
— 182, кип.- 162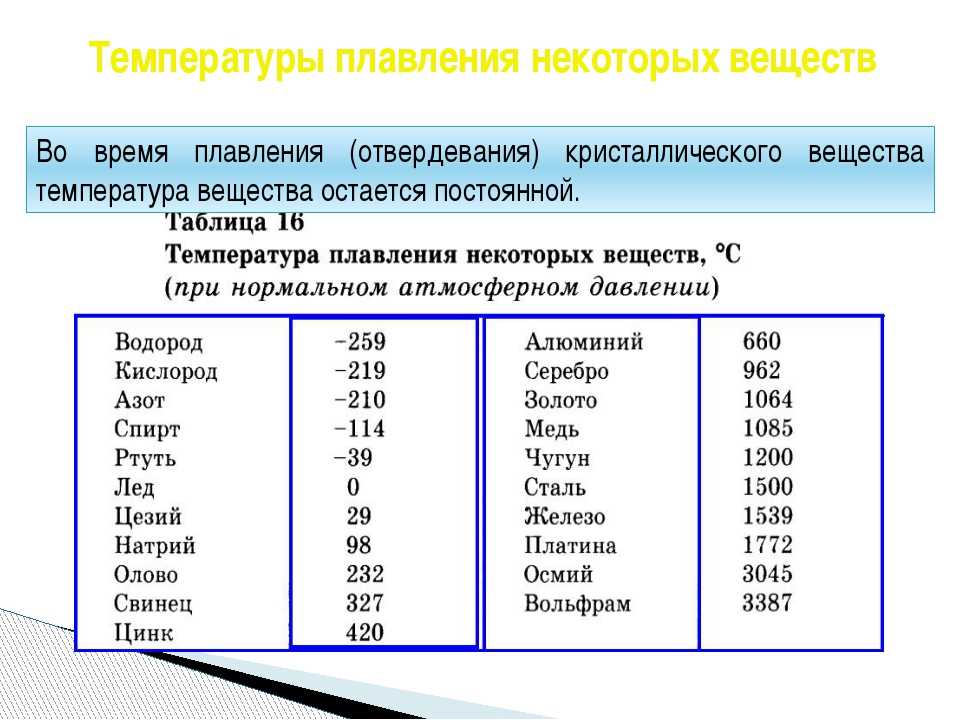 4, разл. > 20
4, разл. > 20 1539, кип. ок. 3200
1539, кип. ок. 3200 — 84, кип. +20
— 84, кип. +20 61, разл. 300
61, разл. 300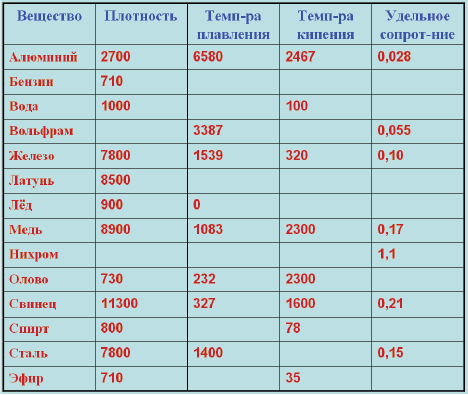 — 39, кип. +357
— 39, кип. +357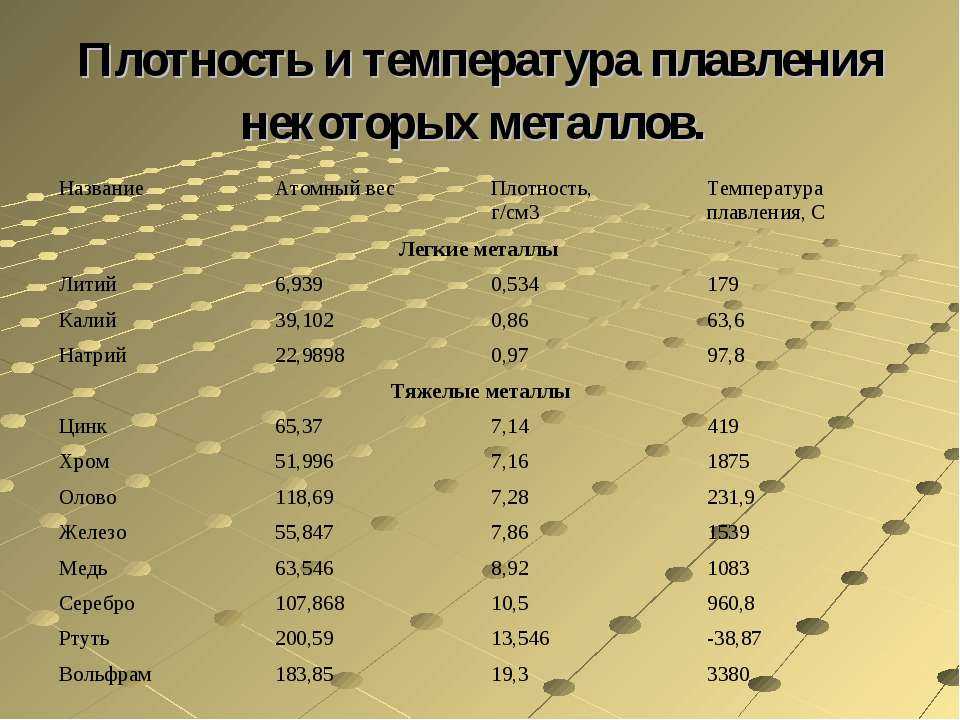 2080
2080 — 164, кип.- 152
— 164, кип.- 152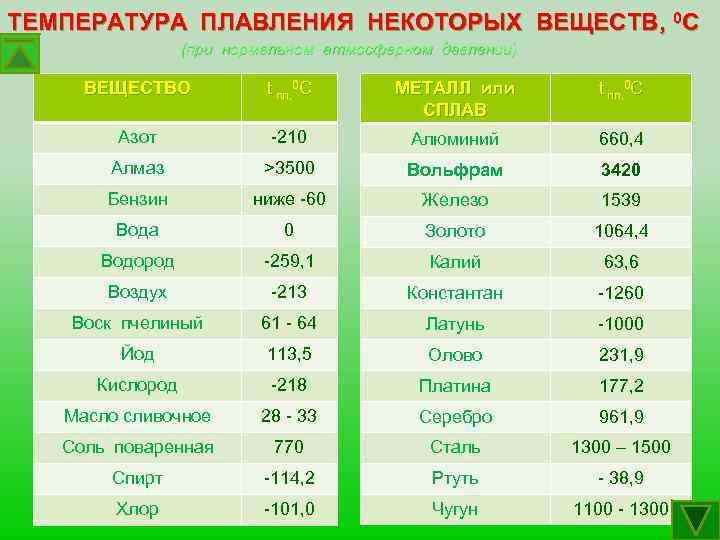 — 219, кип.- 183
— 219, кип.- 183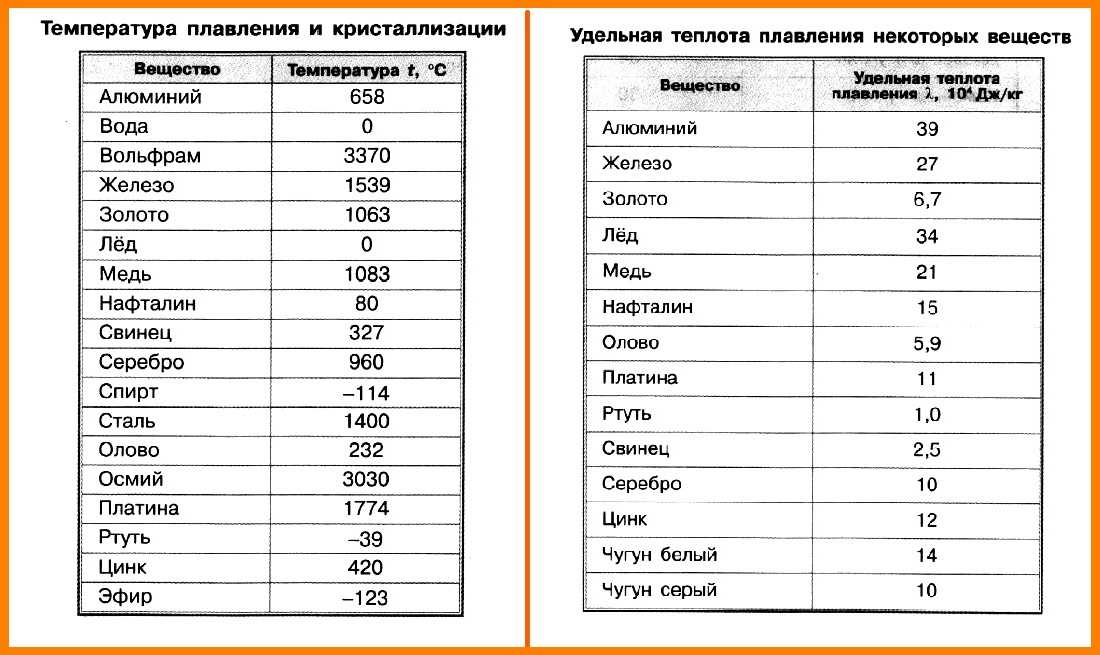 > 344
> 344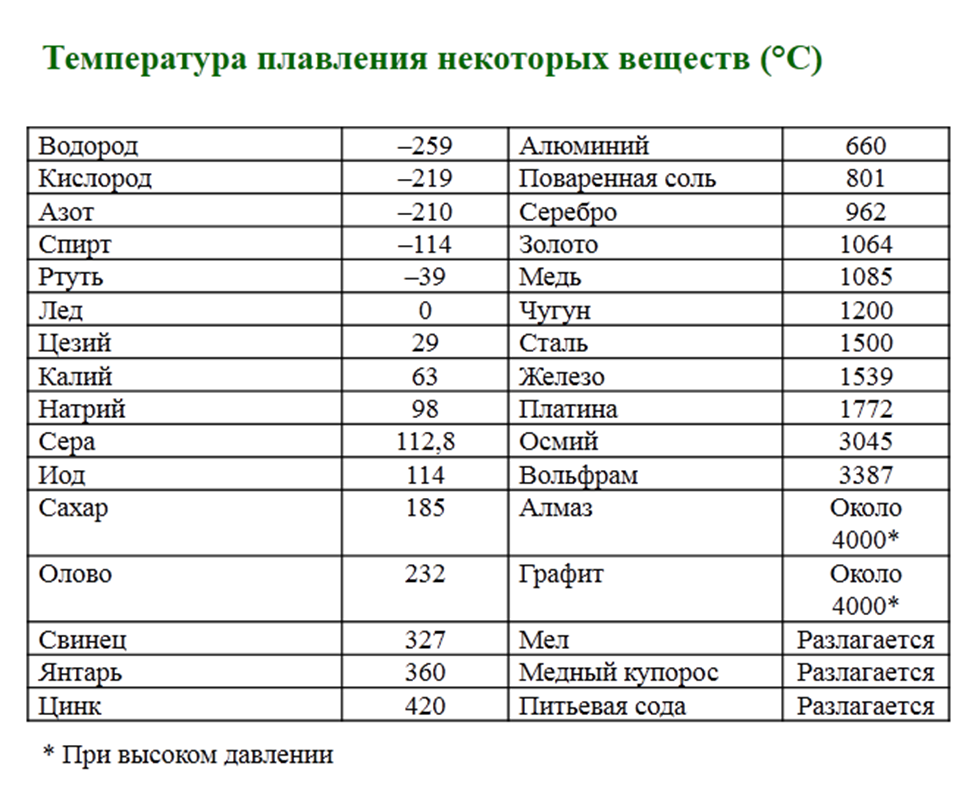 1634
1634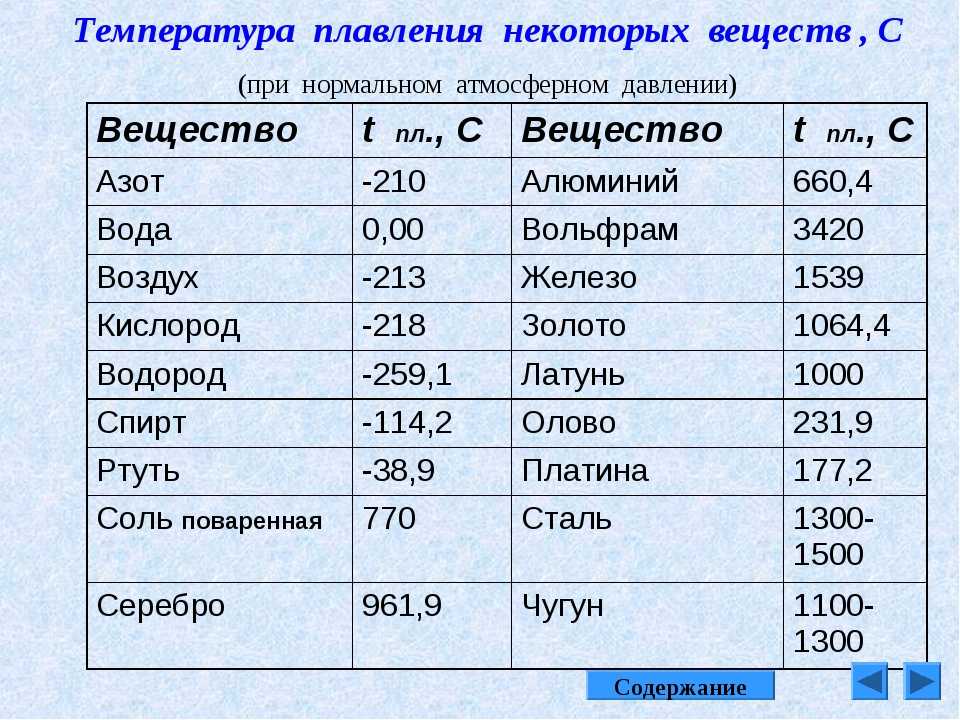 1040, кип. 1425
1040, кип. 1425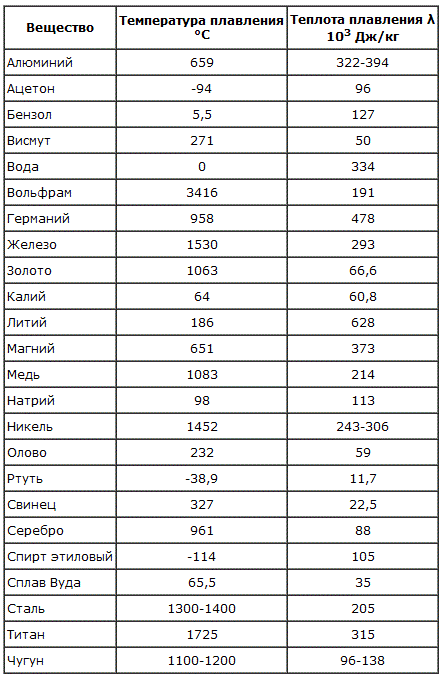 303, кип. ок. 1100
303, кип. ок. 1100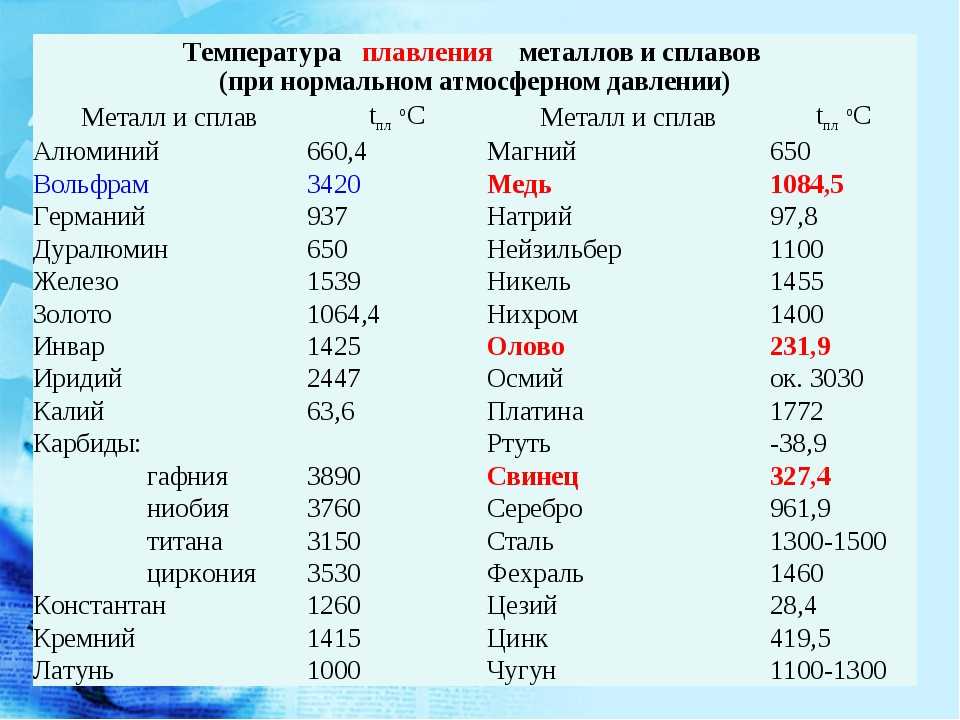 4
4 3
3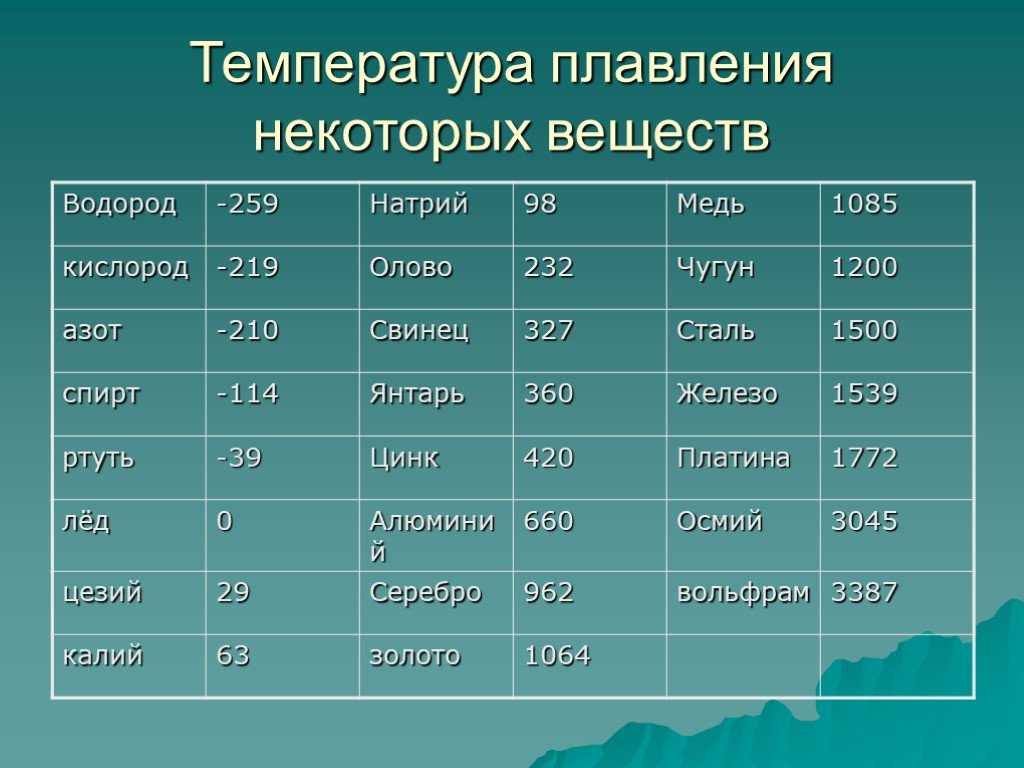 4
4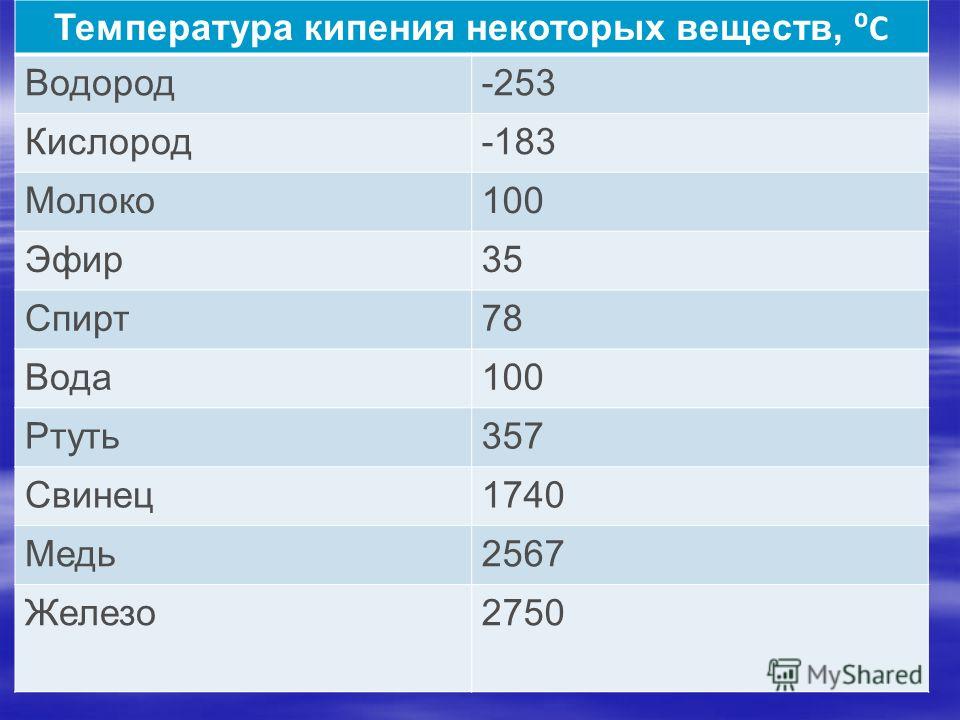 Элементы химических веществ в периодическом таблице. .
Элементы химических веществ в периодическом таблице. . 0754 — Density
0754 — Density 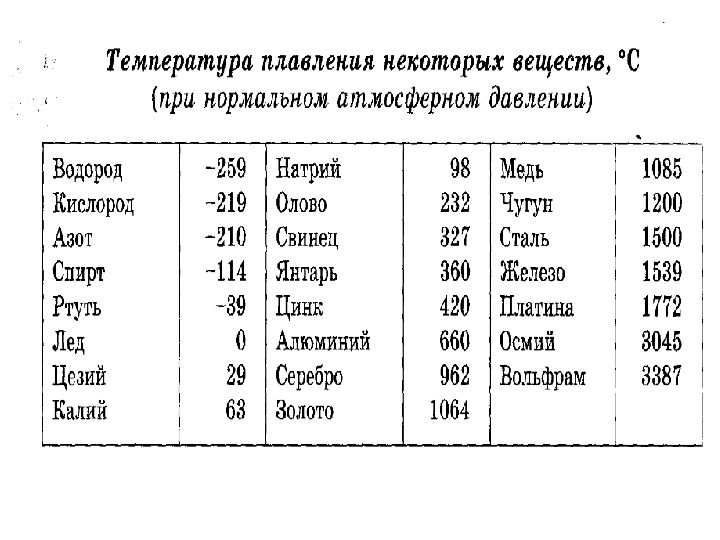 8
8