Медь свойства химические и физические: Свойства меди – все важные характеристики металла + Видео
Содержание
Химические свойства элементов:медь, нахождение меди в природе, получение меди, свойства меди
Ключевые слова: медь, нахождение меди в природе, получение меди, физические свойства меди, сплавы. меди, химические свойства меди.
Медь (Cuprum), Си — химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Латинское название происходит от острова Кипр, где древние греки добывали медную руду. Порядковый номер 29, атомная масса меди 63,54. Природная медь состоит из смеси 2-х стабильных изотопов 63Cu (69,1%) и 65Cu (30,9%). Путем бомбардировки никеля протонами или ядрами дейтерия искусственно получают радиоактивные изотопы меди 6lCu и 64Си с периодами полураспада 3,3 и 12,8 часов соответственно. Эти изотопы обладают высокой удельной активностью и используются в качестве меченых атомов. В химическом отношении медь занимает промежуточное положение между элементами главной подгруппы VIII группы и щелочными элементами I группы периодической системы.
НАХОЖДЕНИЕ МЕДИ В ПРИРОДЕ
Содержание меди в земной коре составляет около 0,01%. Она встречается в свободном состоянии в виде самородков, достигающих значительных размеров (до нескольких тонн). Однако руды самородной меди сравнительно мало распространены, и в настоящее время из них добывается не более 5% меди от общей ее мировой добычи. Медь является халькофильным элементом. До 80% ее присутствует в земной коре в виде соединений с серой. Около 15% меди находится в виде карбонатов, силикатов, оксидов, являющихся продуктами выветривания первичных сульфидных медных руд.Медь образует до 240 минералов, однако лишь около 40 имеют промышленное значение .Различают сульфидные и окисленные руды меди. Промышленное значение имеют сульфидные руды, из которых наиболее широко используется медный колчедан (халькопирит) CuFeS2. В природе он встречается главным образом в смеси с железным колчеданом FeS2 и пустой породой, состоящей из оксидов кремния, алюминия, кальция . Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
ПОЛУЧЕНИЕ МЕДИ
Руды и получаемые из них путем механического обогащения концентраты перерабатывают на медь пирометаллургическим и гидрометаллургическим методами . Первый из них применяется преимущественно для переработки сернистых руд. Вторым методом, получившим небольшое распространение, перерабатывают окисленные и смешанные бедные руды, содержащие около 1% меди.Пирометаллургический метод заключается в обжиге концентратов, плавке полученного огарка на штейн (сплав сульфидов меди и железа), продувке штейна в конвертере с получением черновой меди (содержащей около 5% примесей), рафинировании последних огневым процессом или электролизом для получения чистой меди. Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕДИ
Техническая медь — металл красного, в изломе розового цвета, при просвечивании в тонких слоях — зеленовато-голубой. Имеет гранецентрированную кубическую решетку, плотность 8,96 кг/м3 (20°С). Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокими теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности.
СПЛАВЫ МЕДИ
Небольшие примеси висмута (0,001%*) и свинца (0,01%) делают медь ломкой, а примесь серы вызывает хрупкость на холоду .С металлами медь образует различные сплавы. В двухкомпонентных медных сплавах с Zn, Sn, Al, Ni, Fe, Mn, Si, Be, Cr, Pb, P и др. легирующий элемент входит в твердый раствор замещения на основе Си, а также может образовывать электронные соединения, характеризующиеся определенной электронной концентрацией. В многокомпонентных сплавах часто присутствуют сложные металлические соединения точно неустановленного состава. Легирующие элементы вводят в медь для повышения прочности и твердости, улучшения антифрикционных свойств и стойкости против коррозии и для получения сплавов с заданными физическими свойствами. Медные сплавы делят на латуни, бронзы и медно-никелевые сплавы .
легирующий элемент входит в твердый раствор замещения на основе Си, а также может образовывать электронные соединения, характеризующиеся определенной электронной концентрацией. В многокомпонентных сплавах часто присутствуют сложные металлические соединения точно неустановленного состава. Легирующие элементы вводят в медь для повышения прочности и твердости, улучшения антифрикционных свойств и стойкости против коррозии и для получения сплавов с заданными физическими свойствами. Медные сплавы делят на латуни, бронзы и медно-никелевые сплавы .
Латунями называют сплавы меди и цинка. Медь может растворять цинк в любом количестве. При добавлении к меди до 45—47% Zn увеличивается предел прочности сплава при растяжении; дальнейшее увеличение содержания цинка вызывает снижение предела прочности. Вязкость (пластичность) сплава возрастает при добавлении к меди до 30—32% Zn, а затем уменьшается, достигая очень малой величины при содержании 47—50% Zn.
Ковкая латунь (мунц-металл) содержит 60% Си и 40% Zn, томпак — 90—80% Си и 10—20% Zn. Состав специальных латуней: алюминиевая (66—68% Си, ~3% А1, ~30% Zn), марганцовисто-свинцовая (57—60% Си, 1,5—2,5% РЬ; 1,5—2,5% Мп, -38% Zn).
Состав специальных латуней: алюминиевая (66—68% Си, ~3% А1, ~30% Zn), марганцовисто-свинцовая (57—60% Си, 1,5—2,5% РЬ; 1,5—2,5% Мп, -38% Zn).
Бронзами называют сплавы меди с оловом. В присутствии олова улучшаются механические свойства меди, бронзы обладают хорошими литейными свойствами. Обычно содержание олова не превышает 10%. Алюминиевая бронза содержит 82—90% Си, 4—10% Al, 1—6% Fe + Si; кремнеоловянная бронза — 99,94% Си, по 0,03% Sn и Si.
Сплавы меди с никелем. Никель сильно повышает твердость меди. Сплав 50% Си и 50% Ni обладает наибольшей твердостью. Кроме высокой твердости, эти сплавы обладают пониженной электропроводностью, вследствие чего употребляются в электротехнике .
Хорошие механические свойства, высокая стойкость против коррозии во многих средах, ценные физические свойства в сочетании с простотой плавки, литья и обработки давлением обусловили широкое применение медных сплавов в многочисленных отраслях техники: в авиа-, авто-, судостроении, химической промышленности, станкостроении, электротехнике, приборостроении, в производстве паровой и водяной арматуры, посуды, художественных и других изделий.
ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ
Медь — электроположительный металл. Медь вытесняется из своих солей более электроотрицательными элементами и не растворяется в кислотах, не являющихся окислителями. Медь растворяется в азотной кислоте с образованием (Си(NOз)2 и оксидов азота, в горячей конц. H2SO4 — с образованием CuSO4 и SO2. В нагретой разбавленной H2SO4 медь растворяется только при продувании через раствор воздуха .Химическая активность меди невелика, при температурах ниже 185°С с сухим воздухом и кислородом не реагирует. В присутствии влаги и СО2 на поверхности меди образуется зеленая пленка основного карбоната. При нагревании меди на воздухе идет поверхностное окисление; ниже 375°С образуется СиО, а в интервале 375—1100°С при неполном окислении меди — двухслойная окалина (СиО + СuО). Влажный хлор взаимодействует с медью уже при комнатной температуре, образуя хлорид меди(II), хорошо растворимый в воде.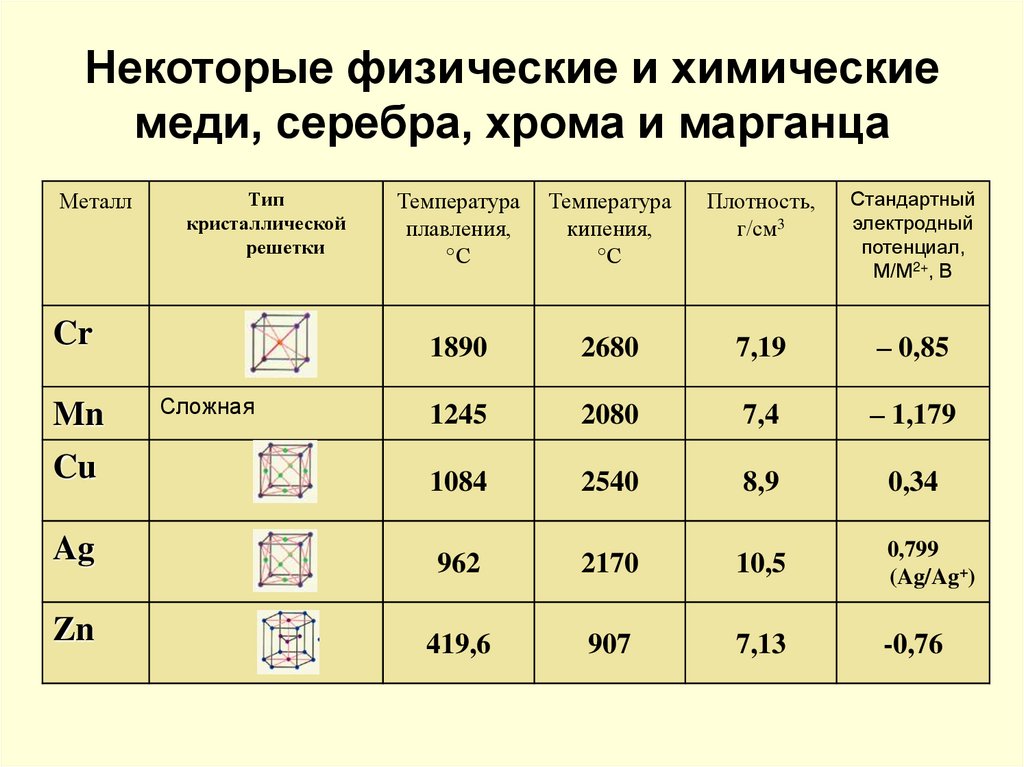 Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»). При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»). При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
Сплавы меди
Реакции с медью(взаимодействие меди)
Оксиды меди
Сульфат меди
Хлорид меди
Нитрат меди
Гидроксид меди
Медь — конспект — Химия | Рефераты Химия
Скачай Медь — конспект — Химия и еще Рефераты в формате PDF Химия только на Docsity! Министерство высшего образования Российской Федерации Башкирский государственный университет Кафедра неорганической химии Курсовая работа Медь Выполнил студент I курса В группы Панкратьев Е.Ю. Проверил доцент кафедры Н.Х. Гайфутдинова Р.К. 2 Уфа 2002. Содержание: 1. Распространение меди в природе. — 3 2. История открытия меди. — 3 3. Месторождений меди. — 4 4. Физические свойства меди. — 5 5. Химические свойства меди. — 6 6. Получение меди. — 10 7. Добыча и получение солей из природных месторождений. — 11 8. Медь и живые организмы. — 12 9. Применение меди. — 12 10. Использованная литература. — 13 2 найдена. В 1652 г. Казанский воевода сообщил царю: “Медные руды… сыскано много и заводы к медному делу заводим”. [2, с.26] Из документов следует, что с 1562 по 1664 г. было послано из “Казани к Москве чистыя меди 4641 пуд. 6 гривенков”. В 1702 г. стала выходить первая русская газета “Ведомости”, которую, очевидно, редактировал Петр I. 2 января 1703 г. в ней писали: “Из Казани пишут. На реке Соку нашли много нефти и медной руды, из той руды меди выплавили изрядно, отчего чают не малую прибыль Московскому государству”. [2, с.27] В начале этого столетия главнейшими месторождениями, которые разрабатывались, были: в районе Северного Урала – Богословский завод, в районе Нижнего Тагила – Выйский завод, а на Кавказе – Калакентский и Кедабекский заводы. В наше время известны месторождения меди на восточном склоне Урала, Средней Азии, Закавказье и т.д. Большое количество меди и других ископаемых находится на дне океанов, которое покрыто так называемыми конкрециями – скоплениями в виде камней округлой неправильной формы.
Казанский воевода сообщил царю: “Медные руды… сыскано много и заводы к медному делу заводим”. [2, с.26] Из документов следует, что с 1562 по 1664 г. было послано из “Казани к Москве чистыя меди 4641 пуд. 6 гривенков”. В 1702 г. стала выходить первая русская газета “Ведомости”, которую, очевидно, редактировал Петр I. 2 января 1703 г. в ней писали: “Из Казани пишут. На реке Соку нашли много нефти и медной руды, из той руды меди выплавили изрядно, отчего чают не малую прибыль Московскому государству”. [2, с.27] В начале этого столетия главнейшими месторождениями, которые разрабатывались, были: в районе Северного Урала – Богословский завод, в районе Нижнего Тагила – Выйский завод, а на Кавказе – Калакентский и Кедабекский заводы. В наше время известны месторождения меди на восточном склоне Урала, Средней Азии, Закавказье и т.д. Большое количество меди и других ископаемых находится на дне океанов, которое покрыто так называемыми конкрециями – скоплениями в виде камней округлой неправильной формы. Они содержат в среднем 0,5% меди. По подсчетам ученых запасы этой ценной и своеобразной руды составляют 5 млрд. тонн. [1, с.16-18] 4. Физические свойства меди. Tплавления Tкипения ra Ρ Rудельное 1083 0C 2877 0C 98 нм 8,96 г/cм3 1,63*10-8 ом*м Таблица 1. Физические свойства меди. Металлы подгруппы меди, как и щелочные металлы, имеют по одному свободному электрону на один ион-атом металла. Казалось бы, эти металлы не должны особенно сильно отличатся от щелочных. Но они, в отличие от щелочных металлов, обладают довольно высокими температурами плавления. Большое различие в температурах плавления между металлами этих подгрупп объясняется тем, что между ион-атомами металлов подгруппы меди почти нет “зазоров” и они расположены более близко. Вследствие этого количество свободных электронов в единице объема, электронная плотность, у них больше. Следовательно, и прочность химической связи у них больше. Поэтому металлы подгруппы меди плавятся и кипят при более высоких температурах. Металлы подгруппы меди обладают, по сравнению с щелочными металлами, обладают большей твердостью.
Они содержат в среднем 0,5% меди. По подсчетам ученых запасы этой ценной и своеобразной руды составляют 5 млрд. тонн. [1, с.16-18] 4. Физические свойства меди. Tплавления Tкипения ra Ρ Rудельное 1083 0C 2877 0C 98 нм 8,96 г/cм3 1,63*10-8 ом*м Таблица 1. Физические свойства меди. Металлы подгруппы меди, как и щелочные металлы, имеют по одному свободному электрону на один ион-атом металла. Казалось бы, эти металлы не должны особенно сильно отличатся от щелочных. Но они, в отличие от щелочных металлов, обладают довольно высокими температурами плавления. Большое различие в температурах плавления между металлами этих подгрупп объясняется тем, что между ион-атомами металлов подгруппы меди почти нет “зазоров” и они расположены более близко. Вследствие этого количество свободных электронов в единице объема, электронная плотность, у них больше. Следовательно, и прочность химической связи у них больше. Поэтому металлы подгруппы меди плавятся и кипят при более высоких температурах. Металлы подгруппы меди обладают, по сравнению с щелочными металлами, обладают большей твердостью. Объясняется это увеличением электронной плотностью и отсутствием “зазоров” между ион-атомами. Необходимо отметить, что твердость и прочность металлов зависят от правильности расположения ион-атомов в кристаллической решетке. В металлах, с которыми мы практически сталкиваемся, имеются различного рода нарушения правильного расположения ион-атомов, например пустоты в узлах кристаллической решетки. К тому же металл состоит из мелких кристалликов (кристаллитов), между которыми связь ослаблена. В Академии Наук СССР была получена медь без нарушения в кристаллической решетке. Для этого очень чистую медь возгоняли при высокой температуре в глубоком вакууме на глубокую подложку. Медь получалась в виде небольших ниточек – “усов”. Как оказалось такая медь в сто раз прочнее, чем обычная. Цвет меди и её соединений. Чистая медь обладает и другой интересной особенностью. Красный цвет обусловлен следами растворенного в ней кислорода. Оказалось, что медь, многократно возогнанная в вакууме (при отсутствии кислорода), имеет желтоватый цвет.
Объясняется это увеличением электронной плотностью и отсутствием “зазоров” между ион-атомами. Необходимо отметить, что твердость и прочность металлов зависят от правильности расположения ион-атомов в кристаллической решетке. В металлах, с которыми мы практически сталкиваемся, имеются различного рода нарушения правильного расположения ион-атомов, например пустоты в узлах кристаллической решетки. К тому же металл состоит из мелких кристалликов (кристаллитов), между которыми связь ослаблена. В Академии Наук СССР была получена медь без нарушения в кристаллической решетке. Для этого очень чистую медь возгоняли при высокой температуре в глубоком вакууме на глубокую подложку. Медь получалась в виде небольших ниточек – “усов”. Как оказалось такая медь в сто раз прочнее, чем обычная. Цвет меди и её соединений. Чистая медь обладает и другой интересной особенностью. Красный цвет обусловлен следами растворенного в ней кислорода. Оказалось, что медь, многократно возогнанная в вакууме (при отсутствии кислорода), имеет желтоватый цвет. Медь в полированном состоянии обладает сильным блеском. 2 При повышении валентности понижается окраска меди, например CuCl – белый, Cu2O – красный, CuCl + h3O – голубой, CuO – черный. Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем обусловлен интересный практический признак для поисков. Электропроводимость. Медь обладает наибольшей (после серебра) электропроводимостью, чем и обусловлено её применение в электронике. Кристаллическая решетка. Медь кристаллизируется по типу централизованного куба (рис 1). Рисунок 1. Кристаллическая решетка меди. 5. Химические свойства меди. Строение атома. Рисунок 2. Схема строения атома меди. 29Cu 1s1 2s2 sp6 3s2 3p6 3d10 4s1 Eионизации 1 = 7.72 эВ Eионизации 2 = 20.29 эВ Eионизации 3 = 36.83 эВ Отношение к кислороду. Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди: В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди: Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета.
Медь в полированном состоянии обладает сильным блеском. 2 При повышении валентности понижается окраска меди, например CuCl – белый, Cu2O – красный, CuCl + h3O – голубой, CuO – черный. Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем обусловлен интересный практический признак для поисков. Электропроводимость. Медь обладает наибольшей (после серебра) электропроводимостью, чем и обусловлено её применение в электронике. Кристаллическая решетка. Медь кристаллизируется по типу централизованного куба (рис 1). Рисунок 1. Кристаллическая решетка меди. 5. Химические свойства меди. Строение атома. Рисунок 2. Схема строения атома меди. 29Cu 1s1 2s2 sp6 3s2 3p6 3d10 4s1 Eионизации 1 = 7.72 эВ Eионизации 2 = 20.29 эВ Eионизации 3 = 36.83 эВ Отношение к кислороду. Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди: В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди: Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие. Qобразования (Cu2O) = 84935 кДж. 2 8 18 1+29 Cu 2 Рисунок 3. Строение оксидной пленки меди. Взаимодействие с водой. Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например: . Эта реакция окислительно-восстановительная, так как происходит переход электронов: Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода. Медь при отсутствии кислорода с водой практически не взаимодействует.
К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие. Qобразования (Cu2O) = 84935 кДж. 2 8 18 1+29 Cu 2 Рисунок 3. Строение оксидной пленки меди. Взаимодействие с водой. Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например: . Эта реакция окислительно-восстановительная, так как происходит переход электронов: Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода. Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната: Взаимодействие с кислотами. Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей: . Отношение к галогенам и некоторым другим неметаллам. Qобразования (CuCl) = 134300 кДж Qобразования (CuCl2) = 111700 кДж Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl.
В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната: Взаимодействие с кислотами. Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей: . Отношение к галогенам и некоторым другим неметаллам. Qобразования (CuCl) = 134300 кДж Qобразования (CuCl2) = 111700 кДж Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты. Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например: . Монохлорид выпадает из раствора в виде белого осадка на поверхности меди. Оксид меди. Cu2O Cu CuO 2 потом раствор позеленел и выпал чёрный осадок Cd2+ Дифенил-карб азид Раствор стал красным Есть Cd Zn2+ Дитизон Фаза дитизона окрасилась в малиновый цвет Есть Zn Mn NaBiO3 Ничего не произошло Mn нет Al3+ Ализарин Раствор стал жёлто-коричневым Al нет Окси-хинолин Выпал зелёно-жёлтый осадок Al нет Раствор 2 HCl, h3SO4, добавление Раствор 3 возможно содержит Sb, Sn Осадок не выпал Pb возможно нет Раствор 3 h3O2 и NaOH Осадок 1 может содержать Sb Раствор 4 может содержать Sn Выпал зелёно-серый осадок (образовался ос.2 и р-р 2) Осадок 1 HNO3 Раствор 5 Осадок растворился Sb нет Раствор 5 Nh4, Nh5Cl, h3O2 Осадок не выпал Раствор 4 Nh5Cl Осадок не выпал Sn нет Раствор 2 I- Выпал жёлтый осадок, который приобрёл красный оттенок Есть Pb2+ Выводы: Проведённый качественный анализ даёт основания считать, что в сплаве содержится медь, цинк, кадмий, железо, свинец.
Реакция происходит самопроизвольно за счет выделяющейся теплоты. Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например: . Монохлорид выпадает из раствора в виде белого осадка на поверхности меди. Оксид меди. Cu2O Cu CuO 2 потом раствор позеленел и выпал чёрный осадок Cd2+ Дифенил-карб азид Раствор стал красным Есть Cd Zn2+ Дитизон Фаза дитизона окрасилась в малиновый цвет Есть Zn Mn NaBiO3 Ничего не произошло Mn нет Al3+ Ализарин Раствор стал жёлто-коричневым Al нет Окси-хинолин Выпал зелёно-жёлтый осадок Al нет Раствор 2 HCl, h3SO4, добавление Раствор 3 возможно содержит Sb, Sn Осадок не выпал Pb возможно нет Раствор 3 h3O2 и NaOH Осадок 1 может содержать Sb Раствор 4 может содержать Sn Выпал зелёно-серый осадок (образовался ос.2 и р-р 2) Осадок 1 HNO3 Раствор 5 Осадок растворился Sb нет Раствор 5 Nh4, Nh5Cl, h3O2 Осадок не выпал Раствор 4 Nh5Cl Осадок не выпал Sn нет Раствор 2 I- Выпал жёлтый осадок, который приобрёл красный оттенок Есть Pb2+ Выводы: Проведённый качественный анализ даёт основания считать, что в сплаве содержится медь, цинк, кадмий, железо, свинец. Таким образом этот сплав является латунью. [8] 6. Получение меди. История получения меди. Интересна история получения меди. Уже 5-6 тысяч лет до н.э. медная руда добывалась египетскими рабами в Нубии, на Синайском полуострове. Рудники, как пишет греческий историк Диодор Сицилийский (I век до н.э.), являлись собственностью фараонов. На каторжный труд в рудниках отправляли рабов и осужденных, зачастую вместе с семьями. В наиболее узкие штольни на обивку руды и ее вынос направляли 2 детей. На поверхность руду доставляли в плетеных корзинках или кожаных мешках. Древнейшая медеплавильная печь найдена на Синайском полуострове. Она представляла яму, обнесенную круглой стеной толщиной в 1 метр. Печь имела внизу два поддувала. По составу шлака установили, что в этой печи выплавлялась медь. Изображение более совершенной печи было обнаружено на греческой вазе, которая датируется VI веком до н.э. Для улучшения литейных свойств меди греки добавляли в руду оловянный камень (двуокись олова) и получали оловянную бронзу.
Таким образом этот сплав является латунью. [8] 6. Получение меди. История получения меди. Интересна история получения меди. Уже 5-6 тысяч лет до н.э. медная руда добывалась египетскими рабами в Нубии, на Синайском полуострове. Рудники, как пишет греческий историк Диодор Сицилийский (I век до н.э.), являлись собственностью фараонов. На каторжный труд в рудниках отправляли рабов и осужденных, зачастую вместе с семьями. В наиболее узкие штольни на обивку руды и ее вынос направляли 2 детей. На поверхность руду доставляли в плетеных корзинках или кожаных мешках. Древнейшая медеплавильная печь найдена на Синайском полуострове. Она представляла яму, обнесенную круглой стеной толщиной в 1 метр. Печь имела внизу два поддувала. По составу шлака установили, что в этой печи выплавлялась медь. Изображение более совершенной печи было обнаружено на греческой вазе, которая датируется VI веком до н.э. Для улучшения литейных свойств меди греки добавляли в руду оловянный камень (двуокись олова) и получали оловянную бронзу. Искусство получения меди и ее сплавов затем перешло к римлянам. Оловянную руду римляне доставали из Англии, которая в то время называлась Касситеридскими островами. Интересно отметить, что минерал – двуокись олова и по настоящее время называется касситеритом. О методах получения меди в России дает представление небольшой, но обстоятельный труд М.В.Ломоносова “Основание металлургии” (1763 год), который сыграл исключительную роль в развитии металлургического производства. В этой же книги дано описание “сульфатизирующего обжига”. Он заключался в медленном окислении медной сульфидной руды до сульфата меди кислородом воздуха: с последующим выщелачиванием соли водой с целью получения медного купороса. В книге даются указания, как использовать теплоту отходящих газов, как контролировать процесс плавки и даже как вентилировать шахты от пыли и газов, которые “для человеческого здоровья вредительны”. [1, с.76-77] Получение меди методом электролиза. Электролиз широко применяют для очистки (рафинирования) меди.
Искусство получения меди и ее сплавов затем перешло к римлянам. Оловянную руду римляне доставали из Англии, которая в то время называлась Касситеридскими островами. Интересно отметить, что минерал – двуокись олова и по настоящее время называется касситеритом. О методах получения меди в России дает представление небольшой, но обстоятельный труд М.В.Ломоносова “Основание металлургии” (1763 год), который сыграл исключительную роль в развитии металлургического производства. В этой же книги дано описание “сульфатизирующего обжига”. Он заключался в медленном окислении медной сульфидной руды до сульфата меди кислородом воздуха: с последующим выщелачиванием соли водой с целью получения медного купороса. В книге даются указания, как использовать теплоту отходящих газов, как контролировать процесс плавки и даже как вентилировать шахты от пыли и газов, которые “для человеческого здоровья вредительны”. [1, с.76-77] Получение меди методом электролиза. Электролиз широко применяют для очистки (рафинирования) меди. Для очистки меди из черновой меди отливают аноды – толстые пластины. Их подвешивают в ванну, содержащую раствор медного купороса. В качестве катодов используют тонкие листы чистой меди, на которые во время электролиза осаждается чистая медь. На аноде происходит растворение меди. Ионы меди передвигаются к катоду, принимают от катода электроны и переходят в атомы: . Чистая медь оседает на катоде. Примеси, входящие в состав черновой меди ведут себя по-разному. Более электроотрицательные элементы – цинк, железо, кадмий и другие растворяются на аноде. Но на катоде эти металлы не выделяются, так как электрохимическом ряду напряжений они находятся левее меди и имеют более отрицательные потенциалы. [1, с.70] Металлотермический метод получения. Пирометаллургический способ получения меди. Поскольку содержание меди не превышает 1.5-2%, их подвергают обогащению, т.е. отделяют соединения меди от пустой породы, применяя флотационный метод. Для этого руду размалывают до тончайшего порошка и смешивают его с водой, добавив в неё предварительно флоторагенты – сложные органические вещества.
Для очистки меди из черновой меди отливают аноды – толстые пластины. Их подвешивают в ванну, содержащую раствор медного купороса. В качестве катодов используют тонкие листы чистой меди, на которые во время электролиза осаждается чистая медь. На аноде происходит растворение меди. Ионы меди передвигаются к катоду, принимают от катода электроны и переходят в атомы: . Чистая медь оседает на катоде. Примеси, входящие в состав черновой меди ведут себя по-разному. Более электроотрицательные элементы – цинк, железо, кадмий и другие растворяются на аноде. Но на катоде эти металлы не выделяются, так как электрохимическом ряду напряжений они находятся левее меди и имеют более отрицательные потенциалы. [1, с.70] Металлотермический метод получения. Пирометаллургический способ получения меди. Поскольку содержание меди не превышает 1.5-2%, их подвергают обогащению, т.е. отделяют соединения меди от пустой породы, применяя флотационный метод. Для этого руду размалывают до тончайшего порошка и смешивают его с водой, добавив в неё предварительно флоторагенты – сложные органические вещества. Они покрывают мельчайшие крупинки соединений меди и сообщают им несмачиваемость. В воду добавляют ещё вещества, создающие пену. Затем через взвесь пропускают сильный поток воздуха. Поскольку частички (крупинки соединений меди) водой не смачиваются, они прилипают к пузырькам воздуха и всплывают наверх. Всё это происходит во флотационных аппаратах. Пену, которая содержит крупинки соединений меди, собирают, отфильтровывают, отжимают от воды и высушивают. Так получают концентрат, из которого выделяется медь. В зависимости от состава руды существует несколько методов её переработки. 2 Сульфидную руду сначала обжигают при свободном токе воздуха для удаления части серы: . Этот обжиг проводят в механических печах, похожих на устройства для обжига серного колчедана. В последнее время начали применять обжиг в кипящем слое. Продукты обжига затем переплавляют совместно с флюсами в отражательной печи. При этом протекает множество химических процессов, например . Пустая порода, часть сульфидов и окислов железа переходит в шлак, а на дне печи скапливается штейн – расплав сульфида меди Cu2S и сульфида железа FeS.
Они покрывают мельчайшие крупинки соединений меди и сообщают им несмачиваемость. В воду добавляют ещё вещества, создающие пену. Затем через взвесь пропускают сильный поток воздуха. Поскольку частички (крупинки соединений меди) водой не смачиваются, они прилипают к пузырькам воздуха и всплывают наверх. Всё это происходит во флотационных аппаратах. Пену, которая содержит крупинки соединений меди, собирают, отфильтровывают, отжимают от воды и высушивают. Так получают концентрат, из которого выделяется медь. В зависимости от состава руды существует несколько методов её переработки. 2 Сульфидную руду сначала обжигают при свободном токе воздуха для удаления части серы: . Этот обжиг проводят в механических печах, похожих на устройства для обжига серного колчедана. В последнее время начали применять обжиг в кипящем слое. Продукты обжига затем переплавляют совместно с флюсами в отражательной печи. При этом протекает множество химических процессов, например . Пустая порода, часть сульфидов и окислов железа переходит в шлак, а на дне печи скапливается штейн – расплав сульфида меди Cu2S и сульфида железа FeS. Штейн сливают из печи и перерабатывают в конвекторе, который по устройству похож на конвектор для переработки стали. Частичное удаление серы происходит за счет продувки воздуха через расплавленный штейн: . Сульфид меди и закись меди дают металлическую черновую медь: Она содержит около 95-98% меди. При последующей переплавке на поду отражательной печи содержание меди может быть повышено до 99,7%. Дальнейшая очистка меди проводится электролизом. Более просто перерабатывают окисные руды меди, состоящие из закиси меди, окиси меди и карбонатов меди (Cu2O, CuO, CuCO3*Cu(OH)2). Эти руды обогащения прокаливают с коксом при высокой температуре: . [1, с.74-75] 7. Добыча и получение солей меди из природных месторождений. Около 15% всех руд меди перерабатывается гидрометаллургическим методом – на измельченную руду действуют растворителем, который переводит медь в раствор. На руды, содержащие оксид меди, действуют разбавленной серной кислотой: По сравнению со многими другими оксидами, встречающимися в руде, оксид меди растворяется сравнительно хорошо.
Штейн сливают из печи и перерабатывают в конвекторе, который по устройству похож на конвектор для переработки стали. Частичное удаление серы происходит за счет продувки воздуха через расплавленный штейн: . Сульфид меди и закись меди дают металлическую черновую медь: Она содержит около 95-98% меди. При последующей переплавке на поду отражательной печи содержание меди может быть повышено до 99,7%. Дальнейшая очистка меди проводится электролизом. Более просто перерабатывают окисные руды меди, состоящие из закиси меди, окиси меди и карбонатов меди (Cu2O, CuO, CuCO3*Cu(OH)2). Эти руды обогащения прокаливают с коксом при высокой температуре: . [1, с.74-75] 7. Добыча и получение солей меди из природных месторождений. Около 15% всех руд меди перерабатывается гидрометаллургическим методом – на измельченную руду действуют растворителем, который переводит медь в раствор. На руды, содержащие оксид меди, действуют разбавленной серной кислотой: По сравнению со многими другими оксидами, встречающимися в руде, оксид меди растворяется сравнительно хорошо. Выделение металлической меди из раствора проводят электролизом. Если медь находится в руде в виде сульфида, то ее в раствор можно перевести, обрабатывая ее руду раствором сульфата железа: [1, с.64] 8. Медь и живые организмы. Медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов и ферментов. При отсутствии или недостатке меди в растительных тканях уменьшается содержание хлорофилла, листья желтеют, растение перестает плодоносить и может погибнуть. Чаще всего медь вносят в почву в виде пятиводного сульфата – медного купороса CuSO4*5h3O. В значительных количествах он ядовит, как и многие другие соединения меди, особенно для низших организмов. Польские ученые установили, что в тех водоемах, где присутствует медь, карпы отличаются крупными габаритами. В прудах и озерах, где нет меди, быстро развивается грибок, который поражает карпов. В малых же дозах медь совершенно необходима всему живому.
Выделение металлической меди из раствора проводят электролизом. Если медь находится в руде в виде сульфида, то ее в раствор можно перевести, обрабатывая ее руду раствором сульфата железа: [1, с.64] 8. Медь и живые организмы. Медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов и ферментов. При отсутствии или недостатке меди в растительных тканях уменьшается содержание хлорофилла, листья желтеют, растение перестает плодоносить и может погибнуть. Чаще всего медь вносят в почву в виде пятиводного сульфата – медного купороса CuSO4*5h3O. В значительных количествах он ядовит, как и многие другие соединения меди, особенно для низших организмов. Польские ученые установили, что в тех водоемах, где присутствует медь, карпы отличаются крупными габаритами. В прудах и озерах, где нет меди, быстро развивается грибок, который поражает карпов. В малых же дозах медь совершенно необходима всему живому.
3.5: Различия в материи: физические и химические свойства
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 182627
Цели обучения
Отделить физические свойства от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1,035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| масло кукурузное | 0,922 |
| майонез | 0,910 |
| мед | 1,420 |
Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Рисунок \(\PageIndex{1}\): карандаш (слева) и кольцо с бриллиантом (справа). Оба являются формой углерода, но обладают очень разными физическими свойствами.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывают его способность подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Присутствующие элементы, электроны и связи придают материи потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Рисунок \(\PageIndex{2}\): Сильная ржавчина на звеньях цепи возле моста Золотые Ворота в Сан-Франциско; он постоянно подвергался воздействию влаги и солевых брызг, что приводило к разрушению поверхности, растрескиванию и отслаиванию металла. (CC BY-SA 3.0; Marlith).
Химическим свойством железа является его способность соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физические свойства | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C. | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе.
- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
Раствор
«Железо разъедает во влажном воздухе» — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответить
- с
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответить
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества. Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Включено
- да
- Теги
- химическое свойство
- физическое имущество
- источник-хим-47458
Cooper and Silver: Physical & Chemical Properties — 1976 Words
Для химической и металлургической промышленности тщательное изучение свойств используемых материалов и применение справочных данных для анализа и возможного прогнозирования результатов практического применения важно. Таким образом, фактически информация о материале, его химическом составе и физико-химических свойствах имеет решающее значение для принятия решения о его полезности в конкретных практических задачах. Вообще говоря, возможность применения конструкционного материала в технических науках определяется его характеристиками. Такой подход обусловлен как необходимостью соответствия параметров материала промышленному применению, так и минимизацией повреждений в сочетании с созданием продукции более высокого качества.
Такой подход обусловлен как необходимостью соответствия параметров материала промышленному применению, так и минимизацией повреждений в сочетании с созданием продукции более высокого качества.
Исследовательский вопрос данной работы сводился к анализу двух неактивных металлов — серебра и меди — по их физико-химическим параметрам для оценки их потенциального использования в промышленности. Характеристики, представляющие интерес и, следовательно, подлежащие измерению в данной работе, включают температуру, термодинамические и физические параметры. В частности, для меди и серебра описаны температуры плавления и кипения, а также плотность материалов и их удельная теплоемкость. Также указано электрическое сопротивление в сочетании с коэффициентом термической стабильности. Кроме того, учитывая, что оба металла являются классическими проводниками электрического тока, повышенный интерес вызвал регрессионный анализ электрического сопротивления в зависимости от температуры: если оба материала линейно увеличивают сопротивление, важно определить более подходящий материал для производственных задач. при заданной температуре. В то же время исследование удельной поглощаемой энергии является задачей проектирования элементов уменьшенной массы. Известно, что эта характеристика определяется как количество энергии — тепловой или электрической — поглощаемой единицей массы вещества. Таким образом, при разных значениях параметра приоритетное преимущество будет иметь тот материал, который поглощает больше энергии в электрохимической и машиностроительной промышленности. По этой причине оценка этого параметра представляет собой интригующую часть исследования, позволяющего определить эффективность меди и серебра как конструкционных материалов.
при заданной температуре. В то же время исследование удельной поглощаемой энергии является задачей проектирования элементов уменьшенной массы. Известно, что эта характеристика определяется как количество энергии — тепловой или электрической — поглощаемой единицей массы вещества. Таким образом, при разных значениях параметра приоритетное преимущество будет иметь тот материал, который поглощает больше энергии в электрохимической и машиностроительной промышленности. По этой причине оценка этого параметра представляет собой интригующую часть исследования, позволяющего определить эффективность меди и серебра как конструкционных материалов.
Актуальность данной темы была продиктована необходимостью качественной и количественной оценки двух металлов для реализации проектных задач. Исследования широкого спектра цифровых научных статей привели к выводу, что хотя сравнение серебра и меди не является новаторской идеей данной работы, большинство работ ориентированы на узко заданное направление, игнорируя общую информацию (Хлина и др. , 2017; Барахона и др., 2016). По этой причине данная диссертация будет подходящим материалом для обобщения имеющейся информации и демонстрации логики расчета и интерпретации некоторых наиболее важных величин.
, 2017; Барахона и др., 2016). По этой причине данная диссертация будет подходящим материалом для обобщения имеющейся информации и демонстрации логики расчета и интерпретации некоторых наиболее важных величин.
Определение физических свойств
Для облегчения визуализации и создания более понятного сравнения физические свойства двух металлов показаны в таблице 1.
Таблица 1. Сводная информация о физических свойствах материалов (Helmenstine, 2019 ; Hampson & Hanssen, 2019; Sebastian et al., 2017).
Как видно, данные по каждому металлу представляют собой набор чисел, значение которых, однако, больше для меди, чем для серебра. Таким образом, физические свойства меди и серебра различны по каждому из параметров, что и обосновывает столь разное использование материалов в промышленности. Прежде чем продемонстрировать практическое использование данных, необходимо уточнить, какие параметры были предложены для обсуждения. Температурой плавления металлов называют температуру перехода твердого кристаллического вещества в жидкую фазу, и наоборот. Температура кипения считается температурным порогом, при котором жидкость закипает при постоянном давлении. В то же время интересно отметить, что температуры плавления и кипения, хотя и являются сходными характеристиками, на самом деле представляют собой совершенно разные структурные изменения в материалах. При плавлении жидкая и твердая фазы находятся в равновесии, тогда как при кипении начинает преобладать жидкость. Плотность — скалярная физическая величина, зависящая от строения кристаллической решетки, определяемая для однородного вещества массой единицы его объема. Таким образом, из двух материалов одинакового объема большую массу имеет тот, у которого плотность выше. Удельная теплоемкость характеризует количество тепловой энергии, которое необходимо передать материалу, чтобы изменить его температуру на один градус. Из названия этого термина, электрическое сопротивление, становится ясно, что он описывает потенциал для проведения электрического тока: чем выше сопротивление, тем слабее проводится ток.
Температура кипения считается температурным порогом, при котором жидкость закипает при постоянном давлении. В то же время интересно отметить, что температуры плавления и кипения, хотя и являются сходными характеристиками, на самом деле представляют собой совершенно разные структурные изменения в материалах. При плавлении жидкая и твердая фазы находятся в равновесии, тогда как при кипении начинает преобладать жидкость. Плотность — скалярная физическая величина, зависящая от строения кристаллической решетки, определяемая для однородного вещества массой единицы его объема. Таким образом, из двух материалов одинакового объема большую массу имеет тот, у которого плотность выше. Удельная теплоемкость характеризует количество тепловой энергии, которое необходимо передать материалу, чтобы изменить его температуру на один градус. Из названия этого термина, электрическое сопротивление, становится ясно, что он описывает потенциал для проведения электрического тока: чем выше сопротивление, тем слабее проводится ток. Наконец, зависимость электрического сопротивления вещества от его текущей температуры характеризуется температурным коэффициентом сопротивления.
Наконец, зависимость электрического сопротивления вещества от его текущей температуры характеризуется температурным коэффициентом сопротивления.
Ориентируясь только на цифры из таблицы, необходимо сделать сразу несколько важных замечаний. Прежде всего, правильно будет отметить, что медь – более «твердый» металл, чем серебро. Хотя серебро на самом деле имеет большую молекулярную массу и плотность, оно относительно хорошо проводит электрический ток и требует меньших внешних усилий для использования в качестве проводника. Это также может быть связано с большим количеством свободных электронов. Во-вторых, для меди ситуация, по-видимому, обратная: металл имеет более высокие температуры кипения и плавления, что свидетельствует об относительной сложности его атомной структуры по сравнению с серебром. В-третьих, термоэлектрические свойства меди также показывают более высокую жесткость, а именно то, что металлу требуется больше тепловой энергии для нагрева на 1 градус: теплоемкость меди выше. Более высокая теплоемкость по сравнению с серебром делает медь более устойчивой к передаче электричества, а превосходное удельное электрическое сопротивление только подтверждает этот факт.
Более высокая теплоемкость по сравнению с серебром делает медь более устойчивой к передаче электричества, а превосходное удельное электрическое сопротивление только подтверждает этот факт.
Для того чтобы построить зависимость электрического сопротивления от температуры, необходимо обратиться к формуле этого параметра, представленной ниже. С помощью программы MS Excel были выполнены расчеты сопротивления для семнадцати контрольных точек и построен график, показанный на рисунке 1. Нетрудно заметить, что электрическое сопротивление каждого из металлов линейно возрастает с повышением температуры. Фактически это означает, что чем выше температура среды, тем более сложный материал будет выполнять функции проводника. Например, если бы нужно было выбирать, какой материал использовать для высокотемпературной работы под высоким напряжением, то при прочих равных условиях серебро было бы более выгодным вариантом.
p i = p 20 [1 + α(t – 20°C)]
Рис. 1. График зависимости электрического сопротивления от температуры.
1. График зависимости электрического сопротивления от температуры.
Интересно отметить, что в основе явления линейности увеличения теплоемкости при повышении температуры лежит квантовое изменение конфигураций атомов. В частности, каждый из элементов имеет определенный запас колебательных и вращательных уровней внутренней энергии, которые начинают возбуждать в случае поступления в вещество дополнительной теплоты. Так как атом нагревается, их кинетическая энергия увеличивается, что приводит к более активным колебаниям атомов. Нагрев сопровождается увеличением заполнения этих уровней, в связи с чем увеличивается количество запасенной энергии металла.
Между тем представленные выше данные позволяют прогнозировать и оценивать характер физических свойств. В частности, с помощью графика можно прогнозировать значения теплоемкости металлов при конкретных температурах. Например, если бы в строительной отрасли стоял выбор между использованием меди и серебра в качестве материала высоковольтного провода, и уточнялось бы, что рабочая температура процесса будет достигать 1300 градусов, то благодаря графике это можно было понять, что серебро было бы более удобным вариантом.
Следует признать, что удельное количество поглощенной энергии представляет собой количество энергии (т. е. тепла), которая была передана веществу для изменения его сопротивления. Учитывая линейность роста удельного сопротивления и физический смысл величины, для установления связи между удельным электросопротивлением и поглощенной энергией можно использовать следующее соотношение:
В то же время величину поглощенной удельной энергии можно найти формула:
В этой формуле нет. 4 видно, что существует прямая зависимость между удельной теплоемкостью вещества и удельной поглощенной энергией. В то же время величина энергии определяется разницей температур: чем существеннее был нагрет материал, тем больше энергии он смог поглотить. Разница температур также важна в формуле поиска электрического сопротивления. Таким образом, эта разница температур (ΔT) в формуле №. 4 является эквивалентом того, что используется в формуле удельного электрического сопротивления №. 1. После выражения разности температур получится следующее уравнение:
1. После выражения разности температур получится следующее уравнение:
Далее, если результат, полученный в пятой формуле, подставить в формулу №. 4 можно получить готовое выражение. При этом следует отметить, что вместо обобщенных значений удельной теплоемкости, электрического сопротивления и температурного коэффициента сопротивления правильнее использовать известные значения.
В целом нетрудно заметить несколько закономерностей, которые можно обнаружить при обращении к формуле №2. Первый момент, на который следует обратить внимание, это прямая зависимость уникальной поглощаемой энергии от теплоемкости материала: чем выше один из этих показателей, тем выше другой. При этом следует обратить внимание на знаменатель, в котором стоит температурный коэффициент сопротивления. Если подставить известные значения серебра и меди в формулы №. 6 и нет. 7, то должны получиться следующие выражения:
На основе формул №. 9 и нет. 11, необходимо сказать, что первый член уравнения для серебра SEA сравним с таким же значением для меди. Подставив в формулы оставшееся значение p 20 , получим:
Подставив в формулы оставшееся значение p 20 , получим:
Завершающим этапом сравнения двух элементов по приведенным выше формулам будет определение характера зависимости удельной поглощаемой энергии от вида металл. Учитывая, что в формулах нет. 12 и нет. 13 единственной переменной является значение электрического сопротивления в конкретной точке, можно построить две функции и оценить кажущуюся разницу. Как показано на рисунке 2, значения удельной поглощенной энергии для серебра всегда будут выше, чем значения SEA для меди при тех же значениях удельного электрического сопротивления. Этот результат можно интерпретировать следующим образом: преобладание плотности энергии серебра свидетельствует о более высокой ценности этого материала, чем меди.
Рис. 2. Визуализация формул для определения особой поглощаемой энергии для двух материалов: меди (синяя линия) и серебра (зеленая).
Выбор того или иного материала в качестве исходного для работы должен сопровождаться анализом его физических свойств. Конкретные критерии сравнения могут включать плотность, термоэлектрические и механические характеристики. Например, медь имеет более высокий приоритет с точки зрения термической стабильности и плотности, но проигрывает по удельной теплоемкости и сопротивлению. Серебро лучше проводит электрический ток, но само по себе является более плотным веществом, что увеличивает вес изделия на 15% по сравнению с медью. Подводя итог, важно сделать вывод, что выбор конкретного источника должен основываться на совокупности факторов, включая потребности, затраты и обоснованность использования.
Конкретные критерии сравнения могут включать плотность, термоэлектрические и механические характеристики. Например, медь имеет более высокий приоритет с точки зрения термической стабильности и плотности, но проигрывает по удельной теплоемкости и сопротивлению. Серебро лучше проводит электрический ток, но само по себе является более плотным веществом, что увеличивает вес изделия на 15% по сравнению с медью. Подводя итог, важно сделать вывод, что выбор конкретного источника должен основываться на совокупности факторов, включая потребности, затраты и обоснованность использования.
Ссылки
Хэмпсон, Дж., и Ханссен, С. (2019). Электротехническая практика . Cengage AU.
Helmenstine, AM (2019). Факты о меди: химические и физические свойства. Мысль Ко. Веб.
Helmenstine, AM (2019). Факты о серебре (атомный номер 47 и символ элемента Ag) .
