Руда содержащая медь: МЕДНЫЕ РУДЫ • Большая российская энциклопедия
Содержание
Медная руда: месторождения, добыча, виды, переработка
Природные соединения с содержанием меди в своем составе
Самородки чистой меди в нашей Земле содержатся в небольших количествах. В основном она добывается в соединении с другими элементами, вот самые известные из них:
- Борнит – это такой минерал, который был назван в честь чешского ученого Борна. Он представляет собой сульфидную руду. У него имеются и альтернативные названия, например, медный пурпур. Добывается в двух видах: низкотемпературный тетрагонально-скаленоэдрический и высокотемпературный кубически-гексаоктаэдрический. Различие видов этого материала зависит от того, где он произошел. Экзогенный борнит – это вторичный ранний сульфид, обладает неустойчивостью и подлежит разрушению при воздействии на него ветров. Эндогенный борнит обладает сменным химическим составом, в нем могут присутствовать различные элементы, например, халькозин и галенит. В теории в состав борнита может входить 11 % железа и более 63 % меди, но, к сожалению, на практике данный состав не сохраняется.

- Халькопирит — данный вид минерала первоначально носил название — медный колчедан, зарождается он гидротермальным путем. Относят халькопирит к категории полиметаллических руд. Помимо меди, такой минерал имеет у себя в составе железо и серу. Образуется он в результате метаморфических процессов, и присутствует в метасоматических типах медных руд.
- Халькозин — такая руда имеет у себя в составе большое количество меди, практически 80 %, оставшееся место занимает сера. Нередко такой вид по-другому называют медным блеском, так как его поверхность похожа на блестящий металл, переливающийся несколькими оттенками. В рудах халькозин образуется как мелкозернистое или плотное включение.
- Куприт — этот минерал относится к группе оксидных, а зарождается он в тех местах, где содержится самородная медь или малахит.
- Ковеллин — такой минерал формируется только метасоматическим путем. Медь в нем содержится практически на 67 %. Крупное месторождение медных руд есть на территории Сербии, Италии и США.

- Малахит, или, как его еще называют, поделочный камень, обладает большой популярностью, представляет собой он медную углекислую зелень. Если где-то находят этот минерал, значит, рядом можно найти и иные, с содержанием в своем составе меди.
Это интересно: Меднение в домашних условиях — химическое, гальваническое
Значение меди в мире
Особенности меди
Медь была одним из первых металлов, которые узнала и стала использовать человеческая цивилизация. Производство ее человек изобрел раньше, чем железо.
Медь – второй после алюминия наиболее потребляемый мировой экономикой цветной металл.
Название свое это металл получил от имени острова Кипр.
Из чего она состоит? В ее структуре множество кристаллов: никель, цинк, молибден, золото, кальций, серебро, свинец, железо, кобальт и многие другие.
А высокая электропроводность сделала ее особенно ценным электротехническим материалом, из которого изготавливают обмотки трансформаторов и генераторов, провода линий электропередачи, внутреннюю электропроводку.
Справка. Ранее на электропровод тратилось до половины всей произведенной в мире меди, то сегодня этим целям служит более доступный алюминий. А сама медь становится наиболее дефицитным цветным металлом.
Широко используются и сплавы меди – с цинком (латунь), с оловом или алюминием (бронза) и др.
Добыча
Медные руды добываются в 50 странах. Таб. 1. Крупнейшие производители в мире по итогам 2014-2015 гг.
| Страна | 2014 | 2015 | ||
| тысяч тонн | место | тысяч тонн | место | |
| Весь мир | 22 000 | 19021 | ||
| Чили | 5 750 | 1 | 5 764 | 1 |
| КНР | 1 694 | 2 | 1 659 | 2 |
| Перу | 1 339 | 3 | 1 654 | 3 |
| США | 1 391 | 4 | 1 408 | 4 |
| Австралия | 969 | 5 | 960 | 5 |
| ДР Конго | 915 | 7 | 918 | 6 |
| Россия | 740 | 6 | 741 | 7 |
| Замбия | 693 | 8 | 705 | 8 |
| Канада | 694 | 9 | 690 | 9 |
| Индонезия | 379 | 587 | 10 |
Основные производственные мощности медедобывающих предприятий сосредоточены в Южной Америке. Именно здесь добывается 41,2% мировых объемов медной руды, 19,8% приходится на долю азиатских стран.
Именно здесь добывается 41,2% мировых объемов медной руды, 19,8% приходится на долю азиатских стран.
Иначе выглядит ситуация в производстве рафинированной меди: Таб. 2. Сравнительная характеристика объемов добычи рафинированной меди по регионам планеты, тыс. тонн
| Медная руда | Рафинированная медь | |
| Весь мир | 19021 | 22211 |
| Северная Америка | 2656 | 1883 |
| Южная Америка | 7841 | 3307 |
| Европа | 1864 | 3764 |
| Азия | 3759 | 11382 |
| Африка | 1893 | 1388 |
| Океания | 1008 | 487 |
Производство рафинированной меди по итогам за 2020 год сосредоточено в азиатском регионе (51,2%). На долю Южной Америки, лидера добычи медной руды, приходится 14,9%. Здесь он уступает даже Европе.
Рис. 1. Распределение вклада континентов
Почти 80% всей меди было произведено из первичного сырья, оставшиеся 20% выпущены из медного лома. В мировом производстве меди сохраняется высокая консолидация – треть ее (34,8%) в 2020 г приходилось на пятерку крупнейших производителей, в которую входят:
В мировом производстве меди сохраняется высокая консолидация – треть ее (34,8%) в 2020 г приходилось на пятерку крупнейших производителей, в которую входят:
- Codelco (Чили).
- Freeport-McMoRan (США).
- Glencore (Швейцария).
- BHP Billiton (Австралия).
- Southern Copper (Мексика).
Справочно. Компания Wood Mackenzie (Brook Hunt) в 2014 году опубликовала прогноз производства меди в мире на период до 2025 года.
Wood Mackenzie — глобальная группа исследований в области энергетики, химических веществ, возобновляемых источников энергии, металлов и горнодобывающей промышленности, имеющая международную репутацию для предоставления всеобъемлющих данных, письменного анализа и консультаций. В 2020 году компания была приобретена американской аналитической компанией и аналитической компанией Verisk Analytics (en.wikipedia.org). Таб. 3. Прогнозные данные на 2014-2025 год
| Год | Тысяч тонн | Год | Тысяч тонн |
| 2014 | 24 305 | 2020 | 25 928 |
| 2015 | 25 830 | 2021 | 25 643 |
| 2016 | 26 449 | 2022 | 25 553 |
| 2017 | 26 580 | 2023 | 25 317 |
| 2018 | 26 517 | 2024 | 24 945 |
| 2019 | 26 115 | 2025 | 24 713 |
По данным компании, мировая добыча в 2020 году составила 19,9 млн тонн, а ее производство достигло 22,5 млн.
Запасы
По данным за 2014 год, территории Северной и Южной Америки владели почти 60% всех мировых запасов, больше половины которых зафиксированы в Чили. А в масштабах планеты на долю этой страны приходится 34% залежей этого цветного металла.
На долю РФ приходилось 5% разведанных запасов меди в мире (после Чили, США, Перу и Австралии это 5-е место).
По оценкам геологов, порядка 5 млрд тонн запасов медной руды находится на дне океанов.
Классификация
Осуществляется добыча просто огромного количества самых различных медных руд. Классификация проводится по их происхождению. Выделяют следующие группы медных руд:
- Колчеданная получила довольно большое распространение. Порода представлена соединением железа и меди, имеет большое количество различных вкраплений и прожилок других примесей.
- Стратиформная представлена сочетанием медных сланцев и песчаников. Подобного рода порода также получила большое распространение, так как представлена крупным месторождением.
 Основными характеристиками можно назвать простую пластовую форму, а также равномерное распределение всех полезных компонентов. За счет этого медная порода подобного типа наиболее востребована, так как позволяет обеспечить производительность на одном уровне.
Основными характеристиками можно назвать простую пластовую форму, а также равномерное распределение всех полезных компонентов. За счет этого медная порода подобного типа наиболее востребована, так как позволяет обеспечить производительность на одном уровне. - Медно-никелевая. Эта руда характеризуется массивным вкраплением текстуры кобальта и золота, а также платиноидов. Месторождения находятся в жильной и пластовой форме.
- Медно-порфировая или гидротермальная. Подобного рода месторождения медной руды имеют в своем составе большую концентрацию серебра и золота, селена и других химических веществ. Кроме этого, все полезные вещества находятся в более высокой концентрации, за счет чего порода востребована. Встречается она крайне редко.
- Карбонатовая. В эту группу входит железомедная и карбонатитовая руда. Стоит учитывать, что эта порода была найдена только на территории ЮАР. Разрабатываемый рудник относится к массивным щелочным породам.
- Скарновая – группа, которая характеризуется локальным расположением в самых различных породах.
 Характерными свойствами можно назвать небольшие размеры и сложную морфологию. Стоит учитывать, что в данном случае руда, содержащая медь, имеет высокую концентрацию. Однако, металл распределен неравномерно. Разрабатываемые породы имеют концентрацию меди около трех процентов.
Характерными свойствами можно назвать небольшие размеры и сложную морфологию. Стоит учитывать, что в данном случае руда, содержащая медь, имеет высокую концентрацию. Однако, металл распределен неравномерно. Разрабатываемые породы имеют концентрацию меди около трех процентов.
Медный колчедан
Медь практически не встречается, к примеру, как золото, в виде массивных самородков. Наиболее крупным подобным образованием можно назвать месторождение в Северной Америке, масса которого составляет 420 тонн. При 250 видов меди только 20 из них получили широкое распространение в чистом виде, другие используются только в качестве легирующих элементов.
Стадии пирометаллургического производства меди
Общие способы получения метала из руды
Промышленное получение меди с использованием пирометаллургического способа имеет преимущества перед другими методами:
- технология обеспечивает высокую производительность – с ее помощью можно получать метал из породы, в которой содержание меди даже ниже 0,5%;
- позволяет эффективно перерабатывать вторичное сырье;
- достигнута высокая степень механизации и автоматизации всех этапов;
- при его использовании значительно сокращаются выбросы вредных веществ в атмосферу;
- метод экономичный и эффективный.

Обогащение
Схема обогащения руды
На первом этапе производства необходимо подготовить руду, которую доставляют на обогатительные комбинаты прямо с карьера или шахты. Часто встречаются большие куски породы, которые предварительно нужно измельчить.
Происходит это в огромных дробильных агрегатах. После дробления получается однородная масса, с фракцией до 150 мм. Технология предварительного обогащения:
- в большую емкость засыпается сырье и заливается водой;
- затем добавляется кислород под давлением, чтобы образовалась пена;
- частицы металла прилипают к пузырькам и поднимаются наверх, а пустая порода оседает на дне;
- далее, медный концентрат отправляется на обжиг.
Обжиг
Этот этап направлен на то, чтобы максимально снизить содержание серы. Рудную массу помещают в печь, где устанавливается температура 700–800оС. В результате термического воздействия содержание серы сокращается в два раза. Сера окисляется и испаряется, а часть примесей (железа и других металлов) переходит в легкошлакуемое состояние, которое облегчит в дальнейшем плавку.
Обжиг руды для снижения уровня серы
Этот этап можно опустить, если порода богатая и содержит после обогащения 25–35% меди, его используют только для бедных руд.
Плавка на штейн
Технология плавки на штейн позволяет получить черновую медь, которая различается по маркам: от МЧ1 – самая чистая до МЧ6 (содержит до 96% чистого металла). В ходе процесса плавки, сырье погружается в специальную печь, в которой температура поднимается до 1450оС.
Технология переработки медной руды и получение черной меди
После расплавления массы она продувается сжатым кислородом в конвертерах. Они имеют горизонтальный вид, а дутье осуществляется через боковое отверстие. В результате продува сульфиды железа и серы окисляются и переводятся в шлак. Тепло в конвертере образуется за счет протекания раскаленной массы, он дополнительно не нагревается. Температура при этом составляет 1300оС.
Общая схема выплавки меди
На выходе из конвертера получают черновой состав, который содержит до 0,04% железа и 0,1% серы, а также до 0,5% прочих металлов:
- олова;
- сурьмы;
- золота;
- никеля;
- серебра.

Такой черновой металл отливается в слитки массой до 1200 кг. Это так называемая анодная медь. Многие производители останавливаются на этом этапе, реализуют такие слитки. Но поскольку часто производство меди сопровождается добычей драгоценных металлов, которые содержатся в руде, то на обогатительных комбинатах используется технология рафинирования чернового сплава. При этом выделяются и сохраняются прочие металлы.
Рафинирование с использованием катодной меди
Технология получения рафинированной меди довольно простая. Ее принцип используют даже для чистки медных монет от окислов в домашних условиях. Схема производства выглядит следующим образом:
Слитки рафинированной меди
- черновой слиток помещается в ванну с электролитом;
- в качестве электролита используется раствор со следующим содержанием: сульфат меди – до 200 г/л;
- серная кислота – 135–200 г/л;
- коллоидные добавки (тиомочевина, столярный клей)– до 60 г/л;
- вода.

температура электролита должна быть до 55оС;
помещаются в ванну пластины катодной меди – тонкие листы чистого металла;
подключается электричество. В это время происходит электрохимическое растворение металла. Частицы меди концентрируются на катодной пластине, а прочие включения оседают на дне и называются шлам.
Весь процесс электролиза протекает в течение 20–28 суток. За этот период вынимают катодную медь до 3–4 раз. Вес пластин получается до 150 кг.
Как это делается: добыча меди
В процессе рафинирования, на катодной меди могут образовываться дендриты – наросты, которые сокращают расстояние до анода. В результате чего снижается скорость и эффективность реакции. Поэтому, при возникновении дендритов, их незамедлительно удаляют.
Применение медной руды
Благодаря полезным свойствам меди, ее используют в сфере электротехники. Из этого металла делают провода и силовые кабели, которые необходимы в повседневной жизни человека.
Интересно и то, что при смешивании меди с другими материалами получаются не менее полезные вещи. Так, например, сплав с никелем необходим в приборостроении. Смесь с вольфрамом используется для нитей накаливания в обычных лампочках. Кроме того, медь необходима в изготовлении радиаторов, кондиционеров, потому что она имеет хорошую теплопроводность.
Так, например, сплав с никелем необходим в приборостроении. Смесь с вольфрамом используется для нитей накаливания в обычных лампочках. Кроме того, медь необходима в изготовлении радиаторов, кондиционеров, потому что она имеет хорошую теплопроводность.
Также этот металл используют в следующих отраслях:
- машиностроении;
- строительстве;
- судостроении.
Существует еще одно полезное свойство, за которое этот металл очень ценится и часто применяется в строительстве. Он слабо поддается коррозии. Изделия из него продержатся несколько десятков лет, прежде чем начнут распадаться.
Медь используется и в ювелирном деле. Иногда создаются украшения исключительно из этого металла, иногда с примесью золота. Поскольку материал мягкий и пластичный, из него удобно создавать тонкие и изысканные ювелирные изделия. Сейчас идет тенденция внедрения дверных ручек, перил из меди, так как она имеет антибактериальные свойства.
Это интересно! Статуя Свободы была облицована именно медью. На ее изготовление потребовалось 80 тонн. В королевстве Непал этот металл и вовсе считается священным.
На ее изготовление потребовалось 80 тонн. В королевстве Непал этот металл и вовсе считается священным.
В сельском хозяйстве медь играет важную роль. Она добавляется во многие удобрения. Многим садоводам известен медный купорос, который они используют для обработки растений от вредных насекомых.
Добыча медной руды
Вследствие низкого содержания меди в руде ее добыча связанна с переработкой больших объемов горных пород. Для того, чтобы выплавить 1 т меди нужно переработать свыше 200 т руды. Методы добычи меди:
- открытый способ. Если рудные месторождения находятся близко к земной поверхности, то их разрабатывают таким способом глубина открытых разработок составляет 150-300 м. Метод характеризуется более низкими потерями
- подземный способ. Этим методом руду добывают с глубины 500 м, а иногда и с 800-1000 м.
Читать также: Принцип работы двухтактного дизеля
Существует пять технологических систем разработки месторождений:
- при помощи самоходного оборудования.
 Эта технология широко применяется
Эта технология широко применяется - при помощи вибрационных механизмов непрерывного действия
- при помощи твердеющей закладки выработанного пространства. При этом происходит сплошная выемка запасов мощных залежей с наименьшими потерями. С применением подобных систем снижаются потери в 3-4 раза
- метод выемки руды горизонтальными пластами. Во время наполнения выработанного пространства (в рудниках под землей) твердеющими соединениями применяют футерованные резиной или базальтом трубы, период эксплуатации которых в 50-100 раз выше, чем у стальных
- циклично-поточная технология реализации горных работ.
Таблица 1. Добыча меди в мире
| Страна | Добыча руды ( тыс. тонн в год) | Запасы ( млн. тонн) |
| Чили | 5,38 | 140 |
| США | 1,16 | 35 |
| Перу | 1 | 30 |
| Индонезия | 0,8 | 35 |
| Австралия | 0,85 | 24 |
| Россия | 0,84 | 20 |
| Китай | 0,62 | 26 |
| Мир | 14,49 | 467 |
Месторождения медных руд
Медь считается наиболее распространенным металлом, который применяется в самых различных отраслях промышленности. Месторождения медной руды встречаются практически во всех странах. Примером можно назвать открытие месторождения в Аризоне и Неваде. Также добычей медной руды занимаются на Кубе, где распространены залежи оксида. В Перу проводят добычу хлоридных образований.
Месторождения медной руды встречаются практически во всех странах. Примером можно назвать открытие месторождения в Аризоне и Неваде. Также добычей медной руды занимаются на Кубе, где распространены залежи оксида. В Перу проводят добычу хлоридных образований.
Медный карьер Чино в США Медный карьер Чукикамата в Чили
Рассматривая порфировые месторождения медной руды или распространение сульфидных месторождений, отметим, что на сегодняшний день обогащенных рудников уже практически нет. Это связано с тем, что подобный металл используется уже на протяжении многих лет. В промышленности проводится обработка породы, которая имеет концентрацию меди около 0,5%. После алюминия и железа, медь занимает третье место по объемам производства во всем мире.
Есть месторождения в России, которые позволяют добывать медную руду в достаточно большом объеме. Если рассматривать долю РФ в мировой добыче руды, то этот показатель составляет 9%. Лидирующее место занимает Чили, на территории которой сосредоточенно до 33% медной руды.
Самыми крупными месторождениями считаются следующие рудники:
- В Чили месторождение Чукикамата. Этот рудник разрабатывается на протяжении последних 100 лет, за которые было добыто около 26 миллионов тонн металла.
- Второй рудник находится в Чили. Открыт он был в 1990 году.
Кроме этого, были открыты месторождения на территории Бразилии и Перу, а также Казахстана. По некоторым расчетам в недрах земли находится еще более 400 миллионов тонн рассматриваемого металла.
Стадии пирометаллургического производства меди
Существует несколько методов переработки руды, из которых пирометаллургический наиболее экономичный. Данный способ не только обеспечивает высокую производительность, но и позволяет получать сопутствующие металлы. Сниженное количество вредных атмосферных выбросов также стоит отнести к преимуществам пирометаллургического метода переработки.
Данный способ не только обеспечивает высокую производительность, но и позволяет получать сопутствующие металлы. Сниженное количество вредных атмосферных выбросов также стоит отнести к преимуществам пирометаллургического метода переработки.
Обогащение
Из карьера или шахты руда попадает на обогатительный комбинат. Здесь ее измельчают дробильные машины. Так как содержание меди в руде невысоко, то далее необходимо произвести обогащение. Для этого применяется метод флотации.
Сырье загружают в специальную емкость, куда затем подают раствор, который представляет собой воду с добавлением флотореагентов. Действие данных веществ может быть различным, но назначение одинаково — они должны повысить выработку металла.
Сквозь смесь водного раствора и руды пропускают пузырьки воздуха. Частицы металла прилипают к ним и поднимаются наверх, образуя пену. Затем происходит разделение осадка — пустой породы, пены — выделяемого металла, водного раствора. Собранная пена поступает на дальнейшую переработку.
Обжиг
В выделенном методом флотации концентрате содержится большое количество примесей, которые необходимо удалить. Для этого руду отправляют в печь, где она подвергается термическому воздействию при температуре порядка 800 °C.
Таким методом выжигается сера. Под действием тепла образуется оксид серы, который затем испаряется. Металлические же примеси, например, железо, переходят в легкошлакуемое состояние, что упрощает их дальнейшее удаление.
Плавка на штейн
Массу, получившуюся после обжига, подвергают сушке. Затем ее помещают внутрь печи, где идет плавка при температурах до 1450 °C. Далее происходит разделение расплава на штейн, состоящий из сульфидов металлов, шлак, представляющий собой оксиды, и газообразную фракцию, которую применяют для изготовления серной кислоты.
Плавка может проводиться по нескольким технологиям. Принципиально различают плавку в жидкой ванной и взвешенную плавку. Эти процессы являются автогенными и преимущественно используются для создания штейнов. Кроме них применяются электроплавка, отражательная плавка, шахтная плавка.
Кроме них применяются электроплавка, отражательная плавка, шахтная плавка.
На выходе получают слитки весом до полутора тонн. Содержание меди в них достигает 96 %. Остальную часть составляют: железо — 0,04 %, сера — 0,1 %. Еще 0,5 % — другие металлы: олово, серебро, никель, золото. Сплав носит наименование «черновая медь», маркируется как МЧ1-6, где цифры от 1 до 6 характеризуют содержание меди.
Рафинирование с использованием катодной меди
На данном этапе происходит получение чистой меди электрохимическим способом. В ванну с электролитом помещают слиток чернового металла, который используется как анод, и пластины чистого металла — они выполняют роль катода.
После подключения электричества молекулы меди, покидая черновой анод, осаждаются на пластинах чистого металла. Примеси других веществ выпадают осадком в виде шлама, который собирают и отправляют на переработку. Весь процесс длится около месяца, как результат — получается металл с содержанием меди 99,99 %.
Различия по насыщенности
Вариаций соединений меди с другими веществами в рудах очень много, порядка двух с половиной сотен. Мы же рассмотрим самые популярные и самые насыщенные:
Мы же рассмотрим самые популярные и самые насыщенные:
- Борнит. Чаще всего принадлежит к гидротермальной группе руд, в составе своем может иметь около 65% Купрума. Хим. формула – Cu5FeS4;
- Ковелин. Также член гидротермальной группы, до 64% меди. Формула – CuS;
- Халькопирит. Гидротермальная группа. Насыщенность медью равна 30%. Самая популярная руда – 50% от всех месторождений. Формула – CuFeS2;
- Халькозин. Лидер в плане насыщенности. 79,8% «рыжего металла». Все та же гидротермальная группа. Формула – Cu2S.
Схема и режимы обогащения сульфидных руд
Сульфидные медные руды в большинстве случаев характеризуются крайне неравномерной вкрапленностью минералов меди, что предопределяет необходимость использования многостадиальных схем обогащения.
Сростки сульфидов меди как с пиритом, так и с минералами породы обычно удается выделить после сравнительно грубого измельчения руды: до 50 – 65% класса -0,074 мм. Для раскрытия сростков необходимо доизмельчать или концентрат, или промежуточный продукт, или оба названных продукта обогащения до 80 – 95 % -0,074 мм (рис. 3.1). Однако схемы циклов флотации обычно просты.
В качестве собирателя при флотации сульфидов меди и железа наиболее часто используются ксантогенаты и аэрофлоты, а в качестве пенообразователей — сосновое масло, дауфрос. Если медь в рудах представлена в основном вторичными сульфидами меди, то в качестве собирателя используется смесь ксантогенатов или аэрофлотов с более сильными собирателями или аполярными маслами.
Реагентный режим флотации пластовых руд (рис. 3.1) обычно прост: флотацию ведут в слабощелочной среде, создаваемой известью (до 1 кг/т), в присутствии собирателя и пенообразователя. Применение высших ксантогенатов в контрольных операциях флотации обеспечивает более высокие технологические показатели по сравнению с низшими ксантогенатами и более полное извлечение в концентрат сопутствующих редких, цветных и благородных металлов.
Рис. 3.1. Технологическая схема обогащения сульфидных медных руд Джезказганского месторождения
Флотация сульфидных медных руд со средним содержанием пирита осуществляется по схеме коллективной флотации с последующим разделением коллективного концентрата на медный и пиритный или по схеме селективной флотации с последовательным выделением медного и пиритного концентратов. Более экономичной из них является схема коллективно-селективной флотации.
Значение рН при коллективной флотации не превышает 7,5, чтобы обеспечить эффективную флотацию сульфидов железа в концентрат. Селективная флотация руд и разделение коллективного медно-пиритного концентрата осуществляются обычно в известковой среде при рН меньше 10, чтобы обеспечить эффективную депрессию сульфидов железа. Расход извести при этом зависит от содержания пирита и степени затронутости руды процессами окисления и находится в пределах 1-5 кг/т.
Разделение сульфидов меди и железа при флотационном обогащении сплошных медно-пиритных руд ведут по селективной схеме в сильнощелочной среде (рН 10-12), создаваемой загрузкой извести (до 15-20 кг/т) обычно после аэрации пульпы перед флотацией для окисления сульфоксидных соединений, солей двухвалентного железа и дополнительной депрессии пирратина и пирита. Хвосты медной флотации являются готовым пиритным концентратом, если содержание породы в исходной руде не превышает 10-15%. В иных случаях пиритные концентраты получают перефлотацией хвостов медной флотации после их сгущения и последующего разбавления свежей водой или кислыми рудничными водами. Для повышения качества пиритных концентратов иногда практикуют обесшламливание их в гидроциклонах.
Хвосты медной флотации являются готовым пиритным концентратом, если содержание породы в исходной руде не превышает 10-15%. В иных случаях пиритные концентраты получают перефлотацией хвостов медной флотации после их сгущения и последующего разбавления свежей водой или кислыми рудничными водами. Для повышения качества пиритных концентратов иногда практикуют обесшламливание их в гидроциклонах.
Среднеуральский завод: характеристика.
Как упоминалось выше, Среднеуральский медный завод (СУМЗ) – один из главных центров выплавки меди в нашей стране. Располагается этот завод в городе Ревда, что в Свердловской области. СУМЗ относится к Уральской горно-металлургической компании, а также является членом промышленной палаты области.
На СУМЗ медь выплавляют из первичного сырья, которое берется с Дегтярского месторождения.
Среднеуральский медеплавильный завод имеет большой цех по выплавке меди, фабрику по обогащению, а также цехи ксантогенатов и серной кислоты. Также завод имеет ряд вспомогательных предприятий, которые занимаются обслуживанием нужд медеплавильного предприятия.
СУМЗ вырабатывает порядка ста тонн черновой меди ежегодно. Медные концентраты на этом заводе обрабатываются путем обжигания в печах «кипящего слоя», также применяется метод конвертирования и отражательной плавки огарка.
Продукция Серднеуральского завода поставляется на все крупные российские предприятия, работающие в металлургической, горно-обогатительной, химической отраслях и расположенные в разных регионах страны, а также за рубежом.
Основные свойства меди
Физические свойства
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
Химические свойства
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Оптические свойства
| Цвет в отраженном свете | розовато-белый |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
Кристаллографические свойства
| Точечная группа | m3m (4/m 3 2/m) — гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по {111} по шпинелевому закону |
[править] Примечания
- Секретный портрет цветной металлургии
- Секретный портрет цветной металлургии
- Секретный портрет цветной металлургии
- Секретный портрет цветной металлургии
- Экспорт Российской Федерации основных товаров в 2010 г.

- РОССИЯ 2012. СТАТИСТИЧЕСКИЙ СПРАВОЧНИК
- РОССИЯ 2012. СТАТИСТИЧЕСКИЙ СПРАВОЧНИК
- Секретный портрет цветной металлургии
- Секретный портрет цветной металлургии
| Торговля в России | |
| История | Древнерусское государство • Русское царство • Российская империя • СССР • 1990-е годы (1991, 1992, 1993, 1994, 1995, 1996, 1997, 1998, 1999) • 2000-е годы (2000, 2001, 2002, 2003, 2004, 2005, 2006, 2007, 2008, 2009) • 2010-е годы (2010, 2011, 2012, 2013, 2014, 2015, 2021, 2021, 2021, 2019) • 2020-е годы (2020, 2021, 2022, 2023, 2024, 2025, 2026, 2027, 2028, 2029) |
| Розничная торговля | История розничной торговли • Компании розничной торговли |
| Оптовая торговля | История оптовой торговли • Компании оптовой торговли |
| Компании | X5 Retail Group N.V. • Магнит • Дикси Групп • ОАО «Лента» • Седьмой конитнент • Группа • Торговый дом «Копейка» • Аптечная сеть 36,6 • Евросеть • ИНВА • Эльдорадо |
| Рынки | Автомобили • Автобусы • Вооружения • Мясо • Нефть • Пшеница • Зерно • Природный газ • Уголь • Каменный уголь • Сталь • Удобрения • Магний • Нефтепродукты • Матрасы • Счётчики электроэнергии • Счётчики газа • Счётчики воды • Микросхемы • Мука • Мясо и мясопродукты • Электроэнергия • Полиэтиленовые трубы • Нефть и нефтепродукты • Древесина • Металлургическая продукция • Урановая продукция • Алкоголь • Машины и оборудование • Мясо птицы • Шины • Рис • Ядерное топливо • Сигареты • Цемент • Молоко и молочные продукты • Сахар • Бумага • Говядина • Свинина • Карамель • Вино • Проволока • Лакокрасочная продукция • Полимеры • Мебель • Яблоки • Одежда • Баранина • Печенье • Лизинг • Пиво • Бытовая техника • Телевизоры • Лекарства • Телевизионная реклама • Услуги связи • Косметика • Интернет-реклама • Реклама • Детские товары • Самолёты • Вертолёты • Фанера • Медь • Алюминий |
| ЦФО | Белгородская область • Брянская область • Владимирская область • Воронежская область • Ивановская область • Калужская область • Костромская область • Курская область • Липецкая область • Московская область • Орловская область • Рязанская область • Смоленская область • Тамбовская область • Тверская область • Тульская область • Ярославская область • Москва |
| СЗФО | Карелия • Коми • Архангельская область • Ненецкий автономный округ • Вологодская область • Калининградская область • Ленинградская область • Мурманская область • Новгородская область • Псковская область • Санкт-Петербург |
| ЮФО | Адыгея • Калмыкия • Краснодарский край • Астраханская область • Волгоградская область • Ростовская область |
| СКФО | Дагестан • Ингушетия • Кабардино-Балкария • Карачаево-Черкесия • Северная Осетия • Чечня • Ставропольский край |
| ПФО | Башкортостан • Марий Эл • Мордовия • Татарстан • Удмуртия • Чувашия • Пермский кpай • Кировская область • Нижегородская область • Оренбургская область • Пензенская область • Самарская область • Саратовская область • Ульяновская область |
| УФО | Курганская область • Свердловская область • Тюменская область • Ханты-Мансийский автономный округ • Ямало-Ненецкий автономный округ • Челябинская область |
| СФО | Алтай • Бурятия • Тыва • Хакасия • Алтайский край • Забайкальский кpай • Красноярский край • Иркутская область • Кемеровская область • Новосибирская область • Омская область • Томская область |
| ДФО | Якутия • Камчатский кpай • Приморский край • Хабаровский край • Амурская область • Магаданская область • Сахалинская область • Еврейская автономная область • Чукотский автономный округ |
| Прочее | Бартер • Доля импортной продукции на российском рынке • Доля импортного продовольствия на российском рынке • Министерство торговли Российской Федерации |
Источник — «»
Категории: Торговля в России | Медь в России
Медная Руда 6 Букв — ответ на кроссворд и сканворд
Решение этого кроссворда состоит из 6 букв длиной и начинается с буквы Б
Ниже вы найдете правильный ответ на Медная руда 6 букв, если вам нужна дополнительная помощь в завершении кроссворда, продолжайте навигацию и воспользуйтесь нашей функцией поиска.
ответ на кроссворд и сканворд
Вторник, 2 Июля 2019 Г.
БОРНИТ
предыдущий
следующий
другие решения
АЗУРИТ
КУПРИТ
АЗУРИТ
ты знаешь ответ ?
ответ:
связанные кроссворды
- Борнит
- Пестрая медная руда; минерал, сложный сульфид меди и железа
- Руда меди
- Борнит
- Минерал 6 букв
похожие кроссворды
- Красная медная руда 6 букв
- Красная медная руда, закись меди 6 букв
- Синий минерал, медная руда 6 букв
- Пестрая медная руда; минерал, сложный сульфид меди и железа
- Медная руда
- ), медная руда, содержащая также серебро, свинец, сурьму, мышьяк и серу
- Старинная мелкая медная монета в четверть копейки 7 букв
- Самая маленькая старинная медная монета 7 букв
- Старинная медная монета в полкопейки; сейчас вообще монетка 7 букв
- Медная монета 5 букв
- Русская медная монета, равная 1 2 копейки 7 букв
- Медная мелкая монета в четверть копейки 7 букв
МЕДНАЯ ПРОМЫШЛЕННОСТЬ | Энциклопедия Кругосвет
Содержание статьи
- Медные руды.

- Металлургия.
- Обогащение.
- Плавление.
- Выщелачивание.
- Рафинирование.
- Применение.
МЕДНАЯ ПРОМЫШЛЕННОСТЬ. Медь была одним из первых металлов, которыми научился пользоваться человек, и наиболее широко применявшимся металлом от начала письменной истории до периода Средних веков, когда были разработаны промышленные способы получения железа, а потом и стали. В наши дни, несмотря на наличие множества металлов, сплавов и других материалов, медь сохраняет свое значение.
Медные руды.
Многочисленные месторождения меди находятся на западе и юго-западе США, а также в шт. Мичиган и Теннесси. Значительны запасы медных руд в Чили, России (Урал), Казахстане (Джезказган), Канаде, Замбии и Заире, месторождения имеются также в Польше, Перу, на Филиппинах, в Австралии, в КНР, Мексике и ряде других стран.
Главным источником для получения меди служат сульфидные руды, содержащие чаще всего халькопирит CuFeS2, называемый медным колчеданом (35% меди), или другие сернистые минералы меди, например халькозин Cu2S (70% меди). Однако медные минералы сопровождаются большим количеством пустой породы – вскрыши и породных примесей. Поэтому перед плавкой руду подвергают обогащению.
Однако медные минералы сопровождаются большим количеством пустой породы – вскрыши и породных примесей. Поэтому перед плавкой руду подвергают обогащению.
Металлургия.
Почти вся медь вырабатывается из сульфидных руд. В процессе обогащения руды флотацией получают концентрат, содержащий до 35% меди, и плавят его на штейн. Штейн – это смесь сульфидов меди и железа, содержащая до 60% меди. Окислением штейна получают черновую медь (содержащую до 98% меди), которую рафинируют до металла высокой чистоты, поступающего на рынок.
Обогащение.
Обогащение низкокачественных (бедных) руд производится методом пенной флотации. Размельченную руду смешивают с водой, небольшим количеством масла, поверхностно-активным веществом, пенообразователем, и смесь перемешивают в баке флотационной машины. Частицы сульфида собираются на поверхности и уносятся пеной, а порода, не содержащая меди, оседает на дно.
Плавление.
Концентрат, к которому добавлен песок или карбонат кальция, нагревают до расплавления. При этом часть железа удаляется в виде силиката железа, а сера частично окисляется в оксид серы. Медный расплавленный штейн собирается на поду печи; его заливают в бочкообразный цилиндрический конвертер с боковым рядом фурм и продувают воздухом. По завершении процесса металлическая медь, образовавшаяся в результате окисления серы (Cu2S + O2® 2Cu + SO2), разливается по изложницам. При охлаждении этой черновой меди (с концентрацией Cu ~98%) из нее выделяется растворенный диоксид серы, поэтому ее поверхность имеет пузырчатый вид. Диоксид серы, выделяющийся в процессе плавки и конвертерной переработки, улавливается, и из него получают серную кислоту, которую либо продают, либо используют для выщелачивания оксидных руд из породных отвалов.
При этом часть железа удаляется в виде силиката железа, а сера частично окисляется в оксид серы. Медный расплавленный штейн собирается на поду печи; его заливают в бочкообразный цилиндрический конвертер с боковым рядом фурм и продувают воздухом. По завершении процесса металлическая медь, образовавшаяся в результате окисления серы (Cu2S + O2® 2Cu + SO2), разливается по изложницам. При охлаждении этой черновой меди (с концентрацией Cu ~98%) из нее выделяется растворенный диоксид серы, поэтому ее поверхность имеет пузырчатый вид. Диоксид серы, выделяющийся в процессе плавки и конвертерной переработки, улавливается, и из него получают серную кислоту, которую либо продают, либо используют для выщелачивания оксидных руд из породных отвалов.
Выщелачивание.
Это другой, гидрометаллургический метод переработки некоторых медных руд. Выщелачиванием серной кислотой из размолотой оксидной руды получают раствор сульфата меди. (Ранее выщелачивание производилось в больших резервуарах, но в наше время оно осуществляется по большей части на месте, непосредственно в породных отвалах или в массе размолотой руды. ) Раствор очищают методом экстракции растворителем, а затем подвергают электролизу, что дает на катоде медь высокой чистоты. Иногда руду выщелачивают с применением бактерий, которые способствуют необходимому окислению с переводом меди в кислые растворы. Шахтные воды, откачиваемые из меднорудных шахт, часто содержат большие количества меди в форме растворенных соединений. Для улавливания этой меди шахтные воды используют в процессе выщелачивания.
) Раствор очищают методом экстракции растворителем, а затем подвергают электролизу, что дает на катоде медь высокой чистоты. Иногда руду выщелачивают с применением бактерий, которые способствуют необходимому окислению с переводом меди в кислые растворы. Шахтные воды, откачиваемые из меднорудных шахт, часто содержат большие количества меди в форме растворенных соединений. Для улавливания этой меди шахтные воды используют в процессе выщелачивания.
Рафинирование.
Почти вся черновая медь рафинируется последовательно двумя методами – огневым (пирометаллургическим) и электролитическим. Огневым рафинированием в отражательных печах из черновой меди удаляют примеси Fe, Zn, Co, Ni и серу в виде оксидов, а затем растворенные газы, после чего медь раскисляют. Ранее для удаления растворенных газов из меди и восстановления Cu2O в металл ванны погружали сырые деревянные жерди, древесина которых выделяет газообразные углеводороды, бурно перемешивающие расплав. Теперь сырую древесину заменяют природным газом, паромазутной смесью, углеводородными побочными продуктами других производств. После огневого рафинирования медь подают на разливочные машины для отливки анодов – квадратных плит с ушками для подвешивания в электролизере. Аноды помещают в ванны с подкисленным раствором сульфата меди. Катодом служит тонкий лист из чистой меди. В процессе электролиза медь и другие основные металлы (железо, цинк, свинец и никель) растворяются, оставляя на аноде шлам серебра, золота и платины. Разность электропотенциалов меди и других основных примесных металлов достаточно велика для того, чтобы медь в кислом растворе избирательно осаждалась на катоде с чистотой около 99,9%.
После огневого рафинирования медь подают на разливочные машины для отливки анодов – квадратных плит с ушками для подвешивания в электролизере. Аноды помещают в ванны с подкисленным раствором сульфата меди. Катодом служит тонкий лист из чистой меди. В процессе электролиза медь и другие основные металлы (железо, цинк, свинец и никель) растворяются, оставляя на аноде шлам серебра, золота и платины. Разность электропотенциалов меди и других основных примесных металлов достаточно велика для того, чтобы медь в кислом растворе избирательно осаждалась на катоде с чистотой около 99,9%.
Применение.
У меди уникальное сочетание свойств, обеспечившее ей широкое применение, – высокие электро- и теплопроводность, хорошая коррозионная стойкость, высокая пластичность и привлекательный естественный цвет. Более 70% всей потребляемой меди идет на электротехнические изделия, 15% – на элементы строительных конструкций, 5% – на детали машин и механизмов, 4% – на транспортные конструкции и 4% – на другие виды изделий, в том числе на изготовление артиллерийского оружия. Строительная промышленность потребляет около 40% всей производимой меди, электротехника и электроника около 26%, общее машиностроение – около 14%, транспортное машиностроение – около 11%, промышленность товаров широкого потребления – остальные 9%. Кабели, электротехнические шины, трансформаторные обмотки и другие электротехнические изделия изготавливаются из разных сортов меди. В тех случаях, когда требуется максимальная электропроводность, применяется «бескислородная медь с высокой электропроводностью», в других же случаях пригодна «технически чистая» медь, содержащая 0,02–0,04% кислорода. Небольшая добавка мышьяка повышает прочность красной меди (продукта огневого рафинирования), но такая медь, содержащая кислород, с трудом поддается сварке. Медь с пониженным содержанием кислорода обладает хорошими литьевыми свойствами и применяется для изготовления химико-технологического оборудования, медных труб, автомобильных радиаторов, судовых конденсаторов, бытовых водопроводных труб, кровельного материала и других технических изделий.
Строительная промышленность потребляет около 40% всей производимой меди, электротехника и электроника около 26%, общее машиностроение – около 14%, транспортное машиностроение – около 11%, промышленность товаров широкого потребления – остальные 9%. Кабели, электротехнические шины, трансформаторные обмотки и другие электротехнические изделия изготавливаются из разных сортов меди. В тех случаях, когда требуется максимальная электропроводность, применяется «бескислородная медь с высокой электропроводностью», в других же случаях пригодна «технически чистая» медь, содержащая 0,02–0,04% кислорода. Небольшая добавка мышьяка повышает прочность красной меди (продукта огневого рафинирования), но такая медь, содержащая кислород, с трудом поддается сварке. Медь с пониженным содержанием кислорода обладает хорошими литьевыми свойствами и применяется для изготовления химико-технологического оборудования, медных труб, автомобильных радиаторов, судовых конденсаторов, бытовых водопроводных труб, кровельного материала и других технических изделий.
Медные сплавы – это группа распространенных сплавов, свойства которых изменяются в широких пределах. Некоторые сплавы меди, содержащие кадмий, хром, серебро или теллур, обладают высокой прочностью при высокой технологичности и хорошей электропроводности. Наиболее известными и широко применяемыми сплавами меди являются латуни (сплавы с цинком) и бронзы (сплавы с оловом).
Данафлоат
Основными сульфидными минералами меди являются халькопирит (CuFeS2), халькоцит (Cu2S), ковеллит (CuS), борнит (Cu5FeS4), тетраэдрит ((Cu,Fe)12Sb4S13) и энаргит (Cu3AsS4). Крупнейшим источником меди являются месторождения порфировой руды, в которых встречается один или комбинация вышеупомянутых минералов. Типичная сульфидная руда меди содержит различные типы сульфидов железа, которые обычно включают пирит (FeS2) и пирротин (Fe1-xS). Часто присутствуют золото и серебро, которые могут быть связаны с сульфидами или быть свободными. Частицы пустой породы могут состоять из ряда силикатных минералов от кварца до талька и глины. Также может присутствовать карбонатная минеральная порода.
Также может присутствовать карбонатная минеральная порода.
При высвобождении типичные сульфидные минералы меди относительно легко флотируются. Когда нет наиважнейших металлургических проблем, часто основное внимание уделяется производству медного концентрата с достаточно высоким содержанием. Часто основная проблема контроля качества связана с минералами сульфида железа, поскольку они также всплывают вместе с медью, разбавляя сорта медного концентрата. Это связано с тем, что: 1) уровни минералов сульфида железа обычно намного выше, чем концентрация меди, 2) сульфидные флотоуловители также могут хорошо флотировать сульфиды железа, 3) высвобождение может быть проблемой, затрудняющей разделение меди и железа, и 4) мелкие частицы часто труднее разделить. Частая и неприятная проблема заключается в том, что драгоценные металлы (золото и серебро) часто присутствуют в сульфидах железа, и отказ от этих минералов влияет на экономику.
Пустая порода шлама (обычно глины и талька) может быть проблемой из-за преимущественного прилипания к поверхности пузырьков, которые «вытесняют» накопление медных минералов на пузырьки. Перемещение пустых шламов в концентраты также может создать серьезные проблемы с разбавлением концентрата, а также потребовать гораздо более длительного времени флотации для обеспечения высокого извлечения медных минералов. На заводе с фиксированной производительностью флотации это означает более низкое извлечение меди. Диспергаторы, такие как силикат натрия, полиакрилаты и гексаметафосфат натрия, часто используются, чтобы свести к минимуму прилипание пузырьков тонкой пустой породы и минимизировать влияние на извлечение меди. В качестве альтернативы КМЦ (карбоксиметилцеллюлоза), декстрин или крахмалы могут быть эффективными депрессорами пустой породы.
Перемещение пустых шламов в концентраты также может создать серьезные проблемы с разбавлением концентрата, а также потребовать гораздо более длительного времени флотации для обеспечения высокого извлечения медных минералов. На заводе с фиксированной производительностью флотации это означает более низкое извлечение меди. Диспергаторы, такие как силикат натрия, полиакрилаты и гексаметафосфат натрия, часто используются, чтобы свести к минимуму прилипание пузырьков тонкой пустой породы и минимизировать влияние на извлечение меди. В качестве альтернативы КМЦ (карбоксиметилцеллюлоза), декстрин или крахмалы могут быть эффективными депрессорами пустой породы.
Депрессию минералов сульфида железа обычно контролируют добавлением извести при уровне pH до 11+. В то время как некоторые операции плавают при естественном рН, по крайней мере, при черновой обработке, в этих случаях можно контролировать сочетание выбора реагента и относительной плавучести пирита. Даже когда при черновой обработке используется нейтральный pH, этапы более чистой флотации обычно проводятся при более высоком pH, чтобы обеспечить депрессию сульфида железа. Когда золото присутствует и имеет значительную ценность, к сожалению, известь также может снизить извлечение золота, особенно если она свободна или связана с минералами сульфида железа.
Когда золото присутствует и имеет значительную ценность, к сожалению, известь также может снизить извлечение золота, особенно если она свободна или связана с минералами сульфида железа.
Цианид также может быть эффективным депрессором сульфида железа, где его использование разрешено, но цианид может растворять ионы металлов, которые могут активировать широкий спектр сульфидных минералов, что может негативно повлиять на селективность флотации. В некоторых случаях для контроля селективности флотации можно использовать кальцинированную соду или едкий натр. Другим полезным вариантом является использование предварительной аэрации пульпы, которая может вызвать окисление на более реакционноспособных поверхностях сульфидов минералов, делая их менее плавучими; конечно, эффективность этого метода зависит от минерализации и характеристик контура.
Стандартные реагенты для флотации сульфида меди представляют собой собиратели класса тиолов на основе серы, которые можно сгруппировать в основные семейства ксантогенатов, дитиофосфатов, тионокарбаматов и тиокарбаматов.
Другие химические вещества также эффективны и составляют отдельные классы, но в качестве общей общей характеристики они обычно имеют атомы серы с двойной связью в своей структуре, посредством которых осуществляется химическое связывание с поверхностью медных минералов. Эффективный выбор реагента флотоуловителя зависит от присутствующих сульфидных минералов, их минеральных ассоциаций в руде и характеристик контура. Поскольку руда обычно содержит более одного типа сульфидных минералов меди, часто используется комбинация сульфидных флотационных собирателей для максимизации металлургических характеристик. Они добавляются отдельно или, что становится все более распространенным, поставляются в виде смешанных продуктов для оптимизации флотации.
Вспенивающие агенты являются важным компонентом набора флотационных реагентов. Вспенивающие химические вещества широко варьируются и обычно включают спирты различной структуры и молекулярной массы, альдегиды / сложные эфиры и гликоли, которые используются отдельно или в виде смесей. Они изменяют поверхностное натяжение пузырьков, которое влияет на формирование размера пузырьков, гидродинамику поверхности пузырьков и способность удерживать минералы на поверхности ячеек, что влияет на флотацию и оптимизацию сульфида меди. Часто необходимо учитывать и оценивать комбинацию коллектор-вспениватель для оптимизации работы контура флотации.
Они изменяют поверхностное натяжение пузырьков, которое влияет на формирование размера пузырьков, гидродинамику поверхности пузырьков и способность удерживать минералы на поверхности ячеек, что влияет на флотацию и оптимизацию сульфида меди. Часто необходимо учитывать и оценивать комбинацию коллектор-вспениватель для оптимизации работы контура флотации.
Окисленные («потускневшие») минералы создают проблемы при флотации, что часто является значительным. Там, где окисленные минералы представляют собой явную проблему, варианты обработки включают смену флотационного коллектора и сульфидирование либо метабисульфидом, либо SO2.
Сульфидная флотация настоящих оксидных медных минералов (таких как малахит, азурит) невозможна с помощью коллекторов для флотации сульфгидрильных минералов, и требуются либо другие собиратели оксидного типа, либо должны быть рассмотрены альтернативные способы обогащения минералов.
Download PDF >
The following Danafloat™ collectors alone and in combinations should be initially considered for copper flotation:
Danafloat™ 067
Danafloat™ 068
Danafloat™ 070
Danafloat™ 233
Danafloat™ 245
Danafloat™ 262E
Danafloat™ 345
Danafloat™ 507E
Danafloat™ 871
Для руд, содержащих окисленные медные минералы:
Danafloat™ 271
Danafloat™ 571
Рудные минералы
Большинство элементов необходимо концентрировать в количествах,
могут быть экономично добыты из рудных месторождений (обычно в сотни-тысячи раз
их земное обилие). Такая концентрация обычно достигается
Такая концентрация обычно достигается
растворение элемента горячей водой (месторождения гидротермальных руд — золота,
серебра, свинца), преимущественной кристаллизации из магм (хромитовых месторождений или
пегматиты), поверхностное выветривание и выщелачивание (алюминий, никель, медь) или
гравитационное разделение полезных ископаемых при эрозии (золото, алмазы, титан). В большинстве случаев имеется только один или два
полезные ископаемые, которые обеспечивают весь конкретный элемент для коммерческого использования. Немного
элементы в низких концентрациях (замещая в незначительных количествах основные
элементы) связаны с полезными ископаемыми, которые добываются для других элементов, но
сдвиговые объемы материалов, которые перерабатываются, приводят к ценному побочному продукту
(т.е. элементы, связанные с медными, свинцовыми и цинковыми рудами). Некоторые элементы настолько
ценно то, что почти любой минерал, содержащий этот элемент в достаточном количестве,
можно добывать (золото, серебро, платиновая группа).
ЭЛЕМЕНТЫ
Алюминий — Руда добывается из горных пород, подвергшихся воздействию
выветривание в тропической среде, бокситы. Основные рудные полезные ископаемые в
бокситы представлены гиббситом, бемеитом и диаспором.
Сурьма — Первичной рудой сурьмы является ее сульфид, антимонит.
Мышьяк — Извлекаемый из других потоков металлообработки (главным образом
из сульфосолей, таких как теннантит и др.). Арсенопирит
является наиболее распространенным минералом мышьяка. Относительно низкий спрос на мышьяк
по сравнению с количеством добываемого мышьяка, связанного с другими металлами
означает, что он может быть получен из отходов другой переработки руды.
Барий — Основным источником бария является барит с незначительным производством
увядание.
Бериллий . Основным рудным минералом для бериллия в США является бертрандит.
в то время как во всем мире основным источником являются пегматиты, содержащие берилл.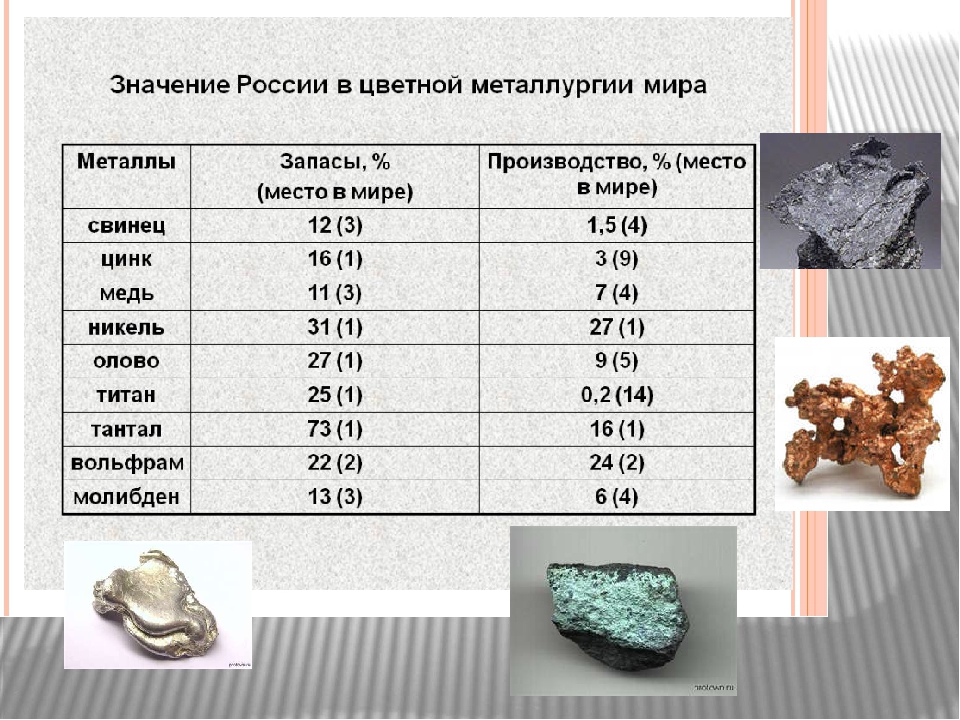
Висмут — в основном побочный продукт переработки свинца. Также найдено в
ряда минералов, таких как висмутинит, и как составная часть различных сульфосолей.
Бор — Основным источником является месторождение буры, колеманита,
кернит, улексит.
Бром — Основными источниками являются рассолы из колодцев и Мертвого моря.
Кадмий — В отличие от
кадмий из многих других товаров производится как побочный продукт добычи цинка (сфалерита).
Цезий — Главный
рудный минерал – поллуцит, минерал пегматита. Производство и использование этого металла
крайне мала (несколько тысяч килограммов в год).
Хлор — Произведено
из минерала галита (каменной соли).
Хром — Начальник
источником является минерал хромит, встречающийся в крупных расслоенных интрузивах и
змеевидные тела.
Кобальт — Первичный
минералы для кобальта кобальтит. Некоторое количество кобальта также получают из выветренных
тропические рудные тела.
Колумбий (см. Ниобий)
Медь — Большая часть меди
рудные тела добываются из минералов, образовавшихся в результате выветривания первичной меди.
рудный минерал халькопирит. Минералы в обогащенной зоне включают халькозин, борнит,
дюрлеит. Минералы в зонах окисления включают малахит, азурит,
хирсоколла, куприт, тенорит, самородная медь и брошантит.
Галлий — А
побочный продукт переработки цинка и глинозема. Некоторая первичная «руда» может
содержат до 200 ppm. Джорджия
Германий — А
побочный продукт переработки цинковой руды. Также с углем связано месторождение в Китае.
Золото — Первичный минерал
из золота — самородный металл и электрум (сплав золота с серебром). Некоторые теллуриды также являются важными рудными минералами.
такие как калаверит, сильванит и петцит.
Гафний — первичный
рудный минерал – циркон.
Индий — В первую очередь
является побочным продуктом переработки цинка.
Йод — Исходный
производство было из морских водорослей. Йод извлекается из рассолов месторождений природного газа.
(до 1200 ppm йода в рассолах).
Железо — Два основных
минералами в производстве железа являются его оксиды, гематит и магнетит.
Они встречаются в докембрийских железистых образованиях. Исторически существовало также
производство из гетита и сидерита. Сульфиды железа (пирит и пирротин)
не использовались как железо
источников из-за сложности удаления серы из металлов и
хрупкость эта сера вызывала в металле.
Ведущий — Первичный
рудный минерал
для свинца это сульфид — галенит. Пришло какое-то незначительное производство из прошлого
из вторичных свинцовых минералов — церуссита и англезита.
Литий — Бывший
первичными рудными минералами были пегматитовые месторождения сподумена, лепидолита и петалита,
амблигонит. В настоящее время
основное производство в США приходится на рассолы карбоната лития.
Магний — Хотя
магний содержится во многих минералах, только в доломите, магнезите, брусите,
промысловое значение имеют карналлит и оливин. Магний и другие
соединения магния получают также из морской воды, колодезных и озерных рассолов и
выпь.
Марганец —
первичные руды представляют собой оксиды/гидроксиды марганца, которые включают такие минералы, как
гаусманнит, пиролюзит, браунит, манганит и др. и карбонат, родохрозит. Крупный потенциальный источник — морские глубины.
марганцевые конкреции.
Меркурий — Основная руда
сульфид, киноварь.
Молибден — первичный
рудный минерал – молибденит.
Никель — Первичный
никелевые руды представлены пентландитом, никельсодержащим пирротином и продуктом выветривания,
гарниерит (смесь непуита, пекораита и виллемсеита).
Ниобий (Колумбий)
— Основным рудным минералом является пирохлор с небольшим содержанием колумбита и танталит-колумбита.
Фосфор — основной
рудные минералы относятся к апатитовой группе минералов (гидроксилапатит, фторапатит,
хлорапатит).
Платиновая группа
(Платина, осмий, родий, рутений, палладий) — первичные руды
природные элементы или сплавы различных элементов или арсенидов, такие как
сперрилит. Они имеют тенденцию возникать в
слоистые интрузивы, связанные с месторождениями хромитов.
Калий (поташ) —
Основными рудными минералами являются сильвин (главным образом), рассолы и лангбейнит.
Редкоземельные элементы
(церий, диспрозий, эрбий, европий, гадолиний, гольмий, лантан,
лютеций, неодим, празеодим, самарий, скандий, тербий, тулий, иттербий,
иттрий) Основные рудные минералы
редкоземельными элементами являются бастназит, монацит и лопарит, а
латеритные ион-адсорбционные глины. Основное производство бастнезита в США приходится на
Маунтин-Пасс, Калифорния.
Рений — Произведено
как побочный продукт молибденита.
Рубидий —
Заменители калия в лепидолите и поллуците. Производство небольшое (т.
несколько тысяч килограммов в год).
Скандий (см. редкоземельные элементы)
Селен — Восстановлен
от обработки меди.
Кремний —
первичный источник — кварц.
Серебро — Производство серебра
был получен из сульфидного аргентита / акантита, самородного серебра, сульфосолей, таких как пираргирит
и прустит, хлорид в виде цераргирита. Он также содержится в небольших количествах в
несколько тетраэдров.
Натрий — Принцип
ресурсы — галит (каменная соль) или кальцинированная сода (см. ниже).
Стронций — основная руда
минерал — целестин с незначительным образованием стронцианита.
Сера — Основные
производство осуществляется путем десульфурации природного газа и нефти. Серная кислота
производится из
дымовые газы металлургических заводов. Исторически сера производилась из самородной серы.
и пирит.
Тантал — В основном
из танталита-колумбита, хотя незначительные количества обнаруживаются в оловянных концентратах.
Теллур —
Извлекается при переработке медных руд.
Таллий — восстановленный
от переработки медных, свинцовых и цинковых руд.
Торий — восстановленный
преимущественно из монацита.
Олово — Первичная руда
касситерит.
Титан — Обычно
из россыпных месторождений рудными минералами являются рутил, ильменит и лейкоксен.
Вольфрам — первичный
рудные минералы — шеелит и гюбнерит-ферберит.
Уран — Начальник
первичные рудные минералы — уранинит, настуран (смесь различных оксидов),
гроб и
множество вторичных минералов, таких как карнотит и аутунит.
Ванадий — восстановленный
из нефтяных остатков, также получаемых из ванадийсодержащих магнетитовых пород. В
в прошлом его извлекали из полезных ископаемых в урановых месторождениях.
Цинк — Цинк первичный
рудный минерал – сфалерит, сульфид цинка. Некоторая предыдущая продукция была из
Смитсонит и гемиморфит.
Цирконий — основной
источником является минерал циркон.
ПРОМЫШЛЕННЫЕ МИНЕРАЛЫ
Абразивы натуральные —
Алмазы, гранаты (альмандин, пироп и андрадит), корунд (наждак).
Барит — Барит в основном используется в качестве добавки, увеличивающей вес для
бурение нефтяных и газовых скважин.
Кальцит — А-мажор
Источником этого минерала является известняк. Его использовали для изготовления
цемент, применение на сельскохозяйственных угодьях для контроля pH, в качестве строительного
материал, и дробленый для гравия.
Глины — используемые в
производство кирпича, плитки и в качестве наполнителя для бумаги и т. д.
Металлы | Бесплатный полнотекстовый | Обзор цианирования медно-золотых руд и концентратов
1.
 Введение
Введение
История современной гидрометаллургии началась с открытия 19 октября 1887 г. Джоном Стюардом Макартуром способа получения золота и серебра из руд. был признан за установление применения процесса цианирования. Производство золота во всем мире быстро удвоилось благодаря первоначальному применению цианирования в горнодобывающей промышленности. После первого применения цианирования при извлечении золота гидрометаллургическая промышленность развивалась и росла в соответствии с потребностями процесса и минеральной сложностью рудных месторождений.
Гидрометаллургические процессы можно определить как выщелачивание целевого металла в раствор с последующим концентрированием и очисткой насыщенного раствора и, наконец, восстановлением металла или его соединений. Переработка золотой и серебряной руды выщелачиванием является одним из наиболее ярких примеров ранних процессов, основанных на гидрометаллургии.
Большая часть извлечения золота из руды достигается за счет применения процесса щелочного цианидного выщелачивания. Химическое извлечение золота может быть определено двумя различными операциями: окислительным растворением золота и восстановительным осаждением металлического золота из раствора. Цианид является одним из наиболее привлекательных выщелачивающих средств в текущем промышленном процессе выщелачивания золота. Во время цианирования золота в растворе обычно присутствуют серебро и медь, что вызывает реакцию ионов их металлов с цианидом (CN − ), образуя комплексы [1].
Химическое извлечение золота может быть определено двумя различными операциями: окислительным растворением золота и восстановительным осаждением металлического золота из раствора. Цианид является одним из наиболее привлекательных выщелачивающих средств в текущем промышленном процессе выщелачивания золота. Во время цианирования золота в растворе обычно присутствуют серебро и медь, что вызывает реакцию ионов их металлов с цианидом (CN − ), образуя комплексы [1].
Цианид считается опасным соединением из-за его токсичности; в настоящее время различные группы по всему миру оказывают давление на окружающую среду с целью запретить промышленное использование цианида. Исследования по замене цианида в качестве выщелачивателя продолжаются уже много лет, и было обнаружено, что существуют другие потенциально пригодные соединения, такие как тиосульфат, тиомочевина, галогениды, различные сульфидные системы, аммиак, бактерии, природные кислоты, тиоцианат, нитрилы и их комбинации. цианида с другими соединениями [1]. Многие из этих альтернативных процессов добычи золота все еще находятся на ранних стадиях разработки. Ключевым фактором коммерческого успеха этих альтернативных выщелачивателей является общая стабильность выщелачивателя и комплекса золота в растворе.
Многие из этих альтернативных процессов добычи золота все еще находятся на ранних стадиях разработки. Ключевым фактором коммерческого успеха этих альтернативных выщелачивателей является общая стабильность выщелачивателя и комплекса золота в растворе.
В настоящее время горнодобывающая промышленность сталкивается с проблемой отделения этих сложных ценных минералов от руды, в которой они находятся. В этой статье описываются различные варианты, которые предлагают гидрометаллургические процессы для обработки этих сложных минералов, содержащих драгоценные металлы, такие как Cu, Ag и Au.
2. Комплексность медных руд
Тот факт, что большинство месторождений медных руд являются сложными, привел к лучшему развитию технологий, позволяющих более эффективно извлекать драгоценные металлы. В таблице 1 показаны некоторые сульфидные минералы, которые можно обнаружить при обработке руд, содержащих руды Cu, Ag и Au.
Месторождения сульфида меди по всему миру обычно связаны с минералами оксида меди. Как правило, оксидные медные минералы не реагируют на стандартные сульфидные собиратели меди и требуют применения различных методов флотации [3]. Обработка минералов сульфида меди, содержащих высокий процент оксида меди, вызывает проблемы в процессе обогащения, снижая содержание меди. Для повышения эффективности процесса обогащения необходимо перерабатывать оксидно-медную составляющую путем выщелачивания измельченной руды перед флотацией или выщелачиванием хвостов флотации, выходящих из обогатительной фабрики [4,5].
Как правило, оксидные медные минералы не реагируют на стандартные сульфидные собиратели меди и требуют применения различных методов флотации [3]. Обработка минералов сульфида меди, содержащих высокий процент оксида меди, вызывает проблемы в процессе обогащения, снижая содержание меди. Для повышения эффективности процесса обогащения необходимо перерабатывать оксидно-медную составляющую путем выщелачивания измельченной руды перед флотацией или выщелачиванием хвостов флотации, выходящих из обогатительной фабрики [4,5].
3. Цианирование комплексных золотых руд и концентратов
Процесс цианирования стал одним из наиболее часто используемых методов извлечения золота из руд. Использование цианидного выщелачивания для извлечения золота основано на свойствах золота, благодаря которым золото не окисляется при обычных температурах. Кроме того, золото не растворяется в серной, соляной и азотной кислотах, но растворяется в царской водке (смесь азотной и соляной кислот). С другой стороны, наиболее важным фактом о золоте в данном случае является то, что оно растворимо в разбавленных растворах цианидов. По этой причине цианид используется в качестве выщелачивателя в процессе выщелачивания для извлечения золота с помощью этого гидрометаллургического процесса [6]
С другой стороны, наиболее важным фактом о золоте в данном случае является то, что оно растворимо в разбавленных растворах цианидов. По этой причине цианид используется в качестве выщелачивателя в процессе выщелачивания для извлечения золота с помощью этого гидрометаллургического процесса [6]
На рис. 1 показано, что гидрометаллургический процесс начинается с выщелачивающих мешалок, где шлам вступает в контакт с цианидом, кислородом, водой и известью, тем самым запуская процесс выщелачивания. В процессе выщелачивания образуются другие цианидные комплексы, такие как сульфидные минералы меди и серебра. На этой стадии цианирования образуются следующие цианидные комплексы:
В этом случае сульфидные минералы меди могут образовывать комплексы с цианидом, например, Cu(CN) 2 , как показывает следующая реакция:
Образование комплексов цианидов меди и серебра влияет на извлечение золота как в процессе цианидного выщелачивания, так и на стадиях очистки и аффинажа [7]. Эти эффекты в основном мешают реакции цианида золота и адсорбции углерода. Большинство медных минералов быстро реагируют с цианидом, образуя множественные цианидные комплексы. В табл. 2 показана растворимость минералов меди в растворе цианида. Как можно показать, халькопирит является минералом меди с самым низким процентом растворенной и извлеченной меди по сравнению с другими минералами [8].
Эти эффекты в основном мешают реакции цианида золота и адсорбции углерода. Большинство медных минералов быстро реагируют с цианидом, образуя множественные цианидные комплексы. В табл. 2 показана растворимость минералов меди в растворе цианида. Как можно показать, халькопирит является минералом меди с самым низким процентом растворенной и извлеченной меди по сравнению с другими минералами [8].
Существуют высокие затраты на управление выбросами углерода и переработку слитков, связанные с вмешательством этих цианидных комплексов. Важную роль играет рН цианистого раствора при выщелачивании. Диапазон цианокомплексов зависит от таких условий, как концентрация цианида и pH, как показано на рисунке 2, где при рабочем диапазоне pH 10–11 концентрация комплекса Cu(CN) выше 4 3 − [8].
4. Потребление цианида
Образование комплексов цианидов меди и серебра на первой стадии процесса выщелачивания влияет на расход цианидов на извлечение золота. Следовательно, эксплуатационные расходы на цианирование значительно возросли. Приблизительно для цианида на каждые 3600 долл. США/т, доставленные на рудник, требуется всего 0,28 кг/т расхода руды, что соответствует 1 долл. США/т руды или 1% извлечения золота [9]. Потребление цианида остается одним из основных экономических соображений.
Следовательно, эксплуатационные расходы на цианирование значительно возросли. Приблизительно для цианида на каждые 3600 долл. США/т, доставленные на рудник, требуется всего 0,28 кг/т расхода руды, что соответствует 1 долл. США/т руды или 1% извлечения золота [9]. Потребление цианида остается одним из основных экономических соображений.
Поведение конкретной руды или концентрата при испытаниях можно определить путем проведения испытаний в скрученных бутылях или, в качестве альтернативы, путем испытаний в сосудах с мешалкой для измерения количества потребления цианида на единицу веса руды. Это значение может быть увеличено для целей инженерного проектирования. На расход цианида в процессе выщелачивания влияют следующие факторы: функции минералогии руды; концентрация цианида; кинетика реакций [10].
Ключевым фактором, который следует учитывать, является влияние времени пребывания и плотности пульпы во время выщелачивания цианидом. Время пребывания определяет и контролирует скорость реакции цианида и кислорода на поверхности свободных частиц. Оптимальное время реакции образования золотоцианидных комплексов достигается в первые часы реакции [7].
Оптимальное время реакции образования золотоцианидных комплексов достигается в первые часы реакции [7].
Вторым важным аспектом, который следует учитывать, является плотность пульпы во время реакции с цианидом. Потребление NaCN уменьшается по мере увеличения процентного содержания твердых веществ при различных концентрациях цианида, а это означает, что если нет надлежащего уровня извлечения золота из шлама, потребление цианида будет выше, как показано на рис. 3.
5. Цианирование золота в хвостах медной флотации
При производстве медных концентратов из сульфидных медно-золотых минералов пенной флотацией обычно образуются хвосты с содержанием меди, серебра и золота. Примером образования цианидных комплексов с медью и серебром в процессе выщелачивания является цианирование хвостов медной флотации, содержащих сульфиды, для извлечения золота [11,12]. На рис. 4 показано изображение образца руды из медного рудника в Мексике, сделанное MLA Automated Minerology и содержащего халькопирит и борнит в качестве сульфидных минералов меди.
Были проведены исследования для анализа извлечения золота цианистым выщелачиванием хвостов флотации из этой руды. В исследованных хвостах имелись значительные количества меди и серебра, которые могли образовывать цианидные комплексы при цианидном выщелачивании. Обогатительная фабрика на этом конкретном руднике в Мексике производит медный концентрат, однако их схема флотации извлекает только около 75% золота; остальное теряется в хвостохранилищах [14,15].
В таблице 3 показаны результаты выщелачивания цианидом хвостов флотации этой мексиканской обогатительной фабрики с концентрацией NaCN 0,5 мг/л. Значения процента извлечения меди и серебра составили 33% и 35% соответственно, что означает, что большая часть значений меди и серебра была потеряна в хвостах выщелачивания, как показано в Таблице 4. Концентрация кислорода измерялась во время испытания, чтобы контролировать подача кислорода, так как он необходим для выщелачивания золота. [16]. Эти значения меди и серебра могут представлять собой проблему, связанную с рециркуляцией цианида во время выщелачивания; по этой причине рекомендуется внедрение процесса детоксикации с цианидной очисткой [17].
Медь и серебро, образующие цианидные комплексы во время цианирования золота, могут вызывать проблемы при адсорбции активированным углем, например, конкурируя с адсорбируемым золотом, поэтому требуется более высокая концентрация свободного цианида [18]. Кроме того, минералогия состоит из минералов сульфида меди, как упоминалось ранее. Ожидается, что раствор, не содержащий цианидов, сохраняет высокое содержание сульфидов, которые можно удалить с помощью процесса SART, обсуждаемого в этой статье [19].].
Как уже упоминалось, процесс очистки больших объемов сточных вод, загрязненных цианидом, остается проблемой в процессе цианирования. Сточные воды содержат свободный цианид и комплексы цианидов металлов, которые в данном конкретном случае представляют собой комплексы меди и серебра [20, 21].
6. Альтернативы выщелачивателям цианида
Как упоминалось в Разделе 1, существуют альтернативные процессы по золоту, в которых используются альтернативные выщелачиватели из цианида. В табл. 5 приведены константы стабильности и стандартные потенциалы восстановления для комплексов золота. Ясно, что цианидный комплекс более стабилен и по своей природе более селективен, чем любой другой альтернативный реагент. Например, тиосульфат, тиомочевина и бисульфид на несколько порядков менее стабильны.
В табл. 5 приведены константы стабильности и стандартные потенциалы восстановления для комплексов золота. Ясно, что цианидный комплекс более стабилен и по своей природе более селективен, чем любой другой альтернативный реагент. Например, тиосульфат, тиомочевина и бисульфид на несколько порядков менее стабильны.
Широкий диапазон значений констант стабильности для комплексов золота указывает на то, что стандартное восстановление для различных видов лигандов золота варьируется почти на 2 В. Большинство реагентов имеют небольшой рабочий интервал для эффективного растворения цианида по сравнению с цианидом, как показано на Рисунок 5. Высокий окислительный потенциал некоторых выщелачивающих веществ приводит к высокому расходу реагентов из-за реакции с сульфидными минералами, содержащимися в руде, и окисления самого реагента. Следует учитывать, что адсорбция реагентов и/или осаждение золота на некоторых породных минералах может повлиять на общее извлечение золота.
7.
 Адсорбция углем
Адсорбция углем
Образование комплексов цианидов меди и серебра также влияет на адсорбцию золота на стадии CIP при выщелачивании. Адсорбция соединений цианидов металлов происходит в селективной форме, в зависимости от ионных диаметров комплексов цианидов металлов. Адсорбция цианидов металлов на активированном угле является селективной, и наиболее активным адсорбируемым комплексом является Au(CN) 2− . С другой стороны, комплекс серебра с цианидом Ag(CN) 2− адсорбируется сильно, но не так сильно, как комплекс золота с цианидом [23].
Цианидные комплексы меди Cu(CN) 2– и Cu(CN) 3 2– проявляют разные адсорбционные свойства, при этом комплекс Cu(CN) 2– адсорбирует сильнее, чем Cu(CN) 2–. CN) 3 2– комплекс [24]. Гидратация является важным аспектом адсорбции углерода, поскольку она вызывает увеличение диаметра молекулы комплексов цианидов металлов из-за того факта, что ион металла, вероятно, имеет заранее заданную гидратацию, которая может повлиять на адсорбцию металлов цианидами углерода. Классификация тех, которые наиболее сильно адсорбируются, и наименее абсорбируемых: Au > Ag > Cu, где Ag и Cu влияют на извлечение золота в процессе выщелачивания [23].
Классификация тех, которые наиболее сильно адсорбируются, и наименее абсорбируемых: Au > Ag > Cu, где Ag и Cu влияют на извлечение золота в процессе выщелачивания [23].
Поддержание высокой концентрации свободного цианида снижает концентрацию более адсорбированных комплексов меди. Увеличение адсорбции цианида меди при низких концентрациях цианида приводит к проблемам с адсорбцией золота, как упоминалось ранее [25].
8. Варианты обработки
Для обработки медно-золотых руд были разработаны различные варианты. Примерно 20% всех месторождений золота имеют значительную медную минерализацию, связанную с халькопиритом, тетраэдритом, теннантитом, борнитом и халькозином. Большинство медных минералов, включая оксиды, карбонаты, сульфиды меди (за исключением халькопирита) и самородную медь, хорошо растворимы в растворах цианидов. Как упоминалось ранее, минералы, содержащие медь, проблематичны, потому что в процессе цианирования золота медь также образует цианидные комплексы, тем самым потребляя цианид [6,25].
Наличие медно-цианидных комплексов создает конкуренцию золоту при активированной адсорбции; это также влияет на эффективность электролиза. Были предприняты исследования, касающиеся обработки медно-золотых руд, а также снижения воздействия медно-цианистых комплексов. Некоторые из вариантов обработки включают [25,26]:
- (1)
Технологии разделения руды
Селекционная сепарация руд с высоким содержанием меди перед процессом выщелачивания является вариантом для снижения воздействия от содержания меди. Например, шахта Red Dome в Австралии избирательно добывает и выщелачивает руды, содержащие менее 0,5% меди [25].
- (2)
Технологии селективного выщелачивания
Другим вариантом обработки является селективное выщелачивание меди, содержащейся в рудах, содержащих золото, перед выщелачиванием золота. Эти процессы часто связаны с высоким расходом реагентов, а также с проблемами извлечения выщелоченной меди./copper.jpg’ /> Были предприняты исследования по применению процессов с медью/аммиаком/цианидом для обработки медьсодержащих руд. Эти исследования показали, что добавление аммиака к раствору цианида приводит к меньшему расходу цианида и более высокой селективности выщелачивания золота по сравнению с медью. Однако скорость выщелачивания золота в этой системе ниже при использовании аммиака; кроме того, это также представляет собой проблему гигиены труда и окружающей среды [24].
- (3)
Технологии разрушения цианидов меди
Этот тип процесса использует SO 2 в сочетании с воздухом для окисления цианида до цианита, при этом медь осаждается в конце реакции в виде меди гидроксид [27]. Существуют альтернативные процессы разрушения цианидов, такие как щелочное хлорирование, использование перекиси водорода (процесс Дегусса), использование кислоты Каро, электрохимическое окисление, биодеградация, использование ультразвуковой технологии или фотолиз [5].
9.
 Технология сульфидирования, подкисления, рециркуляции и сгущения (SART)
Технология сульфидирования, подкисления, рециркуляции и сгущения (SART)
Недавно были разработаны новые процессы для решения основных проблем, ранее упомянутых при переработке комплексных медных руд для извлечения золота. Одним из таких процессов является процесс SART. SGS Lakefield Group и Teck Corporation разработали процесс SART в 1990-х годах [26]. Преимущество использования процесса SART в процессе цианирования заключается в том, что он разрушает цианидные комплексы неблагородных металлов, осаждает металлы в виде высококачественных сульфидных концентратов и высвобождает цианид для рециркуляции в процесс выщелачивания [28]. Процесс SART описывается следующей последовательностью единичных операций:
Сульфидизация и подкисление: на этом этапе раствор цианида смешивают с гидросульфидом натрия NaSH и H 2 SO 4 для снижения pH до 4–5 с образованием Cu 2 S с использованием реактора-осадителя и загустителя. с образованием осадка Cu 2 S в качестве побочного продукта. Уравнения (4) и (5) показывают реакции в ходе этого процесса [29]:
с образованием осадка Cu 2 S в качестве побочного продукта. Уравнения (4) и (5) показывают реакции в ходе этого процесса [29]:
Уравнение (4) показывает закисление раствора, которое способствует диссоциации слабых комплексов металлов с цианидами (WAD комплексов), таких как металлы Cu и Ag . Уравнение (5) включает осаждение растворимых ионов металлов, образующих сульфиды металлов, такие как Cu 2 S. Эффективность осаждения Cu при стандартных условиях процесса составляет от 80% до 90%. [29].
Повторное использование: оставшийся раствор, содержащий HCN, нейтрализуют с помощью CaO для достижения pH от 10 до 11 с образованием CaSO 4 (гипс) и для повторного использования цианида соответственно. Затем образовавшийся твердый гипс удаляют из процесса путем сгущения и фильтрации, как показано в уравнениях (6) и (7) [29]:
Сгущение: гипс осаждают с помощью отстойника и флокулянта для отделения раствора (Китай) 2 и гипс. Цианид рециркулируется в процессе, а гипс осаждается для утилизации. Сливной раствор из загустителя гипса фильтруется и представляет собой конечный раствор. Этот раствор имеет содержание цианида, представленное как Ca (CN) 2 , что эквивалентно свободному цианиду, который рециркулируется в процессе цианирования [29].
Цианид рециркулируется в процессе, а гипс осаждается для утилизации. Сливной раствор из загустителя гипса фильтруется и представляет собой конечный раствор. Этот раствор имеет содержание цианида, представленное как Ca (CN) 2 , что эквивалентно свободному цианиду, который рециркулируется в процессе цианирования [29].
Эти стандартные операции процесса SART описывают обработку раствора цианида после удаления активированного угля. На рис. 6 показана общая схема процесса SART:
Процесс SART уменьшает количество проблем, вызванных комплексами меди и цианида в процессе выщелачивания цианидом. Он перерабатывает цианид, чтобы снизить потребление цианида и обеспечить экономию эксплуатационных расходов. Это позволяет избежать удаления свободного цианида, который может представлять опасность для окружающей среды [30]. Кроме того, образование Cu 2 S в качестве товарного продукта является одним из существенных преимуществ процесса SART при цианидном выщелачивании из-за того, что в нем экономически выгодно используется содержание меди. Идеальной производительностью процесса SART и операции сгущения было бы получение чистого раствора и отделение твердых веществ от обработанного раствора в сгустителе [31].
Идеальной производительностью процесса SART и операции сгущения было бы получение чистого раствора и отделение твердых веществ от обработанного раствора в сгустителе [31].
10. Выводы
Проблемы обработки руд и концентратов медью, серебром и золотом значительно усложнились по мере усложнения минералогии. Следовательно, технология такого лечения была вынуждена стать более эффективной и инновационной, чтобы противостоять этим текущим вызовам. Применение процесса цианирования в сочетании с процессом SART представляет собой инновационный способ уменьшить проблемы, связанные с наличием в процессе вредных цианидных комплексов, путем извлечения товарных сульфидов меди и серебра. В результате угольный цикл можно сделать меньше и спроектировать в первую очередь для извлечения золота. Существуют также экологические преимущества применения этих процессов, в том числе снижение опасного химического воздействия на окружающую среду.
Вклад авторов
Концептуализация, Д. М. и C.G.A.; методология, Д.М. и C.G.A.; Д.М. и C.G.A.; проверка, Д.М. и C.G.A.; формальный анализ, Д.М. и C.G.A.; расследование, Д.М. и C.G.A.; ресурсы, Д.М. и C.G.A.; курирование данных, Д.М. и C.G.A.; написание – черновая подготовка, Д.М.; написание — обзор и редактирование, Д.М.; визуализация, Д.М.; надзор, C.G.A.; администрирование проекта, C.G.A.; приобретение финансирования, C.G.A. Все авторы прочитали и согласились с опубликованной версией рукописи.
М. и C.G.A.; методология, Д.М. и C.G.A.; Д.М. и C.G.A.; проверка, Д.М. и C.G.A.; формальный анализ, Д.М. и C.G.A.; расследование, Д.М. и C.G.A.; ресурсы, Д.М. и C.G.A.; курирование данных, Д.М. и C.G.A.; написание – черновая подготовка, Д.М.; написание — обзор и редактирование, Д.М.; визуализация, Д.М.; надзор, C.G.A.; администрирование проекта, C.G.A.; приобретение финансирования, C.G.A. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Исследование финансировалось NEMISA, 470120.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Адамс, доктор медицинских наук Преимущества в переработке золотой руды, 1-е изд.; Elsevier B.V.: Перт, Австралия, 2005 г. [Google Scholar]
- Twidwell, L.G. Колледж минералогии и технологий Монтаны. Единичные процессы в добывающей металлургии: гидрометаллургия. 1970 г.; п. 16. Доступно в Интернете: https://files.
 eric.ed.gov/fulltext/ED218136.pdf (по состоянию на 6 января 2020 г.).
eric.ed.gov/fulltext/ED218136.pdf (по состоянию на 6 января 2020 г.). - Ли, К.; Арчибальд, Д.; Маклин, Дж.; Рейтер, М.А. Флотация смешанных оксидов меди и сульфидных минералов с собирателями ксантогената и гидроксамата. Шахтер. англ. 2008 , 22, 1–7. [Google Scholar] [CrossRef]
- Sokic, MD; Милошевич В.Д.; Станкович В.Д.; Маткович, Л.В.; Маркович, Б.Р. Кислотное выщелачивание оксидно-сульфидной медной руды перед флотацией — способ увеличения извлечения металла. Хемийская промышленность 2015 , 69, 454–458. [Google Scholar] [CrossRef][Зеленая версия]
- Макклелланд, GE; МакПартленд, Дж.С. Металлургические сравнения от испытаний до производства. Доп. Золотой серебряный процесс. 1990 , 1, 49–57. [Google Scholar]
- Deschenes, G. Успехи в цианировании золота. Дев. Шахтер. Процесс. 2005 , 15, 479–500. [Google Scholar]
- Бриттан М.
 ; Пленге, Г. Оценка процесса извлечения золота, времени пребывания при выщелачивании и потребления цианида для золоторудной руды с высоким потреблением цианида. Шахтер. Металл. Процесс 2015 , 32, 111–120. [Google Scholar] [CrossRef]
; Пленге, Г. Оценка процесса извлечения золота, времени пребывания при выщелачивании и потребления цианида для золоторудной руды с высоким потреблением цианида. Шахтер. Металл. Процесс 2015 , 32, 111–120. [Google Scholar] [CrossRef] - Щерезини, Б. Золото-медные руды. В «Преимуществах в переработке золотой руды», 1-е изд.; Адамс, доктор медицины, изд.; Elsevier B.V.: Перт, Австралия, 2005 г.; стр. 789–821. [Google Scholar]
- Хилл Стивен, Д. Процесс получения углерода в целлюлозе. В извлечении драгоценных металлов из низкосортных ресурсов; Горное управление: Вашингтон, округ Колумбия, США, 1986 г.; стр. 40–43. [Google Scholar]
- Breuer, P.L.; Рамбол, Дж.А. Измерение и контроль содержания цианидов в комплексных рудах и концентратах. В материалах Девятой конференции операторов мельниц, Фримантл, Вашингтон, Австралия, 19–21 марта 2007 г.; AusIMM: Виктория, Австралия, 2007 г.; стр. 249–253. [Google Scholar]
- «> Estay, H. Разработка процесса SART — обзор. Гидрометаллургия 2018 , 176, 147–165. [Google Scholar] [CrossRef]
- Томпсон П.; Рунге, К.; Данн, Р. Испытания сульфидной флотации. В Справочнике по переработке полезных ископаемых и добывающей металлургии, 1-е изд.; Общество горнодобывающей промышленности, МСП: Энглвуд, Колорадо, США, 2019 г.; стр. 1029–1031. [Google Scholar]
- Медина, Д.; Андерсон, К. Извлечение золота из хвостов выщелачиванием цианидов из будущих руд. Магистерская диссертация, Колорадская горная школа, Голден, Колорадо, США, 2020 г. (неопубликованная). [Академия Google]
- Се, Ф.; Драйзингер, Д.; Дойл, Ф. Обзор извлечения меди и цианида из отработанных растворов цианида. Шахтер. Процесс. Доп. Металл. 2013 , 34, 387–411. [Google Scholar] [CrossRef]
- Маркович З.; Вусович, Н.; Миланович, Д. Переработка воды хвостов флотации старой меди. В материалах XXV Международного конгресса по переработке полезных ископаемых (IMPC), Брисбен, Квинсленд, Австралия, 6–10 сентября 2010 г .
 ; Австралийский институт горного дела и металлургии: Брисбен, Австралия, 2010 г.; стр. 3825–3829.. [Google Scholar]
; Австралийский институт горного дела и металлургии: Брисбен, Австралия, 2010 г.; стр. 3825–3829.. [Google Scholar] - Haque, K.E. Роль кислорода в цианидном выщелачивании золотой руды. CIM Bull. 1992 , 85, 31–38. [Google Scholar]
- Андерсон, К.Г. Кинетика щелочного сульфидного выщелачивания золота. Шахтер. англ. 2016 , 92, 248–256. [Google Scholar] [CrossRef]
- Барский Г.; Суэйнсон, С.Дж. Растворение золота и серебра в растворах цианидов. Транс. AIME 1943 , 112, 660–667. [Google Scholar]
- Эстей, Х.; Минхай, Г.К.; Габриэль, С .; Килакео, М.; Баррос, Л.; Фигероа, Р.; Тронкосо, Э. Оптимизация процесса SART: критическая оценка критериев его проектирования. Шахтер. Процесс. 2020 , 146, 1–11. [Google Scholar] [CrossRef]
- Zarate, G.E. Переработка золотых хвостов методом кучного выщелачивания. В разработке малых месторождений драгоценных металлов; Общество горных инженеров: Сантьяго, Чили, 1987 г.
 ; стр. 152–155. [Google Scholar]
; стр. 152–155. [Google Scholar] - Prasad, MS; Менса, BR; Писарро, Р.С. Современные тенденции в обработке золота — обзор. Шахтер. англ. 1991 , 4, 1257–1277. [Google Scholar] [CrossRef]
- Эйлмор, М.Г. Альтернативный выщелачивающий агент цианиду для выщелачивания золотых руд. В «Обработка золотой руды: разработка и эксплуатация проектов», 2-е изд.; Адамс, доктор медицины, изд.; Elsevier B.V.: Амстердам, Нидерланды, 2016 г.; стр. 447–460. [Академия Google]
- Сайнер Б.; Акаркан, Н. Влияние цианидов серебра, никеля и меди на адсорбцию золота на активированном угле. Физико-химическая проблема. Шахтер. Процесс. 2013 , 50, 277–287. [Google Scholar]
- Мьюир Д.М.; Ла Бруй, С.Р.; Фентон, К. Обработка медно-золотых руд аммиаком или растворами цианистого аммиака. Золото мира 1991 , 91, 145–150. [Google Scholar]
- Дай, X.; Саймонс, А .; Брейер, П.
 Обзор технологий извлечения цианида меди для цианирования медьсодержащих золотых руд. Шахтер. англ. 2012 , 25, 1–13. [Google Scholar] [CrossRef]
Обзор технологий извлечения цианида меди для цианирования медьсодержащих золотых руд. Шахтер. англ. 2012 , 25, 1–13. [Google Scholar] [CrossRef] - Литтлджон П.; Краточвил, Д.; Холл, А. Сульфидизация-подкисление-рециркуляция-загущение сложных руд. В Proceedings of the World Gold, Брисбен, Австралия, 26–29 сентября 2013 г.; стр. 149–155. [Google Scholar]
- Никол, М.Дж.; Флеминг, Калифорния; Пол, Р.Л. Химия извлечения золота. В химии извлечения золота; Марсден, Дж., Хаус, И., ред.; МСП: Литтлтон, Колорадо, США, 2006 г.; стр. 831–905. [Академия Google]
- Кратохвиль, Д.; Салари, Д.; Авилес, Т. Внедрение SART на операциях кучного выщелачивания в Мексике. Материалы 50-й ежегодной канадской конференции операторов переработчиков полезных ископаемых, Оттава, Онтарио, Канада, 24 января 2018 г.; CIM: Оттава, Онтарио, Канада; стр. 1–13. [Google Scholar]
- Эстей, Х.; Карвахаль, П.
 ; Хеджази, Ф.; Целлер, Т.В. Опыт применения процесса SART на заводе в Гедабеле. В материалах 4-го Международного семинара по технологической гидрометаллургии, Сантьяго, Чили, 12–13 июля 2012 г.; Гекамин: Сантьяго, Чили; стр. 1–10. [Академия Google]
; Хеджази, Ф.; Целлер, Т.В. Опыт применения процесса SART на заводе в Гедабеле. В материалах 4-го Международного семинара по технологической гидрометаллургии, Сантьяго, Чили, 12–13 июля 2012 г.; Гекамин: Сантьяго, Чили; стр. 1–10. [Академия Google] - Кеван, Дж.Р.Ф.; Роберт Д.Х. Применение процесса SART для кучного выщелачивания. СГС Майнер. Серв. Тех. Бык. 2008 , 51, 1–12. [Google Scholar]
- Эстей, Х.; Беккер, Дж.; Карвахаль, П.; Арриагада, Ф. Прогнозирование образования газообразного HCN в процессе SART. Гидрометаллургия 2012 , 113, 131–142. [Google Scholar] [CrossRef]
Рисунок 1.
Схема цианистого выщелачивания золота с использованием активированного угля. Воспроизведено и адаптировано из [9] с разрешения PERGAMON, 1987.
Рисунок 1.
Схема цианистого выщелачивания золота с использованием активированного угля. Воспроизведено и адаптировано из [9] с разрешения PERGAMON, 1987.
Рисунок 2.
Сравнение видов цианидов и pH. Воспроизведено и адаптировано из [8] с разрешения Elservier B.V., 2005.
Рисунок 2.
Сравнение видов цианидов и pH. Воспроизведено и адаптировано из [8] с разрешения Elservier B.V., 2005.
Рисунок 3.
Расход (кг/т) по сравнению с процентным содержанием твердых веществ (%) NaCN. Воспроизведено и адаптировано из [7] с разрешения Springer, 2015.
Рисунок 3.
Расход (кг/т) по сравнению с процентным содержанием твердых веществ (%) NaCN. Воспроизведено и адаптировано из [7] с разрешения Springer, 2015.
Рисунок 4.
Изображение, содержащее минералы сульфида меди. Воспроизведено и адаптировано из [13] с разрешения авторов, 2020 г.
Рисунок 4.
Изображение, содержащее минералы сульфида меди. Воспроизведено и адаптировано из [13] с разрешения авторов, 2020 г.
Рисунок 5.
Диаграмма, показывающая типичный диапазон действия выщелачивателей. Воспроизведено и адаптировано из [22] с разрешения Elsevier B. V., 2016.
V., 2016.
Рисунок 5.
Диаграмма, показывающая типичный диапазон действия выщелачивателей. Воспроизведено и адаптировано из [22] с разрешения Elsevier B.V., 2016.
Рисунок 6.
Технологическая схема SART. Воспроизведено и адаптировано из [16] с разрешения PERGAMON, 2020.
Рисунок 6.
Технологическая схема SART. Воспроизведено и адаптировано из [16] с разрешения PERGAMON, 2020.
Таблица 1.
Основные сульфидные минералы медных руд [2].
Таблица 1.
Основные сульфидные минералы медных руд [2].
| Sulfide Mineral | Element | Formula | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Chalcopyrite | Copper | CuFeS 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chalcocite | Cu 2 S | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covellite | CuS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bornite | Cu 5 FeS 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pyrite | Iron | FeS 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pyrholite | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Минерал | Формула | процент общего количества медной. ) б | |||
|---|---|---|---|---|---|
| 23 С | 45 С | ||||
| Azurite | 2Cu(CO) 3 · Cu(OH) 2 | 94.5 | 100 | 3. 62 62 | 91.8 |
| Malachite | 2CuCO 3 (OH) 2 | 90.2 | 100 | 4.48 | 99.7 |
| Chalcocite | Cu 2 S | 90.2 | 100 | 2.76 | 92.6 |
| Covellite | CuS | − | − | 5.15 | 95. 6 6 |
| Native Copper | Cu | 90 | 100 | − | − |
| Cuprite | Cu 2 O | 85.5 | 100 | 4.94 | 96.6 |
| Bornite | FeS·2Cu 2 ·CuS | 70 | 100 | 5.13 | 96 |
| Enargite | Cu 3 AsS 4 | 65. 8 8 | 75.1 | − | − |
| Tetrahedrite | (Cu,Fe,Ag,Zn) 12 Sb 4 S 13 | 21.9 | 43.7 | − | − |
| Chrysocolla | CuSiO 3 ·nH 2 O | 11.8 | 15.7 | − | − |
| Chalcopyrite | CUFES 2 | 5,6 | 8,2 | 2,79 | 5,8 |
A 3
a 3 DIKENEN. b Данные Лоуэра и Бута (1965). Расход цианида выражается в г. NaCN/г содержащейся меди, данные получены путем выщелачивания при комнатной температуре в течение 6 часов.
b Данные Лоуэра и Бута (1965). Расход цианида выражается в г. NaCN/г содержащейся меди, данные получены путем выщелачивания при комнатной температуре в течение 6 часов.
Таблица 3.
Результаты цианистого выщелачивания медно-золотых минералов. Воспроизведено из [13] с разрешения авторов.
Таблица 3.
Результаты цианистого выщелачивания медно-золотых минералов. Воспроизведено из [13] с разрешения авторов.
| Conditions | Assay (mg/kg) | Distribution % | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| NaCN concentration (mg/L) | Time (h) | Dissolved Oxygen (mg/L) | pH | Au | Ag | Cu | Au | Ag | Медь | |
| 0,5 | 0. 00 00 | 5.55 | 11.61 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | |
| 2.00 | 4.87 | 11.60 | 0.11 | 0.45 | 85.31 | 12,00 | 7,20 | 10,73 | ||
| 6,00 | 4,75 | 13,75 | ||||||||
0. 76 76 | 135.00 | 18.53 | 12.16 | 16.98 | ||||||
| 17.00 | 4.34 | 11.62 | 0.21 | 1.24 | 186.80 | 22.11 | 19.84 | 23.49 | ||
| 24.00 | 4.29 | 11.70 | 0.22 | 1.70 | 190. 00 00 | 23.16 | 27.20 | 23.90 | ||
| 32.00 | 3.80 | 11.71 | 0.23 | 2.10 | 198.00 | 24.21 | 33.60 | 24.90 | ||
| Recovery % | 81.79 | 33.33 | 35.59 | Head (Расч.) | 100,00 | 100,00 | 100,00 | |||
Таблица 4.
Элементный анализ хвостов выщелачивания. Воспроизведено из [13], с разрешения авторов, 2020 г.
Таблица 4.
Элементный анализ хвостов выщелачивания. Воспроизведено из [13], с разрешения авторов, 2020.
| Образец | Au(мг/кг) | Ag(мг/кг) | Cu(%) | Au(мг/кг) | 0.10 | 2.00 | 0.04 |
|---|---|---|---|
| B | 0.08 | 6.04 | 0.072 |
Table 5.
Константы и стандартные потенциалы восстановления комплексов Au при 25 °С. Воспроизведено и адаптировано из [4] с разрешения Elsevier B. V., 2016.
V., 2016.
Таблица 5.
Константы и стандартные потенциалы восстановления комплексов Au при 25 °С. Воспроизведено и адаптировано из [4] с разрешения Elsevier B.V., 2016 г.
 38
38

 Воспроизведено и адаптировано из [8] с разрешения Elsevier B.V., 2005.
Воспроизведено и адаптировано из [8] с разрешения Elsevier B.V., 2005.