Сравнить и описать свойства меди и железа: Чем отличаются медь и железо
Содержание
Общая характеристика меди, цинка, хрома, железа
Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
+26Fe [Ar]3d64s2 [Ar] 4s 3d
У атома цинка на происходит полное заполнение 3d-подуровня:
+30Zn [Ar]3d104s2 [Ar] 4s 3d
У атомов хрома и меди наблюдается «проскок» или «провал» электрона, когда один электрон переходит с более энергетически выгодного 4s-подуровня на менее выгодный 3d-подуровень. Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d10 у атома меди). Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.
Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d10 у атома меди). Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.
| Элемент | Электронная конфигурация валентной зоны | |
| Теоретическая | Реальная | |
| Медь +29Cu | [Ar]3d104s1 [Ar] 4s 3d | |
| Хром +24Cr | [Ar]3d54s1 [Ar] 4s 3d | |
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.
| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d54s1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d64s2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d104s1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d104s2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:
| Название | Атомная масса, а. е.м. е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Хром | 51,996 | +24 | 1,66 | 0,130 | 652,4 | 1856,9 | 7,19 |
| Железо | 55.845 | +26 | 1.83 | 0,126 | 759,1 | 1538,85 | 7,874 |
| Медь | 63,546 | +29 | 1,90 | 0,128 | 745,0 | 1083,4 | 8,92 |
| Цинк | 65,38 | +30 | 1,65 | 0,138 | 905,8 | 419,6 | 7,133 |
Свойства соединений железа, меди, цинка и хрома.
Для хрома характерны степени окисления +2, +3 и +6.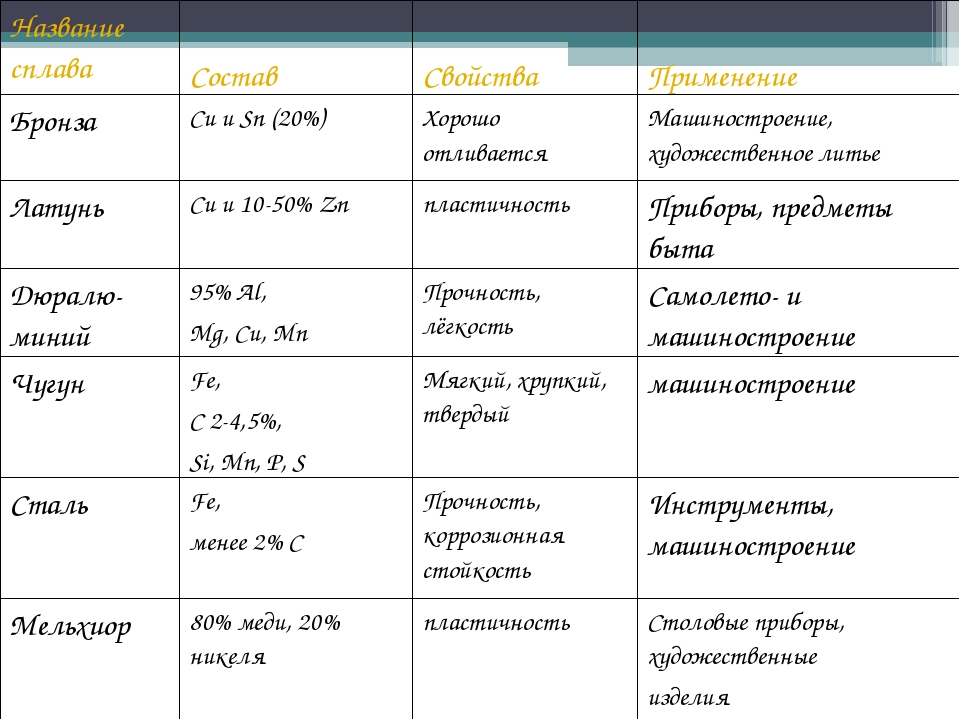 Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно. Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно. Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Характерные степени окисления железа: +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
| Элемент | Степень окисления | Тип и формула оксида | Тип и формула гидроксида | Окислительно-восстановительные свойства |
| Хром | +2 | CrO, основный | Cr(OH)2, основание | восстановитель, слабый окислитель |
| +3 | Cr2O3, амфотерный | Cr(OH)3, амфотерный гидроксид | окислитель и восстановитель | |
| +6 | CrO3, кислотный | H2CrO4 и H2Cr2O7, кислоты | окислитель | |
| Железо | +2 | FeO, основный | Fe(OH)2, основание | восстановитель и слабый окислитель |
| +3 | Fe2O3, амфотерный | Fe(OH)3, амфотерный гидроксид | окислитель, очень слабый восстановитель | |
| Медь | +1 | Cu2O, основный | CuOH, основание | восстановитель и слабый окислитель |
| +2 | CuO, основный | Cu(OH)2, основание | окислитель | |
| Цинк | +2 | ZnO, амфотерный | Zn(OH)2, амфотерный гидроксид | слабый окислитель |
Понравилось это:
Нравится Загрузка.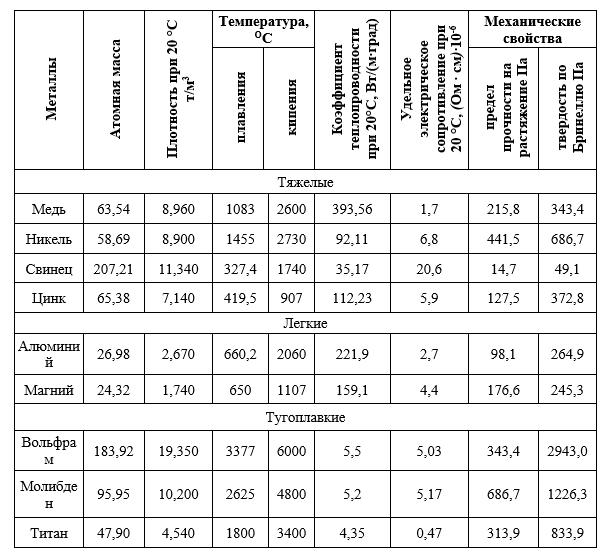 ..
..
Обработка металла в древности. Как человечество вошло в железный век
Как известно, основным материалом, из которого первобытные люди изготавливали орудия труда, был камень. Не зря сотни тысяч лет, прошедшие между появлением человека на земле и возникновением первых цивилизаций называют каменным веком. Но в 5-6 тысячелетиях до н. э. люди открыли для себя металл.
Скорее всего, первое время человек относился к металлу точно так же, как к камню. Он находил, например, медные самородки и пытался обрабатывать их точно так же, как камень, т. е. с помощью обивки, шлифования, отжатия отщепов и т. д. Но очень быстро стала ясна разница между камнем и медью. Может быть, даже, первоначально люди решили, что от металлических самородков толку не будет, тем более что медь была достаточно мягкой, и орудия, которые из нее изготавливались, быстро выходили из строя. Кто придумал плавить медь? Теперь мы никогда не узнаем ответа на этот вопрос. Скорее всего, все получилось случайно. Раздосадованный человек бросил камешек, который показался ему неподходящим для изготовления топора или наконечника стрелы, в костер, а затем с удивлением заметил, что камешек растекся блестящей лужицей, а после прогорания огня – застыл. Потом понадобилось только немного поразмыслить – и идея плавки была открыта. На территории современной Сербии был найден медный топор, созданный за 5 500 лет до Рождества Христова.
Скорее всего, все получилось случайно. Раздосадованный человек бросил камешек, который показался ему неподходящим для изготовления топора или наконечника стрелы, в костер, а затем с удивлением заметил, что камешек растекся блестящей лужицей, а после прогорания огня – застыл. Потом понадобилось только немного поразмыслить – и идея плавки была открыта. На территории современной Сербии был найден медный топор, созданный за 5 500 лет до Рождества Христова.
Правда, медь, конечно, уступала по многим характеристикам даже камню. Как уже говорилось выше, медь – слишком мягкий металл. Его основным преимуществом являлась плавкость, позволявшая изготавливать из меди самые различные предметы, но по прочности и остроте она оставляла желать лучшего. Конечно, до открытия, например, златоустовской стали (Статья «Русский булат из Златоуста»), должно было пройти еще несколько тысячелетий. Ведь технологии создавались постепенно, сначала – неуверенными, робкими шажками, методом проб и бесчисленных ошибок. Вскоре медь была вытеснена бронзой, сплавом меди и олова. Правда, олово, в отличие от меди, встречается далеко не везде. Не зря в древности Британия носила название «Оловянные острова» – многие народы снаряжали туда торговые экспедиции за оловом.
Вскоре медь была вытеснена бронзой, сплавом меди и олова. Правда, олово, в отличие от меди, встречается далеко не везде. Не зря в древности Британия носила название «Оловянные острова» – многие народы снаряжали туда торговые экспедиции за оловом.
Медь и бронза стали основой древнегреческой цивилизации. В «Илиаде» и «Одиссее» мы постоянно читаем о том, что греки и троянцы были одеты в медные и бронзовые доспехи, использовали бронзовое оружие. Да, в древности металлургия во многом обслуживала именно военных. Пахали землю нередко по старинке, деревянным плугом, да и, например, водостоки можно было сделать из дерева или глины, но на поле битвы бойцы выходили в прочных металлических доспехах. Однако бронза как материал для оружия имела один серьезный недостаток: она была слишком тяжелой. Поэтому со временем человек научился выплавлять и обрабатывать сталь.
Железо было известно еще в те времена, когда на Земле шел бронзовый век. Однако сыродутное железо, получавшееся в результате обработки при небольшой температуре, было чересчур мягким.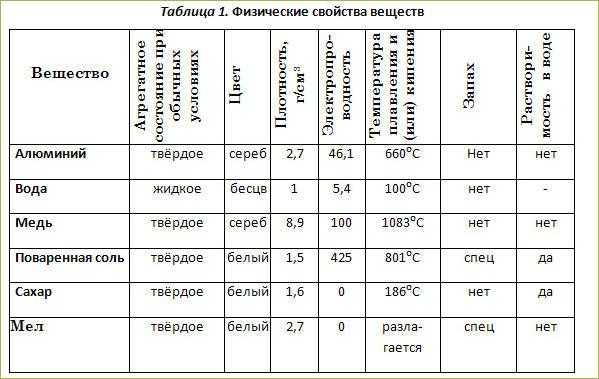 Большей популярностью пользовалось метеоритное железо, но оно было очень редким, найти его можно было лишь по случайности. Однако оружие из метеоритного железа было дорогим, иметь его было очень престижно. Египтяне называли кинжалы, выкованные из упавших с неба метеоритов, Небесными.
Большей популярностью пользовалось метеоритное железо, но оно было очень редким, найти его можно было лишь по случайности. Однако оружие из метеоритного железа было дорогим, иметь его было очень престижно. Египтяне называли кинжалы, выкованные из упавших с неба метеоритов, Небесными.
Принято считать, что широкое распространение обработка железа получила у живших на Ближнем Востоке хеттов. Именно они около 1200 г до н. э. научились выплавлять настоящую сталь. На некоторое время ближневосточные державы стали невероятно могущественными, хетты бросали вызов самому Риму, а филистимляне, о которых упоминается в Библии, владели огромными территориями на современном Аравийском полуострове. Но вскоре их технологическое преимущество сошло на нет, ведь технологии выплавки стали, как оказалось, было не так уж сложно позаимствовать. Главной проблемой было создание горнов, в которых можно было достичь той температуры, при которой железо превращалось в сталь. Когда окрестные народы научились строить такие плавильные печи, производство стали началось буквально во всей Европе.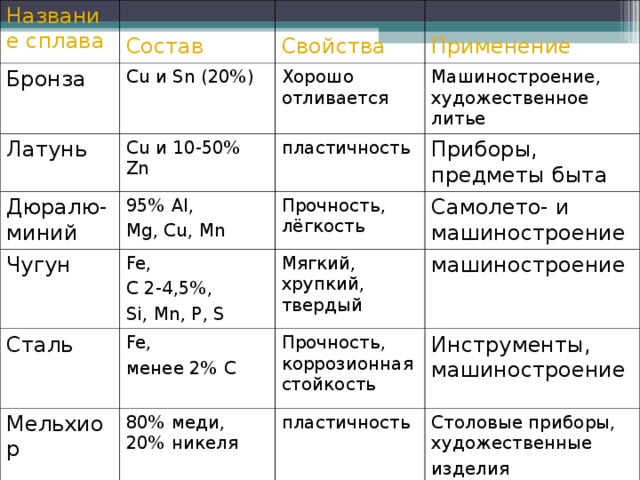 Конечно, многое зависело от сырья. Ведь люди лишь относительно недавно научились обогащать исходное сырье дополнительными веществами, придающими стали новые свойства. Например, римляне насмехались над кельтами, ведь у многих кельтских племен сталь была настолько плохой, что их мечи гнулись в сражении, и воины должны были отбежать в задний ряд, чтобы выпрямить клинок. Зато римляне преклонялись перед изделиями мастеров-оружейников из Индии. Да и у некоторых кельтских племен сталь не уступала знаменитой дамасской. (Статья «Дамасская сталь: мифы и реальность»)
Конечно, многое зависело от сырья. Ведь люди лишь относительно недавно научились обогащать исходное сырье дополнительными веществами, придающими стали новые свойства. Например, римляне насмехались над кельтами, ведь у многих кельтских племен сталь была настолько плохой, что их мечи гнулись в сражении, и воины должны были отбежать в задний ряд, чтобы выпрямить клинок. Зато римляне преклонялись перед изделиями мастеров-оружейников из Индии. Да и у некоторых кельтских племен сталь не уступала знаменитой дамасской. (Статья «Дамасская сталь: мифы и реальность»)
Но, в любом случае, человечество вступило в железный век, и его уже нельзя было остановить. Даже широчайшее распространение пластмасс, произошедшее в ХХ веке, не смогло вытеснить металл из большинства сфер человеческой деятельности.
Медь и железо – в чем разница
Медь и железо – два древнейших известных металла. Оба использовались на протяжении всей истории для различных целей, от инструментов до украшений. Но как они сравниваются? В этой статье будут рассмотрены различия между медью и железом, включая их свойства, использование и преимущества.
Но как они сравниваются? В этой статье будут рассмотрены различия между медью и железом, включая их свойства, использование и преимущества.
Свойства меди по сравнению с железом
Медь — это мягкий металл, обладающий высокой ковкостью и пластичностью. Он обладает отличной электро- и теплопроводностью, что делает его идеальным материалом для проводки и электрических компонентов. Он также устойчив к коррозии в большинстве сред, что делает его идеальным для использования в сантехнике или элементах наружной отделки. Его красновато-оранжевый оттенок также придает ему эстетическую привлекательность.
Железо намного тверже меди и менее пластично. Он также имеет хорошую электропроводность, но лучше, чем теплопроводность меди: железо легко ржавеет при воздействии влаги, поэтому его необходимо покрывать или обрабатывать для предотвращения коррозии. Железо имеет серебристо-серый цвет, что придает ему гладкий вид при полировке или окраске.
Использование меди в сравнении с железом
Медь часто используется в электропроводке из-за ее высокой электропроводности и пластичности, что позволяет изгибать ее в различные формы без разрушения или растрескивания. Также он обладает отличной термостойкостью, поэтому его можно использовать в системах отопления и радиаторах без риска перегрева или расплавления материала. Его можно использовать в сантехнике из-за его коррозионной стойкости и в украшениях, таких как ювелирные изделия, из-за его привлекательной окраски.
Также он обладает отличной термостойкостью, поэтому его можно использовать в системах отопления и радиаторах без риска перегрева или расплавления материала. Его можно использовать в сантехнике из-за его коррозионной стойкости и в украшениях, таких как ювелирные изделия, из-за его привлекательной окраски.
Железо обычно используется в строительстве, потому что оно достаточно прочное, чтобы поддерживать большие конструкции, и в то же время недорогое по сравнению с другими материалами, такими как сталь или алюминий. Его прочность также делает его идеальным материалом для таких инструментов, как молотки или гаечные ключи, поскольку он не ломается легко под нагрузкой или напряжением, как это могут сделать более мягкие металлы, такие как медь. Кроме того, его способность удерживать край означает, что железные лезвия часто предпочтительнее лезвий из более мягких металлов, таких как бронза или латунь, для таких задач, как нарезка овощей или резьба по дереву.
Цена меди и железа
При выборе металла для строительства медь и железо являются двумя наиболее распространенными материалами. Хотя оба металла имеют множество применений, важным фактором, который следует учитывать, является стоимость. Медь, как правило, стоит дороже, чем железо, поэтому проекты, требующие больших порций металла, вероятно, будут дороже, если они будут выполнены с использованием меди. Тем не менее, некоторые предприятия по благоустройству дома и промышленные предприятия могут счесть более экономичным в долгосрочной перспективе использование меди вместо железа из-за ее превосходной долговечности и устойчивости к коррозии. Таким образом, стоимость должна быть тщательно сбалансирована с долгосрочными экономическими перспективами при выборе между этими двумя популярными металлами.
Хотя оба металла имеют множество применений, важным фактором, который следует учитывать, является стоимость. Медь, как правило, стоит дороже, чем железо, поэтому проекты, требующие больших порций металла, вероятно, будут дороже, если они будут выполнены с использованием меди. Тем не менее, некоторые предприятия по благоустройству дома и промышленные предприятия могут счесть более экономичным в долгосрочной перспективе использование меди вместо железа из-за ее превосходной долговечности и устойчивости к коррозии. Таким образом, стоимость должна быть тщательно сбалансирована с долгосрочными экономическими перспективами при выборе между этими двумя популярными металлами.
Проводимость меди и железа
Медь и железо — это два металла, которые, хотя и способны проводить электрический ток, сильно различаются по скорости и силе проводимости. Медь известна своей превосходной электропроводностью по сравнению с железом, что означает, что электрический ток проходит через нее с большей легкостью. По этой причине медь часто используется в производственных линиях, где требуется более высокая передача тока, например, в промышленных целях, таких как автомобильное производство и компьютерные схемы. Подтверждающие расчеты также показали, что медь имеет более стабильный отклик в диапазоне частот, чем железо. Тем не менее, доступность железа компенсирует его более низкую производительность в определенных ситуациях; Он гораздо более долговечен и устойчив к коррозии, чем медь, что делает его идеальным для электрической инфраструктуры, требующей более длительного срока службы, такой как электрические сети и силовые кабельные системы.
По этой причине медь часто используется в производственных линиях, где требуется более высокая передача тока, например, в промышленных целях, таких как автомобильное производство и компьютерные схемы. Подтверждающие расчеты также показали, что медь имеет более стабильный отклик в диапазоне частот, чем железо. Тем не менее, доступность железа компенсирует его более низкую производительность в определенных ситуациях; Он гораздо более долговечен и устойчив к коррозии, чем медь, что делает его идеальным для электрической инфраструктуры, требующей более длительного срока службы, такой как электрические сети и силовые кабельные системы.
Вес меди и железа
Медь и железо являются двумя наиболее распространенными и универсальными металлами, используемыми в различных отраслях промышленности. Хотя оба металла имеют широкий спектр применения, есть одно существенное отличие, которое отличает их друг от друга — вес. Медь значительно легче железа, и с ней легче работать. Это делает его идеальным для использования в изделиях, которые должны быть легкими, но при этом сохранять прочность, например, трубы или провода. С другой стороны, железо имеет гораздо больший вес, поэтому оно отлично подходит для обеспечения надежной поддержки или устойчивости, например, в мостах или крупных строительных проектах. Независимо от того, ищете ли вы что-то, чтобы быстро выполнить работу, или вам нужно что-то, что может выдержать большую нагрузку, вес меди по сравнению с железом, безусловно, играет важную роль в принятии вашего решения.
С другой стороны, железо имеет гораздо больший вес, поэтому оно отлично подходит для обеспечения надежной поддержки или устойчивости, например, в мостах или крупных строительных проектах. Независимо от того, ищете ли вы что-то, чтобы быстро выполнить работу, или вам нужно что-то, что может выдержать большую нагрузку, вес меди по сравнению с железом, безусловно, играет важную роль в принятии вашего решения.
Лучший проводник электричества
Одним из главных преимуществ меди перед железом является то, что она лучше проводит электричество. Это означает, что медь можно более эффективно использовать в электрических приложениях, таких как проводка и электрические компоненты. Кроме того, медь менее подвержена коррозии, чем железо, что делает ее более долговечной.
Более гибкий, чем железо
Еще одно преимущество меди перед железом заключается в том, что она более гибкая. Его можно использовать в приложениях, где важна гибкость, например, в сантехнике и трубопроводах.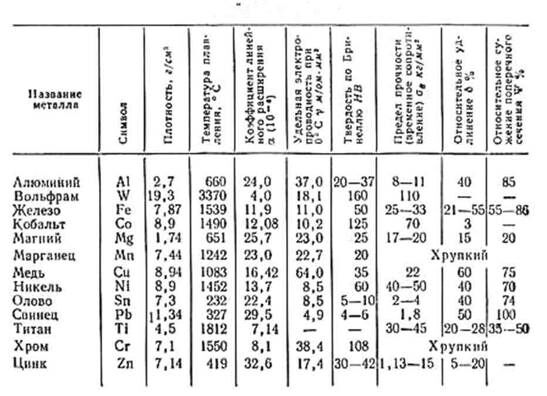 Кроме того, медь с меньшей вероятностью сломается или треснет, чем железо, что делает ее более долговечной.
Кроме того, медь с меньшей вероятностью сломается или треснет, чем железо, что делает ее более долговечной.
Более низкая температура плавления, чем у железа
Медь также имеет более низкую температуру плавления, чем железо, что означает, что ее можно использовать там, где желательна более низкая температура плавления. Например, из меди можно производить полупроводники и другие электронные устройства. Кроме того, более низкая температура плавления меди облегчает работу с ней, чем с железом.
Более устойчивы к коррозии, чем железо
Медь также более устойчива к коррозии, чем железо, что означает, что она не так легко ржавеет или подвергается коррозии. Это делает его идеальным материалом для применений, где важна коррозионная стойкость, например, в морской среде. Кроме того, коррозионная стойкость меди облегчает ее переработку по сравнению с железом.
Более высокая теплопроводность, чем у железа
Наконец, медь имеет более высокую теплопроводность, чем железо, что означает, что ее можно более эффективно использовать в приложениях, где важна теплопередача.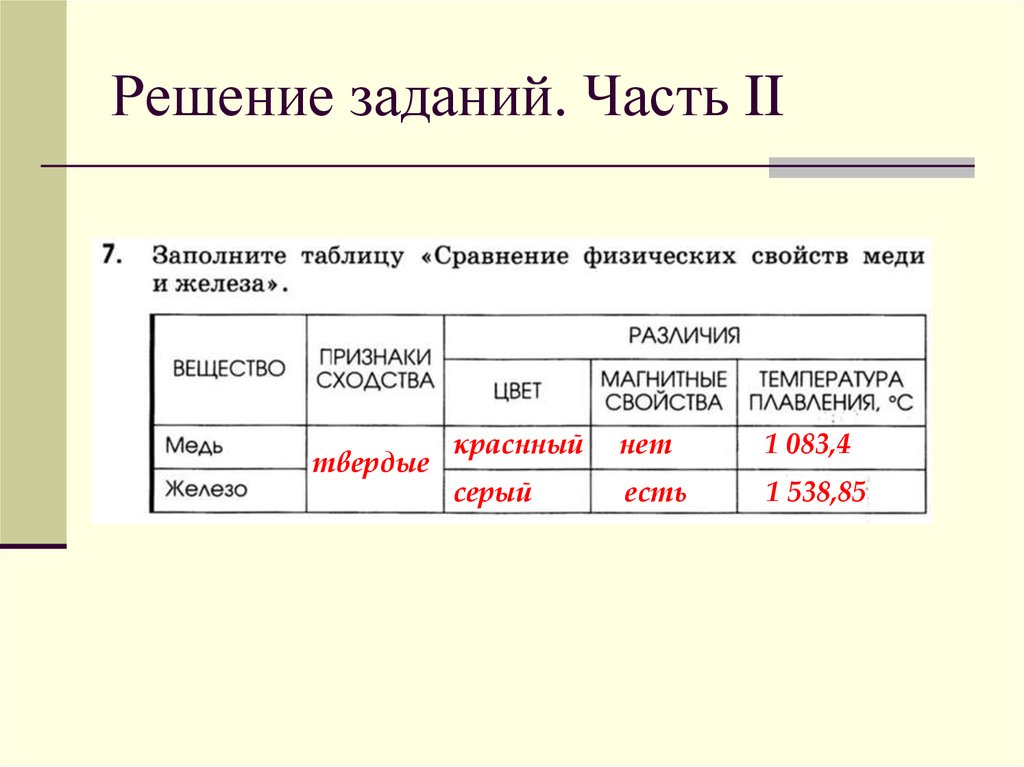 Например, медь можно использовать в теплообменниках и радиаторах.
Например, медь можно использовать в теплообменниках и радиаторах.
Заключение:
При рассмотрении вопроса о том, следует ли использовать для вашего проекта медь или железо, необходимо учитывать несколько факторов: стоимость, прочность, твердость, ковкость и т. д. В конечном итоге оба материала имеют свои сильные и слабые стороны; то, что работает лучше всего, будет зависеть от приложения, для которого вы их используете! Например, если вам нужно что-то, что может выдерживать высокие температуры, то медь будет лучшим выбором, тогда как железо лучше подойдет для поставленной задачи, если важнее прочность. У каждого металла есть свой уникальный набор плюсов и минусов; понимание этого поможет вам сделать правильный выбор при выборе между медью и железом!
Абхишек Модак
Абхишек — опытный блоггер и отраслевой эксперт, который делится своими взглядами и знаниями по различным темам. Своими исследованиями Абхишек предлагает ценные идеи и советы профессионалам и энтузиастам. Подпишитесь на него, чтобы получить экспертные советы о последних тенденциях и разработках в металлургической промышленности.
Подпишитесь на него, чтобы получить экспертные советы о последних тенденциях и разработках в металлургической промышленности.
Контактное уничтожение бактерий на меди подавляется, если контакт бактерий с металлом предотвращается и вызывается на железе ионами меди
1.
Мехтар С, Вид И, Тодоров С.Д.
2008.
Антимикробная активность меди и медных сплавов в отношении внутрибольничных возбудителей и микобактерий туберкулеза, выделенных из медицинских учреждений Западной Капской провинции: исследование исследование in-vitro . Дж. Хосп. Заразить.
68:45–51 [PubMed] [Google Scholar]
2.
Эльгинди Дж., Вагнер Дж., Ренсинг С.
2009.
Гены, участвующие в резистентности к меди, влияют на выживаемость Pseudomonas aeruginosa на медных поверхностях. Дж. Заявл. микробиол.
106:1448–1455 [бесплатная статья PMC] [PubMed] [Google Scholar]
3.
Фаундез Г., Тронкосо М., Наваррете П., Фигероа Г.
2004.
Антимикробная активность медных поверхностей в отношении взвесей Salmonella enterica и Campylobacter jejuni. БМС микробиол.
БМС микробиол.
4:19doi:10.1186/1471-2180-4-19 [бесплатная статья PMC] [PubMed] [Google Scholar]
4.
Noyce JO, Michels H, Keevil CW.
2006.
Потенциальное использование медных поверхностей для снижения выживаемости эпидемического метициллин-резистентного золотистого стафилококка в среде здравоохранения. Дж. Хосп. Заразить.
63:289–297 [PubMed] [Google Scholar]
5.
Noyce JO, Michels H, Keevil CW.
2006.
Использование медных сплавов для контроля перекрестного загрязнения Escherichia coli O157 во время обработки пищевых продуктов. заявл. Окружающая среда. микробиол.
72:4239–4244 [бесплатная статья PMC] [PubMed] [Google Scholar]
6.
Уивер Л., Михелс Х.Т., Кивил К.В.
2008.
Выживание Clostridium difficile на меди и стали: футуристические возможности для больничной гигиены. Дж. Хосп. Заразить.
68:145–151 [PubMed] [Google Scholar]
7.
Уилкс С.А., Михелс Х., Кивил К.В.
2005.
Выживание Escherichia coli O157 на различных металлических поверхностях. Междунар. Дж. Пищевая микробиология.
105:445–454 [PubMed] [Google Scholar]
8.
Уилкс С.А., Михелс Х.Т., Кивил К.В.
2006.
Выживание Listeria monocytogenes Scott A на металлических поверхностях: последствия перекрестного загрязнения. Междунар. Дж. Пищевая микробиология.
111:93–98 [PubMed] [Google Scholar]
9.
Анонимный
2010.
Ежегодный эпидемиологический отчет об инфекционных заболеваниях в Европе.
Европейский центр профилактики и контроля заболеваний, Стокгольм, Швеция:
http://ecdc.europa.eu/en/publications/Publications/1111_SUR_Annual_Epidemiological_Report_on_Communicable_Diseases_in_Europe.pdf [Google Scholar]
10.
Кейси А.Л., Адамс Д., Карпанен Т.Дж., Ламберт П.А., Куксон Б.Д., Найтингейл П., Мирущенко Л., Шиллам Р., Кристиан П., Эллиотт Т.С.
2010.
Роль меди в снижении загрязнения больничной среды. Дж. Хосп. Заразить.
74:72–77 [PubMed] [Google Scholar]
11.
Лайтинен К., Вотилайнен П., Сантала Л.
2010.
Клинические испытания с использованием медных и латунных поверхностей в больнице в Западной Финляндии с использованием микробиологической оценки. Внутренний отчет. http://www.scda.com/doc/uploaded/file/Result_report_Pori_veteran_home_clinical_trial.pdf
Внутренний отчет. http://www.scda.com/doc/uploaded/file/Result_report_Pori_veteran_home_clinical_trial.pdf
12.
Николай А., Хаггет С., Тикана Л., Грасс Г., Браун Дж., Нис Д.Х.
2010.
Выживание бактерий на металлических медных поверхностях в госпитальных испытаниях. заявл. микробиол. Биотехнолог.
87:1875–1879 [PubMed] [Google Scholar]
13.
Рай С., Хирш Б.Э., Аттауэй Х.Х., Надан Р., Фейри С., Харди Дж., Миллер Г., Армеллино Д., Моран В.Р., Шарп П., Эстель А., Мишель Д.Х., Михелс Х.Т., Шмидт М.Г.
2012.
Оценка антимикробных свойств медных поверхностей в амбулаторной инфекционной практике. Заразить. Хосп. Эпидемиол.
33:200–201 [PubMed] [Google Scholar]
14.
Шмидт М.Г., Аттауэй Х.Х., Шарп П.А., Джон Дж. Младший, Сепковиц К.А., Морган А., Фейри С.Э., Сингх С., Стид Л.Л., Канти Дж.Р., Фриман К.Д., Михелс Х.Т., Сальгадо К.Д.
2012.
Устойчивое снижение микробной нагрузки на обычные больничные поверхности за счет введения меди. Дж. Клин. микробиол.
50:2217–2223 [бесплатная статья PMC] [PubMed] [Google Scholar]
15.
О’Горман Дж., Хамфрис Х.
2012.
Применение меди для профилактики и борьбы с инфекцией. Где мы сейчас?
Дж. Хосп. Заразить.
81:217–223 [PubMed] [Google Scholar]
16.
Эспирито Санто К., Лам Э.В., Еловски К.Г., Куаранта Д., Домайль Д.В., Чанг СиДжей, Грасс Г.
2011.
Уничтожение бактерий сухими металлическими медными поверхностями. заявл. Окружающая среда. микробиол.
77:794–802 [бесплатная статья PMC] [PubMed] [Google Scholar]
17.
Эспирито Санто С, Куаранта Д, Грасс Г.
2012.
Антимикробные металлические медные поверхности убивают Staphylococcus haemolyticus через повреждение мембраны. микробиологияopen
1:46–52 [бесплатная статья PMC] [PubMed] [Google Scholar]
18.
Warnes SL, Caves V, Keevil CW.
2012.
Механизм поверхностной токсичности меди у Escherichia coli O157:H7 и Salmonella включает немедленную деполяризацию мембраны с последующей более медленной скоростью разрушения ДНК, что отличается от наблюдаемого для грамположительных бактерий. Окружающая среда. микробиол.
14:1730–1743 [PubMed] [Google Scholar]
19.
Warnes SL, Green SM, Michels HT, Keevil CW.
2010.
Биоцидная эффективность сплавов меди в отношении патогенных энтерококков связана с деградацией геномной и плазмидной ДНК. заявл. Окружающая среда. микробиол.
76:5390–5401 [бесплатная статья PMC] [PubMed] [Google Scholar]
20.
Уорнс С.Л., Кивил К.В.
2011.
Механизм поверхностной токсичности меди у устойчивых к ванкомицину энтерококков после контакта с влажной или сухой поверхностью. заявл. Окружающая среда. микробиол.
77:6049–6059 [бесплатная статья PMC] [PubMed] [Google Scholar]
21.
Уивер Л., Нойс Д.О., Михелс Х.Т., Кивил К.В.
2010.
Потенциальное действие медных поверхностей на устойчивый к метициллину золотистый стафилококк. Дж. Заявл. микробиол.
109:2200–2205 [PubMed] [Google Scholar]
22.
Эспириту Санто К., Таудте Н., Нис Д.Х., Грасс Г.
2008.
Вклад устойчивости к ионам меди в выживание кишечной палочки на металлических медных поверхностях. заявл. Окружающая среда. микробиол.
74:977–986 [бесплатная статья PMC] [PubMed] [Google Scholar]
23.
Молтени С., Абихт Х.К., Солиоз М.
2010.
Уничтожение бактерий медными поверхностями связано с растворением меди. заявл. Окружающая среда. микробиол.
76:4099–4101 [бесплатная статья PMC] [PubMed] [Google Scholar]
24.
Лазаньи А.Ф., Менендес-Ормаса Б.С.
2010.
Двух- и трехмерные микро- и субмикронные периодические структуры с использованием двухлучевой лазерной интерференционной литографии. Доп. англ. Матер.
12:54–60 [Google Академия]
25.
Терзаги Б.Е., Сандин В.Е.
1975 год.
Улучшенная среда для молочнокислых стрептококков и их бактериофагов. заявл. микробиол.
29:807–813 [бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Мюклих Ф., Лазаньи А., Даниэль С.
2006.
Лазерная интерференционная металлургия — использование интерференции в качестве инструмента для микро/наноструктурирования. Междунар. Дж. Матер. Рез.
97:1337–1344 [Google Scholar]
27.
Гутьеррес Х., Портман Т., Першин В., Рингетт М.
2012.
Оценка биоцидной эффективности покрытий из медных сплавов по сравнению с твердыми металлическими поверхностями: образование наноцветов органического фосфата меди. Дж. Заявл. микробиол. [PubMed] [Академия Google]
Дж. Заявл. микробиол. [PubMed] [Академия Google]
28.
Хонг Р., Кан Т.И., Михелс К.А., Гадура Н.
2012.
Мембранное перекисное окисление липидов при контактном умерщвлении Escherichia coli, опосредованном медным сплавом. заявл. Окружающая среда. микробиол.
78:1776–1784 [бесплатная статья PMC] [PubMed] [Google Scholar]
29.
Quaranta D, Krans T, Espírito Santo C, Elowsky CG, Domaille DW, Chang CJ, Grass G.
2011.
Механизмы контактного уничтожения дрожжей на сухих металлических медных поверхностях. заявл. Окружающая среда. микробиол.
77:416–426 [Бесплатная статья PMC] [PubMed] [Google Scholar]
30.
Tian WX, Yu S, Ibrahim M, Almonaofy AW, He L, Hui Q, Bo Z, Li B, Xie GL.
2012.
Медь как антимикробный агент против условно-патогенных и полирезистентных энтеробактерий. Дж. Микробиол.
50:586–593 [PubMed] [Google Scholar]
31.
Эльгинди Дж., Моффит С., Хасман Х., Андраде С., Рагхаван С., Ренсинг С.
2011.
Скорость коррозии металлической меди, содержание влаги и питательная среда влияют на выживание устойчивых к ионам меди бактерий. заявл. микробиол. Биотехнолог.
заявл. микробиол. Биотехнолог.
89:1963–1970 [бесплатная статья PMC] [PubMed] [Google Scholar]
32.
Грасс Г., Ренсинг С., Солиоз М.
2011.
Металлическая медь как антимикробная поверхность. заявл. Окружающая среда. микробиол.
77:1541–1547 [бесплатная статья PMC] [PubMed] [Google Scholar]
33.
Бауредер М., Райманн Р., Хедерштедт Л.
2012.
Вклад каталазы в устойчивость Enterococcus faecalis к перекиси водорода. ФЭМС микробиол. лат.
331:160–164 [PubMed] [Google Scholar]
34.
ван де Гухте М., Серрор П., Шерво С., Смоквина Т., Эрлих С.Д., Магуин Э.
2002.
Стрессовые реакции молочнокислых бактерий. Антони Ван Левенгук
82:187–216 [PubMed] [Google Scholar]
35.
Нандакумар Р., Эспирито Санто С., Мадаипутия Н., Грасс Г.
2011.
Количественное протеомное профилирование реакции кишечной палочки на поверхности металлической меди. Биометаллы
24:429–444 [PubMed] [Google Scholar]
36.
Макомбер Л., Имлей Дж.А.
2009.
Железо-серные кластеры дегидратаз являются первичными внутриклеточными мишенями токсичности меди. проц. Натл. акад. науч. США.
проц. Натл. акад. науч. США.
106:8344–8349 [бесплатная статья PMC] [PubMed] [Google Scholar]
37.
Пак ХДж, Нгуен ТТ, Юн Дж, Ли С.
2012.
Роль активных форм кислорода в инактивации кишечной палочки ионом меди. Окружающая среда. науч. Технол.
46:11299–11304 [PubMed] [Google Scholar]
38.
Сюй Ф.Ф., Имлай Дж.А.
2012.
Серебро (I), ртуть (II), кадмий (II) и цинк (II) нацелены на открытые ферментативные железо-серные кластеры, когда они отравляют Escherichia coli. заявл. Окружающая среда. микробиол.
78:3614–3621 [бесплатная статья PMC] [PubMed] [Google Scholar]
39.
Каваками Х., Ёсида К., Нисида Ю., Кикути Ю., Сато Ю.
2008.
Антибактериальные свойства металлических элементов для легирования оценивали с применением JIS Z 2801:2000. ISIJ Междунар.
48:1299–1304 [Google Scholar]
40.
Диас-Висуррага Х., Гутьеррес К., фон Плессинг К., Гарсия А.
2012.
Металлические наноструктуры как антибактериальные агенты, стр. 210–218
В
Мендес-Вилас А. (редактор), Наука против микробных патогенов: сообщение о текущих исследованиях и технологических достижениях.
