Сравнить серу и медь по физическим свойствам: Сравните физические свойства меди и серы
Содержание
Предмет химии. Вещества — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
Часть 1
1. Химия изучает:
— вещества
— их строения
— их свойства
2. Вещество это —
то, из чего состоят физические тела.
3. Признаки, по которым одни вещества отличаются от других,
— это свойства, например: агрегатное состояние, цвет, запах, плотность и т.д.
4. Существует взаимосвязь: свойство вещества — применение вещества.
Например, для стекла:
1) Прозрачное — оконные стекла
2) изготовление хрусталя
3) витражное стекло
5. Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определенный вид атомов называют химическим элементом. Всего известно 120 химический элементов.
6. Химический элемент существует в трех формах.
Химический элемент существует в трех формах.
Часть 2
1. Установите соответсвие между понятием и примером.
2. Вычеркните лишнее:
колба, приборка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Химическая посуда из стекла
3. Составьте задание, аналогичное предыдущему.
Вычеркните лишнее — приборка, мерная колба, цилиндр, штатив.
4. Заполните таблицу «Физические свойства вещества». В качестве примеров опишите вещества, используемые на кухне.
5. Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая
2) пластичная
3) бесцветная
4) прозрачная
5) ароматная
6) электропроводная
Ответ: 1, 3, 4
6. Заполните таблицу «Сравнение физических свойств газообразных веществ».
Заполните таблицу «Сравнение физических свойств газообразных веществ».
7. Заполните таблицу «Сравнение физических свойств меди и железа».
8. Составьте кроссворд о свойствах и применении какого-либо вещества (по своему выбору).
9. На примере химического элемента водорода укажите правильную последовательность (1-2-3) перечисленных понятий от единичного к общему. Конкретизируте ее, используя слова и рисунки моделей частиц.
3) Вещество — это то, из чего состоят физические тела.
1) Атом — это химически неделимая частица.
2) Молекула — это наименьшая частица вещества.
10. Выражения, являющиеся синонимами понятия «химический элемент».
1) вид одинаковых атомов
2) вид одинаковых молекул
3) вид атомов, имеющих одинаковые свойства
4) простые вещества
5) названия видов атомов
Ответ: 1, 3
11. Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
12. Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено две молекулы сложных веществ, образованных из двух химических элементов.
13. Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: хлор.
В тех фразах, которые вы не выбрали, речь идет о сере как о простом вещества.
Халькогены – строение, общая характеристика в таблице
4.3
Средняя оценка: 4.3
Всего получено оценок: 749.
4.3
Средняя оценка: 4.3
Всего получено оценок: 749.
Элементы VI группы главной подгруппы называются халькогенами. К ним относятся кислород, сера, селен, теллур и полоний. Слово «халькоген» состоит из двух греческих слов, означающих «медь» или «руда» и «рождённый».
К ним относятся кислород, сера, селен, теллур и полоний. Слово «халькоген» состоит из двух греческих слов, означающих «медь» или «руда» и «рождённый».
Описание
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам относятся неметаллы и металлы. В группе сверху вниз свойства меняются следующим образом:
- металлические свойства усиливаются;
- свойства окислителя ослабевают;
- электроотрицательность уменьшается;
- термическая устойчивость ослабевает.
Общая характеристика группы халькогенов:
Рис. 1. Халькогены.
По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения р-орбитали не хватает двух электронов, поэтому в соединениях халькогены проявляют свойства окислителя. С увеличением в группе количества энергетических уровней связь с внешними электронами ослабевает, поэтому теллур и полоний являются восстановителями.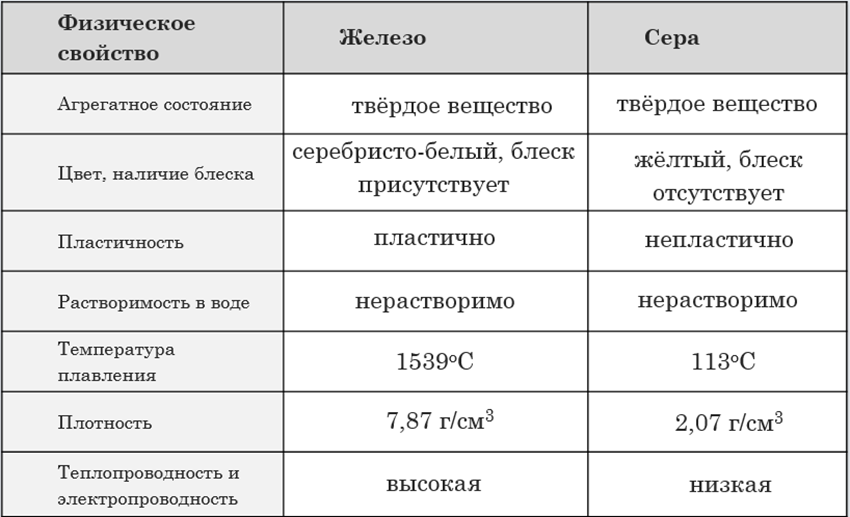
Находясь на границе металлов и неметаллов, теллур относится к металлоидам или полуметаллам. Является аналогом серы и селена, но менее активен.
Рис. 2. Теллур.
Свойства
Наиболее активным элементом группы халькогенов является кислород. Это мощный окислитель, который проявляет четыре степени окисления – -2, -1, +1, +2.
Основные свойства халькогенов представлены в таблице.
Элемент | Физические свойства | Химические свойства |
Кислород (О) | Газ. Образует две модификации – О2 и О3 (озон). О2 не имеет запаха и вкуса, плохо растворим в воде. Озон – голубоватый газ с запахом, хорошо растворимый в воде | Реагирует с металлами, неметаллами |
Сера (S) | Типичный неметалл. Твёрдое вещество с температурой плавления 115°С. Нерастворима в воде. | Реагирует с кислородом, галогенами, неметаллами, металлами |
Селен (Se) | Хрупкое твёрдое вещество. Полупроводник. Имеет три модификации – серый, красный, чёрный селен. Степень окисления – -2, +2, +4, +6 | Реагирует со щелочными металлами, кислородом, водой |
Теллур (Te) | Внешне похож на металл. Полупроводник. Степень окисления – -2, +2, +4, +6 | Реагирует с кислородом, щелочами, кислотами, водой, металлами, неметаллами, галогенами |
Полоний (Po) | Радиоактивный металл серебристого цвета. Степень окисления – +2, +4, +6 | Реагирует с кислородом, галогенами, кислотами |
К халькогенам также причисляют искусственно созданный ливерморий (Lv) или унунгексий (Uuh). Это 116 элемент периодической таблицы. Проявляет сильные металлические свойства.
Это 116 элемент периодической таблицы. Проявляет сильные металлические свойства.
Рис. 3. Ливерморий.
Что мы узнали?
Халькогены – элементы шестой группы периодической таблицы Менделеева. В группе находятся три неметалла (кислород, сера, селен), металл (полоний) и полуметалл (теллур). Поэтому халькогены являются как окислителями, так и восстановителями. Металлические свойства усиливаются в группе сверху вниз: кислород – газ, полоний – твёрдый металл. К халькогенам также относится искусственно синтезированный ливерморий с сильными металлическими свойствами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
София Белова
4/5
Ники Коноваленкова
5/5
Сергей Ефремов
1/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 749.
А какая ваша оценка?
Сульфид меди II Факты, формула, свойства, применение
- Идентификация сульфида меди II
- Состав и синтез
- Свойства и характеристики сульфида меди 2
- Выдающиеся реакции CuS
- Чашка ric Sulfide Uses
- Опасно ли это
Медь ii сульфид или сульфид меди, представленный химической формулой CuS, который носит название IUPAC sulfanylidenecopper [1] представляет собой черный порошок или комки, растворимые в азотной кислоте, но нерастворимые в воде [3] . Встречается в виде минерального ковеллита и представляет собой ионное соединение [3, 4] . Он стабилен на воздухе, когда он сухой, но окисляется до сульфата меди влагой воздуха [1] .
Встречается в виде минерального ковеллита и представляет собой ионное соединение [3, 4] . Он стабилен на воздухе, когда он сухой, но окисляется до сульфата меди влагой воздуха [1] .
Сульфид меди II
Идентификация сульфида меди II | |
| Номер CAS | 1317-40-4 [1] |
| Идентификационный номер PubChem | 14831 [1] |
| Идентификатор ChemSpider | 145403 [2] |
| Номер ЕС | 215-271-2 [1] |
Состав и синтез
Сульфид меди ii может быть получен реакцией между расплавленной серой и медью с последующим кипячением в гидроксиде натрия [1] .
Cu + S = CuS
Сульфид меди II Формула
Свойства и характеристики сульфида меди 2
Общие свойства | ||
| Молярная масса/молекулярная масса | 95,606 г/моль [1] | |
Физические свойства | ||
| Цвет/внешний вид | Черный порох [3] | |
| Точка плавления/замерзания | 220°C, 428°F (разлагается) [3] | |
| Температура кипения | Н/Д [3] | |
| Плотность | 4,6 г мл -1 при 25°C [3] | |
| Состояние вещества при комнатной температуре (нормальная фаза) | Твердый [3] | |
| Показатель преломления | 1,45 [1] | |
Химические свойства | ||
| Растворимость в воде | Н/Д [1] | |
Атомные свойства | ||
| Кристаллическая структура | Шестигранник [1] | |
Структура сульфида меди II
Выраженные реакции CuS
Сульфид меди II реагирует с кислородом при температуре 300-500°C с образованием оксида меди и диоксида серы [7] .
2CuS + 3O 2 = 2CuO + 2SO 2
Сульфид меди Использование
- При приготовлении смешанных катализаторов [3] .
- При разработке анилинового черного красителя для текстильной печати [3] .
- В необрастающих красках [3] .
- В фотооптике и в качестве полупроводника [6] .
Опасно ли это
Сульфид меди токсичен при проглатывании. Следует избегать контакта с глазами и кожей, а также вдыхания, так как это может вызвать раздражение. Оказывает длительное вредное воздействие на водную жизнь [1, 3, 5] . В условиях пожара он разлагается с образованием опасных оксидов меди и оксидов серы [8] .
- Каталожные номера
- Сульфид меди (II) – Pubchem.ncbi.nlm.nih.gov
- Сульфид меди (II) — Chemspider.com
- Сульфид меди (II) — Chemicalbook.com
- Примеры ионной связи – Examples.
 yourdictionary.com
yourdictionary.com - Сульфид меди CuS – Espimetals.com
- Сульфид меди – Americanelements.com
- Реакция сульфида меди с кислородом – Chemiday.com
- Паспорт безопасности материала – Nwmissouri.edu
Бис(селеносемикарбазоновые) комплексы меди, направленные против гипоксии: сравнение с их аналогами серы
Сравнительное исследование
. 20 августа 2003 г .; 125 (33): 10040-9.
doi: 10.1021/ja035737d.
Замок Томаса Си
1
, Ричард И. Маурер, Фрэнк Э. Соури, Майкл Дж. Вент, Кристофер А. Рейнольдс, Эрик Дж. Л. Макиннес, Филип Дж. Блоуэр
принадлежность
- 1 Школа физических наук Кентского университета, Кентербери CT2 7NR, Соединенное Королевство.
PMID:
12914467
DOI:
10.
 1021/ja035737d
1021/ja035737d
Сравнительное исследование
Томас К. Кастл и др.
J Am Chem Soc.
.
. 20 августа 2003 г .; 125 (33): 10040-9.
doi: 10.1021/ja035737d.
Авторы
Замок Томаса Си
1
, Ричард И. Маурер, Фрэнк Э. Соури, Майкл Дж. Вент, Кристофер А. Рейнольдс, Эрик Дж. Л. Макиннес, Филип Дж. Блоуэр
принадлежность
- 1 Школа физических наук Кентского университета, Кентербери CT2 7NR, Соединенное Королевство.
PMID:
12914467
DOI:
10.
 1021/ja035737d
1021/ja035737d
Абстрактный
Были синтезированы первые комплексы бис(селеносемикарбазона) меди с использованием лигандов бис(селеносемикарбазона глиоксаля), бис(селеносемикарбазона) пирувальдегида и бис(селеносемикарбазона) 2,3-бутандиона. Их спектроскопические свойства указывают на то, что они структурно аналогичны своим хорошо известным квадратно-плоским серосодержащим аналогам, комплексам бис(тиосемикарбазона) меди. Спектроскопическое сравнение серо- и селенсодержащих комплексов позволяет понять их электронную структуру. Влияние на спектроскопические и окислительно-восстановительные свойства замены серы селеном и последовательного добавления метильных групп к основной цепи лиганда рационализируется с точки зрения их электронной структуры с использованием расчетов функционала плотности без ограничений по спину. Это предполагает, что, как и аналоги серы, комплексы имеют очень низко расположенную пустую пи-орбиталь на основе лиганда непосредственно над НСМО, в то время как сама НСМО имеет характер d(x2)-(y2) (т.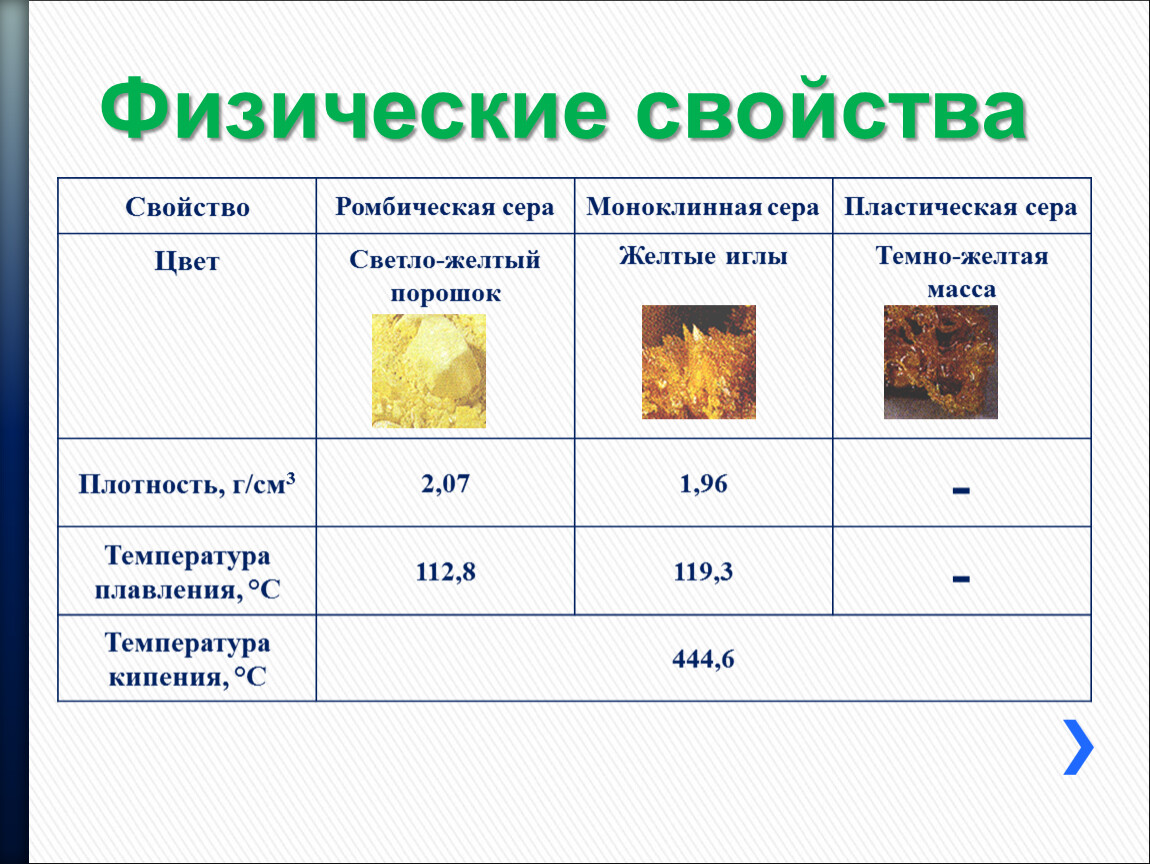 е. является партнером по спину). ГОМО). Замена S на Se сдвигает потенциалы окисления намного больше, чем потенциалы восстановления, тогда как алкилирование основной цепи лиганда сдвигает потенциалы восстановления больше, чем потенциалы окисления. Это предполагает, что окисление и восстановление включают пространственно разные орбитали, при этом дополнительный электрон в восстановленных частицах занимает основанную на лиганде пи-орбиталь, а не d(x2)-(y2). Расчеты функционала плотности для предполагаемых синглетных Cu(I)-восстановленных частиц предполагают, что этот пи-характер лиганда может быть вызван искажением от плоскостности во время восстановления, что позволяет низколежащему лиганду pi-LUMO смешиваться с d(x2) ВЗМО на основе -(y2). Аналогия в структуре и характере восстановления между серо- и селенсодержащими комплексами позволяет предположить, что комплексы, меченные позитрон-излучающими изотопами меди (Cu-60, Cu-62, Cu-64), требуют биологической оценки в качестве радиофармпрепаратов для визуализации тканевой перфузии и гипоксии.
е. является партнером по спину). ГОМО). Замена S на Se сдвигает потенциалы окисления намного больше, чем потенциалы восстановления, тогда как алкилирование основной цепи лиганда сдвигает потенциалы восстановления больше, чем потенциалы окисления. Это предполагает, что окисление и восстановление включают пространственно разные орбитали, при этом дополнительный электрон в восстановленных частицах занимает основанную на лиганде пи-орбиталь, а не d(x2)-(y2). Расчеты функционала плотности для предполагаемых синглетных Cu(I)-восстановленных частиц предполагают, что этот пи-характер лиганда может быть вызван искажением от плоскостности во время восстановления, что позволяет низколежащему лиганду pi-LUMO смешиваться с d(x2) ВЗМО на основе -(y2). Аналогия в структуре и характере восстановления между серо- и селенсодержащими комплексами позволяет предположить, что комплексы, меченные позитрон-излучающими изотопами меди (Cu-60, Cu-62, Cu-64), требуют биологической оценки в качестве радиофармпрепаратов для визуализации тканевой перфузии и гипоксии.
Похожие статьи
Трехъядерные комплексы меди с трипсаленовыми лигандами: геометрические и электронные эффекты на ферромагнитную связь через механизм спиновой поляризации.
Глейзер Т., Хайдемайер М., Страутманн Дж. Б., Бёгге Х., Штаммлер А., Крикемейер Э., Хюнербайн Р., Гримме С., Боте Э., Билл Э.
Глейзер Т. и др.
Химия. 2007;13(33):9191-206. doi: 10.1002/chem.200700781.
Химия. 2007.PMID: 17937379
Катионные бисциклометаллированные фенантролиновые комплексы иридия(III) с боковыми флуоренильными заместителями: синтез, окислительно-восстановительный потенциал, фотофизические свойства и светоизлучающие клетки.
Цзэн X, Тавасли М., Перепичка И.Ф., Бацанов А.С., Брайс М.Р., Чан С.Дж., Роте С., Монкман А.П.
Цзэн X и др.

Химия. 2008;14(3):933-43. doi: 10.1002/chem.200700308.
Химия. 2008.PMID: 18033698
О (2)-реактивность комплекса меди (I) с тиоэфирным лигандом N (3) S: аддукт меди и кислорода, включая лигирование серы, оксигенацию лиганда и сравнения со всеми аналогами азотного лиганда.
Lee DH, Hatcher LQ, Vance MA, Sarangi R, Milligan AE, Sarjeant AA, Incarvito CD, Rheingold AL, Hodgson KO, Hedman B, Solomon EI, Karlin KD.
Ли Д.Х. и др.
Неорг хим. 2007 г., 23 июля; 46 (15): 6056-68. doi: 10.1021/ic700541k. Epub 2007 20 июня.
Неорг хим. 2007.PMID: 17580938
Почему природа выбрала селен.
Райх HJ, Hondal RJ.
Райх Х.Дж. и др.
ACS Chem Biol. 2016 15 апреля; 11 (4): 821-41. doi: 10.1021/acschembio.6b00031. Epub 2016 21 марта.
ACS Chem Biol.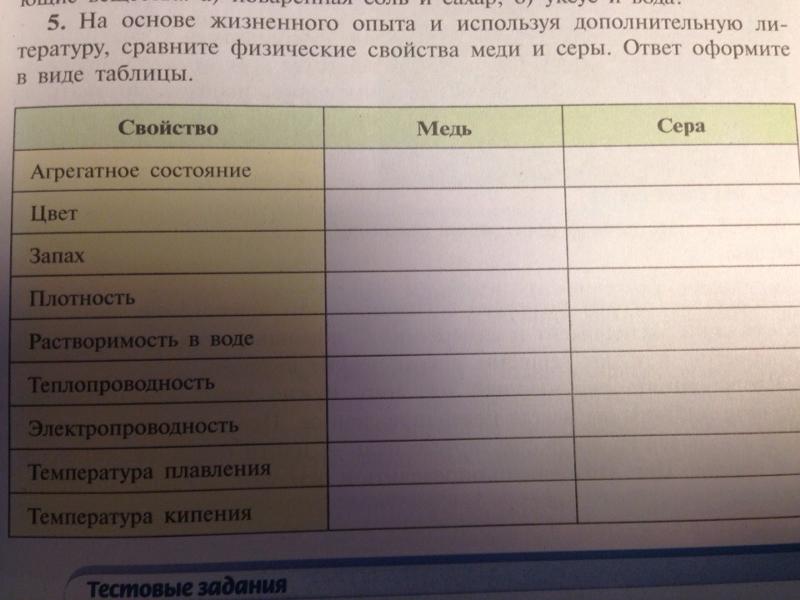 2016.
2016.PMID: 26949981
Обзор.
К новым гипоксическим селективным агентам на основе переходных металлов для терапии и визуализации.
Блоуэр П.Дж., Дилворт Дж.Р., Маурер Р.И., Маллен Г.Д., Рейнольдс К.А., Чжэн Ю.
Блоуэр П.Дж. и др.
Дж. Инорг Биохим. 2001 г., май; 85 (1): 15–22. doi: 10.1016/s0162-0134(00)00228-2.
Дж. Инорг Биохим. 2001.PMID: 11377691
Обзор.
Посмотреть все похожие статьи
Цитируется
Неинвазивная радионуклидная визуализация следов торговли металлами в норме и при болезнях: «ПЭТ-металломика».
Ферт Г., Блоуэр Дж. Э., Бартницка Дж. Дж., Мишра А., Майклз А. М., Ригби А., Дарвеш А., Аль-Салими Ф., Блоуэр П. Дж.
Ферт Г. и др.
РСК хим. биол. 2022 11 апреля; 3 (5): 495-518. дои: 10.1039/d2cb00033d. Электронная коллекция 2022 11 мая.
дои: 10.1039/d2cb00033d. Электронная коллекция 2022 11 мая.
РСК хим. биол. 2022.PMID: 35656481
Бесплатная статья ЧВК.Обзор.
Стимулированные микросредой биочувствительные низкомолекулярные носители для радиофармпрепаратов.
Чатурведи С., Хазари П.П., Каул А., Анджу, Мишра А.К.
Чатурведи С. и др.
АСУ Омега. 2020 5 октября; 5 (41): 26297-26306. doi: 10.1021/acsomega.0c03601. Электронная коллекция 2020 20 октября.
АСУ Омега. 2020.PMID: 33110957
Бесплатная статья ЧВК.Обзор.
Возможности и проблемы для химии металлов в молекулярной визуализации: от визуализации с помощью гамма-камеры до ПЭТ и мультимодальной визуализации.
Southworth R, Torres Martin de Rosales R, Meszaros LK, Ma MT, Mullen GED, Fruhwirth G, Young JD, Imberti C, Bagunya-Torres J, Andreozzi E, Blower PJ.

Саутворт Р. и др.
Adv Inorg Chem. 2016;68:1-41. doi: 10.1016/bs.adioch.2015.09.001. Epub 2015 16 ноября.
Adv Inorg Chem. 2016.PMID: 30381783
Бесплатная статья ЧВК.(Халькоген)семикарбазоны и их комплексы кобальта дифференцируют клетки миелоидного лейкоза HL-60 и являются цитотоксическими по отношению к опухолевым клеточным линиям.
Тодорович Т.Р., Вукашинович Дж., Порталоне Г., Сулейман С., Глигориевич Н., Белогрлич С., Йованович К., Радулович С., Анджелкович К., Кассар А., Филипович Н.Р., Шембри-Висмайер П.
Тодорович Т.Р. и соавт.
Медхимком. 2016 20 октября; 8 (1): 103-111. дои: 10.1039/c6md00501b. Электронная коллекция 2017 1 января.
Медхимком. 2016.PMID: 30108695
Бесплатная статья ЧВК.Кислородное зондирование, отслеживание гипоксии и in Vivo Визуализация с использованием функциональных металлозондов для раннего выявления неинфекционных заболеваний.


 Встречается три модификации – ромбическая, моноклинная, пластическая. Степень окисления – -2, -1, 0, +1, +2, +4, +6
Встречается три модификации – ромбическая, моноклинная, пластическая. Степень окисления – -2, -1, 0, +1, +2, +4, +6