Свойства меди химия: Физико-химические свойства меди обеспечивают ей широкое применение во всех отраслях промышленности.
Содержание
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Цельработы
Ознакомление с основными соединениями меди; изучение свойств и способов получения меди и ее соединений.
Краткиетеоретическиесведения
Медь имеет порядковый номер 29 в периодической системе элементов. Электронная конфигурация валентного уровня 3d104s1 обуславливает пере-
менную валентность I и II. Стандартный электродный потенциал Å0Cu / Cu2+ = 0,34
Вопределяет ее окислительно-восстановительные свойства.
Вприроде медь находится в самородном состоянии, но основное со-
держание меди сосредоточено в виде минералов (халькозина, Сu2S, ковелина, CuS, куприта, Cu2O, и других) в составе полиметаллических руд. Количество меди в земной коре оценивают в пределах 0,01 вес.%.
Промышленная переработка руд с целью извлечения металлической меди включает несколько процессов – это измельчение руды, обогащение (гравитационные и флотационные методы), переработка концентрата. Концентраты перерабатывают пироили гидрометаллургическими методами в зависимости от характера руды и содержания в ней меди, например:
Cu2S + O2 = 2Cu + SO2
CuS + 2O2 = CuSO4 | CuSO4 + SO2 + 2h3O = Cu + 2h3SO4 |
Для получения чистого металла сырую медь очищают методом аффинажа (процесс получения чистого металла из сырого путем удаления примесей). В последней стадии при рафинировании меди используют либо пирометаллургический процесс
В последней стадии при рафинировании меди используют либо пирометаллургический процесс
2Cu2O + Cu2S = 6Cu + SO2
либо электролитическое рафинирование меди
CuSO4 ‘ Cu2+ + SO 24− h3O ‘ H+ + OH– катод (–) Сu2+ + 2ē → Cu↓
анод (+) 4OH– – 4ē → O2↑ + 2h3O
Химия. Лаб. практикум | -191- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Краткие теоретические сведения
В лаборатории медь получают аналогично промышленному процессу электролитического рафинирования, приведенному выше, или восстановлением меди из раствора медного купороса порошком железа:
CuSO4 + Fe → FeSO4 + Cu
Чистая медь – металл красноватого цвета. Она обладает хорошими тепло- и электропроводящими свойствами.
В химическом отношении медь – малоактивный металл. Однако с галогенами она реагирует уже при комнатной температуре, например:
Cu + Br2 = CuBr2
С кислородом медь взаимодействует в присутствии воды:
2Cu + O2 + 2h3O = 2Cu(OH)2
Концентрированная соляная кислота и разбавленная серная кислота на медь не действуют. Эти кислоты не взаимодействуют с металлами, которые стоят в ряду напряжений после водорода, поскольку их окислительные свойства соответствуют потенциалу Ен/н+.
Эти кислоты не взаимодействуют с металлами, которые стоят в ряду напряжений после водорода, поскольку их окислительные свойства соответствуют потенциалу Ен/н+.
Концентрированная h3SO4 при нагревании взаимодействует с медью вследствие окисляющих свойств атома серы (степень окисления +6) вкислоте:
Cu + 2h3SO4(конц) = CuSO4 + SO2 + 2h3O
В азотной кислоте (энергичный окислитель) медь легко окисляется с получением солей меди и азотсодержащих газообразных продуктов. Чем ниже концентрация кислоты, тем выше степень восстановления азота в газообразных продуктах:
2Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4h3O Cu + 4HNO3(конц) = Сu(NO3)2 + 2NO2 + 2h3O
Медь растворяется в водном растворе аммиака только в присутствии кислорода. Этот сложный процесс приводит к комплексному соединению:
Cu + 4Nh5OH + 1/2O2 = [Cu(Nh4)4](OH)2 + 3h3O
Гидроксид тетраамминмеди (II)
Оксид меди (I) в лаборатории получают обработкой растворов солей меди (II) растворами щелочей в присутствии глюкозы. В ходе этой реакции глюкоза выступает в роли восстановителя – альдегидная группа глюкозы окисляется до карбоксильной группы глюконовой кислоты:
В ходе этой реакции глюкоза выступает в роли восстановителя – альдегидная группа глюкозы окисляется до карбоксильной группы глюконовой кислоты:
Химия. Лаб. практикум | -192- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Краткие теоретические сведения
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
2Cu(OH)2 + C6h22O6 = Cu2O + C6h22O7 + 2h3O
Глюкоза Глюконовая кислота
Закись меди в присутствии кислорода при 1025 °С превращается в окись меди:
2Сu2O + O2 → 4CuO
Гидроксид меди (I) получают обработкой солей меди (I) щелочью при комнатной температуре:
CuCl + KOH = CuOH + KCl
При кипячении CuOH теряет воду и переходит вкрасный оксид меди(I):
2СuOH → Cu2O + h3O
Оксид меди (II) CuO получают нагреванием металлической меди выше 80 °С или нагреванием (50 °С) водной суспензии Cu(OH)2, а также прокаливанием нитрата меди (II):
Cu + 1/2O2 = CuO
Cu(OH)2 = CuO + h3O
Cu(NO3)2 = CuO + 2NO2 + 1/2O2
В отличие от металлической меди, оксид меди (II) взаимодействует с HCl и разбавленной h3SO4 с образованием соответствующих солей меди (II):
CuO + 2HCl = CuCl2 + h3O СuO + h3SO4 = CuSO4 + h3O
Гидроксид меди (II) образуется в виде аморфного осадка синего цвета при обработке растворов солей меди (II) растворами щелочей при обычной температуре:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
При нагревании гидроксид меди (II) отщепляют молекулу воды, превращаясь в оксид меди (II):
Cu(OH)2 = CuO + h3O
Трудно растворимое в воде соединение Cu(OH)2 растворяется в кислотах с образованием простых солей, а в растворах щелочей – комплексных соединений:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2h3O
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4]
Тетрагидроксокупрат(II) натрия
Химия. | -193- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Краткие теоретические сведения
Действие на раствор медного купороса щелочью приводит к гидроксиду меди. Добавление к гидроксиду меди (II) глицерина образует комплексное соединение глицерат меди ярко-синего цвета:
|
|
| Ch3 |
| OH | O |
| h3C |
|
|
|
|
| ||||
Ch3 |
| OH | | |
|
| Cu | | | | |
|
|
| ||||||
2CH |
| OH +Cu(OH)2 → CH |
| O | HO |
| HC +2h3O | |
|
|
| ||||||
Ch3 |
| OH | | |
|
| | | | | |
|
|
| ||||||
|
|
| Ch3 |
| OH | HO |
| h3C |
|
|
|
|
| ||||
В промышленности на основе меди получают многочисленные сплавы, в частности различные латуни и бронзы. В химической промышленности медь служит катализатором процесса разложения метана и других предельных углеводородов. Соединения меди входят в состав зеленого пигмента в производстве керамики и стекла. В сельском хозяйстве некоторые соединения меди применяются как фунгициды (против почвенных бактерий).
В химической промышленности медь служит катализатором процесса разложения метана и других предельных углеводородов. Соединения меди входят в состав зеленого пигмента в производстве керамики и стекла. В сельском хозяйстве некоторые соединения меди применяются как фунгициды (против почвенных бактерий).
Вопросы для подготовки к лабораторной работе
1.Укажите положение меди в периодической системе элементов и напишите ее электронную формулу. Почему медь может проявлять различные степени окисления?
2.Охарактеризуйте свойства меди, указав отношение металлической меди к воздуху, воде и кислотам.
3.Приведите примеры оксидов и гидроксидов меди, укажите их
свойства.
4.Пользуясь таблицей стандартных электродных потенциалов, установите, можно ли Fe2+-ионами восстановить Cu2+-ион до свободного металла.
5.Как определить наличие ионов Cu2+ в растворе? Приведите примеры реакций.
Экспериментальнаячасть
Опыт 1
Получениемедиэлектролизомсульфатамеди(II)
Налейте в электролизер 0,2 н. раствор CuSO4. Опустите графитовые электроды и присоедините к источнику постоянного тока. Через 2-3 мин наблюдайте на одном из электродов появление красного налета меди, а на другом – выделение кислорода.
раствор CuSO4. Опустите графитовые электроды и присоедините к источнику постоянного тока. Через 2-3 мин наблюдайте на одном из электродов появление красного налета меди, а на другом – выделение кислорода.
Опыт 2 Взаимодействиемедискислотами
Опыт выполняется в вытяжном шкафу!
Химия. Лаб. практикум | -194- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Экспериментальная часть
Втри пробирки внесите по 10 капель разбавленных растворов кислот:
впервую – серной, во вторую – соляной, в третью – азотной. В каждую пробирку бросьте немного тонких медных стружек. Наблюдайте в третьей пробирке выделение газа NO.
Втри пробирки внесите по 5–7 капель концентрированных растворов кислот (в первую – серной, во второй – соляной, в третью – азотной) и слег-
ка нагрейте на водяной бане. Наблюдайте выделение бесцветного газа SO2 c резким запахом серы в первой пробирке и красно-бурого газа NO2 – в третьей.
Опыт 3
Получениеираспадгидроксидамеди(I)
К1-2 мл 0,2 н. раствора CuSO4 прилейте 4-5 мл 2 н. раствора щелочи
иглюкозы. Смесь хорошо перемешайте и затем нагрейте. Объясните образование желто-оранжевого осадка и его последующее превращение при более сильном нагревании в красный осадок. Составьте уравнения реакций, имея в виду, что глюкоза превращается в глюконовую кислоту:
O | O |
// | // |
Ch3OH – (CHOH)4 – C → Ch3OH – (CHOH)4 – C | |
\ | \ |
H | OH |
Опыт 4
Получениеоксидамеди(II) иисследованиеегосвойств
К 2-3 мл горячего 5 %-го раствора гидроксида натрия прилейте горячий 0,2 н. раствор CuSO4 до полноты осаждения оксида меди (II). Отметьте цвет выпавшего осадка гидроксида меди (II). Нагрейте содержимое пробирки до изменения цвета осадка при превращении гидроксида меди (II) в оксид.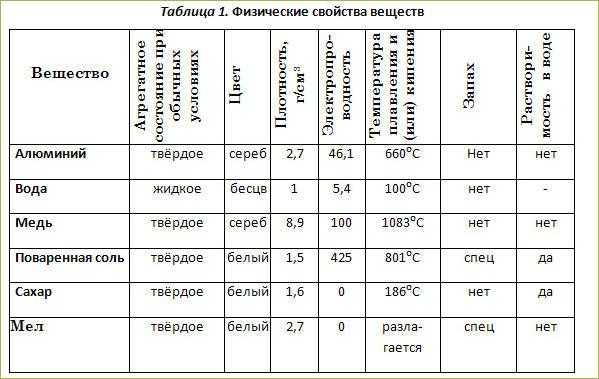
Полученный оксид меди (II) разлейте на две пробирки. В одну пробирку прибавьте 5-6 капель 2 н. серной кислоты, в другую – столько же соляной. Наблюдайте в обоих случаях появление окраски раствора.
Опыт 5
Получениегидроксидамеди(II) иисследованиеегосвойств
В пробирку внесите 5–7 капель 0,2 н. раствора CuSO4 и добавьте такой же объем раствора натриевой щелочи.
Полученный гидроксид меди (II) разделите на две части. К одной части добавьте разбавленный раствор кислоты, к другой – концентрированный раствор гидроксида натрия. Что наблюдается? К каким гидроксидам по своим свойствам относится гидроксид меди (II)?
Химия. Лаб. практикум | -195- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Экспериментальная часть
Опыт 6 Получениеглицератамеди
В пробирку налейте 2 мл 2 н. раствора гидроксида натрия и добавьте немного 0,2 н. раствора CuSO4 до выпадения осадка. К осадку прилейте глицерин и взболтайте. Наблюдайте растворение осадка и появление ярко-синей окраски раствора. Напишите уравнение реакций.
К осадку прилейте глицерин и взболтайте. Наблюдайте растворение осадка и появление ярко-синей окраски раствора. Напишите уравнение реакций.
Контрольныевопросыизадачи
1.Пользуясь рядом напряжений металлов, укажите, может ли медь при обычных условиях вытеснять водород из разбавленных кислот. В какой разбавленной кислоте металлическая медь растворяется? Напишите уравнение реакции и укажите, какое свойство кислоты при этом проявляется?
2.Какую степень окисления проявляют атомы меди в соединениях? Дайте объяснение. Приведите примеры.
3.Что произойдет при действии на медь серной кислоты: а) разбавленной; б) концентрированной при кипячении?
4.Напишите уравнение реакции образования карбоната гидроксомеди
(CuOH)2CO3, зеленый налет которого образуется на поверхности изделий из меди под действием паров воды, кислорода и диоксида углерода, находящихся в воздухе.
5.В каких реакциях проявляется непрочность гидроксидов меди и чем она объясняется?
6.Гидроксид меди (II) растворим в разбавленных кислотах и в растворе аммиака. Напишите в молекулярном и ионном виде соответствующие уравнения.
Напишите в молекулярном и ионном виде соответствующие уравнения.
7.Основный характер какого гидроксида более выражен: CuOH или Cu(OH)2? Ответ мотивируйте.
8.Сколько литров 92 %-го раствора h3SO4 потребуется для получения 20 кг медного купороса при действии серной кислоты на медь?
9.Вычислите, сколько миллилитров 2 н. раствора HNO3 потребуется для растворения 20 г Cu(OH)2?
Химия. Лаб. практикум | -196- |
Медь. Химические свойства. Получение меди. Применение презентация, доклад
Медь
Медь – первый металл, который впервые стал использовать человек в древности за несколько тысячелетий до нашей эры. Первые медные орудия изготовлялись из самородной меди, которая встречается довольно часто. Самый крупный самородок меди был найден на территории США, он имел массу 420 т. Но в виду того, что медь – мягкий металл, медь в древности не смогла вытеснить каменные орудия труда. Лишь когда человек научился плавить медь и изобрел бронзу (сплав меди с оловом), металл заменил камень. Широкое использование меди началось в IV тысячелетии до н.э.
Но в виду того, что медь – мягкий металл, медь в древности не смогла вытеснить каменные орудия труда. Лишь когда человек научился плавить медь и изобрел бронзу (сплав меди с оловом), металл заменил камень. Широкое использование меди началось в IV тысячелетии до н.э.
Медь — тяжелый розово-красный металл, мягкий и ковкий, ее температура плавления 1083° С, является отличным проводником электрического тока и теплоты электрическая проводимость меди в 1,7 раза выше, чем алюминия, и в 6 раз выше железа.
Положение меди в периодической системе Д.И. Менделеева.
Медь Сu — химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Порядковый номер 29, атомная масса 63,54.
Распределение электронов в атоме меди — Is22s22p63s23p63d104s1.
Природная медь состоит из смеси 2-х стабильных изотопов с массовыми числами 63 (69,1%) и 65 (30,9%).
В соединениях медь может проявлять степени окисления +1, +2 и +3, из которых +2 — наиболее характерная и устойчивая.
Медь (II) образует устойчивые оксид СuО и гидроксид Си(ОН)2. Этот гидроксид амфотерен, хорошо растворяется в кислотах и в концентрированных щелочах.
Соли меди (II) нашли широкое применение в народном хозяйстве. Особенно важным является медный купорос — кристаллогидрат сульфата меди (II) .
Распространение в природе.
Среднее содержание меди в земной коре 4,7-10-3 % (по массе)
Медь — важный элемент жизни, она участвует во многих физиологических процесса
В речной воде очень мало меди, 1-10-7 %. Приносимая в океан со стоком медь сравнительно быстро переходит в морские илы. Поэтому глины и сланцы несколько обогащены медью (5,7-10-3 %), а морская вода резко недосыщена медью (3-10-7 %).
Среднее содержание меди в живом веществе 2-10-4 %.
Медь образует до 240 минералов, однако лишь около 40 имеют промышленное значение.
Химические свойства меди.
Медь относится к малоактивным металлам.
При обычных условиях она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой.
Однако в кислотах-сильных окислителях (например, азотной и концентрированной серной)-медь растворяется:
Сu + 8HN03 = 3Cu(N03 )2 + 2NO + 4Н20
разбавленная
Сu + 4HN03 = Cu(N03)2 + 2N02+ 2Н20
концентрированная
Сu+ 2h3S04 = CuS04 + S02 + 2 Н20
концентрированная
Получение меди.
Его можно упрощенно представить следующим образом: вначале сульфид меди (например, Cu2S) подвергают окислительному обжигу:
Cu2S + 202 =2CuO+S02
К образовавшемуся оксиду, меди (II) добавляют новую порцию сульфида.
При высокой температуре протекает реакция:
2CuO + Cu2S = 4 Сu + S02
Применение меди
Одна из важнейших отраслей применения меди — электротехническая промышленность. Из меди изготавливают электрические провода.
Из меди изготавливают электрические провода.
Очень важная область применения меди-производство медных сплавов. Со многими металлами медь образует так называемые твердые растворы, которые похожи на обычные растворы тем, что в них атомы одного компонента (металла) равномерно распределены среди атомов другого. Большинство сплавов меди-это твердые растворы.
Сплав меди, известный с древнейших времен,-бронза содержит 4-30% олова (обычно 8-10%). Интересно, что бронза по своей твердости превосходит отдельно взятые чистые медь и олово. Бронза более легкоплавка по сравнению с медью. До наших дней сохранились изделия из бронзы мастеров Древнего Египта, Греции, Китая. Из бронзы отливали в средние века орудия и многие другие изделия. Знаменитые Царь-пушка и Царь-колокол в Московском Кремле также отлиты из сплава меди с оловом.
Сплав мельхиор содержит от 18 до 33% никеля (остальное медь). Он имеет красивый внешний вид. Из мельхиора изготавливают посуду и украшения, чеканят монеты («серебро»).
Он имеет красивый внешний вид. Из мельхиора изготавливают посуду и украшения, чеканят монеты («серебро»).
Сплавы меди с цинком с содержанием цинка до 50% носят название латунь. Это дешевые сплавы, обладают хорошими механическими свойствами, легко обрабатываются. Латуни благодаря своим качествам нашли широкое применение в машиностроении, химической промышленности, в производстве бытовых товаров. Для придания латуням особых свойств в них часто добавляют алюминий, никель, кремний, марганец и другие металлы.
Соли меди (II) имеют широкое применение. Особенно важное значение имеет медный купорос-кристаллогидрат сульфата меди (II) CuS04 • 5 Н20.
Медный купорос используют в производстве минеральных и органических красителей, в медицинской промышленности, для пропитки древесины в качестве антисептика (предохраняет дерево от гниения).
Большое значение имеет медный купорос в сельском хозяйстве: им протравливают семена перед посевом, опрыскивают деревья и кустарники для борьбы с вредителями.
Соединения меди обладают высокой биологической активностью. Они содержатся в животных и растительных организмах.
В растениях медь участвует в процессах синтеза хлорофилла, поэтому она входит в качестве одного из компонентов в состав минеральных удобрений.
Медь встречается в составе многих продуктов, которые использует в пищу человек: много меди, например, в молоке. Употребление продуктов с пониженным содержанием меди может привести к различным заболеваниям, в частности, может ухудшиться состав крови. Однако избыток соединений меди также вреден, он может привести к тяжелым отравлениям.
Вот почему не рекомендуется пользоваться при приготовлении пищи медной посудой: при кипячении в раствор может перейти избыточное количество меди. Можно лишь использовать медную посуду, хорошо облуженную изнутри, т.е. покрытую слоем олова.
Скачать презентацию
Copper Chemical Properties (25 Facts You Should Know) – Lambda Geeks
Copper is a transition element that is multidisciplinary in its approach to various scientific fields. Let us discuss some facts about it.
Let us discuss some facts about it.
Copper is one of the rarest species which is available and used in its purest and native metallic state. It is a brownish metal that is malleable, ductile, and lustrous with high conductivity. Being a solid it has a face-centered cubic crystal structure.
From early ages, copper has been the only element used by human beings making it one of the oldest elements. Presently, it is employed in metallurgical, medicinal, textile industries, etc. Let us understand its chemical properties like density, radius, magnetism, etc.
Copper symbol
The symbol is a small representation of an element according to its scientific name which involves the first 2 letters. Let us check the representation of copper.
The symbol of copper is Cu as mentioned in the periodic table which is derived from its scientific name cuprum.
Representation of copper metal
Copper group in the periodic table
The vertical column of the periodic table where elements of the same family are placed together is a group. Let us figure out the group assigned to copper.
Let us figure out the group assigned to copper.
Copper is assigned group 11 of the periodic table and belongs to the coinage metal family which are known since prehistoric times as metals of value.
Copper period in the periodic table
A period is a horizontal row in the периодическая таблица which signifies the change in the trend with the addition of electrons in the same shell. Let us find out the period assigned to copper.
Copper belongs to the 4th period which is approximately in the center of the periodic table.
Copper block in the periodic table
A block is a zone of unified elements which have similarities in their azimuthal quantum numbers. Let us discuss the block of copper.
Copper’s location in the periodic table is the d block which is the block of the transition metal elements.
Copper atomic number
Игровой автомат атомный номер is the number unique to every element in the periodic table. Let us check the atomic number for copper.
Let us check the atomic number for copper.
The atomic number of copper is 29. Mathematically it is equal to no. of electrons and protons. In copper, the no. of electrons and protons is 29. Hence atomic number is 29.
Copper atomic weight
Atomic weight is the weight of an atom. It is the sum of protons and neutrons or the total weight in a nucleus. Let us check the same for copper.
The atomic weight of the copper element is 63.546 u.
Copper electronegativity according to Pauling
Электроотрицательность is the attracting power of an atom during bonding either by transference or sharing of electrons. Let us check out the same for copper.
The electronegativity of copper according to the Pauling scale is 1.9 which implies that it prefers forming ionic bonds which involve the transference of electrons.
Copper atomic density
Atomic density is the volume occupied by the no. of atoms along with their mass. Let us find out the atomic density of copper.
of atoms along with their mass. Let us find out the atomic density of copper.
The atomic density of copper is 8.92 g/cm3 at atmospheric pressure and room temperature.
Copper melting point
Игровой автомат температура плавления is the stage at which there is a change in the state of matter from solid to liquid and both states are in equilibrium. Let us look for the same in copper.
The melting point of copper is 1085 degree Celsius which is very high due to strong intermolecular forces and metallic bonds.
Copper boiling point
Игровой автомат точка кипения is a particular temperature where the vapor pressure is equal to atmospheric pressure. Let us check the boiling point of copper.
The boiling point of copper is 2562 degree Celsius which is in complete alignment with atmospheric pressure.
Copper van der Waals radius
Vander Waal radius is measured when the atom does not exhibit bonding as described by Pauling. Let us check the radius for copper.
Let us check the radius for copper.
The Vander Waal radius of copper is 1.4 angstrom.
Copper ionic radius
Ионный радиус as the name suggests is the radius of an ion but is not fixated and involves the influence of an electron cloud as well. Let us discuss it in copper.
The ionic radius for Cu+ is 77pm and for Cu2+ it is 73pm. It varies according to the charge present on the copper ion.
Copper isotopes
Изотопы are a family of an element where no. of protons is the same, but the neutrons are different. Let us discuss isotopes in copper.
Copper has 2 stable and natural isotopes and 27 radioisotopes. The stable isotopes are mentioned below.
- 63Cu
- 65Cu
Copper electronic shells
Концепция electronic shells is based on the octet rule and their ability to hold electrons. Let us figure out the electronic shells involved in copper.
Let us figure out the electronic shells involved in copper.
The electronic shells in copper are 4. The atomic number of copper is 29 according to which the distribution of electrons in the shell will be 2, 8, 18, 1.
Copper energy of first ionization
Имя энергия ионизации is the ability to remove first loosely bound electrons during bonding. Let us discuss copper in the same context.
The energy of the first ionization in copper is 7.7264eV which is much higher than alkali metals.
Copper energy of second ionization
Second ionization energy is the capacity to remove the 2nd electron from the atom. Let us check it for copper.
The second ionization energy for copper is 1957.9eV which is higher than the first one making it difficult for copper to lose electrons due to its small size and stronger forces.
Copper energy of third ionization
Third ionization energy is the requirement to remove 3rd electron from the shell. Let us discuss the energy requirements for copper.
Let us discuss the energy requirements for copper.
The third ionization energy of copper is very high which is 3555eV because after the removal of 2 electrons copper gains a stable half-filled configuration. So, the removal of 3rd electron is hard.
Copper oxidation states
Окислительные состояния are commonly found in ionic species as a hypothetical charge or the ability to form ionic bonds. Let us discover the oxidation states of copper.
The principal oxidation states of copper are +1 and +2 but some complexes, especially coordination compounds also show +3 oxidation states.
Copper electronic configurations
Игровой автомат электронная конфигурация is the concept of quantum chemistry focusing on the distribution of electrons at an orbital level. Let us check it for copper.
The electronic configuration of copper is [Ar]3d104s1 where Ar is the argon noble gas. The detailed configuration is 1s22s22p63s23p64s13d10.
The detailed configuration is 1s22s22p63s23p64s13d10.
Copper CAS number
CAS номер is a unique 10-digit number assigned to every element by Chemical Abstracts Service. Let us find it for copper.
The CAS number for copper is 7440-50-8.
Copper ChemSpider ID
Идентификатор ChemSpider is an identification given to every element in a chemical structure database owned by the Royal Society of Chemistry. Let us look the same for copper.
The ChemSpider ID for copper is 22414.
Copper allotropic forms
Allotropism is the property where a chemical element can exist in different physical forms. Let us check whether the same is observed in copper.
Copper does not have any allotropic forms. Here there is only a single structure, and no crystalline and аморфный forms exist.
Copper chemical classification
The chemical classification of an element gave us insight into the characteristics associated with it. Let us discuss the chemical classification of copper.
The characteristics of copper are:
- Copper is one of the rarest metals which is found in its neutral and free state.
- Copper has high conductivity and mechanical properties at cryogenic conditions which make it successful for many applications.
- Copper can be tempered easily according to the required tensile strength.
- Copper shows good resistance against биообрастание и коррозия.
Copper state at room temperature
The state of any element depends on the temperature and pressure conditions. Let us check out the state of copper at room temperature.
The state of copper at room temperature is solid because of its high melting and boiling point.
Is copper paramagnetic?
Парамагнетизм is the weak attraction of the element due to externally applied magnetics forces. Let us check whether copper is paramagnetic or not.
Copper is not a paramagnetic substance, instead, it is ferromagnetic where there is a strong attraction to the magnetic field.
Заключение
In a nutshell, copper is a very important coinage metal with great historical significance and application in the present scenario. All its properties are in complete alignment with the properties exhibited by metallic substances.
Физико-химические свойства меди, важные для ее антибактериальной активности и разработки унифицированной модели
Сохранить цитату в файл
Формат:
Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
адрес:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета:
SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Обзор
. 2015 16 марта; 11 (1): 018902.
дои: 10. 1116/1.4935853.
1116/1.4935853.
Майкл Ганс
1
, Салима Мэтьюз
2
, Франк Мюклих
1
, Марк Солиоз
3
Принадлежности
- 1 Функциональные материалы, Саарландский университет, Саарбрюккен 66123, Германия.
- 2 Департамент клинических исследований Бернского университета, Берн 3008, Швейцария.
- 3 Лаборатория биохимии и молекулярной биологии Томского государственного университета, 634050 Томск, Российская Федерация.
PMID:
26577181
DOI:
10.
 1116/1.4935853
1116/1.4935853
Обзор
Michael Hans et al.
Биоинтерфазы.
.
. 2015 16 марта; 11 (1): 018902.
дои: 10.1116/1.4935853.
Авторы
Майкл Ханс
1
, Салима Мэтьюз
2
, Франк Мюклих
1
, Марк Солиоз
3
Принадлежности
- 1 Функциональные материалы, Саарландский университет, Саарбрюккен 66123, Германия.
- 2 Департамент клинических исследований Бернского университета, Берн 3008, Швейцария.

- 3 Лаборатория биохимии и молекулярной биологии Томского государственного университета, 634050 Томск, Российская Федерация.
PMID:
26577181
DOI:
10.1116/1.4935853
Абстрактный
Контактное уничтожение — это новый термин, описывающий уничтожение бактерий при их контакте с металлической медью или медьсодержащими сплавами. В последние годы механизму контактного умерщвления уделяется большое внимание, и доступно много деталей этого механизма. Авторы здесь рассматривают некоторые из этих механистических аспектов, уделяя особое внимание критическим физико-химическим свойствам меди, которые делают ее антибактериальной. Известные механизмы контактного уничтожения связаны с ионными, коррозионными и физическими свойствами меди. Анализ показывает, что окислительные свойства меди в сочетании с растворимостью оксидов меди являются ключевыми факторами, которые делают металлическую медь антибактериальной. Выдвинутая здесь концепция объясняет уникальное положение меди как антибактериального металла. На основе нашей модели могут быть получены новые критерии проектирования металлических антибактериальных материалов.
Известные механизмы контактного уничтожения связаны с ионными, коррозионными и физическими свойствами меди. Анализ показывает, что окислительные свойства меди в сочетании с растворимостью оксидов меди являются ключевыми факторами, которые делают металлическую медь антибактериальной. Выдвинутая здесь концепция объясняет уникальное положение меди как антибактериального металла. На основе нашей модели могут быть получены новые критерии проектирования металлических антибактериальных материалов.
Похожие статьи
Уничтожение бактерий медными, кадмиевыми и серебряными поверхностями выявляет соответствующие физико-химические параметры.
Луо Дж., Хайн С., Мюклих Ф., Солиоз М.
Луо Дж. и др.
Биоинтерфазы. 2017 13 апреля; 12 (2): 020301. дои: 10.1116/1.4980127.
Биоинтерфазы. 2017.PMID: 28407716
Роль оксидов меди в контактном умерщвлении бактерий.

Ханс М., Эрбе А., Мэтьюз С., Чен Ю., Солиоз М., Мюклих Ф.
Ханс М. и др.
Ленгмюр. 2013 31 декабря; 29 (52): 16160-6. doi: 10.1021/la404091z. Epub 2013 17 декабря.
Ленгмюр. 2013.PMID: 24344971
Восстановление меди и контактное уничтожение бактерий железными поверхностями.
Мэтьюз С., Кумар Р., Солиоз М.
Мэтьюз С. и др.
Appl Environ Microbiol. 2015 сен; 81 (18): 6399-403. doi: 10.1128/AEM.01725-15. Epub 2015 6 июля.
Appl Environ Microbiol. 2015.PMID: 26150470
Бесплатная статья ЧВК.Применение бактерицидных свойств меди в медицинской практике.
Прадо Дж.В., Видаль А.Р., Дюран Т.К.
Прадо Дж. В. и др.
Преподобный Мед Чил. 2012 г., октябрь; 140 (10): 1325-32. doi: 10. 4067/S0034-98872012001000014.
4067/S0034-98872012001000014.
Преподобный Мед Чил. 2012.PMID: 23559292
Обзор.
Испанский.Антимикробные материалы и покрытия на основе меди: потенциальное многогранное биомедицинское применение.
Митра Д., Канг Э.Т., Неох К.Г.
Митра Д. и др.
Интерфейсы приложений ACS. 2020 13 мая;12(19):21159-21182. дои: 10.1021/acsami.9b17815. Epub 2019 27 декабря.
Интерфейсы приложений ACS. 2020.PMID: 31880421
Обзор.
Посмотреть все похожие статьи
Цитируется
Антибактериальные металлические сенсорные поверхности.
Вильяпун В.М., Довер Л.Г., Кросс А., Гонсалес С.
Виллапун В.М. и соавт.
Материалы (Базель). 2016 авг 29;9(9):736. дои: 10. 3390/ma90
3390/ma90
.
Материалы (Базель). 2016.PMID: 28773856
Бесплатная статья ЧВК.Обзор.
Типы публикаций
термины MeSH
вещества
Процитируйте
Формат:
ААД
АПА
МДА
НЛМ
Отправить на
Химические свойства меди (25 фактов, которые вы должны знать) – Lambda Geeks
Медь является переходным элементом, который является междисциплинарным в своем подходе к различным научным областям. Давайте обсудим некоторые факты об этом.
Медь является одним из самых редких видов, который доступен и используется в самом чистом и естественном металлическом состоянии. Это коричневатый металл, ковкий, пластичный и блестящий с высокой проводимостью. Будучи твердым телом, он имеет гранецентрированную кубическую кристаллическую структуру.
Будучи твердым телом, он имеет гранецентрированную кубическую кристаллическую структуру.
С давних времен медь была единственным элементом, используемым людьми, что делает ее одним из древнейших элементов. В настоящее время он используется в металлургической, медицинской, текстильной промышленности и т. д. Давайте разберемся с его химическими свойствами, такими как плотность, радиус, магнетизм и т. д.
Символ меди
научное название, состоящее из первых двух букв. Проверим представление меди.
Символом меди является Cu, как указано в периодической таблице, которая происходит от ее научного названия cuprum.
Представление металлической меди
Группа меди в периодической таблице
Вертикальный столбец периодической таблицы, в котором элементы одного семейства размещены вместе, представляет собой группу. Разберемся, к какой группе относится медь.
Медь относится к 11-й группе периодической таблицы и принадлежит к семейству металлов для чеканки, которые известны с доисторических времен как ценные металлы.
Медный период в таблице Менделеева
Период — это горизонтальная строка в таблице Менделеева, обозначающая изменение тренда при добавлении электронов в одну и ту же оболочку. Выясним период, присвоенный меди.
Медь относится к 4 периоду, который находится примерно в центре таблицы Менделеева.
Медный блок в таблице Менделеева
Блок – это зона единых элементов, имеющих сходство по своим азимутальным квантовым числам. Давайте обсудим блок меди.
Расположение меди в периодической таблице — блок d, который является блоком элементов переходного металла.
Атомный номер меди
Атомный номер — это номер, уникальный для каждого элемента периодической таблицы. Проверим атомный номер меди.
Атомный номер меди 29. Математически он равен нет. электронов и протонов. В меди нет. число электронов и протонов равно 29. Следовательно, атомный номер равен 29..
Следовательно, атомный номер равен 29..
Атомный вес меди
Атомный вес – это вес атома. Это сумма протонов и нейтронов или общий вес в ядре. Проверим то же самое для меди.
Атомный вес медного элемента 63,546 ед.
Электроотрицательность меди по Полингу
Электроотрицательность – это сила притяжения атома во время связывания путем переноса или совместного использования электронов. Проверим то же самое для меди.
Электроотрицательность меди по шкале Полинга равна 1,9, что означает, что медь предпочитает образовывать ионные связи, включающие перенос электронов.
Атомная плотность меди
Атомная плотность – это объем, занимаемый №. атомов вместе с их массой. Найдем атомную плотность меди.
Атомная плотность меди составляет 8,92 г/см 3 при атмосферном давлении и комнатной температуре.
Температура плавления меди
Температура плавления – это стадия, при которой происходит изменение состояния вещества из твердого в жидкое и оба состояния находятся в равновесии.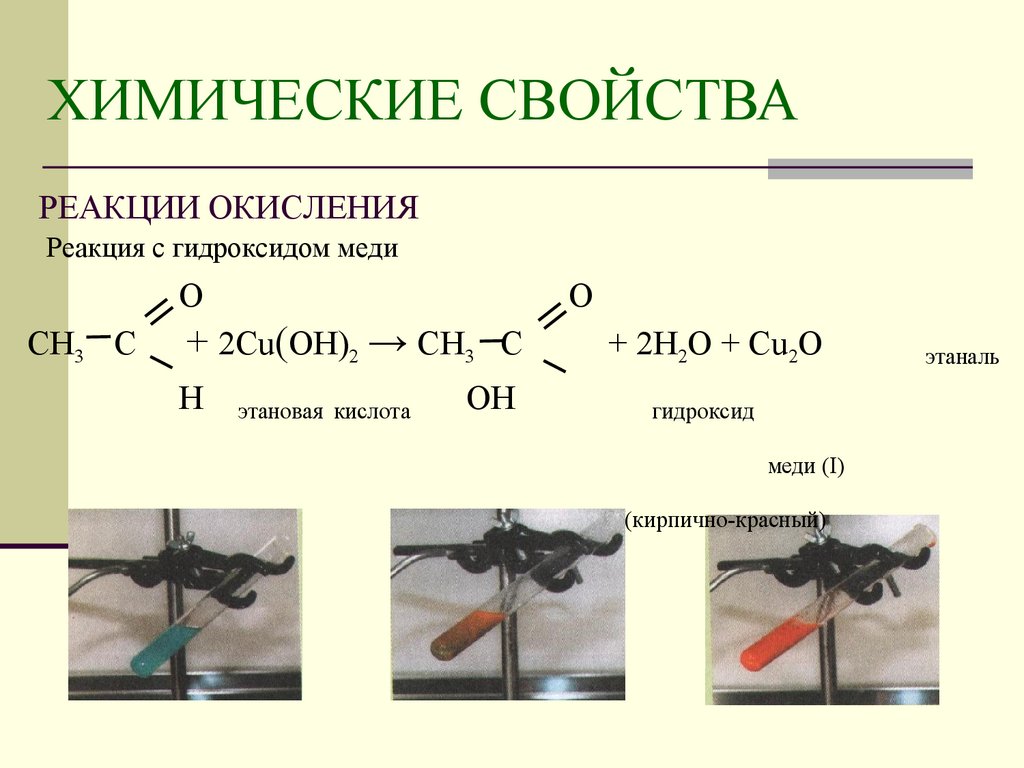 Поищем то же самое в меди.
Поищем то же самое в меди.
Температура плавления меди составляет 1085 градусов Цельсия, что является очень высоким показателем благодаря сильным межмолекулярным силам и металлическим связям.
Температура кипения меди
Температура кипения – это определенная температура, при которой давление паров равно атмосферному давлению. Проверим температуру кипения меди.
Температура кипения меди составляет 2562 градуса Цельсия, что полностью соответствует атмосферному давлению.
Радиус Ван-дер-Ваальса меди
Радиус Ван-дер-Ваальса измеряется, когда атом не проявляет связи, как описано Полингом. Проверим радиус для меди.
Вандер-Ваальовский радиус меди составляет 1,4 ангстрема.
Ионный радиус меди
Ионный радиус, как следует из названия, является радиусом иона, но не фиксируется и также включает влияние электронного облака. Давайте обсудим это в меди.
Давайте обсудим это в меди.
Ионный радиус для Cu + составляет 77 пм, а для Cu 2+ — 73 пм. Варьируется в зависимости от заряда иона меди.
Изотопы меди
Изотопы – это семейство элементов, где нет. протоны одинаковые, а нейтроны разные. Обсудим изотопы в меди.
Медь содержит 2 стабильных природных изотопа и 27 радиоизотопов. Стабильные изотопы упомянуты ниже.
- 63 CU
- 65 CU
Медные электронные раковины
. Разберемся с электронными оболочками, задействованными в меди.
Электронных оболочек в меди 4. Атомный номер меди 29, согласно которому распределение электронов в оболочке будет 2, 8, 18, 1.
Энергия первой ионизации меди
Энергия первой ионизации – это способность удалить первые слабо связанные электроны при связывании. Давайте обсудим медь в том же контексте.
Давайте обсудим медь в том же контексте.
Энергия первой ионизации в меди составляет 7,7264 эВ, что намного выше, чем у щелочных металлов.
Энергия второй ионизации меди
Энергия второй ионизации – это способность оторвать 2-й электрон от атома. Проверим на медь.
Вторая энергия ионизации для меди составляет 1957,9 эВ, что выше, чем первая, что затрудняет потерю электронов медью из-за ее небольшого размера и более сильных сил.
Энергия третьей ионизации меди
Энергия третьей ионизации необходима для удаления 3-го электрона с оболочки. Обсудим энергетические потребности меди.
Третья энергия ионизации меди очень высока и составляет 3555 эВ, потому что после удаления 2 электронов медь приобретает стабильную полузаполненную конфигурацию. Итак, удаление 3-го электрона сложно.
Степени окисления меди
Степени окисления обычно обнаруживаются в ионных частицах как гипотетический заряд или способность образовывать ионные связи. Выясним степени окисления меди.
Выясним степени окисления меди.
Основные степени окисления меди +1 и +2, но некоторые комплексы, особенно координационные соединения, также показывают степени окисления +3.
Электронные конфигурации меди
Электронная конфигурация — это концепция квантовой химии, посвященная распределению электронов на орбитальном уровне. Проверим на медь.
Электронная конфигурация меди: [Ar]3d 10 4s 1 , где Ar — благородный газ аргон. Подробная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 .
Медь Номер CAS
Номер CAS — это уникальный 10-значный номер, присваиваемый каждому элементу компанией Chemical Abstracts Service. Найдем его для меди.
Номер CAS для меди: 7440-50-8.
Медь ChemSpider ID
ChemSpider ID — это идентификатор, присвоенный каждому элементу в базе данных химической структуры, принадлежащей Королевскому химическому обществу. Посмотрим то же самое для меди.
Посмотрим то же самое для меди.
Идентификатор ChemSpider для меди: 22414.
Аллотропные формы меди
Аллотропность — это свойство, при котором химический элемент может существовать в различных физических формах. Проверим, наблюдается ли то же самое в меди.
Медь не имеет аллотропных форм. Здесь имеется только одна структура, а кристаллических и аморфных форм не существует.
Химическая классификация меди
Химическая классификация элемента дала нам представление о связанных с ним характеристиках. Остановимся на химической классификации меди.
Характеристики меди:
- Медь является одним из самых редких металлов, который находится в нейтральном и свободном состоянии.
- Медь обладает высокой проводимостью и механическими свойствами в криогенных условиях, что делает ее пригодной для многих применений.

- Медь можно легко закалить в соответствии с требуемой прочностью на растяжение.
- Медь обладает хорошей устойчивостью к биообрастанию и коррозии.
Состояние меди при комнатной температуре
Состояние любого элемента зависит от условий температуры и давления. Проверим состояние меди при комнатной температуре.
Медь при комнатной температуре находится в твердом состоянии из-за высокой температуры плавления и кипения.
Является ли медь парамагнитной?
Парамагнетизм — это слабое притяжение элемента из-за внешних магнитных сил. Проверим, является ли медь парамагнитной или нет.
Медь не является парамагнитным веществом, вместо этого она становится ферромагнитной, если существует сильное притяжение к магнитному полю.
Заключение
В двух словах, медь является очень важным металлом для чеканки монет, имеющим большое историческое значение и применение в настоящем сценарии. Все его свойства полностью соответствуют свойствам металлических веществ.
Все его свойства полностью соответствуют свойствам металлических веществ.
Химия меди
Химия меди
История
Информация о
история меди
доступен в Медном
Development Association, Inc., где они отмечают, что:
» В течение почти 5000 лет медь была единственным металлом, известным человеку.
Сегодня это один из наиболее часто используемых и повторно используемых наших современных
металлов.»
Люди впервые использовали медь около 10 000 лет назад.
Кулон, обнаруженный в Северном Ираке, как полагают, датируется
около 8700 г. до н.э. Доисторический человек, вероятно, использовал медь для оружия
изготовление. Древние египтяне, похоже, тоже ценили
коррозионная стойкость металла. Они использовали медные полосы и
гвозди в судостроении и медные трубы использовались для транспортировки
вода. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии.
Оценка общего производства меди в Египте за 1500 лет.
составляет 10 000 тонн.
Спустя годы появились медные сплавы. Бронзы (медно-оловянные сплавы)
появились сначала, а гораздо позже — латунь (медно-цинковая
сплавы). В «бронзовом веке» широко использовались медь и
бронза для оружия, монет, домашней утвари, мебели и др.
Предметы. Самый ранний известный пример использования латуни — римская монета.
отчеканены во время правления Августа 27 г. до н.э. — 14 г. н.э. Медь позже
сыграли важную роль в появлении электричества и сегодня
по-прежнему является одним из наших самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э.
Сульфат меди, например, был особенно важным соединением.
в ранние времена. Древние египтяне использовали его как морилку в своих
процесс окрашивания. Соединение также использовалось для изготовления мазей и
другие подобные препараты. Позже, лечебное использование медного купороса
возникла с его рецептом для легочных заболеваний. Медь
сульфат по-прежнему широко используется сегодня и не имеет вредных побочных эффектов.
последствия его 9Сообщалось об использовании 0547 предписанных .
Распространение
Медь является 25-м -м -м наиболее распространенным элементом Земли, но
один из менее распространенных переходных металлов первого ряда. Это происходит как
мягкий красноватый металл, который можно найти в виде больших валунов
массой в несколько сотен тонн или в виде сульфидных руд. Последние
сложные смеси меди, железа и серы в сочетании с
другие металлы, такие как мышьяк, цинк и серебро. Медь
концентрация в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , латунь
желтая руда, на долю которой приходится примерно 50% мировой добычи
месторождения меди. Многочисленные другие медные руды разных цветов
и составы есть. Примеры малахит,
Cu 2 CO 3 (OH) 2 , ярко-зеленая руда,
и красный рудный куприт Cu 2 O.
Международный центр экологических и ядерных наук (ICENS)
имеет текущую программу картографирования геохимического состава Ямайки.
«Геохимический атлас Ямайки» был опубликован в 1919 г.95 и доступен на Amazon или ICENS.
Результаты, полученные для меди, показаны ниже (любезно предоставлено профессором Г. К. Лалором).
Медь встречается в биологических системах в составе
простетическая группа некоторых белков. Для примера меди
содержащие белки см. статью родом из Университета
Лидса, факультет биохимии и молекулярной биологии Института Скриппса.
Красный пигмент в
мягкоклювая птица Т (о) урако
содержит медно-порфириновый комплекс. Пигмент сильно водный
растворим в щелочных условиях и был
сообщили в 1952
что попытки зоозащитников помыть птицу привели к тому, что вода
приобретают красноватый оттенок.
T(o)uracos, как говорят, единственные птицы, обладающие настоящим красным и зеленым цветом.
Как правило, цвет, который вы воспринимаете при наблюдении за птицами, обусловлен отражениями.
благодаря структуре пера. Красные и зеленые пигменты (турацин и тураковердин)
найденные в перьях T(o)uraco, оба содержат медь.
Свойства меди
Отличный сайт для поиска свойств элементов,
в том числе медь по адресу
Еще одна полезная ссылка на
Страницы геологического проекта
в унив. Невада, Рено.
Извлечение меди
Медь извлекают из руды двумя основными способами:
- Пирометаллургический метод
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд.
Всего четыре основных этапа:
- Горнодобывающая и фрезерная промышленность
- Руда измельчается и измельчается в порошок
обычно содержащие менее 1% меди.
Минералы концентрируются в суспензию, которая составляет около 15%.
медь.
Минералы меди отделяют от бесполезного материала флотацией.
с использованием пенообразующих растворов. - Плавка
- Плавка медного концентрата и извлечение
нагреванием, потоком и добавлением кислорода. Сера, железо и другие
Сера, железо и другие
нежелательные элементы удаляются, и продукт называется
черновая медь. - Переработка
- Это заключительный этап процесса
получение высококачественной меди. Методы огневого и электрорафинирования
используются техники. Последний производит медь высокой чистоты.
пригодны для использования в электротехнике.
Гидрометаллургический метод — SX/EW
Экстракция растворителем/электровыделение является наиболее распространенным методом выщелачивания
процесс, используемый сегодня при восстановлении меди из химических
решения. Как следует из названия, метод включает в себя два основных
этапы:
Экстракция растворителем – процесс выщелачивания ионов меди
или иным образом извлекаемые из необработанной руды с использованием химических
агенты.
Электролиз — электролиз раствора, содержащего ионы металлов
таким образом, что ионы Cu в нем осаждаются на катоде и
после этого удаляется в элементарной форме.
Процесс состоит из следующих этапов:
- Выбирается выщелачивающий раствор для использования в
вымывание ионов Cu из руды. Обычными реагентами являются слабые кислоты.
например Н 2 SO 4 , H 2 SO 4 +
Fe 2 (SO 4 ) 3 , хлорангидрид
решения напр. FeCl 2 , хлорид аммония и аммоний
солевые композиции. - При нанесении на руду выбранный выщелачиватель растворяет
ионы меди, образующие выщелачивающий продукт, называемый «беременным
выщелачивающий раствор». - Затем выбирается органический экстрагент для удаления ионов Cu из
водный раствор. Предпочтительные органические экстрагенты состоят из
гидроксифенилоксимы, имеющие основную химическую формулу: - C 6 H 3 (R)(OH) CNOHR*, R=
C 9 H 19 или C 12 H 25 и
R*= H, CH 3 или C 6 H 5
Структура 5-нонилсалицилальдоксима |
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и
смесь этого соединения и 2-гидрокси-5-нонилацетофенона
оксим. Коммерчески доступные реагенты обычно содержат 5-10%
Коммерчески доступные реагенты обычно содержат 5-10%
оксима в 90-95% разбавитель нефти, такой как
керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент
содержат мало или совсем не содержат меди и на данном этапе называются
«бесплодный органический экстрагент».
- Ионы меди переносятся из выщелачивающего раствора в
органический экстрагент при смешивании двух реагентов. Фаза
происходит разделение с образованием водной и органической фаз
называемые соответственно первой водной и первой органической фазами.
Первая водная фаза, «рафинат», является выщелачивателем.
лишен ионов меди, в то время как первой органической фазой является
«загруженный органический экстрагент», т.е. экстрагент с ионами меди
подарок. - Рафинат рециркулируется на площадку выщелачивания, в то время как
загруженный органический экстрагент смешивают с раствором электролита
называется «бедным электролитом» (т. е. не содержащим меди).
Типичными электролитами являются кислые растворы, такие как серная кислота,
H 2 SO 4 . Ионы меди, находившиеся в
Ионы меди, находившиеся в
органический экстрагент при этом растворяется в растворе электролита
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
является фазовым разделением. Вторая органическая фаза – бесплодная.
органический экстрагент, а вторая водная фаза представляет собой «богатую
электролит». Бесплодный органический экстрагент затем рециркулируется для
повторное использование в применении к выщелачивающему продукту. - Завершающей стадией процесса является электролиз
кислый раствор ионов металлов. В результате растворенные ионы меди
наносятся на катод, и элементарная медь удаляется.
Таким образом, процесс восстановления завершен.
A Примечание о примесях
Присутствие взвешенных загрязнителей в системе SX/EW может
значительно снижает эффективность его работы. Такой
загрязняющие вещества могут попасть в систему из руды или
из окрестностей. Система подвержена загрязнению
от дождя, ветра и других сил окружающей среды с момента первого
защитная оболочка, в которой хранится выщелачивающий продукт, обычно
незакрытые и расположенные на открытом воздухе. Таким образом, твердые отходы в
Таким образом, твердые отходы в
в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков
и взвешенные вещества часто вводятся в систему в
ранних стадиях и сохраняется на последующих стадиях
процесс.
Воздействие этих загрязняющих веществ является значительным и
включают:
- увеличенное время разделения фаз на стадиях, когда органические и
водные растворители смешивают. - отсутствие полного разделения фаз после экстракции,
это приводит к потерям дорогостоящего органического экстрагента, т.к.
его остается в водном растворе. - снижение КПД по току и снижение
чистота гальванического изделия из меди при электролизе
сцена.
В большинстве систем SX/EW этапы очистки были введены в
чтобы облегчить эту проблему. В
Патент США (номер 573341)
например, хотя бы часть
вторая органическая фаза фильтруется для удаления твердых примесей
перед повторным использованием при обработке выщелачивающего продукта. Переработанная органика
Переработанная органика
поэтому экстрагент содержит мало или совсем не содержит примесей, зависящих от
от того, была ли часть или вся вторая органическая фаза
отфильтровано. Установлено, что эта стадия фильтрации
значительно повышает эффективность работы, даже если
часть экстрагента подвергается обработке.
Использование меди и ее соединений
Медь на протяжении веков уступает по полезности только железу.
Металл и его соединения используются во всех сферах жизни от
электрооборудование для медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большинства
выход меди. Металл используется в производстве электротехники.
устройства, такие как катоды и провода.
Другое применение включает:
— Кровля
-Посуда
-Монеты
-Слесарная работа
-Сантехника
— Катушки холодильника и кондиционера
-Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве.
С момента открытия их токсичности для некоторых насекомых грибы
и водорослей эти соединения использовались в инсектицидах,
фунгицидов и предотвращения развития водорослей в питьевой воде
водохранилища. Поэтому они используются для борьбы с животными и
болезни растений. Удобрения также часто дополняются
соединения меди, т.е. медный купорос, чтобы увеличить почву
плодородие и, таким образом, стимулировать рост урожая.
Соединения меди также используются в фотографии и в качестве красителей.
для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Это
входит в состав простетических групп многих белков и ферментов и
таким образом, имеет важное значение для их надлежащего функционирования. Поскольку тело может
не синтезируют медь, ее необходимо принимать с пищей. Орехи, семечки,
злаки, мясо (например, печень) и рыба являются хорошими источниками
медь.
Медь также нашла применение в медицине. Он использовался с раннего
Он использовался с раннего
раз при лечении ран груди и очистке воды. Это
Недавно было высказано предположение, что медь помогает предотвратить
воспаление, связанное с артритом и такими заболеваниями.
Продолжаются исследования лекарственных средств, содержащих медь, для лечения
этого и других условий.
Для получения дополнительной информации о важности меди для здоровья и
дефицит меди см.:
MotherNature и/или исследования витаминов
Продукты
Соединения меди
Медь содержит множество соединений, многие из которых
цветной. Двумя основными степенями окисления меди являются +1 и
+2, хотя известны некоторые комплексы +3. Соединения меди(I)
предположительно диамагнитны по своей природе и обычно бесцветны,
за исключением случаев, когда цвет является результатом переноса заряда или
анион. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В
твердые соединения, медь (I) часто находится в более стабильном состоянии при
умеренные температуры.
Ион меди(II) обычно находится в более стабильном состоянии в водной среде.
решения. Соединения этого иона, часто называемые соединениями меди,
обычно бывают цветными. На них влияет
Искажения Яна Теллера
и демонстрируют широкий спектр стереохимии с
преобладают четырех-, пяти- и шестикоординационные соединения. +2
ион часто демонстрирует искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя
фтор в чистом виде еще не получен. Медь
хлориды, бромиды и йодиды бесцветны, диамагнитны
соединения. Они кристаллизуются при обычных температурах с
структура цинковой обманки, в которой атомы Cu связаны тетраэдрически
до четырех галогенов. Соли хлорида и бромида меди (I)
получают кипячением кислого раствора ионов меди(II) в
избыток меди. При разбавлении белый CuCl или бледно-желтый
Производится CuBr. Добавление растворимого йодида в водную
раствор ионов меди(II) приводит к образованию
осадок йодида меди (I), который быстро разлагается до Cu (I)
и йод.
Галогениды меди(I) мало растворимы в воде и большая часть
медь в водном растворе находится в состоянии Cu(II). Несмотря на это,
плохая растворимость соединений меди(I) увеличивается при
присоединение галогенид-ионов. В таблице ниже показаны некоторые свойства
галогениды меди(I).
| Формула | Цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | — |
| CuBr | белый | 483 | 1345 | — |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получен восстановлением CuX 2 -> CuX;
за исключением F, который не был получен в чистом виде.
| Формула | Цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | — | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | — | 1,3 |
Все четыре галогенида меди (II) известны, хотя иодид меди
быстро разлагается на йодид меди и йод. желтый
желтый
хлорид меди (II) и почти черный бромид меди (II).
обычные галогениды. Эти соединения принимают структуру с
бесконечные параллельные полосы квадрата CuX 4 шт. медь
хлориды и бромиды хорошо растворимы в воде и в донорных
растворители, такие как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за
Пара Cu(I)/Cu(II). В воде, где потенциал в значительной степени
аквакомплексов не так много
разница между ними, но в неводных средах окисляющая
(галогенирование) мощность увеличивается в последовательности; CuF 2
<< CuCl 2 << CuBr 2 .
Могут быть получены прямой реакцией с соответствующими
галогены:
Cu + F 2 → CuF 2 ;
Cu + Cl 2 / 450°C → CuCl 2 ;
Cu + Br 2 → CuBr 2
В качестве альтернативы они могут быть получены из CuX 2 .aq путем
нагрев -> CuX 2
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при
высокие температуры. Оксид меди(I) встречается в самородном виде в виде красного
Оксид меди(I) встречается в самородном виде в виде красного
куприт. В лаборатории снижение
Решение Фелинга
с восстанавливающим сахаром, таким как глюкоза, дает красный осадок.
Тест достаточно чувствителен, чтобы даже 1 мг сахара произвел
характерный красный цвет соединения. Закись меди может
также может быть приготовлен в виде желтого порошка контролируемым восстановлением
щелочная соль меди(II) с гидразином. Термическое разложение
оксид меди (II) также дает оксид меди (I), поскольку последний имеет
большая термическая стабильность. Таким же способом можно приготовить
соединение из нитрата меди (II), карбоната и
гидроксид.
Оксид меди(II) встречается в природе в виде тенорита. Этот черный
Кристаллическое твердое вещество можно получить пиролизом
нитратные, гидроксидные или карбонатные соли. Он также образуется при
порошкообразную медь нагревают на воздухе или в кислороде. В таблице ниже показано
некоторые характеристики оксидов меди.
| Формула | Цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложить |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительная химия меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель
достаточно силен, чтобы превратить Cu в Cu + , более чем достаточно силен, чтобы
преобразовать Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Нет, это не так
Нет, это не так
поэтому ожидается, что любые стабильные соли Cu + будут существовать в
водный раствор.
Также может произойти диспропорционирование:
2Cu + → Cu 2+ + Cu E=0,37 В или
К=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дает комплекс
где ЭДТА оказалась пентадентатной, а НЕ гексадентатной, в отличие от
другие ионы M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана
в виде плоского квадрата или в виде искривленного октаэдра, когда упаковка в
рассматривается кристаллическая решетка. В случае с натриевой солью
отдельные блоки параллельны в ячейке с медью
связаны с атомами кислорода, координированными с медью в
единицы, расположенные как сверху, так и снизу, тогда как в
калиевой соли, единицы не параллельны и при взгляде на три
ед. центральный находится почти под прямым углом к двум другим.
Здесь медь связана с одним из некоординированных атомов кислорода.
в единицах выше и ниже его.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора
который растворяет целлюлозу. Это эксплуатируется в
промышленная подготовка района. Решения содержат
тетраммины и пентамины. С пиридином взаимодействуют только тетрамины.
сформированный например Cu(py) 4 SO 4 .
Широко изучена реакция меди(II) с аминокислотами.
Почти во всех случаях продукт содержит группы в транс
конфигурация, которая, как ожидается, будет более стабильной. В этом случае
глицина первым осаждается всегда цис-изомер .
который превращается в транс- при нагревании.
См.
Лабораторное руководство для C31L
Больше подробностей.
Аналитическое определение меди(II)
Полезный реагент для аналитического определения
ион меди(II) представляет собой натриевую соль N,N-диэтилдитиокарбамата.

 Лаб. практикум
Лаб. практикум