Типы электродов: Виды электродов для сварки – марки, технические характеристики и состав покрытия, выбор диаметра
Содержание
Основные характеристики и свойства электродов для ручной дуговой сварки
Ручная дуговая сварка используется для решения бытовых и профессиональных задач. При этом результат ее применения зависит не только от мастерства сварщика, но и от расходных материалов. В настоящее время насчитываются десятки производителей, которые выпускают различные марки электродов. По ряду признаков их можно разделить на несколько видов.
Как устроен электрод
Электрод представляет собой металлический сердечник, покрытый специальным составом, который называется «обмазкой». В процессе работы сердечник плавится и вместе с металлом изделия формирует шов. Обмазка в это же время сгорает с образованием газа, который необходим для защиты сварочной зоны от вредного влияния воздуха (речь идет прежде всего об отрицательном воздействии на расплавленный металл кислорода и азота).
Ручная дуговая сварка
Какие задачи решает электрод?
В целом электроды решают сразу несколько задач:
- Вещества, которые входят в состав покрытия, характеризуются низкой величиной потенциала ионизации.
 В результате электрическая дуга после зажигания легко насыщается свободными ионами, которые поддерживают и стабилизируют процесс горения.
В результате электрическая дуга после зажигания легко насыщается свободными ионами, которые поддерживают и стабилизируют процесс горения. - Обмазка электродов не только создает газовое облако во время сгорания, но также участвует в образовании поверх сварного шва слоя шлака. Он выполняет защитную функцию и одновременно снижает скорость охлаждения расплавленного металла. Благодаря этому создаются благоприятные условия для удаления из шва нежелательных примесей или неметаллических включений.
- Важным условием получения качественных швов является отсутствие в них кислорода. Поэтому в состав покрытия электрода входят специальные вещества – раскислители. В процессе сварки они вступают в химическую реакцию с кислородом и «связывают» его.
- Еще одна важная функция – легирование металла шва рядом элементов с целью улучшения его свойств. Для этого в состав электрода входят хром, кремний, марганец, титан и др.
Назначение электродов
Само название «электрод» возникло от двух греческих слов: elektra и hodos.Они переводятся как «электричество» и «дорога».
Виды покрытий электродов
Электродные покрытия могут иметь разный состав. От них зависит стабильность горения дуги, вязкость шлака и расплавленного металла, поведение металла при переходе в сварочную ванну и другие параметры. Насчитывается несколько видов покрытий.
Рутиловое
Основным элементом рутилового покрытия является диоксид титана. При применении таких электродов уменьшается разбрызгивание металла, повышается его текучесть и формируется обильный слой шлака, который затем легко отделяется. Швы получаются ровными, а повторное зажигание дуги заметно облегчается. При этом электроды плохо поддаются сушке и при их использовании высок риск образования пор. Они подходят для работы на постоянном и переменном токе. С помощью рутиловых электродов удобно сваривать низкоуглеродистые стали небольшой толщины.
Целлюлозное
В состав покрытия входит целлюлоза, а также ферросплавы кремния и магния. Покрытие обеспечивает повышенное газообразование при горении дуги и надежную защиту сварочной ванны. В процессе работы формируется небольшое количество быстро твердеющего шлака, что удобно при сварке вертикальных швов. При этом они имеют неэстетичный внешний вид и низкую пластичность. Кроме того, использование целлюлозных электродов сопровождается повышенной разбрызгиваемостью металла. Их применение оптимально при сварке на постоянном токе.
Покрытие обеспечивает повышенное газообразование при горении дуги и надежную защиту сварочной ванны. В процессе работы формируется небольшое количество быстро твердеющего шлака, что удобно при сварке вертикальных швов. При этом они имеют неэстетичный внешний вид и низкую пластичность. Кроме того, использование целлюлозных электродов сопровождается повышенной разбрызгиваемостью металла. Их применение оптимально при сварке на постоянном токе.
Основное
Основными элементами покрытий электродов этого вида являются карбонаты кальция и магния: магнезит, доломит или мрамор. Они обеспечивают механическую прочность, высокую пластичность и химическую чистоту металла шва. Сварочные работы могут выполняться в любых пространственных положениях. Электроды с таким видом покрытия допускается применять при изготовлении ответственных конструкций. При этом швы получаются довольно грубыми, шлак удаляется с трудом, а электрическая дуга отличается неустойчивостью. Электроды с основным покрытием больше подходят для опытных сварщиков.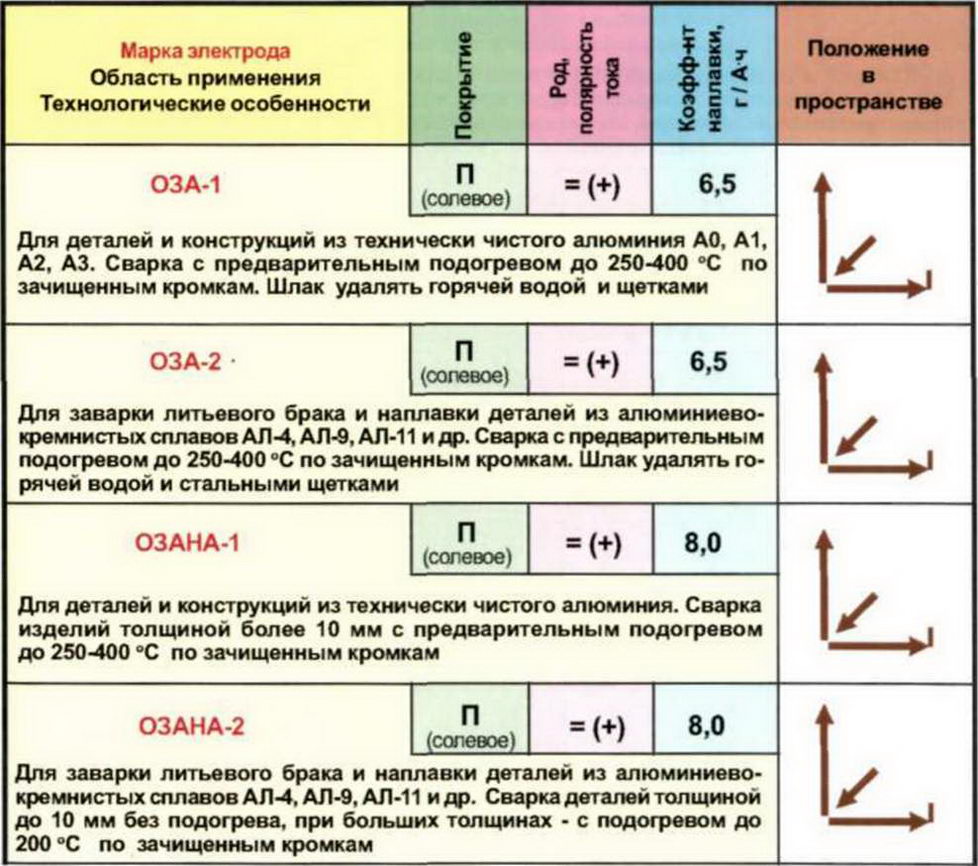 Кроме того, они отличаются высокой гигроскопичностью и легко впитывают влагу, поэтому нуждаются в особом внимании при хранении. Их использование оптимально на постоянном токе обратной полярности.
Кроме того, они отличаются высокой гигроскопичностью и легко впитывают влагу, поэтому нуждаются в особом внимании при хранении. Их использование оптимально на постоянном токе обратной полярности.
Кислое
В состав кислого покрытия входят оксиды марганца и железа. Эти элементы обеспечивают стабильность дуги и легкое отделение шлака, но металл в сварочной ванне становится слишком жидким. По этой причине электроды с кислым покрытием подходят для выполнения только горизонтальных швов. При их использовании возможно поддержание высокой скорости работы, но существует риск образования подрезов или трещин. Кроме того, электроды нельзя сушить при высокой температуре, поэтому в них может содержаться влага, ухудшающая качество швов. Дополнительно следует отметить, что кислое покрытие считается наиболее опасными для здоровья. Такие электроды можно использовать на постоянном и переменном токе.
Электроды с разным покрытием
Электроды для разных видов сталей
Для получения качественных швов химический состав сердечника электрода должен быть схож с химическим составом свариваемого металла. По этому признаку различают расходные материалы, предназначенные для сваривания углеродистых, легированных, высоколегированных, нержавеющих и жаростойких сталей, а также алюминия и чугуна. Для бытовых нужд чаще всего используются электроды из углеродистых и низколегированных сталей.
По этому признаку различают расходные материалы, предназначенные для сваривания углеродистых, легированных, высоколегированных, нержавеющих и жаростойких сталей, а также алюминия и чугуна. Для бытовых нужд чаще всего используются электроды из углеродистых и низколегированных сталей.
Пространственное положение
Насчитывается пять основных пространственных положений электродов, в которых можно вести сварочные работы:
- Нижнее горизонтальное считается самым удобным и производительным. Его частным случаем является положение «в лодочку».
- Тавровое похоже на нижнее горизонтальное, но требует большего мастерства сварщика. В этом случае возможно образование подрезов на вертикальной поверхности и наплывов на горизонтальной.
- Горизонтальное положение электрода на вертикальной поверхности считается достаточно сложным. Для его применения на практике чаще всего выполняется скос на верхней кромке соединяемых элементов.
- Вертикальные швы могут вариться двумя способами: на подъем или на спуск.
 В первом случае обеспечивается лучшее качество швов, а во втором – более высокая скорость.
В первом случае обеспечивается лучшее качество швов, а во втором – более высокая скорость. - Потолочное пространственное положение считается самым сложным. Оно не подходит для соединения тонких элементов и используется только при невозможности выполнения сварочных работ другим способом.
Производители в обязательном порядке указывают, в каких пространственных положениях с помощью электродов можно вести сварочные работы.
Пространственные положения электрода
Важность шлака
Шлак, образующийся во время ручной дуговой сварки, делится на два вида: «длинный» и «короткий». У первого вязкость при понижении температуры возрастает медленно. По этой причине электроды с покрытиями, образующими «длинные» шлаки, не подходят для сварки в вертикальных и потолочных пространственных положениях. У «коротких» шлаков вязкость возрастает значительно быстрее, поэтому они эффективно препятствуют вытеканию жидкого металла из сварочной ванны. Такой результат дают электроды с основным или рутиловым покрытием.
Такой результат дают электроды с основным или рутиловым покрытием.
Род и полярность тока
Сварочные работы могут выполняться на переменном или постоянном токе. Первый вариант менее желателен. Он приводит к повышенному разбрызгиванию расплавленного металла, а сам шов получается менее аккуратным и качественным. При использовании постоянного тока может применяться прямая и обратная полярность.
Прямая полярность
К положительному полюсу подключается деталь, а к отрицательному – держатель электрода. В этом случае большему нагреву подвергается именно деталь. По этой причине прямая полярность используется при сварке металлов, имеющих высокую температуру плавления или значительную толщину.
Обратная полярность
При применении обратной полярности деталь подключается к отрицательному полюсу, а электрод – к положительному. В этом случае больше нагревается электрод, а работа в целом выполняется в щадящем режиме. Обратная полярность оптимальна для сварки тонколистовых деталей или нержавеющей стали.
Свойства электродов
Под свойствами электродов подразумеваются три их составляющие:
- Физические свойства покрытия. К ним относятся коэффициенты объемного и линейного расширения, газопроницаемость, плотность, вязкость, теплоемкость, температура затвердевания и плавления.
- Химические свойства покрытия. Под ними подразумевается способность обмазки легировать и раскислять расплавленный металл.
- Механические свойства металла шва. К ним относятся твердость, ударная вязкость, удлинение, пластичность, коррозионная стойкость и твердость.
В каталоге или паспорте для каждой марки электродов производители указывают их наиболее важные характеристики.
Прокалка электродов
Обмазка сварочных электродов способна впитывать влагу из воздуха. В этом случае влажное покрытие горит неравномерно и плохо плавится. В результате затрудняется проведение сварочных работ, а образовавшиеся швы могут иметь дефекты в виде трещин или пор. Для выведения лишней влаги из электродов они подвергаются прокалке при определенной температуре (она указывается в документах на электроды или на упаковке) в специальных печах или в обычной бытовой духовке.
Для выведения лишней влаги из электродов они подвергаются прокалке при определенной температуре (она указывается в документах на электроды или на упаковке) в специальных печах или в обычной бытовой духовке.
Мы рассказали об основных видах электродов. Эта информация поможет вам с большей точностью подобрать необходимую марку для конкретного вида работ и получить качественные швы.
Поделитесь с друзьями:
Основные характеристики сварочных электродов. Типы обмазки
В настоящее время существует множество различных методов сварки, однако метод ручной дуговой сварки, по прежнему является наиболее удобным и востребованным.
Удобство и скорость сварочных работ, а также качество шва напрямую зависят от правильно подобранных электродов.
Выбор качественных сварочных электродов для ручной дуговой сварки, для неопытного сварщика, может стать нелегкой задачей.
Например, как определить подходящий диаметр электрода для сварки определенной толщины металла, или какой ток нужно выбрать для обеспечения качественного сварного шва?
Электрод -это. ..
..
Сварочный электрод представляет собой стержень из электропроводного материала или сварочная проволока- называемая сердечник. Сердечник обеспечивает подвод тока к свариваемому изделию и имеет специальное покрытие состоящее из порошка и клейкой массы, называемое обмазкой.
При выполнении сварочных работ стержень плавится, а обмазка при сгорании создает газовую защиту шва от негативного действия кислорода и образует защитный шлаковый слой.
Один конец стержня длинной около 3см не имеет покрытия и предназначен для зажатия в электрододержателе и обеспечения электрического контакта. Другой край немного счищается для более легкого зажигания дуги, за счет контакта с изделием.
Разновидности покрытия электродов
Существует 4 типа обмазки (покрытия):
- основная (УОНИ-13/45),
- рутиловая (АНО-4, МР-3, ОЗС-12),
- кислая,
- целлюлозная.
Существуют и смешанные типы покрытий. Для осуществления сварочных работа с использованием только постоянного типа тока- подходят электроды с основным и целлюлозным типом покрытия.
Такие электроды подходят для сваривания ответственных конструкций, для обеспечения максимального качества сварного соединения.
Целлюлозная обмазка до 50% состоит из органических компонентов, чаще всего, целлюлозы. Металлическое изделие, наплавленное такими электродами, имеет химический состав соответствующий полуспокойной или спокойной стали, но имеет повышенное содержание водорода.
Рутиловая обмазка подходит для сварки на постоянном и переменном токе. Такие электроды легко поджигаются и характеризуются низким разбрызгиванием металла. Применяются на сварочных аппаратах имеющих низкое напряжение холостого хода.
Кислая обмазка состоит из оксида железа, марганца или кремния. Сварной шов при использовании таких электродов склонен к появлению горячих трещин. Для сварки подходят аппараты с постоянным или переменным током. Использование электродов с кислой обмазкой обеспечивает легкое отделение шлака.
Существует ограничение на использование такого типа электродов в закрытых помещениях, поскольку они опасны для здоровья. Химический состав конструкционных элементов электрода имеет особое значение. Правильно подобранный состав и баланс составляющих должен быть схож с свариваемым металлом, обеспечивать низкую температуру плавления и короткий период затвердения. Именно по этому,различают электроды для: углеродистых, легированных, высоколегированных, нержавеющих, жаростойких сталей, алюминия и чугуна и различных сплавов.
Химический состав конструкционных элементов электрода имеет особое значение. Правильно подобранный состав и баланс составляющих должен быть схож с свариваемым металлом, обеспечивать низкую температуру плавления и короткий период затвердения. Именно по этому,различают электроды для: углеродистых, легированных, высоколегированных, нержавеющих, жаростойких сталей, алюминия и чугуна и различных сплавов.
Прежде чем приступать к сварке , нужно обязательно проверить нет ли механических повреждений на электродах, поскольку добиться стабильной дуги, в таком случае, не получится.
Также, обязательным условием является не превышение допустимого уровня влажности электрода.
Добиться качественного шва отсыревшими, из-за неправильного хранения электродами, Вам вряд ли удастся.
Для обеспечения сухости электродов- используют специальные печи. Но в бытовых условиях сушат и при помощи обычных духовок.
В быту, чаще всего сваривают изделия металлопроката из конструкционных сталей, причем толщина изделий обычно не велика. Выбираются жлектроды для сварки черных сталей (АНО-4, АНО-21, АНО-36, УОНИ 13/55, УОНИ 13/65 и др.)
Выбираются жлектроды для сварки черных сталей (АНО-4, АНО-21, АНО-36, УОНИ 13/55, УОНИ 13/65 и др.)
Наиболее подходящие для таких целей электроды с основной, рутиловой или смешанной обмазкой.
Опубликовано: 18.03.2016
Поделиться:
Вернуться к списку новостей
Газовый электрод, электрод из металлической соли и т. д.
Наука > Химия > Электрохимия > Типы электродов
В этой статье мы изучим различные типы электродов, их представление, написание клеточных реакций и нахождение ЭДС. клетки.
Есть
четыре типа электродов
- Газовые электроды
- Электроды на основе малорастворимых солей металлов
- Металло-ионные электроды
- Редокс-электроды
Газовые электроды:
Газовый электрод состоит из газа (например, h3, Cl2, O2), находящегося в контакте с раствором, содержащим ионы, образующиеся из газа, напр. Н+, Cl-, ОН-. Потенциал газового электрода зависит от концентрации его ионов в растворе и давления газа.
Газовый электрод состоит из газа, барботируемого вокруг инертной металлической проволоки (платинированный платиновый электрод), погруженной в раствор, содержащий ионы, с которыми газ необратим. Платина используется в качестве проводника и для адсорбции газа. например Стандартный водородный электрод.
Примеры газовых электродов:
Стандартный водородный электрод (SHE):
SHE is
представлен как
Pt| H 2(г) (1 атм.)| H + (водный)
(1 м)
Половинка
клеточные реакции:
H 2(g) → 2H + (водн.) + 2e –
(окисление) (L.H.S.)
2H + (водн.) + 2e – → H 2(g)
(уменьшение) (правая сторона)
Потенциалу электрода произвольно присваивается нуль. Этот
электрод катионный электрод.
Электрод для газообразного хлора:
Этот
электрод — анионный электрод.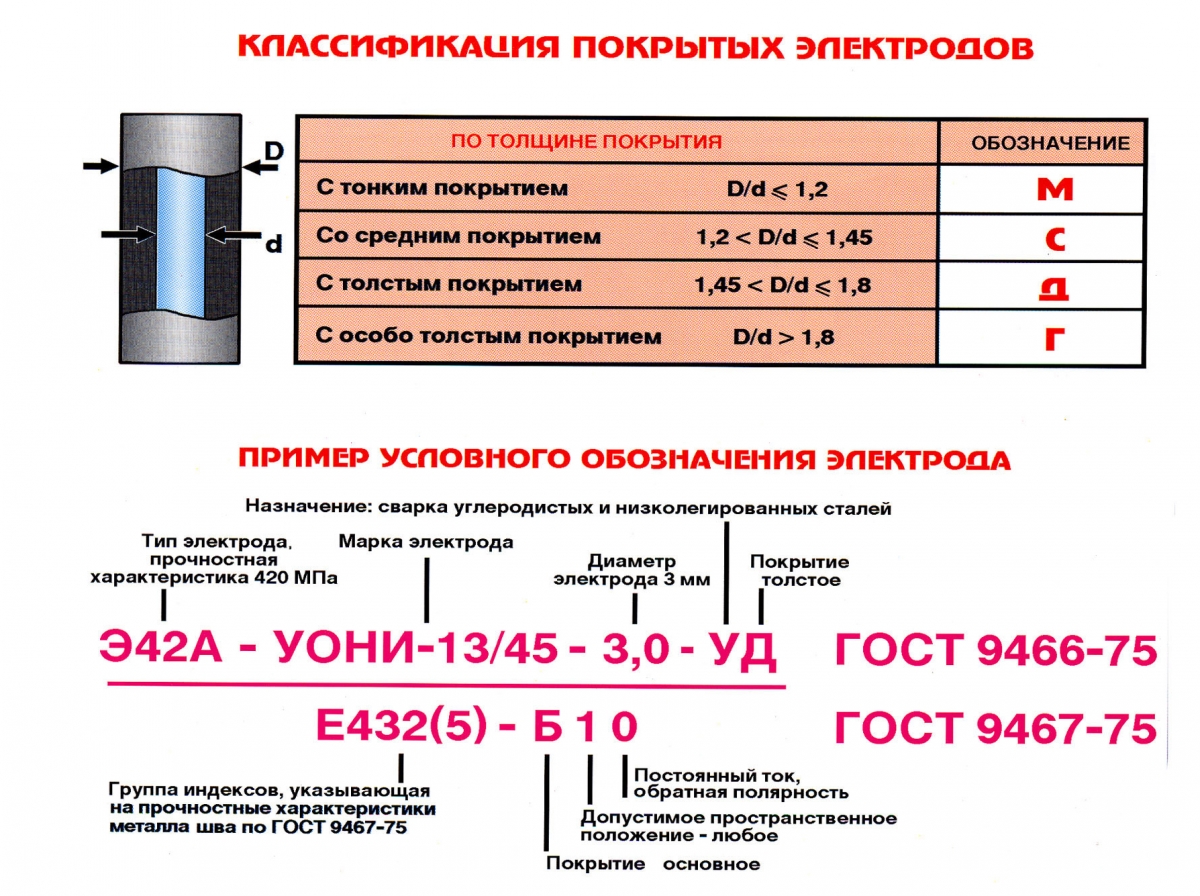 Хлоргазовый электрод представлен
Хлоргазовый электрод представлен
как,
Pt| Cl 2(г) (1 атм.)| Cl – (водный)
(1 м)
Половинка
клеточные реакции:
2Cl – (водн.) → Cl 2(г) + 2e –
(окисление) (Л.В.С.)
Cl 2(г) + 2e – → 2Cl – (водн.)
(восстановление) (R.H.S.)
Кислородный электрод:
Кислородный газ
электрод представлен как,
Pt | O 2(г) (1 атм)| ОН – (водный)
(1M)
Половинка
реакция клетки
4OH – → 2H 2 O+ O 2(g) + 4e –
(окисление) (Л.В.С.)
2H 2 O + O 2(g) + 4e – →
4OH – (восстановление) (R.H.S.)
Электрод на основе малорастворимой соли металла:
Реверсивный
анионный электрод также называют металл-умеренно растворимой солью металла.
электрод. В этом электроде металл, малорастворимая соль металла в
равновесие с раствором, содержащим тот же анион, что и труднорастворимый
соль. например Каломельный электрод.
Металлоионные электроды:
В этом случае металлическая полоса находится в контакте с раствором водорастворимого солевого катиона того же металла.
напр. Zn (с) |
Zn ++ (водный)
В
в электрохимической ячейке электрод с более высоким потенциалом окисления подвергается
окисления и действует как анод или отрицательный электрод и электрод, имеющий
меньший потенциал окисления подвергается восстановлению и действует как катод или
положительный электрод.
Примеры электродов металл-ионы металла:
Zn (s) | Zn ++ (водный)
Zn (s) → Zn ++ (водн.) +
2e – (Окисление)
Zn ++ (водн. ) + 2e – → Zn (s)
) + 2e – → Zn (s)
(Сокращение)
Cu (s) | Cu ++ (водн.)
Cu (тв.) → Cu ++ (водн.) +
2e – (Окисление)
Cu ++ (водн.) + 2e – → Cu (s)
(Уменьшение)
Окислительно-восстановительный электрод:
В этих
электродов инертный металл типа Pt погружают в раствор, содержащий ионы
активный металл в двух различных степенях окисления.
Пл | Fe 2+ , Fe 3+
Fe 2+ → Fe 3+
e – (Окисление)
Fe +++ + e –
→ Fe ++ (восстановление)
Pt | Сн 2+ , Сн 4+
Sn 2+ → Sn 4+ +
2e – (Окисление)
Sn 4+ + 2e – →
Sn 2+ (Редукция)
Запись клеточной реакции и нахождение Э. Д.С. ячейки:
Д.С. ячейки:
Окислительно-восстановительный потенциал:
Потенциал, возникающий благодаря способности ионов терять или приобретать электроны, образуя более высокую или более низкую стабильную степень окисления, называется окислительно-восстановительным потенциалом.
Редокс
потенциал зависит от соотношения концентраций двух типов ионов.
Пт | Fe 2+ (водн.) (1M), Fe 3+ (водн.) (1M) E 2 ox =
– 0,771 В
Представление ячеек, содержащих стандарт и эталон
электроды:
А ячейка
состоит из контакта цинкового стержня с 1-молярным раствором иона цинка и насыщенного
каломельный электрод.
Zn (с) | Zn 2+ (1M) || KCl (водный) (насыщенный) |
Hg 2 Cl 2(s) |Hg (л) , тел +
Ячейка состоит из SHE и насыщенного каломельного электрода
Pt | H 2(г) (1 атм)| H + (водный)
(1М) || KCl (водн. ) (насыщенный)|Hg 2 Cl 2(тв) | рт.ст. (л)
) (насыщенный)|Hg 2 Cl 2(тв) | рт.ст. (л)
,Pt +
Реакции ячеек:
Шаги для записи реакции ячейки гальванического элемента:
- Представьте данный гальванический элемент со стандартным соглашением.
- Электрод в левой части изображения показывает, что он является анодом и на этом электроде происходит окисление. Напишите для него реакцию полуклеточного окисления полуклеточную реакцию.
- Электрод в правой части изображения показывает, что он является катодом и на этом электроде происходит восстановление. Напишите для него полуклеточную реакцию восстановления полуклеточной реакции.
- Баланс выше двух реакций для электронов для реакции окисления и восстановления.
- Добавьте две реакции и получите чистую (общую) клеточную реакцию.
Шаг
– 1: Представьте ячейку условно:
Pb (s) | Pb 2+ (водн. ) (1M)
) (1M)
|| Ag + (водн.) (1M)| Ag (s) +
Шаг
– 2: Напишите реакцию полуэлемента слева: Pb(s) находится в левой части изображения.
что это анод, и окисление происходит на Pb(s) электроде.
Pb (т) → Pb 2+ (водн.)
+ 2e – (Окисление) … (1)
Шаг
– 3: Напишите реакцию правой половины ячейки: Ag (s) находится в правой части представления
показывает, что это катод и восстановление происходит при Ag (с)
электрод.
Ag + (водный) + e –
→ Ag (s) (Сокращение) … (2)
Шаг
– 4: Сбалансируйте электроны двух вышеуказанных реакций половинной ячейки:
Умножьте уравнение (2) на 2, чтобы сбалансировать электроны.
2Ag + (водный) + 2e –
→ 2Ag (s) (Сокращение) … (2)
Шаг
– 5: Складывая уравнения (1) и (3), получаем
общая реакция.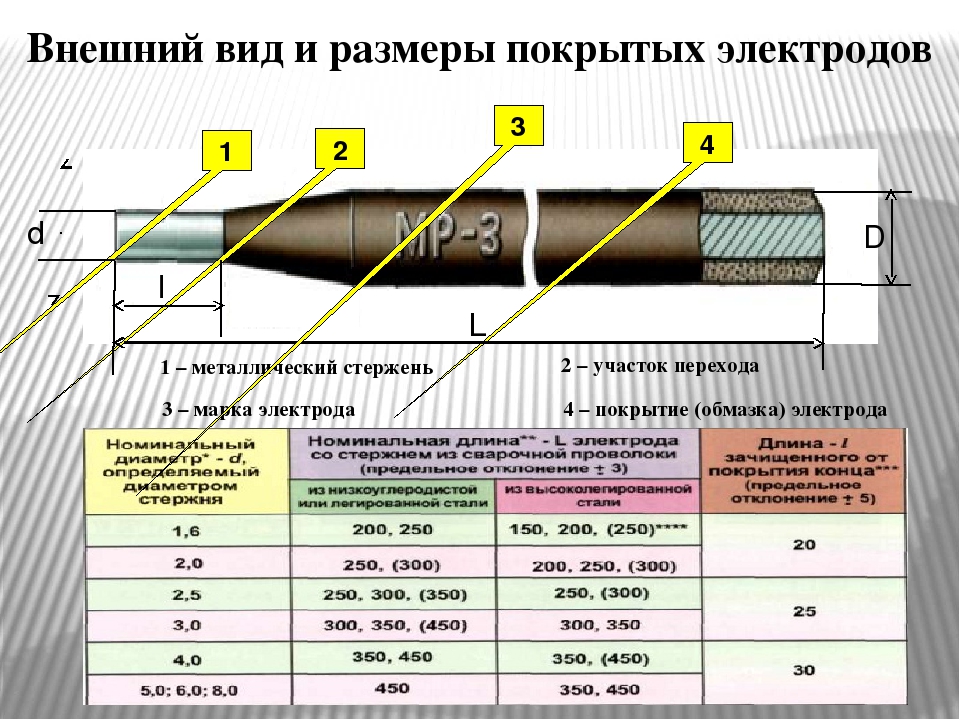
Pb (т) + Ag + (водн.)
→ Pb 2+ (водн.) + Ag (s)
Действия по нахождению ЭДС. гальванического элемента:
- Представление данного гальванического элемента в соответствии со стандартными условными обозначениями.
- Электрод в левой части изображения показывает, что он является анодом и на этом электроде происходит окисление.
- Электрод в правой части изображения показывает, что он является катодом и на этом электроде происходит восстановление.
- Получите стандартные значения потенциала окисления из электродвижущего ряда для материала катода и анода.
- Используйте следующую формулу для расчета Э.Д.С. клетки.
E o Ячейка = E o (вол/катод)
– E o (вол/анод)
ИЛИ
E o Ячейка = E o (вол/катод) 9 0040 +
E или (красный/анод)
Чтобы найти э. д.с. Daniel Cell:
д.с. Daniel Cell:
Шаг
– 1: представить ячейку условно
Шаг
– 2: Определите анод и катод: Pb(s) является
в левой части изображения видно, что это анод и окисление
происходит на Pb(s) электроде. Ag(s) находится на правой стороне
изображении видно, что это катод и восстановление происходит при
Ag(s) электрод.
Шаг
– 3: Получить значения потенциала окисления или
восстановительный потенциал для электродов из электрохимической серии
E o (ox/Zn) = 0,76 В и EE o (ox/Cu)
=-0,34 В
Шаг
– 4: рассчитать ЭДС ячейки:
E o Cell = E o (вол/катод)
– E (окс/анод)
E o Ячейка = E o (ox/Zn)
– E o (ox/Cu)
E o Ячейка
= 0,76 – (- 0,34)
E o Ячейка =
0,76 + 0,34
E o Ячейка = 1,1 В
Предыдущая тема: Электроды сравнения
Следующая тема: Теория электродного потенциала Нернта
Следующая тема:
Наука > Химия > Электрохимия > Типы электродов
Стандартные электроды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 269
Электрод по определению представляет собой точку, в которой ток входит и выходит из электролита. Когда ток покидает электроды, он известен как катод, а когда ток входит, он известен как анод. Электроды являются жизненно важными компонентами электрохимических элементов. Они переносят произведенные электроны из одной полуэлемента в другую, что создает электрический заряд. Этот заряд основан на стандартной электродной системе (SHE) с эталонным потенциалом 0 вольт и служит средой для любого расчета потенциала клетки.
Когда ток покидает электроды, он известен как катод, а когда ток входит, он известен как анод. Электроды являются жизненно важными компонентами электрохимических элементов. Они переносят произведенные электроны из одной полуэлемента в другую, что создает электрический заряд. Этот заряд основан на стандартной электродной системе (SHE) с эталонным потенциалом 0 вольт и служит средой для любого расчета потенциала клетки.
Что такое механика электрода?
Какие процессы происходят?
Электрод представляет собой металл, поверхность которого служит местом, где устанавливается окислительно-восстановительное равновесие между металлом и тем, что находится в растворе. Электрод может быть анодом или катодом. Анод получает ток или электроны из смеси электролитов, таким образом окисляясь. Когда атомы или молекулы подходят достаточно близко к поверхности электрода, раствор, в который помещен электрод, отдает электроны. Это заставляет атомы/молекулы становиться положительными ионами.
С катодом происходит обратное. Здесь электроны высвобождаются из электрода, а раствор вокруг него восстанавливается.
Из чего сделан электрод?
Электрод должен быть хорошим проводником электричества, поэтому обычно это металл. То, из чего сделан этот металл, зависит от того, участвует ли он в реакции. Для некоторых реакций требуется инертный электрод, который не участвует. Примером этого может быть платина в реакции SHE (описанной ниже). В то время как в других реакциях используются твердые формы реагентов, что делает их электродами. Примером этого типа ячейки может быть:
(левая сторона — анод) Cu(s)|Cu(NO 3 ) 2 (водн.) (0,1M)||AgNO 3 (водн.) (0,01M)|Ag(s) ( правая сторона — катод)
(В приведенной выше схеме ячейки: внешние компоненты — это электроды для реакции, а внутренние части — это растворы, в которые они погружены)
Здесь вы можете видеть, что твердая форма реагента, используется медь. Медь, как и серебро, участвует в качестве реагентов и электродов.
Медь, как и серебро, участвует в качестве реагентов и электродов.
Примеры электродов
Некоторые обычно используемые инертные электроды: графит (углерод), платина, золото и родий.
Некоторые обычно используемые реактивные (или вовлеченные) электроды: медь, цинк, свинец и серебро.
Стандартный водородный электрод
Стандартный водородный электрод (SHE) — это электрод, который ученые используют для сравнения во всех реакциях с потенциалом полуэлемента. Значение стандартного электродного потенциала равно нулю, что составляет основу, необходимую для расчета клеточных потенциалов с использованием разных электродов или разных концентраций. Важно иметь этот общий эталонный электрод так же, как для Международного бюро мер и весов важно иметь запечатанный кусок металла, который используется для ссылки на килограмм СИ.
Из чего сделана ОНА?
SHE состоит из 1,0 М раствора H + (водный), содержащего квадратный кусок платинированной платины (соединенный с платиновой проволокой, где возможен обмен электронами) внутри трубки.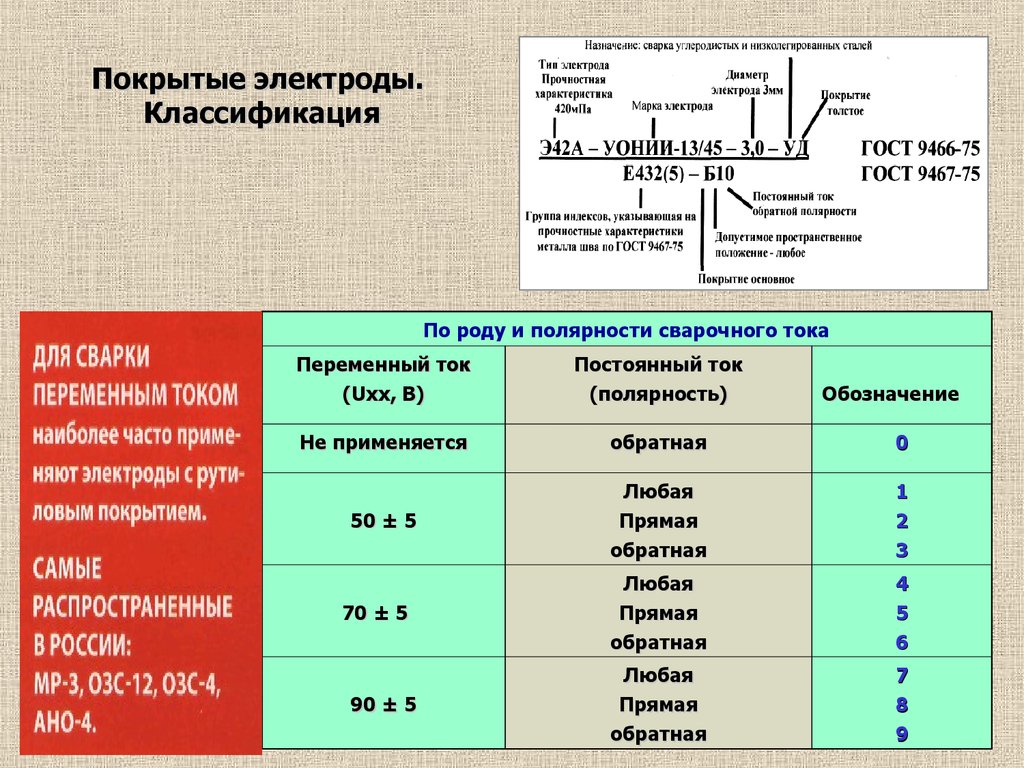 Во время реакции газообразный водород затем пропускают через трубку в раствор, вызывая реакцию:
Во время реакции газообразный водород затем пропускают через трубку в раствор, вызывая реакцию:
2H + (водн.) + 2e — <==> H 2 (г).
Платина используется, потому что она инертен и мало реагирует с водородом.
Что происходит в этом процессе?
Сначала начальный разряд позволяет электронам заполнить самый высокий занятый энергетический уровень Pt. При этом часть ионов H+ образует ионы H 3 O + с молекулами воды в растворе. Эти ионы водорода и гидроксония затем подходят достаточно близко к платиновому электроду (на платинированной поверхности этого электрода), где водород притягивается к электронам в металле и образует атом водорода. Затем они объединяются с другими атомами водорода, чтобы создать h3(g). Этот газообразный водород выпускается из системы. Чтобы реакция продолжалась, к электроду требуется постоянный поток H 2 (г). Провод Pt подключен к аналогичному электроду, в котором происходит противоположный процесс, создавая заряд, который соответствует 0 вольт. Другие стандартные электроды обычно предпочтительнее, потому что электрод SHE может быть сложным в настройке. Трудность возникает при подготовке платинированной поверхности и контроле концентрации реагентов. По этой причине SHE называют гипотетическим электродом.
Другие стандартные электроды обычно предпочтительнее, потому что электрод SHE может быть сложным в настройке. Трудность возникает при подготовке платинированной поверхности и контроле концентрации реагентов. По этой причине SHE называют гипотетическим электродом.
Трехэлектродная система
Трехэлектродная система состоит из рабочего электрода, электрода сравнения и вспомогательного электрода. Трехэлектродная система важна в вольтамперометрии. Все три электрода служат уникальному валку в трехэлектродной системе. Электрод сравнения относится к электроду, который имеет установленный электродный потенциал. В электрохимической ячейке электрод сравнения можно использовать как полуячейку. Когда электрод сравнения действует как полуячейка, можно определить электродный потенциал другой полуячейки. Вспомогательный электрод — это электрод, который следит за тем, чтобы ток не проходил через эталонную ячейку. Это гарантирует, что ток равен току рабочего электрода. Рабочий электрод — это электрод, который переносит электроны к присутствующим веществам и от них.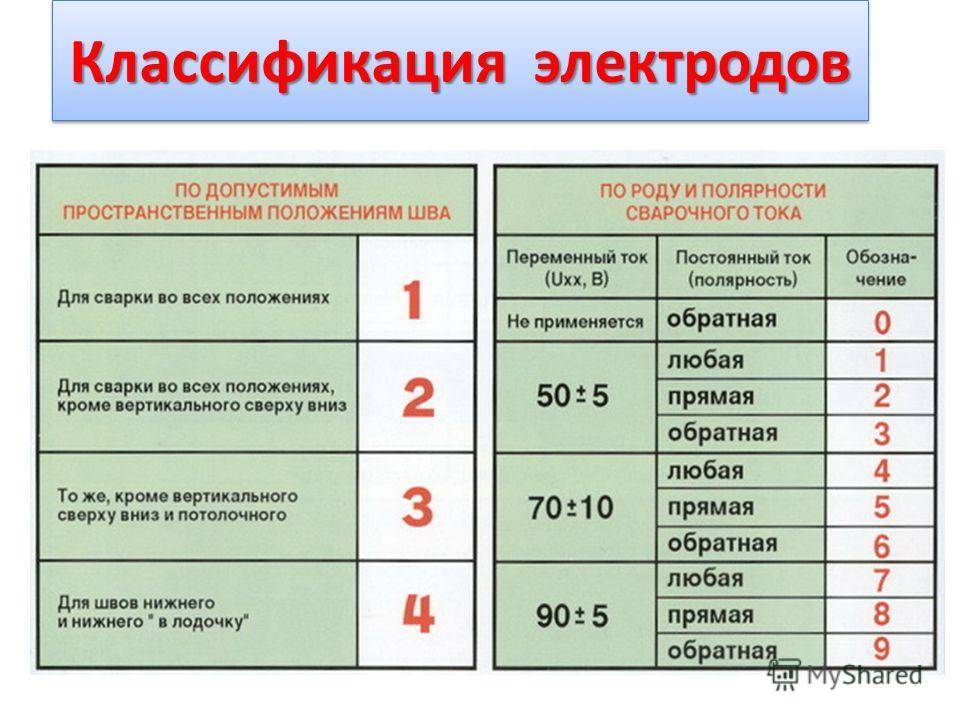 Вот некоторые примеры эталонных ячеек:
Вот некоторые примеры эталонных ячеек:
Каломельный электрод: Этот электрод сравнения состоит из молекул ртути и хлорида ртути. Этот электрод может быть относительно проще в изготовлении и обслуживании по сравнению с SHE. Он состоит из твердой пасты Hg 2 Cl 2 и жидкой элементарной ртути, прикрепленной к стержню, погруженному в насыщенный раствор KCl. Необходимо, чтобы раствор был насыщенным, так как это позволяет фиксировать активность хлоридом калия, а напряжение быть ниже и ближе к СВЭ. Этот насыщенный раствор позволяет происходить обмену ионами хлора. Все это обычно помещают внутрь трубки с пористым соляным мостиком, позволяющим электронам течь обратно и замыкать цепь. 9-_{(водн.)}\]
Серебряно-хлоридный электрод : Электрод такого типа осаждает в растворе соль, которая участвует в электродной реакции. Этот электрод состоит из твердого серебра и его осажденной соли AgCl. Это широко используемый электрод сравнения, потому что он недорогой и не такой токсичный, как каломельный электрод, содержащий ртуть. Серебряно-хлоридный электрод изготавливается путем взятия проволоки из твердого серебра и кодирования ее в AgCl. Затем его помещают в пробирку с раствором KCl и AgCl. Это позволяет образовываться ионам (и наоборот) по мере того, как электроны втекают и выходят из системы электродов. 9-_{(aq)}\]
Серебряно-хлоридный электрод изготавливается путем взятия проволоки из твердого серебра и кодирования ее в AgCl. Затем его помещают в пробирку с раствором KCl и AgCl. Это позволяет образовываться ионам (и наоборот) по мере того, как электроны втекают и выходят из системы электродов. 9-_{(aq)}\]
Ссылки
- Айвз, Дэвид Дж. Г. и Джордж Джон. Янц. «2. Водородный электрод». Электроды сравнения. Нью-Йорк [usw.]: Acad. Пр., 1961. Печать.
- Аллманд, А., и Гарольд Иоганн Томас. Эллингем. «Глава 4: Электролизная ванна». Принципы прикладной электрохимии, . Нью-Йорк: Лонгманс, Грин, 1924. Печать
- Стандартный водородный электрод: искаженная концепция, http://pubs.acs.org/doi/pdf/10.1021/ed050p604
.
Задачи
1. Какой электрод окисляет раствор в полуэлементе? Анод или катод?
2. Почему стандартный водородный электрод важен для расчета потенциалов клеток?
3. Определите, какая сторона является катодом, а какая анодом.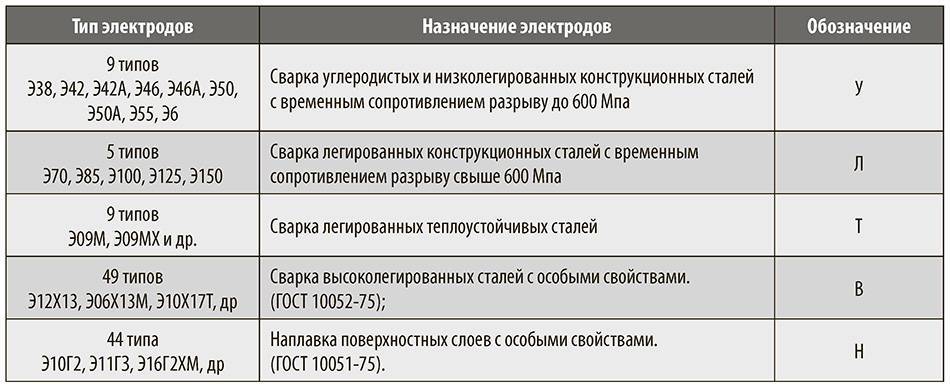
Ag(s) | Ag+(водн.)(0,5M) || Ag + (водн.) (0,05M) | Ag(s)
4. Почему важно использовать инертный электрод в ситуациях, подобных SHE?
5. Каков стандартный потенциал полуэлемента для SHE?
Ответы (выделите, чтобы увидеть):
1. Анод
2. Важен при расчете потенциалов полуэлементов, т.к. служит ориентиром. Без этого электрода не было бы основы для расчета значений клеточных потенциалов.
3. Левый — анод, правый — катод.
4. В этой ситуации важно использовать инертный электрод, потому что он не будет реагировать или участвовать в реакции в ячейке, а только обеспечит площадь поверхности для протекания реакции.
5. 0 вольт.
Авторы и ссылки
- Майкл Девендженцо (UCD)
Standard Electrodes распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- нет на странице
- Теги


 В результате электрическая дуга после зажигания легко насыщается свободными ионами, которые поддерживают и стабилизируют процесс горения.
В результате электрическая дуга после зажигания легко насыщается свободными ионами, которые поддерживают и стабилизируют процесс горения.