Аффинаж никеля в домашних условиях: Аффинаж никеля в домашних условиях. Никелирование в домашних условиях (химическое и гальваническое). Растворы для серебрения
Содержание
Аффинаж золота в домашних условиях из радиодеталей
- Суть аффинажа золота
- Места для проведения
- Процесс аффинажа золота в домашних условиях
- Способы аффинажа золота
- Способ извлечения золотого металла из карт памяти
Золото привлекает многих людей – это легко объясняется его свойствами и эстетикой, обуславливающими высокую стоимость. Но мало кто знает, что некоторое его количество имеется в домашней электронике, микросхемах и картах памяти. Процесс добычи «жёлтого металла» из радиодеталей называется аффинаж золота, в домашних условиях он может выполняться несколькими способами.
Суть аффинажа золота
По своей сути аффинаж золота – это его очистка от всего лишнего. Например, золото 585 пробы в реальности содержит всего 58,5% «жёлтого металла», а остальное – примеси, добавленные для придания изделию нужных свойств (прочности, цвета). Цель проведения очистки драгметалла – выделение из него всех имеющихся примесей и получение золота 999,9 пробы (99,9%).
Аффинаж золота в домашних условиях
Места для проведения
Аффинаж золота может проводиться несколькими способами, в большинстве которых используются различные опасные для здоровья человека процедуры и вещества, такие как кислота. Поэтому настоятельно рекомендуется выполнять его только знающим людям и желательно в лабораториях. Аффинаж в домашних условиях также может проводиться, но только с соблюдением всех мер безопасности.
Аффинаж золота в лаборатории
Процесс аффинажа золота в домашних условиях
Аффинаж золота, проводимый дома, требует обустройства рабочего места. Обязательно наличие вытяжного шкафа и средств защиты кожи. Предварительно придётся приготовить все необходимые инструменты и реактивы.
Сырьё
В качестве сырья для очистки золота могут служить:
Золотосодержащий лом подойдет в качестве сырья для аффинажа
- Золотосодержащий лом – технологический или из ювелирных изделий.
- Концентраты, полученные на приисках добычи золота.

- Шламы, полученные в процессе электролитической очистки цветных металлов (медь, никель, цинк и т. д.).
- «Серебристая пена», полученная на свинцовых заводах посредством проведения процесса Паркесса.
- Разнообразные элементы электроники – микросхемы, транзисторы, карты памяти и другие.
Чаще всего в домашних условиях золото добывается из компьютерных материнских плат и всевозможных радиодеталей.
Подготовка
Любой материал, выбранный в качестве сырья для выделения из него золота, должен быть предварительно подготовлен. Подготовка может заключаться в измельчении или дроблении сырья, сплавления его с цинком или обжига.
Подготовка к аффинажу — распайка телефонных плат
Приспособления
Для извлечения золота дома пригодятся:
- Специальный тигель – сосуд, предназначенный для нагрева, обжига или сжигания чего-нибудь на сильном огне и расплавления металлов.
- Прочный и удобный пинцет для переноса (например, цинка в золото).
- Титановая палочка, трёхмиллиметровая по толщине.
- Стальная спица, чтобы помешивать раствор.
- Термостойкая колба (из огнеупорного стекла).
- Электрическая спиральная плитка, требуется для нагрева золотосодержащего раствора или кислот.
- Горелка, необходимая для плавки металлов.
- Ёмкость, марля, бумага для фильтрации и колпак с отверстием снизу.
Реактивы
Очищать золото можно разными методами, для которых могут пригодиться следующие химические вещества:
- Царская водка (ЦВ), представляющая собой специальную смесь из концентратов двух кислот (азотной и соляной) в соотношении 1:3 – 1 часть HNO3, азотная кислота (65-68%) и 3 части HCl, соляная кислота (32–35%).
- Медь, которая будет служить разрыхлителем (при наличии в золоте серебра).
- Хлорид олова – необходим для проведения восстановления.
- Цинковые элементы (6*6*6 мм).
- Железный купорос.
- Хлор или калиевая селитра – применяется в сухом методе.

- Хлорид натрия, который нужен для разрушения хлорида золота.
- Цианид натрия – пригодится для выщелачивания «жёлтого металла».
- Дистиллированная и обычная вода.
Выбор веществ обуславливается способом проведения аффинажа.
Способы аффинажа золота
На сегодняшний день найдено много методов проведения аффинажа золота, основными из которых являются сухой, мокрый и химический.
Сухой
В данном методе для очистки золота используется калиевая селитра либо хлор. Сырьё предварительно подготавливается, а затем обжигается в тигле (предпочтительно керамическом). Постепенно туда засыпается селитра (пока не кончится реакция с примесями). Для удаления цинка и других сопутствующих металлов необходимо использовать тетраборат натрия (буру). Очистка хлором осуществляется в соответствии с методикой Миллера.
Сырьё предварительно подготавливается, а затем обжигается в тигле (предпочтительно керамическом). Постепенно туда засыпается селитра (пока не кончится реакция с примесями). Для удаления цинка и других сопутствующих металлов необходимо использовать тетраборат натрия (буру). Очистка хлором осуществляется в соответствии с методикой Миллера.
Аффинаж золота сухим способом
Мокрый
Золотой лом перерабатывается посредством добавления других металлов, диктующих выбор способа очистки. Наличие серебра ведёт к тому, что золотой лом перестаёт растворяться в смеси азотной и соляной кислот. Для разрыхления необходимо добавлять медь. По мокрой технологии может проводиться выщелачивание золота, для чего применяется цианид натрия.
Набор ингредиентов для мокрого аффинажа золота
Химический
Данный способ подразумевает добычу «жёлтого металла» из всевозможных остатков деятельности в лабораториях и промышленности. Для получения золотого осадка в хлоридном растворе могут применяться сернистый газ, этанол, щавелевая кислота или муравьиная кислота.
Другие методы
Кроме основных методов, перечисленных выше, стоит упомянуть и другие, не менее эффективные, такие как:
- Кратование – добыча драгоценного металла путём кипячения технических остатков в азотной кислоте, промывки и сплавления золотых частиц.
- Выделение из хлористого золота – требуется много реагентов, так как процесс требует внедрения постороннего неблагородного металла.
- Переработка золотосодержащих шлифовальных порошков.
- Электролиз (обычно применяется для очистки драгоценного металла высоких проб – выше 900).
Электролиз золота
В домашних условиях
Дома можно осаждать драгоценный металл используя цинк, железный купорос или хлорное олово.
Использование цинка подразумевает следующие шаги:
Реактивы для аффинажа золота в домашних условиях
- Высушить и накалить тигель.
- Расплавить золотое сырьё, добавив в него буру и поместив в тигель титановую палочку.

- Прибавить к сырью поочерёдные цинковые кусочки, помещая последующий только после расплавления предыдущего.
- Цинк разрыхлит сырьё и поможет примесям выйти из сплава.
- Полученный материал необходимо измельчить, накрыв тканью, высыпать в огнеупорную колбу и поставить на плиту.
- Влить в колбу смесь азотной и соляной кислоты (царскую водку), но не более 200 мл.
- Тщательно промыть осадок водой, с небольшим количеством которой перелить в марлю, посыпать тетраборатом натрия (бурой).
- Марлю завернуть в комок, покрыть фильтровальной бумагой, вернуть в тигель, ещё раз посыпать бурой.
- Накрыть всё колпаком и держать на плите до полного истлевания бумажно-марлевого комка.
- Полученный кусочек металла прокипятить в течение 5 минут в растворе.
- Промыть водой.
Железный купорос применяется следующим образом:
- К золотому сырью добавляют соляную кислоту, нагревают всё и добавляют азотную кислоту.
- Фильтруют, промывают в соляной кислоте, оставляют на день, выпаривают серной кислотой.

- В полученный раствор добавляют немного соляной кислоты и сернокислое железо, которое нужно для выделения золотого осадка.
Позолоченный металл до и после помещения в реактив
Хлорное олово используется так:
- Его соединяют поровну с соляной кислотой и водой, добавляют в золотосодержащую смесь.
- После появления реакции требуется оставить раствор на день для осаждения «жёлтого металла».
- Убрать мутность окраса осадка можно его кипячением в соляной кислоте.
Способ извлечения золотого металла из карт памяти
Драгметалл дома часто добывают из карт памяти и материнских плат. В этом случае аффинаж золота проводят в следующей последовательности:
Количество разных драгметаллов, в том числе, золота, в мобильном телефоне
- Подготавливается материал – срезаются позолоченные контакты (должно быть около 0,5 кг).
- 4 доли соляной кислоты совмещают с 1 долей перекиси водорода.
- Складывают материал в стеклянную ёмкость и заливают раствором.

- Оставляют для отделения позолоты, которая оседает на дно полностью уже через 24 часа.
- Ещё через 48 часов раствор сливают, фильтруют, растворяют в царской водке.
- Для осаждения золотых частиц используется смесь пиросульфита натрия и дистиллированной воды.
- Полученный осадок сплавляют в тигле посредством горелки (должен получиться кусочек весом примерно 2,9 гм).
Видео по теме: Простой способ извлечения золота
Мы старались для Вас!
Оцените статью
(25 оценок, среднее: 4,04 из 5)
Загрузка. ..
..
или
Расскажите о ней
Особенности аффинированных драгоценных металлов
Аффинаж – это металлургический процесс очистки или разделения благородных драгоценных металлов и дополнительных примесей. Они также называются лигатуры и могут содержать в себе частички серебра, меди, цинка, никеля.
Найти золото можно не только в шахтах, но и на ювелирных производствах, которые занимаются изготовлением драгоценных украшений. Самая большая часть материала находится в отходах производства, таких как пыль после шлифовки и галтовки. Здесь смешивается золотая пыль, остатки пасты для полировки, ворс и крошка со шлифовочных кругов. Кроме этого, для рафинирования (очистки) используют лом драгметаллов и отходы производства.
Аффинаж особо больших партий добытого из недр земли золота, производят на больших предприятиях, где профессиональное оборудование позволяет это делать в крупных масштабах. Очистка небольшого количества золота также может проводиться в небольших ювелирных мастерских или в домашних условиях. Домашнее рафинирование небезопасно и поэтому все-таки стоит обратиться к специалистам.
Домашнее рафинирование небезопасно и поэтому все-таки стоит обратиться к специалистам.
Что значит понятие аффинаж?
Аффинаж (Affinage, что значит «очищать») – это процесс очистки благородных металлов от примесей в промышленных масштабах.
Соответственно, аффинированные драгметаллы — это элементы, полученные одним из этих методов. Некоторые способы аффинажа драгоценных металлов осуществимы в домашних условиях.
В качестве сырья применительно для частного сектора используется электро- и радиооборудование, потерявшие практическое применение, позолоченные предметы: часы, бижутерия и т.д.
Серебро можно аффинировать даже из битых елочных игрушек. Однако главным предметом охоты являются различные транзисторы, реле, резисторы, микросхемы и т.п.
Причем в приоритете изделия эпохи развитого социализма, так как в Союзе не жалели драгметаллы на благие цели. Особенно для оборудования, предназначенного для «оборонки».
Несмотря на то, что условия современной экономики диктуют производителям высокоточного оборудования минимальный расход драгметаллов, из 1 тонны утилизированных мобильных устройств можно аффинировать 1 кг серебра и около 150 г золота.
Из килограмма потерявших практический интерес компьютерных процессоров можно «добыть» 4 – 12 г «желтого» металла 999,9 пробы. Для сравнения, предприятие, занимающееся аффинажем в промышленных масштабах, извлекает из 1 т руды всего 5 г золота.
Метод очистки металла: в чем суть
Аффинаж требует наличия специального оборудования. Обычно процессы организованы в заводских условиях, а очистка пошаговая. Материал обрабатывается химически, затем шлифуется, очищается высококонцентрированными составами. В Москве методы очистки металлов актуальны при работе в заводских условиях. Правильная организация процесса гарантирует достижение заданного уровня чистоты конечного продукта.
Для аффинажа исходным материалом служит приисковый концентрат, лом драгоценных изделий. Чтобы подготовить металл, его соединяют при высокой температуре с цинком, затем дробят и обжигают. Технология первичной очистки реализуется сухим, мокрым способом, электролизом. Электролитические процессы сузили область применения остальных методов. Расположены многие заводы с оборудованием для электролитических методов очистки металлов в Москве.
Расположены многие заводы с оборудованием для электролитических методов очистки металлов в Москве.
Можно использовать лом украшений, техники, возвратные отходы. Обрабатывают растворы, радиодетали, порошки, золу, проволоку, аккумуляторы, кино-, фотопленку, катализаторы, шлаки. Сырьем используют получающийся в результате электротехнической очистки шлам, серебряные оксидные соединения, цианистое, бромистое, сернистое серебро.
Какие драгметаллы можно аффинировать?
За счет фундаментальных принципов аффинажа, соответствующего оборудования и реагентов можно получить вторичные драгоценные металлы (ВДМ) высокой пробы.
Реестр благородных металлов, которые можно получить путем очистки от посторонних примесей – других сплавов, полимеров и т.д., выглядит следующим образом:
- золото;
- серебро;
- платина;
- палладий;
- тантал;
- осмий;
- иридий.
Благодаря сравнительно простой технологии очистки и доступности сырья, наиболее популярны в народе первые два драгметалла.
Реже аффинируют платину и палладий из-за сложности процесса очистки и последующей реализации.
Все перечисленные металлы, за исключением технического серебра — дорогостоящие элементы. При владении информацией, как осуществить аффинаж в домашних условиях, каких радиодеталях или другом сырье находится наибольшее количество редкоземельных элементов, рециклинг может приносить неплохой доход.
О содержании драгметаллов в радиодеталях мы рассказывали тут. Также вам пригодится статья о том, как произвести аффинаж радиодеталей в домашних условиях. Желающим заняться снятием серебра с контактов пригодится этот материал.
Перспективы развития отрасли
Не только ювелирные мастерские и домашние умельцы испытывают потребности в высокочистых драгоценных металлах. Последним, кстати, важно не забывать, что при аффинаже золота и продаже результатов химических превращений могут возникнуть разногласия с действующим законодательством, поэтому так важно не переступать грани дозволенного…
Петербургский Монетный двор, открытый в 1724 году по инициативе и при деятельном участии Петра I, был в России того времени первым аффинажным предприятием, а сегодня эта цифра вплотную приблизилась к десяти. Большинство заводов работают с золотом, добытым на рудниках, и в число их клиентов входят крупнейшие отечественные золотодобытчики. Существенными критериями для выбора аффинажного завода являются:
Большинство заводов работают с золотом, добытым на рудниках, и в число их клиентов входят крупнейшие отечественные золотодобытчики. Существенными критериями для выбора аффинажного завода являются:
- уровень производственной дисциплины,
- грамотный документооборот,
- короткие сроки выполнения работ,
- высокий процент извлечения золота,
- доступность цен.
Для этого предприятиям необходимы грамотные долгосрочные стратегии, предполагающие уменьшение себестоимости аффинажа. Сюда же относится и расширение рамок сырьевой базы, внедрение инновационных энергосберегающих технологий, модернизация отсталых участков. Это не только позволит отвечать запросам самых требовательных заказчиков, но и наращивать золотовалютный запас страны.
Способы и реагенты
Существует несколько методов извлечения ВДМ из первоначального сырья: электролиз, «сухой» и «мокрый» способ. Рассмотрим коротко эти варианты.
Электролиз
Данный способ изъятия ВДМ с помощью электролитов из утилизированного сырья применяется, как правило, для аффинирования золота и серебра путем осаждения благородных металлов на катоде с образованием примесей (шлама).
С экономической точки зрения электролиз — это самый рентабельный вариант «добычи» ВДМ.
Кроме этого, к его преимуществам относятся высокая степень очистки драгметаллов (золото не ниже 999,9 пробы), экологическая чистота и безопасность, возможность получить ВДМ платиновой группы как побочный продукт.
В качестве реагентов используются соляная или серная кислота, чистая аптечная бура для последующего плавления слитков ВДМ.
Мокрый способ
Этот процесс очистки с одинаковым успехом используется для «добычи» золота, платины, а также металлов платиновой группы (палладий, иридий и т.д.) путем растворения элементов в «царской водке» с последующим осаждением различными реагентами.
К данному методу относится вытравливание золота из обедненных руд цианидом, то есть, по сути, жидкостная экстракция.
Состав «царской водки»: концентрированная соляная и азотная кислота в соотношении 3:1. Для осаждения ВДМ используются: нитрат аммония, аммиак, йод, сахар, пищевая сода и другие реагенты. Цинк или медь применяются в качестве разрыхлителя.
Цинк или медь применяются в качестве разрыхлителя.
Сухой метод
Этот вариант аффинажа, который также называют «методом Миллера», заключается в воздействии на расплавленное сырье хлором. В процессе все неблагородные элементы преобразуются в соли (хлориды) с последующим испарением.
Одновременно с этим соли серебра всплывают на поверхность золота, пребывающего в расплавленном виде.
Это существенно облегчает последующую обработку, так как примеси серебра препятствуют аффинажу по мокрому методу из-за нерастворимости этого элемента в «царской водке».
На выходе получается золото 996,5 пробы, серебро (после восстановления из хлорида) 999,0.
Любой из озвученных выше вариантов добычи ВДМ подразумевает работу с летучими ядовитыми химикатами. В том числе, наименее опасный способ, которым является электролиз. Поэтому техника безопасности – краеугольный камень аффинажа.
Все работы необходимо осуществлять в хорошо проветриваемом помещении, в идеале – в вытяжном шкафу или на свежем воздухе.
Также обязательны средства индивидуальной защиты – прорезиненные перчатки, фартук, респиратор, очки.
Электролиз и метод Миллера
Второй способ аффинирования золота — электролитический, его применяют крупные производства с большими объёмами переработки. Анодом для электролиза служит очищаемое золото массой до 2 кг, а катодом — золотая жесть толщиной от 0,1 до 0,25 мм, изготовленная из чистого металла методом прокатки и рифлёная для жёсткости на специальном прессе.
Реакция происходит в смеси растворов соляной кислоты и хлорного золота, для чего используются небольшие фарфоровые или винипластовые ванны ёмкостью от 20 до 65 литров. Их устанавливают в водяных банях, что позволяет поддерживать температуру электролита от 50 до 60 °C. Раствор перемешивается сжатым воздухом методом барботирования, а выделяющийся во время реакции хлор удаляется посредством вытяжки. Золото осаждается на катоде в виде блестящей плёнки, скорость процесса зависит от плотности используемого тока.
Ещё один промышленный способ аффинажа — метод Миллера, использующий ядовитый газообразный хлор. Он применяется, если нужно удалить серебро из золотых сплавов и для получения золота из материалов природного или искусственного происхождения, имеющих малый процент содержания драгметалла. Измельчённое сырьё, имеющее большое количество посторонних примесей, при обработке парами хлора в первую очередь расстаётся металлами, которые слабее по окислительным способностям.
Сначала в реакцию хлорирования вступают цинк и железо, затем сурьма и олово, далее — медь и свинец. Последними в этом списке находятся серебро и золото. Преимуществом метода является отсутствие иных химических реагентов, кроме хлора, и малые габариты реактора (от 1,0 до 1,5 м).
Существенный недостаток — высокая опасность отравления образующимися летучими соединениями. Например, хлорид ртути (сулема) — опаснейший нейротоксин, накапливаясь в человеческом организме, не выводится и медленно его убивает.
Оборудование
Для различных способов очистки ВДМ потребуется соответствующее оборудование.
Предлагаем примерный список того, что обязательно найдет применение:
- прочный большой пинцет, который понадобится для погружения в расплавленную субстанцию кусочков сырья и выемки элементов ВДМ;
- для размешивания необходима длинная, 2-, 3-милимметровая по толщине металлическая спица;
- лабораторная колба объемом не менее 500 мл, обладающая жаростойкими характеристиками;
- электроплитка, оборудованная закрытой спиралью;
- тигли – керамические емкости для плавки ВДМ;
- колпак с отверстием в нижней части, который нужен для накрывания сырья, содержащего ВДМ во время прокалки в тигле непосредственно перед процедурой плавления;
- фарфоровая посуда, химическая воронка и т.д.
Все перечисленное выше оборудование можно приобрести в специализированных магазинах для ювелиров.
На тему аффинажа различных элементов вы можете прочесть следующие статьи:
- Аффинаж золота.

- Аффинаж серебра.
- Аффинаж платины.
- Аффинаж палладия.
Цена и места приема ВДМ
Следует сразу оговориться: на территории РФ реализация ВДМ – противозаконное деяние (ст. 192 УК РФ), которое несет административное наказание (штраф). Если речь идет о крупных размерах, тогда грозит реальный срок (до 5 лет). Однако закон не состоятелен. Что это означает?
Дело в том, что в статье оговаривается приоритетность государства в плане скупки аффинированных драгметаллов у субъектов в том случае, если оно (государство) осуществило инвестиции — то есть авансировала структуры, вид деятельности которых заключается в рециклинге вторичного сырья.
Другими словами, если факт инвестирования не имел места быть, субъект может реализовывать аффинированные драгметаллы кому угодно.
На счет «кому угодно», целесообразней продавать ВДМ лицензированным организациям, а не разнообразным теневым структурам: скупкам, ломбардам и т. п. Именно официальные организации дадут справедливую цену.
п. Именно официальные организации дадут справедливую цену.
Говоря о стоимости драгметаллов, стоит упомянуть о взлете котировок на золото вначале 2021 года. Однако радость инвесторов продлилась недолго – вскоре ранок рухнул, а вслед за золотом упали котировки на другие драгметаллы.
Картину текущего состояния цен на драгметаллы, в том числе и аффинированные, предлагаем в таблице.
| Название металла | Стоимость на мировом рынке за грамм (USD) | Цена за грамм, установленная Центробанком РФ (RUB) |
| Золото | 39,92 | 2 234 |
| Серебро | 0,58 | 32,49 |
| Платина | 30,38 | 1700,22 |
| Палладий | 25,62 | 1422,94 |
Более подробно том, какова цена на аффинированные драгоценные металлы и куда из можно сдать, мы рассказывали здесь.
Вывод
Знание способов аффинажа, а также первоначального сырья, которое содержит в себе драгметаллы в том или ином процентном соотношении, способствуют рентабельности процессов очистки ВДМ.
Главное — соблюдать технику безопасности и дружить с законодательством, если речь идет о последующем сбыте редких элементов. Кроме этого, чтобы не терять «кровные» на серых схемах теневых структур, которые осмысленно снижают реальную стоимость ВДМ, рекомендуется сотрудничать с организациями, имеющими государственные лицензии.
Это также относится к «нетерпеливым» предпринимателям, которые занимаются скупкой утиля, содержащего драгметаллы, у населения без последующего аффинажа. Сдавать всевозможные резисторы, транзисторы, микросхемы, позолоченные часы, бижутерию и т.д. целесообразней в официальные структуры.
Работа с серебром
Эффективный сухой метод очистки металла – содовый. Хлорид соды соединяют с натриевым карбонатом в равных пропорциях, нагревают в полупустом тигле, ожидая завершения процесса выделения газа. Затем температуру повышают, чтобы серебро спокойно плавилось, и охлаждают смесь. Вынув металл, его снова плавят, отливают. Процесс сравнительно быстрый. Единственный недостаток – разрушение тигля вследствие длительного влияния соды.
Единственный недостаток – разрушение тигля вследствие длительного влияния соды.
Продать золото
Купирование – мокрый метод очистки, рекомендованный, если проба исходного серебряного сырья низкая. Технологически это окислительная реакция свинца и содержащих драгметалл отходов. Расплавленный с серебром свинец окисляется и отделяется от обрабатываемой массы, одновременно выводя примеси. Сырье семейства платины сохраняется в сплаве.
◄ Назад к новостям
Добываем золото из хлама / Хабр
Хомяки приветствуют вас друзья!
Сегодняшний пост будет посвящен алхимии — древнему ремеслу, способного превращать камень в золото. В ходе поста будем работать с различными кислотами, приготовим самый настоящий золотой бульон и узнаем как приручить драгоценный металл история которого, началась около 6 тыс. лет назад ориентировочно в Египте. Процесс этот увлекательный и местами непредсказуемый, что требует базовых знаний техники безопасности.
Эта история начинается еще со школьных времен, когда все блестящие предметы собирались в отдельную коробку, на случай, а вдруг когда-нибудь пригодится. Многие знакомые, узнав, что предстоит съемка фильма про аффинаж золота разбавили имеющуюся коллекцию различными артефактами, часами, радиодеталями, процессорами от компьютеров и многим другим. Каждая из вышеперечисленных категорий требует своего индивидуального подхода в процессе извлечения драгоценного металла. Но, обо всем по порядку.
Многие знакомые, узнав, что предстоит съемка фильма про аффинаж золота разбавили имеющуюся коллекцию различными артефактами, часами, радиодеталями, процессорами от компьютеров и многим другим. Каждая из вышеперечисленных категорий требует своего индивидуального подхода в процессе извлечения драгоценного металла. Но, обо всем по порядку.
Реактивы. Для работы с золотом нам понадобится: азотная кислота плотностью 1.4, соляная кислота с концентрацией до 14% и серная кислота, она же электролит продается с плотностью 1.27 гр. на см.кв. Концентрированную соляную и серную кислоту в свободной продаже не найти, считаются прекурсорами. Всё из-за этих наркоманов… Карбамид она же мочевина является обыкновенным азотным удобрением, в данном ремесле используется для гашения азотной кислоты. Последний представитель списка реактивов — гидразин гидрат, необходим для восстановления золота.
Сразу оговоримся. Многие для этого дела применяют железный купорос, продается на рынке как фунгицид для защиты растений от различных грибков. Работать с ним не понравилось, осадок всегда получался грязный в отличии от гидразин гидрата. Часто для гашения азотной кислоты используют сульфаминовую кислоту, подружится с ней так же не получилось, реакция у нее протекает значительно медленней нежели с карбамидом. Возможно попалась какая-то просрочка с перебитыми датами на упаковке.
Работать с ним не понравилось, осадок всегда получался грязный в отличии от гидразин гидрата. Часто для гашения азотной кислоты используют сульфаминовую кислоту, подружится с ней так же не получилось, реакция у нее протекает значительно медленней нежели с карбамидом. Возможно попалась какая-то просрочка с перебитыми датами на упаковке.
Фильтрация растворов. Для этих целей применяется вакуумная колба Бунзена совместно с воронкой Бюхнера. В воронку с внутренним диаметров 90 мм вкладываются беззольные бумажные фильтры, которые перед началом работы обязательно нужно смочить водой чтобы обеспечить плотное прилегание к чаше. В зависимости от типа фильтрации бумага может иметь разную плотность. Фильтры «красная лента» применяются для быстрой фильтрации растворов, «зеленая лента» — для средней фильтрации. Существует целая палитра такой бумаги на любой вкус и цвет.
Для самой грубой работы с растворами лучше использовать ватные диски, золотая фольга после первичного травления через неё всё равно не пройдет. Бумагу лучше использовать для фильтрации относительно чистых растворов, так как поры у нее имеют свойство быстро забиваться, а сами фильтры коллекционироваться для дальнейшей переработки.
Бумагу лучше использовать для фильтрации относительно чистых растворов, так как поры у нее имеют свойство быстро забиваться, а сами фильтры коллекционироваться для дальнейшей переработки.
Так же необходимы: лабораторные стаканы разного объема, стеклянные воронки, мерная колба, шприц и пластиковая бутылка омыватель объемом в пол литра, способная смывать позолоту со стенок стаканов. Завершает этот список стеклянные палочки разной длинны.
Вакуум в колбе создается ножным портативным медицинским аспиратором. Где такой достать — даже не спрашивайте!
В процессе химической реакции в значительных количествах будет выделятся бурый газ диоксида азота. Он вредный! Чтоб не превратить хату в газенваген, была собрана примитивная вытяжка из вентилятора и алюминиевой гофры.
Для ускорения химической реакции растворы необходимо подогревать. Для этих целей была собрана примитивная конфорка с применением советского 1 кВт утюга. Корпус вырезан из куска жести, который валялся в кладовке. Изначально это устройство собиралось как стол нижнего подогрева для пайки печатных плат. Контроллер тут плавно набирает заданную температуру, держит ее до момента плавления припоя, а затем нагрев автоматически отключается. Проект был взят с ресурса GitHub у пользователя maker.moekoe.
Изначально это устройство собиралось как стол нижнего подогрева для пайки печатных плат. Контроллер тут плавно набирает заданную температуру, держит ее до момента плавления припоя, а затем нагрев автоматически отключается. Проект был взят с ресурса GitHub у пользователя maker.moekoe.
В общей сложности сборка занимает 30 минут. Конструкция здесь мягко говоря непродуманная. Даже разъем для программирования пришлось подпилить, чтоб хоть как-то засунуть его в ардуино. Диапазон регулировки температур тут от 150 до 240 градусов. В процессе эксплуатации часто вылазил программный баг, при котором отваливалось обновление температуры на экране. Обновления происходило только после того как покрутить ручку резистора. Вероятно тут что то с библиотеками напутано. Программирование для меня — это темный лес.
Конструкция стола нижнего подогрева выглядит так. Паять платы начнем как-нибудь в другой раз, сегодня плите предстоит совсем другая задача. Будем готовить золотой бульйон из продуктов, которые представлены на ваших экранах.
Самое вкусное из этого всего — это часы. Корпус и браслет изделия у них полностью позолочены, но, так как стрелки механизма до сих пор тикают, показываю данную красоту исключительно для примера. Толщина позолоты бывает разная, от 1 до 20 микрон. Зачастую это указано на корпусе. По возможности избавляемся от всего лишнего металла. Браслет резинка имеет позолоченные декоративные вставки, которые легко отделяются плоскогубцами. Мухи отдельно, котлеты отдельно!
Электронные платы. Советская индустрия умела удивить разнообразием электронных компонентов с содержанием драгоценных металлов. Палладий, платина, серебро, золото, всё можно найти. Выпаиваем блестящие микросхемы, маркировка 530ЛА3, представляет собой четыре логических элемента 2И-НЕ. Предназначались для работы в узлах и блоках электронной аппаратуры специального назначения. Имеет жирную позолоту.
Крестик, который принесли аферисты в ломбард и обманули приёмщицу. С первого взгляда ничего особенного за исключением того, что скелет изделия сделан из вольфрама.
Пакетик с золотой пылью в виде накусанных ножек каких-то радиодеталей. Материал магнитный, его нужно перерабатывать отдельно от немагнитного. На вопрос — почему? Станет понятно чуть позже.
Палки держалки для гальванического золочения школьных медалей, которые мне никогда не светили из за учебной успеваемости. Хоть золотую проволоку в руках подержу! Основа тут медь, на которую наносился слой никеля, затем золота, никеля, золота и так далее. Это бесконечный бутерброд чередования металлов хорошо видно под микроскопом. Обязательно напишите в комментариях кому досталась золотая медаль с этих палок.
Тему мобильных телефонов мы затронем как-нибудь в другом посте, переработаем сразу несколько килограмм такого материала. В процессорах от компьютеров интересны только ножки, отделил их за кадром. В общем, насобиралась куча разношерстного сырья. Весь материал был отсортирован, магнит, не магнит, корпуса часов и так далее.
Это СВЧ усилитель, дорожки у него выполнены на керамике.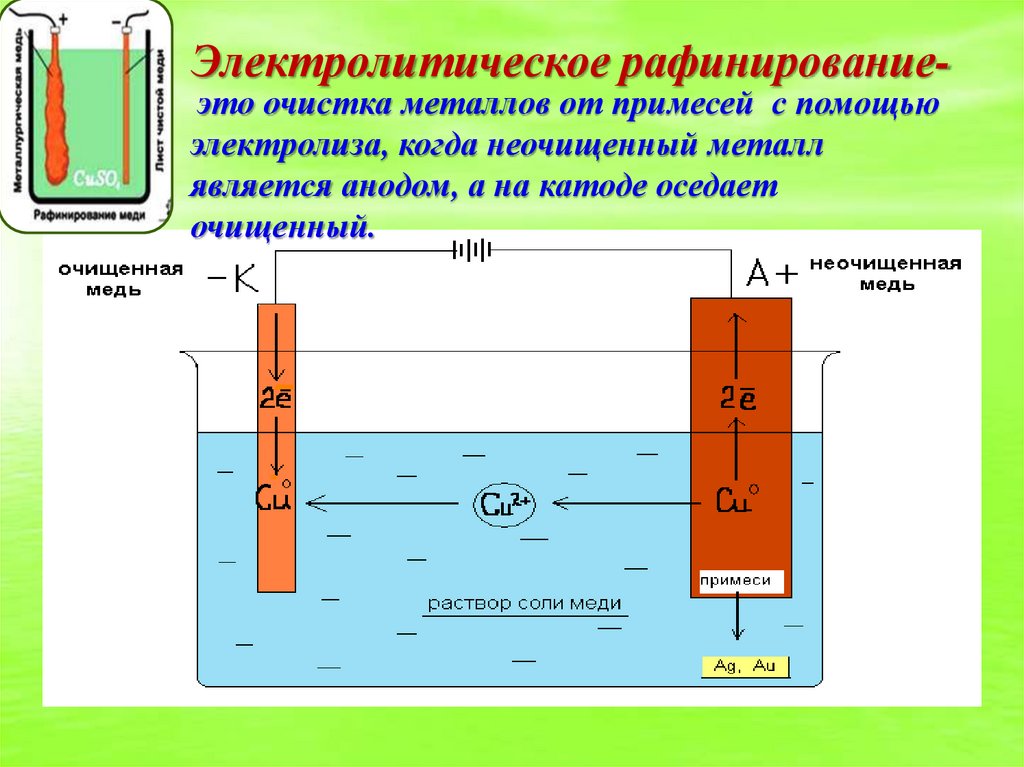 Любопытно на каких частотах работал этот модуль, уверен, что характеристики транзисторов дадут ответы эти на вопросы.
Любопытно на каких частотах работал этот модуль, уверен, что характеристики транзисторов дадут ответы эти на вопросы.
А потом ко мне пришел Серёжка. В прошлом он что то аффинировал и решил помочь. Принес двухсот двадцатилетние часы своего деда на растворение. Заведя пружину шестеренки зашевелились и механизм начал отчитывать время. Пришлось объяснить человеку ценность этого предмета!
Начал Серёга загружать металл в бетономешалку. Смотрю корпуса часов закинул, взял с отдельной кучи проволоку. Всё что видит, тянет в кастрюлю. Сверху словно специями посыпает материал магнитными контактами. Наверняка знает что делает, подумал Штирлиц.
Время заливать всё азотной кислотой, да побольше, чтобы в два пальца сверху покрыло металл. Схватил он коробку с микросхемами, транзисторами и ножками от процессоров которые покрыты припоем. Ух, наваристый получится суп, подумал я. Для аромата еще не хватает процессоров на бериллиевой керамике…
Спрашиваю у него:
Я — Ты точно уверен в этом рецепте?
Серёжа — Конечно, я уже сто раз так делал, вообще без б…
Раствор нагрелся и пошла реакция. Задача азотной кислоты — растворить весь лишний металл кроме золота, которое останется плавать в виде фольги. В процессе, густое облако диоксида азота напомнило Аида из мультфильма «Геркулес». Он хотел свергнуть своего брата Зевса и стать повелителем Олимпа. Сейчас прическа этого персонажа рассеивается по ветру.
В среднем для растворения 100 грамм меди необходимо около 400 мл. азотной кислоты. По мере химической реакции её сила расходуется и приходится подливать новые порции чтобы процесс не останавливался. В общем занимательная химия. Кислота понемногу растворяет корпус часов, а сверху неспешно собирается слой золотой плёнки.
Начали делать вакуумную фильтрацию через бумажные фильтры. Подкачали немного и налили целую воронку раствора. Жидкость покапала чуть-чуть и всё. Чем больше качаешь, тем хуже идёт фильтрация. Подключили к системе 100 литровый вакуумный насос. Кислота в колбе уже кипит полным ходом, а с воронки практически ничего не льется. Очень странные дела. С трудом отфильтровав первую порцию бульона выяснилось, что фильтр забивает какой-то серый порошок.
Жидкость покапала чуть-чуть и всё. Чем больше качаешь, тем хуже идёт фильтрация. Подключили к системе 100 литровый вакуумный насос. Кислота в колбе уже кипит полным ходом, а с воронки практически ничего не льется. Очень странные дела. С трудом отфильтровав первую порцию бульона выяснилось, что фильтр забивает какой-то серый порошок.
Говорю Серёге: мы это с тобой сто лет будем фильтровать, он такой погодь, жена что-то пишет, в общем мне пора собираться, мы же с тобой справились!? Да, справились…
Фильтровать литр раствора пришлось 30 дней и 30 ночей. Одна капля в день просачивалась через бумагу. В результате накопился целый стакан макулатуры с болотом. Вся эта муть, результат присутствия олова в растворе. Для подтверждения этого феномена растворил в азотной кислоте свинцово-оловянный припой для пайки. В результате химической реакции свинец растворится в кислоте, а олово превратится в оксид и осядет на дне стакана в виде белого порошка. Этот осадок появлялся везде, даже в профильтрованных ранее растворах.
История с вакуумным насосом закончилась тем, что колба однажды переполнилась и кислота пошла по шлангам. Первое что нужно сделать, это слить весь горюче-смазочный материал. Его больше нельзя использовать. Разбирать насос было лень, потому ограничился простой сменой масла.
Через месяц естественно он перестал держать вакуум, так как весь внутри поржавел. Пришлось отмывать все детали в ультразвуковой ванне, проводить механическую чистку узлов и механизмов. Не знаю из какого материала сделаны внутренности, но ржавеют они от малейшего дуновения ветра. В конечном результате операция прошла успешно и насос работает как часы.
И так мы выяснили, что присутствие в растворе кислоты припоя напрямую влияет на фильтрацию. Потому его желательно удалять перед началом аффинажа, особенно это актуально когда речь идет о телефонах и других подобных вещах. Сделаем растворитель припоя по методу Франсуа Пелье.
Для этого нам понадобится 100 мл дистиллированной воды, 25 мл азотки, 6 грамм лимонной кислоты и 0. 5 грамма мочевины. Мочевину нужно растворить в небольшом количестве воды и подливать азотную кислоту до тех пор, пока не начнут образовываться кристаллы нитрата мочевины. Выливаем оставшиеся воду в стакан и растворяем кристаллы. Добавляем лимонную кислоту. Перемешиваем до полного растворения и вливаем в раствор остаток азотной кислоты.
5 грамма мочевины. Мочевину нужно растворить в небольшом количестве воды и подливать азотную кислоту до тех пор, пока не начнут образовываться кристаллы нитрата мочевины. Выливаем оставшиеся воду в стакан и растворяем кристаллы. Добавляем лимонную кислоту. Перемешиваем до полного растворения и вливаем в раствор остаток азотной кислоты.
Заливаем платы получившемся раствором. Не могу сказать с уверенностью как именно этот раствор избирательно растворяет припой, но точно знаю — он работает. Реакция идёт не спеша, весь процесс занимает пару тройку часов. На примере процессоров видно, что растворение идёт неравномерно из-за разной марки припоя на платах. Предположительно там где идёт растворение хуже, содержится серебро.
В первый раз мне показалось что процесс идет как-то медленно и я решил нагреть раствор. Это было напрасно! Милый растворитель припоя превратится в голубую суспензию, которая начала разъедать не только медь, а и паяльную маску на платах. Часть позолоты плавала в жидкости, а попытка ее профильтровать превратились в ад.
Теперь, когда припоя на платах нет их можно заливать азотной кислотой. Она растворит медные дорожки, а позолота, которая на них присутствовала останется плавать в растворе в виде фольги. Останется только процедить эту жижу и получить драгоценный фильтр. В процессе их было огромное количество, главное не перепутать где какой исходный материал содержится.
С мобильными телефонами и процессорами всё предельно просто, возвращаемся к банке в которой находится ассорти. Визуально видно что растворилось не всё, транзисторы валяются целые. Ножки и корпус от них выполнены из сплава никеля, который требует иного способа растворения. Подобный материал зачастую магнитный, и его легко отсортировать. Всё что пристало к магниту переработаем в растворе электролита и азотной кислоты в пропорции 4:1. По отдельности кислоты не реагируют, а вместе жрут никель как не в себя.
И так, на дне стакана всё растворилось. Обязательно промываем эту красоту водой. На некоторых микросхемах позолота не хотела отлипать, пришлось ей немного помочь. Из справочника драгоценных металлов можно узнать сколько всего интересного находится в одной микросхеме 530ЛА3. Видим золото в количестве 0,0148942 грамм. Выходит всего из 68 микросхем можно получить 1 грамм золота.
Из справочника драгоценных металлов можно узнать сколько всего интересного находится в одной микросхеме 530ЛА3. Видим золото в количестве 0,0148942 грамм. Выходит всего из 68 микросхем можно получить 1 грамм золота.
Насобирались у нас такие бумажки. В белой тарелке — позолота из мобильных телефонов. В синей — ножки от процессоров. Вольфрам из крестика не растворился, он такой, крепкий товарищ. В розовой тарелке находятся фильтры с припоем. Стоп, а зачем собирать пыль от припоя спросите вы? Дело в том, что при пайке происходит диффузия металла, позолоченные площадки и припой частично приникают друг в друга. Представляете сколько золотой пыли можно слить в унитаз, если не знать школьной программы химии 7 класса!?
Помещаем фильтр в кружку, смачиваем содержимое небольшим количеством воды и заливаем царскую водку. Классический рецепт этого напитка, соляная и азотная кислоты в пропорции 3 к 1. Нам она не подходит. Дело в том, чтобы запустить процесс растворения золота достаточно всего одной капли азотной кислоты на 20 мл соляной. Это пропорция 400 к 1 примерно.
Это пропорция 400 к 1 примерно.
В процессе этой реакции в растворе образуется хлоридный комплекс золота, моноксид азота и вода. Процесс длится до тех пор, пока в стакане не растворится весь металл. В данном случае выпарилась азотная кислота, добавляем еще каплю и возобновляем реакцию. Это просто пример, на самом деле пропорция царской водки 10 к 1 самое оно. Зачем это нужно спросите вы? Всё очень просто. Дело в том, что перед осаждением золота излишки азотной кислоты нужно будет гасить карбамидом и чем меньше её будет, тем лучше.
Чтоб сделать реактив на золото, достаточно растворить пару грамм олова в 10 мл соляной кислоты. В результате реакции выделяется водород и образуется раствор хлорида олова 2, самое чувствительное вещество для проверки, выделения и распознания в растворе золота, палладия или платины. Чистое олово можно достать у деда на чердаке, оно обязательно должно хрустеть когда его гнешь руками. Припой для пайки без содержания канифоля внутри тоже сойдет, единственное, потом раствор нужно будет слить с осадка.
Возвращаемся к царской водке. Многие писали в инстаграмме, мол почему раствор то зеленый, то желтый!? При первом растворении это обычное явление. Фольга от мобильных телефонов окрашивает раствор в зеленый цвет, так как золото там не чистое а легированное примесями. Так же раствор может окрасится если к примеру в ножках от транзисторов остался никель. Получится темное болото, но из него без проблем можно осадить золото.
В определенный момент стало интересно в какой цвет окрашивают азотную кислоту различные металлы. В первый контейнер добавим медь, в следующие латунь, бронзу, чистое серебро, железный гвоздь и в последний стакан поместим муху. Как можно заметить первые три раствора вышли зеленого цвета. Это вызвано тем, что сразу после растворения металла в азотной кислоте в жидкой фазе присутствует диоксид азота, окрашивающий жидкость в желтый цвет. Это хорошо видно на примере серебра. Через пару часов он разложился и первые три стакана стали голубыми. Серебро стало прозрачным. В последней пробирке образовался желтый раствор с хлоридом мухи. Попробуем её восстановить гидразин гидратом. Капаем пару капель и вуаля, муха на глазах коагулируется в первоначальное состояния. Магия вне Хогвартса запрещена!
Серебро стало прозрачным. В последней пробирке образовался желтый раствор с хлоридом мухи. Попробуем её восстановить гидразин гидратом. Капаем пару капель и вуаля, муха на глазах коагулируется в первоначальное состояния. Магия вне Хогвартса запрещена!
Отфильтрованный раствор царской водки содержит в себе остаточное количество азотной кислоты, которую необходимо погасить карбамидом. Процесс сопровождается активным шипением. Зачем нужна эта процедура? Бесполезно и бессмысленно восстанавливать металлическое золото из царской водки, если весь металл тут же растворится обратно в хлорид. Подсыпаем карбамид до тех пор, пока не прекратится шипение. Набираем в шприц гидразин гидрат. На отрытом воздухе он дымит как сатана. Добавляем его по одной капле и наблюдаем как происходит восстановление.
В результате, если раствор с золотом был без посторонних примесей, осадок скоогулируется в такие красивые шарики. Обязательно промываем их водой. Сразу скажу, что это идеальный пример осаждения перерастворенного несколько раз в царской водке чистого золота для получения 999 пробы. Если же в растворе присутствуют примеси, то осаждение может сопровождаться в виде самых разных аномалий.
Если же в растворе присутствуют примеси, то осаждение может сопровождаться в виде самых разных аномалий.
Предсказать каким будет осадок из грязного раствора невозможно. К примеру если появилась так называемая золотая пенка — это хороший знак. Это явный признак того, что восстановленное металлическое золото точно скоогулируется в мелкие гранулы похожие на песок. В самых неприятных случаях восстановление проходит без слипания частиц и осадок выпадает мелкой пылью. Такой раствор несколько суток нужно отстаивать чтобы вся муть выпала на дно.
Если же после восстановления вы увидели, что раствор превратился в газировку, это явный признак того, что в нем осталась азотная кислота и царская водка начала обратно растворять металл. Через пару часов он ушел в раствор. Куда-то торопился и забыл присыпать сюда карбамид.
Когда осадки осядут, полученные растворы обязательно нужно проверить на наличие растворенного в кислоте золото хлоридом олова. Первые три образца дали негативную пробу, а последней стакан позитивную. Бумажка почернела. Чувствительность реактива на аурум по некоторым данным 0,1 г/л.
Бумажка почернела. Чувствительность реактива на аурум по некоторым данным 0,1 г/л.
Один из растворов не помню чего, хоть с виду и золотой, но по факту в нем ничего интересного нет. Промытый в воде осадок необходимо высушить. Он как шкварки, в начале с виду большие, а потом ужимаються раз в 10. Так выглядит металлическое золото. В процессе не покидало чувство, что ты какой-то шеф повар. Только блюдо под конец выходи несъедобное.
В тарелках имеем металл, который можно спокойно плавить. Как видно некоторые осадки получились грязные, особенно напротив плат от мобильных телефонов. Предлагаю перед дальнейшей работой взвесить весь рыжий материал. Начнем с той банки в которую кинули всё подряд в самом начале фильма. Очень таки не плохо, 4.39 гр. Все остальное по весу как говорится мелочь, а приятно. Из припоя вышло 0.11 гр.
Как очистить грязный осадок? Можно его снова растворить в царской водке для дальнейшего переосаждения или же прокипятить в соляной кислоте. Она растворит большую часть примесей. Для особых гурманов, можно хорошо промыть осадок, раз 10 минимум, а потом прокипятить его еще в азотной кислоте и по окончанию так же промыть водой.
Она растворит большую часть примесей. Для особых гурманов, можно хорошо промыть осадок, раз 10 минимум, а потом прокипятить его еще в азотной кислоте и по окончанию так же промыть водой.
Высыпаем порошок в какую-нибудь бумажку и скручиваем в форме шишки. Дальше все по накатанной! Если имеем дело с большим количеством порошка, то шаг с бумажкой лучше пропустить и сделать из этого попкорна брикет с помощью шприца. Материал уплотнится и его легко будет плавить. Помещаем таблетку в тигель и отдаем тело огню.
Золотые слитки после плавки кипятим в лимонной кислоте, чтобы избавится от излишков буры. Самая большая из них блестит как у кота яйка. Вес металла как был 4.39 гр до плавки, так и остался. Примесей после первого осаждения там особо нет. Самая маленькая капля получилась с припоя. Она и весь остальной материал прошел двойное перерастворение, а изначальный вес после процедур немного уменьшился.
Как невооруженным взглядом распознать относительно чистое золото? Тут всё очень просто. Во первых поверхность металла должна иметь зеркально чистый блеск. Во вторых, это характерная кристаллизация металла в месте его усадки. Её будет видно как на крупных, так и на мелких каплях в 0.2 грамма.
Во первых поверхность металла должна иметь зеркально чистый блеск. Во вторых, это характерная кристаллизация металла в месте его усадки. Её будет видно как на крупных, так и на мелких каплях в 0.2 грамма.
Рентгенофлуоресцентный анализ показал вот такие результаты сегодняшней проделанной работы. Нужно ли очищать золото еще лучше это вопрос. Получить пробу 999 в домашних условиях не представляет особого труда.
После всех проделанных экспериментов на кухне скопилась целая куча разноцветных растворов. Выливать их в унитаз нельзя! В них может содержатся серебро! Для проверки нужно снять жидкость с осадка и залить в неё концентрированный раствор пищевой соли. Голубой раствор, который удалял припой с телефонов и процессоров побелел, а на дно выпали хлопья хлорида серебра. Дальше его нужно собрать, растворить в аммиаке и осадить гидразин гидратом. На эти скоогулированные куски драгоценного металла можно смотреть вечно. Дальше их промываем водой, сушим и сплавляем в каплю. Способов роботы с серебром существует целое множество, если под этим постом наберется больше одного лайка, сделаю отдельный пост.
Способов роботы с серебром существует целое множество, если под этим постом наберется больше одного лайка, сделаю отдельный пост.
Вес добытого из растворов серебра составил 0.2…0.27 грамм. Не плохо. Во всех остальных растворах ничего интересного не было. Первоначальный осадок из всех банок содержал в себе исключительно растворенный лак и всякий мусор.
Наверняка вы уже побежали искать старые дедовские часы на чердаке чтобы их растворить. Не спешите, сейчас самое время поговорить о технике безопасности!
В материал перед растворением обязательно нужно налить воду, а уж затем небольшими порциями добавлять кислоту. Если не придерживается этого простого правила, реакция может слегка выйти из под контроля и весь кисель пойдет через вверх. Для таких форс мажорных ситуаций рекомендую использовать стеклянную крышку от кастрюли для запекания, она не даст кислоте прожечь пол к соседям. Как-то раз выпаривая раствор царской водки, он на середине процедур вспенился и разбежался по всей плите. Если эта гадость попадёт на пальцы, то оставит синие следы, как будто шелковицу с дерева срывал. Если азотная кислота попадает на пальцы, верхний слой кожи желтеет и отмирает. Для нейтрализации действия кислот, место поражения своевременно необходимо вымочить в растворе пищевой соды.
Если эта гадость попадёт на пальцы, то оставит синие следы, как будто шелковицу с дерева срывал. Если азотная кислота попадает на пальцы, верхний слой кожи желтеет и отмирает. Для нейтрализации действия кислот, место поражения своевременно необходимо вымочить в растворе пищевой соды.
Как конкретно действую кислоты на открытые участках кожи сейчас продемонстрирую на курице, капаю пару капель азотной кислоты и смотрим. Нанесение азотной кислоты практически сразу сморщивает кожу. Соляная кислота ведёт себя приблизительно так же. От электролита мгновенных видимых изменений не наблюдается, спустя несколько минут он слегка отбелил поверхность так же как гидразин гидрат. Раствор царской водки оставил после себя желтый потек.
Лидером этого наглядного эксперимента выступил электролит, которым миллионы автолюбителей заправляют свинцовые аккумуляторы. Он оставил самый большой химический ожог на мышечной ткани. В общем что хотел донести, при работе с кислотами обязательно пользуемся перчатками и защитными очками.
Для справки. Съемка этого выпуска планировалась завершится за один день, но как всегда процесс затянулся на два месяца. В создания ролика участвовало около 20 человек. Каждый помогал чем мог, кто информацией, кто материалом. Всем огромная благодарность! Хата за это время стала похожа на подпольную лабораторию производства амфетамина. Вытяжка под конец экспериментов разломалась на две части. Просто обвисла под собственным весом. Детальное рассмотрение поверхности алюминия показало, что пары кислоты разъели её в решето!
Весь инструмент, который лежал на подоконнике поржавел от кислотных паров. Всех припаркованных возле дома автомобилей ждала такая же участь. Пол под газетой, на которой лежали беззольные фильтры стал красного цвета. Паркетный лак аннигилировал. Стол нижнего подогрева превратился в старую рухлядь. Нужно будет отнести его на покраску.
Всё с чем соприкасалась кислота, пыталось превратится в золото, но не всему это удавалось. Пойду отмываться от реактивов и готовится к съемкам следующего захватывающего приключения. Вот так вот
Вот так вот
Поддержи нас на Patreon
Полное видео проекта на YouTube
Наш Instagram
Никелирование в домашних условиях своими руками: технология, советы
- Электролитическое никелирование
- Химическое никелирование
- Некоторые нюансы технологии
Никелирование, которое является достаточно распространенной технологической операцией, выполняют для того, чтобы нанести на поверхность металлического изделия тонкий слой никеля. Толщина такого слоя, величину которого можно регулировать, используя различные приемы, может варьироваться от 0,8 до 55 мкм.
Никелирование используется в качестве защитно-декоративного покрытия, а также для получения подслоя при хромировании
С помощью никелирования металла можно сформировать пленку, обеспечивающую надежную защиту от таких негативных явлений, как окисление, развитие коррозионных процессов, реакции, вызванные взаимодействием с соляной, щелочной и кислотной средами. В частности, очень большое распространение получили никелированные трубы, которые активно используются для производства изделий сантехнического назначения.
В частности, очень большое распространение получили никелированные трубы, которые активно используются для производства изделий сантехнического назначения.
Чаще всего никелированию подвергаются:
- изделия из металла, которые будут эксплуатироваться на открытом воздухе;
- кузовные детали мото- и автотранспортных средств, в том числе и те, для изготовления которых был использован алюминиевый сплав;
- оборудование и инструменты, применяемые в общей медицине и стоматологии;
- изделия из металла, которые длительное время эксплуатируются в воде;
- ограждающие конструкции, изготовленные из стали или алюминиевых сплавов;
- изделия из металла, подвергающиеся воздействию сильных химических веществ.
Существует несколько используемых как в производственных, так и в домашних условиях методов никелирования металлических изделий. Наибольший интерес в практическом плане представляют способы никелирования металлических деталей, не требующие применения сложного технологического оборудования и реализуемые в домашних условиях. К таким способам относится электролитическое и химическое никелирование.
К таким способам относится электролитическое и химическое никелирование.
Свойства гальванического и химического покрытия никелем
Электролитическое никелирование
Суть технологии электролитического никелирования металлических деталей, имеющей и другое название – «гальваническое никелирование», можно рассмотреть на примере того, как выполняется омеднение поверхности изделия из металла. Такую процедуру можно проводить как с применением электролитического раствора, так и без него.
Деталь, которая будет в дальнейшем обрабатываться в электролитическом растворе, подвергается тщательной обработке, для чего с ее поверхности при помощи наждачной бумаги удаляют оксидную пленку. Затем обрабатываемое изделие промывается в теплой воде и обрабатывается содовым раствором, после чего снова промывается водой.
Крупные детали лучше очищать пескоструйным аппаратом
Сам процесс никелирования выполняется в стеклянной емкости, в которую заливается водный раствор (электролит). В составе такого раствора содержится 20% медного купороса и 2% серной кислоты. Обрабатываемую деталь, на поверхность которой необходимо нанести тонкий слой меди, в растворе электролита помещают между двумя анодами из меди. Чтобы запустить процесс омеднения, на медные аноды и обрабатываемую деталь необходимо подать электрический ток, величину которого рассчитывают, исходя из показателя 10–15 мА на один квадратный сантиметр площади детали. Тонкий слой меди на поверхности изделия появляется уже через полчаса его нахождения в растворе электролита, причем такой слой будет тем толще, чем дольше будет протекать процесс.
В составе такого раствора содержится 20% медного купороса и 2% серной кислоты. Обрабатываемую деталь, на поверхность которой необходимо нанести тонкий слой меди, в растворе электролита помещают между двумя анодами из меди. Чтобы запустить процесс омеднения, на медные аноды и обрабатываемую деталь необходимо подать электрический ток, величину которого рассчитывают, исходя из показателя 10–15 мА на один квадратный сантиметр площади детали. Тонкий слой меди на поверхности изделия появляется уже через полчаса его нахождения в растворе электролита, причем такой слой будет тем толще, чем дольше будет протекать процесс.
Схема установки для электролитического никелирования
Нанести медный слой на поверхность изделия можно и по другой технологии. Для этого необходимо изготовить кисточку из меди (можно использовать многожильный провод, предварительно сняв с него изоляционный слой). Такую кисточку, сделанную своими руками, надо зафиксировать на деревянной палочке, которая будет служить ручкой.
Изделие, поверхность которого предварительно зачищают и обезжиривают, помещают в емкость из диэлектрического материала и заливают электролитом, в качестве которого можно использовать насыщенный водный раствор медного купороса. Самодельную кисточку подключают к плюсовому контакту источника электрического тока, а обрабатываемую деталь – к его минусу. После этого приступают к процедуре омеднения. Заключается она в том, что кисточкой, которую предварительно обмакивают в электролит, проводят над поверхностью изделия, не прикасаясь к ней. Наносить покрытие, применяя такую методику, можно в несколько слоев, что позволит сформировать на поверхности изделия слой меди, на котором практически отсутствуют поры.
Схема простого приспособления для нанесения покрытия
Электролитическое никелирование выполняется по схожей технологии: при его осуществлении тоже используется раствор электролита. Так же, как и в случае с омеднением, обрабатываемое изделие располагают между двумя анодами, только в данном случае они изготовлены из никеля. Аноды, помещенные в раствор для никелирования, подключаются к плюсовому контакту источника тока, а изделие, подвешенное между ними на металлической проволоке, – к минусовому.
Аноды, помещенные в раствор для никелирования, подключаются к плюсовому контакту источника тока, а изделие, подвешенное между ними на металлической проволоке, – к минусовому.
Для осуществления никелирования, в том числе и выполняемого своими руками, используются электролитические растворы двух основных типов:
- водный раствор, включающий в свой состав сернокислый никель, натрий и магний (14:5:3), 2% борной кислоты, 0,5% поваренной соли;
- раствор на основе нейтральной воды, содержащий в своем составе 30% сульфата никеля, 4% хлорида никеля, 3% борной кислоты.
Электролит блестящего никелирования с добавкой органических блескообразователей (натриевых солей)
Выравнивающий электролит блестящего никелирования. Подходит для поверхностей с низким классом очистки
Чтобы приготовить электролитический раствор, сухую смесь из вышеуказанных элементов заливают одним литром нейтральной воды и тщательно перемешивают. Если в полученном растворе образовался осадок, от него избавляются. Только после этого раствор можно использовать для выполнения никелирования.
Если в полученном растворе образовался осадок, от него избавляются. Только после этого раствор можно использовать для выполнения никелирования.
Обработка по данной технологии обычно длится полчаса, при этом используют источник тока с напряжением 5,8–6 В. Результатом является поверхность, покрытая неравномерным матовым цветом серого цвета. Чтобы она стала красивой и блестящей, необходимо ее зачистить и выполнить ее полировку. Следует иметь в виду, что такая технология не может быть использована для деталей, отличающихся высокой шероховатостью поверхности или имеющих узкие и глубокие отверстия. В таких случаях покрытие поверхности металлического изделия слоем никеля следует выполнять по химической технологии, которую также называют чернением.
Электролит для осаждения черного никеля
Суть технологической операции чернения заключается в том, что на поверхность изделия сначала наносится промежуточное покрытие, основой которого может быть цинк или никель, а на верхней части такого покрытия формируется слой черного никеля толщиной не более 2 мкм. Покрытие никелем, выполненное по технологии чернения, смотрится очень красиво и обеспечивает надежную защиту металла от негативного воздействия различных факторов внешней среды.
Покрытие никелем, выполненное по технологии чернения, смотрится очень красиво и обеспечивает надежную защиту металла от негативного воздействия различных факторов внешней среды.
В отдельных случаях металлическое изделие одновременно подвергают сразу двум технологическим операциям, таким как никелирование и хромирование.
Химическое никелирование
Процедуру химического никелирования изделий из металла выполняют по следующей схеме: обрабатываемую деталь на некоторое время погружают в кипящий раствор, в результате чего на ее поверхности оседают частички никеля. При применении такой технологии электрохимическое воздействие на металл, из которого изготовлена деталь, отсутствует.
Результатом использования такой технологии никелирования является формирование на поверхности обрабатываемой детали никелевого слоя, который прочно связан с основным металлом. Наибольшей эффективности такой способ никелирования позволяет добиться в тех случаях, когда с его помощью обрабатываются предметы, изготовленные из стальных сплавов.
Наибольшей эффективности такой способ никелирования позволяет добиться в тех случаях, когда с его помощью обрабатываются предметы, изготовленные из стальных сплавов.
Комплект для нанесения никелированного покрытия химическим способом
Выполнять такое никелирование в домашних условиях или даже в условиях гаража нетрудно. При этом процедура никелирования проходит в несколько этапов.
- Сухие реактивы, из которых будет приготовлен электролитический раствор, смешиваются с водой в эмалированной посуде.
- Полученный раствор доводят до кипения, а затем в него добавляют гипофосфит натрия.
- Изделие, которое необходимо подвергнуть обработке, помещают в электролитический раствор, причем делают это так, чтобы оно не касалось боковых стенок и дна емкости. Фактически надо изготовить бытовой аппарат для никелирования, конструкция которого будет состоять из эмалированной емкости соответствующего объема, а также диэлектрического кронштейна, на котором будет фиксироваться обрабатываемая деталь.

- Продолжительность кипения электролитического раствора в зависимости от его химического состава может составлять от одного часа до трех.
- После завершения технологической операции уже никелированная деталь извлекается из раствора. Затем ее промывают в воде, в составе которой содержится гашеная известь. После тщательной промывки поверхность изделия подвергается полированию.
Процесс никелировки в домашних условиях
Электролитические растворы для выполнения никелирования, которому можно подвергать не только сталь, но также латунь, алюминий и другие металлы, обязательно содержат в своем химическом составе следующие элементы – хлористый или сернокислый никель, гипофосфит натрия различной кислотности, какую-либо из кислот.
Чтобы увеличить скорость никелирования изделий из металла, в состав для выполнения этой технологической операции добавляют свинец. Как правило, в одном литре электролитического раствора выполняют никелевое покрытие поверхности, площадь которой составляет 20 см2. В электролитических растворах с более высокой кислотностью проводят никелирование изделий из черных металлов, а в щелочных обрабатывают латунь, осуществляют никелирование алюминия или деталей из нержавеющей стали.
В электролитических растворах с более высокой кислотностью проводят никелирование изделий из черных металлов, а в щелочных обрабатывают латунь, осуществляют никелирование алюминия или деталей из нержавеющей стали.
Некоторые нюансы технологии
Выполняя никелирование латуни, изделий из стали различных марок и других металлов, следует учитывать некоторые нюансы этой технологической операции.
- Пленка из никеля будет более устойчивой, если она нанесена на предварительно омедненную поверхность. Еще более устойчивой никелированная поверхность будет в том случае, если готовое изделие будет подвергнуто термической обработке, заключающейся в его выдержке при температуре, превышающей 450°.
- Если никелированию подвергаются детали из закаленных сталей, то нагревать и выдерживать их можно при температуре, не превышающей 250–300°, иначе они могут утратить свою твердость.

- При никелировании изделий, отличающихся большими размерами, возникает потребность в постоянном перемешивании и в регулярной фильтрации электролитического раствора. Такая сложность особенно характерна для процессов никелирования, выполняемых не в промышленных, а в домашних условиях.
Причины дефектов никелирования
По сходной с никелированием технологии можно покрыть латунь, сталь и другие металлы слоем серебра. Покрытие из данного металла наносят, в частности, на рыболовные снасти и изделия другого назначения, чтобы предотвратить их потускнение.
Процедура нанесения слоя серебра на сталь, латунь и другие металлы отличается от традиционного никелирования не только температурой проведения и временем выдержки, но также тем, что для нее применяют электролитический раствор определенного состава. При этом выполняют данную операцию в растворе, температура которого составляет 90°.
Никелированные латунные фитинги
Чтобы своими руками приготовить раствор, при помощи которого на сталь, латунь и другие металлы наносится слой серебра, достаточно выполнить ряд несложных действий.
- В 10%-й водный раствор соли добавляют аптечный ляпис.
- Осадок серебра, выпавший в растворе, промывают, смешивают с 2%-м гипосульфитом и фильтруют.
- Полученную смесь смешивают с меловой пылью и доводят до сметанообразного состояния.
Такой смесью, которая может храниться только в течение нескольких суток, натирается поверхность металлического изделия, пока на ней не сформируется тонкий слой серебра.
Полученное покрытие легко полируется до блеска
Можно приготовить порошок для серебрения, который не утратит своих характеристик в течение полугода. Для получения такого порошка необходимо смешать 15 граммов ляписа, 55 граммов лимонной кислоты и 30 граммов хлористого аммония. Все компоненты после перемешивания следует перетереть в пыль. Хранится полученный порошок в сухом виде.
Достаточно сложным является никелирование такого металла, как алюминий. Компоненты, входящие в состав электролитического раствора для никелирования изделий из данного металла, дорогостоящие, но даже их использование не дает гарантии того, что сформированный на изделии слой никеля не пойдет пузырями. Блестящее никелирование, если ему подвергают алюминий, может порвать готовое покрытие, поэтому в домашних условиях такую обработку выполняют в условиях слабой адгезии.
Блестящее никелирование, если ему подвергают алюминий, может порвать готовое покрытие, поэтому в домашних условиях такую обработку выполняют в условиях слабой адгезии.
Аффинаж палладия с помощью аммиака в домашних условиях
Слово Аффинаж произошло от французского affiner что означает очищать. При помощи этого метода получают металлы платиновой группы высшей пробы. Аффинаж палладия – это разновидность процесса очистки химического элемента от примесей. Так как этот металл в чистом виде не встречается, его извлекают из различных руд и электронных приборов. Промышленным способом получить драгметалл сложно и тем более повторить процесс дома, так как нужно использовать опасные химические реактивы. Но многие химики любители устраивают дома целые лаборатории для извлечения элемента в натуральном виде. Каким способом можно выделить чистый палладий, и для каких целей его добывают?
Общие сведения и область применения материала
Востребованность палладия объясняется его особыми химическими и физическими характеристиками:
- вещество устойчиво перед влиянием щелочей и влаги;
- материал не боится воздействия аммиака;
- металл обладает высокой температурой плавления;
- вещество проявляет оптимальную электропроводность.

Так как субстанция реагирует на воздействие концентрированной азотной кислоты, с ее помощью чаще всего и проводят аффинаж палладия. Металл нашел широкое применение в следующих отраслях:
- для выведения примесей из водорода методом глубокой очистки;
- для производства электрических контактов, которые в составе микросхем и приборов активно применяются в аэрокосмической и военной отраслях. Здесь ценится высокая износостойкость материала;
- в медицине – для производства зубных протезов и всевозможных узкопрофильных приборов;
- в гальванотехнике востребован палладиевый хлорид, он необходим для металлизации диэлектриков – это одна из стадий изготовления электрических плат;
- с помощью катализаторов на основе палладия выявляют даже минимальное присутствие в воздухе угарного газа, осуществляют крекинг нефти;
- введение этого металла в золото способствует изменению цвета сплава, методика активно используется в ювелирной нише.
Палладий используется в медицине
Палладий востребован при производстве измерительного оборудования, так как он исключает вероятность возникновения поверхностной коррозии, данное свойство актуально при проектировании химической аппаратуры. Палладиевое напыление на электрических контактах предотвращает эффект искрения.
Палладиевое напыление на электрических контактах предотвращает эффект искрения.
История и общие сведения
Химический элемент палладий относится к благородным металлам и в Периодической системе стоит под номером 46. Он был открыт в 1802 году и был назван в честь астероида Паллады, который обнаружили в тот же год. Сам астероид был назван по имени персонажа греческой мифологии – дочери морского царя Тритона и сестры богини Афины.
Как это обыкновенно случается, открытие палладия произошло случайно и совершенно незапланированно. Английский химик Вильям Волластон, которому и удалось его обнаружить, не надеялся найти новый элемент. Он занимался очищением платины от примесей ртути и золота, и на одном из этапов работы получил осадок розового цвета. Ни один из компонентов раствора не мог дать такой оттенок, поэтому ученый предположил о наличии неизвестных ему примесей.
Волластон пытался растворить осадок в царской водке, добавлял в него цианид калия, нагревал и поддавал другим испытаниям. В конце концов, он выделил из него целых два новых компонента – палладий и родий, что стало настоящим прорывом в его карьере.
В конце концов, он выделил из него целых два новых компонента – палладий и родий, что стало настоящим прорывом в его карьере.
Методы аффинажа палладия
Практикуются следующие методы извлечения драгметалла:
- мокрый,
- электролитический,
- сухой.
Восстановление палладия обычно осуществляют посредством электролиза: на катоде происходит осаждение искомого металла, вспомогательные примеси отсеиваются в форме шлама. Подобная операция осуществляется с помощью высококонцентрированной серной кислоты, здесь она выполняет функцию электролита. В качества катода можно взять свинец, анодом послужит непосредственно электродеталь, из которой планируется получить чистый элемент. В рассматриваемом случае латунно-медный сплав не подвергается воздействию, для очищения образующегося палладия с примесями используют соляно-азотную кислоту.
Главным достоинством электролитического способа аффинажа признается низкая себестоимость, в результате образуется материал с высокой степенью очистки. Метод позволяет создать благоприятные условия труда и способствует извлечению палладия в виде продуктов распада.
Метод позволяет создать благоприятные условия труда и способствует извлечению палладия в виде продуктов распада.
Сущность мокрого способа заключается в использовании царской водки – смеси соляной и азотной кислот. В ней растворяют металлы платиновой группы, в том числе и палладий, из образовавшейся субстанции ценные материалы извлекают с применением реактивов, таких как сахар, аммиак, хлористый аммоний. Если искомый материал содержится в сплаве серебра, в качестве реагента будет задействована азотная кислота.
При мокром методе царскую водку разбавляют дистиллированной водой, раствор должен «дойти» в течение суток. Это время необходимо для образования осадка на дне – хлорида серебра, его впоследствии фильтруют. Восстановление палладия происходит с помощью аммиака – его вводят в емкость с раствором и оставляют на несколько дней. Золотую смесь также нужно отфильтровать, в качестве восстановителя здесь используют цинк.
Небольшое количество добавляют в палладиевый раствор, в результате образуется осадок характерного желто-оранжевого цвета. Выждав некоторое время, осадок фильтруют, высушивают и нагревают до 500°, чтобы обеспечить прокаливание субстанции. В итоге выделяется чистый материал порошкообразной консистенции.
Выждав некоторое время, осадок фильтруют, высушивают и нагревают до 500°, чтобы обеспечить прокаливание субстанции. В итоге выделяется чистый материал порошкообразной консистенции.
Чистый драгметалл нельзя получить, используя сухой способ аффинажа, потому что в ходе очищения от серебряных и золотых примесей искомый элемент не отсеивается. Отделяется лишь свинец, так как он отслаивается от серебра и на открытом воздухе окисляется. В данном аспекте будут бесполезны все доступные в быту виды катализов.
Свойства металла
Палладий — химический элемент, в периодической таблице Менделеева он находится на 46 позиции. Относится к благородным металлам, хотя используется не только в ювелирном деле, но и в промышленности. В природе состоит из шести стабильных изотопов, седьмой, искусственный радиоактивный изотоп, имеет период полураспада более семи миллионов лет. Может образовываться при делении ядер урана и плутония в ядерных реакторах.
Температура плавления палладия равна 1554 градусам Цельсия, плотность — 12г/см3. Он примерно в полтора раза тяжелее железа, но среди металлов своего ряда (платины, иридия и осмия) легче всех почти в два раза. По сравнению с этими металлами, он и обрабатывается гораздо легче — именно поэтому высоко ценится в ювелирном деле.
Он примерно в полтора раза тяжелее железа, но среди металлов своего ряда (платины, иридия и осмия) легче всех почти в два раза. По сравнению с этими металлами, он и обрабатывается гораздо легче — именно поэтому высоко ценится в ювелирном деле.
Выглядит палладий как металл серебристо-белого цвета. Он плотный, устойчив к коррозии и является парамагнетиком. Даже при добавлении 1% значительно улучшает устойчивость титана к кислотам. Это явление учёные навали самопассивацией (самозащитой) металлов: если в сплавы на основе титана, хрома, свинца или железа ввести даже небольшую дозу благородных металлов, то их коррозиестойкость повышается в десятки и даже сотни раз.
Палладий — самый химически активный металл из платиновых. Он не вступает в реакцию с водой, разбавленными щелочами, кислотами и аммиаком, реагирует только с горячими концентрированными серной и азотной кислотами.
Его исключительные химические свойства связаны с тем, что на внешней орбите его атома находятся 18 электронов, то есть она полностью заполнена. Благодаря этому металл почти не подвергается внешнему разрушительному воздействию различных веществ. Для того чтобы они вступили во взаимодействие, нужно обеспечить высокую температуру — от 500 градусов по Цельсию.
Благодаря этому металл почти не подвергается внешнему разрушительному воздействию различных веществ. Для того чтобы они вступили во взаимодействие, нужно обеспечить высокую температуру — от 500 градусов по Цельсию.
Ещё одно интересное свойство палладия в том, что он способен поглощать некоторые газы в большом количестве. При комнатной температуре 1 см³ металла может поглотить до 800 см³ водорода. После такого металл изменяется: он вспучивается, трескается и разбухает. Получают металл при переработке серебра, никеля и меди. Около 10% мирового производства получают из переработки вторсырья.
Детали, содержащие металл
Извлечение материала в домашних условиях может преследовать 2 цели: использование чистого палладия в качестве катализатора или дальнейшая перепродажа. Металл имеет тенденцию к постоянному увеличению стоимости, если есть доступ к достаточному объему исходных компонентов, можно получить немалую прибыль с его продажи.
Извлечение материала в домашних условиях проводится для использование чистого палладия в качестве катализатора
Чаще всего элемент добывают из радиодеталей и разнообразных компонентов, входящих в «начинку» современной электроники. Такие изделия содержат искомый металл в составе сплавов – серебряных, платиновых, золотых и прочих. Крайне редко можно встретить палладий в технике в чистом виде.
Такие изделия содержат искомый металл в составе сплавов – серебряных, платиновых, золотых и прочих. Крайне редко можно встретить палладий в технике в чистом виде.
В быту в качестве исходных материалов умельцы применяют радиодетали, так как разработчики подобной техники активно используют палладий в составе сплавов: они закладываются в основу микросхем с расчетом на существенное увеличение их эксплуатационного срока. Для извлечения металла можно использовать конденсаторы КМ, в которых элемент встречается как один из «участников» платинового сплава.
Металл может содержаться и в конденсаторах других видов, используемых в иностранных, российских и советских радиодеталях. Здесь нужно помнить, что концентрация исходных веществ в сплавах напрямую зависит от сущности электросхемы и предполагаемых условий ее эксплуатации. Очень редко можно найти драгоценный элемент в транзисторах, даже если он и применяется, его содержание будет ничтожным. В связи с чем нецелесообразно привлекать транзисторы к аффинажу.
Визуально палладий очень похож на платину и серебро, все эти металлы обладают близким светло-серым оттенком. Даже опытные специалисты не всегда могут их отличить «на глаз». Чтобы отделить материалы, нужно использовать подогретую азотную кислоту – она не образует реакцию с платиной. Но нужно иметь в виду, что последняя активно растворяется в разогретой царской водке.
Чтобы извлечь металл из пробирного камня, выполняют следующие действия:
- На поверхности пробирного камня формируют царапину, с нажимом проведя по нему заостренной гранью металлического образца.
- Подготавливают смесь из йода и раствора калия 10%, ее соединяют с соляной и азотной кислотами.
- Покрывают царапину химической смесью.
Сформировавшееся на поверхности красно-коричневое пятно свидетельствует о присутствии платины.
Так как аффинаж подразумевает приобретение дорогостоящих вспомогательных веществ и устойчивых емкостей, целесообразно сначала подготовить как можно больше исходных материалов, содержащих палладий. Его совсем немного в современных электродеталях, наибольшим потенциалом в этом отношении обладают керамические конденсаторы КМ с маркировкой от 3 до 6. КМ встречаются в советской электронике по типу аналоговой техники, генераторов, осциллографов, измерительных приборов.
Его совсем немного в современных электродеталях, наибольшим потенциалом в этом отношении обладают керамические конденсаторы КМ с маркировкой от 3 до 6. КМ встречаются в советской электронике по типу аналоговой техники, генераторов, осциллографов, измерительных приборов.
Где найти материал
Pd применяется в промышленности для изготовления конденсаторов, реле, контактов и микросхем. Исходный материал для аффинажа палладия в домашних условиях — это разные радиодетали содержащие драгметаллы. Разработчики на основе сплава Pd повышают срок службы микросхем. А также химический элемент присутствует в конденсаторах КМ в составе сплава платины. Драгметалл входит в конденсаторы радиодеталей российского и зарубежного производства. Содержание исходных элементов в сплавах различается, это зависит от вида электрической схемы и её работы.
В других приборах содержание драгметаллов бывает редким явлением, например, в транзисторах. Поэтому такие приборы не применяются в аффинаже для получения натурального металла.
Химический элемент Pd имеет светлый оттенок, из-за чего очень схож с серебром и платиной. На взгляд опытный специалист не всегда отделит его от других драгметаллов. Плотность у металлов платиновой группы разная, но по этому признаку трудно их отличить. Отделить платину от Pd можно при воздействии на них азотной кислотой: платина в ней не растворяется.
Чтобы определить, содержится ли драгметалл в конкретном сплаве, делают следующий опыт: по пробирному камню проводят куском металла, оставляя глубокую царапину. После берут реактив, приготовленный из смеси азотной и соляной кислот с добавлением 10% раствора калия с йодом. Если произошла химическая реакция, и появилось пятно красно-коричневого цвета, то этозначит что, в образце есть палладий.
Pd в радиодеталях содержится в небольшом количестве. Больше всего встречается в керамических конденсаторах типа КМ -3,4,5,6. Эти модели отличаются дороговизной и пользуются спросом, и если нет желания проводить химические опыты по выделению драгметалла, можно их легко продать.
Главная страница Сведения об авторах
ЭЛЕКТРОХИМИЧЕСКОЕ СЕЛЕКТИВНОЕ ИЗВЛЕЧЕНИЕ ПАЛЛАДИЯ ИЗ ОТРАБОТАННЫХ КАТАЛИЗАТОРОВ
Байрачный Б. И., Ляшок Л. В., Орехова Т. В., Афонина И. А., Национальный технический университет «Харьковский политехнический институт», Харьков, Украина
Проблема эффективного использования вторичных ресурсов очень актуальна в связи с ограниченностью природных запасов сырья. На рынке торговли металлами наблюдается стремительный рост спроса на палладий, поэтому среди драгоценных металлов он становится лучшим объектом для инвестиций. Палладий широко применяется в различных отраслях промышленности. Крупнейшие потребители — автоконцерны, которые используют его для производства катализаторов дожигания выхлопных газов (нейтрализаторов) (таблица).
Потребление палладия в различных отраслях в 2006 г.
| Отрасль | Потребление, % |
| Производство нейтрализаторов | 60,56 |
| Электроника и электротехника | 16,25 |
| Стоматология | 13,45 |
| Химическая промышленность | 4,13 |
| Ювелирная промышленность | 4,04 |
| Прочее | 1,57 |
В Украине палладий не добывается, но имеется большое количество палладийсодержащих отходов в виде лома электроники, отработанных катализаторов и т. д., в связи с чем создание эффективных, экологически безопасных технологий извлечения палладия из вторичного сырья — актуальная проблема.
д., в связи с чем создание эффективных, экологически безопасных технологий извлечения палладия из вторичного сырья — актуальная проблема.
Авторы разработали схему извлечения палладия из гранулированных палладийсодержащих катализаторов на основе оксида алюминия. Продукт переработки — палладиевый порошок чистотой 99,99 %.
Выщелачивание палладия проводится в реакторе раствором концентрированной соляной кислоты при температуре 50–80 °С:
Pd + 2HCl = PdCl2 + h3.
Реактор должен обеспечивать максимальную степень выщелачивания при наибольшей селективности процесса, быть неэнергоемким и надежным, иметь простую конструкцию.
Как правило, процесс переработки вторичного сырья, содержащего драгоценные металлы, малотоннажный, поэтому для выщелачивания палладия целесообразно использовать реактор периодического действия. Лимитирующей стадией процесса является диффузия реагентов к поверхности реакции. Для его интенсификации необходимо обеспечить перемешивание с помощью мешалки либо циркуляцию раствора сквозь неподвижное сырье.
После фильтрации для отделения палладия от различных примесей раствор направляют в реактор получения дихлордиамминпалладия Pd(Nh4)2Cl2 — нерастворимого в воде и частично растворимого в соляной кислоте порошка желтого цвета.
Полученный после выщелачивания палладиевый раствор обрабатывают при нагревании избытком аммиака. При этом вначале выпадает соль Вокелена, которая растворяется в избытке аммиака, образуя Pd(Nh4)4Cl2:
Pd(Nh4)4PdCl4 + 4Nh5OH = 2Pd(Nh4)4Cl2 + 4h3O.
После добавления в раствор соляной кислоты выпадает малорастворимый осадок дихлордиамминпалладия
Pd(Nh4)4Cl2 + 2HCl = Pd(Nh4)2Cl2 + 2Nh5Cl.
После отстаивания раствора осадок фильтруют и промывают.
Дихлордиамминпалладий Pd(Nh4)2Cl2 используют для получения порошка палладия электрохимическим методом. Выход порошка по току составляет 80–99 %.
При электролизе в хлоридном электролите Pd(Nh4)2Cl2 растворяется с образованием относительно нестойкого комплекса согласно механизму: а) дихлордиамминпалладий в горячей соляной кислоте образует тетрахлоропалладоат аммония
Pd(Nh4)2Cl2 + 2HCl = [PdCl4](Nh5)2;
б) тетрахлоропалладоат аммония диссоциирует с образованием комплексного иона PdCl42-, который разряжается на катоде с образованием металлического порошка палладия
[PdCl4](Nh5)2 = PdCl42- + 2Nh5+.
На электродах протекают следующие реакции: а) на катоде PdCl42- + 2е = Pd + 4Cl-, 2H+ + 2e = h3, 2Nh5+ + 2e = 2Nh4 + h3; б) на аноде 2Cl- — 2e = Cl2.
В начале процесса все количество электричества тратится на выделение палладия. По мере того, как в электролите уменьшается концентрация палладия, доля тока на выделение водорода возрастает. Когда диффузионные ограничения значительно уменьшают скорость выделения палладия на катоде, доля тока для водорода резко возрастает, и он начинает интенсивно выделяться, восстанавливая оставшийся в объеме электролита металл. Таким образом, достигается 100%-ное выделение металла из электролита.
Схема извлечения палладия из отработанных палладийсодержащих катализаторов представлена на рисунке.
Принципиальная схема извлечения палладия из отработанных катализаторов:
1 — реактор выщелачивания; 2 — реактор для получения дихлордиамминпалладия; 3 — фильтр; 4 — ванна электроэкстракции; 5 — выпрямитель; 6 — ванна улавливания; 7 — ванна промывки; 8 — насос; 9 — сушильный шкаф
Предложенная технологическая схема извлечения палладия из отработанных катализаторов обеспечивает полное извлечение палладия из исходного сырья в виде порошка чистотой 99,99 %. Промышленная реализация этого процесса имеет большое значение для решения сырьевой проблемы.
Промышленная реализация этого процесса имеет большое значение для решения сырьевой проблемы.
ELECTROCHEMICAL SELECTIVE EXTRACTION OF PALLADIUM FROM SPENT CATALYSTS
Bayrachniy B. I., Lyashok L. V., Orekhova T. V., Afonina I. A., National Technical University «Kharkiv Polytechnic Institute», Kharkiv, Ukraine
The palladium recovery process for spent catalysts is described in the paper. It enables the full recovery of palladium in the form of powder with the purity level of 99.99 %.
Главная страница
Сведения об авторах
Байрачный Борис Иванович
, д-р техн. наук, проф., зав. кафедрой технической электрохимии, Национальный технический университет «Харьковский политехнический институт», ул. Фрунзе, 21, Харьков, 61002, Украина. Тел.
Ляшок Лариса Васильевна
, канд. техн. наук, доц., кафедра технической электрохимии, Национальный технический университет «Харьковский политехнический институт», ул. Фрунзе, 21, Харьков, 61002, Украина. Тел. (057) 707–67–91
(057) 707–67–91
Орехова Татьяна Васильевна
, вед. инженер, кафедра технической электрохимии, Национальный технический университет «Харьковский политехнический институт», ул. Фрунзе, 21, Харьков, 61002, Украина. Тел. (057) 707–67–91
Афонина Ирина Александровна
, аспирант, кафедра технической электрохимии, Национальный технический университет «Харьковский политехнический институт», ул. Фрунзе, 21, Харьков, 61002, Украина. Тел. (057) 707–67–91. E-mail
© Независимое агентство экологической информации
Последние изменения внесены 16.08.08
Радиодетали, в которых есть палладий
В чистом виде этот металл встречается не часто. Он является одним из составляющих никелевой руды.
Много палладия содержится в конденсаторах, резисторах, разъемах. Что касается первых, то все они, преимущественно, производились в Болгарии в советские времена. А на болгарских заводах каждый конденсатор содержал этот металл. В космической, военной и радиоэлектронной отрасли палладий до сих пор широко применяется.
В настоящее время чистый Pd в микросхемах редко удается встретить. Чаще наблюдается платино-палладиевый микс. Делается это для лучшей устойчивости в условиях повышенной температуры.
Сдавать этот металл можно только в пункт приема цветных металлов, имеющий лицензию. Незаконный сбыт палладия карается несколькими годами тюремного заключения.
Добыча, цена и местонахождения
Палладий считается редким металлом, в земной коре его содержится 1·10–6% по массе. Это не самое маленькое количество, однако найти его в виде самородков очень сложно. Примерно 98 % добываемого объема извлекает из коренных месторождений, где палладий находится в составе минералов. Чаще всего он присутствует в потарите, ферроплатине, брэгитте, иридистой и палладистой платине, звягинцевите.
Основное количество металла добывают в медно-никелевых рудниках. Наибольшие такие месторождения располагаются на территории России. Крупные залежи палладия находятся также в платиновых месторождениях ЮАР. Затем следуют рудники в США, Канаде, Австрии и Колумбии.
Затем следуют рудники в США, Канаде, Австрии и Колумбии.
Стоимость палладия на рынке драгметалла, как правило, выше платины. Им нередко торгуют на биржах, а в банковских системах некоторых стран мира он может служить валютой для открытия счета.
Прочие примечательные металлы
Другие металлы не относятся к категории драгоценных металлов, но заслуживают упоминания. Иридиевые (Ir) тигли используются для производства монокристаллов сапфира для светодиодов в смартфонах и плоских дисплеях, а кристаллы на основе лития для поверхностных акустических фильтров переплетения в сотовых телефонах и беспроводной связи. Никель (Ni) обычно используется в аккумуляторных батареях.
Продать палладий
Осмий (Os) — это отвердитель в сплавах платины. Родий с высокой отражательной способностью (Rh) используется в качестве оптического покрытия для сложной электронной спектроскопии. Рутений (Ru) увеличивает твердость и коррозионную стойкость контактов и дисководов. Вездесущая медь (Cu) остается универсальным фаворитом для проводки и полупроводников.
◄ Назад к новостям
Золото
Сектор электроники является основным промышленным потребителем золота и серебра. Универсальное золото (Au) — отличный проводник, который ценится за его надежность и превосходную устойчивость к коррозии. Золото, наиболее пластичное из всех металлов, может быть использовано в твердотельных и микроэлектронных устройствах с минимальными токами. Он используется в соединителях, контактах переключателей и реле, проводке, тонкопленочных слоях и защитных покрытиях, а также в соединениях пайки или пайки. Номинальное количество золота сегодня можно найти почти во всей электронике, включая мобильные телефоны, ПК и планшеты, а также телевизоры. Типичные приложения, использующие золото, включают: покрытия на сенсорных дисплеях, торцевые и штекерные разъемы на материнских платах, устройства флэш-памяти, мягкое золотое покрытие полупроводников, аэрокосмическое оборудование и другие высокотемпературные среды
Никелирование в домашних условиях: технология и способы никелирования
Никель широко используется в приборостроении и машиностроении, а также в других различных отраслях. В пищевом производстве никель заменяет покрытия из олова, а в области оптики он известен за счет процесса черного никелирования металла. Никелем обрабатывают изделия, сделанные из стали и цветных металлов, для защиты от образования коррозии и увеличения сопротивления деталей механическому износу. Содержание фосфора в никеле позволяет делать пленку, по твердости схожей с пленкой хрома.
В пищевом производстве никель заменяет покрытия из олова, а в области оптики он известен за счет процесса черного никелирования металла. Никелем обрабатывают изделия, сделанные из стали и цветных металлов, для защиты от образования коррозии и увеличения сопротивления деталей механическому износу. Содержание фосфора в никеле позволяет делать пленку, по твердости схожей с пленкой хрома.
Процесс никелирования
Процедура никелирования подразумевает нанесение на поверхность изделия никелевого покрытия, которое, как правило, имеет толщину слоем 1-50 мкм. Никелевые покрытия могут быть матовыми черными или блестящими, но вне зависимости от этого, создают надежную и прочную защиту металла от агрессивных воздействий (щелочи, кислоты) и в условиях высоких температур.
Перед никелирования изделие необходимо подготовить. Этапы подготовки:
- деталь обрабатывают наждачкой для снятия оксидной пленки;
- обрабатывают щеткой;
- промывают под водой;
- обезжиривают в теплом содовом растворе;
- подвергают промывке еще раз.

Покрытия из никеля могут с течением времени утрачивать свой изначальный блеск, потому очень часто никелевый слой покрывают более стойким слоем хрома.
Никель, нанесенный на сталь, это катодное покрытие, которое защищает металл только механическим способом. Слабая плотность защитного слоя способствует появлению коррозионных пор, где растворимым электродом является именно стальная часть. В итоге под покрытием возникает коррозия, она разрушает стальную подложку и создает отслаивание никелевого слоя. Чтобы этого не допустить металл всегда необходимо обрабатывать толстым слоем никеля.
Покрытия из никеля наносятся на:
- медь;
- железо;
- титан;
- вольфрам и другие металлы.
Нельзя обрабатывать при помощи никелирования такие металлы, как:
- кадмий;
- свинец;
- свинец;
- олово;
- висмут;
- сурьму.
При никелировании деталей из стали необходимо делать подслой меди.
Никелевые покрытия применяют в различных сферах промышленности для специальных, декоративно-защитных целей, а также используют в роли подслоя. Технику никелирования применяют для восстановления изношенных деталей и запчастей автомобилей, покрытия медицинского инструмента, химической аппаратуры, предметов домашнего обихода, измерительных инструментов, деталей, которые подвергаются небольшим нагрузкам в условии действия крепких щелочей или сухого трения.
Разновидности никелирования
На практике существует два вида никелирования:
- Химическое;
- Электролитическое.
Первый вариант является четь дороже электролитического, но может обеспечить возможность создания равномерного покрытия по толщине и качеству на любых участках изделия, если создано условие доступа раствора к ним.
Электролитическое покрытие никелем в домашних условиях
Электролитическое никелирование отличается небольшой пористостью, она зависит от толщины защитного слоя и тщательности подготовки основания. Для создания качественной антикоррозионной защиты необходимо абсолютное отсутствие пор, для чего принято предварительно делать омеднение металлической детали или наносить несколько слоев покрытия, что намного прочней однослойного покрытия даже при одинаковой толщине.
Для создания качественной антикоррозионной защиты необходимо абсолютное отсутствие пор, для чего принято предварительно делать омеднение металлической детали или наносить несколько слоев покрытия, что намного прочней однослойного покрытия даже при одинаковой толщине.
Для чего в домашних условиях надо подготовить электролит. Необходимо 3,5 гр. хлорида никеля, 30 гр. сульфата никеля и 3 гр. борной кислоты на 100 мл. воды, этот электролит перелейте в емкость. Для никелирования меди или стали будут необходимы никелевые аноды, которые необходимо погрузить в электролит.
Деталь подвешивается на проволочке между никелевыми электродами. Проволочки, которые от никелевых пластинок, нужно соединить вместе. Детали подсоединяют к отрицательному полюсу источнику напряжения, а проволочки – к положительному. После необходимо подключить реостат в цепь и миллиамперметр для регулировки напряжения. Понадобится источник постоянного тока, с напряжением не более 6 Вольт.
Ток нужно включать примерно на 20 минут. После деталь достается, промывается и высушивается. Деталь покрыта матовым слоем никеля серого оттенка. Чтобы защитный слой получил блеск, его нужно отполировать. Но при работе не забывайте о значительных недостатках электролитического покрытия в домашних условиях — невозможности покрытия узких и глубоких отверстий и неравномерности осаждения на рельефной никелевой поверхности.
После деталь достается, промывается и высушивается. Деталь покрыта матовым слоем никеля серого оттенка. Чтобы защитный слой получил блеск, его нужно отполировать. Но при работе не забывайте о значительных недостатках электролитического покрытия в домашних условиях — невозможности покрытия узких и глубоких отверстий и неравномерности осаждения на рельефной никелевой поверхности.
Химическое покрытие никелем в домашних условиях
Кроме электролитического способа, существует еще один, довольно несложный вариант для покрытия полированной стали или железа прочным и тонким никелевым слоем. Необходимо 10% раствор хлористого цинка и потихоньку добавлять к сернокислому раствору никеля, пока раствор не будет ярко-зеленым. Затем жидкость необходимо довести до кипения, желательно для этого взять фарфоровую емкость.
При этом образуется характерная муть, но на никелирования изделий она никак не влияет. Когда доведете раствор до кипения, надо в него опустить изделие, которое подвергается никелированию. Предварительно его надо обезжирить и почистить. Деталь должна кипеть в жидкости около часа, периодически доливайте дистиллированную воду по мере уменьшения раствора.
Предварительно его надо обезжирить и почистить. Деталь должна кипеть в жидкости около часа, периодически доливайте дистиллированную воду по мере уменьшения раствора.
Если увидели при кипении, что раствор поменял цвет из ярко на слабо зеленый, то необходимо добавить чуть сернокислого никеля, чтобы получить изначальный окрас. Через указанное время достаньте деталь из жидкости, сполосните в воде, где растерто чуть-чуть мела, и хорошенько высушите. Полированное железо или сталь, покрытые таким образом, этот защитный слой удерживают довольно хорошо.
В основе процесса химического покрытия лежит реакция преобразования никеля из водяного раствора его солей с помощью гипофосфита натрия и других химических элементов. Растворы, использующиеся для химического покрытия, могут быть щелочными с рН более 6,5 и кислыми с рН 4-6,5.
Кислые растворы лучше всего применять для обработки меди, латуни и черных металлов. Щелочные используются для нержавейки. Кислый раствор, в отличие от щелочного, создает на полированном изделии более гладкую поверхность. Также важной особенностью кислых растворов является меньший шанс саморазряда при увеличении уровня рабочей температуры. Щелочные вещества гарантируют более прочное сцепление никелевой пленки с основанием металла.
Также важной особенностью кислых растворов является меньший шанс саморазряда при увеличении уровня рабочей температуры. Щелочные вещества гарантируют более прочное сцепление никелевой пленки с основанием металла.
Любые водные растворы для никелирования считаются универсальными, а именно подходящими для любых металлов. Для химического покрытия используют дистиллированную воду, но вы можете взять и конденсат из обычного холодильника. Химические реагенты подходят чистые – с маркировкой на упаковке «Ч».
Этапы приготовления раствора:
- Все химические вещества, кроме гипофосфита натрия, необходимо растворить в воде в эмалированной емкости.
- После разогрейте жидкость до кипячения, растворите гипофосфит натрия и разместите изделие в растворе.
- При помощи литра раствора можно покрыть никелем детали, имеющих площадь до 2 кв. дм.
Ванны для покрытия никелем
В мастерских часто используется ванна, состоящая из трех основных элементов:
- хлорид;
- сульфат;
- борная кислота.

Сульфат никеля это источник никелевых ионов. Хлорид существенно влияет на работу анодов, его пропорция в ванне точно не указывается. В безхлоридных ваннах происходит значительное пассивирование никеля, после этого количество в ванне никеля снижается, и как результат, падение качества покрытий и снижение выхода по току.
Аноды при хлоридах растворяются в необходимом количестве для достаточного протекания никелирования алюминия или меди. Хлориды повышают работу ванны при загрязнениях цинком и ее проводимость. Борная кислота поддерживает рН на необходимом уровне. Эффективность этого процесса зависит в основном от количества борной кислоты.
В роли хлорида можно выбрать хлорид магния, цинка или натрия. Повсеместно используются сульфатные ванны Воттса, содержащие в роли добавки электропроводные соли, увеличивающие электропроводность ванн и повышающие привлекательный вид защитного слоя. Наиболее часто используемый среди таких солей является сульфат магния (около 30 гр. на 1 л.).
на 1 л.).
Как правило, сульфат никеля вводить в соотношении приблизительно 220-360 гр. на 1 л. Сегодня появились тенденции к снижению сульфата никеля – менее 190 гр./л., это помогает значительно уменьшить потери раствора.
Добавление борной кислоты приблизительно 25-45 гр. на 1 л. Если менее 25 гр./л., то повышаются процессы защелачивания ванны. А превышение этого предела является неблагоприятным, по причине вероятной кристаллизации борной кислоты и выпадения осадков кристаллов на анодах и стенках ванны.
Никелевая ванна может работать в различном диапазоне температур. Но техника никелирования в домашних условиях нечасто используется при комнатной температуре. От покрытий, нанесенных в прохладных ваннах, зачастую отходит никель, потому ванну нужно прогревать минимум до 32 градусов. Плотность тока подбирают экспериментальным путем, чтобы не произошел прижег защитного слоя.
Натриевая ванна хорошо работает в большом диапазоне рН. Когда-то поддерживали рН 5,3-5,9, мотивируя слабой агрессивностью и лучшими кроющими свойствами ванны. Но высокие показатели рН провоцируют существенное увеличение напряжений в никелевом слое. Потому во многих ваннах рН равен 3,4-4,6.
Но высокие показатели рН провоцируют существенное увеличение напряжений в никелевом слое. Потому во многих ваннах рН равен 3,4-4,6.
Особенности никелирования
Сцепление никелевой пленки с металлом относительно низкое. Эту проблему решают при помощи термообработки пленок никеля. В основе процесса низкотемпературной диффузии находится нагрев отникелированных деталей до температуры 400 гр. и выдержке изделий в течение часа при данной температуре.
Но не забывайте, что если изделия, покрытые никелем, были закалены, то при 400 гр. они могут утратить прочность – их главное качество. Потому низкотемпературную диффузию в этих случаях делают при температуре около 260-310 гр. с выдержкой три часа. Эта термообработка может повышать и прочность никелевого покрытия.
Ванны подразумевают специальное оборудование для покрытия никелем и перемешивания водяного раствора для интенсификации процесса никелирования и снижения вероятности питтинга – появления мелких углублений в защитном слое. Перемешивание ванны влечет необходимость организации постоянной фильтрации для удаления загрязнений.
Перемешивание ванны влечет необходимость организации постоянной фильтрации для удаления загрязнений.
Перемешивание с помощью активной катодной штанги не настолько эффективно, как использование сжатого воздуха, и кроме этого, нуждается в наличии специального вещества, исключающего образования пены.
Удаление никелевого покрытия
Покрытия из никеля на стали принято убирать в ваннах с разведенной серной кислотой. Добавьте к 25 л. охлажденной воды частями 35 л. концентрированной серной кислоты, при этом постоянно перемешивания. Следите, чтобы температура не была не более 55 градусов. После остывания до комнатной температуры жидкости ее плотность должна быть 1,64.
Для снижения вероятности затравливания металла, из которого изготовлена подложка, в ванну добавляют глицерин в пропорции 50 гр. на 1 л. Ванны чаще всего делаются из винипласта. Детали навешивают на среднем поручне, соединенным с плюсом источника напряжения. Поручни, где прикреплены свинцовые листы, подсоединяются к минусу источника питания.
Проследите, чтобы температура ванны была не более 32 гр., потому что горячий раствор агрессивно воздействует на подложку. Плотность тока обязана быть около 4,1 А./дм. кв., но возможно изменение тока в диапазоне 4,5-6,2 Вольт.
Добавьте через некоторое время серную кислоту, чтобы выдержать плотность равной 1,64. Чтобы избежать разбавления ванны окунайте детали только после проведения их предварительной просушки.
На сегодняшний день никелирование – это наиболее популярный гальванотехнический процесс. Никелевые покрытия отличаются высокой коррозионной устойчивостью, твердостью, недорогой стоимостью никелирования, удельным электрическим сопротивлением и отличными отражательными возможностями.
- Автор: Николай Иванович Матвеев
- Распечатать
Оцените статью:
(11 голосов, среднее: 4. 5 из 5)
5 из 5)
Поделитесь с друзьями!
Колонка: Завод по очистке никеля возглавляет список желаний США по производству аккумуляторных металлов: Энди Хоум
ЛОНДОН, 14 июня (Рейтер) — Правительство Соединенных Штатов должно инвестировать в мощности по переработке никеля в координации со своими союзниками, согласно 100-дневному обзору администрации Байдена. критических цепочек поставок.
«Если у США есть возможность нацелиться на одну часть цепочки поставок аккумуляторов, это, вероятно, будет наиболее важным для обеспечения краткосрочной и среднесрочной стабильности цепочки поставок», — говорится в отчете.
Это неожиданный приоритет. Никель не входит в список важнейших минералов США. Хотя страна зависит от импорта, 68% поставок поступает из стран, которые в отчете называются «союзными странами», таких как Канада, Австралия, Норвегия и Финляндия.
Зарегистрируйтесь сейчас и получите БЕСПЛАТНЫЙ неограниченный доступ к Reuters.
 com
com
Но Министерство энергетики (DOE) определило никель класса 1, который лучше всего подходит для литий-ионных аккумуляторов, как ключевую уязвимость и ключевую возможность.
Акцент на никеле не означает, что Белый дом безразличен к другим критически важным материалам для аккумуляторов, таким как литий и кобальт, но он многое говорит о том, как администрация думает об этой проблеме.
НИЗКИЕ ЗАПАСЫ, БЕЗ ПЕРЕРАБОТКИ
Соединенные Штаты зависят от импорта по всему спектру аккумуляторных металлов, при этом большая часть цепочки поставок захвачена Китаем, проблематичным международным торговым партнером.
Однако характер зависимости зависит от минерала, начиная с земли.
Соединенные Штаты, например, «имеют ресурсы лития и местные корпорации, хорошо разбирающиеся в извлечении и переработке во всем мире», согласно отчету.
Таким образом, целью является стимулирование отечественной добычи и, что еще более важно, отечественной переработки за счет потенциального сочетания закупочных гарантий, федерального финансирования и исследований и разработок в области усовершенствованных технологий извлечения.
Инвестиции Китая в этот отрезок цепочки поставок «сделали их мировым лидером, несмотря на ограниченные внутренние поставки лития», отмечается в отчете.
Однако, когда дело доходит до никеля, единственная действующая шахта в США — Игл в Мичигане — должна быть закрыта в 2025 году, а внутренние месторождения малы и бедны содержанием.
Нет внутренних мощностей по переработке никеля, кроме ограниченного количества побочного продукта производства соли.
Тем не менее, в отчете говорится, что спрос на этот конкретный аккумуляторный металл, вероятно, будет наиболее значительным в ближайшие годы, поскольку «рынок указывает на то, что в ближайшие 3-7 лет может возникнуть большая нехватка никеля класса 1». .
.
Действительно, с ростом содержания никеля в конструкции катода аккумуляторов отсутствие достаточного количества никеля нужного типа «создает риск цепочки поставок для производства аккумуляторов во всем мире, а не только в Соединенных Штатах».
ИЗМЕНЕНИЕ СПРОСА
Спрос на никель растет, потому что автопроизводители пытаются сократить использование кобальта, металла, который находится в тени зависимости цепочки поставок от Демократической Республики Конго (ДРК) и ее кустарной рабочей силы.
Министерство энергетики хочет помочь им с обязательством по «многолетней инициативе по решению научных и инженерных проблем по сокращению и устранению кобальта в батареях электромобилей».
Уже ведутся исследования новых материалов, таких как кремниевые и литий-металлические аноды, и прогресс на сегодняшний день «очень хороший», говорится в отчете.
Мотивация такая же, как у Tesla (TSLA.O) или Volkswagen (VOWG_p.DE). Изменение динамики спроса является самым надежным долгосрочным способом решения проблем со стоимостью и поставками кобальта.
Министерство энергетики присвоило кобальту «самую низкую оценку качества цепочки поставок из всех элементов, в основном из-за предполагаемых условий добычи в Демократической Республике Конго и условий, связанных с переработкой кобальта в Китае».
Но учитывая, что большая часть известных мировых запасов кобальта находится в Конго, существует понимание того, что краткосрочные риски могут быть снижены лишь частично за счет максимального использования внутренних ресурсов, особенно старых хвостохранилищ, и сотрудничества с союзными странами.
В отчете рекомендуется использовать Финансовую корпорацию развития США (DFC) для «выявления проектов в странах-союзниках и странах-партнерах, которые могут быть профинансированы для создания новых устойчивых операций по добыче и переработке лития, графита и других ключевых металлов и материалов».
ПЕРЕРАБОТКА
По данным Министерства энергетики, для снижения зависимости от критически важных минералов также будет важно наращивание мощностей по переработке.
Переработка аккумуляторов может обеспечить до 30% использования никеля и 80% кобальта в электромобилях к концу десятилетия, но на пути к этому есть множество препятствий.
Потребуется национальная политика утилизации, чтобы привести в соответствие сектор, который в настоящее время фрагментирован законодательством штата. Без одного аккумуляторы отправятся на свалку или будут вывезены в другие страны, где будут извлекаться металлы.
Также потребуются дополнительные исследования и разработки по переработке аккумуляторов электромобилей, поскольку в настоящее время во многих случаях это невыгодно и становится все более сложным с химической точки зрения по мере увеличения количества ингредиентов аккумуляторов.
В идеале это должно происходить в тандеме с наращиванием других частей цепочки поставок аккумуляторов, таких как производство элементов и батарей, что позволит непрерывно возвращать «новый» лом обратно в производственный процесс.
В отчете рекомендуется, чтобы Соединенные Штаты сформировали межведомственную целевую группу, чтобы «получить целостное представление о ландшафте возможностей и скоординировать действия по поддержке внутренней переработки».
Несмотря на длинный список проблем, Министерство энергетики приходит к выводу, что переработанные материалы могут «смягчить нестабильность объемов и цен» в краткосрочной перспективе, и, поскольку все больше аккумуляторов для электромобилей достигает конца срока службы, «могут в конечном итоге обеспечить значительную долю критических потребности в материалах для аккумуляторов».
НИКЕЛЬ СРОЧНО
Переработка, скорее всего, поможет сократить разрыв в зависимости от кобальта в США быстрее, чем никеля.
Это связано с тем, что текущий поток вторсырья в основном состоит из бытовой электроники и электромобилей первого поколения, ни один из которых не содержит много никеля.
Миру понадобится гораздо больше нового никеля, прежде чем переработка сможет оказать реальное влияние.
В Индонезии идет бум добычи и переработки никеля, но вместо того, чтобы утешить Соединенные Штаты, доминирование китайских игроков просто означает, что страна рискует «еще больше отстать от Китая в этом важнейшем минерале».
Таким образом, «существует срочная разработка стратегии в отношении никеля класса 1», — говорится в отчете.
Начиная с завода по переработке никеля, финансируемого США.
Зарегистрируйтесь сейчас и получите БЕСПЛАТНЫЙ неограниченный доступ к Reuters.com
Редактирование: Эмилия Ситхоул-Матариз
Наши стандарты: Принципы доверия Thomson Reuters.
Высказанные мнения принадлежат автору. Они не отражают точку зрения агентства Reuters News, которое в соответствии с Принципами доверия придерживается принципов честности, независимости и свободы от предвзятости.
Освобождение меди и никеля: реальная история
Что приходит вам на ум, когда вы видите слово « освобождение» ?
—
Слово «освобождение» происходит от латинского слова liberatus , что буквально означает « освобождать» или «освобождать», и может легко применяться к множеству различных тем. от политики и религии к науке и промышленности
В частности, в медной промышленности слово «освобождение» относится к акту освобождения меди, в частности, от электролита, выделяемого на нефтеперерабатывающем заводе. технологических операций. Давайте подробнее рассмотрим историю «освобождения меди».
В среднем добытая руда содержит около 1 % меди, и для извлечения этой меди из горной породы требуется несколько этапов физической и химической обработки и рафинирования для производства металлической меди, пригодной для продажи.
Горное дело: Глава первая
Весь процесс начинается с доставки добытой руды грузовиками на горнодобывающий завод, часто рядом с рудным карьером, где руда дробится и измельчается, тем самым отделяя медь от меди. пустая порода (т.е. пустая порода). Измельченная руда затем смешивается с водой, образуя суспензию, перед тем как пройти пенную флотацию, процесс, который включает добавление различных химических реагентов при барботировании воздуха в суспензию, в результате чего медь прикрепляется к пузырькам и всплывает на поверхность. Как только достаточное количество меди всплывает наверх, ее снимают, затем концентрируют в сгустителе и продавливают через фильтр, получая примерно 25–40% медного концентрата с содержанием влаги 8–12%. Остальную часть концентрата составляют другие металлы, такие как железо, никель, мышьяк, висмут, сурьма и т. д., а также сера.
Рафинирование меди
Рафинирование меди — это процесс, состоящий из нескольких этапов. Обычно он начинается с медного концентрата, который плавится для получения нечистых медных анодов. Затем аноды подвергают электрорафинированию для получения медного катода LME Grade A (+99,99%).
Обычно он начинается с медного концентрата, который плавится для получения нечистых медных анодов. Затем аноды подвергают электрорафинированию для получения медного катода LME Grade A (+99,99%).
Одним из важнейших факторов рафинирования меди является контроль концентрации меди и примесей в растворе. Медь на аноде растворяется в электролите быстрее, чем происходит покрытие на катоде. В результате медь имеет тенденцию накапливаться в электролите, и ее необходимо контролировать.
Одним из способов контроля содержания меди и примесей в электролите нефтеперерабатывающего завода является схема электролиза. Этот процесс обычно называют «освобождением меди».
Переработка: пиро- и гидрометаллургия
Гидрометаллургия представляет собой процесс, при котором медь, обогащенная электролитом, отделяется от примесей серной кислотой и подвергается экстракции растворителем. и раствор рафината. При электровыделении богатый медью электролит подвергается воздействию электрического тока, который восстанавливает медь в растворе до металлической пластины на катоде. Этот процесс обычно используется для оксидов меди, когда содержание меди низкое.
Этот процесс обычно используется для оксидов меди, когда содержание меди низкое.
Пирометаллургия, как следует из названия, использует высокие температуры для очистки сульфидного медного концентрата. Концентрат нагревают в печи в процессе, называемом плавлением, в результате чего медный концентрат разделяется на два слоя: слой шлака, который содержит примеси, и слой вещества, который содержит медь, достигая степени чистоты около 55%. Сульфиды удаляются и собираются в виде газообразного SO2, который используется для производства серной кислоты. Медный штейн смешивается с реагентами в конвертере для удаления оставшихся сульфидов и оксидов с получением черновой меди, содержащей 97-98% меди. Черновая медь отливается в аноды для электролитического рафинирования, где нечистая медь подвергается электрорафинированию в чистый медный катод. Процесс включает пропускание электрического тока через медный анод и инертный катод, погруженные в кислый раствор сульфата. Нечистая медь на аноде растворяется в кислом растворе и осаждается на катоде в виде чистой меди. Катод из чистой меди продается медеплавильным заводам, которые производят готовую продукцию, такую как медная проволока, катанка и т. д.
Катод из чистой меди продается медеплавильным заводам, которые производят готовую продукцию, такую как медная проволока, катанка и т. д.
Освобождение электрорафинировочного завода
К сожалению, на этом процесс рафинирования меди не заканчивается, и именно здесь эта история становится интересной. Как мы уже упоминали ранее, нечистая медь с анодов растворяется в растворе и повторно осаждается или осаждается на катоде в виде чистой меди, процесс растворения происходит быстрее, чем процесс нанесения покрытия, что приводит к постепенному накоплению ионов меди в электролите нефтеперерабатывающего завода. Концентрация меди продолжает увеличиваться вместе с другими примесями, такими как никель, цинк, мышьяк, висмут, сурьма и многие другие. Чтобы контролировать концентрацию меди и других примесей в электролите, требуется слив раствора, также известный как «9».0095 Copper liberator «Контур. В схемах извлечения меди используется электролиз для удаления меди на различных стадиях истощения.
См. также: Электровыделение 101: Что такое электролиз? , сурьма и т. д., и, следовательно, по мере того, как медь истощается из раствора, качество производимого медного катода ставится под угрозу. Типичная схема высвобождения меди с использованием обычного электролиза производит медь «анодного» качества, которая повторно используется в печи для литья анодов, в то время как загрязненная медь шлам рециркулируется обратно в плавильный завод. Это приводит к высокой циркулирующей нагрузке по меди в интегрированном медном комплексе (плавильный завод-рафинировочный завод) и высокому оборотному капиталу. стибиновые газы, оба чрезвычайно токсичны, когда медь истощены до достаточно низких концентраций.
Идеальной альтернативой для цепей высвобождения меди для извлечения пригодной для продажи катодной меди из отходов нефтеперерабатывающего завода при одновременном улучшении здоровья и безопасности операций высвобождения является использование электролиза emew. Ячейка emew повышает эффективность меднения за счет использования уникальной цилиндрической ячейки, которая значительно увеличивает эффективность извлечения и чистоту продукта.
Ячейка emew повышает эффективность меднения за счет использования уникальной цилиндрической ячейки, которая значительно увеличивает эффективность извлечения и чистоту продукта.
Типичный контур emew liberator производит товарную катодную медь высокой чистоты в качестве основного продукта, при этом лишь небольшое количество меди необходимо возвращать обратно в анодную печь. Это значительно снижает нагрузку на рециркулирующую медь и оборотный капитал, а также повышает степень извлечения при первом проходе, что снижает эксплуатационные расходы. Закрытый характер элемента emew устраняет опасный кислотный туман, а в сочетании с возможностью контроля напряжения отдельных элементов значительно улучшает здоровье и безопасность цепей liberator за счет устранения риска воздействия арсина. Обезмедненный стравливаемый раствор можно дополнительно обработать, чтобы восстановить значения кислотности и никеля.
Одним из распространенных методов является выпаривание для концентрирования никеля с последующей кристаллизацией для получения сырого сульфата никеля (NiSO4), который можно продавать «как есть» с так называемой «черной кислотой» (в среднем 20-25% Ni в раствор серной кислоты) нейтрализуют в отдельной очистной установке. Иногда, если уровень никеля недостаточно высок, для облегчения кристаллизации добавляют дополнительный сульфат никеля.
Иногда, если уровень никеля недостаточно высок, для облегчения кристаллизации добавляют дополнительный сульфат никеля.
Несмотря на кажущуюся простоту этого процесса, ему присущи многие недостатки, такие как:
- Угрозы безопасности — При работе с очень кислой черной кислотой и повышенном воздействии растворов при высоких температурах из-за особенностей испарителя.
- Высокие эксплуатационные расходы — Испарителю требуется электроэнергия для нагревания раствора и последующей обработки или нейтрализации.
- Неустойчивое производство — Производимая черная кислота имеет низкую рыночную стоимость или не имеет ее вообще и обычно отправляется на нейтрализацию как отходы.
Итак, есть ли лучший способ обработки обезмеденного раствора, чтобы повысить ценность?
Передовая альтернатива: поворотный момент ионный обмен для извлечения серной кислоты и получения декислотного раствора никеля. Теперь, когда серная кислота была выделена из стравливаемого электролита, концентрированная и очищенная кислота может быть возвращена на перерабатывающий завод.
Теперь, когда серная кислота была выделена из стравливаемого электролита, концентрированная и очищенная кислота может быть возвращена на перерабатывающий завод.
Затем раствор никеля обрабатывается реагентами для осаждения примесей с получением раствора сульфата никеля, из которого никель можно получить электролизом, используя, например, электролизную ячейку emew. Конечным результатом является катод из никеля высокой чистоты, который идеально подходит для продажи. Нажмите здесь, чтобы узнать, как компания Hindustan Copper Limited недавно внедрила зеленую альтернативу для извлечения меди, кислоты и никеля, используя emew и схему APU.
Итак, в чем ценность для завода по очистке меди модернизации своей цепи освобождения?
При сравнении традиционных методов обезмеднения и извлечения никеля с усовершенствованными схемами, включающими emew-APU-emew, становится ясно, что существует множество преимуществ. Таким образом, схема emew-APU-emew:
- Улучшит здоровье и безопасность — Нет необходимости очищать шлам третичного либератора, не будет подвергаться воздействию кислотного тумана и не может образовываться газ арсин или стибин.

- Более низкие эксплуатационные расходы — Меньшие оборотные средства из-за меньшего количества рециклов меди (меньше некондиционных для анодной печи/плавильного завода), рекуперации кислоты, а не нейтрализации, значительно более низких требований к вентиляции, низких эксплуатационных расходов и низкой рабочей силы.
- Реализация кредитов на побочную продукцию никеля — Извлечение никеля непосредственно в качестве катода высокой чистоты.
- Улучшение контроля примесей — Удаление примесей для очистки, извлечение меди и никеля непосредственно в товарный вид, высококачественный катод из растворов с высоким содержанием примесей.
- Включить расширение мощностей — Больше товарной меди от emew liberators в сочетании с возможностью преобразования существующих ячеек liberator в ячейки очистки для увеличения мощности завода.
Готовы ли вы узнать, как emew advanced liberators в сочетании с ВСУ и извлечением никеля могут принести пользу вашему электрорафинированию меди?
Ссылки :
- Медеплавильные заводы — http://www.
 boliden.com/Global/Smelters/coppersmelters_large.jpg
boliden.com/Global/Smelters/coppersmelters_large.jpg - Переработка меди: от руды к рынку (2011 г.) – http://investingnews.com/daily/resource-investing/base-metals-investing/copper-investing/copper-refining-from-ore-to-market/
- «Извлечение никеля из завода по выпуску электролитов на заводе Atlanic Copper», Г. Риос, Р. Рамирес, И. Руис и И. Гонсалес (2013 г.).
обработка никеля | Британика
никелевые брикеты
Смотреть все материалы
- Похожие темы:
- обработка материалов
никель
См. все связанные материалы →
обработка никеля , подготовка металла для использования в различных продуктах.
Несмотря на то, что никель (Ni) наиболее известен своим использованием в чеканке монет, он стал гораздо более важным благодаря своим многочисленным промышленным применениям, которые обязаны своим значением уникальному сочетанию свойств. Никель имеет относительно высокую температуру плавления 1453 ° C (2647 ° F) и гранецентрированную кубическую кристаллическую структуру, что придает металлу хорошую пластичность. Никелевые сплавы обладают высокой коррозионной стойкостью в самых различных средах и обладают способностью выдерживать диапазон высоких и низких температур. В нержавеющих сталях никель улучшает стабильность защитной оксидной пленки, обеспечивающей коррозионную стойкость. Его основной вклад связан с хромом в аустенитных нержавеющих сталях, в которых никель позволяет сохранить аустенитную структуру при комнатной температуре. Современные технологии в значительной степени зависят от этих материалов, которые составляют жизненно важную часть химической, нефтехимической, энергетической и смежных отраслей промышленности.
Никель имеет относительно высокую температуру плавления 1453 ° C (2647 ° F) и гранецентрированную кубическую кристаллическую структуру, что придает металлу хорошую пластичность. Никелевые сплавы обладают высокой коррозионной стойкостью в самых различных средах и обладают способностью выдерживать диапазон высоких и низких температур. В нержавеющих сталях никель улучшает стабильность защитной оксидной пленки, обеспечивающей коррозионную стойкость. Его основной вклад связан с хромом в аустенитных нержавеющих сталях, в которых никель позволяет сохранить аустенитную структуру при комнатной температуре. Современные технологии в значительной степени зависят от этих материалов, которые составляют жизненно важную часть химической, нефтехимической, энергетической и смежных отраслей промышленности.
История
Никель использовался в промышленности в качестве легирующего металла почти за 2000 лет до того, как он был выделен и признан новым элементом. Еще в 200 г. до н. э. китайцы производили значительное количество белого сплава из цинка и медно-никелевой руды, найденной в провинции Юньнань. Сплав, известный как pai-t’ung , экспортировался на Ближний Восток и даже в Европу.
Сплав, известный как pai-t’ung , экспортировался на Ближний Восток и даже в Европу.
Позже горняки в Саксонии обнаружили нечто похожее на медную руду, но обнаружили, что при ее переработке получается только бесполезный шлакоподобный материал. Они считали его заколдованным и приписывали дьяволу, «Старому Нику». Таким образом, он стал известен как купферникель (медь Старого Ника). Именно из этой руды, изученной Акселем Фредриком Кронштедтом, в 1751 г. был выделен и признан новым элементом никель. В 1776 г. было установлено, что pai-t’ung , ныне называемый нейзильбером, состоял из меди, никеля и цинка.
Спрос на нейзильбер был стимулирован в Англии примерно в 1844 г. развитием гальванопокрытия серебра, для которого оно оказалось наиболее подходящей основой. Использование чистого никеля в качестве антикоррозионного гальванического покрытия появилось несколько позже; оба эти использования по-прежнему важны.
Небольшие количества никеля производились в Германии в середине 19 века. Более значительные объемы поступали из Норвегии, а немного — с шахты в Гэпе, штат Пенсильвания, в Соединенных Штатах. Новый источник, Новая Каледония в южной части Тихого океана, начал добычу примерно в 1877 г. и доминировал до разработки медно-никелевых руд в регионе Коппер-Клифф-Садбери, Онтарио в Канаде, который после 1905 стал крупнейшим в мире источником никеля. К концу 1970-х производство в Советской России превысило производство в Канаде. К началу 21 века Китай стал мировым лидером по производству никеля, за ним следуют Россия, Япония, Австралия и Канада.
Более значительные объемы поступали из Норвегии, а немного — с шахты в Гэпе, штат Пенсильвания, в Соединенных Штатах. Новый источник, Новая Каледония в южной части Тихого океана, начал добычу примерно в 1877 г. и доминировал до разработки медно-никелевых руд в регионе Коппер-Клифф-Садбери, Онтарио в Канаде, который после 1905 стал крупнейшим в мире источником никеля. К концу 1970-х производство в Советской России превысило производство в Канаде. К началу 21 века Китай стал мировым лидером по производству никеля, за ним следуют Россия, Япония, Австралия и Канада.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Канадские руды представляют собой сульфиды, содержащие никель, медь и железо. Наиболее важным минералом никеля является пентландит, (Ni, Fe) 9 S 8 , за которым следует пирротин, обычно в диапазоне от FeS до Fe 7 S 8 , в котором часть железа может быть заменена никелем. Халькопирит, CuFeS 2 , является преобладающим минералом меди в этих рудах с небольшим количеством другого минерала меди, кубанита, CuFe 2 S 3 . Также присутствуют некоторое количество золота, серебра и шести металлов платиновой группы, и их извлечение имеет важное значение. Кобальт, селен, теллур и сера также могут быть извлечены из руд.
Халькопирит, CuFeS 2 , является преобладающим минералом меди в этих рудах с небольшим количеством другого минерала меди, кубанита, CuFe 2 S 3 . Также присутствуют некоторое количество золота, серебра и шести металлов платиновой группы, и их извлечение имеет важное значение. Кобальт, селен, теллур и сера также могут быть извлечены из руд.
Другими важными классами руд являются латериты, которые являются результатом длительного выветривания перидотита, первоначально содержащего небольшой процент никеля. Выветривание в субтропическом климате удаляет большую часть вмещающей породы, но содержащийся никель растворяется и просачивается вниз, и его концентрация может достигать достаточно высокой концентрации, чтобы сделать добычу экономически выгодной. Из-за этого способа образования латеритные отложения обнаруживаются вблизи поверхности в виде мягкого, часто глинистого материала с концентрацией никеля в пластах в результате выветривания. Гарниерит, (NiMg) 6 Si 4 O 10 (OH) 8 , никель-магниевый силикат, самый богатый никелем, но никельсодержащий лимонит, (Fe, Ni)O(OH)· n H 2 O, составляет основную часть латеритов. Месторождения Новой Каледонии относятся к типу гарниерита, а многочисленные другие месторождения латерита разбросаны по всему миру, что создает широкий спектр проблем с добычей, транспортировкой и добычей. Содержание никеля в латеритах сильно варьируется: например, в Ле Никеле в Новой Каледонии руда, доставленная на плавильный завод в 1900 содержал 9 процентов никеля; в настоящее время он содержит от 1 до 3 процентов.
Месторождения Новой Каледонии относятся к типу гарниерита, а многочисленные другие месторождения латерита разбросаны по всему миру, что создает широкий спектр проблем с добычей, транспортировкой и добычей. Содержание никеля в латеритах сильно варьируется: например, в Ле Никеле в Новой Каледонии руда, доставленная на плавильный завод в 1900 содержал 9 процентов никеля; в настоящее время он содержит от 1 до 3 процентов.
Поскольку никель обнаружен в двух совершенно разных типах руды, неудивительно, что методы добычи различаются. Сульфидные месторождения обычно добываются подземным способом, как и медь, хотя некоторые месторождения на ранних стадиях добывались открытым способом. Добыча латеритов в основном представляет собой землеройную операцию с использованием больших экскаваторов, драглайнов или фронтальных погрузчиков, извлекающих богатые никелем пласты и выбрасывающих большие валуны и отходы. Руда загружается в самосвалы в забое, как в карьере, и доставляется на плавильный завод.
Terrafame Ltd
Terrafame Ltd — многопрофильная металлургическая компания, производящая никель, цинк, кобальт и медь на своем руднике и металлургическом заводе, расположенном в Соткамо, Финляндия. Наша цель — вести экологически устойчивую, безопасную и прибыльную деятельность.
Стратегическая дорожная карта
Основная стратегическая цель компании была ясна с самого начала деятельности: компания стремится войти в число 25% самых рентабельных мировых производителей никеля. Наращивание производства прошло гладко, и теперь компания намерена продолжать свои целенаправленные и систематические усилия по повышению эффективности своей работы.
Стратегическое направление Terrafame было определено осенью 2018 года. Тогда же было принято решение инвестировать в завод по производству аккумуляторных химикатов. После завершения строительства завод будет использовать текущий основной продукт завода по извлечению металлов — сульфид никеля-кобальта — в качестве сырья. Когда компания начнет очищать промежуточные продукты, которые в настоящее время продаются в качестве сырья компаниям по переработке металлов, она продвинется по цепочке создания стоимости и станет производителем специальных химикатов. Новый завод является одним из крупнейших в мире предприятий по производству сульфата никеля, используемого в батареях электромобилей.
Когда компания начнет очищать промежуточные продукты, которые в настоящее время продаются в качестве сырья компаниям по переработке металлов, она продвинется по цепочке создания стоимости и станет производителем специальных химикатов. Новый завод является одним из крупнейших в мире предприятий по производству сульфата никеля, используемого в батареях электромобилей.
Для компании Terrafame продвижение вперед в цепочке переработки также означает изменение ее позиции на рынке химикатов для аккумуляторов. Цель состоит в том, чтобы превратить Terrafame в бренд, демонстрирующий глубокие корни нашей компании в регионе Кайнуу, а также ее сильные стороны:
- Значительные ресурсы никеля на руднике Соткамо
- Наш уникальный интегрированный производственный процесс от карьера до химикатов для аккумуляторов
- Низкий углеродный след нашего производства
- Наша устойчивая и отслеживаемая европейская цепочка поставок
- Наш квалифицированный персонал
Управление
Мы стремимся к надлежащему управлению нашей коммерческой деятельностью. Помимо законов и нормативных актов, мы руководствуемся краеугольными камнями нашей деятельности — безопасностью, эффективностью и приверженностью делу — а также нашими принципами работы.
Помимо законов и нормативных актов, мы руководствуемся краеугольными камнями нашей деятельности — безопасностью, эффективностью и приверженностью делу — а также нашими принципами работы.
Принятие решений Terrafame соответствует Уставу, Закону Финляндии об обществах с ограниченной ответственностью и другим действующим законам. Мы также соблюдаем Кодекс корпоративного управления Финляндии для зарегистрированных на бирже компаний.
Охрана труда
Безопасность персонала является одним из краеугольных камней деятельности Terrafame. Мы стремимся снизить частоту несчастных случаев как с нашим персоналом, так и с компаниями-партнерами.
Наши менеджеры играют ключевую роль в развитии культуры безопасности. Руководство и представители отдела участвуют в регулярных обходах по безопасности на нашей производственной площадке. Нашему персоналу выплачивается дополнительная ежемесячная надбавка за безопасность, если не было несчастных случаев, повлекших за собой отсутствие.
Все наши операции основаны на двух принципах безопасности:
- Работа будет выполняться безопасно или не будет выполняться вообще.
- Всегда есть время сделать все безопасно, аккуратно и по инструкции.
Ответственность
Кодекс деловой этики Terrafame основан на видении компании и корпоративной культуре. Кодекс объединяет правила работы в Terrafame и распространяется на всех сотрудников Terrafame и ее деловых партнеров. Кодекс устанавливает общие обязанности, которые далее определяются в более подробных и конкретных политиках и стандартах Terrafame. Практическое применение Кодекса поддерживается системой управления компанией и специальными инструкциями.
В сфере безопасности наша цель – обеспечить безопасную и здоровую рабочую среду и безопасные методы работы. Наша постоянная цель – ноль несчастных случаев. Мы также стремимся постоянно улучшать наши экологические показатели, управлять рисками, связанными с нашей деятельностью, и снижать воздействие на окружающую среду.
Наша деятельность всегда должна осуществляться ответственно и прозрачно. Мы открыто и честно информируем наших сотрудников, партнеров, соседей и заинтересованные стороны о нашей горнодобывающей и производственной деятельности и ее влиянии.
Мы также стремимся к прибыльности и производительности нашей деятельности. Таким образом, мы можем предложить долгосрочную занятость в промышленности в регионе Кайнуу, тем самым улучшая благосостояние в этом районе.
Кодекс деловой этики Terrafame (pdf, 122 КБ)
Политика устойчивого развития Terrafame (pdf, 208 КБ)
Terrafame — выберите климат
Отчетность
Terrafame сообщает о своей деятельности в финансовых обзорах и промежуточных отчетах. Годовые отчеты за 2015–2018 годы включают также финансовый обзор, финансовую отчетность, отчет о корпоративном управлении и отчет о заработной плате и вознаграждении. Годовые отчеты за 2015–2017 годы содержат также отчеты предшественника Финской группы минералов, компании Terrafame Group Ltd, отчеты Совета директоров и финансовые отчеты.
2021
Sustainability Review: Towards Carbon Neutral Battery Chemicals
— pdf (2.5Mb)
— flipbook
Financial Review 2021 (pdf, 1,7Mb)
Corporate Governance Statement 2021 (pdf, 774kb )
Отчет о вознаграждениях за 2021 г. (pdf, 209 КБ)
2020
Обзор устойчивого развития: создание ответственной цепочки создания стоимости аккумуляторов
— pdf (5.0Мб)
— флипбук
Финансовый обзор за 2020 г., включая обзор Совета директоров и финансовую отчетность (pdf, 1.9).Mb)
Отчет о корпоративном управлении за 2020 г. (pdf, 711 КБ)
Отчет о вознаграждениях за 2020 г. (pdf, 608 КБ)
2019
Обзор устойчивого развития за 2019 г.
Финансовый обзор и финансовый отчет Совета директоров за 2019 г. , 4Mb)
Отчет о корпоративном управлении за 2019 год (pdf, 2Mb)
Отчет о вознаграждении за 2019 год (pdf, 2 Mb)
Политика вознаграждения (pdf, 2 Mb)
Ранее
Годовой отчет за 2018 год (pdf, 2,290Mb3)
Годовой отчет за 2017 г. (pdf, 1,6 Мб)
(pdf, 1,6 Мб)
Годовой отчет за 2016 г. (pdf, 3,3 Мб)
Годовой отчет за 2015 г. (pdf, 3,0 Мб)
Растущий спрос на электромобили привлекает внимание к единственному в Америке никелевому руднику.
Разбитая на куски горная порода, теперь называемая рудой, в течение двух часов поднимается на поверхность, прежде чем ее транспортируют на дробильную мельницу, которая отделяет ценные минералы в процессе флотации, в результате чего образуется комковатая серая фильтровальная корка.
Этот концентрат загружают в поезда и отправляют в Канаду на переплавку и переработку в сульфат, используемый в литий-ионных батареях, питающих электромобили.
В течение почти десяти лет это происходит круглосуточно на Верхнем полуострове штата Мичиган, где руда из двух крупных месторождений под равнинами Желтая собака возле Маркетта составляет 100 процентов внутреннего предложения никеля в Соединенных Штатах.
С 2014 года рудник Eagle поместил Америку на карту глобального производства критического минерала, который играет ключевую роль в сокращении выбросов углекислого газа от автомобилей, вызывающих потепление климата. Шахта, принадлежащая компании Lundin Mining Co. из Торонто, является единственным местом в США, где добывается никель, минерал, который помогает увеличить накопление энергии в литий-ионных батареях и, таким образом, увеличить запас хода электромобиля на одной зарядке. произведено.
Шахта, принадлежащая компании Lundin Mining Co. из Торонто, является единственным местом в США, где добывается никель, минерал, который помогает увеличить накопление энергии в литий-ионных батареях и, таким образом, увеличить запас хода электромобиля на одной зарядке. произведено.
Этот статус привлек внимание к Eagle Mine, поскольку растущий импульс производства электромобилей (EV) повышает спрос на никель для аккумуляторов; минерал, в основном добываемый в таких странах, как Россия, Бразилия, Индонезия и Филиппины, где нестрогие экологические нормы и грязные методы добычи подрывают экологический дух рынка электромобилей.
«Никелевые рудники мирового класса со стабильными политическими обоснованиями крайне редки», — сказал Роберт Джонстон, научный сотрудник Центра глобальной энергетической политики Колумбийского университета и бывший генеральный директор Eurasia Group, который руководит практикой консалтинговой фирмы в области климата и энергетики.
«Они поступили правильно, разработав крупный никелевый рудник на востоке США в штате с высокими стандартами экологической и социальной оценки проектов такого рода», — сказал Джонстон.
Противостояние окружающей среде ослабевает в UP
Шахта Eagle добывает никель из двух рудных тел уже около восьми лет. Ежедневно добывается «массивная» и «полумассивная» руда, содержащая от 6,5 до 1,5 процента никеля, в результате чего в 2021 году будет получено около 18 000 тонн никелевого концентрата. Рудник также производит около 18 000 тонн медного концентрата и меньший объем кобальта, около 380 тонн.
Сегодня Eagle Mine ближе к концу своей жизни, чем к ее началу. Если не будет найдено больше руды, шахта закроется примерно через четыре года. Когда в 2014 году началась добыча, Eagle был первым за последние десятилетия новым рудником, открытым в Мичигане, и это не обошлось без многочисленных споров.
Шахта производит сульфидную руду, которую необходимо дробить и измельчать для извлечения полезных ископаемых из пустой породы, известной как хвостохранилище. Экологические группы, племена и частный горный клуб гуронов обеспокоены тем, что серокислые стоки из шахты могут попасть в грунтовые воды и в две реки, Лососевую форель и Желтую собаку, расположенные поблизости.
Компания Kennecott Minerals Co. открыла месторождение Орла в 2002 году, и компания потратила более десяти лет на получение разрешений и судебные разбирательства, которые в конечном итоге прекратились.
С тех пор «было довольно тихо», — сказала Мелани Хамфри, техник-геолог в отделе нефти, газа и полезных ископаемых Департамента окружающей среды, Великих озер и энергетики Мичигана (EGLE), который следит за выбросами отходов шахты и выдает разрешения. согласие. «Мы действительно не получали никаких жалоб в течение довольно долгого времени».
В отделе водных ресурсов EGLE Рэнди Конрой сказал, что шахта упоминалась из-за незначительных проблем со сбросом, но «поскольку они очень оперативно и своевременно сообщают о своих уведомлениях и корректирующих действиях, на самом деле это не обострилось».
Первоначальные опасения по поводу реки Лососевой форели, особенно для редкого вида форели, называемой форелью каботажного ручья, не оправдались, сказал Конрой. «Разряд шахты в конце концов попадает туда, но мониторинг не показывает, что он повлияет на этих рыб».
Аэрофотоснимок рудника Лундин Игл недалеко от Биг-Бей, штат Мичиган. Никелевый и медный рудник был открыт в 2014 году и планируется закрыть в 2026 году. мониторинг, но данные проверяются Superior Watershed Partnership, некоммерческой организацией, работающей совместно с индейской общиной Keweenaw Bay и Фондом сообщества округа Маркетт.
Лундин оплачивает программу, и данные размещаются в Интернете. Экологические испытания выходят за рамки того, что требуется в разрешении на шахту, и включают анализ съедобных ягод и растений, имеющих культурное значение в этом районе. Программа вызвала широкий интерес и была включена в учебники по горному делу как пример передовой практики.
«Теперь это воспроизведено по всему миру. С нами связались различные шахты и университеты, которые хотят запустить подобную программу», — сказала Джеральдин Грант, старший планировщик и биолог из Superior Watershed Partnership. «Каждый год мы получаем запросы».
Хорст Шмидт, президент Экологической коалиции Верхнего полуострова (UPEC), которая выступила против шахты, сказал, что внимание их группы переключилось на борьбу с другим проектом, предлагаемым открытым золотым рудником вдоль реки Меномини под названием Back Forty.
Шмидт сдержанно похвалил Лундина.
«Они, вероятно, лучше, чем большинство компаний, о которых я читал», — сказал Шмидт. «На самом деле это добросовестная горнодобывающая компания, и, похоже, они соблюдают правила».
«Если им что-то сойдет с рук, я подозреваю, что они это делают».
Лундин купил рудник у Rio Tinto, материнской компании Kennecott, в 2013 году за 325 миллионов долларов. В 2016 году компания начала проходку второго рудного тела примерно в миле к востоку и на глубине 2500 футов. Второе месторождение, Орлиное Восточное, начало добычу никеля в 2019 году.. Восточное месторождение продлило срок службы рудника с 2023 по 2025 год, после чего стволы будут засыпаны, а здания снесены. Эта дата закрытия была недавно перенесена на год, до 2026 года, после того как повышение цен на никель сделало руду с более низким содержанием пригодной для добычи.
Продолжается поисковое подземное бурение дополнительных залежей. Новое открытие может продлить жизнь рудника, а также мельницы Гумбольдта, перепрофилированной металлургической фабрики недалеко от Ишпеминга, которая прошла реабилитацию стоимостью 275 миллионов долларов, чтобы вернуть ее к функциональной жизни.
На шахте и фабрике работает около 400 человек, некоторые из которых ездят на работу из Айрон-Маунтин, Кристал-Фолс и Висконсин. Джереми Франсуа, начальник завода, приезжает из Пелки, примерно в часе езды на запад.
Джефф Порье, консультант Eagle Mine по охране труда и технике безопасности, сказал, что шахта продолжит нанимать людей даже после истощения рудных тел.
«После того, как мы закончим работу, предстоит еще много работ по сносу и строительству. Для этого потребуются люди, отвечающие за безопасность и защиту окружающей среды. На самом деле я не думаю о 2026 году как о своей конечной дате», — сказал Порье. — Я имею в виду, что после этого многое произойдет.
Рост рынка электромобилей создает огромный спрос на никель
Внешние силы привлекли внимание к руднику Игл.
По данным международной исследовательской компании Roskill, ожидается, что к 2030 году 36 процентов мирового производства никеля будет направлено на производство аккумуляторов по сравнению с 6 процентами в 2020 году. Рудник в основном поставляет на мировой рынок нержавеющую сталь, которая является крупнейшим источником никеля в целом. , но доля производства аккумуляторов для электромобилей быстро растет.
Рудник в основном поставляет на мировой рынок нержавеющую сталь, которая является крупнейшим источником никеля в целом. , но доля производства аккумуляторов для электромобилей быстро растет.
Растущий спрос в сочетании с недавней волатильностью цен на никель, вызванной проблемами с поставками на фоне начала войны России с Украиной, вызвали повышенный интерес к руднику Eagle в этом году, сказал Мэтт Джонсон, менеджер по внешним связям Eagle Mine.
В январе шахта привлекла к себе большое внимание в социальных сетях, когда компания Porsche опубликовала видео о занесенной в Книгу рекордов Гиннеса попытке добиться изменения высоты на 3 мили на электромобиле, который ехал со дна Игл-Ист, самой низкой точки для движения. в Америке, по всей стране до Пайкс-Пика в Колорадо, самой высокой точки, по которой можно проехать.
В апреле президент Байден приказал Министерству обороны рассматривать пять металлов — литий, кобальт, графит, никель и марганец — как необходимые для национальной безопасности в соответствии с Законом об оборонном производстве из-за их важности для аккумуляторных технологий. Использование закона времен холодной войны для стимулирования добычи полезных ископаемых может привести к новым субсидиям для внутренней добычи и переработки полезных ископаемых, от которых США в значительной степени зависят от Китая и других стран.
Использование закона времен холодной войны для стимулирования добычи полезных ископаемых может привести к новым субсидиям для внутренней добычи и переработки полезных ископаемых, от которых США в значительной степени зависят от Китая и других стран.
Единая точка производства в сочетании с нехваткой внутренних мощностей по выплавке и рафинированию никеля для аккумуляторов «создает риск цепочки поставок для производства аккумуляторов во всем мире, а не только в Соединенных Штатах», согласно обзору цепочки поставок Белого дома за 2021 год. , который рекомендовал федеральному правительству инвестировать в отечественный никелевый завод.
«Мы получили много звонков от правительства, штата и федерального правительства, спрашивая наше мнение, знаете ли, «что бы вы сделали для политики внутреннего планирования» и «что вы думаете об этом?», — сказал Джонсон. «У нас определенно есть мнение из-за нашего опыта».
Прямые запросы также поступают от автопроизводителей.
— Например, на прошлой неделе звонил «Фольксваген», — сказал Джонсон. Рудник работает с университетами над исследованиями новых технологий в области устойчивой добычи полезных ископаемых.
Рудник работает с университетами над исследованиями новых технологий в области устойчивой добычи полезных ископаемых.
На глубине 3000 футов в шахте Eagle возле Биг-Бей, штат Мичиган, горняк с помощью анкероустановщика укладывает защитную проволочную сетку вокруг туннеля, чтобы предотвратить обвалы. (Предоставлено | Орлиный рудник)
Устойчивое производство никеля представляет большой интерес для автопроизводителей по мере роста производства электромобилей. Стремительно растут продажи автомобилей, работающих от аккумуляторов. С апреля по июнь этого года на электромобили приходилось 5,6% всех продаж автомобилей, что вдвое больше, чем год назад. Спрос превышает предложение, поскольку производители борются с нехваткой важнейших компонентов, таких как полупроводники, и ростом цен на элементы аккумуляторов, такие как никель и литий.
Переход рынка на электромобили привел производителей автомобилей к прямому контакту с горнодобывающими компаниями для получения сырья. General Motors подписывает соглашения с такими горнодобывающими компаниями, как Glencore, на поставку кобальта. Tesla подписала с Talon Metals соглашение о поставках никеля с предполагаемого рудника Tamarack в Миннесоте, который еще не прошел процесс получения разрешений и который планируется открыть в 2026 году9.0003
Tesla подписала с Talon Metals соглашение о поставках никеля с предполагаемого рудника Tamarack в Миннесоте, который еще не прошел процесс получения разрешений и который планируется открыть в 2026 году9.0003
В 2021 году Tesla подписала контракты на поставку никеля в Австралию и Новую Каледонию, небольшую французскую территорию недалеко от Фиджи. Генеральный директор Tesla Илон Маск ясно дал понять, что компания хочет получать поставки от рудников, которые производят никель «экологически чувствительным способом». В Миннесоте в рамках проекта Tamarack разрабатывается технология улавливания, которая будет химически связывать углерод с горными породами на руднике, что позволит компании продавать свой никель как углеродно-нейтральный.
Горнодобывающие компании, такие как Lundin и Rio Tinto, хотят находиться в стабильных юрисдикциях, где экологические стандарты более жесткие, но также прозрачные и обеспечивают определенный уровень уверенности, сказал Джонстон из Колумбийского университета. Это может занять больше времени, чтобы получить разрешение в США, но «как только вы это сделаете, гораздо менее вероятно, что правительство изменит условия, национализирует ресурсы или вы будете захвачены местными протестующими».
Это может занять больше времени, чтобы получить разрешение в США, но «как только вы это сделаете, гораздо менее вероятно, что правительство изменит условия, национализирует ресурсы или вы будете захвачены местными протестующими».
Чарльз Гриффит, директор климатической и энергетической программы Экологического центра в Анн-Арборе, сказал, что растущий спрос на электромобили создает возможность модернизировать законы о добыче полезных ископаемых.
«В США мы все еще работаем в соответствии с довольно древними законами о добыче полезных ископаемых, которые давно не обновлялись», — сказал Гриффит, который работает с некоммерческой организацией Clean Fuels Michigan. «Это возможность заниматься майнингом более устойчивым образом и с большим участием сообщества».
«Это, вероятно, с большей вероятностью произойдет в США, чем в некоторых других странах, где законы еще слабее», — сказал Гриффит.
Джонстон сказал, что Eagle Mine оказалась исключением из обычного стенания, которое он часто слышит в Вашингтоне, округ Колумбия, о том, что «вы просто не можете строить проекты по добыче полезных ископаемых в США». из-за обременительных и длительных разрешений и высоких экологических стандартов.
из-за обременительных и длительных разрешений и высоких экологических стандартов.
По мере того, как мир движется к более чистому транспорту, «вы должны признать, что где-то эти полезные ископаемые должны быть добыты, и лучше ли делать это в Мичигане с операцией мирового класса и прозрачностью, или в Конго или Индонезии, где добывается шахта. работать по экономическим причинам, не обращая внимания на экологические стандарты», — сказал Джонстон.
«Если бы этот проект сейчас проходил процесс получения разрешений, я думаю, у вас бы выстроилась очередь НПО, чтобы поддержать его».
Истории по теме:
Правозащитники борются за сохранение леса Кевино
Эко-катастрофа стоимостью 1 миллиард долларов поглотила побережье Кевино
Скалы на фото наводнили рекордные туристы
Климатический план Мичигана предусматривает использование 60% возобновляемой энергии к 2030 году
Детройтский предприниматель выходит на арену зарядки электромобилей
Мичиган добавляет 600 рабочих мест в автомобилестроении, электромобилях и полупроводниках
U. P. Дебаты об охоте на волков в Мичигане по модели фермы
P. Дебаты об охоте на волков в Мичигане по модели фермы
Ослы защищают домашний скот в битве с серыми волками
Старейшая в мире пара гагар рассталась после 25 лет пребывания в приюте UP
Стоимость проекта восстановления Soo Locks превысила 1 млрд долларов
Доступ на остров через пешеходный мост приходит к водопаду Тахкуаменон
Над Китч-ити-кипи: Большой источник величественен с воздуха
Примечание для читателей: если вы покупаете что-то по одной из наших партнерских ссылок, мы можем получить комиссию.
Страница не найдена
Критерий поиска
Сожалеем, но на сайте нет страницы, соответствующей вашей записи.
Возможно, вы неправильно набрали адрес или страница может не
дольше существуют. Вы можете попробовать другую запись или выбрать из
ссылки ниже, которые, мы надеемся, помогут вам найти то, что вы ищете.
Если вы считаете, что эта страница должна существовать, отправьте электронное письмо по адресу
support@q4inc.


