Физические свойства меди: Опишите физические свойства: а)Меди;б)Воды;в)Соли — ответ на Uchi.ru
Содержание
Как определить, что перед нами: латунь или медь, их основные отличия
Самородная медь размером около 4 см
Медь
— минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Смотрите так же:
Золото
— структура и физические свойства
Алюминий
— структура и физические свойства
Медь и ее сплавы
Металл имеет красновато-желтый оттенок благодаря оксидной пленке, которая образуется при первом взаимодействии металла с кислородом. Пленка придает благородный вид и обладает антикоррозийными свойствами.
Пленка придает благородный вид и обладает антикоррозийными свойствами.
Сейчас доступно несколько способов добычи металла. Распространёнными являются медный колчедан и блеск, которые встречаются в виде сульфидных руд. Каждая из технологий получения меди требует особого подхода и следования процессу.
Добыча в природных условиях происходит в виде поиска медных сланцев и самородков. Объемные месторождения в виде осадочных пород находятся в Чили, а медные песчаники и сланцы расположились на территории Казахстана. Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Основной порядок плавления и свойства:
- на температурных порогах от 20 до 100° материал полностью сохраняет свои свойства и внешний вид, верхний оксидный слой остается на месте;
- кристаллическая решетка распадается на отметке 1082°, физическое состояние становится жидким, а цвет белым. Уровень температуры задерживается на некоторое время, а затем продолжает рост;
- температура кипения меди начинается на отметке 2595°, выделяется углерод, происходит характерное бурление;
- при отключении источника тепла происходит снижение температуры, происходит переход в твердую стадию.

Плавка меди возможна в домашних условиях, при соблюдении определенных условий. Этапы и сложность задачи зависят от выбора оборудования.
Кровельные покрытия
Оригинальный цвет, присущий меди, а также её антикоррозийное свойство сыграли большую роль в освоении её как кровельного материала ещё много лет назад. Долго в этом качестве использовали более дешёвые сталь и алюминий, но в последнее время дизайнеров и архитекторов вновь заинтересовал необычный металл.
Кровля из медного покрытия отличается не только роскошностью и привлекательностью, но также высоким качеством и долгим сроком службы, способностью противостоять различным воздействиям: механическим, температурным и другим. Дома с медной кровлей имеют стильный и презентабельный вид.
Благодаря технологическим возможностям сейчас сразу можно получать медь нужного цвета, раньше дома покрывались жёлто-блестящего цвета металлолом. Со временем цвет кровли постепенно темнел, так как формировался оксид металла на её поверхности. А ещё через время химические процессы, которые происходили под действием окружающей среды, образовывали на кровле слой патины малахитово-зелёного цвета. Благодаря такому слою металл надёжно защищён от коррозионного процесса, поэтому крыши, покрытые патиной, служат несколько десятилетий и при этом сохраняют свои эксплуатационные характеристики.
А ещё через время химические процессы, которые происходили под действием окружающей среды, образовывали на кровле слой патины малахитово-зелёного цвета. Благодаря такому слою металл надёжно защищён от коррозионного процесса, поэтому крыши, покрытые патиной, служат несколько десятилетий и при этом сохраняют свои эксплуатационные характеристики.
В настоящее время специализированные магазины снабжены множеством каталогов, где сразу можно подобрать медные листы, подходящего цвета, для покрытия крыши. Благодаря современным технологиям на выбор представлен классический, оксидированный и патинированный тип покрытия.
Сейчас медь используют не только для кровель домов, но и для фасадов. Это и красиво, и выгодно. Фасад из меди не нуждается в особом уходе, не выгорает на солнце, защищает строение от перепадов температуры и повышенной влажности.
Оригинальностью цвета отличаются оксид и сульфат меди, широко применяющиеся в промышленности. Оксид меди, у которого кристаллы чёрного цвета, используется для тонирования стеклянных и лакокрасочных материалов. Сульфат меди не применяется как краситель, но зато обладает чудным сине-бирюзовым цветом.
Сульфат меди не применяется как краситель, но зато обладает чудным сине-бирюзовым цветом.
Физические свойства
Основные характеристики металла:
- в чистом виде плотность металла составляет 8.93 г/см3;
- хорошая электропроводность с показателем 55,5S, при температуре около 20⁰;
- теплопередача 390 Дж/кг;
- кипение происходит на отметке 2600°, после чего начинает выделение углерода;
- удельное электрическое сопротивление в среднем температурном диапазоне – 1.78×10 Ом/м.
Основными направлениями эксплуатации меди является электротехнические цели. Высокая теплоотдача и пластичность дают возможность применения к различным задачам. Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы.
 Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением. - Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород.
 Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается. - Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
- Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.
Химический состав меди
- Марганец.
 Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока. - Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
- Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
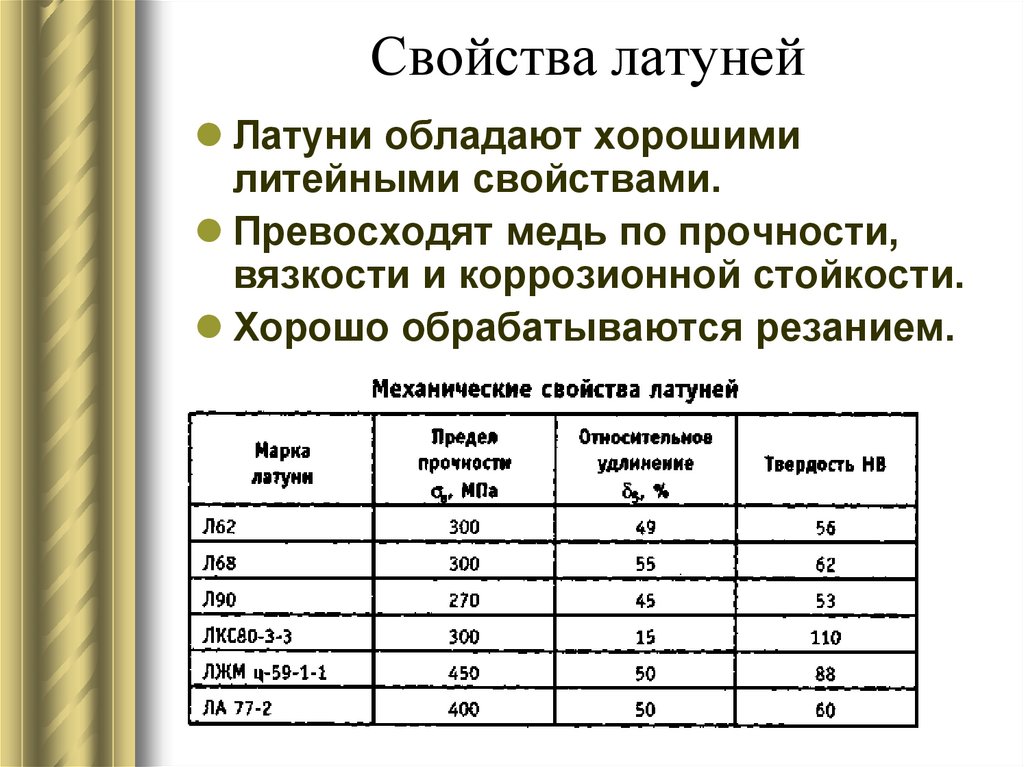
Латунь
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию.
 Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях. Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Добыча металла
В природе медь в виде самородков встречается чаще, по сравнению с золотом, серебром или железом. Древнейшие медные предметы, а также шлак, свидетельствующий о выплавке её из руды, были обнаружены в Турции при раскопках древних поселений. Из истории известно, что за каменным веком последовал медный, характеризующийся изготовлением и применением медных предметов. Исследования учёных говорят о том, что даже при мягкости металла орудия труда из меди выигрывают в скорости строгания, рубки, сверления и распила древесины у каменных изделий.
Исследования учёных говорят о том, что даже при мягкости металла орудия труда из меди выигрывают в скорости строгания, рубки, сверления и распила древесины у каменных изделий.
Медные руды — это залежи минералов, которые содержат не только медь, но и другие вещества, способствующие формированию их свойств, например, никель. Медными считают те виды руд, в которых содержание количества меди было бы достаточным для целесообразной добычи промышленными способами. Таким требованиям соответствуют руды, содержащие цветной металл в пределах от 0,5 до 1%. Земля располагает ресурсами, содержащими медь, 90% из которых — медно-никелевые руды.
Сейчас добывают руду в ряде стран, но наиболее масштабные месторождения отмечаются в Австралии, Чили, Индонезии, США. В последние годы непрерывный процесс добычи этого металла заметно сократился. Это обуславливается широким использованием в промышленности лома (сырья).
Из-за прочности металла и способности сохранять свои физико-химические свойства продолжительное время жизненный цикл у меди довольно долгий, хотя изделия приходят со временем в негодность. Они сдаются в металлоприемные пункты, и начинается новый процесс переработки медного лома, состоящий из нескольких этапов и положительно влияющий на экономику производства. При этом недра земли остаются нетронутыми, к тому же переработка руды требует немалых затрат энергии, а на переработку лома расходуется на 90% меньше. Таким высоким показателем характеризуются далеко не все металлы.
Они сдаются в металлоприемные пункты, и начинается новый процесс переработки медного лома, состоящий из нескольких этапов и положительно влияющий на экономику производства. При этом недра земли остаются нетронутыми, к тому же переработка руды требует немалых затрат энергии, а на переработку лома расходуется на 90% меньше. Таким высоким показателем характеризуются далеко не все металлы.
Медь принадлежит к группе цветных металлов, даже руда отличается выраженным медным цветом. Добычу руды осуществляют в основном открытым способом, то есть без шахтных сооружений, а металл извлекается с применением обогащения методом флотации. Рудная порода смачивается водой, вещества, не содержащие металл, увлажняются и слипаются, образуя отходы, а не смоченные частицы поднимаются вверх и образуют пену. Затем медная руда подвергается дополнительному циклу очистки, отправляется в плавильную печь, потом на изготовление заготовок.
Температура плавления меди
Плавится материал при определенной температуре, которая зависит от наличия и количества сплавов в составе.
В большинстве случаев, процесс происходит при температуре от 1085°. Наличие олова в сплаве дает разбег, плавление меди может начаться при 950°. Цинк в составе также понижает нижнюю границу до 900°.
Для точных расчетов времени понадобится график плавления меди. На обычном листке бумаги используется график, где по горизонтали отмечается время, а по вертикали градусы. График должен указывать, на каких моментах поддерживается температура при нагреве для полного процесса кристаллизации.
Печь для плавки меди
Плавление меди в домашних условиях
В домашних условиях медные сплавы возможно плавить несколькими способами. При использовании любого из методов, понадобятся сопутствующие материалы:
- тигель – посуда, изготовленная из закаленной меди или другого огнеупорного металла;
- древесный уголь, понадобится в роли флюса;
- крюк металлический;
- форма будущего изделия.
Наиболее легким вариантом для плавления является муфельная печь. В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
Вторым способом плавления в домашних условиях является использование горелки или резака. Пропан – кислородное пламя отлично подойдет для работ с цинком или оловом. Куски материалов для будущего сплава помещаются в тигель, и нагреваются мастером произвольными движениями. Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Плавка меди в домашних условиях подразумевает работу с повышенными температурами. Приоритетом служит соблюдение техники безопасности. Перед любой процедурой следует одеть защитные огнеупорный перчатки и плотную, полностью закрывающую тело одежду.
Как отличить медь от других металлов на глаз?
Визуальное восприятие – наиболее простой, но не всегда достаточно точный метод. Впрочем, в большинстве случаев он работает и отличить лом меди от лома другого цветмета не трудно. Действительно, несмотря на название категории цветные металлы, одинаково окрашенными оказываются только:
Впрочем, в большинстве случаев он работает и отличить лом меди от лома другого цветмета не трудно. Действительно, несмотря на название категории цветные металлы, одинаково окрашенными оказываются только:
- медь;
- золото;
- цезий;
- осмий.
Остальные металлы характеризуются серой тональностью и отличаются преимущественно по интенсивности блеска. Поэтому цвет – отличное «средство идентификации», в таких вопросах как отличить медь от алюминия, цинка или никеля.
Чистая медь с характерным медным цветом
Естественный окрас чистого элемента Cu – красно-розовый. Смотреть на металл рекомендуется при естественном свете. Искусственное освещение, за исключением светодиодных ламп теплых цветовых температур, меняет оттенок в сторону желто-зеленого тона.
Второе правило визуальной идентификации меди – требуется устранить поверхностную оксидную пленку. Окисление создает на поверхности металла зеленовато голубой налет. Поэтому определять на цвет, что у вас медь, желательно по свежему спилу или обработав материал напильником. Намного сложнее обстоит ситуация с медными сплавами: латунью и бронзой. Также визуально трудно различить Cu и омедненный алюминий.
Намного сложнее обстоит ситуация с медными сплавами: латунью и бронзой. Также визуально трудно различить Cu и омедненный алюминий.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Он выражается отношением массы меди к объему всего сплава.
Определение при помощи химии
Этот способ относится к самым простым и доступным, и одновременно является достаточно точным. Для определения состава металла понадобится раствор соляной кислоты. Такие жидкости часто используются для очистки контактов при пайке в радиоэлектронике. Соответственно, кислоту можно купить в любом радиомагазине. И стоит она недорого.
Если не вдаваться в подробности и не прибегать к химическим формулам, то суть проверки заключается в следующем. На поверхность исследуемого металла необходимо нанести несколько капель кислоты. Если это медь, то она просто очистится и приобретет свой натуральный красноватый или розоватый оттенок. Если же перед нами латунь, то на ее поверхности будет проходить химическая реакция с выделением белого вещества – оксида цинка.
Расчет удельного веса
В настоящее время учеными разработано огромное количество способов, помогающих найти характеристики удельного веса меди, которые позволяют даже без обращения к специализированным таблицам вычислять этот немаловажный показатель.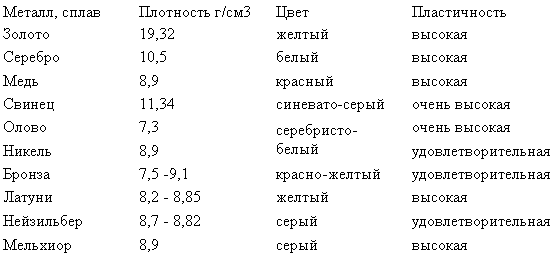 Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
Как уже говорилось выше, удельный вес меди можно подсмотреть в специализированном справочнике, но если под рукой такого нет, то его можно рассчитать по следующей формуле: вес делим на объем и получаем необходимую нам величину. Общими словами такое соотношение можно выразить как общее весовое значение к общему значению объема всего изделия.
Не стоит путать его с понятием плотности, так как он характеризует металл по-другому, хоть и имеет одинаковые значения показателей.
Рассмотрим, как можно вычислить удельный вес, если известна масса и объем медного изделия.
Например, имеем чистый медный лист толщиной 5 мм, шириной 2 м и длиной 1 м. Для начала посчитаем его объем: 5 мм * 1000 мм (1 м = 1000 мм) * 2000 мм, что составляет 10 000 000 мм3 или 10 000 см3. Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Определение по цвету
Самостоятельно определить, медное изделие или латунное, проще всего по его цвету. Для точности рекомендуется тщательно очистить поверхность металла от грязи и оксидной пленки. Как уже было сказано ранее – медь имеет красноватый оттенок, иногда коричневатый или розовый.
Если исследуемое изделие имеет желтоватый цвет, напоминает золото, то перед нами, скорее всего, латунь. И чем больше выражена желтизна, тем большая доля цинка имеется в сплаве.
По цвету можно определить металл методом сравнения с заведомо известным изделием. В быту в качестве медного образца можно использовать электропровод, очищенный от изоляции и защитного лака. Латунь можно увидеть на вилках электроприборов – из этого сплава делаются их штыри.
Расчет веса с использованием значений удельного веса
Не будем уходить далеко и воспользуемся примером, описанным выше. Вычислим общее содержание меди в 25 листах. Поменяем условие и будем считать, что листы изготовлены из медного сплава. Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см3. Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм3 или 10 000 см3. Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем рассчитанный результат на 25 листов и получаем 2 235 кг. Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Как отличить медь от алюминия
Естественно, металлы несложно отличить по цвету. Ситуация усложняется, когда требуется определить из чего изготовленные жилы кабеля. Луженная медь приобретает серебристый оттенок, тогда как омедненный алюминий – желтый. Результат, отличить металлы между собой по цвету, крайне сложно.
Луженая медь в кабелях
Оптимальный вариант – измерить сопротивление. У медной витой пары, длинной около 100 метров, величина параметра достигает 4 – 8 Ом. Сопротивление аналогичного кабеля из алюминия существенно выше: 12 – 20 Ом. Этот метод хорош отсутствием механического воздействия на металл.
Второй способ – сгибание/разгибание жилы. Алюминиевый проводник быстро сломается. Следующий вариант – испытание пламенем. Температура плавления алюминия – 600 °C, у меди – намного выше.
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Вывод
Людям, промышляющим сбором, сдачей и приемом цветного лома, необходимо знать и уметь отличать внешне похожие цветные металлы. Способность определять может хорошо окупиться, так как латунь в пунктах приема стоит почти в два раза дешевле, чем медь первого сорта.
Если найденный объект небольшой, можно определить самостоятельно. Если количество лома велико, можно прибегнуть к помощи инструментов или анализатора, который берется в аренду.
Если вы решили сдать цветной металлолом, то убедитесь, что у пункта приема есть для этого лицензия.
Как очистить данные цветные металлы перед сдачей, вы можете увидеть в данном видеоролике:
Химический элемент медь — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Медь
Выполнил: ст.гр. БО-18-1
Портнягина И.М
2. Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе Периодической
системы химических элементов Д.И. Менделеева.
В четвертом периоде медь является
предпоследним d-элементом, её валентные
электроны 3d94s2, однако вследствие
устойчивости d10-состояния энергетическим более
выгодным оказывается переход одного dэлектрона на 4s-подуровень, поэтому валентные
электроны меди имеют следующую
конфигурацию: 3d104s1. В соединениях для меди
В соединениях для меди
характерная степень окисления +2, возможно
проявление степеней окисления +1 и +3.
3. Физические свойства меди
Медь – пластичный, розовато-красный металл с
металлическим блеском. Обладает высокой
тепло- и электропроводностью, по значению
электропроводности уступает только серебру.
Температура плавления 1083°С, температура
кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зеленосерой пленкой основного карбоната, которая
защищает её от дальнейшего окисления.
4. Химические свойства меди
С кислородом в зависимости от температуры
взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл
покрывается темно-красной пленкой оксида
меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом
образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
5. Взаимодействие с аммиаком
Медь растворяется в водном растворе аммиака
в присутствии кислорода воздуха с
образованием гидроксида тетраамминмеди (II):
2Cu + 8Nh4 + 2h3O + O2 = 2[Cu(Nh4)4](OH)2.
6. Восстановительные свойства
Медь окисляется оксидом азота (IV) и хлоридом
железа (III):
2Cu + NO2 = Cu2O + NO;
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
7. Взаимодействие с кислотами
В электрохимическом ряду
напряжений металлов медь расположена после
водорода, поэтому она не взаимодействует с
растворами разбавленной соляной и серной
кислот и щелочей.
Растворяется в разбавленной азотной кислоте с
образованием нитрата меди (II) и оксида азота
(II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O.
Реагирует с концентрированными растворами
серной и азотной кислот с образованием солей
меди (II) и продуктов восстановления кислот:
Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O.
С концентрированной соляной кислотой медь
реагирует с образованием трихлорокупрата (II)
водорода:
Cu + 3HCl = H[CuCl3] + h3
Медь — один из первых металлов,
широко освоенных человеком изза сравнительной доступности
для получения и малой
температуры плавления.
Латинское название меди Cuprum
произошло от названия
острова Кипр.
Известно, что при возведении
пирамиды Хеопса использовались
медные инструменты.
Кипр
Пирамида
Хеопса
9. Нахождение в природе.
Медь встречается в природе как
в соединениях, так и в
самородном виде. Нередко
встречаются месторождения
меди в осадочных породах —
медистые песчаники и сланцы.
Содержание меди в руде составляет
от 0,3 до 1,0 %.
Самородный вид
Медь в соединениях
10. Физические свойства
Медь — золотисто-розовый
пластичный металл, на воздухе
быстро покрывается оксидной
плёнкой. Медь обладает
высокой тепло и электропроводност
ью, занимает второе место по
электропроводности после серебра.
11. Применение
Медь широко применяется
в электротехнике для изготовления
силовых кабелей, проводов или
других проводников.
Теплопроводимость меди позволяет
применять её в
различных теплоотводных
устройствах: радиаторах охлаждения
,кондиционироввания
и отопления.
Медный радиатор.
Медный кабель.
Медь широко используется для
производства медных труб применяющихся
для транспортировки жидкостей и газов
В разнообразных областях техники широко
используются сплавы с использованием
меди, самыми широко распространёнными
из которых являются бронза и латунь.
Для деталей машин используют сплавы
меди с цинком, оловом, алюминием,
кремнием и др.
• Медноникелевые сплавы,
широко используются в
судостроении.
Медные трубы.
Метизы (Детали машин)
Сплавы меди.
13. Ювелирные сплавы
В ювелирном деле часто
используются сплавы меди
с золотом для увеличения прочности
изделий к деформациям и
истиранию, так как чистое золото —
очень мягкий металл и нестойко к
этим механическим воздействиям.
14. Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного
листа служат
безаварийно по 100—150 лет.
Медная кровля.
Медные водосточные трубы.
Медный фасад.
15. Биологическая роль
Медь — необходимый
элемент для высших растений и
животных.
После усваивания меди
кишечником она
транспортируется к печени с
помощью альбумина.
Продукты, богатые медью.
Здоровому
взрослому
человеку необходимо
поступление меди в
количестве 0,9 мг в
день. При недостатке
меди снижается
активность ферментных
систем и замедляется
белковый обмен, в
результате замедляется
и нарушается рост
костных тканей.
16. Влияние на экологию
При открытом способе добычи меди,
после её прекращения карьер
становится источником токсичных
веществ. Самое токсичное озеро в
мире — Беркли Пит — образовалось в
кратере медного рудника.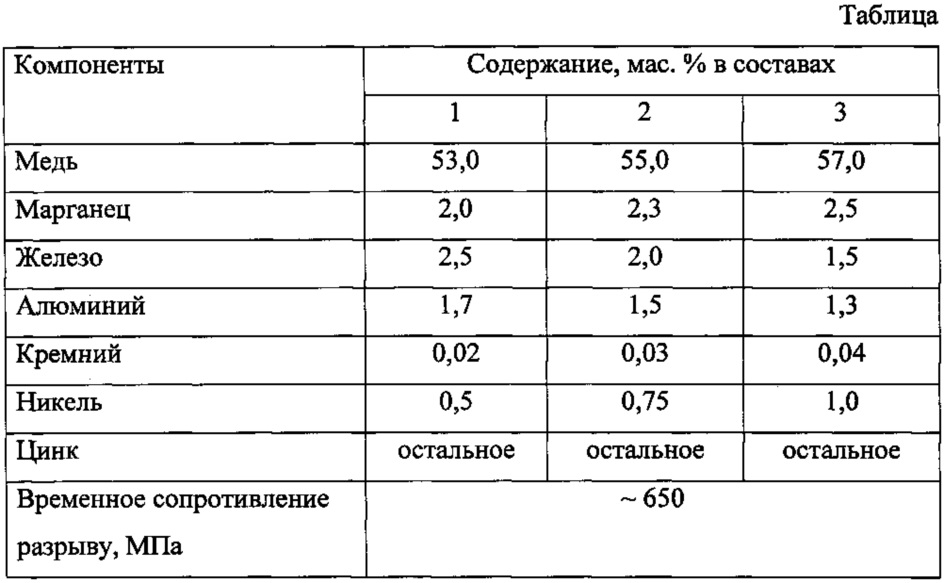 Оно
Оно
находится в Штате Монтана в США.
в 1984 году
в 2008 году
17. Заключение
Несмотря на то, что медь была одним из самых
первых открытых человеком металлов,
масштабы и способы ее потребления только
возрастают. Благодаря развитию науки и
прогрессу, ученые открывают все новые
свойства металла и, соответственно, новые
области его применения.
Мне кажется, что применение этого металла
в производственных сферах человечеством
изучено подробно, тогда как ее роль в
физиологических и биологических процессах,
происходящих в организмах, еще только
предстоит исследовать в полной мере.
English
Русский
Правила
Медь, свойства атома, химические и физические свойства
Медь, свойства атома, химические и физические свойства.
Cu 29 Медь
63,546(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Медь — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 29. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), четвертом периоде периодической системы.
И. Менделеева с атомным номером 29. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), четвертом периоде периодической системы.
Атом и молекула меди. Формула меди. Строение атома меди
Цена на медь
Изотопы и модификации меди
Свойства меди (таблица): температура, плотность, давление и пр.
Физические свойства меди
Химические свойства меди. Взаимодействие меди. Химические реакции с медью
Получение меди
Применение меди
Таблица химических элементов Д.И. Менделеева
Атом и молекула меди. Формула меди. Строение атома меди:
Медь (лат. Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Медь – металл. Относится к переходным металлам, а также к группе тяжёлых, цветных металлов.
Медь обозначается символом Cu.
Как простое вещество медь при нормальных условиях представляет собой пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки). Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Молекула меди одноатомна.
Химическая формула меди Cu.
Электронная конфигурация атома меди 1s2 2s2 2p6 3s2 3p6 3d10 4s1. Потенциал ионизации (первый электрон) атома меди равен 745,48 кДж/моль (7,726380(4) эВ).
Строение атома меди. Атом меди состоит из положительно заряженного ядра (+29), вокруг которого по четырем оболочкам движутся 29 электронов. При этом 28 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку медь расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома меди – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
Радиус атома меди (вычисленный) составляет 145 пм.
Атомная масса атома меди составляет 63,546(3) а. е. м.
Медь с давних пор широко используется человеком.
Медь, свойства атома, химические и физические свойства
Изотопы и модификации меди:
Свойства меди (таблица): температура, плотность, давление и пр.
 :
:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Медь |
| 102 | Прежнее название | |
| 103 | Латинское название | Cuprum |
| 104 | Английское название | Copper |
| 105 | Символ | Cu |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 9000 г. до н. э. |
| 111 | Внешний вид и пр. | Пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки) |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 63,546(3) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s1 |
| 203 | Электронная оболочка | K2 L8 M18 N1 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 132 пм |
| 207 | Радиус иона (кристаллический) | Cu+ 60 (2) пм, 74 (4) пм, 91 (6) пм, 71 (4) пм, 87 (6) пм, Cu3+ low spin 68 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 140 пм |
| 209 | Электроны, Протоны, Нейтроны | 29 электронов, 29 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, 0, +1, +2 , +3, +4 |
| 302 | Валентность | I, II |
| 303 | Электроотрицательность | 1,90 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 745,48 кДж/моль (7,726380(4) эВ) |
| 305 | Электродный потенциал | Cu+ + e– → Cu, Eo = +0,520 В, Cu2+ + e– → Cu+, Eo = +0,153 В, Cu2+ + 2e– → Cu, Eo = +0,337 В |
| 306 | Энергия сродства атома к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,96 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 8,02 г/см3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость), 7,962 г/см3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость), 7,225 г/см3 (при 2027 °C и иных стандартных условиях, состояние вещества – жидкость), |
| 402 | Температура плавления* | 1084,62 °C (1357,77 K, 1984,32 °F) |
| 403 | Температура кипения* | 2562 °C (2835 K, 4643 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,26 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 300,4 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,384 Дж/г·K (при 20 °C) |
| 410 | Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 7,12399 см³/моль |
| 412 | Теплопроводность | 401 Вт/(м·К) (при стандартных условиях), 401 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 3,615 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 315 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-50-8 |
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см3 (при 0 °C и при иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Физические свойства меди:
Химические свойства меди. Взаимодействие меди. Химические реакции с медью:
Получение меди:
Применение меди:
Таблица химических элементов Д. И. Менделеева
И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Copper
- https://de.wikipedia.org/wiki/Kupfer
- https://ru.wikipedia.org/wiki/Медь
- http://chemister.ru/Database/properties.php?dbid=1&id=239
- https://chemicalstudy.ru/med-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www. pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
медь атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле меди
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
3 291
температура плавления, физические свойства, сплавы
Твердый металл медь люди научились плавить еще до нашей эры. Название элемента по таблице Менделеева – Cuprum, в честь первого массового расположения производства меди. Именно на острове Кипр в третьем тысячелетии до н.э. начали добывать руду. Металл зарекомендовал себя как хорошее оружие и красивый, блестящий материал для изготовления посуды и других приборов.
Именно на острове Кипр в третьем тысячелетии до н.э. начали добывать руду. Металл зарекомендовал себя как хорошее оружие и красивый, блестящий материал для изготовления посуды и других приборов.
Процесс плавления меди
Изготовление предметов требовало множество усилий при отсутствии технологий. В первых шагах развития цивилизации и поиску новых металлов, люди научились добывать и плавить медную руду. Получение руды происходило в малахитовом, а не в сульфидном состоянии. Получение на выходе свободной меди, из которой можно изготавливать детали, требовало обжига. Для исключения окислов, металл с древесным углем размещалась в сосуд из глины. Поджигался металл в специально подготовленной яме, образующийся в процессе угарный газ способствовал процессу появления свободной меди.
Для точных расчетов использовался график плавления меди. В то время производился точный расчет времени и примерная температура, при которой происходит плавка меди.
Содержание
Медь и ее сплавы
Металл имеет красновато-желтый оттенок благодаря оксидной пленке, которая образуется при первом взаимодействии металла с кислородом. Пленка придает благородный вид и обладает антикоррозийными свойствами.
Пленка придает благородный вид и обладает антикоррозийными свойствами.
Сейчас доступно несколько способов добычи металла. Распространёнными являются медный колчедан и блеск, которые встречаются в виде сульфидных руд. Каждая из технологий получения меди требует особого подхода и следования процессу.
Добыча в природных условиях происходит в виде поиска медных сланцев и самородков. Объемные месторождения в виде осадочных пород находятся в Чили, а медные песчаники и сланцы расположились на территории Казахстана. Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Основной порядок плавления и свойства:
- на температурных порогах от 20 до 100° материал полностью сохраняет свои свойства и внешний вид, верхний оксидный слой остается на месте;
- кристаллическая решетка распадается на отметке 1082°, физическое состояние становится жидким, а цвет белым.
 Уровень температуры задерживается на некоторое время, а затем продолжает рост;
Уровень температуры задерживается на некоторое время, а затем продолжает рост; - температура кипения меди начинается на отметке 2595°, выделяется углерод, происходит характерное бурление;
- при отключении источника тепла происходит снижение температуры, происходит переход в твердую стадию.
Плавка меди возможна в домашних условиях, при соблюдении определенных условий. Этапы и сложность задачи зависят от выбора оборудования.
Физические свойства
Основные характеристики металла:
- в чистом виде плотность металла составляет 8.93 г/см3;
- хорошая электропроводность с показателем 55,5S, при температуре около 20⁰;
- теплопередача 390 Дж/кг;
- кипение происходит на отметке 2600°, после чего начинает выделение углерода;
- удельное электрическое сопротивление в среднем температурном диапазоне – 1.78×10 Ом/м.
Основными направлениями эксплуатации меди является электротехнические цели. Высокая теплоотдача и пластичность дают возможность применения к различным задачам. Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
- Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
- Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции.
 Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы. - Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.
Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
- Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Латунь
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях.
Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Температура плавления меди
Плавится материал при определенной температуре, которая зависит от наличия и количества сплавов в составе.
В большинстве случаев, процесс происходит при температуре от 1085°. Наличие олова в сплаве дает разбег, плавление меди может начаться при 950°. Цинк в составе также понижает нижнюю границу до 900°.
Для точных расчетов времени понадобится график плавления меди. На обычном листке бумаги используется график, где по горизонтали отмечается время, а по вертикали градусы. График должен указывать, на каких моментах поддерживается температура при нагреве для полного процесса кристаллизации.
Печь для плавки меди
Плавление меди в домашних условиях
В домашних условиях медные сплавы возможно плавить несколькими способами. При использовании любого из методов, понадобятся сопутствующие материалы:
При использовании любого из методов, понадобятся сопутствующие материалы:
- тигель – посуда, изготовленная из закаленной меди или другого огнеупорного металла;
- древесный уголь, понадобится в роли флюса;
- крюк металлический;
- форма будущего изделия.
Наиболее легким вариантом для плавления является муфельная печь. В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
Вторым способом плавления в домашних условиях является использование горелки или резака. Пропан – кислородное пламя отлично подойдет для работ с цинком или оловом. Куски материалов для будущего сплава помещаются в тигель, и нагреваются мастером произвольными движениями. Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Плавка меди в домашних условиях подразумевает работу с повышенными температурами. Приоритетом служит соблюдение техники безопасности. Перед любой процедурой следует одеть защитные огнеупорный перчатки и плотную, полностью закрывающую тело одежду.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Расчет удельного веса
В настоящее время учеными разработано огромное количество способов, помогающих найти характеристики удельного веса меди, которые позволяют даже без обращения к специализированным таблицам вычислять этот немаловажный показатель. Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
Как уже говорилось выше, удельный вес меди можно подсмотреть в специализированном справочнике, но если под рукой такого нет, то его можно рассчитать по следующей формуле: вес делим на объем и получаем необходимую нам величину. Общими словами такое соотношение можно выразить как общее весовое значение к общему значению объема всего изделия.
Не стоит путать его с понятием плотности, так как он характеризует металл по-другому, хоть и имеет одинаковые значения показателей.
Рассмотрим, как можно вычислить удельный вес, если известна масса и объем медного изделия.
Например, имеем чистый медный лист толщиной 5 мм, шириной 2 м и длиной 1 м. Для начала посчитаем его объем: 5 мм * 1000 мм (1 м = 1000 мм) * 2000 мм, что составляет 10 000 000 мм3 или 10 000 см3. Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Единицы измерения удельного веса
В разных системах измерения используются разные единицы для обозначения удельного веса меди:
- В системе измерения СГС или сантиметр-грамм-секунда используется дин/см3.
- В Международной СИ используются единицы н/м3.
- В системе МКСС или метр-килограмм-секунда-свеча применяется кг/м3.
Первые два показателя равны между собой, а третий при конвертации равен 0,102 кг/м3.
Расчет веса с использованием значений удельного веса
Не будем уходить далеко и воспользуемся примером, описанным выше. Вычислим общее содержание меди в 25 листах. Поменяем условие и будем считать, что листы изготовлены из медного сплава. Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см3. Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм3 или 10 000 см3. Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см3. Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм3 или 10 000 см3. Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем рассчитанный результат на 25 листов и получаем 2 235 кг. Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Области использования меди
Благодаря физико-механическим свойствам, она широко используется для различных отраслей промышленности. Наиболее часто ее можно встретить в электротехнической области в качестве составляющей части электрического провода. Не меньшей популярностью она пользуется также в производстве систем отопления и охлаждения, электроники и системах теплового обмена.
В строительной отрасли она используется, прежде всего, для создания разного рода конструкций, которые получаются гораздо меньше по массе, чем из любых других аналогичным материалов. Часто ее используют для кровли, так как такие изделия обладают легкостью и пластичностью. Такой материал легко обрабатывается и позволяет менять геометрии профиля, что очень удобно.
Часто ее используют для кровли, так как такие изделия обладают легкостью и пластичностью. Такой материал легко обрабатывается и позволяет менять геометрии профиля, что очень удобно.
Как уже говорилось выше, основное свое применение она находит в изготовлении электрических и иных токопроводящих кабелей, где она используется для изготовления жил проводов и кабелей. Обладая хорошей электропроводностью, она дает достаточное сопротивление электронам тока.
Широко используются также сплавы меди, например, сплав меди и золота повышает прочность последнего в разы.
На стенках медных прокатов никогда не образуются соляные отложения. Такое качество полезно для транспортировки жидкостей и паров.
На основе оксидов меди получают сверхпроводники, а в чистом виде она идет на изготовление гальванических источников питания.
Схема гальванического источника питания
Она входит в состав бронзы, которая обладает стойкостью к агрессивным средам, как морская вода. Поэтому часто ее используют в навигации. Также бронзовые продукты можно увидеть на фасадах домов, как элемент декора, так как такой сплав обрабатывается легко, так как очень пластичен.
Химические свойства элементов:медь, нахождение меди в природе, получение меди, свойства меди
Ключевые слова: медь, нахождение меди в природе, получение меди, физические свойства меди, сплавы. меди, химические свойства меди.
Медь (Cuprum), Си — химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Латинское название происходит от острова Кипр, где древние греки добывали медную руду. Порядковый номер 29, атомная масса меди 63,54. Природная медь состоит из смеси 2-х стабильных изотопов 63Cu (69,1%) и 65Cu (30,9%). Путем бомбардировки никеля протонами или ядрами дейтерия искусственно получают радиоактивные изотопы меди 6lCu и 64Си с периодами полураспада 3,3 и 12,8 часов соответственно. Эти изотопы обладают высокой удельной активностью и используются в качестве меченых атомов. В химическом отношении медь занимает промежуточное положение между элементами главной подгруппы VIII группы и щелочными элементами I группы периодической системы.
Эти изотопы обладают высокой удельной активностью и используются в качестве меченых атомов. В химическом отношении медь занимает промежуточное положение между элементами главной подгруппы VIII группы и щелочными элементами I группы периодической системы.
НАХОЖДЕНИЕ МЕДИ В ПРИРОДЕ
Содержание меди в земной коре составляет около 0,01%. Она встречается в свободном состоянии в виде самородков, достигающих значительных размеров (до нескольких тонн). Однако руды самородной меди сравнительно мало распространены, и в настоящее время из них добывается не более 5% меди от общей ее мировой добычи. Медь является халькофильным элементом. До 80% ее присутствует в земной коре в виде соединений с серой. Около 15% меди находится в виде карбонатов, силикатов, оксидов, являющихся продуктами выветривания первичных сульфидных медных руд.Медь образует до 240 минералов, однако лишь около 40 имеют промышленное значение .Различают сульфидные и окисленные руды меди. Промышленное значение имеют сульфидные руды, из которых наиболее широко используется медный колчедан (халькопирит) CuFeS2. В природе он встречается главным образом в смеси с железным колчеданом FeS2 и пустой породой, состоящей из оксидов кремния, алюминия, кальция . Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
В природе он встречается главным образом в смеси с железным колчеданом FeS2 и пустой породой, состоящей из оксидов кремния, алюминия, кальция . Часто сульфидные руды содержат примеси благородных металлов (золота, серебра), цветных и редких металлов ( цинка, свинца, никеля, кобальта, молибдена ) и рассеянных элементов (германий).Содержание меди в руде обычно составляет 1—5%, но благодаря технологии флотации, ее можно обогащать, получая концентрат, содержащий 20% меди и более . Наиболее крупные запасы медных руд в России сосредоточены главным образом на Урале, в Казахстане и Средней Азии, за рубежом — в Африке (Катанта, Замбия), Америке (Чили, США, Канада).
ПОЛУЧЕНИЕ МЕДИ
Руды и получаемые из них путем механического обогащения концентраты перерабатывают на медь пирометаллургическим и гидрометаллургическим методами . Первый из них применяется преимущественно для переработки сернистых руд. Вторым методом, получившим небольшое распространение, перерабатывают окисленные и смешанные бедные руды, содержащие около 1% меди. Пирометаллургический метод заключается в обжиге концентратов, плавке полученного огарка на штейн (сплав сульфидов меди и железа), продувке штейна в конвертере с получением черновой меди (содержащей около 5% примесей), рафинировании последних огневым процессом или электролизом для получения чистой меди. Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
Пирометаллургический метод заключается в обжиге концентратов, плавке полученного огарка на штейн (сплав сульфидов меди и железа), продувке штейна в конвертере с получением черновой меди (содержащей около 5% примесей), рафинировании последних огневым процессом или электролизом для получения чистой меди. Гидрометаллургический метод получения меди заключается в извлечении ее из руд различными растворителями с последующим выделением металла из растворов электролизом или посредством вытеснения его железом в виде цементной меди. Иногда медь выделяют в виде оксида.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕДИ
Техническая медь — металл красного, в изломе розового цвета, при просвечивании в тонких слоях — зеленовато-голубой. Имеет гранецентрированную кубическую решетку, плотность 8,96 кг/м3 (20°С). Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокими теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности.
СПЛАВЫ МЕДИ
Небольшие примеси висмута (0,001%*) и свинца (0,01%) делают медь ломкой, а примесь серы вызывает хрупкость на холоду .С металлами медь образует различные сплавы. В двухкомпонентных медных сплавах с Zn, Sn, Al, Ni, Fe, Mn, Si, Be, Cr, Pb, P и др. легирующий элемент входит в твердый раствор замещения на основе Си, а также может образовывать электронные соединения, характеризующиеся определенной электронной концентрацией. В многокомпонентных сплавах часто присутствуют сложные металлические соединения точно неустановленного состава. Легирующие элементы вводят в медь для повышения прочности и твердости, улучшения антифрикционных свойств и стойкости против коррозии и для получения сплавов с заданными физическими свойствами. Медные сплавы делят на латуни, бронзы и медно-никелевые сплавы .
Латунями называют сплавы меди и цинка. Медь может растворять цинк в любом количестве. При добавлении к меди до 45—47% Zn увеличивается предел прочности сплава при растяжении; дальнейшее увеличение содержания цинка вызывает снижение предела прочности. Вязкость (пластичность) сплава возрастает при добавлении к меди до 30—32% Zn, а затем уменьшается, достигая очень малой величины при содержании 47—50% Zn.
Вязкость (пластичность) сплава возрастает при добавлении к меди до 30—32% Zn, а затем уменьшается, достигая очень малой величины при содержании 47—50% Zn.
Ковкая латунь (мунц-металл) содержит 60% Си и 40% Zn, томпак — 90—80% Си и 10—20% Zn. Состав специальных латуней: алюминиевая (66—68% Си, ~3% А1, ~30% Zn), марганцовисто-свинцовая (57—60% Си, 1,5—2,5% РЬ; 1,5—2,5% Мп, -38% Zn).
Бронзами называют сплавы меди с оловом. В присутствии олова улучшаются механические свойства меди, бронзы обладают хорошими литейными свойствами. Обычно содержание олова не превышает 10%. Алюминиевая бронза содержит 82—90% Си, 4—10% Al, 1—6% Fe + Si; кремнеоловянная бронза — 99,94% Си, по 0,03% Sn и Si.
Сплавы меди с никелем. Никель сильно повышает твердость меди. Сплав 50% Си и 50% Ni обладает наибольшей твердостью. Кроме высокой твердости, эти сплавы обладают пониженной электропроводностью, вследствие чего употребляются в электротехнике .
Хорошие механические свойства, высокая стойкость против коррозии во многих средах, ценные физические свойства в сочетании с простотой плавки, литья и обработки давлением обусловили широкое применение медных сплавов в многочисленных отраслях техники: в авиа-, авто-, судостроении, химической промышленности, станкостроении, электротехнике, приборостроении, в производстве паровой и водяной арматуры, посуды, художественных и других изделий.
ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ
Медь — электроположительный металл. Медь вытесняется из своих солей более электроотрицательными элементами и не растворяется в кислотах, не являющихся окислителями. Медь растворяется в азотной кислоте с образованием (Си(NOз)2 и оксидов азота, в горячей конц. H2SO4 — с образованием CuSO4 и SO2. В нагретой разбавленной H2SO4 медь растворяется только при продувании через раствор воздуха .Химическая активность меди невелика, при температурах ниже 185°С с сухим воздухом и кислородом не реагирует. В присутствии влаги и СО2 на поверхности меди образуется зеленая пленка основного карбоната. При нагревании меди на воздухе идет поверхностное окисление; ниже 375°С образуется СиО, а в интервале 375—1100°С при неполном окислении меди — двухслойная окалина (СиО + СuО). Влажный хлор взаимодействует с медью уже при комнатной температуре, образуя хлорид меди(II), хорошо растворимый в воде. Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»). При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
Медь реагирует и с другими галогенами. Особое сродство проявляет медь к сере: в парах серы она горит. С водородом, азотом, углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твердой меди незначительна и при 400°С составляет 0,06 г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так называемая «водородная болезнь»). При пропускании аммиака над раскаленной медью образуется Cu2N. Уже при температуре каления медь подвергается воздействию оксидов азота: N2O и NO взаимодействуют с образованием СuО, a NO2 — с образованием СиО. Карбиды Cu2C2 и СuС2 могут быть получены действием ацетилена на аммиачные растворы солей меди. Оксид меди(I) Си2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди(I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому Сu2О. Гидроксид меди(I) обладает слабыми основными свойствами, он немного растворим в концентрированных растворах щелочей.
Сплавы меди
Реакции с медью(взаимодействие меди)
Оксиды меди
Сульфат меди
Хлорид меди
Нитрат меди
Гидроксид меди
Медь – свойства, применение, характеристики медных сплавов
История меди
Человечество начало добывать медь несколько тысячелетий назад. Самые древние изделия, найденные из этого металла, датируются 7-6 веками до нашей эры. Среди них – украшения, инструменты, посуда и орудия труда.
Большим шагом вперед в развитии металлургии было открытие сплава меди с оловом – бронзы. Этот материал отличался повышенной прочностью и способностью к ковке, благодаря чему все изделия из данного медного сплава получались более качественными.
На территории нашей страны медь издавна добывают на Урале, Алтае и в Сибири. Из нее отлиты известнейшие культурные памятники: Царь-пушка, Царь-колокол, Медный всадник.
Медь
В Греции медь была известна под названием халькос (χαλκός). Она была важным ресурсом для римлян, греков и других античных народов. Во времена Римской Империи она была известна как Cyprium, так как является обобщенным латинским термином для обозначения медных сплавов, и Cyprium от названия острова Кипр, где добывалось большое количество меди. Слово было сокращено до cuprum, а затем до английского copper. Афродита и Венера представляют медь в мифологии и алхимии, поскольку, за счет ее глянцевитой красоты, в античности она использовалась для производства зеркал, а также за счет связи с Кипром, который был посвящен богине. Семь небесных светил, известных в античности, ассоциировались с семью известными в то время металлами, и Венера была закреплена за медью. Первое применение в Британии латуни датируется около III–II века до н.э. В Северной Америке добыча меди началась с малодоходных работ, проводимых коренными американцами. Самородная медь извлекалась из мест заложения на Айл Роял примитивными каменными инструментами между 800 и 1600 гг.20) Медная металлургия процветала в Южной Америке, а именно в Перу около 1000 г. н.э.; более медленно она переходила на другие континенты. Были найдены погребальные украшения из меди XIV века, но коммерческое производство металла не начиналось до ранних годов XX века. Роль меди в культуре достаточно важна, в частности в качестве платежного средства. Римляне с VI до III века до н.э. использовали куски меди в качестве денег. В первую очередь, медь ценилась сама по себе, но постепенно форма и внешний вид меди становились все более важными. У Юлия Цезаря имелись собственные монеты, изготовленные из латуни, в то время как монеты цезаря Октавиана Августа были выполнены из сплава Cu-Pb-Sn.
Семь небесных светил, известных в античности, ассоциировались с семью известными в то время металлами, и Венера была закреплена за медью. Первое применение в Британии латуни датируется около III–II века до н.э. В Северной Америке добыча меди началась с малодоходных работ, проводимых коренными американцами. Самородная медь извлекалась из мест заложения на Айл Роял примитивными каменными инструментами между 800 и 1600 гг.20) Медная металлургия процветала в Южной Америке, а именно в Перу около 1000 г. н.э.; более медленно она переходила на другие континенты. Были найдены погребальные украшения из меди XIV века, но коммерческое производство металла не начиналось до ранних годов XX века. Роль меди в культуре достаточно важна, в частности в качестве платежного средства. Римляне с VI до III века до н.э. использовали куски меди в качестве денег. В первую очередь, медь ценилась сама по себе, но постепенно форма и внешний вид меди становились все более важными. У Юлия Цезаря имелись собственные монеты, изготовленные из латуни, в то время как монеты цезаря Октавиана Августа были выполнены из сплава Cu-Pb-Sn. Учитывая расчетный ежегодный выход приблизительно в 15000 т, активность римлян в отношении добычи и плавки меди достигла уровня, непревзойденного до времен Промышленной революции; добыча наиболее интенсивно велась в провинциях, таких как Испания, Кипр и Центральная Европа. Ворота Иерусалимского храма выполнены из коринфской бронзы, покрытой позолотой. Это было широко распространено в Александрии, где предположительно получила начало алхимия. В древней Индии медь использовалась в холистической медицинской науке Аюрведе для хирургических инструментов и другого медицинского оборудования. Древние египтяне (~2400 г. до н.э.) использовали медь для обеззараживания ран и питьевой воды, а позже в отношении головных болей, ожогов и зуда. Багдадская батарея с медными цилиндрами, припаянными к проволочному выводу, датируется с 248 г. до н.э. до 226 г. н.э. и имеет сходство с гальваническим элементом, в связи с чем люди полагают, что это была первая батарейка; не было подтверждено.21)
Учитывая расчетный ежегодный выход приблизительно в 15000 т, активность римлян в отношении добычи и плавки меди достигла уровня, непревзойденного до времен Промышленной революции; добыча наиболее интенсивно велась в провинциях, таких как Испания, Кипр и Центральная Европа. Ворота Иерусалимского храма выполнены из коринфской бронзы, покрытой позолотой. Это было широко распространено в Александрии, где предположительно получила начало алхимия. В древней Индии медь использовалась в холистической медицинской науке Аюрведе для хирургических инструментов и другого медицинского оборудования. Древние египтяне (~2400 г. до н.э.) использовали медь для обеззараживания ран и питьевой воды, а позже в отношении головных болей, ожогов и зуда. Багдадская батарея с медными цилиндрами, припаянными к проволочному выводу, датируется с 248 г. до н.э. до 226 г. н.э. и имеет сходство с гальваническим элементом, в связи с чем люди полагают, что это была первая батарейка; не было подтверждено.21)
Физические характеристики
Характерный цвет медь приобретает в результате взаимодействия с кислородом и образования тонкой оксидной пленки. Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
- высокая электро- и теплопроводность (уступает только серебру),
- мягкость,
- пластичность,
- легко поддается вытягиванию и обработке,
- коррозионная стойкость.
Из прочих характеристик меди стоит отметить хорошую невосприимчивость к внешним природным факторам (температура, ультрафиолет, химическое воздействие) и приятный внешний вид (возможность патирования). В случаях, когда необходимо использовать более твердый материал, в ход идут латунь и бронза – сплавы меди с цинком и оловом соответственно. Медная продукция обладают высокой плотностью, может прокатываться в проволоку, пруток или лист любой толщины.
AllMetals
Медь
Большая роль меди в технике обусловлена рядом ее ценных свойств и прежде всего высокой электропроводностью, пластичностью, теплопроводностью. Благодаря этим свойствам медь — основные материал для проводов; свыше 50% добываемой меди применяют в электротехнической промышленности. Все примеси понижают электропроводность Меди, а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9% Cu.
Все примеси понижают электропроводность Меди, а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9% Cu.
Высокие теплопроводность и сопротивление коррозии позволяют изготовлять из меди ответственные детали теплообменников, холодильников, вакуумных аппаратов и т. п.
Применение сплавов меди
Более 30% меди идет на сплавы. Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры. Медные сплавы — латуни (основная добавка цинк, Zn), бронзы (сплавы с разными элементами, главным образом металлами — оловом, алюминием, берилием, свинцом, кадмием и другими, кроме цинка и никеля) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер. В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием и медь с никелем) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
Применение меди в быту
Медь как художественный материал используется с медного века (украшения, скульптура, утварь, посуда). Кованые и литые изделия из меди и сплавов украшаются чеканкой, гравировкой и тиснением. Легкость обработки меди (обусловленная ее мягкостью) позволяет мастерам добиваться разнообразия фактур, тщательности проработки деталей, тонкой моделировки формы. Изделия из меди отличаются красотой золотистых или красноватых тонов, а также свойством обретать блеск при шлифовке. Медь нередко золотят, патинируют, тонируют, украшают эмалью. С 15 века медь применяется также для изготовления печатных форм.
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей. Медь самый широкоупотребляемый катализатор полимеризации ацетилена.
Кроме нужд тяжелой промышленности, связи, транспорта, некоторое количество меди (главным образом в виде солей) потребляется для приготовления минеральных пигментов, борьбы с вредителями и болезнями растений, в качестве микроудобрений, катализаторов окислительных процессов, а также в кожевенной и меховой промышленности и при производстве искусственного шелка.
Химические свойства
В условия низкой влажности медь почти не демонстрирует каких-либо особенных химических свойств. Однако при контакте с водой и углекислым газом она быстро вступает в окислительную реакцию, на ее поверхности образуется пленка, защищающая ее от разрушения. Также окисление происходит при нагреве до 375 градусов.
Металл вступает в активную реакцию с неметаллами галогеновой группы, селеном и серой. В паре с последней, к примеру, он воспламеняется. Медь с валентностью I и II участвует в создании комплексных соединений (двойных солей и аммиачных смесей), обладающих высокой стойкостью и применяемых во многих промышленных сферах.
Методы добычи
Медь добывают открытым и закрытым способом. Первый актуален, если руда находится в толще до 500 метров. Для более глубоких залежей строят специальные подземные шахты. Чистую медь получают в основном пирометаллургическим способом, реже – гидрометаллургическим.
Пирометаллургическая методика условно подразделяется на два этапа, и в качестве исходного сырья использует халькопирит (медный купорос). Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Химические формулы процесса:
- ZnS + 1.5O2 = ZnO + SO2 + Q – реакция протекает при температуре, превышающей +800 градусов;
- ZnS + 2O2 = ZnSO2 + Q – оптимальная температура варьируется в пределах +600/+700 градусов.
После этого, обогащённая руда плавится в шахтных печах при температуре + 14 500 градусов, преобразуясь в сплав, состоящий из сульфидов железа и меди (штейн). Чтобы повысить качество, проводится конвертерный обдув без подачи топлива. Содержание меди в таком сплаве составляет примерно 91%. Вторая стадия – рафинирование, после чего медная составляющая увеличивается до 99.9%.
Гидрометаллургический способ основывается на выщелачивании. Для этого руду дробят на небольшие куски, и заливают растворителями:
- Nh5OH;
- h3SO4;
- Fe (SO4).
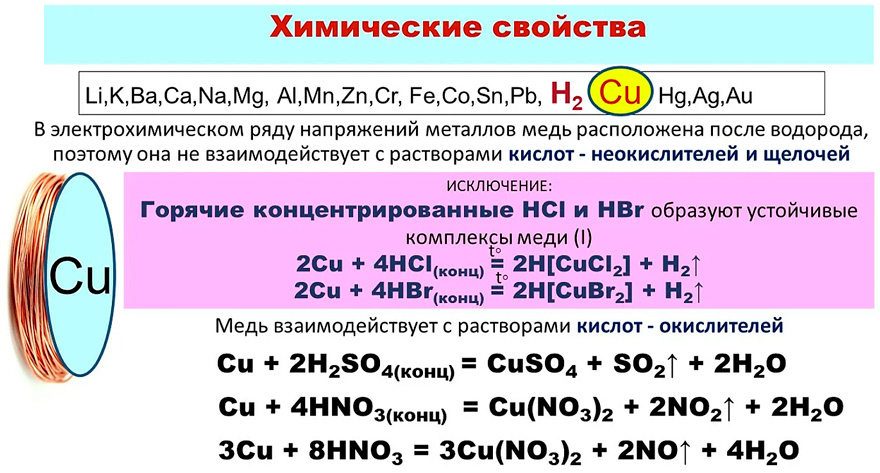
В результате получается раствор, в котором выделяется медь и другие металлы. Формулы процесса:
- CuO+h3SO4>CuSO4+h3O – выщелачивание серной кислотой;
- CuSO4+2Fe2SO4>4FeSO4+2CuSO+S – применение сульфата железа;
- Cu2S + 2 Fe2 (SО4)3>2 СuSO4 + 4 FeSO4 + S – выщелачивание сернокислым железом.
Полученный раствор проходит последующую обработку для извлечения металла. Например, может использоваться методика цементации: CuSО4 + Fe>FeSО4 + Cu. Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Область применения
Медная плита находит широкое применение в строительстве, автомобильной, корабельной и железнодорожной промышленности.
Медный лист применяется при возведении кровель, фасадов, заборов и ограждений. А из-за бактерицидности металлической поверхности изделий из меди делают предметы для использования в больницах: двери, ручки, поручни, перила и даже посуду.
Медная труба предназначена для транспортировки жидких и воздушных сред в системах водо- и газоснабжения, отопления, кондиционирования, а также в теплообменниках и холодильных установках. Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Медная проволока идет на производство кабельной продукции и проводов с невысоким сопротивлением и особенными магнитными свойствами.
Медная лента используется в приборостроении, электротехнике и радиоэлектронике, при изготовлении проводников, обмотков, силовых трансформаторов.
Медный пруток также нередко применяется в строительной и промышленной отрасли. Из него могут готовить подшипники, стеклоподъемники, водозапорную арматуру, декоративные конструкции в архитектуре и интерьере зданий.
Ее использование в строительстве
Высокие показатели электро- и теплопроводности обусловили для меди активное использование, как в строительстве, так и в автомобиле- и приборостроении. Сам же материал устойчив к негативному воздействию коррозии и ультрафиолетовых лучей, также без деформации и нарушения структуры переносит резкие температурные перепады.
Благодаря таким особенностям, позволяет производить детали и прочие конструкции, которые рассчитаны на длительное воздействие влаги.
Провода
Наибольший спрос медь получила именно в электротехнической области, в частности для производства проводов. С этой целью используется максимально чистый металл, поскольку второстепенные компоненты существенно снижают его токопроводимость. Если в готовом материале присутствует более 0,02% алюминия, то его способность проводить ток снижается на 10%.
Существенно возрастание сопротивления происходит в результате присутствия в сырье примесей неметаллического характера. Сам же металл относится крайне низким сопротивлением, которое уступает лишь серебру. Такая особенность металла также послужила его использованию в силовых трансформаторах и энергосберегающих приводах.
Проволока
Высокий уровень вязкости и пластичности обусловили активное использование меди для производства изделий с различными узорами. Проволока, которая была изготовлена из красной меди, после обжига становится максимально пластичной и мягкой. В таком состоянии она позволяет создавать узоры и орнаменты любой сложности.
Такая проволока активно используется в следующих отраслях:
- Электротехника;
- Электроэнергетика;
- Автомобилестроение;
- Судостроение;
- Производство кабеля и проводов.
Водо- и теплоснабжение
Благодаря своей высокой теплопроводности медь используется в различных теплообменниках и теплоотводных приборах. Иными словами, из нее изготавливают кулера для системных блоков, радиаторы отопления, трубы, кондиционеры и прочие приборы.
Медные трубы обладают абсолютно уникальными характеристиками, которые и обусловили их широкое распространение не смотря на высокую стоимость самого сырья. Такие изделия не бояться ультрафиолетового излучения, устойчивы к возникновению коррозии и температурным перепадам. Эти свойства позволяют производить монтаж медных труб даже при низких температурах воздуха.
Высокий показатель механической прочности, а также возможность механической обработки материала позволяют создавать бесшовные медные трубы, обладающие круглым сечением. Они рассчитаны на транспортировку жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.
Они рассчитаны на транспортировку жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.
О роли медных труб в водоснабжении расскажет данное видео:
Кровля
Одним из первых материалов, используемых в качестве кровельного покрытия, является медь. Такая кровля отличается длительным сроком службы (до 200 лет), который происходит благодаря ее уникальным особенностям. Кровля из меди спустя некоторое время претерпевает процесс окисления, который заключается в образовании патины.
Этот своего рода защитный слой уберегает поверхность меди от негативного влияния ультрафиолета, низких температур, влаги и прочих погодных явлений.
Таким образом, медная кровля сразу после своего монтажа имеет золотистый оттенок, но уже через 10 лет становится более темной, в некоторых случаях практически черного цвета.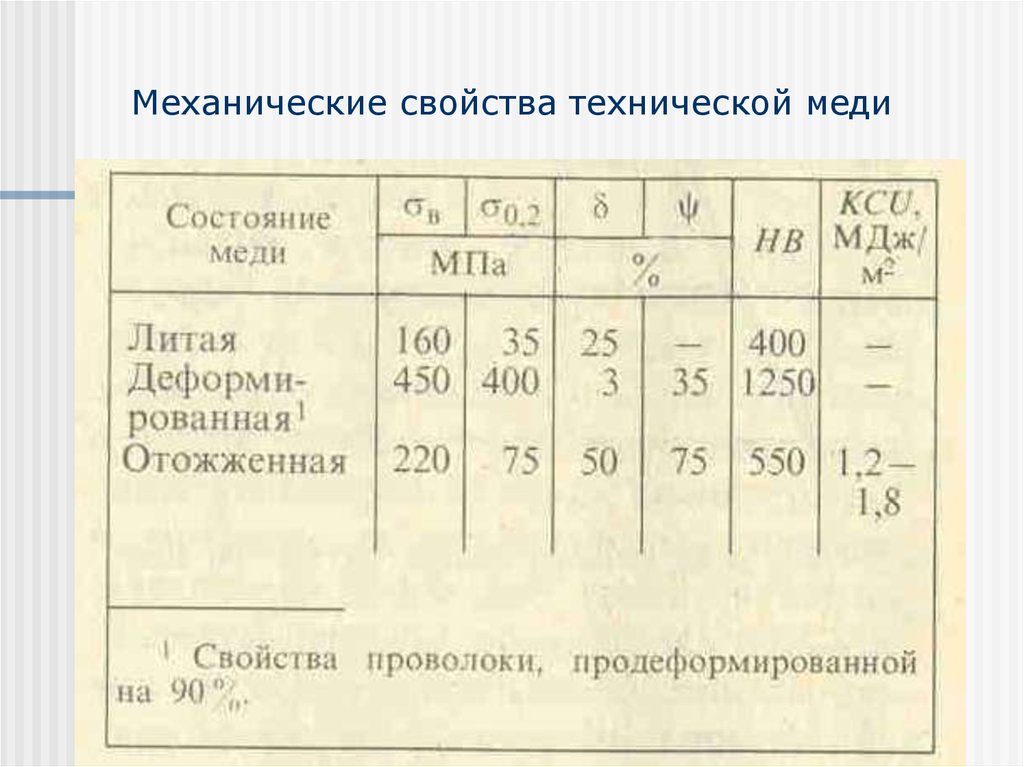 Этот процесс образования патины при желании можно искусственно ускорить.
Этот процесс образования патины при желании можно искусственно ускорить.
Про иные сфера применения меди читайте ниже.
Особенности популярных медных сплавов
Сплав М1 изготавливается в соответствии с ГОСТ 859-2014, является высокопластичным и хорошо обрабатываемым металлом, отличается наибольшим содержанием меди (99,9%). В качестве дополнительных элементов встречаются цинк, никель, фосфор, железо, мышьяк, кислород, олово, висмут (суммарно не более 0,1%). Удельное электрическое сопротивление составляет 0,018 мкОм. Сплав может быть двух типов – твердый (М1т) и мягкий (М1м), они различаются по пределам прочности и текучести. Металлопрокат востребован в автомобиле- и авиастроении, при создании проводников тока, криогенной техники, проволоки и прутков.
Сплав М2 имеет меньший коэффициент меди в составе (99,7%). Остальные 0,3% приходятся на никель, железо, сурьму, кислород, олово, свинец, серу, мышьяк. Данная марка пластична и не поддается ржавлению, превосходно обрабатывается под давлением и применяется для изготовления сплавов на медной основе и деталей холодильной техники.
Сплав М3 – это медь техническая, она включает наименьший процент металла среди представленных (99,5%). В качестве легирующих компонентов используются те же элементы, что и в М2, только в большей пропорции (до 0,5%), что делает этот сплав самым доступным по стоимости. Оптимально подходит для металлических изделий, которые реализуются прокатным способом, а также литейных сплавов.
Применение меди в разрезе теплопроводности
Высокая электропроводность меди является лишь одним из главных свойств, которые определяют широчайшие использования в быту и промышленности. Вторым основополагающим свойством меди является ее крайне высокая теплопроводность, которая при наличии примесей олова, мышьяка, фосфора, железа их других элементов резко падает вместе с ростом электрического сопротивления. Высокая теплопроводность, хороший теплообмен позволяют применять медь в теплообменниках, теплоотводах и приборах где они используются — холодильниках, кулерах, в кондиционерах. Лучшие компьютерные кулеры используют медные радиаторы, которые отводят тепло от процессоров и видеокарт.
Примеры применения меди — медицина, ювелирка, аксессуары
В настоящее время проводится широкий спектр исследований бактерицидных свойств меди. Издавна считалось, что медная посуда способствует уничтожению болезнетворных бактерий и является очень гигиеничным. Современные научные изыскания говорят о том, что использование меди в быту снижают перенос бактерий. Таким образом, возникают рекомендации использование меди в больничном быту и в поликлиниках как антисептика. Окружающие нас золотые изделия из золота разных проб являются стволам меди и золота, их пропорции и называют пробой. Чистое золото без меди мы видим , практически, только в слитках , которые хранятся в банках. Медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде медного купороса — пятиводного сульфата меди. В значительных количествах он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых дозах медь совершенно необходима всему живому. Также медь используют для никелирования и хромирования стали. Можно заметить, что когда с блестящих ручек и прочих элементов хоть капельку стирается серебристый блестящий слой, то под ним мы видим не сталь, а розоватый, тончайший слой медного напыления. Без этого слоя хромированные, никелированные детали становились бы облезлыми и некрасивыми очень быстро.
В малых дозах медь совершенно необходима всему живому. Также медь используют для никелирования и хромирования стали. Можно заметить, что когда с блестящих ручек и прочих элементов хоть капельку стирается серебристый блестящий слой, то под ним мы видим не сталь, а розоватый, тончайший слой медного напыления. Без этого слоя хромированные, никелированные детали становились бы облезлыми и некрасивыми очень быстро.
Биологическая ценность для человека
Медь относится к категории жизненно-необходимых элементов, и в организме взрослого человека, содержится около 100 граммов этого металла. Переоценка токсичности данного вещества проводилась в 2003 году Всемирной Организацией Здравоохранения. Исследования установили, что медь не является причиной заболеваний пищеварительного тракта, и не провоцирует развитие болезни Вильсона-Коновалова (гепатоцеребральная дистрофия, поражающая печень и головной мозг), как считалось ранее. Учёные пришли к выводу, что для здоровья человека больше вреден недостаток меди, а не её переизбыток.
Бактерицидность меди известна давно, а последние исследования в этой области подтвердили эффективность металла в профилактике свиного гриппа, поражения золотистым стафилококком. В экспериментах было установлено, что на медной поверхности погибает 99% болезнетворных бактерий в течение 2-х часов. Поэтому медь и её сплавы широко применяется для обеззараживания воды. В Европе из этого металла изготавливаются дверные ручки, замки, петли и перила, которые устанавливаются в медучреждениях и местах общего пользования.
Оксид меди(II) | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Оксид меди(II)
Номер продукта: Все применимые коды продуктов American Elements, например. CU2-OX-02
, CU2-OX-03
, CU2-OX-04
, CU2-OX-05
Номер CAS: 1317-38-0
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-44 -9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS07
Acute Tox. 4 h402 Вреден при проглатывании.
Классификация согласно Директиве 67/548/ЕЭС или Директиве 1999/45/ЕС
Xn; Вреден для здоровья
R22: Вреден при проглатывании.
Н; Опасно для окружающей среды
R50/53: Очень токсичен для водных организмов, может вызывать долговременные неблагоприятные последствия в водной среде.
Информация об особых опасностях для человека и окружающей среды:
Н/Д
Опасности, не классифицированные иначе
Нет доступных данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с регламентом CLP .
Пиктограммы, обозначающие опасности
GHS07
Сигнальное слово: Осторожно
Предупреждения об опасности
h402 Вреден при проглатывании.
Меры предосторожности
P264 Тщательно вымыть после работы.
P270 Не ешьте, не пейте и не курите при использовании этого продукта.
P301+P312 ПРИ ПРОГЛАТЫВАНИИ: Позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу/…/, если вы плохо себя чувствуете.
P330 Прополоскать рот.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
2
0
0
Здоровье (острые воздействия) = 4 9000 Опасность = 4 9002 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
CAS No. 0 Оксид меди(II)
0 Оксид меди(II)
Идентификационный номер(а):
Номер ЕС: 215-269-1
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт негорючий. Используйте меры пожаротушения, подходящие для окружающего огня.
Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Пар оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию
Меры предосторожности по защите окружающей среды:
Не допускать попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Утилизировать загрязненный материал как отходы в соответствии с разделом 13.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
Информацию о безопасном обращении см. в разделе 7
Информацию о средствах индивидуальной защиты см. в Разделе 8.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт негорючий
Условия для безопасного хранения с учетом любых несовместимостей
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Хранить вдали от алюминия, алюминиевых сплавов.
Хранить вдали от металлических порошков.
Хранить вдали от магния/магниевых сплавов.
Хранить вдали от щелочных металлов.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Конкретное конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость потока при не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация: нет данных
Контроль экспозиции
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.
Рекомендуемое фильтрующее устройство для кратковременного использования:
Используйте респиратор типа N95 (США) или полиэтиленовые (EN 143) картриджи в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук: Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Материал перчаток
Нитрилкаучук, NBR
Время проникновения через материал перчаток (в минутах): Данные отсутствуют
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Различные формы (порошок/хлопья/кристаллы/гранулы и т.д.)
Цвет: Черный
Запах: Без запаха
Порог запаха : Данные недоступны.
pH: неприменимо
Температура плавления/диапазон плавления: 1326 °C (2419°F)
Точка/диапазон кипения: Данные отсутствуют
Температура сублимации / начало: Данные отсутствуют
Воспламеняемость (твердое вещество, газ): Данные отсутствуют.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров:
Н/Д
Плотность при 20 °C (68 °F): 6,3–6,49г/см 3 (52,574-54,159 фунтов/галлон)
Относительная плотность: Данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная активность
Нет данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не произойдет, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции не известны
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Окислители
Металлические порошки
Щелочные металлы
Алюминий/алюминиевые сплавы.
Магний/сплавы магния
Опасные продукты разложения:
Пары оксидов металлов
РАЗДЕЛ 11.
 ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Вреден при проглатывании.
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения LD/LC50, важные для классификации: Пероральная LD50 470 мг/кг (крыса)
Раздражение или коррозия кожи: Может вызывать раздражение
Раздражение или коррозия глаз: Может вызывать раздражение
Повышение чувствительности: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях для этого вещества.
Канцерогенность:
EPA-D: Канцерогенность для человека не классифицируется: неадекватные доказательства канцерогенности для людей и животных или данные отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая системная токсичность на орган-мишень — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при многократном приеме этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна имеется
Потенциал биоаккумуляции
Нет данных
Мобильность в почве
Нет данных
Экотоксическое воздействие:
Примечание:
Очень токсично для водных организмов
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Также ядовит для рыб и планктона в водоемах.
Может оказывать долговременное вредное воздействие на водные организмы.
Избегайте попадания в окружающую среду.
Очень токсичен для водных организмов
Результаты оценки PBT и vPvB
PBT: Н/Д
vPvB: Н/Д
Другие неблагоприятные воздействия
Нет доступных данных
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Ознакомьтесь с официальными правилами для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA
UN3077
Собственное отгрузочное наименование ООН
DOT
Вещества, опасные для окружающей среды, твердые, н.у.к. (оксид меди(II))
IMDG, IATA
ВЕЩЕСТВО ТВЕРДОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ, Н.У.К. (оксид меди(II))
Класс(ы) опасности при транспортировке
DOT, IMDG
Класс
9 Прочие опасные вещества и изделия.
Маркировка
9
Класс
9 (M7) Прочие опасные вещества и изделия
Маркировка
9
IATA
Класс
9 Прочие опасные вещества и изделия.
Этикетка
9
Группа упаковки
DOT, IMDG, IATA
III
Опасность для окружающей среды:
Специальная маркировка (ADR):
Символ (рыба и дерево)
Специальная маркировка (IATA):
Символ (рыба и дерево)
Особые меры предосторожности для пользователя
Предупреждение : Прочие опасные вещества и изделия
Номер EMS:
F-A,S-F
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
N/A
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT):
№
ООН «Типовой регламент»:
UN3077, Вещества твердые, опасные для окружающей среды, н.у.к. (оксид меди(II)), 9, III
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Агентство по защите Закон о контроле за токсичными веществами Инвентаризация химических веществ.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
1317-38-0 Оксид меди(II)
Предложение 65 штата Калифорния
Предложение 65 – Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Медь и ее свойства
Дом |
Бесплатные практические тесты
Основными рудами меди являются медный пирит (CuFeS 2 ), куприт (Cu 2 O), сульфид меди (I) (Cu 2 S) и малахит (CuCO 3 .Cu(OH) ). 2 ).
Медь очень стабильна на воздухе, поэтому ее можно свободно найти в виде металла в нескольких местах.
Добыча меди
Руда, из которой обычно добывают медь, представляет собой медный колчедан CuFeS 2 . Сначала его концентрируют в процессе флотации, а затем обжигают на воздухе для получения сульфида меди (I).
2CuFeS 2(т) + 4O 2(г) → Cu2S (т) + 3SO 2(г) + 2FeO (т)
Добавление SiO 2 и нагревание в отсутствие воздуха удаляет оксид железа(II) в виде шлака триоксосиликата(IV) железа(II), FeSiO 3 . Затем остается сульфид меди(I), Cu 2 S.
Затем остается сульфид меди(I), Cu 2 S.
Медь извлекают из Cu 2 S нагреванием в регулируемой подаче воздуха.
Cu 2 S (т) + O 2(г)
→ 2Cu (т) + SO 2(г)
Примечание:
*Подача воздуха должна регулироваться, так как медь может реагировать с кислородом с образованием оксидов.
*Производимая медь очень нечистая, поэтому она
очищают с помощью электролитических средств. Анодом служит нечистая медь, а катодом служит полоска чистой меди.
Электролит — раствор CuSO 4 —
см. более подробную информацию об этом процессе здесь:
электролитический
Ячейки
Свойства меди (физ.
и химическая)
Медь проявляет следующие физические и химические
свойства:
Физические свойства
1. Медь представляет собой мягкое твердое вещество красного цвета с блеском.
2. Плотность 8,95 г/см 3 .
3. Он очень податлив и пластичен.
4. Обладает относительно высокой прочностью на растяжение.
5. Температура плавления 1080 o С.
6. Это очень хороший проводник тепла и электричества.
Химические свойства
Медь, серебро и золото часто называют элементами чеканки, потому что они используются для изготовления монет в мире из-за того, что они
не реакционноспособны и устойчивы к коррозии.
1. Воздействие воздуха — медь очень устойчива на чистом воздухе (напомним, что медь менее реакционноспособна, стоя в ряду реакционной способности значительно ниже).
На влажном воздухе постепенно покрывается зеленым налетом основного сульфата меди(II), CuSO 4 .3Cu(OH) 2 и карбоната. При воздействии влажного морского воздуха на нем образуется налет основного хлорида.
Медь при нагревании на воздухе легко окисляется с образованием оксида меди (II) (черного цвета).
2Cu (т) + O 2(г) → 2CuO (т)
2. С кислотами — медь не вытеснит водород разбавленных кислот (будучи ниже водорода в ряду активности).
Поэтому он не реагирует с разбавленной HCl или H 2 SO 4 . Однако медь реагирует с растворами
окисляющие кислоты, такие как HNO 3 и горячая конц. H 2 SO 4 .
С HNO 3 — концентрация кислоты будет определять образующиеся продукты.
С горячей конц. HNO 3 — образуются оксид азота(IV) и соль триоксонитрата(V) меди(II).
Cu (с) + 4HNO 3(водн.) → Cu(NO 3 ) 2(водн.) + 2H 2 O (л) + 2NO 2(г)
С разбавленной HNO 3 — образуются оксид азота(II) и соль триоксонитрата(V) меди(II).
3Cu (т) + 8HNO 3(водн.) → 3Cu(NO 3 ) 2(водн. ) + 4H 2 O (л) + 2NO 8
) + 4H 2 O (л) + 2NO 8
23 г (0
3)
С горячей конц. H 2 SO 4 — CuSO 4 формируется и SO 2 освобождается.
Cu(т) + 2H 2 SO 4(водн.) → CuSO 4(водн.) + 2h3O (л) + SO 2(г)
Соль CuSO 4 кристаллизуется в виде синего пентагидрата.
— CuSO 4 .5H 2 О
Примечание: реакция между металлической медью и H 2 SO 4 происходит только при горячей и концентрированной кислоте.
Со щелочами — медь не вступает в реакцию со щелочами.
Использование CuSO
4
CuSO 4 можно использовать следующим образом:
(1). В качестве фунгицида для опрыскивания винограда, цитрусовых деревьев и картофеля.
(2). При производстве некоторых пигментов.
(3). При приготовлении промывок, таких как «Бордоская смесь».
(4). В гальванике.
(5). В окрашивании.
(6). При получении других соединений меди.
(7). Для сохранения древесины.
Тест на ион меди(II), Cu
2+
Растворы солей меди(II) обычно синего цвета. Следующие тесты выявят и подтвердят их:
1. Тест на пламя. Соли меди(II) горят в несветящемся пламени, образуя голубовато-зеленый цвет.
2. С гидроксидом натрия — при добавлении нескольких капель NaOH к раствору соли Cu 2+ образуется голубой студенистый осадок.
Осадок нерастворим в избытке NaOH.
Cu 2+ (водн.) + 2NaOH (водн.)
→ Cu(OH) 2(т) + 2Na + (водн.)
3. С водным раствором аммиака — выпадает синий осадок. Синий осадок фактически представляет собой гидроксид меди(II), Cu 2+ (водн.) + 2OH — (водн.)
→ Cu(OH) 2(т)
который будет растворяться в избытке водного аммиака, давая темно-синий раствор.
Cu(OH) 2(т) + 4NH 4 + (водн.) + 4OH — (водн.)
→ Cu(NH 3 ) 4 2+ (водн.) + 2OH — (водн.) + 4H 2 O
2 (3)
Использование меди
(1). Медь, будучи очень хорошим проводником электричества, а также пластичностью, используется для изготовления электрических проводов.
(2). Используется в металлоконструкциях, сантехнических и кровельных работах.
(3). При изготовлении различных сплавов огромного применения.
(4). Используется для изготовления монет.
Нравится |
Элемент месяца — медь
- Дом
- Элемент месяца — медь
Стивен Райт | Пн, 30. 09.2019 — 18:31
09.2019 — 18:31
«В честь Международного года Периодической таблицы эта серия статей подробно описывает проект Element of the Month , разработанный Стивеном В. Райтом (SWW), младшим научным сотрудником Pfizer Inc., и Маршей Р. Фолгер. (MRF), учитель химии (сейчас на пенсии) в средней школе Лайма — Олд Лайм в Коннектикуте. Прочтите Элемент месяца — введение , чтобы получить обзор проекта и ссылки на другие статьи серии». — Редактор
В феврале мы вернемся к более знакомым элементам и подробно обсудим металлический элемент с исследованием меди. Это позволяет нам перейти к обсуждению ряда активности металлов и продемонстрировать реакционную способность различных металлов, определяемую их потенциалами окисления. Химия меди, конечно, красочна, что добавляет удовольствия от этих экспериментов.
Использование
Учащиеся обычно хорошо осведомлены о том, что медь используется в чеканке монет, кухонной посуде, кровле, сантехнике и электрических проводниках. Мы отмечаем, что медь часто сплавляют с цинком для получения латуни, популярного декоративного сплава, и с оловом для получения бронзы, которая тверже и менее подвержена коррозии, чем латунь или медь, и часто используется для изготовления деталей кораблей, таких как гребные винты. Отметим, что соединения меди используются в качестве фунгицидов и альгицидов. На столе выставлена банка с пенни, обрывок медной трубы и несколько фитингов, обрывок медного электрического кабеля, обрывок медной обшивки, обломок медной кухонной посуды, латунная дверная ручка и обрывок, обработанный давлением. древесина.
Мы отмечаем, что медь часто сплавляют с цинком для получения латуни, популярного декоративного сплава, и с оловом для получения бронзы, которая тверже и менее подвержена коррозии, чем латунь или медь, и часто используется для изготовления деталей кораблей, таких как гребные винты. Отметим, что соединения меди используются в качестве фунгицидов и альгицидов. На столе выставлена банка с пенни, обрывок медной трубы и несколько фитингов, обрывок медного электрического кабеля, обрывок медной обшивки, обломок медной кухонной посуды, латунная дверная ручка и обрывок, обработанный давлением. древесина.
Физические свойства
Учащиеся часто знакомы с медью как красноватым, умеренно плотным, мягким металлом. Мы замечаем, что медь одновременно и ковкая, и пластичная, и объясняем, что эти термины означают, что ей легко придать форму ковкой или волочением через матрицу. Мы отмечаем, что не все металлы таковы, и железо, очевидно, труднее придать форму. Медь является отличным проводником как электричества, так и тепла.
Рисунок 1: Слева направо: раствор сульфата меди II, раствор сульфата меди II плюс небольшое количество NH 4 OH, осаждающий Cu(OH) 2 , раствор сульфата меди II плюс избыток NH 4 обозначение.
Химические свойства
Начнем с того, что медь является относительно нереакционноспособным или трудноокисляемым металлом. Вот почему это так полезно. Нам не нужны крыши, монеты, трубы и провода, которые легко поддаются коррозии. Мы демонстрируем качественный аналитический тест на ион меди, обрабатывая раствор сульфата меди 2 М раствором гидроксида аммония в большой пробирке. Мы показываем начальное образование голубого осадка Cu(OH) 2 с последующим растворением осадка при дальнейшем добавлении раствора гидроксида аммония с образованием темно-синего комплексного иона Cu(NH 3 ) 4 2 + (см. рисунок 1). 1 Мы также продемонстрировали окраску пламени меди с помощью 0,2 М раствора хлорида меди (см. Видео 1). Этот раствор дает гораздо более яркий цвет пламени, чем сульфат меди. 2 Отметим, что медь образует множество комплексов, не только с аммиаком, поэтому химия меди так красочна. Например, мы показываем и сравниваем образцы безводного и гидратированного сульфата меди. Затем мы добавляем несколько капель воды к безводному сульфату меди, чтобы показать гидратацию безводного сульфата меди с образованием синего Cu(H 2 О) 4 2+ ион. Мы особенно отмечаем смену цвета с белого на синий, который по совпадению является школьным цветом нашей средней школы. Затем мы готовим 0,2 М раствор хлорида меди, растворяя 17 г дигидрата CuCl 2 в 500 мл воды, содержащей 10 мл концентрированной соляной кислоты (HCl предотвращает возможный частичный гидролиз CuCl 2 с образованием нерастворимого Cu(OH) 2 ). Мы сливаем 200 мл этого раствора в отдельную колбу и показываем, что ион меди также образует комплекс с ионом хлорида при добавлении большого избытка безводного хлорида кальция (25 г).
Видео 1). Этот раствор дает гораздо более яркий цвет пламени, чем сульфат меди. 2 Отметим, что медь образует множество комплексов, не только с аммиаком, поэтому химия меди так красочна. Например, мы показываем и сравниваем образцы безводного и гидратированного сульфата меди. Затем мы добавляем несколько капель воды к безводному сульфату меди, чтобы показать гидратацию безводного сульфата меди с образованием синего Cu(H 2 О) 4 2+ ион. Мы особенно отмечаем смену цвета с белого на синий, который по совпадению является школьным цветом нашей средней школы. Затем мы готовим 0,2 М раствор хлорида меди, растворяя 17 г дигидрата CuCl 2 в 500 мл воды, содержащей 10 мл концентрированной соляной кислоты (HCl предотвращает возможный частичный гидролиз CuCl 2 с образованием нерастворимого Cu(OH) 2 ). Мы сливаем 200 мл этого раствора в отдельную колбу и показываем, что ион меди также образует комплекс с ионом хлорида при добавлении большого избытка безводного хлорида кальция (25 г). Дополнительный хлорид-ион способствует смещению равновесия от синего Cu(H 2 O) 4 2+ до зеленого CuCl 4 2+ ион. 3 Цвета химии меди делают ее забавной, а низкая реакционная способность металла делает ее полезной.
Дополнительный хлорид-ион способствует смещению равновесия от синего Cu(H 2 O) 4 2+ до зеленого CuCl 4 2+ ион. 3 Цвета химии меди делают ее забавной, а низкая реакционная способность металла делает ее полезной.
Видео 1: Цвета элементов в пламени — хлорид меди(II). Авторы: Ф. М. Гастингс, Дж. Дж. Якобсен. Получено от Якобсена, Джеррольда Дж.; Мур, Джон В., Химия оживает!, Vol. 2; Journal of Chemical Education, 2000, 77(5), 671. DOI: 10.1021/ed077p671.*
Затем мы спрашиваем класс, растворяется ли металлическая медь в соляной кислоте. Мы демонстрируем реакцию образцов медной, железной, цинковой и алюминиевой проволоки с 6 М соляной кислотой в больших пробирках. Сначала мы даем образцам проволоки прореагировать при комнатной температуре, а затем ненадолго нагреваем каждую пробирку по очереди, помещая пробирку в большой химический стакан с очень горячей водой (Примечание: важно убедиться, что образцы медной и железной проволоки не подвержены коррозии). или потускнеть, и что железная проволока не содержит смазки или масла). Мы объясняем, что металлическая медь растворяется только в окисляющих кислотах, таких как крепкая серная кислота или азотная кислота, и напоминаем им об эксперименте Айры Ремсен, который мы провели в ноябре и который описан в Элементе месяца: азот (см. видео 2).
или потускнеть, и что железная проволока не содержит смазки или масла). Мы объясняем, что металлическая медь растворяется только в окисляющих кислотах, таких как крепкая серная кислота или азотная кислота, и напоминаем им об эксперименте Айры Ремсен, который мы провели в ноябре и который описан в Элементе месяца: азот (см. видео 2).
Видео 2: Несколько капель концентрированной азотной кислоты капают на медную монету до 1982 года выпуска. Кредиты: Якобсен, Джеррольд Дж.; Мур, Джон В., Химия оживает!, Vol. 3; Journal of Chemical Eduacation, 1999 (76) 9 1311. DOI: 10.1021/ed076p1311.*
Основываясь на реакциях образцов проволоки с соляной кислотой, мы спрашиваем класс: Какой металл наиболее активен? Что наименее реакционноспособно? Что находится между ними? Мы пишем список на доске в порядке реакции, от самой низкой к самой высокой, в зависимости от выбора учащихся. Мы просим, «есть ли металлы, которые менее реакционноспособны, чем медь? Обычно учащиеся вскоре предлагают серебро, золото и, возможно, платину. Мы добавляем эти металлы в наш список на доске. Затем мы спрашиваем класс, «что произойдет если мы поместим в раствор соединения меди металл, более реакционноспособный, чем медь?» Мы продемонстрируем это, растворив 25 г дигидрата CuCl 2 в 500 мл воды в химическом стакане при быстром магнитном перемешивании, а затем добавьте в химический стакан 5 г алюминиевых гранул размером 20 меш.0226 4 Продолжаем быстро перемешивать и отмечаем явный жар реакции. Когда реакция стихает, мы фильтруем смесь через большую гофрированную фильтровальную бумагу и отмечаем бесцветный фильтрат, содержащий хлорид алюминия, и фильтровальную бумагу, содержащую осажденную металлическую медь. Затем мы спрашиваем класс : «А как насчет обратной реакции, когда медь помещается в раствор алюминия?» Большинство учеников сразу заявляют, что никакой реакции ожидать не следует. Мы помещаем образец медной фольги в разбавленный раствор сульфата алюминия в большую пробирку и спрашиваем класс, следует ли нам приостановить задание «Элемент месяца» до тех пор, пока не проявится реакция.
Мы добавляем эти металлы в наш список на доске. Затем мы спрашиваем класс, «что произойдет если мы поместим в раствор соединения меди металл, более реакционноспособный, чем медь?» Мы продемонстрируем это, растворив 25 г дигидрата CuCl 2 в 500 мл воды в химическом стакане при быстром магнитном перемешивании, а затем добавьте в химический стакан 5 г алюминиевых гранул размером 20 меш.0226 4 Продолжаем быстро перемешивать и отмечаем явный жар реакции. Когда реакция стихает, мы фильтруем смесь через большую гофрированную фильтровальную бумагу и отмечаем бесцветный фильтрат, содержащий хлорид алюминия, и фильтровальную бумагу, содержащую осажденную металлическую медь. Затем мы спрашиваем класс : «А как насчет обратной реакции, когда медь помещается в раствор алюминия?» Большинство учеников сразу заявляют, что никакой реакции ожидать не следует. Мы помещаем образец медной фольги в разбавленный раствор сульфата алюминия в большую пробирку и спрашиваем класс, следует ли нам приостановить задание «Элемент месяца» до тех пор, пока не проявится реакция. Хор «Нет!» результатов и мы идем дальше.
Хор «Нет!» результатов и мы идем дальше.
Рисунок 3: Ногти до (слева) и после (справа) воздействия 0,2 М раствора CuCl 2 в течение примерно 10 минут.
Мы спрашиваем, «что может произойти, если мы используем менее активный металл, такой как железо, с нашим раствором хлорида меди?» Мы помещаем три или четыре чистых стальных гвоздя в 0,2 М раствор хлорида меди в стакане. Обычные гвозди «четыре пенни» хорошо работают, но их необходимо очистить от жира с помощью полотенца и небольшого количества растворителя для краски или скипидара. Через минуту-две сливаем раствор хлорида меди и выкладываем ногти на бумажную салфетку (см. рисунок 3). Они покрыты красно-коричневым налетом металлической меди. Затем мы задаемся вопросом, что может произойти, если мы пойдем другим путем и добавим менее активный металл, такой как серебро, в раствор меди. Класс снова правильно догадается, что никакой реакции ожидать не приходится. Мы подтверждаем это, помещая кусок серебряной фольги в раствор сульфата меди (мы не используем раствор хлорида меди, потому что ион хлорида может потускнеть на поверхности серебра). Хорошо, мы спрашиваем, «что может произойти, если мы поместим металлическую медь в раствор серебра?» К этому моменту класс выполняет задание и правильно предложит реакцию. Мы помещаем кусок медной фольги в 0,1 М (или 5%) раствор нитрата серебра в большой пробирке и наблюдаем быстрый рост частиц серебра на поверхности медной фольги. 5 Наконец, мы спрашиваем класс, как можно получить осаждение металлической меди на серебре, чтобы реакция пошла «в обратном направлении»? Это, конечно, может быть достигнуто только путем подачи энергии в систему в виде электрической энергии. Мы показываем, что мы можем гальванизировать медь на серебре, используя химический стакан, содержащий 0,2 М раствор сульфата меди, подкисленный небольшим количеством разбавленной серной кислоты, с использованием анода из медной фольги и катода из серебряной фольги с подачей постоянного тока около 3 вольт. 6 На серебряной фольге быстро появляется коричневый налет меди. Наконец, мы спрашиваем класс, что произойдет, если мы запустим ячейку в обратном порядке.
Хорошо, мы спрашиваем, «что может произойти, если мы поместим металлическую медь в раствор серебра?» К этому моменту класс выполняет задание и правильно предложит реакцию. Мы помещаем кусок медной фольги в 0,1 М (или 5%) раствор нитрата серебра в большой пробирке и наблюдаем быстрый рост частиц серебра на поверхности медной фольги. 5 Наконец, мы спрашиваем класс, как можно получить осаждение металлической меди на серебре, чтобы реакция пошла «в обратном направлении»? Это, конечно, может быть достигнуто только путем подачи энергии в систему в виде электрической энергии. Мы показываем, что мы можем гальванизировать медь на серебре, используя химический стакан, содержащий 0,2 М раствор сульфата меди, подкисленный небольшим количеством разбавленной серной кислоты, с использованием анода из медной фольги и катода из серебряной фольги с подачей постоянного тока около 3 вольт. 6 На серебряной фольге быстро появляется коричневый налет меди. Наконец, мы спрашиваем класс, что произойдет, если мы запустим ячейку в обратном порядке. Мы меняем полярность ячейки, и осадок меди почти волшебным образом исчезает с серебряной фольги. 7
Мы меняем полярность ячейки, и осадок меди почти волшебным образом исчезает с серебряной фольги. 7
* *дополнительные видео из коллекции ChemEd X доступны по подписке.
Примечания и ссылки:
См., например, Engelder, C.J.; Дункельбергер, Т. Х.; Шиллер, В. Дж. Полумикрокачественный анализ; Уайли: Нью-Йорк, 19 лет.36; стр. 122.
- Цветовая эмиссия подписи вызвана возбуждением хлорида металла; см., например: (а) Lancaster, R.; Симидзу, Т .; Батлер, REA; Hall, R.G. Fireworks: Principles and Practice Chemical Publishing Co.: New York, 1972; стр. 60; (b) Конклинг, Дж. Р. Химия пиротехники Марсель Деккер: Нью-Йорк, 1985; стр. 155 – 166.
- Этот эксперимент изменен из (a) Summerlin, Lee R.; Или, Джеймс Л. младший. Химические демонстрации: справочник для учителей; Американское химическое общество: Вашингтон, округ Колумбия, 1985; стр. 54 – 55; и (b) Саммерлин, Ли Р.; Боргфорд, Кристи Л.; Или, Джули Б.
 Химические демонстрации: Справочник для учителей, том 2, 2-е изд.; Американское химическое общество: Вашингтон, округ Колумбия, 1988 г.; стр. 71 – 72. Мы используем безводный хлорид кальция вместо концентрированной соляной кислоты, чтобы избежать коррозионной смеси, одновременно вызывая повышение температуры и высокую концентрацию ионов хлора.
Химические демонстрации: Справочник для учителей, том 2, 2-е изд.; Американское химическое общество: Вашингтон, округ Колумбия, 1988 г.; стр. 71 – 72. Мы используем безводный хлорид кальция вместо концентрированной соляной кислоты, чтобы избежать коррозионной смеси, одновременно вызывая повышение температуры и высокую концентрацию ионов хлора. - Это модификация Summerlin, Lee R.; Боргфорд, Кристи Л.; Или, Джули Б. Химические демонстрации: Справочник для учителей, том 2, 2-е изд.; Американское химическое общество: Вашингтон, округ Колумбия, 1988; стр. 202. Пятнадцать граммов гранулированного металлического цинка размером 30 меш можно использовать, если гранулированный алюминий недоступен. В качестве альтернативы можно использовать три грамма алюминиевой фольги, нарезанной на небольшие квадратные кусочки размером около 3 мм.
- Демонстрация серебряной «листвы» на «дереве» из медной фольги популярна уже много лет, см.: Ford, Leonard A. Chemical Magic, 2nd ed.; Дувр: Минеола, Нью-Йорк, 1993; стр.
 82.
82. - См. Шакашири, Бассам А. Химические демонстрации: Справочник для учителей, Vol. 4; University of Wisconsin Press: Мэдисон, Висконсин, 19 лет.92; стр. 212 – 223.
- В этих экспериментах по гальванике важно использовать сульфат меди (II), а не хлорид меди (II) в качестве раствора электролита. Когда в конце демонстрации ячейку запускают «назад» для удаления слоя меди с серебряной фольги, некоторое количество металлического серебра будет окисляться до ионов серебра на аноде, что приведет к мутной суспензии AgCl, если медь (II ) используется хлорид. Мы сохраняем раствор электролита и используем его из года в год.
Концепции:
Элемент
Коллекция:
Элементы
Безопасность
Общая безопасность
Для лабораторных работ: См. Руководство ACS по безопасности химических лабораторий в средних школах (2016 г.).
Для демонстраций: Пожалуйста, обратитесь к Руководству по безопасности химических демонстраций отдела химического образования ACS.
Прочие ресурсы по безопасности
RAMP: распознать опасности; Оценить риски опасностей; Свести к минимуму риски опасностей; Подготовьтесь к чрезвычайным ситуациям
Безопасность: видеодемонстрация
Демонстрационные видеоролики, представленные здесь, не предназначены для обучения химическим методам демонстрации. Они предназначены для использования в классе. Демонстрации могут представлять угрозу безопасности или показывать явления, которые трудно наблюдать всему классу во время живой демонстрации.
Те, кто выполняет демонстрации, показанные в этом видео, прошли обучение и придерживаются передовых методов безопасности.
Любой, кто собирается провести демонстрацию химии, должен сначала прочитать, а затем соблюдать Руководство по безопасности для демонстрации химии (2016 г.) . Эти рекомендации также доступны на сайте ChemEd X.
НГСС
Химические реакции HS-PS1-2
Учащиеся, демонстрирующие понимание, могут построить и пересмотреть объяснение результата простой химической реакции, основанное на самых удаленных электронных состояниях атомов, тенденциях в периодической таблице и знании закономерностей химических свойств.
*Более подробную информацию обо всех DCI для HS-PS1 можно найти на https://www.nextgenscience.org/dci-arrangement/hs-ps1-matter-and-its-interactions, а также дополнительные ресурсы на https://www. .nextgenscience.org.
Сводка:
Учащиеся, демонстрирующие понимание, могут построить и пересмотреть объяснение результата простой химической реакции, основанное на самых удаленных электронных состояниях атомов, тенденциях в периодической таблице и знании закономерностей химических свойств.
Граница оценки:
Оценка ограничена химическими реакциями с участием элементов основных групп и реакциями горения.
Пояснение:
Примеры химических реакций могут включать реакцию натрия и хлора, углерода и кислорода или углерода и водорода.
ПЕНТАГИДРАТ СУЛЬФАТА МЕДИ | CAMEO Chemicals
Добавить в MyChemicals
Страница для печати
Химический паспорт
Химические идентификаторы |
Опасности |
Рекомендации по ответу |
Физические свойства |
Нормативная информация |
Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
| никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
никто | |||
NFPA 704
данные недоступны
Общее описание
ФИЗИЧЕСКОЕ ОПИСАНИЕ: Синие кристаллические гранулы или порошок. Температура плавления 110°С (с разложением). Негорючий. Отвратительный металлический привкус. Без запаха. Белый при обезвоживании. (НТП, 1992)
Температура плавления 110°С (с разложением). Негорючий. Отвратительный металлический привкус. Без запаха. Белый при обезвоживании. (НТП, 1992)
Опасности
Что это за информация?
Опасные поля
включают
специальные предупреждения об опасности
воздух и вода
реакции, пожароопасность, опасность для здоровья, профиль реактивности и
подробности о
задания реактивных групп
а также
потенциально несовместимые абсорбенты.
Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Предупреждения о реактивности
нет
Реакции воздуха и воды
Медленно растворяется в воздухе. Вода.
Пожароопасность
В литературных источниках указано, что это соединение негорюче. (НТП, 1992)
Опасность для здоровья
СИМПТОМЫ: Симптомы воздействия этого соединения могут включать раздражение кожи, глаз, дыхательных путей и желудочно-кишечного тракта. Проглатывание может вызвать серьезные желудочно-кишечные расстройства (рвота, боль, локальная коррозия и кровоизлияния), прострацию, анурию, гематурию, анемию, увеличение количества лейкоцитов, желтуху, кому, затруднение дыхания и недостаточность кровообращения. Он также может вызывать тошноту, металлический привкус, потливость, головную боль, чувство жжения в пищеводе и желудке, боли в животе, геморрагический гастрит, слабый пульс, мелену, конъюнктивит, изъязвление роговицы, гипотонию и помутнение. Другие симптомы могут включать водянистый и кровянистый стул, жжение во рту и горле, поражение печени с желтухой, гемолиз, тенезмы, позывы на рвоту, коллапс и судороги. Сообщалось о случаях уремии, шока и почечной недостаточности. Контакт с кожей может вызвать жжение и ожоги первой степени при кратковременном воздействии. Длительное воздействие может привести к ожогам второй степени. Лица с ранее существовавшей болезнью Вильсона могут быть более восприимчивы к этим эффектам.
Проглатывание может вызвать серьезные желудочно-кишечные расстройства (рвота, боль, локальная коррозия и кровоизлияния), прострацию, анурию, гематурию, анемию, увеличение количества лейкоцитов, желтуху, кому, затруднение дыхания и недостаточность кровообращения. Он также может вызывать тошноту, металлический привкус, потливость, головную боль, чувство жжения в пищеводе и желудке, боли в животе, геморрагический гастрит, слабый пульс, мелену, конъюнктивит, изъязвление роговицы, гипотонию и помутнение. Другие симптомы могут включать водянистый и кровянистый стул, жжение во рту и горле, поражение печени с желтухой, гемолиз, тенезмы, позывы на рвоту, коллапс и судороги. Сообщалось о случаях уремии, шока и почечной недостаточности. Контакт с кожей может вызвать жжение и ожоги первой степени при кратковременном воздействии. Длительное воздействие может привести к ожогам второй степени. Лица с ранее существовавшей болезнью Вильсона могут быть более восприимчивы к этим эффектам.
ОСТРЫЕ/ХРОНИЧЕСКИЕ ОПАСНОСТИ: Это соединение токсично при проглатывании. Это сильный раздражитель. При нагревании до разложения выделяет ядовитые пары оксидов серы. Может всасываться через кожу (многократное нанесение на кожу вызывает отравление). (НТП, 1992 г.)
Это сильный раздражитель. При нагревании до разложения выделяет ядовитые пары оксидов серы. Может всасываться через кожу (многократное нанесение на кожу вызывает отравление). (НТП, 1992 г.)
Профиль реакционной способности
ПЕНТАГИДРАТ СУЛЬФАТА МЕДИ можно дегидратировать нагреванием. Служит слабым окислителем. Вызывает воспламенение гидроксиламина. Легко набирает воду. Гидратированная соль энергично восстанавливается гидроксиламином [Mellor 8:292(1946-1947)]. Обе формы несовместимы с тонко измельченными металлами. Оба несовместимы с магнием, разъедают сталь и железо, могут реагировать со щелочами, фосфатами, газообразным ацетиленом, гидразином или нитрометаном, а также могут реагировать с бета-нафтолом, пропиленгликолем, сульфатиазолом и триэтаноламином, если pH превышает 7 (NTP, 1992). . Оба действуют как кислые соли, разъедают металлы и раздражают ткани.
Принадлежит к следующей реакционной группе(ам):
- Соли кислотные
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа
включают в себя расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, пожарное реагирование, защитная одежда и первая помощь.
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 151 [Вещества — Токсичные (негорючие)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых веществ.
РАЗЛИВ: При необходимости увеличьте расстояние для немедленных мер предосторожности в подветренном направлении.
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
(ЭРГ, 2020)
Пожаротушение
Пожары, связанные с этим материалом, можно тушить с помощью сухих химикатов, двуокиси углерода или галоновых огнетушителей. (НТП, 1992)
Непожарное реагирование
НЕБОЛЬШИЕ РАЗЛИВЫ И УТЕЧКИ: Если вы пролили это химическое вещество, вам следует смочить твердый разлитый материал водой, а затем переместить смоченный материал в подходящий контейнер. Используйте впитывающую бумагу, смоченную водой, чтобы собрать оставшийся материал. Запечатайте загрязненную одежду и впитывающую бумагу в паронепроницаемый пластиковый пакет для возможной утилизации. Вымойте все загрязненные поверхности мыльным раствором. Не возвращайтесь в загрязненную зону до тех пор, пока сотрудник службы безопасности (или другое ответственное лицо) не убедится, что зона была должным образом очищена.
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ХРАНЕНИИ: Этот материал следует хранить в условиях окружающей среды и защищать от влаги. (НТП, 1992 г. )
)
Защитная одежда
РЕКОМЕНДУЕМЫЙ РЕСПИРАТОР: В случае взвешивания и разбавления неразбавленного испытуемого химического вещества наденьте полумаску, одобренную NIOSH, оснащенную картриджем с органическим паром/кислотным газом (специально для органических паров, HCl, кислого газа и SO2) с пыле/туманный фильтр. (NTP, 1992)
DuPont Tychem® Suit Fabrics
Информация отсутствует.
Первая помощь
ГЛАЗА: Сначала проверьте наличие у пострадавшего контактных линз и снимите их, если они есть. Промывать глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно звоня в больницу или токсикологический центр. Не закапывайте в глаза пострадавшему какие-либо мази, масла или лекарства без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.
КОЖА: НЕМЕДЛЕННО промойте пораженную кожу водой, сняв и изолировав всю загрязненную одежду. Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
ПРИ ВДЫХАНИИ: НЕМЕДЛЕННО покинуть зараженную зону; сделать глубокий вдох свежего воздуха. При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы доставить пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, входящим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
ПРОГЛАТЫВАНИЕ: Некоторые тяжелые металлы являются ОЧЕНЬ ТОКСИЧНЫМИ ЯДАМИ, особенно если их соли хорошо растворяются в воде (например, свинец, хром, ртуть, висмут, осмий и мышьяк). НЕМЕДЛЕННО позвоните в больницу или в токсикологический центр и найдите активированный уголь, яичный белок или молоко на случай, если медицинский консультант порекомендует принять один из них. Также найдите сироп ипекакуаны или стакан соленой воды на случай, если медицинский консультант порекомендует вызвать рвоту. Обычно это НЕ РЕКОМЕНДУЕТСЯ без наблюдения врача. Если консультация врача недоступна, а пострадавший находится в сознании и у него нет конвульсий, дайте пострадавшему стакан взвеси активированного угля в воде или, если это невозможно, стакан молока или взбитых яичных белков и НЕМЕДЛЕННО транспортируйте пострадавшего. в больницу. Если пострадавший находится в судорогах или без сознания, ничего не давайте через рот, убедитесь, что дыхательные пути пострадавшего открыты, и положите пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992)
Также найдите сироп ипекакуаны или стакан соленой воды на случай, если медицинский консультант порекомендует вызвать рвоту. Обычно это НЕ РЕКОМЕНДУЕТСЯ без наблюдения врача. Если консультация врача недоступна, а пострадавший находится в сознании и у него нет конвульсий, дайте пострадавшему стакан взвеси активированного угля в воде или, если это невозможно, стакан молока или взбитых яичных белков и НЕМЕДЛЕННО транспортируйте пострадавшего. в больницу. Если пострадавший находится в судорогах или без сознания, ничего не давайте через рот, убедитесь, что дыхательные пути пострадавшего открыты, и положите пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
| Химическая формула: |
|
Температура вспышки: данные недоступны
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления:
297°F
(обезвоживает)
(NTP, 1992)
Давление пара: данные отсутствуют
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес:
2,284
(НТП, 1992)
Точка кипения:
1207°F
при 760 мм рт.ст.
(разлагается)
(NTP, 1992)
Молекулярный вес:
249,68
(НТП, 1992)
Растворимость в воде:
больше или равно 100 мг/мл
при 70°F
(NTP, 1992)
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.
PAC (критерии защитного действия)
| Химические вещества | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Пентагидрат сульфата меди(II) (7758-99-8) | 12 мг/м3 | 32 мг/м3 | 190 мг/м3 |
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Соединения меди | Н100 | и | 313 |
- & указывает, что этому общему или широкому классу не присвоено RQ, хотя этот класс является опасным веществом CERCLA.
 См. 50 Федерального реестра 13456 (4 апреля 1985 г.).
См. 50 Федерального реестра 13456 (4 апреля 1985 г.).
(Список списков Агентства по охране окружающей среды, 2022 г.)
Антитеррористические стандарты CISA Chemical Facility (CFATS)
Отсутствует нормативная информация.
Перечень стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе представлен список альтернативных названий этого химического вещества,
включая торговые названия и синонимы.
- СИНЯЯ МЕДЬ КАК
- СИНИЙ ВИТРИОЛ
- ГОЛУБОЙ КАМЕНЬ
- МЕДИ (2+) СУЛЬФАТ ПЕНТАГИДРАТ
- МЕДИ (II) СУЛЬФАТ ПЕНТАГИДРАТ
- МЕДИ (II) СУЛЬФАТ ПЕНТАГИДРАТ (1:1:5)
- СУЛЬФАТ МЕДИ
- СУЛЬФАТ МЕДИ (CUSO4) ПЕНТАГИДРАТ
- ПЕНТАГИДРАТ СУЛЬФАТА МЕДИ
- СУЛЬФАТ МЕДИ
- ПЕНТАГИДРАТ СУЛЬФАТА МЕДИ(2+)
- СУЛЬФАТ МЕДИ(II) ПЕНТАГИДРАТ
- МЕДЬ-ЦИНК
- CSP
- МЕДИ СУЛЬФАТ ПЕНТАГИДРАТ
- ПРИРОДНЫЙ ХАЛЬКАНТИТ
- РИМСКИЙ ВИТРИОЛ
- ЗАЛЬЦБУРГСКИЙ ВИТРИОЛ
- СЕРНАЯ КИСЛОТА, МЕДНАЯ (2+) СОЛЬ (1:1), ПЕНТАГИДРАТ
- СЕРНАЯ КИСЛОТА, МЕДНАЯ (2+) СОЛЬ, ПЕНТАГИДРАТ
- ТРЕУГОЛЬНИК
Химическая формула меди: символ, свойства, формулы, примеры
- Автор Ankita Sahay
- Последнее изменение 19-07-2022
- Автор
Анкита Сахай - Последнее изменение 19-07-2022
Химическая формула меди: Медь — это металл, имеющий символ «\({\rm{Cu}}\). » Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
» Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
Медь является чрезвычайно хорошим проводником тепла и электричества, и это свойство меди объясняет ее широкое использование в производстве посуды и электрических проводов. Медь также является необходимым микроэлементом, необходимым человеческому организму. Медь обычно извлекается из руд Халькопирит, также известный как медный колчедан и подобные сульфидные руды. Медь в основном встречается в Чили и Перу, расположенных в Южной Америке. В Индии основными производителями меди являются Джаркханд, Раджастхан и Мадхья-Прадеш. После того, как медные руды извлечены, они обрабатываются в несколько этапов для извлечения из них чистой и рафинированной металлической меди.
Химическая формула меди
Узнайте, как написать химическую формулу
Название происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Поскольку медь является элементом, вместо химической формулы у нее есть символ. Символ меди: \({\rm{‘Cu’}}\). Символ \({\rm{‘Cu’}}\) происходит от самого купрума . Этот элемент известен с доисторических времен.
Медь — это металл, который используется в различных сферах жизни и занимает важную часть цивилизации. Медь находится в группе \(11\) и периоде \(4\) современной периодической таблицы. Его атомный номер \(29{\text {th}}\) элемент современной периодической таблицы, также известный как переходный элемент, поскольку он является элементом d-блока. Некоторые из важных физических свойств меди приведены ниже:
- Медь имеет характерный красновато-коричневый цвет.
- Медь — чрезвычайно мягкий, пластичный и ковкий металл. Таким образом, ему можно придать нужную форму или согнуть в соответствии с нашими потребностями.

- Является хорошим проводником тепла и электричества. По этой причине из него изготавливают электрические провода и посуду. 9{65} \mathrm{Cu}\)
Химические свойства меди
1. Как и другие металлы, медь реагирует с влажной атмосферой, что приводит к коррозии. Медь тускнеет до сине-зеленого цвета, образуя гидроксид меди и карбонат меди. Но процесс коррозии в меди протекает крайне медленно, так как под воздействием влаги и воздуха на поверхности металлической меди образуется защитный оксидный слой и основные соли.
2. Медь растворяется в азотной кислоте.
3. Медь реагирует с кислородом воздуха с образованием оксида меди (II).
\({\rm{2Cu}}\left( {\rm{s}} \right){\rm{+}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \to {\rm{2CuO}}\left({\rm{s}} \right)\)
4. Медь реагирует с галогенами с образованием галогенидов меди различных цветов, таких как хлорид меди (желто-коричневое твердое вещество в безводном и сине-зеленое твердое вещество в дигидрате), фторид меди (белый цвет) и бромид меди (черный цвет).
5. В ряду реакционной способности металлов медь занимает нижнее положение. Таким образом, он менее реактивен. Медь вытесняется железом, когда железный гвоздь опускают в раствор медного купороса. Это приводит к образованию сульфата железа и меди.
\(\ mathrm{CuSO}_{4}(\mathrm{aq})+\mathrm{Fe}(\mathrm{s}) \rightarrow \mathrm{FeSO}_{4}(\mathrm{aq}) +\mathrm{Cu}(\mathrm{s})\)
Использование меди
1. Они используются в электроприборах – Поскольку медь является отличным проводником электричества и имеет низкое удельное сопротивление. Серебро — еще один металл, который является отличным проводником электричества, даже лучше, чем медь. Его доступная цена делает его широко используемым во всем мире в производстве электроэнергии, передаче электроэнергии, телекоммуникациях, электронных схемах, производстве электрических проводов, кабелей и т. д.
2. Используется для изготовления посуды – Благодаря высокой теплопроводности, высокой температуре плавления и кипения, а также высокой пластичности медь широко используется для изготовления посуды различных форм и размеров. Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
3. Медь также используется в теплообменниках кондиционеров, радиаторах компьютеров, автомобильных радиаторах, термосварочных машинах и телевизорах, поскольку этот металл является хорошим проводником тепла.
4. Медь очень полезна для водопровода трубопроводов и соединительных шин, которые являются жизненно важными элементами систем распределения электроэнергии, поскольку ее можно легко соединить пайкой, болтами или клеями.
5. Медь является одним из основных питательных веществ для человеческого организма. Он обеспечивает образование эритроцитов в организме вместе с железом. Достаточное количество меди в рационе очень важно, поскольку она помогает поддерживать здоровье костей, кровеносных сосудов, нервов и иммунной системы. Медь помогает предотвратить сердечно-сосудистые заболевания и остеопороз. Медью богаты моллюски, орехи и семечки, крупы с пшеничными отрубями, цельнозерновые продукты, шоколад, мясо и т. д.
д.
6. Медь также используется при изготовлении скульптур и статуй из-за легкости соединения. Он также используется ювелирами и другими ремесленниками.
7. Медь широко используется в автомобилях в качестве высокочистого медного провода, по которому проходит ток от автомобильного аккумулятора по всему автомобилю к такому оборудованию, как фары, центральный замок, цифровой экран и системы спутниковой навигации. Он также используется в электромобилях.
8. Медь также используется в трубопроводах. Он используется для транспорт вода для бытовых нужд; он также используется для подачи природного газа в дома и другие места, где это необходимо.
9. Изготавливаются различные сплавы меди, такие как бронза (медь и олово), латунь (медь и цинк), никель-серебро (медь, цинк и никель). Эти сплавы прочнее и устойчивы к коррозии, чем металлическая медь.
Резюме
В двух словах, медь — это металл, представленный как ‘\({\rm{Cu}}\)’. Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это хороший проводник электричества, поэтому в основном используется для изготовления электрических проводов, кроме меди. Серебро — еще один металл, который является отличным проводником электричества, но медь дешевле серебра, поэтому ее используют для изготовления электрических проводов. Медь поставляет электричество и чистую воду в наши дома и города и играет важную роль в достижении устойчивого развития. Более того, это необходимо для самой жизни, поскольку нашему телу нужны следы меди в качестве минералов, чтобы выжить. 9{1}\)
Q. 2. Откуда произошло химическое название меди?
2. Откуда произошло химическое название меди?
Ответ: Химически медь обозначается как ‘\({\rm{Cu}}\)’. Его символ происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Таким образом, символ \({\rm{‘Cu’}}\) происходит от первых двух букв самого купрума .
Q.3. Что такое медь?
Ответ: Медь — это металл, присутствующий в d-блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт». Медь — очень ковкий и пластичный металл. Кроме того, это отличный проводник электричества и тепла. Благодаря этим уникальным свойствам медь широко используется в производстве электрических проводов и посуды. Он используется в различных сферах жизни и имеет древнюю историю. Медь также известна как «металл для монет», потому что в древние времена люди использовали медные монеты.
Q. 4. Каковы два химических свойства меди?
4. Каковы два химических свойства меди?
Ответ: Два химических свойства меди: (i) Медь реагирует с кислородом воздуха с образованием оксида меди (II). (ii) Медь тускнеет до сине-зеленого цвета с образованием гидроксида меди и карбоната меди.
Q.5. Из чего делают медь?
Ответ: Медь является элементом. Это природный ресурс, обнаруженный в виде руды, известной как куприт, найденной глубоко в земле. После добычи медь проходит несколько этапов очистки и рафинирования, чтобы обойти \(99,9%\) чистого металла.
«Мы надеемся, что эта статья «Химическая формула меди» помогла вам. Если у вас есть какие-либо вопросы, оставьте комментарий ниже, и мы свяжемся с вами».
Практические вопросы по меди с советами и решениями
Медь — Энциклопедия Нового Света
Медь (символ Cu , атомный номер 29) — один из старейших металлов, известных в истории человечества. Красновато-оранжевый цвет, он пластичен, податлив и является отличным проводником тепла и электричества. В своей ионной форме медь является эссенциальным элементом для высших растений и животных, а также для человеческого организма.
В своей ионной форме медь является эссенциальным элементом для высших растений и животных, а также для человеческого организма.
Содержание
- 1 Этимология и алхимический символ
- 2 История
- 3 источника
- 4 Примечательные характеристики
- 4.1 Изотопы
- 4.2 Сплавы
- 5 приложений
- 6 Биологическая роль
- 6.1 Токсичность
- 6.2 Прочие опасности
- 7 соединений
- 8 Тесты на медь 2+ ионы
- 9 Примечания
- 10 Каталожные номера
- 11 кредитов
Медь и ее сплавы широко используются в электропроводке и машинах, электронных компонентах, конструкционных материалах, кухонной утвари и столовых приборах, чеканке монет, музыкальных инструментах и скульптурах. Кроме того, поскольку медь является биостатическим материалом, медные поверхности и дверные ручки используются в больницах для предотвращения переноса микробов, а сульфат меди (II) используется в качестве фунгицида.
Этимология и алхимический символ
Алхимический символ меди
Медь была важным ресурсом для древних греков и римлян. Греки назвали металл халкос (χαλκός). В римские времена он стал известен как aes Cyprium — aes , являющийся общим латинским термином для медных сплавов, таких как бронза (медь, сплавленная с оловом), и Cyprium , указывающий, что большая часть меди добывалась на Кипре. Отсюда латинское слово стало cuprum , которое в конечном итоге было переведено на английский язык до меди .
В мифологии и алхимии медь ассоциировалась с богиней Афродитой/Венерой из-за ее блестящей красоты, ее древнего использования для изготовления зеркал и связи с Кипром, который был посвящен богине. В алхимии символ меди был также символом планеты Венера.
История
Древний медный слиток из Закроса, Крит, имеет форму кожи животного, характерную для той эпохи тысяч лет. Медный кулон был найден на территории нынешнего северного Ирака и датируется 8700 годом 9.1592 г. до н. э. К 5000 г. г. до н.э. , имеются следы плавки меди, аффинажа меди из простых минералов, таких как малахит или азурит. Медь была первым металлом, выплавленным из руд.[1] Напротив, самые ранние признаки использования золота появляются около 4000 года до н. э.
Медный кулон был найден на территории нынешнего северного Ирака и датируется 8700 годом 9.1592 г. до н. э. К 5000 г. г. до н.э. , имеются следы плавки меди, аффинажа меди из простых минералов, таких как малахит или азурит. Медь была первым металлом, выплавленным из руд.[1] Напротив, самые ранние признаки использования золота появляются около 4000 года до н. э.
Самый древний известный литой медный предмет — это наконечник булавы, обнаруженный в Кан Хасане в южной Анатолии и датированный примерно 5000 годом года до н. э. Имеются артефакты из меди и бронзы (медь в сплаве с оловом, а иногда и с другими элементами) из шумерских городов, датируемых 3000 г. г. до н. э. , а древнеегипетские артефакты из меди и бронзы почти такого же возраста. В одной пирамиде была обнаружена пятитысячелетняя медная водопроводная система.
Египтяне обнаружили, что добавление небольшого количества олова облегчает литье металла, поэтому бронзовые сплавы были найдены в Египте почти сразу же, как и медь. Использование меди в Древнем Китае датируется по крайней мере 2000 годом г. до н.э. К 1200 г. г. до н.э. , в Китае делали отличные бронзы. Обратите внимание, что на эти даты повлияли войны и завоевания, так как медь легко переплавляется и используется повторно.
Использование меди в Древнем Китае датируется по крайней мере 2000 годом г. до н.э. К 1200 г. г. до н.э. , в Китае делали отличные бронзы. Обратите внимание, что на эти даты повлияли войны и завоевания, так как медь легко переплавляется и используется повторно.
В Европе Эци Ледяной человек, хорошо сохранившийся мужчина, датируемый 3200 годом до н. э. , был найден с топором с медным наконечником, металл которого имел чистоту 99,7%. Высокий уровень мышьяка в его волосах предполагает, что он занимался выплавкой меди. Латунь, сплав цинка и меди, была известна грекам, но впервые широко использовалась римлянами.
Различные цивилизации мира прошли через «Бронзовый век» в разные, но пересекающиеся периоды времени. Например, считается, что ближневосточный бронзовый век длился с 3500 до 1200 гг.1592 г. до н. э. ; британский бронзовый век датируется с 2100 по 700 год г. до н.э. ; а центральноевропейский бронзовый век длился с 1800 по 700 год г. до н.э. Переходный период в некоторых регионах между предшествующим периодом неолита (новый каменный век) и бронзовым веком называется энеолитом, когда некоторые инструменты из меди высокой чистоты использовались наряду с каменными орудиями.
до н.э. Переходный период в некоторых регионах между предшествующим периодом неолита (новый каменный век) и бронзовым веком называется энеолитом, когда некоторые инструменты из меди высокой чистоты использовались наряду с каменными орудиями.
West Mine at Alderley Edge
В эпоху бронзы медь добывалась на Британских островах в основном в следующих местах: South West County Cork, West Wales (например, шахта Cwmystwyth), North Wales (например, Great Orme) , Англси (гора Пэрис), Чешир (Олдерли-Эдж), Стаффордширские вересковые пустоши (например, шахта Эктон) и остров Мэн (между Англией и Северной Ирландией).
В Америке добыча меди началась с маргинальных разработок коренных американцев и некоторых разработок первых испанцев. Европейцы добывали медь в Коннектикуте еще в 1709 году. Движение на запад также привело к расширению добычи меди с разработкой значительных месторождений в Мичигане и Аризоне в 1850-х годах и в Монтане в 1860-х годах.
Медь активно добывалась на полуострове Кевинау в Мичигане, а центром добычи был продуктивный рудник Куинси. В Аризоне было много известных месторождений, в том числе «Медная королева» в Бисби и «Юнайтед Верде» в Джероме. К 1886 году Анаконда в Бьютте, штат Монтана, стала главным поставщиком меди в стране. Медь также добывалась в Юте, Неваде и Теннесси, среди других мест.
Источники
Открытый медный рудник Эль-Чино в Нью-Мексико
Среднее содержание меди в породах земной коры составляет примерно 68 частей на миллион (млн) по массе. Источниками меди являются следующие минералы:
- сульфиды: халькопирит (CuFeS 2 ), борнит (Cu 5 FeS 4 ), ковеллит (CuS), халькоцит (Cu 2 S)
- карбонаты: азурит (Cu 3 (CO 3 ) 2 (OH) 2 ) и малахит (Cu 2 CO 3 (OH) 2 )
- оксид: куприт (Cu 2 O).

Самородная медь также образуется в нерентабельных россыпных месторождениях.
Медные руды в основном находятся в Чили, США, Индонезии, Австралии, Перу, России, Канаде, Китае, Польше, Казахстане и Мексике. [1]
Большая часть медной руды добывается или извлекается в виде сульфидов меди на крупных карьерах в медно-порфировых месторождениях (медные рудные тела в порфировых породах), содержащих 0,4–1,0% меди. Примеры открытых медных рудников включают Chuquicamata в Чили и шахту El Chino в Нью-Мексико.
Межправительственный совет стран-экспортеров меди (CIPEC), прекративший свое существование в 1992 году, когда-то пытался играть ту же роль в отношении меди, что и ОПЕК в отношении нефти. Однако такого же влияния она не добилась — не в последнюю очередь потому, что второй по величине производитель, Соединенные Штаты, никогда не был ее членом. Образована в 1967 году, ее основными членами были Чили, Перу, Заир и Замбия.
Примечательные характеристики
Медь существует в виде металлически связанного вещества, что позволяет ей иметь широкий спектр металлических свойств
В периодической таблице медь является переходным металлом в периоде 4, между никелем и цинком. Кроме того, он находится в группе 11 (бывшая группа 1В) вместе с серебром и золотом и имеет с ними ряд общих характеристик. Подобно серебру и золоту, медь обладает высокой тепло- и электропроводностью (среди чистых металлов при комнатной температуре только серебро имеет более высокую электропроводность). Все три являются пластичными и ковкими металлами, то есть их можно легко вытянуть в проволоку или раскатать в листы.
Кроме того, он находится в группе 11 (бывшая группа 1В) вместе с серебром и золотом и имеет с ними ряд общих характеристик. Подобно серебру и золоту, медь обладает высокой тепло- и электропроводностью (среди чистых металлов при комнатной температуре только серебро имеет более высокую электропроводность). Все три являются пластичными и ковкими металлами, то есть их можно легко вытянуть в проволоку или раскатать в листы.
Золото и медь являются единственными цветными металлическими элементами, кроме цезия, щелочного металла периода 6. Медь имеет свой характерный красновато-оранжевый цвет, поскольку отражает красный и оранжевый свет и поглощает другие частоты в видимом спектре. Под воздействием атмосферы поверхность металла превращается в карбонат меди (CuCO 3 ), вещество зеленого цвета, называемое патиной .
Чистота меди выражается как 4N для чистоты 99,9999% или 7N для 9Чистота 9,9999999%. Цифра показывает количество девяток после запятой.
Изотопы
Существует два стабильных изотопа меди: 63 Cu и 65 Cu. Кроме того, есть пара десятков радиоизотопов. Подавляющее большинство радиоизотопов имеют период полураспада порядка минут или меньше; самый долгоживущий, 64 Cu, имеет период полураспада 12,7 часа с двумя режимами распада, которые приводят к двум отдельным продуктам.
Кроме того, есть пара десятков радиоизотопов. Подавляющее большинство радиоизотопов имеют период полураспада порядка минут или меньше; самый долгоживущий, 64 Cu, имеет период полураспада 12,7 часа с двумя режимами распада, которые приводят к двум отдельным продуктам.
Сплавы
Существует множество сплавов меди: металлическое зеркало представляет собой сплав меди/олова, латунь представляет собой сплав меди/цинка, а бронза представляет собой сплав меди/олова (иногда с некоторыми другими элементами). Металлический монель представляет собой сплав меди и никеля, также называемый мельхиором. Хотя термин «бронза» обычно относится к сплавам меди и олова, он также является общим термином для любого сплава меди, такого как алюминиевая бронза, кремниевая бронза и марганцевая бронза.
Применение
Медь широко используется в самых разных продуктах, как указано ниже.
- Электрические и электронные товары:
- Электропроводка.

- Электромагниты.
- Электрические машины, особенно электромагнитные двигатели и генераторы.
- Электрические реле, шины и переключатели.
- Вакуумные трубки, электронно-лучевые трубки и магнетроны в микроволновых печах.
- Волноводы для микроволнового излучения.
- В интегральных схемах медь все чаще заменяет алюминий из-за его превосходной проводимости.
- В качестве материала для изготовления компьютерных радиаторов из-за его превосходной способности рассеивать тепло по сравнению с алюминием.
- Электропроводка.
- Конструкционный материал:
- Строительство статуи: Статуя Свободы, например, содержит 179 200 фунтов (81,3 тонны) меди.
- Легированный никелем, используется для коррозионно-стойких материалов в судостроении.
- Кровля, водосточные желоба и водосточные желоба на зданиях.
- Товары для дома:
- Медная сантехника.
- Дверные ручки и прочая фурнитура в домах.

- В кухонной утвари, такой как сковороды.
- Большинство столовых приборов (ножи, вилки, ложки) содержат некоторое количество меди (нейзильбер).
- пробы, если оно используется в столовой посуде, должно содержать несколько процентов меди.
Серебро
- Тираж:
- Медные сплавы используются в чеканке монет. Например, пенни США состоят из 2,5% меди и 97,5% цинка по весу; никель состоит из 75,0% меди и 25,0% никеля; Даймы и четверти состоят из 91,67% меди и 8,33% никеля.
- Медицинское применение:
- Бактерии не размножаются на поверхности меди, поскольку она является биостатической. Медные дверные ручки и медные поверхности используются в больницах для уменьшения передачи болезнетворных микробов.
- Болезнь легионеров подавляется медными трубками в системах кондиционирования воздуха.
- Сульфат меди(II) используется в качестве фунгицида и средства для борьбы с водорослями в домашних озерах и прудах.
 Он используется в садовых порошках и спреях для уничтожения плесени.
Он используется в садовых порошках и спреях для уничтожения плесени.
- Разное:
- В качестве компонента керамических глазурей и для окрашивания стекла.
- Сплав цинка с образованием латуни используется в музыкальных инструментах и декоративных предметах.
- Различные бронзы, состоящие из меди, олова и других элементов (таких как алюминий, марганец или кремний), используются для изготовления колоколов, тарелок, скульптур и промышленных компонентов.
- Соединения меди (например, раствор Фелинга) находят применение в химии.
- В качестве облицовки частей судов для защиты от скопления ракушек и мидий. Первоначально он использовался в чистом виде, но позже был заменен формой латуни, называемой металлом Мунца.
- Паровой двигатель Джеймса Уатта.
- Инуиты иногда использовали медь для изготовления режущего лезвия для ножей улу.
Биологическая роль
Медь необходима всем высшим растениям и животным. Медь в основном переносится кровью с помощью белка плазмы, называемого церулоплазмином. Когда медь впервые всасывается в кишечнике, она транспортируется в печень в связанном виде с альбумином. Медь содержится в различных ферментах, включая медные центры цитохром-с-оксидазы и фермента супероксиддисмутазы (содержащего медь и цинк). В дополнение к своим ферментативным функциям медь используется для биологического переноса электронов. Белки синей меди, которые участвуют в переносе электронов, включают азурин и пластоцианин. Название «голубая медь» происходит от их интенсивного синего цвета, возникающего из-за полосы поглощения переноса заряда лиганда на металл (LMCT) около 600 нанометров.
Медь в основном переносится кровью с помощью белка плазмы, называемого церулоплазмином. Когда медь впервые всасывается в кишечнике, она транспортируется в печень в связанном виде с альбумином. Медь содержится в различных ферментах, включая медные центры цитохром-с-оксидазы и фермента супероксиддисмутазы (содержащего медь и цинк). В дополнение к своим ферментативным функциям медь используется для биологического переноса электронов. Белки синей меди, которые участвуют в переносе электронов, включают азурин и пластоцианин. Название «голубая медь» происходит от их интенсивного синего цвета, возникающего из-за полосы поглощения переноса заряда лиганда на металл (LMCT) около 600 нанометров.
Большинство моллюсков и некоторые членистоногие, такие как мечехвост, используют для транспорта кислорода медьсодержащий пигмент гемоцианин, а не железосодержащий гемоглобин, поэтому их кровь при насыщении кислородом становится синей, а не красной.
Как отмечалось выше, медь является биостатическим материалом, и медные поверхности не позволяют размножаться бактериям.
Считается, что цинк и медь конкурируют за всасывание в пищеварительном тракте, поэтому диета с избытком одного из этих минералов может привести к дефициту другого. Рекомендуемая диетическая норма (RDA) меди для здоровых взрослых составляет 0,9.миллиграмм (мг)/день.
Токсичность
Со всеми соединениями меди, если не известно иное, следует обращаться так, как если бы они были токсичными. Для человека 30 граммов сульфата меди потенциально смертельны. Предлагаемый безопасный уровень меди в питьевой воде для человека варьируется в зависимости от источника, но, как правило, составляет от 1,5 до 2 мг/л. Верхний допустимый уровень потребления диетической меди (DRI) для взрослых из диетической меди из всех источников составляет 10 мг/день. При токсичности медь может ингибировать фермент дигидрофилгидратазу, фермент, участвующий в кроветворении.
Значительная часть токсичности меди связана с ее способностью принимать и отдавать отдельные электроны при изменении степени окисления. Это катализирует образование очень реакционноспособных «свободных радикалов», таких как гидроксильный (ОН) радикал, аналогично химии фентона. Эта каталитическая активность меди используется ферментами, с которыми она связана, и поэтому токсична только в том случае, если она не изолирована и не опосредована. Увеличение количества неопосредованных реактивных радикалов обычно называют «окислительным стрессом» и является активной областью исследований при различных заболеваниях, где медь может играть важную, но более тонкую роль, чем при острой токсичности.
Это катализирует образование очень реакционноспособных «свободных радикалов», таких как гидроксильный (ОН) радикал, аналогично химии фентона. Эта каталитическая активность меди используется ферментами, с которыми она связана, и поэтому токсична только в том случае, если она не изолирована и не опосредована. Увеличение количества неопосредованных реактивных радикалов обычно называют «окислительным стрессом» и является активной областью исследований при различных заболеваниях, где медь может играть важную, но более тонкую роль, чем при острой токсичности.
Наследственное заболевание, называемое болезнью Вильсона, заставляет организм удерживать медь, поскольку она не выводится печенью с желчью. Это заболевание, если его не лечить, может привести к поражению головного мозга и печени. Кроме того, исследования показали, что люди с психическими заболеваниями, такими как шизофрения, имеют повышенный уровень меди в организме. Однако на данном этапе неизвестно, способствует ли медь психическому заболеванию, пытается ли организм накапливать больше меди в ответ на болезнь, или высокий уровень меди является результатом психического заболевания.
Избыток меди в воде наносит ущерб морским обитателям. Наблюдаемый эффект этих более высоких концентраций на рыб и других существ заключается в повреждении жабр, печени, почек и нервной системы.
Прочие опасности
В порошкообразном виде металл представляет опасность возгорания. Кроме того, при концентрациях выше 1 мг/л медь может оставлять пятна на одежде и других предметах, выстиранных в воде.
Соединения
Самородная медь
Обычные степени окисления меди включают менее стабильное состояние меди (I), Cu 1+ и более стабильное состояние меди (II) Cu 2+ . Последний образует голубые или сине-зеленые соли и растворы. В необычных условиях можно получить состояние 3+ и крайне редкое состояние 4+. Медь (I) и медь (II) также называются их общими названиями, медь и медь, соответственно.
Карбонат меди(II) зеленого цвета. Этот состав придает уникальный вид покрытым медью крышам и куполам некоторых зданий. Сульфат меди (II) образует синий кристаллический пентагидрат, одно из наиболее известных соединений меди в лаборатории. В качестве фунгицида используется бордоская смесь.
Сульфат меди (II) образует синий кристаллический пентагидрат, одно из наиболее известных соединений меди в лаборатории. В качестве фунгицида используется бордоская смесь.
Существует два стабильных оксида меди: оксид меди(II) (CuO) и оксид меди(I) (Cu 2 O). Эти оксиды используются для получения оксида иттрия-бария-меди (YBa 2 Cu 3 O 7-δ ) или YBCO, который составляет основу многих нетрадиционных сверхпроводников.
- Соединения меди (I) : хлорид меди (I), оксид меди (I).
- Соединения меди (II) : карбонат меди (II), хлорид меди (II), гидроксид меди (II), нитрат меди (II), оксид меди (II), сульфат меди (II), медь ( II) сульфид.
- Медные (III) Соединения (редко): калий гексафторуплат (K 3 CUF 6 )
- 33). CuF 6 )
Тесты на медь
2+ ионов
Добавьте водный раствор гидроксида натрия в тестируемый раствор. Если раствор содержит ионы меди 2+ , то замещением ионов меди ионами натрия будет образовываться голубой осадок гидроксида меди(II). Ионное уравнение:
Если раствор содержит ионы меди 2+ , то замещением ионов меди ионами натрия будет образовываться голубой осадок гидроксида меди(II). Ионное уравнение:
- Cu 2+ (водн.) + 2OH − (водн.) → Cu(OH) 2 (тв.)
Альтернативно, добавьте к тестируемому водному раствору аммиака. Если раствор содержит ионы меди 2+ , выпадет осадок, но он растворится при добавлении избытка аммиака, образуя темно-синий аммиачный комплекс, тетрааминомедь(II). Ионное уравнение:
- Cu 2+ (водн.) + 4NH 3 (водн.) → Cu(NH 3 ) 4 2+ (водный)
Примечания
- ↑ Коалиция по образованию в области минералов меди. Проверено 20 июня 2013 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- «Металлы, токсичность и окислительный стресс».
 Current Medicinal Chemistry 12(10) (май 2005 г.): 1161-1208.
Current Medicinal Chemistry 12(10) (май 2005 г.): 1161-1208. - Управление оценки технологий. Глава 6: «Технология производства меди». В Медь: технология и конкурентоспособность (резюме). 2005.
- «Роль химии Фентона в индуцированной тиолами токсичности и апоптозе». Рез. 145(5) (май 1996 г.): 542-53.
Авторы
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на энциклопедии Нового Света 91 573 участника и самоотверженные добровольные участники Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования.
