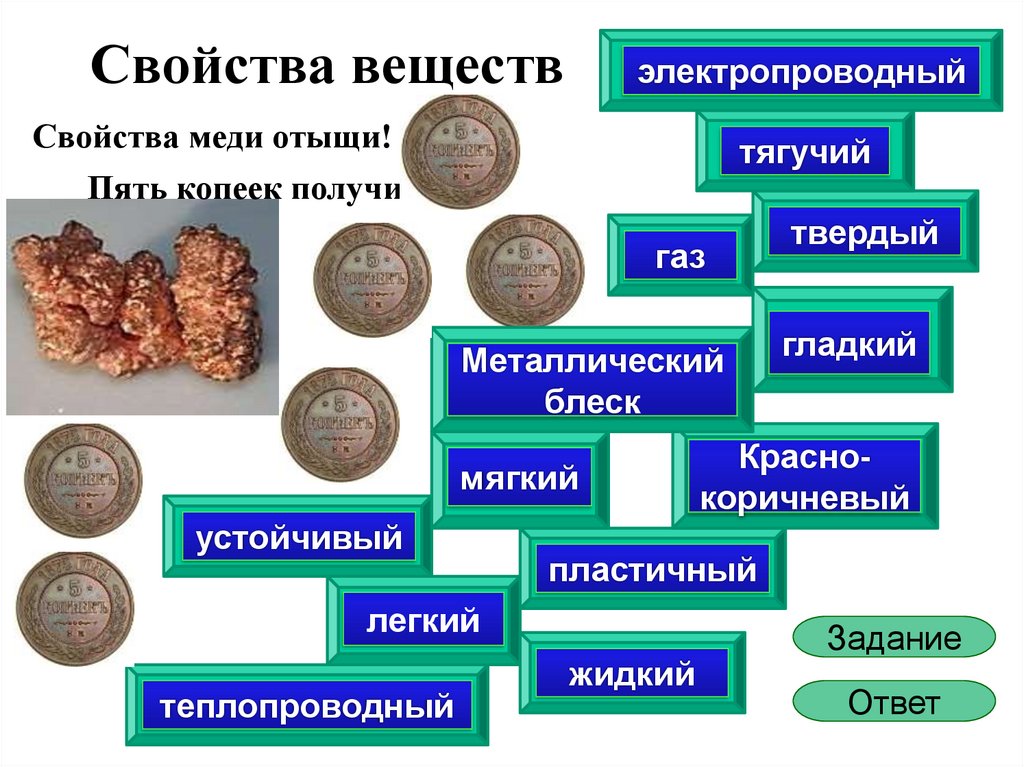
Физико химические свойства меди: Медь – свойства, применение, характеристики медных сплавов
Содержание
Медь — химические свойства » HimEge.ru
Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе
Периодической системы химических элементов Д.И. Менделеева
. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны
3
d
9
4
s
2
,
однако вследствие устойчивости
d
10
-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию:
3
d
10
4
s
1
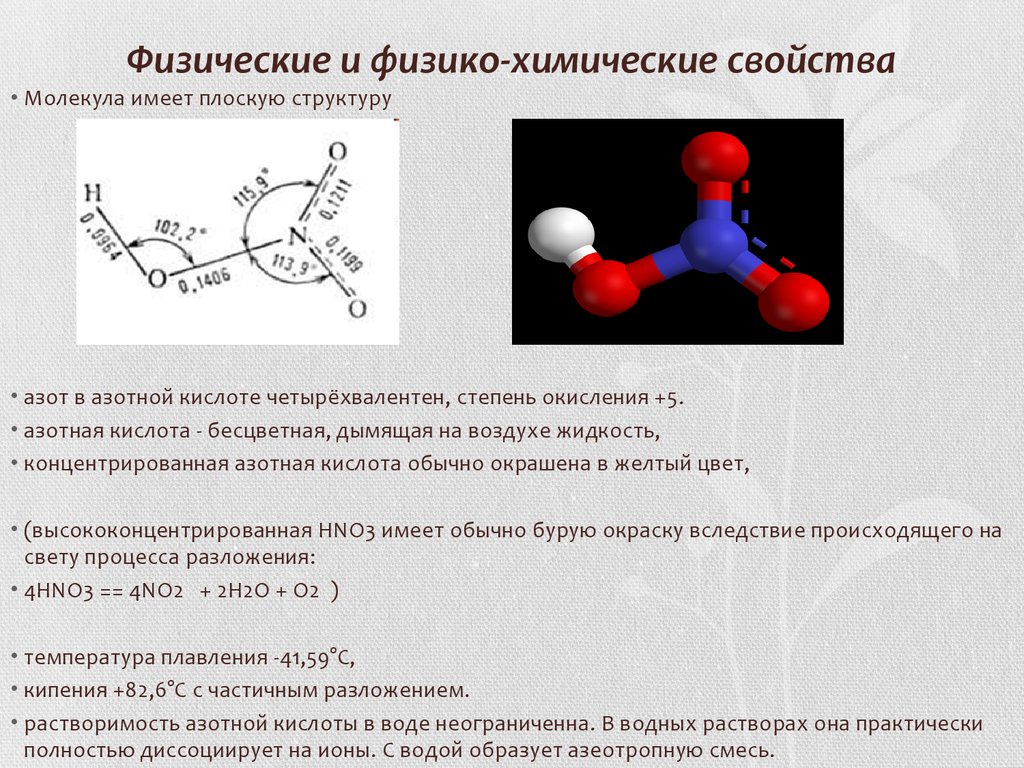
. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
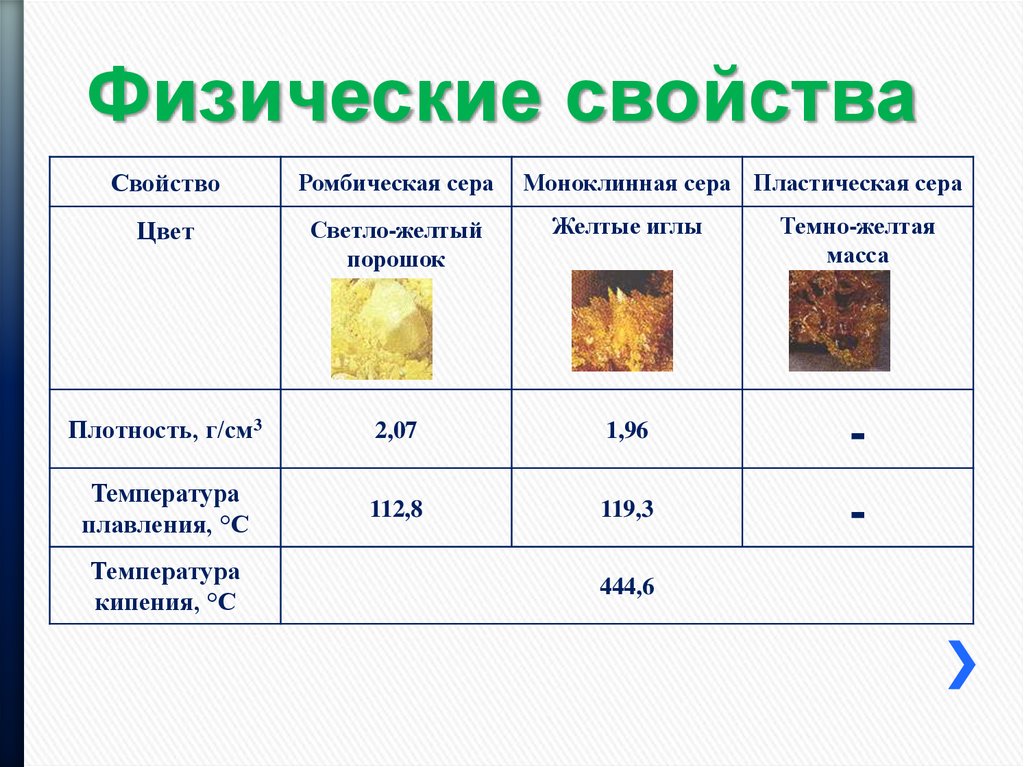
Физические свойства меди
Медь
– пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см
3
.
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O
2
= 2CuO (черный цвет)
При температуре около 150
о
С металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O
2
= 2Cu
2
O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br
2
= CuBr
2
;
с йодом – образуется йодид меди (I):
2Cu + I
2
= 2CuI.
Cu + S = CuS
4Cu + SO
2
= Cu
2
S + 2CuO
4Cu + 2NO
2
= 4CuO + N
2
Взаимодействие с кислотами
В
электрохимическом ряду напряжений
металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO
3
= 3Cu(NO
3
)
2
+ 2NO + 4H
2
O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H
2
SO
4
= CuSO
4
+ SO
2
+ 2H
2
O;
Cu + 4HNO
3
= Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O.
С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода:
Cu + 3HCl = H[CuCl
3
] + H
2
Медь.
 Химия меди и ее соединений
Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
- Способы получения
- Химические свойства
Оксид меди (I)
- Химические свойства
Гидроксид меди (II)
- Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s 2p
3s 3p 4s 3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4.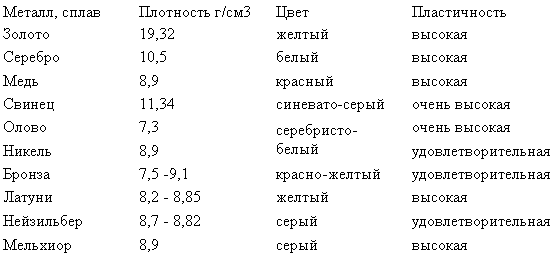 Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Видеоопыт взаимодействия сульфата меди (II) с железом можно посмотреть здесь.
- Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций.
 Основные стадии процесса:
Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Но, обратите внимание:
2Cu + I2 = 2CuI
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2. 2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц. ) = Cu(NO3)2 + 2NO2 + 2H2O
) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2 → CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя:
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
А под действием окислителей, например, кислорода — свойства восстановителя:
2Cu2O + O2 = 4CuO
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц.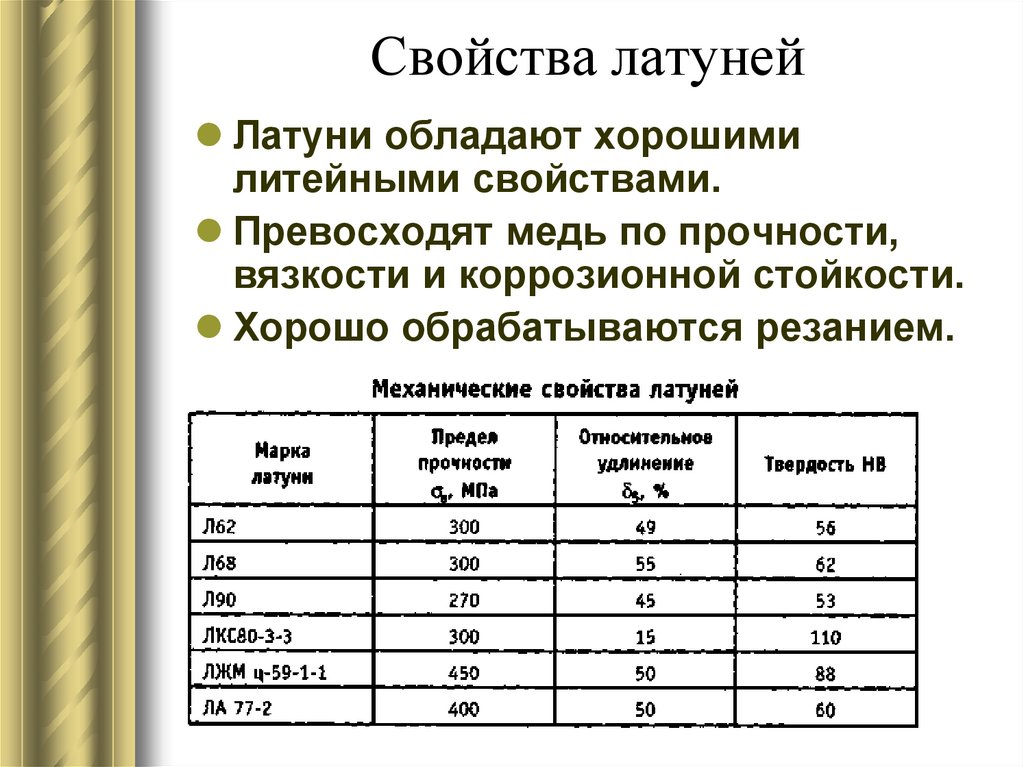 гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
1.
CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2.
CuCl2 = Cu + Сl2
на катоде на аноде
Cu + S = CuS
CuS + 8HNO3(конц. гор.) = CuSO4 + 8NO2↑ + 4H2O
гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3.
NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2NaNO3 = 2NaNO2 + O2↑
4.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
Cu(OH)2 = CuO + H2O
CuO + C Cu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 = 2CuO + CO2 + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10.
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 = 3Cu + N2 + 3H2O
11.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + H2 = Cu + H2O
12.
Cu + Cl2 = CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
13.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
CuO + H2 = Cu + H2O
14.
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15.
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16.
2Cu + I2 = 2CuI
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
17.
2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб. ) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20.
Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
21.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
22.
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
23.
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24.
CuO + CO = Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
.
25.
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц. ) = Cu(NO3)2 + 2NO2↑ + 2H2O
) = Cu(NO3)2 + 2NO2↑ + 2H2O
26.
H2C2O4 = CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
CuO + CO = Cu + CO2
27.
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Понравилось это:
Нравится Загрузка…
Медь
|
| |
|---|---|
|
Атомный номер |
|
|
Внешний вид простого вещества |
пластичный металл золотисто-розового цвета |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
|
|
Радиус атома |
|
|
Энергия ионизации (первый электрон) |
|
|
Электронная конфигурация |
|
|
Химические свойства | |
|
Ковалентный радиус |
|
|
Радиус иона |
|
|
Электроотрицательность (по Полингу) |
|
|
Электродный потенциал |
|
|
Степени окисления |
|
|
Термодинамические свойства простого вещества | |
|
Плотность |
|
|
Молярная теплоёмкость |
|
|
Теплопроводность |
|
|
Температура плавления |
|
|
Теплота плавления |
|
|
Температура кипения |
|
|
Теплота испарения |
|
|
Молярный объём |
|
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
|
|
Параметры решётки |
|
|
Отношение c/a |
— |
|
Температура Дебая |
|
|
Cu |
29 |
|
63,546 | |
|
3d104s1 | |
|
Медь | |
Медь —элемент побочной подгруппы первой группы, четвертого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной пленки). C давних пор широко применяется человеком. История и происхождение названия
И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной пленки). C давних пор широко применяется человеком. История и происхождение названия
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век). Латинское название элемента происходит от названия острова Кипр (лат. Cuprum), на котором добывали медь.
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
На воздухе покрывается оксидной плёнкой.
Соединения
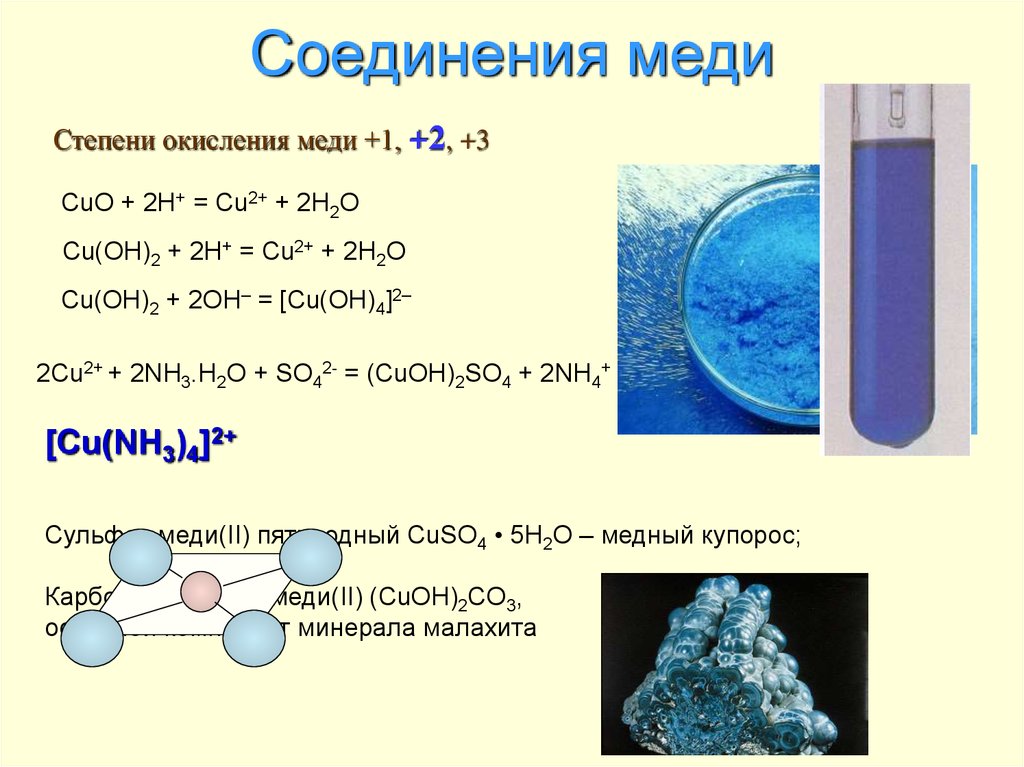
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди.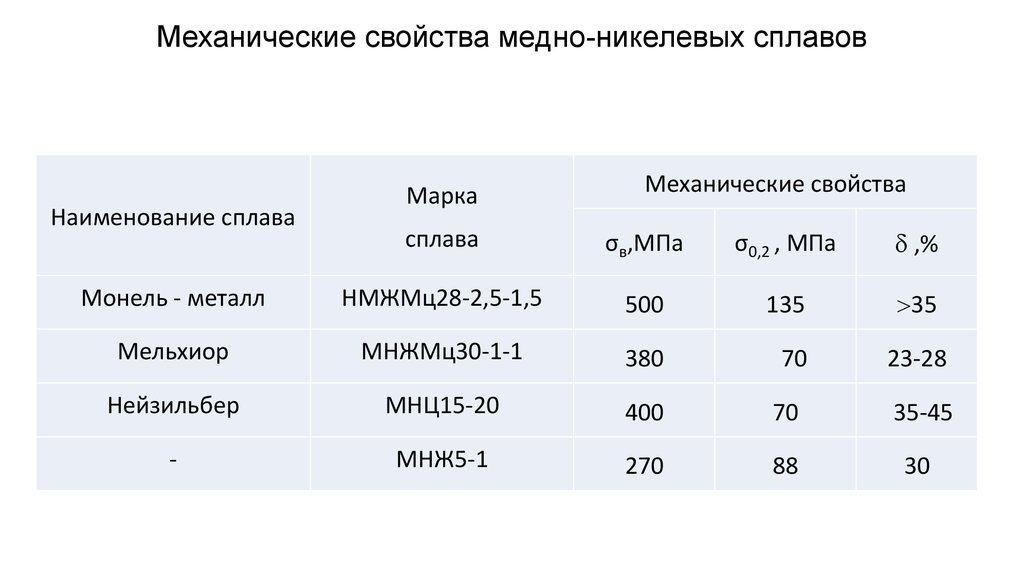 Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн. ) → Cu2+(водн.) + Cu(тв.)
) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн.) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
-
Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода. -
В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически. -
Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4].
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортера CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азыATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[5]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей. [источник не указан 226 дней]
[источник не указан 226 дней]
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[6] (агентство подчеркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т.. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
|
Компания |
тыс. тонн |
% |
|---|---|---|
|
Норильский никель |
425 |
45 % |
|
Уралэлектромедь |
351 |
37 % |
|
Русская медная компания |
166 |
18 % |
Мировое производство меди в 2007 году составляло15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были: Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), США (1,170/1,310), Перу (1,190/1,220), Китай (0,946/1,000), Австралия (0,870/0,850), Россия (0,740/0,750), Индонезия (0,797/0,650), Канада (0,589/0,590), Замбия (0,520/0,560), Казахстан (0,407/0,460), Польша (0,452/0,430), Мексика (0,347/0,270).
Лидерами производства были: Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), США (1,170/1,310), Перу (1,190/1,220), Китай (0,946/1,000), Австралия (0,870/0,850), Россия (0,740/0,750), Индонезия (0,797/0,650), Канада (0,589/0,590), Замбия (0,520/0,560), Казахстан (0,407/0,460), Польша (0,452/0,430), Мексика (0,347/0,270).
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причем, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Однажды нашли самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
-
2CO + (CuOH)2CO2 (t°) → 3CO2 + 2Cu + H2O.
Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Физические и химические свойства меди
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Выполнил:
Содержание
О меди
Физические и химические свойства меди
Медь и здоровье
Применение меди
История меди
Народная медицина
Медь – первый металл, который
впервые стал использовать человек
в древности за несколько
тысячелетий до нашей эры. Первые
медные орудия изготовлялись из
самородной меди, которая
встречается довольно часто. Самый
крупный самородок меди был
найден на территории США, он имел
массу 420 т.
Но в виду того, что медь – мягкий
металл, медь в древности не смогла
вытеснить каменные орудия труда.
Лишь когда человек научился
плавить медь и изобрел бронзу
(сплав меди с оловом), металл
заменил камень. Широкое
использование меди началось в IV
тысячелетии до н.э.
Медь — тяжелый розово-красный металл, мягкий и
ковкий, ее температура плавления 1083° С,
является отличным проводником электрического
тока и теплоты электрическая проводимость меди в
1,7 раза выше, чем алюминия, и в 6 раз выше
железа.
В повседневной жизни все время приходится иметь
дело с медью и ее сплавами: включаем компьютер
или настольную лампу — ток идет по медным
проводам, пользуемся металлическими деньгами,
которые, как желтые, так и белые, изготовлены из
сплавов меди. Некоторые дома украшают изделия
из бронзы, из меди изготавливается посуда. Тем
временем медь- далеко не самый
распространенный в природе элемент: содержание
меди в земной коре составляет 0,01%, что
позволяет ей занимать лишь 23-е место среди всех
элементов.
Медь – первый металл, который
впервые стал использовать человек
в древности за несколько
тысячелетий до нашей эры. Первые
Первые
медные орудия изготовлялись из
самородной меди, которая
встречается довольно часто. Самый
крупный самородок меди был
найден на территории США, он имел
массу 420 т.
Медь — малоактивный металл, в
Но в виду того, что медь – мягкий
электрохимическом ряду
металл, медь в древности не смогла
напряжений она стоит правее
вытеснить каменные орудия труда. водорода. Она не взаимодействует с
Лишь когда человек научился
водой, растворами щелочей,
плавить медь и изобрел бронзу
соляной и разбавленной серной
(сплав меди с оловом), металл
кислотой. Однако в кислотах —
заменил камень. Широкое
сильных окислителях (например,
использование меди началось в IV
азотной и концентрированной
тысячелетии до н. э.
серной) — медь растворяется:
Сu + 4НМО3 — Сu(NO3)2 + 2NO+
2Н2О концентрированная
Медь обладает достаточно высокой
стойкостью к коррозии. Однако во
влажной атмосфере, содержащей
углекислый газ медь покрывается
зеленоватым налетом основного
карбоната меди:
2Сu + O2 + СO2 + Н2O = СU(ОН)2
СuСО3
В соединениях медь может проявлять
степени окисления +1,
+•2 и +3, из которых +2 — наиболее
характерная и устойчивая.
Медь (II) образует устойчивые оксид
СuО и гидроксид Си(ОН)2.
Этот гидроксид амфотерен, хорошо
растворяется в кислотах
Сu(ОН)2 + 2НСl = СuСl2 + 2Н2О и в
концентрированных щелочах. Соли
меди (II) нашли широкое применение в
народном хозяйстве. Особенно важным
является медный купорос —
кристаллогидрат сульфата меди (II)
СuSО4 • 5Н2.
Медь и здоровье
Организму человека медь необходима для образования
различных протеинов и ферментов. Медь нужна:
Для синтеза гемоглобина
Для образования костей
Для функционирования системы кровообращения
Для функционирования центральной нервной системы
Для получения энергии из клеток
Последние исследования показали, что весьма близко к
истине предположение о том, что питание с недостаточным
содержанием меди повышает риск сердечно-сосудистых
заболеваний. Дефицит меди в организме может привести к
таким тяжелым последствиям как порок развития костей,
малокровие и мозговая недостаточность. Дельнейшими
Дельнейшими
последствиями являются:
Блокировка клеточного дыхания
Остановка образования мочевой кислоты
Неправильное образование нейромедиаторов
Остановка образования пигментов (белые волосы)
Человек вместе с пищей должен получать
определенное количество меди для достаточного
насыщения организма этим элементом. Ежедневная
потребность взрослого человека в меди составляет 2-3
мг. Многие продукты и напитки содержат этот важный
элемент в различном количестве. Одного потребления
питьевой воды с ионами меди недостаточно. К
продуктам с высоким содержанием меди относятся:
Шоколад
Белая и зеленая фасоль
Рыба
Лесные и южные орехи
А ниже перечисленные продукты наоборот содержат
медь лишь в малом количестве:
Сыр
Молоко
Белый хлеб
Говядина и баранина
В данной таблице приведен список продуктов и
содержание в них меди
Выделяется технический металл, содержащий 97 — 98% меди. Одна из
важнейших отраслей применения меди — электротехническая
промышленность. Из меди изготовляют электрические провода. Для этой
Из меди изготовляют электрические провода. Для этой
цели металл должен быть очень чистый: примеси резко снижают
электрическую проводимость. Присутствие в меди 0,02% алюминия снизит
ее электрическую проводимость почти на 10%. Еще более резко
возрастает сопротивление металла в присутствии неметаллических
примесей. Для получения чистой меди, которую можно использовать в
электротехнике, проводят ее электрорафинирование. Этот метод основан
На проведении электролиза водного раствора соли меди с растворимым
медным анодом. Техническую или черновую медь, кото-служит одним из
электродов, погружают в ванну, заполненную водным раствором сульфата
меди. В ванну погружают еще один электрод. К электродам подключают
источник постоянного тока таким образом чтобы техническая медь стала
анодом (положительный полюс источника тока), а другой электрод —
катодом.
Очень важная область применения
меди — производство медных сплавов.
Со многими металлами медь образует
так называемые твердые растворы,
которые похожи на обычные растворы
тем, что в них атомы одного компонента
(металла) равномерно распределены
среди атомов другого (рис. 34).
34).
Большинство сплавов меди — это
твердые растворы.
Сплав меди, известный с древнейших
времен, — бронза — содержит 4—30%
олова (обычно 8—10%). Интересно, что
бронза по своей твердости превосходит
отдельно взятые чистые медь и олово.
Бронза более легкоплавка по
сравнению с медью. До наших дней
сохранились изделия из бронзы
мастеров Древнего Египта, Греции,
Китая. Из бронзы отливали в средние
века орудия и многие другие изделия.
Знаменитые Царь-пушка (рис. 35) и
Царь-колокол в Московском Кремле
также отлиты из сплава меди с оловом.
Народная
медицина
Лечебные свойства меди известны очень давно. Древние считали, что
лечебный эффект меди связан с её обезболивающем жаропонижающим
антибактериальным и противовоспалительным свойствами. Ещё
Авиценна и Гален описывали медь, как лекарственное средство, а
Аристотель, указывая на общеукрепляющее действие меди на организм,
предпочитал засыпать с медным шариком в руке.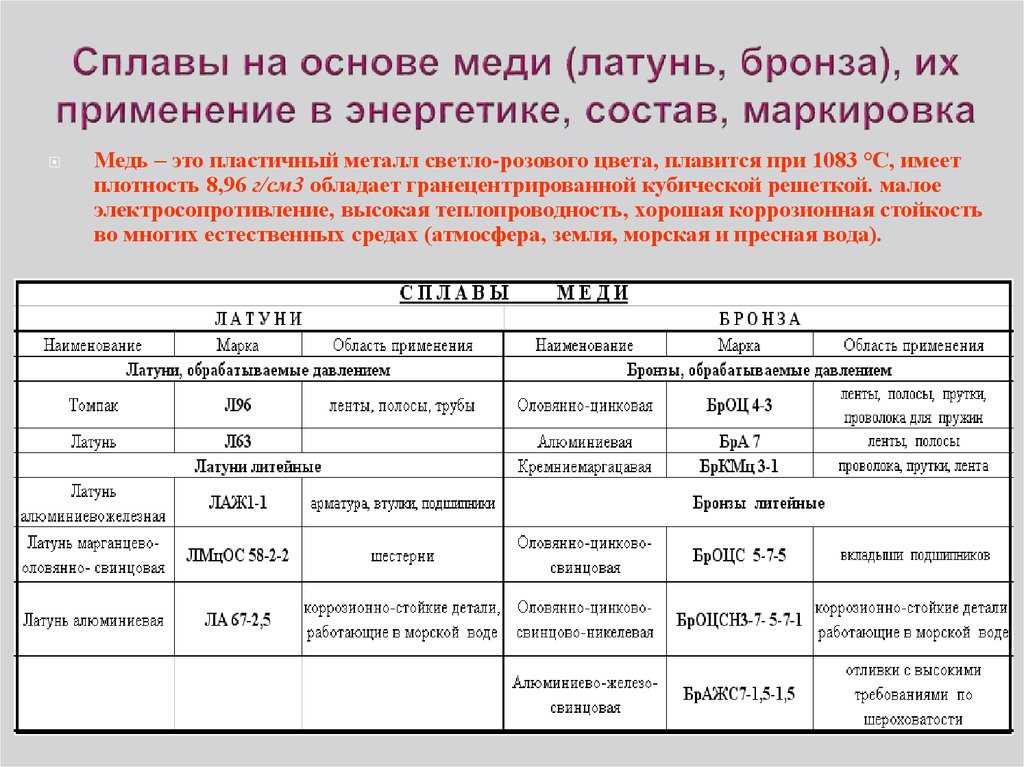 Царица Клеопатра
Царица Клеопатра
носила тончайшие медные браслеты, предпочитая их золотым и
серебряным, хорошо зная медицину и алхимию. В медных доспехах
античные воины меньше уставали, а их раны меньше гноились и быстрее
заживали. Была подмечена и широко использовалась в Древнем мире
способность меди положительно влиять на «мужскую силу».
В наши дни применение медных изделий широко
распространено. В Средней Азии носят медные изделия и
практически не болеют ревматизмом. В Египте и Сирии медные
изделия носят даже дети. Во Франции с помощью меди лечат
расстройства слуха. В США медные браслеты носят как средства
от артрита. В китайской медицине используются аппликации
медных дисков на активные точки. А в Непале медь считают
священным металлом.
Медетерапия (лечение медью) – один из видов народной
медицины. В детстве прикладывая по совету бабушки медный
пятак на шишку, мы уменьшали боль и воспаление, хотя в 5-ти
копеечной монете, выпущенной в советское время, содержание
меди было невелико. В медетерапии используются изделия с
В медетерапии используются изделия с
содержанием меди не менее 99,9%. Самым простым,
эффективным, эстетически красивым и практичным средством в
медетерапии является медный браслет, разрешенный и
рекомендуемый МинЗдравом РФ
English
Русский
Правила
Медь
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн.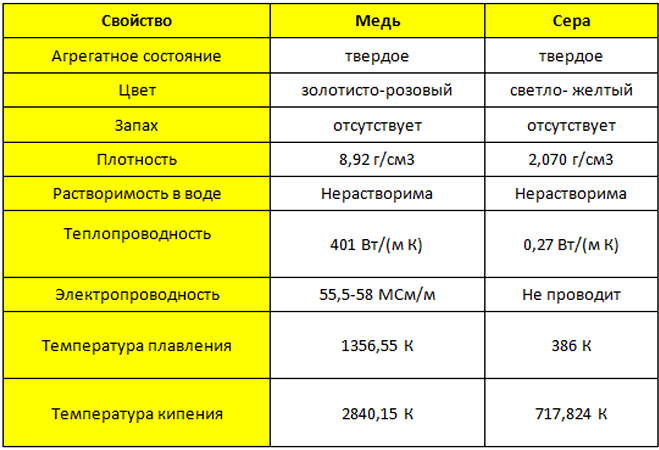 Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков производят русское слово медь (польск. miedz, чешск. med) от древненемецкого smida (металл) и Schmied (кузнец, англ. Smith). Конечно, родство корней в данном случае несомненно, однако, оба эти слова произведены от греч. рудник, копь независимо друг от друга. От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь венера (Venus). В более древние времена встречается название марс (Mars).
В более древние времена встречается название марс (Mars).
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра).
Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Источник: Википедия
Другие заметки по химии
Характеристика меди — химические и физические свойства
Свойства меди, металла, который встречается и в виде довольно больших самородков, люди изучали еще в древности. Тогда из меди и его сплавов создавали предметы посуды, оружие, украшения, разные предметы бытового назначения. Столь высокая популярность этого металла на протяжении столетий была обусловлена не только его особыми качествами, но и легкостью обработки. Медь, присутствующую в руде в форме карбонатов и окислов, довольно легко восстановить, что и научились делать наши предки в древности. В этой статье поговорим о свойствах меди и методах ее определения.
Физические свойства меди
Чистая медь – это металл, цвет которого варьируется от розового до красного оттенка. Радиус положительно заряженных ионов меди, может принимать такие значения:
Радиус положительно заряженных ионов меди, может принимать такие значения:
- при координационном показателе равном 6-ти — до 0,091 нм
- при координационном показателе равном 2 — до 0,06 нм.
Радиус атома меди равняется 0,128 нм. Величина сродства к электрону достигает 1,8 эВ. Процесс ионизации данного атома увеличивает сродство к электрону от 7,726 до 82,7 эВ.
Медь является переходным металлом. Величина показателя его электроотрицательности достигает 1,9 единиц по шкале Полинга. Стоит отметить, что степень окисления способна принимать разные значения. В условиях температуры в пределах от 20 до 100 градусов, показатель теплопроводности равен 394 Вт/м*К. показатель электропроводности меди, уступает по которому она только серебру, колеблется в пределах 55,5–58 МСм/м.
Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм. Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Кроме вышеперечисленных, стоит выделить еще и такие физические и механические свойства меди:
- показатель термического линейного расширения составляет 0,00000017 единиц
- показатель предела прочности на растяжение достигает 22 кгс/мм2
- уровень твердости меди по шкале Бринелля равен 35 кгс/мм2
- удельная масса составляет 8,94 г/см3
- показатель упругости равен 132000 Мн/м2
- относительное удлинение равняется 60%.
Абсолютно неповторимыми можно назвать магнитные свойства этого металла, который является полностью диамагнитным. Именно благодаря этим показателям, вместе с физическими свойствами, к примеру, удельным весом и удельной проводимостью, можно объяснить такую широкую популярность этого металла в производстве изделий электротехнической отрасли. Несколько похожие свойства имеет алюминий, который тоже активно применяется в изготовлении различной электротехнической продукции, к примеру, проводов, кабелей и прочего.
Несколько похожие свойства имеет алюминий, который тоже активно применяется в изготовлении различной электротехнической продукции, к примеру, проводов, кабелей и прочего.
Единственная характеристика меди, которую можно изменить — это предел прочности. Этот показатель может быть улучшен почти в два раза (до 420–450 МН/м2), путем специальной технологической операции, называемой наклеп.
Химические свойства меди
Химическая характеристика меди определяется ее расположением в периодической таблице элементов Менделеева, где ей присвоен порядковый номер 29. Находится она в четвертом периоде и в одной группе с благородными металлами. Таким образом, лишний раз подтверждается уникальность ее химических качеств, о которых дальше мы расскажем более детально.
Если уровень влажный не высокий, то медь почти не проявляет химической активности. Однако, все кардинально меняется, когда изделия помещают в условия высокой влажности и повышенного содержания углекислого газа. Именно такие условия являются идеальными для начала активного окисления меди. В процессе окисления на поверхности медного предмета создается зеленоватая пленка, которая состоит из CuCO3, Cu(OH)2, а также разных сернистых соединений. Эту пленку называют патиной и она очень важна, поскольку защищает металл от дальнейшего разрушения.
В процессе окисления на поверхности медного предмета создается зеленоватая пленка, которая состоит из CuCO3, Cu(OH)2, а также разных сернистых соединений. Эту пленку называют патиной и она очень важна, поскольку защищает металл от дальнейшего разрушения.
Кроме влажности, процесс окисления запускает и нагревание. В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Медь довольно легко вступает в реакции с элементами, находящимися в группе галогенов. Под действием паров серы металл воспламеняется. Высокий уровень родства медь демонстрирует и к селену. Общие свойства меди не позволяют ей вступить в реакцию с азотом, углеродом и водородом даже при нагревании.
Взаимодействие с кислотами:
- результатом реакции с серной кислотой является сульфат и чистая медь
- с бромоводородной и иодоводородной кислотой соответственно образуются бромид и иодид меди.

А вот взаимодействие со щелочами позволяет получить купрат. Реакции получения меди, при которых происходит восстановление металла до свободного состояния, невозможны без присутствия оксида углерода, аммиака, метана и некоторых других веществ.
Основные свойства меди позволяют ей вступать во взаимодействие с раствором солей железа. Результатом такой реакции является восстановление железа. Эту реакцию применяют для снятия ранее напыленного медного слоя с разных изделий.
Свойства солей меди
Одно- и двухвалентная медь может формировать комплексные соединения, которые выделяются высоким уровнем устойчивости. К подобным соединениям можно отнести двойные соли меди и аммиачные смеси. Они активно используются в различных отраслях промышленности.
Сульфат меди (II) — CuSO4 в безводном состоянии является белым порошком. При добавлении воды он приобретает синюю окраску. Поэтому его используют для выявления остатков воды в органических жидкостях. Водный раствор сульфата меди отличается сине-голубым оттенком.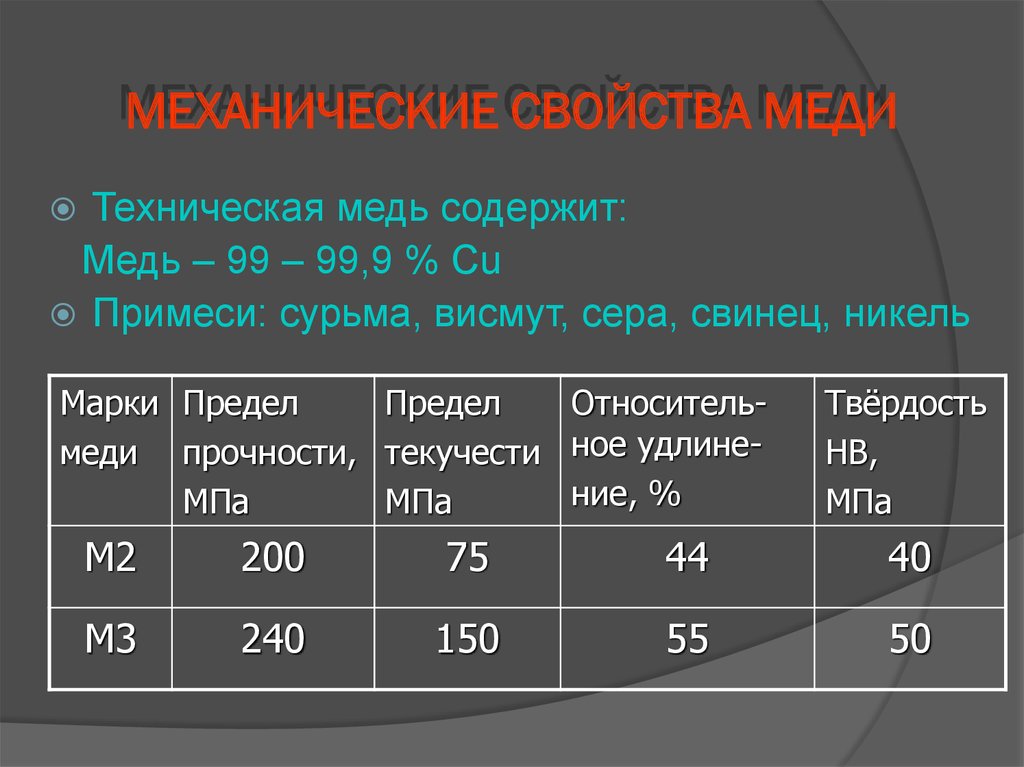 За этот цвет отвечают гидратированные ионы [Cu(h3O)4]2+, следовательно, такого же цвета и все остальные разбавленные растворы солей меди (II). Исключением являются растворы с содержанием окрашенных анионов.
За этот цвет отвечают гидратированные ионы [Cu(h3O)4]2+, следовательно, такого же цвета и все остальные разбавленные растворы солей меди (II). Исключением являются растворы с содержанием окрашенных анионов.
Из водного раствора сульфат меди кристаллизуется с пятью молекулами воды, путем формирования прозрачных синих кристаллов медного купороса. Полученное соединение используется:
- в процессе электролитического нанесения меди на металлы
- для создания минеральных красок
- как исходный материал для получения прочих соединений меди.
В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.
Хлорид меди (II) — CuCl2. 2h3O. Это легко растворимое в воде соединение темно-зеленого цвета. Высокая концентрация хлорида меди позволяет получить растворы зеленого цвета, а разбавление приводит к окраске в сине-голубой оттенок.
Нитрат меди (II) — Cu(NO3)2.3h3O. Его получают путем растворения меди в азотной кислоте. В процессе нагревания синие кристаллы нитрата меди сначала отдают воду, после чего с легкостью разлагаются, выделяя кислород и бурый диоксид азота, становясь оксидом меди (II).
Гидроксокарбонат меди (II) — (CuOH)2CO3. Данное вещество можно встретить в природе в виде минерала малахита, который отличается красивым изумрудно-зеленым цветом. В лабораторных условиях его можно создать при помощи действия Na2CO3 на растворы солей меди (II).
2CuSO4 + 2Na2CO3 + h3O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑
Кроме этого, его используют, чтобы получить хлорид меди (II), а также приготовить синие и зеленые минеральные краски.
Ацетат меди (II) — Cu (Ch4COO)2.h3O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты. Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Помните, что все без исключения соли меди являются ядовитыми. По этой причине, во избежание формирования медных солей, вся медная посуда должна быть изнутри покрыта слоем олова.
По этой причине, во избежание формирования медных солей, вся медная посуда должна быть изнутри покрыта слоем олова.
Методы определения меди
Определение меди может проводиться такими методами:
- химическими
- количественными
- фотометрическими.
Различные химические составы способны оказывать влияние на расщепление молекул и атомов вещества, следовательно, можно выделить его составные части. Химический метод определения количества заключается в электролитическом методе измерения медной части в сплавах других металлов. Его осуществляют при помощи таких элементов:
- ацетилен
- винная кислота
- водный аммиак
- азотнокислый аммоний
- динатриевая соль
- этиловый спирт
- купризон.
Прежде всего, происходит взвешивание медного состава (навески). После этого ее отправляют в подготовленный раствор реактивов. В этом растворе навеска должна полностью раствориться. Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины. Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.
Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины. Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.
Контрольным испытанием является повторный процесс электролиза. Необходимо электроды погрузить в раствор, ниже уровня выделенной меди и подключить ток. При правильном проведении первой реакции, во время контрольной процедуры вы не увидите налета металла. Полученный таким образом медный катод нужно промыть водой, не отключая электроток, а потом обработать этиловым спиртом и высушить. После этого катод необходимо взвесить, и сопоставить массу с первоначальным весом. Итак, вы получите удельный вес меди в соединении.
Разработано большое количество видов химических растворов для очистки медных изделий.
Количественное определение массы меди в общем объеме металла целесообразно использовать для сплавов с никелем, бронзой или цинком. При воздействии на вещество происходит осаждение меди и в таком виде ее можно измерить. Осаждение может быть осуществлено неорганическими и органическими элементами. Из неорганических веществ можно выделить:
При воздействии на вещество происходит осаждение меди и в таком виде ее можно измерить. Осаждение может быть осуществлено неорганическими и органическими элементами. Из неорганических веществ можно выделить:
- тетрароданодиаминхромиат аммония, называемый солью Рейнеке
- тиокарбонат калия способен осадить медь при температуре выше 80 оС
- уксусной кислотой можно осадить медный оксалат.
Из органических веществ применяются:
- оксихинолин-8, который способен осадить медь в комплексе с аммиачным и щелочным раствором. Нагревание осадка приводит к образованию оксида меди
- α-бензоиноксим при участии спирта может осадить металл в форме хлопьев. Реакция невозможна, если в составе есть никель
- йодид калия применяют в нейтральной и кислой среде. Нет смысла использовать его, когда в сплаве имеется железо, сурьма и мышьяк.
Достоинства фотометрического метода заключаются в высоком показателе точности измерения количества меди, а также простота применения. Для реализации этого метода потребуются такие соединения:
Для реализации этого метода потребуются такие соединения:
- купризон
- диэтилдитиокарбамат свинца.
Смысл фотометрического метода определения меди состоит в фиксации интенсивности цвета материала, прошедшего через концентрированный раствор. Раствор состоит из:
- аммиака
- лимоннокислого раствора аммония
- диэтилдитиокарбамата свинца
- сернокислого натрия.
Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Определение меди возможно также и в сточных, канализационных, речных, морских водах, и в составе почве. Существует три способа:
- атомноабсорбционный прямой
- атомноабсорбционный при участии хелатообразования
- атомноабсорбционный, подразумевающий использование графитовой печи.
Чтобы определить количество меди в почве самым надежным методом является метод с использованием графитной печи.
Для этого пробу почвы нужно поместить в графитовую трубу, обезводить при помощи сжигания и распылить. Процедура распыления сопряжена с разделением вещества на атомы, с последующей фильтрацией и выделением из них нужного металла. Чтобы оценить пробу грунта можно воспользоваться любым фотометрическим методом определения меди.
меди | Использование, свойства и факты
медь
Посмотреть все СМИ
- Ключевые люди:
- Джеймс Дуглас
Маркус Дейли
Уильям Э. Додж
Сэр Честер Битти
Йохан Готлиб Ган
- Похожие темы:
- обработка меди
солнечная батарея CIGS
нейзильбер
медная работа
медно-порфировое месторождение
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
Следуйте за медью из сырой породы в карьерах для плавки, преобразования и рафинирования в анодные пластины
Просмотреть все видео для этой статьи
медь (Cu) , химический элемент, красноватый, чрезвычайно пластичный металл группы 11 ( Ib) таблицы Менделеева, который является необычно хорошим проводником электричества и тепла. Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
| atomic number | 29 |
|---|---|
| atomic weight | 63.546 |
| melting point | 1,083 °C (1,981 °F) |
| boiling point | 2,567 ° C (4653 °F) |
| плотность | 8. 96 at 20 °C (68 °F) 96 at 20 °C (68 °F) |
| valence | 1, 2 |
| electron configuration | 2-8-18-1 or (Ar)3 d 10 4 s 1 |
Самородная медь встречается во многих местах как первичный минерал в базальтовых лавах, а также в виде восстановленных соединений меди, таких как сульфиды, арсениды, хлориды и карбонаты. (О минералогических свойствах меди см. таблица самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькозин, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе водорослей, во многих морских кораллах, в печени человека, во многих моллюсках и членистоногих. Медь играет такую же роль транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина. Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
Медь в промышленных масштабах производится в основном путем плавки или выщелачивания, обычно с последующим электроосаждением из сульфатных растворов. Подробное описание производства меди см. в разделе обработка меди. Большая часть производимой в мире меди используется электротехнической промышленностью; большая часть остатка соединяется с другими металлами, образуя сплавы. (Это также технологически важно в качестве гальванического покрытия.) Важными сериями сплавов, в которых медь является основным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и мельхиоры (медь, цинк и никель, нет). Серебряный). Есть много полезных сплавов меди и никеля, в том числе монель; два металла полностью смешиваются. Медь также образует важную серию сплавов с алюминием, называемых алюминиевыми бронзами.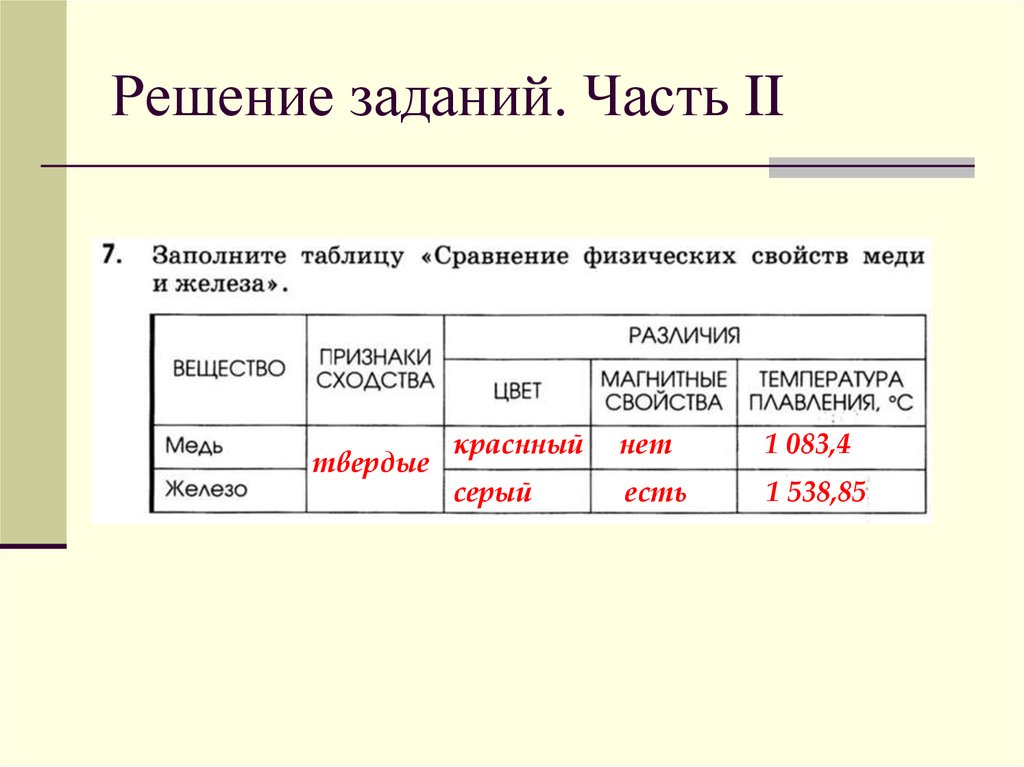 Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако к 60-м годам более дешевый и доступный алюминий отодвинулся на второе место в мировом производстве.
Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако к 60-м годам более дешевый и доступный алюминий отодвинулся на второе место в мировом производстве.
| страна | добыча на руднике в 2016 г. (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. (метрические тонны)* | % мировых доказанных запасов |
|---|---|---|---|---|
| *Оцененный. | ||||
** Из-за округления данные не складываются в общую сумму. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Чили | 5 500 000 | 28,4 | 210 000 000 | 29,2 |
| Перу | 2 300 000 | 11,9 | 81 000 000 | 11.3 |
| Китай | 1 740 000 | 9,0 | 28 000 000 | 3,9 |
| Соединенные Штаты | 1 410 000 | 7.3 | 35 000 000 | 4. 9 9 |
| Австралия | 970 000 | 5,0 | 89 000 000 | 12,4 |
| Конго (Киншаса) | 910 000 | 4.7 | 20 000 000 | 2,8 |
| Замбия | 740 000 | 3,8 | 20 000 000 | 7.4 |
| Канада | 720 000 | 3,7 | 11 000 000 | 1,5 |
| Россия | 710 000 | 3,7 | 30 000 000 | 4. 2 2 |
| Мексика | 620 000 | 3.2 | 46 000 000 | 6.4 |
| другие страны | 3 800 000 | 19,6 | 150 000 000 | 20,8 |
| мировой итог | 19 400 000** | 100** | 720 000 000 | 100** |
Медь — один из самых пластичных металлов, не особо прочный и твердый. Прочность и твердость заметно увеличиваются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Поскольку медь находится ниже водорода в электродвижущем ряду, она не растворяется в кислотах с выделением водорода, хотя будет реагировать с окисляющими кислотами, такими как азотная и горячая концентрированная серная кислота. Медь противостоит действию атмосферы и морской воды. Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений. Медь является умеренно благородным металлом, не подверженным влиянию неокисляющих или не образующих комплексов разбавленных кислот в отсутствие воздуха. Однако он легко растворяется в азотной и серной кислотах в присутствии кислорода. Он также растворим в водном аммиаке или цианиде калия в присутствии кислорода из-за образования при растворении очень стабильных цианокомплексов. Металл будет реагировать при красном калении с кислородом с образованием оксида меди CuO, а при более высоких температурах — оксида меди Cu9.0293 2 O. It reacts on heating with sulfur to give cuprous sulfide, Cu 2 S.
Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений. Медь является умеренно благородным металлом, не подверженным влиянию неокисляющих или не образующих комплексов разбавленных кислот в отсутствие воздуха. Однако он легко растворяется в азотной и серной кислотах в присутствии кислорода. Он также растворим в водном аммиаке или цианиде калия в присутствии кислорода из-за образования при растворении очень стабильных цианокомплексов. Металл будет реагировать при красном калении с кислородом с образованием оксида меди CuO, а при более высоких температурах — оксида меди Cu9.0293 2 O. It reacts on heating with sulfur to give cuprous sulfide, Cu 2 S.
Copper Properties
Copper Properties
| |||||||||||||||||||||||||||||||||||||||||||||||||
Facts, Symbol, Properties, Compounds, Uses
Facts about copper
Медь представляет собой химический элемент или красновато-коричневый переходный металл группы 11 или IB периодической таблицы с символом Cu и атомным номером 29. Это мягкий, прочный и блестящий металл с высокой теплопроводностью и электропроводностью. Медь помогает в образовании гемоглобина (переносчика кислорода) в организме животного.
Это мягкий, прочный и блестящий металл с высокой теплопроводностью и электропроводностью. Медь помогает в образовании гемоглобина (переносчика кислорода) в организме животного.
Металл образует гранецентрированную кубическую кристаллическую решетку. Он встречается в нашей среде в виде свободного металлического состояния или легко извлекаемых руд.
Бронза, сплав меди и олова, используется человечеством в истории с бронзового века. Медь содержится в гемоцианине в крови каракатиц и таких растениях, как зеленый горошек.
Кто открыл медь?
Археологическое открытие острова, а именно Кипра в восточной части Средиземного моря, славится своими медными рудниками. Название меди происходит от латинского названия Cuprum через Cyprium.
Свойства меди
В химии физические и химические свойства монет или благородных металлов, таких как Cu, Ag и Au, очень похожи.
| Медь | |||
| Химический символ | Медь | ||
| Дискавери | Историческая эпоха | ||
| Название производное от | Староанглийское слово coper и латинское слово Cyprium aes, означающее металл с Кипра | ||
| Основной изотоп | 29 Медь 63 | ||
| Степени окисления | +1 и +2 | ||
| Номер CAS | 7440-50-8 | ||
| Периодические свойства | |||
| Атомный номер | 29 | ||
| Атомный вес | 63,546 | ||
| Электрон на оболочку | 2, 8, 18, 1 | ||
| Электронная конфигурация | [Ar] 3d 10 4s 1 | ||
| Группа | 11 | ||
| Период | 4 | ||
| Блок | крестовина | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Место встречи | 1084,6 °С | ||
| Точка кипения | 2560 °С | ||
| Плотность | 8,95 г/см 3 | ||
| Молярная теплоемкость | 24,440 Дж моль -1 К -1 | ||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) | ||
| Удельное электрическое сопротивление | 16,78 нОм·м | ||
| Атомные свойства | |||
| Атомный радиус (несвязанный) | 1,96 Å | ||
| Ковалентный радиус | 1,22 Å | ||
| Электроотрицательность | 1,90 (шкала Полинга) | ||
| Сродство к электрону | 119,16 кДж моль −1 | ||
| Энергии ионизации (кДж моль −1 ) | 1-й | 2-й | 3-й |
| 745,48 | 1957,92 | 3554,61 | |
Медь в таблице Менделеева
Валютный металл, медь, серебро и золото помещаются в группу-11 или группу-1B периодической таблицы.
Все эти металлы содержат электронную конфигурацию валентной оболочки ns 1 (n−1)d 10 с заполненной d подоболочкой. Из-за наличия не полностью заполненной d-подоболочки в степени окисления +2 или +3 они называются переходными металлами.
Химические свойства
В ранней менделеевской чеканке периодической таблицы такие металлы, как Cu, Ag и Au, помещаются рядом с щелочными металлами. И щелочной металл, и металл для денег или монет имеют один электрон на самой внешней s-орбитали, а +1 является обычной степенью окисления или состоянием.
Физические и химические свойства этих двух семейств сильно различаются. Щелочные металлы представляют собой мягкие низкоплавкие высокоэлектроположительные элементы, в то время как чеканные или благородные металлы представляют собой относительно тугоплавкие и сравнительно менее электроположительные металлы. Поэтому монетные металлы помещены в группу 11 современной периодической таблицы.
Металлы 11 группы имеют высокую энергию первой ионизации и меньшие ионные радиусы. Участие d-электронов в металлической связи влияет на более высокую температуру плавления меди.
Участие d-электронов в металлической связи влияет на более высокую температуру плавления меди.
Ион Cu(II) более стабилен, чем ион Cu(I) в водном растворе. Это связано с небольшим размером и, следовательно, чрезвычайно высокой энергией гидратации Cu (II) по сравнению с Cu (I), которая компенсирует вторую энергию ионизации меди.
Где добывают медь?
Медь присутствует в земной коре в количестве 68 частей на миллион, что немного меньше, чем у никеля.
Самородная медь (минералы базальтовых листьев) и восстановленная форма соединений металлов, таких как сульфиды, карбонаты, арсениды и хлориды, обнаружены в различных местах мира.
В основном встречается в Северной и Южной Америке, Чили (ведущий мировой производитель), Конго и российских округах. В Индии два основных месторождения медной руды находятся в Бихаре (Сингбхум) и Раджастхане (Алвар, Аджмер и Кхетри).
Медные руды
Основные руды металлов указаны ниже в таблице,
| Медная руда | Химическая формула |
| Халькопирит | КуФеС 2 |
| Куприт | Медь 2 О |
| Ковеллит | CuS |
| Халькоцит | Медь 2 С |
| Малахит | [CuCO 3 , Cu(OH) 2 ] |
| Борнит | 2 Cu 2 S, CuS, FeS |
| Дигенит | Медь 9 С 5 |
| Диоптаза | CuSiO 2 (ОН) 2 |
Процесс извлечения меди
Медь извлекается в основном из сульфидной руды в процессе самовосстановления. Низкое качество (0,5 процента меди) превращается в высокое качество (15-20 процентов меди) для высокой производительности металла. Для этого используется процесс пенной флотации.
Низкое качество (0,5 процента меди) превращается в высокое качество (15-20 процентов меди) для высокой производительности металла. Для этого используется процесс пенной флотации.
Основными стадиями извлечения меди являются,
Плавка меди
Руда обжигается и плавится (около 1400 °С) с добавлением кремнезема в отражательной печи. FeS предпочтительно окисляется до Cu 2 S из-за более основных свойств железа.
Оксид железа образует заготовку с кремнеземом. Расплавленная масса отделяется для образования верхнего слоя. Нижний слой содержит медный штейн (Cu 2 S и FeS).
Самовосстановление
- Расплавленный штейн дополнительно окисляется воздухом для окисления оставшегося железа.
- Добавляется больше кремнезема, который образует шлак, содержащий оксид железа.
- После удаления шлака сульфид металла окисляется воздухом с образованием Cu 2 O, который в сочетании с оставшейся Cu 2 S образует медь путем самовосстановления.

Cu 2 S + 2 Cu 2 O → 6 Cu + SO 2
Рафинирование меди электролизом
Неочищенный металл очищают электролизом в ванне с подкисленным раствором сульфата с использованием сырой меди в качестве анода и чистой меди в качестве катода. Примеси из анода используются для извлечения золота, серебра и платины.
Химические соединения
В состояниях +1 или +2 медь образует различные типы оксидов, гидроксидов, галогенидов, сульфатов, карбонатов, нитратов и комплексных соединений.
Степень окисления меди
Степень Cu (II) является основной степенью окисления металлической меди с конфигурацией d 9 . Cu (I) имеет замкнутую конфигурацию 3d 10 и хорошо стабилизируется по обменной энергии.
Твердые соединения в состоянии +1 термодинамически стабильны при умеренной температуре. Следовательно, Cu 2 O образуется при высоких температурах из CuO, а CuBr 2 разлагается при нагревании с образованием CuBr.
Большое количество химических соединений образуется в состояниях +1 и +2 металлической меди.
Cu (III) является изоэлектронным с никелем (II), но в этом состоянии известно лишь несколько соединений.
Оксиды меди
Оксиды меди существуют в двух формах: черный оксид меди (CuO) и красный оксид меди (Cu 2 O) со степенями окисления +2 и +1 соответственно.
- Оксид черного цвета (CuO) образуется при нагревании Cu с кислородом. Термическое разложение карбоната, нитрата или гидроксида — лучший способ получения оксида меди.
- Красный оксид Cu (I) или оксид меди (Cu 2 O) образуется при восстановлении щелочных растворов Cu (II) мягкими восстановителями, такими как глюкоза. Встречается в природе в виде куприта и используется для изготовления рубинового стекла.
Гидроксид меди (II)
Синий осадок гидроксида меди (II) получают добавлением щелочи к водному раствору Cu(II). Осадок темнеет при стоянии из-за дегидратации гидроксида до оксида. Он растворяется в щелочи с образованием [Cu(OH) 4 ] −2 .
Он растворяется в щелочи с образованием [Cu(OH) 4 ] −2 .
В растворе аммиака образует темно-синий цвет [Cu(NH 3 ) 4 (H 2 O) 2 ] +2 . Темно-синий раствор называется реактивом Швейцера. Он используется для растворения целлюлозы и изготовления купраммониевой вискозы.
Галогениды меди
Только белый фторид, желтый хлорид и черный бромид известны в степени окисления +2. Благодаря восстановительным свойствам йод восстанавливает CuI 2 до Cu 2 я 2 .
Гидратированные галогениды получают растворением CuCO 3 или Cu(OH) 2 в галогеноводородах. CuF плохо охарактеризован.
Другие галогениды Cu (I) представляют собой бесцветные твердые вещества, нерастворимые в воде. Хлорид меди получают восстановлением меди (II) металлической медью или диоксидом серы в соляной кислоте.
Сульфат и нитрат
Сульфат меди (CuSO 4 , 5H 2 O) получают растворением металлолома в разбавленной серной кислоте в присутствии воздуха и кристаллизацией.
Нитрат получают в виде темно-синего расплывающегося кристаллического твердого вещества Cu(NO 3 ) 3 , 3H 2 O под действием азотной кислоты в растворе Cu (II).
Соединения меди (III)
Из-за большего размера и более высокого значения суммы первой, второй и третьей энергии ионизации Cu (III) образует несколько химических соединений.
Простых образцов галогенидов нет, но бледно-зеленый K 3 CuF 6 может быть получен действием фтора в смеси хлорида калия и CuCl 2 при 250 °С.
Твердое соединение купрата (III), подобное KCuO 2 , образуется при нагревании смеси CuO с супероксидом щелочного металла в присутствии молекулы кислорода.
Использование меди
- Медь является хорошим проводником электричества и широко используется в производстве проводов, кабелей, генераторов, трансформаторов, двигателей и любого другого электрического оборудования.
- Также используется для изготовления посуды, трубок и денежных монет.

- Медные сплавы, такие как латунь, бронза, константан, манганин и монал, широко используются в различных бытовых и промышленных целях благодаря их высокой механической прочности и коррозионной стойкости.
Использование медных сплавов
Латунь представляет собой сплав меди. Его получают путем сплавления меди с цинком и другими металлами, такими как алюминий, никель и свинец.
Как правило, он содержит от 57 до 97 процентов меди, а остальную часть составляет цинк или другие металлы, которые изменяют механическую прочность и химические свойства.
Латунь в основном используется в бытовом оборудовании, статуях, судовых гребных винтах и подшипниках.
| Медный сплав | |
| Сплав | Состав |
| Латунь | 70 % Cu и 30 % Zn |
| Металл Muntz | 60 % Cu и 40 % Zn |
| Дельта-металл | 55 % Cu, 40 % Zn и 5 % Fe |
Дельта-металл твердый как сталь и устойчив к морской воде. Используется для изготовления корабельных гребных винтов и подшипников.
Используется для изготовления корабельных гребных винтов и подшипников.
Использование бронзы
Бронза представляет собой сплав меди, олова и других металлов, таких как алюминий, марганец, цинк и т. д. Обычно бронза содержит от 4 до 25 процентов олова и других элементов.
Широко используется для изготовления статуй и денежных монет. В настоящее время эти сплавы постепенно вытесняются сталью и другими более дешевыми и легкими сплавами на основе алюминия.
Мельхиор
Мельхиор (от 10 до 30 процентов никеля и остальная часть меди) обладает высокой прочностью на растяжение и устойчив к химической коррозии, ржавчине и кислоте.
Мельхиор широко используется на химических заводах, телефонных системах, лопатках турбин и т. д.0001
Медь — это химический элемент, который раньше имел красноватый цвет. Медь чрезвычайно пластичный металл, который находится в 11-й группе периодической таблицы. Атомный номер меди — 29. Он обладает многими химическими свойствами, такими как хороший проводник электричества и тепла. В природе встречается в виде руды. Эта самородная медь была впервые использована в c. 8000 г. до н.э. в качестве замены камня людьми нового каменного века. Это основной элемент многих соединений и сплавов.
В природе встречается в виде руды. Эта самородная медь была впервые использована в c. 8000 г. до н.э. в качестве замены камня людьми нового каменного века. Это основной элемент многих соединений и сплавов.
(изображение скоро будет обновлено) 9{3}\].
Очень легко проводит тепло и электричество. Он также обладает отличной коррозионной стойкостью.
Природная медь представляет собой смесь или медный состав двух стабильных изотопов. Это изотопы меди-63 (69,15 %) и меди-65 (30,85 %).
Может быть повторно переработан без потери качества.
Использование меди
Ниже приведены некоторые из популярных применений медного элемента.
Медь добавляется в некоторые металлы для улучшения их гибкости, твердости, эластичности, цвета и коррозионной стойкости, поскольку это основной металл, который легко формуется.
 Медные сплавы, используемые в ювелирных изделиях, такие как серебро и золото, являются распространенными металлами, которые сплавляются с медью.
Медные сплавы, используемые в ювелирных изделиях, такие как серебро и золото, являются распространенными металлами, которые сплавляются с медью.Медь используется в большинстве распространенных материалов в сантехнике и электротехнике, таких как трубы, детали двигателей, провода, трубы и т. д.
Медь также считается важным элементом для здоровья человека. Взрослому человеку требуется примерно 1,2 мг Cu в день, чтобы помочь ферментам передавать энергию в клетки. Избыточное количество меди в организме токсично. Болезнь Вильсона и болезнь Менкеса являются генетическими заболеваниями, которые могут повлиять на способность организма правильно использовать медь.
Он легирован металлами, чтобы его можно было использовать в различных целях. Некоторыми важными сплавами меди являются сплавы меди с никелем, латуни, сплавы меди с бериллием, бронзы, сплавы нейзильбера, бронзы и т. д.
д.
Соединения меди
Некоторые из важных соединений меди следующие.
Оксиды. Медь образует два оксида, так как имеет две валентности. Этими соединениями являются закись меди (\[Cu_{2}O\]) и закись меди (CuO). Закись меди получают печными методами или электролитами. Это красный кристаллический материал. Закись меди получают прокаливанием подходящих солей, таких как гидроксид, нитрат или карбонат меди, или нагреванием закиси меди. CuO представляет собой порошок черного цвета.
Галогениды- хлорид меди (CuCl), хлорид меди (\[CuCl_{2}\]) представляют собой соединения меди с хлором. При прямом соединении меди и йода получается йодид меди (CuI). Иодид меди (\[Cul_{2}\]) существует только в сложных органических соединениях или в сочетании с солями аммония.
Сульфаты.
 Сульфат меди (\[CuSO_{4}\]) называют медным купоросом, потому что он имеет ярко-синий цвет и является наиболее важной солью меди. Сульфат меди обычно кристаллизуется в виде \[CuSO_{4}. 5Н_{2}О\].
Сульфат меди (\[CuSO_{4}\]) называют медным купоросом, потому что он имеет ярко-синий цвет и является наиболее важной солью меди. Сульфат меди обычно кристаллизуется в виде \[CuSO_{4}. 5Н_{2}О\].
Карбонаты. При добавлении щелочного карбоната к раствору соли меди образуются основные карбонаты меди. Соединения, имеющие ярко-зеленый или синий цвет, используются при получении пигментов, встречающихся в природе, таких как минералы малахит и азурит.
Залежи меди
Самородная медь встречалась в различных местах или местах в качестве первичного минерала в базальтовых лавах. Он также восстанавливается из соединений меди, таких как арсениды, карбонаты, хлориды и сульфиды. Медь встречается в сочетании со многими минералами, такими как азурит, малахит, халькопирит, борнит, куприт и халькоцит. Во многих морских кораллах он присутствует в золе водорослей, в печени человека, во многих моллюсках и членистоногих. Медь необходима для живых существ, поскольку она играет такую же роль в переносе кислорода в гемоцианине моллюсков (голубокровных) и ракообразных, как железо в гемоглобине краснокровных животных. Медь присутствует в организме человека в качестве микроэлемента, который помогает катализировать образование гемоглобина. Крупнейшим известным месторождением полезных ископаемых является месторождение медно-порфирового сплава в Андах Чили. К началу 21 века Чили стала ведущим производителем меди в мире. Другими крупными производителями меди являются Перу, Китай и США.
Медь присутствует в организме человека в качестве микроэлемента, который помогает катализировать образование гемоглобина. Крупнейшим известным месторождением полезных ископаемых является месторождение медно-порфирового сплава в Андах Чили. К началу 21 века Чили стала ведущим производителем меди в мире. Другими крупными производителями меди являются Перу, Китай и США.
Заключение
В этой статье мы получаем информацию о медном металле, такую как его символ, использование, а также появление и свойства меди и т. д. Нет сомнений в том, что медь является очень важным металлом, используемым в повседневной жизни, а также промышленные цели. Широкая область применения меди возможна благодаря ее металлическим свойствам.
Медь — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к цинку >
| Группа | 11 | Температура плавления | 1084,62°С, 1984,32°F, 1357,77 К |
| Период | 4 | Температура кипения | 2560°С, 4640°F, 2833 К |
| Блок | г | Плотность (г см −3 ) | 8,96 |
| Атомный номер | 29 | Относительная атомная масса | 63,546 |
| Состояние при 20°C | Твердый | Ключевые изотопы | 63 Медь |
| Электронная конфигурация | [Ar] 3d 1 0 4s 1 | Номер КАС | 7440-50-8 |
| ChemSpider ID | 22414 | ChemSpider — бесплатная база данных химической структуры. | |
Изображение представляет собой один из многих алхимических символов, когда-то использовавшихся для обозначения элемента меди. Он показан на карте Кипра 17-го века, откуда элемент получил свое название.
Красновато-золотой металл, который легко обрабатывается и втягивается в провода.
Исторически медь была первым металлом, с которым работали люди. Открытие того, что его можно закалить небольшим количеством олова, чтобы образовать легированную бронзу, дало название бронзовому веку.
Традиционно это один из металлов, используемых для изготовления монет, наряду с серебром и золотом. Тем не менее, это самый распространенный из трех и, следовательно, наименее ценный. Все монеты США теперь изготавливаются из медных сплавов, а оружейные металлы также содержат медь.
Большая часть меди используется в электрическом оборудовании, таком как проводка и двигатели. Это потому, что он очень хорошо проводит тепло и электричество, и его можно втянуть в провода. Он также используется в строительстве (например, кровля и сантехника) и в промышленном оборудовании (например, в теплообменниках).
Это потому, что он очень хорошо проводит тепло и электричество, и его можно втянуть в провода. Он также используется в строительстве (например, кровля и сантехника) и в промышленном оборудовании (например, в теплообменниках).
Сульфат меди широко используется как сельскохозяйственный яд и как альгицид при очистке воды.
Соединения меди, такие как раствор Фелинга, используются в химических тестах для обнаружения сахара.
Медь является важным элементом. Взрослому человеку требуется около 1,2 миллиграмма меди в день, чтобы помочь ферментам передавать энергию в клетки. Избыток меди токсичен.
Генетические заболевания, такие как болезнь Вильсона и болезнь Менкеса, могут повлиять на способность организма правильно использовать медь.
В отличие от млекопитающих, которые используют железо (содержащееся в гемоглобине) для транспортировки кислорода по своему телу, некоторые ракообразные используют комплексы меди.
Металлическая медь встречается в природе, но, безусловно, самый большой источник находится в таких минералах, как халькопирит и борнит. Медь получают из этих руд и минералов плавлением, выщелачиванием и электролизом. Основными производителями меди являются Чили, Перу и Китай.
Медь получают из этих руд и минералов плавлением, выщелачиванием и электролизом. Основными производителями меди являются Чили, Перу и Китай.
История элементов и периодической таблицы
В северном Ираке были раскопаны медные бусины, возраст которых превышает десять тысяч лет и которые предположительно сделаны из самородной меди, самородки которой иногда можно найти. Медь широко использовалась в древнем мире в виде бронзы, ее сплава с оловом, из которого изготавливали столовые приборы, монеты и инструменты. В Китае его использовали для колоколов.
Медь несложно извлечь из нее руды, но извлекаемые месторождения были относительно редки. Некоторые из них, такие как медный рудник в Фалуне, Швеция, датируемый 1200-ми годами, были источником большого богатства. Один из способов извлечения металла заключался в обжиге сульфидной руды с последующим выщелачиванием образовавшегося сульфата меди водой. Затем его капали на железный лом, на поверхность которого осаждалась медь, образуя чешуйчатый слой, который легко удалялся.
| Атомный радиус, несвязанный (Å) | 1,96 | Ковалентный радиус (Å) | 1,22 |
| Сродство к электрону (кДж моль -1 ) | 119,159 | Электроотрицательность (шкала Полинга) | 1,90 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 745. 2 -й 1957.919 3 рд 3554,616 4 -й 5536,33 5 -й 7699,5 6 -й 9938 7 -й 13411 8 -й 16017 | ||
| Общие степени окисления | 2 , 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 63 Медь | 62. 930 930 | 69,15 | — | — | |
| 65 Медь | 64,928 | 30,85 | — | — | |
|
|
| Удельная теплоемкость (Дж кг −1 К −1 ) | 385 | Модуль Юнга (ГПа) | 129. 8 8 | |||||||||||
| Модуль сдвига (ГПа) | 48,3 | Объемный модуль (ГПа) | 137,8 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
Слушайте медный подкаст |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец акции) Крис Смит Привет, на этой неделе монеты, проводимость и медь. Чтобы рассказать историю об элементе, который перенес нас из каменного века в век информации, вот Стив Майлон. Стив Майлон Бедная медь, до недавнего времени она, казалось, уступала в прямом и переносном смысле своим собратьям из переходных металлов, Серебру и Золоту. Я предполагаю, что это комбинированный результат, который история имеет в изобилии. Почти никогда не бывает так, чтобы популярные элементы были такими из-за их полезности и интересного химического состава. Но для Gold и Silver это все так поверхностно. Они более популярны, потому что они красивее. Моя жена, например, не химик, не мечтает носить медное обручальное кольцо. Возможно, это как-то связано с тем фактом, что оксид меди имеет раздражающую привычку окрашивать кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы узнать ее немного; может быть, тогда она, вероятно, повернется спиной к другим и будет носить его с гордостью. Некоторые говорят, что медь — это первый металл, добытый и изготовленный людьми. Так это или нет, но есть свидетельства того, что цивилизации использовали медь еще 10 000 лет назад. Чтобы культуры перешли от каменного века к бронзовому, им нужна была медь. Бронза состоит из 2 частей меди и 1 части олова, а не серебра или золота. Важность меди для цивилизации никогда не ослабевала, и даже сейчас из-за ее превосходной проводимости медь пользуется большим спросом во всем мире, поскольку быстро развивающиеся страны, такие как Китай и Индия, создают инфраструктуру, необходимую для подачи электричества в дома своих граждан. Например, за последние пять лет цена на медь увеличилась более чем в четыре раза. Возможно, самой большой пощечиной этому важному металлу является его использование в монетах во многих странах мира. Оранжево-коричневые монеты, как правило, имеют низкий номинал, в то время как блестящие, более серебряные монеты занимают место вверху. Даже в 5-центовой монете США никель выглядит блестящим и серебристым, но на самом деле содержит 75% меди и только 25% никеля. Конечно, я мог бы продолжать и продолжать выявлять множество интересных фактов и фактов о меди и о том, почему другие должны относиться к ней с подозрением. Они легко могли бы, потому что это также отличный проводник тепла, но я нахожу этот металл таким интересным и по многим другим причинам. Медь является одним из немногих металлов-индикаторов, необходимых для всех видов. По большей части биологическая потребность в меди довольно низка, так как только несколько ферментов, таких как цитохромоксидаза и супероксиддисмутаза, требуют меди в своих активных центрах. Обычно они основаны на окислительно-восстановительном цикле и играют важную роль в дыхании. Для людей потребность в меди также довольно низкая, всего 2 мг меди в день для взрослых. Тем не менее, слишком мало меди в вашем рационе может привести к высокому кровяному давлению и повышению уровня холестерина. Интересно, что для меди разрыв, разделяющий необходимое количество и токсичное количество, довольно мал. По моему мнению, вы вряд ли найдете в таблице Менделеева металл, обладающий такой же универсальностью, как медь, и при этом не пользующийся заслуженным уважением среди себе подобных. Хотя он значительно более распространен, чем золото и серебро, его значение в истории не имеет себе равных, а его полезность на макроуровне сопоставима только с его полезностью на микроуровне. Никакой другой металл не может конкурировать. Итак, я попытаюсь объяснить это своей жене, когда подарю ей пару медных сережек или красивое медное ожерелье в эти праздничные дни. Я предполагаю, что она вздернет нос, потому что подумает, что пенни сделаны из этого материала, хотя в наши дни это совсем не так. Крис Смит Мужчина, женатый на меди, это Стив Майлон. Питер Уотерс Его младший двоюродный брат Эдмунд Дэви в то время помогал Хамфри, и он рассказывает, как, когда Хамфри впервые увидел, как крошечные шарики калия прорываются сквозь корку поташа и загораются, он не мог сдержать радости. Дэви имел полное право быть в восторге от этого удивительного нового металла. Он выглядит точно так же, как другие яркие блестящие металлы, но его плотность меньше, чем у воды. Это означало, что металл будет плавать на воде. По крайней мере, сойдет, если он не взорвется, как только соприкоснется с водой. Калий настолько реактивен; он даже отреагирует и прожжет дыру во льду. Крис Смит Питер Уотерс с рассказом об элементе номер 19, калии. Это на следующей неделе Химия в ее элементе . Я надеюсь, что вы можете присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания! (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о меди
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
Data
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г.
Таблица 903 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
Использование и свойства
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Данные о рисках снабжения
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
созданы The Nake Scients Scientists. .
Периодическая таблица видео
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Сульфат меди | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Сульфат меди
Номер продукта: Все применимые коды продуктов American Elements, например. CU2-SAT-02
, КР2-САТ-03
, КР2-САТ-04
, КР2-САТ-05
, CU2-SAT-TG
Номер CAS: 7758-98-7
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements Анхелес, Калифорния
Тел. : +1 310-208-0551
: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
2 ОПАСНОСТИ РАЗДЕЛА 2.
Классификация вещества или смеси
Классификация GHS в соответствии с 29 CFR 1910 (OSHA HCS)
Острая токсичность, пероральная (категория 4), h402
Раздражение кожи (категория 2), h415
Раздражение глаз (категория 2A), h419
Острая водная токсичность (категория 1), ч500
Хроническая токсичность в водной среде (Категория 1), h510
Элементы маркировки СГС, включая меры предосторожности
Пиктограмма
Сигнальное слово
Предупреждение
Краткая характеристика опасности
h402
Вреден при проглатывании.
h415
Вызывает раздражение кожи.
h419
Вызывает серьезное раздражение глаз.
h510
Очень токсичен для водных организмов с долгосрочными последствиями.
Меры предосторожности
P264
Тщательно вымыть кожу после работы.
P270
Не ешьте, не пейте и не курите при использовании этого продукта.
P273
Избегать попадания в окружающую среду.
P280
Пользоваться средствами защиты глаз/лица.
P280
Носить защитные перчатки.
P301 + P312 + P330
ПРИ ПРОГЛАТЫВАНИИ: При плохом самочувствии обратитесь в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу.
Прополоскать рот.
P302 + P352
ПРИ ПОПАДАНИИ НА КОЖУ: Промыть большим количеством воды с мылом.
P305 + P351 + P338
ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
Р332 + Р313
При появлении раздражения кожи: обратиться к врачу.
P337 + P313
Если раздражение глаз не проходит: обратиться к врачу.
P362
Снять загрязненную одежду и постирать ее перед повторным использованием.
P391
Собрать разлив.
P501
Утилизируйте содержимое/контейнер на утвержденном предприятии по утилизации отходов.
Опасности, не классифицированные иначе (HNOC) или не охваченные GHS
—
нет
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
Синонимы: Сульфат меди
Формула: CuO 4 S
Молекулярный вес: 159,61 г/моль
CAS-номер: 7758-98-7
EC-номер: 231-847-6
Index-No. : 029-004-00-0
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общие рекомендации
Обратитесь к врачу. Покажите этот паспорт безопасности лечащему врачу.
Покиньте опасную зону.
При вдыхании
При вдыхании вывести пострадавшего на свежий воздух. Если человек не дышит, сделайте ему искусственно дыхание. Проконсультируйтесь с врачом.
При попадании на кожу
Смыть большим количеством воды с мылом. Проконсультируйтесь с врачом.
При попадании в глаза
Тщательно промыть большим количеством воды в течение не менее 15 минут и обратиться к врачу.
При проглатывании
Никогда ничего не давайте в рот человеку, находящемуся без сознания. Прополоскать рот водой. Проконсультируйтесь с врачом.
Прополоскать рот водой. Проконсультируйтесь с врачом.
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Наиболее важные известные симптомы и эффекты описаны на этикетке (см. раздел 2) и/или в разделе 11
Указание на необходимость немедленной медицинской помощи и специального лечения
Данные отсутствуют
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Средства пожаротушения
Подходящие средства пожаротушения
Используйте распыленную воду, спиртостойкую пену, сухой химикат или двуокись углерода.
Особые опасности, исходящие от вещества или смеси
Нет данных
Рекомендации для пожарных
При тушении пожара надевайте автономный дыхательный аппарат, если это необходимо.
Дополнительная информация
Нет данных
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Избегайте образования пыли. Избегайте вдыхания паров, тумана или газа. Обеспечьте достаточную вентиляцию. Избегайте вдыхания пыли.
Избегайте образования пыли. Избегайте вдыхания паров, тумана или газа. Обеспечьте достаточную вентиляцию. Избегайте вдыхания пыли.
Индивидуальную защиту см. в разделе 8.
Меры предосторожности по охране окружающей среды
Предотвратите дальнейшую утечку или разлив, если это безопасно. Не допускайте попадания продукта в канализацию. Следует избегать выброса в окружающую среду.
Методы и материалы для локализации и очистки
Собрать и организовать утилизацию без образования пыли. Подметать и сгребать. Хранить в подходящих закрытых контейнерах для утилизации.
Ссылка на другие разделы
Информацию об утилизации см. в разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Меры предосторожности для безопасного обращения
Избегать контакта с кожей и глазами. Избегайте образования пыли и аэрозолей.
Дальнейшая обработка твердых материалов может привести к образованию горючей пыли. Перед дополнительной обработкой следует принять во внимание возможность образования горючей пыли.
Обеспечьте соответствующую вытяжную вентиляцию в местах образования пыли.
Меры предосторожности см. в разделе 2.
Условия для безопасного хранения с учетом любых несовместимостей
Хранить контейнер плотно закрытым в сухом и хорошо проветриваемом месте.
Чувствителен к воздуху.
гигроскопичен
Хранить в среде инертного газа.
Хранить в сухом месте.
Класс хранения (TRGS 510): негорючие твердые вещества
Особое конечное использование
Помимо использования, указанного в разделе 1, никакие другие специальные применения не предусмотрены
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Средства контроля воздействия
Соответствующие технические меры
Обращайтесь в соответствии с правилами промышленной гигиены и техники безопасности. Мойте руки перед перерывами и в конце рабочего дня.
Средства индивидуальной защиты
Средства защиты глаз/лица
Защитные очки с боковыми щитками, соответствующие стандарту EN166. Используйте средства защиты глаз, проверенные и одобренные в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или EN 166 (ЕС).
Используйте средства защиты глаз, проверенные и одобренные в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или EN 166 (ЕС).
Защита кожи
Работать в перчатках. Перчатки должны быть проверены перед использованием. Используйте правильную технику снятия перчаток (не касаясь внешней поверхности перчатки), чтобы избежать контакта этого продукта с кожей. Утилизируйте загрязненные перчатки после использования в соответствии с применимыми законами и передовой лабораторной практикой. Вымойте и высушите руки.
Защита тела
Полный костюм для защиты от химикатов. Тип средств защиты должен выбираться в зависимости от концентрации и количества опасного вещества на конкретном рабочем месте.
Средства защиты органов дыхания
При неприятных воздействиях используйте противоаэрозольный респиратор типа P95 (США) или типа P1 (ЕС EN 143). Для защиты более высокого уровня используйте респираторные картриджи типа OV/AG/P99 (США) или типа ABEK-P2 (ЕС EN 143). . Используйте респираторы и компоненты, проверенные и одобренные в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
. Используйте респираторы и компоненты, проверенные и одобренные в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
Контроль воздействия на окружающую среду
Предотвратить дальнейшую утечку или разлив, если это безопасно. Не допускайте попадания продукта в канализацию. Следует избегать выброса в окружающую среду.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид
Форма: порошок
Цвет: светло-серый
Запах
Нет данных
Порог восприятия запаха
pH 9 Нет данных
Точка плавления/замерзания
Точка/диапазон плавления: 200 °C (392 °F) – разл.
Начальная точка кипения и интервал кипения
Данные отсутствуют
Температура вспышки
Н/Д
Скорость испарения
Нет данных
Воспламеняемость (твердое вещество, газ)
Нет данных
Верхний/нижний пределы воспламеняемости или взрываемости
Нет данных
Давление пара
9,7 гПа (7,3 мм рт. ст.) при 25 °C (77 °F)
ст.) при 25 °C (77 °F)
Плотность пара
Нет данных
Относительная плотность
3,603 г/мл при 25 °C (77 °F)
Растворимость в воде
Нет данных
Коэффициент распределения: н-октанол/вода
Нет данных
Температура самовоспламенения
Нет данных
Температура разложения
Недоступные данные
ВИСКОСТЬ
Данные Доступны
Взрывные свойства
Недоступные данные
Окислительные свойства
ДАННЫЕ ДАННЫ имеются данные
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Возможность опасных реакций
Данные отсутствуют
Условия, которых следует избегать
Нет данных
Несовместимые материалы
Порошкообразные металлы, гидроксиламин, Магний, Сильные восстановители
В случае пожара: см. раздел 5
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность
LD50 Перорально-крыса-482 мг/кг
Вдыхание: данные отсутствуют
Кожный: данные отсутствуют
LD50 внутрибрюшинно-крыса-20 мг/кг
LD50 подкожно-крыса-43 мг/кг /кг
Разъедание/раздражение кожи
Нет данных
Серьезное повреждение/раздражение глаз
Нет данных
Респираторная или кожная сенсибилизация
Нет данных
Мутагенность зародышевых клеток
Крыса
Печень
Повреждение ДНК
Мышь
Повреждение ДНК 903 903

 е. м. (г/моль)
е. м. (г/моль) Физические и химические свойства — это характеристики вещества, такого как медь, которые отличают его от любого другого вещества. Наиболее распространенные вещества, такие как медь, существуют в виде состояний материи в виде твердых тел, жидкостей, газов и плазмы. Обратитесь к нашей статье о медном элементе для получения дополнительной информации и фактов об этом металлическом веществе.
Физические и химические свойства — это характеристики вещества, такого как медь, которые отличают его от любого другого вещества. Наиболее распространенные вещества, такие как медь, существуют в виде состояний материи в виде твердых тел, жидкостей, газов и плазмы. Обратитесь к нашей статье о медном элементе для получения дополнительной информации и фактов об этом металлическом веществе. сияние или свечение
сияние или свечение Доступ к дополнительным фактам и информации о Периодической таблице и ее элементах можно получить через карту сайта Периодической таблицы.
Доступ к дополнительным фактам и информации о Периодической таблице и ее элементах можно получить через карту сайта Периодической таблицы.