Характеристика меди по химии: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов / Справочник :: Бингоскул
Содержание
Характеристика меди
Компания ООО «Эксклюзив-строй» предлагает изделия из меди любой сложности.
Медь — химический элемент. Один из семи металлов, известных с глубокой древности. По некоторым археологическим данным — медь была хорошо известна египтянам еще за 4000 лет до Р. Хр. Знакомство человечества с медью относится к более ранней эпохе, чем с железом; это объясняется с одной стороны более частым нахождением меди в свободном состаянии на поверхности земли, а с другой — сравнительной легкостью получения ее из соединений. Древняя Греция и Рим получали медь с острова Кипра (Cyprum), откуда и название ее Cuprum. Особенно важна медь для электротехники.
По электропроводности медь занимает второе место среди всех металлов, после серебра. Однако в наши дни во всем мире электрические провода, на которые раньше уходила почти половина выплавляемой меди, все чаще делают из аллюминия. Он хуже проводит ток, но легче и доступнее. Медь же, как и многие другие цветные металлы, становится все дефицитнее. Если в 19 в. медь добывалась из руд, где содержалось 6-9% этого элемента, то сейчас 5%-ные медные руды считаются очень богатыми, а промышленность многих стран перерабатывает руды, в которых всего 0,5% меди.
Он хуже проводит ток, но легче и доступнее. Медь же, как и многие другие цветные металлы, становится все дефицитнее. Если в 19 в. медь добывалась из руд, где содержалось 6-9% этого элемента, то сейчас 5%-ные медные руды считаются очень богатыми, а промышленность многих стран перерабатывает руды, в которых всего 0,5% меди.
Медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата — медного купороса. В значительных количествах он ядовит, как и многие другие соединениямеди, особенно для низших организмов. В малых же дозах медь совершенно необходима всему живому.
Химические и физические свойства элемента.
Медь — химический элемент I группы периодической системы Менделеева; атомный номер 29, атомная масса 63,546. Температура плавления- 1083° C; температура кипения — 2595° C; плотность — 8,98 г/см3. По геохимической классификации В.М. Гольдшмидта, медь относится к халькофильным элементам с высоким сродством к S, Se, Te, занимающим восходящие части на кривой атомных объемов; они сосредоточены в нижней мантии, образуют сульфиднооксидную оболочку.
По геохимической классификации В.М. Гольдшмидта, медь относится к халькофильным элементам с высоким сродством к S, Se, Te, занимающим восходящие части на кривой атомных объемов; они сосредоточены в нижней мантии, образуют сульфиднооксидную оболочку.
Вернадским в первой половине 1930 г были проведены исследования изменения изотопного состава воды, входящего в состав разных минералов, и опыты по разделению изотопов под влиянием биогеохимических процессов, что и было подтверждено последующими тщательными исследованиями. Как элемент нечетный состоит из двух нечетных изотопов 63 и 65 На долю изотопа Cu (63) приходится 69,09%, процентное содержание изотопа Cu (65) — 30,91%. В соединениях медь проявляет валентность +1 и +2, известны также немногочисленные соединения трехвалентной меди.
К валентности 1 относятся лишь глубинные соединения, первичные сульфиды и минерал куприт — Cu2O. Все остальные минералы, около сотни отвечают валентности два. Радиус одноволентной меди +0.96, этому отвечает и эк — 0,70. Величина атомного радиуса двухвалентной меди — 1,28; ионного радиуса 0,80.
Величина атомного радиуса двухвалентной меди — 1,28; ионного радиуса 0,80.
Очень интересна величена потенциалов ионизации: для одного электрона — 7,69, для двух — 20,2. Обе цифры очень велики, особенно вторая, показывающая большую трудность отрыва наружных электронов. Одновалентная медь является равноквантовой и потому ведет к бесцветным солям и слабо окрашенным комплексам, тогда как разноквантовя двух валентная медь характеризуется окрашенностью солей в соединении с водой.
Медь — металл сравнительно мало активный. В сухом воздухе и кислороде при нормальных условиях медьне окисляется. Она достаточно легко вступает в реакции с галогенами, серой, селеном. А вот с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют.
Электроотрицательность атомов — способность при вступлении в соединения притягивать электроны. Электроотрицательность Cu2+ — 984 кДЖ/моль, Cu+ — 753 кДж/моль. Элементы с резко различной ЭО образуют ионную связь, а элементы с близкой ЭО — ковалентую. Сульфиды тяжелых металлов имеют промежуточную связь, с большей долей ковалентной связи ( ЭО у S-1571, Cu-984, Pb-733). Медь является амфотерным элементом — образует в земной коре катионы и анионы.
Элементы с резко различной ЭО образуют ионную связь, а элементы с близкой ЭО — ковалентую. Сульфиды тяжелых металлов имеют промежуточную связь, с большей долей ковалентной связи ( ЭО у S-1571, Cu-984, Pb-733). Медь является амфотерным элементом — образует в земной коре катионы и анионы.
Минералы
Медь входит более чем в 198 минералов, из которых для промышленности важны только 17, преимущественно сульфидов, фосфатов, силикатов, карбонатов, сульфатов. Главными рудными минералами являются халькопирит CuFeS2, ковеллин CuS, борнит Cu5FeS4, халькозин Cu2S.
Окислы: тенорит, куприт. Карбонаты: малахит, азурит. Сульфаты: халькантит, брошантит. Сульфиды: ковеллин, халькозин, халькопирит, борнит.
Чистая медь — тягучии, вязкий металл красного, в изломе розового цвета, в очень тонких слоях на просвет медь выглядит зеленовато-голубой. Эти же цвета, характерны и для многих соединений меди, как в твердом состаянии, так и в растворах.
Понижение окраски при повышении валентности видно из следующих двух примеров:
CuCl — белый, Cu2O — красный, CuCl2+H2O — голубой, CuO — черный
Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем намечается интересный практический признак для поисков.
Практическое значение имеют: самородная медь, сульфиды, сульфосоли и карбонаты (силикаты).
Придерживаясь принципа»заказчик, прежде всего», квалифицированный персонал нашей компании творчески подходит к решению каждой задачи, считая основой своей деятельности высокое качество обслуживания клиентов.
Изготовим: Доборные Элементы кровли, Водосточные Системы, Флюгарки, Отливы, Колпаки на забор, Дымники, Флюгера.
Медная Кровля Эксклюзив.
Подготовка к ЦТ и ЕГЭ по химии
3
Мар
Posted on Author admin
0
Чтобы поделиться, нажимайте
Медь расположена в IB группе Периодической системы химических элементов Д. И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.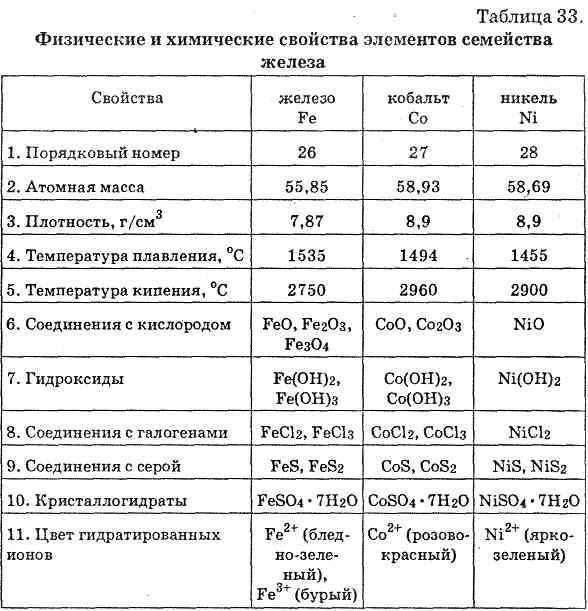
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
С концентрированной горячей соляной кислотой:
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
Характеристики меди и реакция металла с азотной кислотой
Похоже, вы зашли на наш сайт из
Германия .
Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Стабильный металл Vs. Сильный окислитель
[Депозитные фотографии]
Медь — один из старейших известных металлов, который использовался людьми с древних времен. На латыни медь известна как cuprum, а ее атомный номер — 29. В периодической таблице Менделеева медь расположена в четвертом периоде, в первой группе.
Физические и химические свойства меди
Встречающаяся в природе медь представляет собой тяжелый металл розово-красного цвета с пластичной и мягкой структурой. Температура кипения составляет более 1000 градусов по Цельсию. Купрум является хорошим проводником электричества и тепла и плавится при температуре 1084 градусов по Цельсию. Плотность металла 8,9.г/см3, а в природе встречается в основном виде.
Плотность металла 8,9.г/см3, а в природе встречается в основном виде.
Согласно электронной формуле атома меди он имеет 4 уровня. На 4-s валентной орбитали находится один электрон. При химическом взаимодействии с другими веществами от атома отщепляется от одной до трех отрицательно заряженных частиц (электронов), в результате чего образуются соединения меди со степенью окисления +3, +2, +1. Максимальную стабильность проявляют двухвалентные производные меди.
[Депозитные фотографии]
Медь — вещество с низкой способностью к взаимодействию. Различают две основные степени окисления металла, проявляющиеся в соединениях: +1 и +2. Вещества, у которых эти значения изменяются до +3, встречаются редко. Медь взаимодействует с углекислым газом, воздухом, соляной кислотой и другими соединениями при очень высоких температурах. На поверхности металла образуется защитная оксидная пленка. Этот металл защищает медь от дальнейшего окисления, делает ее стабильной и придает металлу низкую активность.
Этот металл защищает медь от дальнейшего окисления, делает ее стабильной и придает металлу низкую активность.
Металл взаимодействует с простыми веществами – галогенами, селеном, серой. Металл способен образовывать двойные соли или комплексные соединения. Ядовиты почти все комплексные соединения этого элемента, кроме оксидов. Вещества, образованные одновалентной медью, легко окисляются до двухвалентных эквивалентов.
В химических реакциях медь выступает как малоактивный металл. Металл не растворяется в воде в обычных условиях. В сухом воздухе металл не подвергается коррозии, но при нагревании поверхность меди покрывается черным налетом окиси. Химическая стабильность элемента проявляется в его стойкости к воздействию углерода, сухих газов, ряда органических соединений, спиртов и фенольных смол. Для меди характерны сложные реакции, при которых выделяются окрашенные соединения. Медь имеет сходство с металлами щелочной группы, так как образует одновалентные производные.
Медь — реакция с азотной кислотой
Медь растворяется в азотной кислоте. Эта реакция происходит потому, что металл окисляется сильным реагентом.
Эта реакция происходит потому, что металл окисляется сильным реагентом.
Молекула азотной кислоты
[Депозитные фотографии]
Азотная кислота (разбавленная и концентрированная) проявляет окислительные свойства, с растворением меди. При реакции металла с разбавленной кислотой образуются нитрат меди и двухвалентный оксид азота в соотношении 75% и 25%. Уравнение реакции
8HNO₃ + 3Cu → 3Cu(NO3)₂ + 2NO + 4H₂O
В процессе реакции принимают участие 1 моль меди и 3 моля концентрированной азотной кислоты. При растворении меди раствор сильно нагревается, происходит термический распад окислителя и выделяется дополнительное количество оксида азота. Уравнение реакции
4HNO₃ + Cu → Cu(NO3) + 2NO₂ + 2H₂O
Этот способ растворения меди имеет свои недостатки – при реакции меди с азотной кислотой выделяется большое количество оксида азота. Для улавливания или нейтрализации оксида азота требуется специальное оборудование, поэтому этот процесс слишком дорог. Растворение меди в азотной кислоте считается завершенным, когда перестают образовываться летучие оксиды азота. Температура реакции составляет от 60 до 70 градусов Цельсия. Следующий этап – слив раствора из химического реактора. На дне реактора остаются куски меди, не вступившие в реакцию. В полученную жидкость добавляют воду, и ее фильтруют. Нажмите здесь, чтобы узнать о свойствах меди во взаимодействии с другими веществами.
Для улавливания или нейтрализации оксида азота требуется специальное оборудование, поэтому этот процесс слишком дорог. Растворение меди в азотной кислоте считается завершенным, когда перестают образовываться летучие оксиды азота. Температура реакции составляет от 60 до 70 градусов Цельсия. Следующий этап – слив раствора из химического реактора. На дне реактора остаются куски меди, не вступившие в реакцию. В полученную жидкость добавляют воду, и ее фильтруют. Нажмите здесь, чтобы узнать о свойствах меди во взаимодействии с другими веществами.
Реакция азотной кислоты и меди, проиллюстрированная экспериментом
Всю реакцию азотной кислоты и меди можно проследить с помощью опыта: поместите кусок меди в концентрированную азотную кислоту. Выделяется коричневый газ – сначала медленно, затем интенсивнее. Раствор становится зеленым. Если в процессе реакции добавить много меди, раствор постепенно станет синим. Реакция меди с азотной кислотой протекает с выделением тепла и ядовитого газа, имеющего едкий запах.
Реакция меди и концентрированной азотной кислоты является окислительно-восстановительной реакцией. Восстановитель – металл, окислитель – азотная кислота. Уравнение реакции
Cu + 4HNO₃ = Cu(NO3)₂ + 2NO₂↑ + 2H₂O
Реакция экзотермическая, поэтому при самопроизвольном нагревании смеси она ускоряется.
Реакция меди с азотной кислотой начинается при комнатной температуре. Металл покрывается пузырьками, которые начинают подниматься на поверхность и наполняют пробирку коричневым газом – NO₂ (ядовитый ядовитый диоксид азота с едким запахом). Этот газ в 1,5 раза тяжелее воздуха.
Реакция меди с азотной кислотой протекает в две стадии: на первой стадии кислота окисляет медь до оксида меди с выделением диоксида азота; на второй стадии оксид меди реагирует с новыми порциями кислоты, образуя нитрат меди Cu(NO₃)₂. Смесь нагревается, и реакция ускоряется.
Образец тригидрата нитрата меди(II)
[Википедия]
В результате металл растворяется, и образуется раствор нитрата меди. Нитрат меди придает раствору зеленый или синий цвет (это будет зависеть от количества используемой воды).
Нитрат меди придает раствору зеленый или синий цвет (это будет зависеть от количества используемой воды).
У нас есть еще статьи по химии для вас:
- Эксперимент «Оловянный ёжик»
Как вырастить металлического ежика за 5 минут - Эксперимент «Кристаллы медного купороса»
Как вырастить красивый голубой кристалл с медной солью
Вы можете провести десятки химических опытов дома!
Синяя бутылка
Учить больше
Попытайся
Элемент Медь — Атом Меди
| |||||
| Общий | |||||
|---|---|---|---|---|---|
| Название, символ, номер | медь, Cu, 29 | ||||
| Химическая серия | переходные металлы | ||||
| Группа, период, блок | 11, 4, д | ||||
| Плотность, твердость | 8920 кг/м 3 , 3,0 | ||||
| Внешний вид | медь, металлик | ||||
| Атомный свойства | |||||
| Атомный вес | 63,546 а. е.м. е.м. | ||||
| Атомный радиус (расч.) | 135 (145) пм | ||||
| Ковалентный радиус | 138 вечера | ||||
| Радиус Ван-дер-Ваальса | 140 часов | ||||
| Электронная конфигурация | [Ar]3d 10 4s 1 | ||||
| e — на уровень энергии | 2, 8, 18, 1 | ||||
| Степени окисления (оксид) | 2 ,1 (умеренно основной) | ||||
| Кристаллическая структура | кубический, гранецентрированный | ||||
| Физический свойства | |||||
| Состояние вещества | твердый (диамагнитный) | ||||
| Температура плавления | 1357,6 К (1084,6 С / 1984. 3 Ж) 3 Ж) | ||||
| Температура кипения | 2840 К (2567,2°С / 4653°F) | ||||
| Молярный объем | 7.11 10 -6 м 3 /моль | ||||
| Теплота парообразования | 300,3 кДж/моль | ||||
| Теплота плавления | 13,05 кДж/моль | ||||
| Давление паров | 0,0505 Па при 1358 К | ||||
| Скорость звука | 3570 м/с при 293,15 К | ||||
| Разное | |||||
| Электроотрицательность | 1,9 (шкала Полинга) | ||||
| Удельная теплоемкость | 380 Дж/(кг*К) | ||||
| Электропроводность | 59,6 10 6 /(м*Ом) | ||||
| Теплопроводность | 401 Вт/(м*К) | ||||
| 1 st потенциал ионизации | 745,5 кДж/моль | ||||
| 2 nd потенциал ионизации | 1957,9 кДж/моль | ||||
| 3 rd потенциал ионизации | 3555 кДж/моль | ||||
| 4 й потенциал ионизации | 5536 кДж/моль | ||||
| СИ единицы и STP используются, если не указано иное.  | |||||
Медь — химический элемент
в периодической таблице, который имеет символ Cu
и атомный номер 29.
Примечательно
характеристики
Медь – металл красноватого цвета с высоким
электро- и теплопроводность (среди чистых
металлов при комнатной температуре только серебро имеет
более высокая электропроводность). Медь вполне может
быть самым старым используемым металлом, как медные артефакты
датируемые 8700 г. до н.э. Помимо того
входит в состав различных руд, медь можно найти в
металлическая форма (т.е. самородная медь )
в некоторых местах.
В греческие времена металл был известен под названием
Чалкос . В римские времена стало известно
как aes Cyprium , потому что так много его
был добыт на Кипре. Отсюда и пошла фраза
упрощенный до cuprum , а затем англизированный
на английский медь .
Применение
Медь ковкая и ковкая, используется
широко, в таких продуктах, как:
- Медная проволока.
- Медная сантехника.
- Дверные ручки и прочая арматура в домах.
- Скульптура: Статуя Свободы, например,
содержит 179 000 фунтов меди. - Электромагниты.
- Двигатели, особенно электромагнитные двигатели.

- Паровая машина Уатта.
- Реле электрические, электрические шины и
электрические выключатели. - Вакуумные трубки, электронно-лучевые трубки и магнетроны
в микроволновых печах. - Волноводы для микроволнового излучения.
- Медь все чаще используется в интегрированных
цепей, заменив алюминий из-за его
превосходная проводимость. - В качестве компонента монет.
- В кухонной посуде, такой как сковороды.
- Большинство столовых приборов (ножи, вилки, ложки) содержат
немного меди (нейзильбер). - Стерлинговое серебро, если оно будет использоваться в столовой посуде,
должен содержать несколько процентов меди.
- В качестве компонента керамических глазурей и для окрашивания
стакан. - Музыкальные инструменты, особенно духовые.
- В качестве биостатического покрытия в больницах и для
линейные части кораблей для защиты от ракушек
и мидии. - Соединения, такие как раствор Фелинга, имеют
приложения по химии. - Сульфат меди (II) используется как яд и
очиститель воды.
История
Медь была известна некоторым древнейшим цивилизациям
зарегистрирована и имеет историю использования, которая находится на
не менее 10 000 лет. Медный кулон был найден
Медный кулон был найден
на территории нынешнего северного Ирака, датируемого 8700 г.
ДО Н.Э. К 5000 г. до н.э. появляются следы выплавки меди,
рафинирование меди из простых оксидов меди
Например, малахит или азурит. Самые ранние признаки
использования золота, напротив, появляются около 4000 г. до н.э.
Есть медные и бронзовые артефакты из Шумера
города, датируемые 3000 г. до н.э., и египетские артефакты
в меди и меди, легированной оловом, почти как
старый. В одной пирамиде медная водопроводная система
было обнаружено, что ему 5000 лет. Египтяне
обнаружил, что добавление небольшого количества олова сделало
металл легче отливать, поэтому встречаются бронзовые сплавы
в Египте почти сразу после обнаружения меди. Использовать
Использовать
меди в древнем Китае датируется как минимум 2000 г.
ДО Н.Э. К 1200 г. до н.э. производились превосходные изделия из бронзы.
в Китае. Обратите внимание, что на эти даты влияет
войны и завоевания, так как медь легко плавится
вниз и повторно использовать. В Европе Эци Ледяной Человек,
был найден хорошо сохранившийся мужчина, датируемый 3200 г. до н.э.
топором с медным наконечником из металла 99,7%
чистый. Высокий уровень мышьяка в его волосах предполагает
занимался выплавкой меди.
Использование бронзы было настолько
эпоха цивилизации, которую он назвал
Бронзовый век. Переходный период в некоторых
регионы между предшествующим периодом неолита
а бронзовый век называют энеолитом,
с использованием некоторых инструментов из меди высокой чистоты
рядом с каменными орудиями.
Латунь, сплав цинка и меди, была известна
грекам, но впервые широко использовалась
римляне.
Медь ассоциировалась с богиней Афродитой/Венерой
в мифологии и алхимии, благодаря своему блестящему
красота, его древнее использование в производстве зеркал,
и его ассоциация с Кипром, которая была священной
к богине. В алхимии символ меди
был также символом планеты Венера.
Биологическая роль
Медь необходима всем высшим растениям и
животные. Медь содержится в различных ферментах,
включая медные центры цитохром с оксидазы,
Cu-Zn-содержащий фермент супероксиддисмутаза,
и является центральным металлом в переносчике кислорода
пигмент гемоцианин. Кровь подковы
Кровь подковы
краб, Limulus polyphemus использует медь
а не железо для транспорта кислорода.
Рекомендуемая суточная доза меди для здоровых взрослых составляет
0,9 мг/день.
Медь в основном переносится кровотоком на
белок плазмы, называемый церулоплазмином. Хотя
когда медь впервые всасывается в кишечнике,
транспортируется в печень в связанном виде с альбумином.
Наследственное заболевание, называемое болезнью Вильсона.
заставляет организм удерживать медь, так как она не
выделяется печенью с желчью. Это заболевание,
при отсутствии лечения может привести к повреждению головного мозга и печени.
Распространение
Медь встречается в виде самородной меди в минеральной форме.
Минералы, такие как карбонаты азурита и малахита
являются источниками меди, как и сульфиды, такие как
халькопирит (CuFeS 2 ), борнит (Cu 5 FeS 4 ),
ковеллит (CuS), халькоцит (Cu 2 S)
и оксиды типа куприта (Cu 2 O).
Соединения
Существуют многочисленные сплавы меди — зеркало
металл представляет собой сплав меди/олова, а латунь представляет собой сплав меди/цинка.
сплав, а бронза представляет собой сплав меди с оловом.
Обычные степени окисления меди включают
медь (I) состояние, Cu +1 и медь
(II) состояние, Cu +2 .
Карбонат меди зеленого цвета, из которого
неповторимый внешний вид покрытых медью крыш или куполов
на некоторых зданиях.
Оксиды меди (например, оксид иттрия-бария-меди
(YBa 2 Cu 3 O 7-´ )
или YBCO) составляют основу многих нетрадиционных
сверхпроводники
Другие соединения : сульфид меди (II)
Изотопы
Два стабильных изотопа, 63 Cu
и 65 Cu вместе с парой десятков
радиоизотопы. Подавляющее большинство радиоизотопов
имеют период полураспада порядка минут или меньше,
самый долгоживущий, 64 Cu, имеет половину
срок службы 12,7 часов, с двумя режимами затухания, ведущий
на два отдельных продукта.
Меры предосторожности
Все соединения меди, за исключением
иначе известные, должны рассматриваться как если бы они
были токсичны. Металл в порошкообразном состоянии
Металл в порошкообразном состоянии
опасность пожара. 30 г сульфата меди потенциально
смертелен для человека. Медь в питьевой воде на
концентрации выше 1 мг/л могут окрашивать
одежду и предметы, выстиранные в воде. Предлагаемый
безопасный уровень меди в питьевой воде для человека
варьируется в зависимости от источника, но, как правило,
ориентировочно 1,5-2 мг/л. DRI терпимо
Верхний уровень потребления диетической меди для взрослых
из всех источников составляет 10 мг/сут.
Горнодобывающая промышленность
Открытый медный рудник Эль-Чино в Нью-Мексико.
Большая часть меди в настоящее время добывается на крупных открытых
шахты в месторождениях, которые содержат менее одного
процентов меди. Примеры включают: Chuquicamata,
Примеры включают: Chuquicamata,
Шахта Чили и Эль Чино в Нью-Мексико.
Медный концентрат обычно содержит от 25 до 30
процентов меди. Медный концентрат получается
продукт после шахтной руды (содержащий менее 1
процентов меди) измельчали, измельчали и концентрировали.
Катодная медь состоит из 99,97% меди в листах
размеры: 96 см х 95 см х 1 см, с массой
около 100 кг. Это настоящий товар и продукт
доставляется на биржи металлов в Нью-Йорке,
Лондон и Шанхай. Химическая спецификация
для электролитической меди — ASTM B 115-00.
Каталожные номера
- Лос-Аламосская национальная лаборатория
— Медь ( http://periodic.lanl.gov/elements/29.html )
Внешняя ссылка
- EnvironmentalChemistry.

