Хим элемент cu: Copper (Cu) — Медь
Содержание
Купрум | это… Что такое Купрум?
Медь / Cuprum (Cu) | |
|---|---|
| Атомный номер | 29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета |
| Свойства атома | |
| Атомная масса (молярная масса) | 63,546 а. е. м. (г/моль) |
| Радиус атома | 128 пм |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 72 (+1e) 96 пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 8,96 г/см³ |
| Удельная теплоёмкость | 24,465 Дж/(K·моль) |
| Теплопроводность | 401 Вт/(м·K) |
| Температура плавления | 1356,6 K |
| Теплота плавления | 13,01 кДж/моль |
| Температура кипения | 2840 K |
| Теплота испарения | 304,6 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 3,615 Å |
| Отношение c/a | n/a |
| Температура Дебая | 315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Содержание
|
История и происхождение названия
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu20 имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн. ) → [CuCl]— (водн.)
) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.

- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах.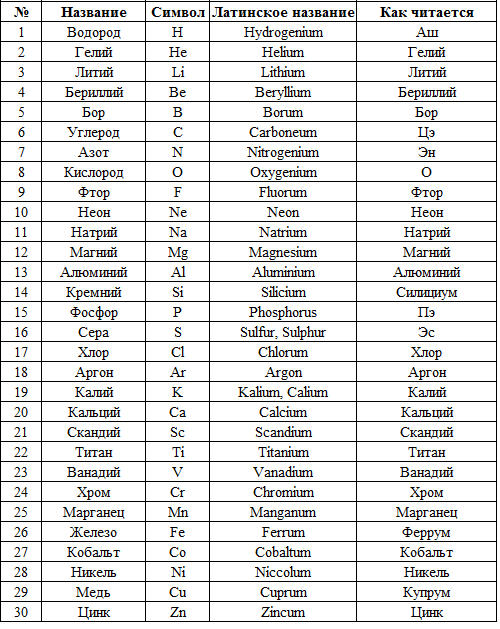 В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2][3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро.
Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Медь в месторождениях
- Российский Центр Меди
- Некоммерческий ресурс о меди (eng)
- Химия в действии, М.
 Фримантл, том 2, изд. «Мир», М. 1991
Фримантл, том 2, изд. «Мир», М. 1991
Периодическая система химических элементов Д. И. Менделеева
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| Uue | Ubn | ||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
Примечания
- ↑ [1]
- ↑ 1 2 3 http://www.
 ecsocman.edu.ru/db/msg/142462.html
ecsocman.edu.ru/db/msg/142462.html - ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
описание химического элемента, свойства и сферы применения
Металлическая медь издавна используется человечеством в самых разных областях жизни. Двадцать девятый элемент из периодической таблицы Д. И. Менделеева , находящийся между никелем и цинком, обладает интересными характеристиками и свойствами. Этот элемент обозначается символом Cu. Это один из немногих металлов с характерной окраской, отличной от серебристого и серого цветов.
- История появления меди
- Способы добычи
- Немного о названии
- Физические свойства металла
- Химические свойства элемента
- Области и особенности применения
- Сплавы меди
- Отрасли промышленности
- Роль в организме человека
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Физические свойства металла
Пожалуй, невозможно понять, что такое металлическая медь, не разобравшись в ее свойствах, основных характеристиках и особенностях.
При контакте с воздухом этот металл становится желтовато-розового цвета. Этот неповторимый золотисто-розовый оттенок обусловливается возникновением на поверхности металла оксидной пленки. Если эту пленку удалить, медь приобретет выразительный розовый цвет с характерным ярким металлическим блеском.
Удивительный факт: тончайшие медные пластинки на просвет имеют вовсе не розовый, а зеленовато-голубой или, иначе говоря, морской цвет.
В форме простого вещества медь обладает следующими характеристиками:
- удивительной пластичностью;
- достаточной мягкостью;
- тягучестью.

Чистая медь без наличия каких-либо примесей превосходно поддается обработке — ее с легкостью можно прокатить в пруток или лист либо вытянуть в проволоку, толщина которой будет доведена до тысячных долей миллиметра. Добавление примесей в этот металл повышает его твердость.
Помимо упомянутых физических характеристик, этот химический элемент обладает высокой электропроводностью. Эта особенность главным образом определила применение металлической меди.
Среди основных свойств этого металла стоит отметить его высокую теплопроводность. По показателям электропроводности и теплопроводности медь является одним из лидеров среди металлов. Более высокими показателями по этим параметрам обладает только один металл — серебро.
Нельзя не принимать во внимание тот факт, что показатели электро- и теплопроводности меди относятся к разряду базовых свойств. Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
- мышьяка;
- железа;
- олова;
- фосфора;
- сурьмы.
Каждая из этих примесей в сочетании с медью оказывает на нее определенное влияние, в результате которого значения тепло- и электропроводности заметно понижаются.
Помимо всего прочего, металлическая медь характеризуется невероятной прочностью, высокой температурой плавления, а также высокой температурой кипения. Данные действительно впечатляют. Температура плавления меди превышает одну тысячу градусов Цельсия! А температура кипения составляет 2570 градусов Цельсия.
Этот металл относится к группе металлов-диамагнетиков. Это значит, что его намагничивание, как и у ряда других металлов, происходит не по направлению внешнего магнитного поля, а против него.
Еще одной немаловажной характеристикой можно назвать отличную устойчивость этого металла к коррозии.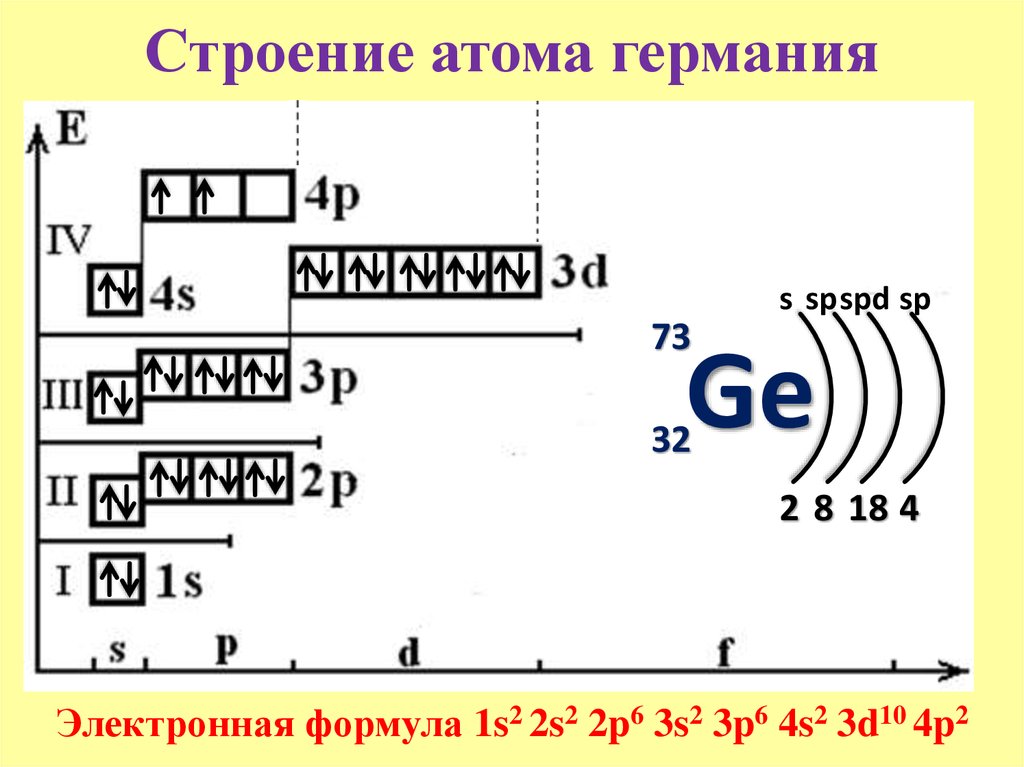 В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
Химические свойства элемента
Данный элемент является малоактивным. При контакте с сухим воздухом в обычных условиях медь не начинает окисляться. Влажный воздух, напротив, запускает окислительный процесс, при котором образуется медный карбонат (II), являющийся верхним слоем патины. Практически моментально этот элемент реагирует с такими веществами, как:
- сера;
- селен;
- галогены.
Кислоты, не обладающие окислительными свойствами, не способны оказывать на медь влияние. Кроме того, она никак не реагирует при контакте с такими химическими элементами, как:
- азот;
- углерод;
- водород.
Кроме уже отмеченных химических свойств, для меди характерна амфотерность. Это значит, что в земной коре она способна образовать катионы и анионы. Соединения этого металла могут проявлять как кислотные свойства, так и основные — это напрямую зависит от конкретных условий.
Области и особенности применения
В древние времена металлическая медь использовалась для изготовления самых разных вещей. Умелое применение этого материала позволило древним людям обзавестись:
- дорогой посудой;
- украшениями;
- инструментами, имеющими тонкое лезвие.
Сплавы меди
Говоря о применении меди, нельзя не упомянуть о ее значении в получении различных сплавов, в основу которых ложится именно этот металл. К таким сплавам относятся:
- бронза;
- латунь.
Две эти разновидности явяются основными видами медных сплавов. Первый бронзовый сплав был создан на Востоке еще за три тысячелетия до нашей эры. Бронза по праву может считаться одним из величайших достижений металлургов древности. По сути, бронза — это соединение меди с прочими элементами. В большинстве случаев в роли второго компонента выступает олово. Но вне зависимости от того, какие элементы входят в сплав, основным компонентом всегда является медь. Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Помимо бронзы и латуни, этот химический элемент участвует в создании сплавов с другими металлами, среди которых алюминий, золото, никель, олово, серебро, титан, цинк. Медные сплавы с неметаллами, такими как кислород, сера и фосфор, используются гораздо реже.
Отрасли промышленности
Ценные свойства медных сплавов и чистого вещества способствовали их использованию в таких отраслях, как:
- электротехника;
- электромашиностроение;
- приборостроение;
- радиоэлектроника.
Но, разумеется, это еще не все области применения этого металла. Он является высокоэкологичным материалом. Именно поэтому он используется при строительстве домов. Например, кровельное покрытие, выполненное из металлической меди, благодаря своей высочайшей коррозийной устойчивости обладает сроком службы более сотни лет, не требуя при этом особого ухода и покраски.
Еще одна область использования этого металла — ювелирная отрасль. В основном он применяется в форме сплавов с золотом. Изделия из медно-золотого сплава характеризуются повышенной прочностью, высокой стойкостью. Такие изделия на протяжении долгого времени не деформируются и не истираются.
Соединения металлической меди выделяются высокой биологической активностью. В мире флоры этот металл имеет важное значение, так как он участвует в синтезе хлорофилла. Участие данного элемента в этом процессе позволяет обнаружить его в числе компонентов минеральных удобрений для растений.
Роль в организме человека
Нехватка этого элемента в человеческом организме может оказать негативное влияние на состав крови, а именно ухудшить его. Восполнить дефицит этого вещества можно при помощи специально подобранного питания. Медь содержится во многих продуктах питания, поэтому составить полезный рацион по душе не составит труда. Для примера, одним из продуктов, в составе которых имеется этот элемент, является обычное молоко.
Но составляя насыщенное этим элементом меню, не следует забывать о том, что переизбыток его соединений может привести к отравлению организма. Поэтому, насыщая организм этим полезным веществом, очень важно не переусердствовать. И касается это не только количества потребляемых продуктов.
К примеру, пищевое отравление может вызвать использование медной посуды. Приготовление пищи в такой посуде крайне не рекомендуется и даже воспрещается. Связано это с тем, что в процессе кипячения в пищу поступает значительное количество этого элемента, что может привести к отравлению.
В запрете на медную посуду есть одна оговорка. Использование такой посуды не представляет опасности в том случае, если ее внутренняя поверхность имеет оловянное покрытие. Только при выполнении этого условия использование медных кастрюлек не несет угрозы пищевого отравления.
Помимо всех перечисленных отраслей применения, распространение этого элемента не обошло стороной и медицину. В сфере лечения и поддержания здоровья он применяется в качестве вяжущего вещества и антисептика. Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
Медь (Cu) — Таблица Менделеева
Медь является химическим элементом периодической таблицы с химическим символом Cu и атомным номером 29 с атомным весом 63,5463 u, классифицируется как переходный металл и входит в группу 11 (металлы для монет). Медь находится в твердом состоянии при комнатной температуре.
Никель Периодическая таблица
Цинк
| Symbol | Cu |
| Atomic number | 29 |
| Group | 11 (Coinage metals) |
| Period | 4 |
| Block | d |
| Classification | Переходный металл |
| Внешний вид | Красно-оранжевый металлический блеск |
| Цвет | Медь |
| Number of protons | 29 p + |
| Number of neutrons | 35 n 0 |
| Number of electrons | 29 e — |
Из Википедии, свободной энциклопедии Медь — химический элемент с символом Cu (от латинского: cuprum) и атомным номером 29. . Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет.
. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет.
| Фаза на STP | SOLI | |||||||||||||||||||||||||
| Плотность | 8,96 г/см 3 | |||||||||||||||||||||||||
| Atomic Weight | 63,54464613 U
Медь: введение в химический элементМедь: введение в химический элемент Вы здесь:
Реклама org/Person»> Криса Вудфорда. Последнее обновление: 3 марта 2022 г. Медь — один из тех материалов, которые мы используем Фото: Благодаря своему уникальному красновато-оранжево-коричневому цвету медь является одним из самых легко узнаваемых металлов. Содержание
Что такое медь? Медь представляет собой относительно мягкий красноватый металл, проводящий тепло и В отличие от металлов, таких как алюминий и титан, Диаграмма: Какие страны производят мировую медь? Расчетные показатели добычи на 2021 год. Источник: Геологическая служба США, Обзоры полезных ископаемых: медь, январь 2022 г. Производство меди Если вы управляете медным рудником, большая часть руды Фото: Открытый медный рудник в Карр-Форк, Бингем-Каньон, Юта, США. Фото Как правило, процесс начинается с дробления руды на очень мелкие Рекламные ссылки На что похожа медь? Медь, которую вы получите после завершения процесса аффинажа Фото: Образец меди. Фото Горного управления США, предоставлено Геологической службой США. Физические свойства Физически медь очень хорошо проводит тепло и электричество (в других Соединения меди Хотя медь довольно неактивна, она может производить широкий спектр Медные сплавыФото: навесной замок, основная часть которого (золотая часть внизу) сделана из латуни, прочного сплава меди и цинка. Он прочный, атмосферостойкий и относительно недорогой. Медные сплавы получают путем смешивания меди с одним или несколькими другими Для чего используется медь? Фото: Вы можете увидеть много медных проводов в этом То, для чего мы можем использовать материалы, зависит от физических и Таблица: Для чего мы используем медь? Использование меди (и медных сплавов) в Соединенных Штатах в 2021 г. Источник: данные Ассоциации развития меди, Inc., приведенные в USGS Mineral Commodity Summarys: Copper, January 2022. Краткие факты Фото: Большая часть меди используется в строительстве, часто вне поля зрения в таких вещах, как трубы отопления, но иногда и в очень декоративных целях, как, например, этот чудесный лифт из латуни и меди в бывшем здании Федерального окружного суда в Тексаркане, Техас.
Медь Работа: Периодическая таблица химических элементов, показывающая положение меди. Основные данные
Узнайте большеНа этом сайте
На других сайтах
Статьи
КнигиДля читателей старшего возраста
Для младших читателей
Пожалуйста, НЕ копируйте наши статьи в блоги и другие веб-сайты. Статьи с этого веб-сайта зарегистрированы в Бюро регистрации авторских прав США. Копирование или иное использование зарегистрированных произведений без разрешения, удаление этого или других уведомлений об авторских правах и/или нарушение смежных прав может повлечь за собой серьезные гражданские или уголовные санкции. Авторские права на текст © Chris Woodford 2008, 2022. Все права защищены. Полное уведомление об авторских правах и условия использования. Подпишитесь на насОцените эту страницуПожалуйста, оцените эту страницу или оставьте отзыв, и я сделаю пожертвование WaterAid. Сохранить или поделиться этой страницейНажмите CTRL + D, чтобы добавить эту страницу в закладки на будущее или рассказать о ней своим друзьям: Цитировать эту страницу Вудфорд, Крис. (2008/2022) Медь. Получено с https://www. |

 0141 (a mildly basic oxide)
0141 (a mildly basic oxide) Он очень быстро и эффективно проводит тепло, поэтому его часто используют для
Он очень быстро и эффективно проводит тепло, поэтому его часто используют для
 Процесс обычно занимает
Процесс обычно занимает
 Может быть
Может быть

 )
)