Каковы области применения воды углекислого газа алюминия меди: Каковы области применения: а) воды: б) углекислого газа; в) алюминия; г) меди; д) серебра?
Содержание
Как производится алюминий
Сайт об алюминии
Несмотря на то, что алюминий самый распространенный металл на нашей планете, в чистом виде на Земле его не встретить. Из-за высокой химической активности атомы алюминия легко образуют соединения с другими веществами. При этом «крылатый металл» нельзя получить плавлением руды в печи, как это происходит, например, с железом. Процесс получения алюминия значительно сложнее и основан на использовании электричества огромной мощности. Поэтому алюминиевые заводы всегда строятся рядом с крупными источниками электроэнергии – чаще всего гидроэлектростанциями, не загрязняющими окружающую среду. Но обо всем по порядку.
- Бокситы
- Глинозем
- Криолит
- Алюминий
- Литейное производство
- Новые технологии
- Переработка
«В природе ничто не возникает мгновенно и ничто не появляется в свете в совершенно готовом виде».
Александр Герцен
русский публицист, писатель
Добыча бокситов
Производство металла делится на три основных этапа: добыча бокситов – алюминийсодержащей руды, их переработка в глинозем – оксид алюминия, и, наконец, получение чистого металла с использованием процесса электролиза – распада оксида алюминия на составные части под воздействием электрического тока. Из 4-5 тонн бокситов получается 2 тонны глинозема, из которого производят 1 тонну алюминия.
В мире существуют несколько видов алюминиевых руд, но основным сырьем для производства этого металла являются именно бокситы. Это горная порода, состоящая, в основном, из оксида алюминия с примесью других минералов. Боксит считается качественным, если он содержит более 50% оксида алюминия.
Запасы бокситов
Общие мировые подтвержденные запасы бокситов оцениваются в 18,6 миллиардов тонн. При нынешнем уровне добычи это обеспечивает потребность в алюминий больше, чем на сто лет.
Бокситы могут сильно отличаться друг от друга. По структуре они бывают твердые и плотные либо рыхлые и рассыпчатые. По цвету – как правило, кирпично-красные, рыжеватые или коричневые из-за примеси оксида железа. При небольшом содержании железа бокситы имеют белый или серый цвет. Но иногда встречаются руды желтого, темно-зеленого цвета и даже пестрые – с голубыми, красно-фиолетовыми или черными прожилками.
Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – из них 73% приходится на пять стран: Гвинею, Бразилию, Ямайку, Австралию и Индию. В Гвинее бокситов больше всего – 5,3 миллиарда тонн (28,4%), при этом они высокого качества, содержат минимальное количество примесей и залегают практически на поверхности.
Крупнейшие страны по добыче бокситов, 2014 год
Чаще всего добыча бокситов ведется открытым способом – специальной техникой руду «срезают» слой за слоем с поверхности земли и транспортируют для дальнейшей переработки. Однако в мире есть места, где алюминиевая руда залегает очень глубоко, и для ее добычи приходится строить шахты – одна из самых глубоких шахт в мире «Черемуховская-Глубокая» находится в России, на Урале, ее глубина – 1550 метров.
Однако в мире есть места, где алюминиевая руда залегает очень глубоко, и для ее добычи приходится строить шахты – одна из самых глубоких шахт в мире «Черемуховская-Глубокая» находится в России, на Урале, ее глубина – 1550 метров.
Производство глинозема
Следующим этапом является производственной цепочки является переработка бокситов в глинозем – это оксид алюминия Al2O3, который представляет собой белый рассыпчатый порошок. Основным способом получения глинозема в мире является метод Байера, открытый более ста лет назад, но актуальный до сих пор – около 90% глинозема в мире производятся именно так. Этот способ весьма экономичен, но использовать его можно только при переработке высококачественных бокситов со сравнительно низким содержанием примесей – в первую очередь кремнезема.
Метод Байера основан на следующем: кристаллическая гидроокись алюминия, входящая в состав боксита, хорошо растворяется при высокой температуре в растворе едкого натра (каустической щёлочи, NaOH) высокой концентрации, а при понижении температуры и концентрации раствора вновь кристаллизуется. Посторонние, входящие в состав боксита (так называемый балласт), не переходят при этом в растворимую форму или перекристаллизовываются и выпадают в осадок до того, как производится кристаллизация гидроокиси алюминия. Поэтому после растворения гидроокиси алюминия балласт легко может быть отделен – он называется красный шлам.
Посторонние, входящие в состав боксита (так называемый балласт), не переходят при этом в растворимую форму или перекристаллизовываются и выпадают в осадок до того, как производится кристаллизация гидроокиси алюминия. Поэтому после растворения гидроокиси алюминия балласт легко может быть отделен – он называется красный шлам.
Красный шлам
Это густая масса красно-бурого цвета, состоящая из соединений кремния, железа, титана и других элементов. Его складируют на тщательно изолированных территориях – шламохранилищах. Их обустраивают таким образом, чтобы содержащиеся в отходах щёлочи не проникали в грунтовые воды. Как только хранилище отрабатывает свой потенциал, территорию можно вернуть в первоначальный вид, покрыв её песком, золой или дёрном и посадив определённые виды деревьев и трав. На полное восстановление могут уйти годы, но в итоге местность возвращается в изначальное состояние.
Многие специалисты не считают красный шлам отходом, так как он может служить сырьем для переработки. Например, из него извлекают скандий для дальнейшего производства алюминиево-скандиевых сплавов. Скандий придает таким сплавом особую прочность, сферы использования – автомобиле- и ракетостроение, спортивная экипировка, производство электропроводов.
Например, из него извлекают скандий для дальнейшего производства алюминиево-скандиевых сплавов. Скандий придает таким сплавом особую прочность, сферы использования – автомобиле- и ракетостроение, спортивная экипировка, производство электропроводов.
Также красный шлам может использоваться для производства чугуна, бетона, получения редкоземельных металлов.
Крупные частицы гидроксида алюминия легко отделяются от раствора фильтрованием, их промывают водой, высушивают и кальцинируют – то есть нагревают для удаления воды. Так получают глинозем.
Нефелин
Бокситы – самое распространенное, но не единственное сырье для производства глинозема. Его также можно получить из нефелина. В природе он встречается в виде апатито-нефелиновых пород (апатит – материал из группы фосфорнокислых солей кальция). В процессе производства глинозема из нефелина также получают сода, поташ (используется в строительном секторе, производстве бытовой химии, кондитерской промышленности и так далее), редкий металл галлий. А из отходов производства – белого шлама – высококачественный цемент. Чтобы получить 1 тонну глинозема в среднем требуется 4 тонны нефелина и 7,5 тонн известняка.
А из отходов производства – белого шлама – высококачественный цемент. Чтобы получить 1 тонну глинозема в среднем требуется 4 тонны нефелина и 7,5 тонн известняка.
У глинозема нет срока годности, но хранить его непросто, так как при малейшей он возможности активно впитывает влагу – поэтому производители предпочитают как можно быстрее отправлять его на алюминиевое производство. Сначала глинозем складывают в штабели весом до 30 тысяч тонн – получается своеобразный слоеный пирог высотой до 10-12 метров. Потом пирог «нарезают» и грузят для отправки в железнодорожные вагоны – в среднем, в один вагон от 60 до 75 тонн (зависит от вида самого вагона).
Существует еще один, гораздо менее распространенный способ получения глинозема – метод спекания. Его суть заключается в получения твердых материалов из порошкообразных при повышенной температуре. Бокситы спекают с содой и известняком – они связывают кремнезем в нерастворимые в воде силикаты, которые легко отделить от глинозема. Этот способ требует больших затрат, чем способ Байера, но в то же время дает возможность перерабатывать бокситы с высоким содержанием вредных примесей кремнезема.
Этот способ требует больших затрат, чем способ Байера, но в то же время дает возможность перерабатывать бокситы с высоким содержанием вредных примесей кремнезема.
Криолит
Ивиттуут
Одно из единичных месторождений природного криолита на Земле. Расположено в Гренландии и было обнаружено в 1799 году. Добыча криолита прекратилась там в 1987 году, когда был изобретен способ искусственного получения этого редкого минерала. Позднее криолит был найден в Ильменских горах на Южном Урале (Миасс) и в штате Колорадо (США).
Глинозем выступает непосредственным источником металла в процессе производства алюминия. Но для создания среды, в которой этот процесс будет происходить, необходим еще один компонент – криолит.
Это редкий минерал из группы природных фторидов состава Na3AlF6. Обычно он образует бесцветные, белые или дымчато-серые кристаллические скопления со стеклянным блеском, иногда – почти черные или красновато-коричневые. Криолит хрупкий и легко плавится.
Природных месторождений этого минерала крайне мало, поэтому в промышленности используется искусственный криолит. В современной металлургии его получают взаимодействием плавиковой кислоты с гидроксидом алюминия и содой.
Производство алюминия
Итак, мы добыли боксит, получили из него глинозем, запаслись криолитом. Все готово для последней стадии – электролизу алюминия. Электролизный цех является сердцем алюминиевого завода и не похож на цеха других металлургических предприятий, производящих, например, чугун или сталь. Он состоит из нескольких прямоугольных корпусов, протяженность которых зачастую превышает 1 км. Внутри рядами установлены сотни электролизных ванн, последовательно подключенных массивными проводами к электричеству. Постоянное напряжение на электродах каждой ванны находится в диапазоне всего 4-6 вольт, в то время как сила тока составляет 300 кА, 400 кА и более. Именно электрический ток является здесь главной производственной силой – людей в этом цехе крайне мало, все процессы механизированы.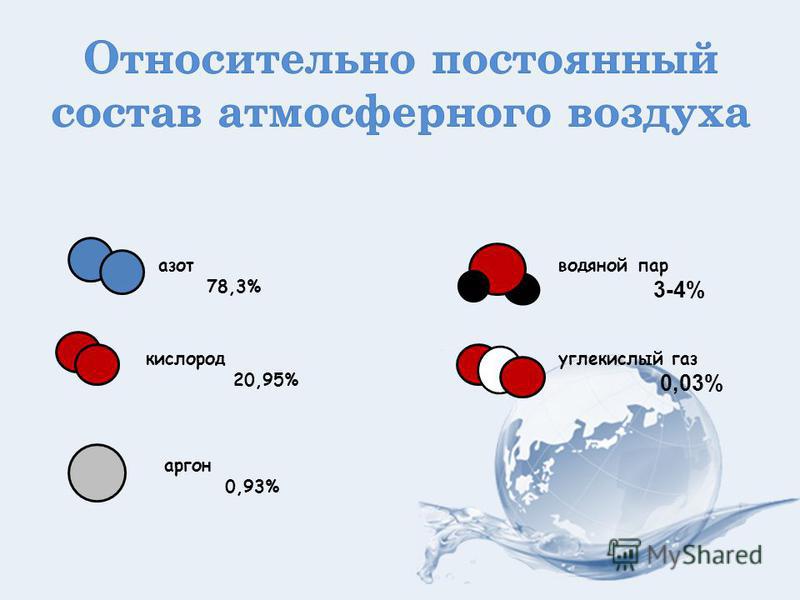
Ток для производства алюминия
Для запуска двигателя автомобильный аккумулятор должен обеспечить электрический ток в 300-350 А в течение 30 секунд. То есть в 1000 раз меньше, чем нужно одному электролизеру для постоянной работы.
В каждой ванне происходит процесс электролиза алюминия. Емкость ванны заполняется расплавленным криолитом, который создает электролитическую (токопроводящую) среду при температуре 950°С. Роль катода выполняет дно ванны, а анода – погружаемые в криолит угольные блоки длиной около 1,5 метров и шириной 0,5 метра, со стороны они выглядят как впечатляющих размеров молот.
Каждые полчаса при помощи автоматической системы подачи глинозема в ванну загружается новая порция сырья. Под воздействием электрического тока связь между алюминием и кислородом разрывается – алюминий осаждается на дне ванны, образуя слой в 10-15 см, а кислород соединяется с углеродом, входящим в состав анодных блоков, и образует углекислый газ.
Примерно раз в 2-4 суток алюминий извлекают из ванны при помощи вакуумных ковшей. В застывшей на поверхности ванны корке электролита пробивают отверстие, в которое опускают трубу. Жидкий алюминий по ней засасывается в ковш, из которого предварительно откачан воздух. В среднем, из одной ванны откачивается около 1 тонны металла, а в один ковш вмещается около 4 тонн расплавленного алюминия. Далее этот ковш отправляется в литейное производство.
При производстве каждой тонны алюминия выделяется 280 000 м3 газов. Поэтому каждый электролизер независимо от его конструкции оснащен системой газосбора, которая улавливает выделяющиеся при электролизе газы и направляет их в систему газоочистки. Современные «сухие» системы газоочистки для улавливания вредных фтористых соединений используют ни что иное, а глинозем. Поэтому перед тем как использоваться для производства алюминия, глинозем на самом деле сначала участвует в очистке газов, которые образовались в процессе производства металла ранее. Вот такой замкнутый цикл.
Вот такой замкнутый цикл.
Для процесса электролиза алюминия требуется огромное количество электроэнергии, поэтому важно использовать возобновляемые и не загрязняющие окружающую среду источники этой энергии. Чаще всего для этого используются гидроэлектростанции – они обладают достаточной мощностью и не имеют выбросов в атмосферу. Например, в России 95% алюминиевого мощностей обеспечены гидрогенерацией. Однако есть в места в мире, где угольная генерация пока доминирует – в частности, в Китае на нее приходится 93% производства алюминия. В результате для производства 1 тонны алюминия с использованием гидрогенерации в атмосферу выделяется чуть более 4 тонн углекислого газа, а при использовании угольной генерации – в пять раз больше – 21,6 тонны.
Углекислый газ
Для сравнения — за один солнечный день 1 гектар леса поглощает из воздуха 120-280 кг углекислого газа и выделяет 180-200 кг кислорода.
Литейное производство
Расплавленный алюминий в ковшах доставляется в литейный цех алюминиевого завода. На этой стадии металл все еще содержит небольшое количество примесей железа, кремния, меди и других элементов. Но даже доли процента, приходящиеся на примеси, могут изменить свойства алюминия, поэтому здесь их удаляют методом переплавки в специальной печи при температуре 800°С. Полученный чистый алюминий разливают в специальные формы, в которых металл приобретает свою твердую форму.
На этой стадии металл все еще содержит небольшое количество примесей железа, кремния, меди и других элементов. Но даже доли процента, приходящиеся на примеси, могут изменить свойства алюминия, поэтому здесь их удаляют методом переплавки в специальной печи при температуре 800°С. Полученный чистый алюминий разливают в специальные формы, в которых металл приобретает свою твердую форму.
Самые маленькие слитки алюминия называются чушками, они имеют вес 6 до 22,5 кг. Получив алюминий в чушках, потребители вновь расплавляют его и придают тот состав и форму, которые требуются для их целей.
Самые большие слитки – 30-тонные параллелепипеды длиной 11,5 метров. Их изготавливают в специальных формах, уходящих в землю на примерно 13 метров. Горячий алюминий заливается в нее в течение двух часов – слиток «растет» в форме как сосулька, только в обратном направлении. Одновременно его охлаждают водой и к моменту завершения выливки он уже готов к дальнейшей транспортировке. Прямоугольные слитки называются слябами (от англ. slabs) – они используются для проката в тонкие листы и производства алюминиевой фольги, банок для напитков или, к примеру, автомобильных кузовов.
Прямоугольные слитки называются слябами (от англ. slabs) – они используются для проката в тонкие листы и производства алюминиевой фольги, банок для напитков или, к примеру, автомобильных кузовов.
Алюминий в форме цилиндрических слитков достигает в длину 7 метров – их используют для экструзии, то есть выдавливание через отверстие необходимой формы. Именно так производится большая часть алюминиевых изделий.
В литейном цехе алюминию придают не только разные формы, но и состав. Дело в том, что в чистом виде этот металл используется гораздо реже, чем в виде сплавов.
Сплавы производятся путем введения в алюминий различных металлов (так называемых легирующих добавок) – одни повышает его твердость, другие плотность, третьи приводят к изменению его теплопроводности и т.д. В качестве добавок используются бор, железо, кремний, магний, марганец, медь, никель, свинец, титан, хром, цинк, цирконий, литий, скандий, серебро и др. Кроме этих элементов, в алюминиевых сплавах могут присутствовать еще около десятка легирующих добавок, таких как стронций, фосфор и другие, что значительно увеличивает возможное число сплавов. На сегодняшний день в промышленности используется свыше 100 марок алюминиевых сплавов.
На сегодняшний день в промышленности используется свыше 100 марок алюминиевых сплавов.
Новые технологии
Производители алюминия постоянно совершенствуют свои технологии, дабы научиться производить металл наилучшего качества с наименьшими затратами и минимальным воздействием на экологию. Уже сконструированы и работают электролизеры, мощность силы тока у который по 400 и 500кА, модернизируются электролизеры прошлых поколений.
Одна из передовых мировых разработок – производство металла с использованием инертного анода. Эта уникальная революционная технология позволит алюминщикам отказаться от использования угольных анодов. Инертный анод, упрощенно говоря, вечен, но что самое важное – при его использовании в атмосферу выделяется не углекислый газ, а чистейший кислород. Причем 1 электролизная ванна сможет вырабатывать столько же кислорода, сколько 70 га леса. Пока эта технология секретна и проходит промышленные испытания, но кто знает – может быть, в будущем она сделает из алюминиевой промышленности еще одни легкие нашей планеты.
Переработка
Алюминий обладает полезным свойством – не терять своих свойств в процессе использования, поэтому изделия из него могут подвергаться переплавке и вторичной переработке в уже новые изделия. Это позволяет сохранить ту колоссальную энергию, затраченную на производство алюминия впервые.
По расчетам Международного алюминиевого института с 1880 года в мире произведен почти 1 млрд тонн алюминия и три четверти всего этого объема до сих пор используется. Около 35% в зданиях и сооружениях, 30% – в электрических кабелях и оборудовании и 30% – в транспорте.
Здания и сооружения
Электрические кабели
Транспорт
По всему миру собирают отходы алюминия – в быту это, в основном, алюминиевые банки из-под напитков. Подсчитано, что 1 кг собранных и сданных в переработку банок позволяет сэкономить 8 кг боксита, 4 кг различных фторидов и 14 кВт/ч электроэнергии. Кроме этого, это позволяет существенно сократить экологический урон от все разрастающихся свалок. Развитие экологической ответственности делает все более популярной идею раздельного сбора мусора во всем мире.
Кроме этого, это позволяет существенно сократить экологический урон от все разрастающихся свалок. Развитие экологической ответственности делает все более популярной идею раздельного сбора мусора во всем мире.
Алюминиевая банка – самый часто перерабатываемый продукт. Примерно через 6 недель после использования они вновь оказываются на полках магазинов.
Ежегодно в мире производится более 220 млрд банок для напитков, в Европе 90% из них вторично перерабатываются – причем зачастую снова в банки, поэтому именно алюминиевую банку называют вечной. Но переработать можно что угодно – и корпуса автомобилей, и использованную фольгу для запекания, и раму велосипеда.
В статье использованы фотоматериалы © Shutterstock и © Rusal.
Алюминий и сплавы. Свойства.
Свойства алюминия
Алюминий и его сплавы имеют малую плотность 2,64— 2,89 г/см3. Прочностные же свойства зависят от легирования, термической обработки, степени деформирования и могут достигать высоких значений. По прочности многие алюминиевые сплавы не уступают конструкционным сталям.
По прочности многие алюминиевые сплавы не уступают конструкционным сталям.
Чистый алюминий (суммарное содержание примесей не более 0,05%) имеет гранецентрированную кубическую решетку с параметрами 4,04 А. Температура его плавления 659,8—660,2° С, температура кипения 1800—2500° С.
Для сплавов алюминия электропроводность составляет 30—50% электропроводности меди, а для чистого алюминия 62—65% электропроводности меди.
Алюминий окисляется с образованием окисной пленки Аl203, которая защищает его от дальнейшего окисления,Химический состав деформируемых и литейных алюминиевых сплавов по ГОСТам 4784—65 и 2685—63.
Из алюминиевых сплавов в основном изготовляют конструкции, работающие при сравнительно низких температурах не свыше 350° С. Так дуралюмин используют для работы при температурах не более 200° С, сплавы типа В95 до 125° С, авиали до 80—100° С при длительной работе и до 200° С при кратковременной. Специальные сплавы САП (спеченный алюминиевый порошок) применяют и для работы при более высоких температурах. До температуры 100° С кратковременные механические свойства меняются мало. Обращает внимание высокое относительное удлинение алюминиевых сплавов при низких температурах.
До температуры 100° С кратковременные механические свойства меняются мало. Обращает внимание высокое относительное удлинение алюминиевых сплавов при низких температурах.
Характеристики длительной прочности термически не упрочняемых сплавов обычно ниже, чем термически упрочняемых.
Длительные выдержки сплавов типа авиаль при температурах свыше 80—100° С приводят к их упрочнению и снижению пластических свойств. Исследованиями, проведенными авторами, установлено, что относительное удлинение снижается при указанных условиях с 20—25% (исходное состояние после закалки и естественного старения) до 1—2%. Подобное ухудшение свойств, при которых возможно хрупкое разрушение конструкций, является существенным препятствием применения сплавов такого типа для работы при температурах выше 80° С.
Циклическая прочность
Циклическая прочность деформируемых сплавов при симметричном изгибе на базе 5*108циклов составляет 3,5 кГ/мм2 для сплава А ДМ, 4,2—6,3 кГ/мм2 для сплава АДН, 5—6,5 кГ/мм2 для сплава АМцАМ, 15 кГ/мм2 для сплава В95.
Области применения литейных сплавов различны. Сплавы группы I рекомендуют для литья в песчаные формы, кокиль и для литья под давлением. Сплав АЛ22 обычно применяют в закаленном состоянии, а сплав АЛ23 и АЛ29 — в литом. Сплавы группы II имеют высокие литейные свойства благодаря наличию в сплавах двойной эвтектики, которая уменьшает также литейную усадку и склонность к образованию горячих трещин. Сплавы AЛ2, АЛ4 и АЛ9 обладают повышенной коррозионной стойкостью, поэтому их применяют для изделий, работающих во влажной и морской средах. С целью получения заданных механических свойств отливки подвергают термической обработке по различным режимам.
Сплавы группы III обладают высокими механическими свойствами, особенно пределом текучести и повышенной жаропрочностью. У этих сплавов пониженные литейные свойства и коррозионная стойкость, кроме того, они склонны к образованию горячих трещин. Для выполнения отливок сложной формы такие сплавы не рекомендуют. Сплав АЛ7 применяют для деталей, испытывающих средние нагрузки и температуры не свыше 200° С. Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
Сплавы группы IV применяют для всех способов литья. По литейным свойствам они менее технологичны, чем сплавы II.
Сплавы группы V применяют для самых разнообразных деталей, работающих при высоких температурах. К этой группе относятся также самозакаливающиеся сплавы.
Механические свойства
Механические свойства всех вышеуказанных, литейных сплавов зависят от режимов термической обработки, определяющей структурное и фазовое состояние сплавов.
Высокая коррозионная стойкость алюминия объясняется образованием окисиой пленки Аl203. Коррозионная стойкость алюминия зависит от влияния агрессивной среды на растворимость защитной окисной пленки, от чистоты обработки поверхности и режима термической обработки. Чистый алюминий обладает высокой стойкостью в сухом и влажном воздухе. В азотной кислоте концентрации 30—50% при увеличении температуры скорость коррозии алюминия возрастает. При концентрации азотной кислоты выше 80% коррозия резко снижается. Алюминий обладает высокой стойкостью в разбавленной серной кислоте и в концентрированной при 20° С. Средние концентрации серной кислоты (более 40%) наиболее опасны для алюминия. При комнатных температурах алюминий устойчив в фосфорной и уксусных кислотах. Такие, как муравьиная, щавелевая, трихлоруксусная и другие хлороорганические кислоты значительно разрушают алюминий. В растворах едких щелочей окисная пленка алюминия растворяется. Растворы углекислых солей калия и натрия оказывают меньшее влияние на скорость коррозии алюминия.
В азотной кислоте концентрации 30—50% при увеличении температуры скорость коррозии алюминия возрастает. При концентрации азотной кислоты выше 80% коррозия резко снижается. Алюминий обладает высокой стойкостью в разбавленной серной кислоте и в концентрированной при 20° С. Средние концентрации серной кислоты (более 40%) наиболее опасны для алюминия. При комнатных температурах алюминий устойчив в фосфорной и уксусных кислотах. Такие, как муравьиная, щавелевая, трихлоруксусная и другие хлороорганические кислоты значительно разрушают алюминий. В растворах едких щелочей окисная пленка алюминия растворяется. Растворы углекислых солей калия и натрия оказывают меньшее влияние на скорость коррозии алюминия.
Алюминий при температурах до 300° С обладает хорошей стойкостью в жидких металлических средах, например, натрии.
Коррозионная стойкость алюминия в воде и водяном паре при повышенных температурах (выше 200° С) зависит от чистоты алюминия. Если происходит движение среды, то скорость коррозии повышается в 10—60 раз.
Основными видами коррозии алюминиевых сплавов является межкристаллитная коррозия и коррозия под напряжением. Для повышения коррозионных свойств применяют защитные покрытия, такие, как плакирование, оксидные пленки, лакокрасочные покрытия, смазки, хромовые или никель-хромовые гальванические покрытия.
Технология производства
Технология производства и термическая обработка могут оказывать существенное влияние на коррозионные свойства сплавов. Сплавы АД, АД1, АМц, АМг2 и АМгЗ мало чувствительны к методам производства. Коррозионная стойкость сплавов АМг5, АМгб во многом зависит от методов производства. У этих сплавов при длительном нагреве на 60—70° С проявляется склонность к межкристаллитной коррозии и коррозии под напряжением.
Сплавы Д1, Д18, Д16 и типа В95 имеют пониженную коррозионную стойкость. Подобные сплавы применяют с соответствующей защитой от коррозии. Сплавы типа авиаль обладают высокой коррозионной стойкостью в воде высокой чистоты с добавлением углекислого газа при температурах до 100° С.
При изучении влияния облучения на некоторые характеристики алюминия установлено, что после облучения интегральным потоком 1,1 х 1019 нейтрон/см2 при 80° С критическое напряжение сдвига увеличивается в 5 раз. При этом электросопротивление алюминия повышается на 30%. Влияние облучения на электрическое и критическое сопротивления сдвигу снимается при температуре около 60° С.
Из разработанных свариваемых, термически обрабатываемых, самозакаливающихся при сварке сплавов, наиболее характерны сплавы системы Аl—Zn—Mg. Однако, обладая удовлетворительными прочностными свойствами, они склонны к коррозии под напряжением и замедленному разрушению. Такая склонность вызвана переходом от зонной к фазовой стадии старения даже при комнатных температурах эксплуатации сварных соединений. Поэтому сплавы системы Аl—Zn-Mg можно применять в условиях низких температур, исключающих переход к фазовому старению при низком уровне сварочных напряжений. Содержание цинка и магния должно быть при этом минимальным.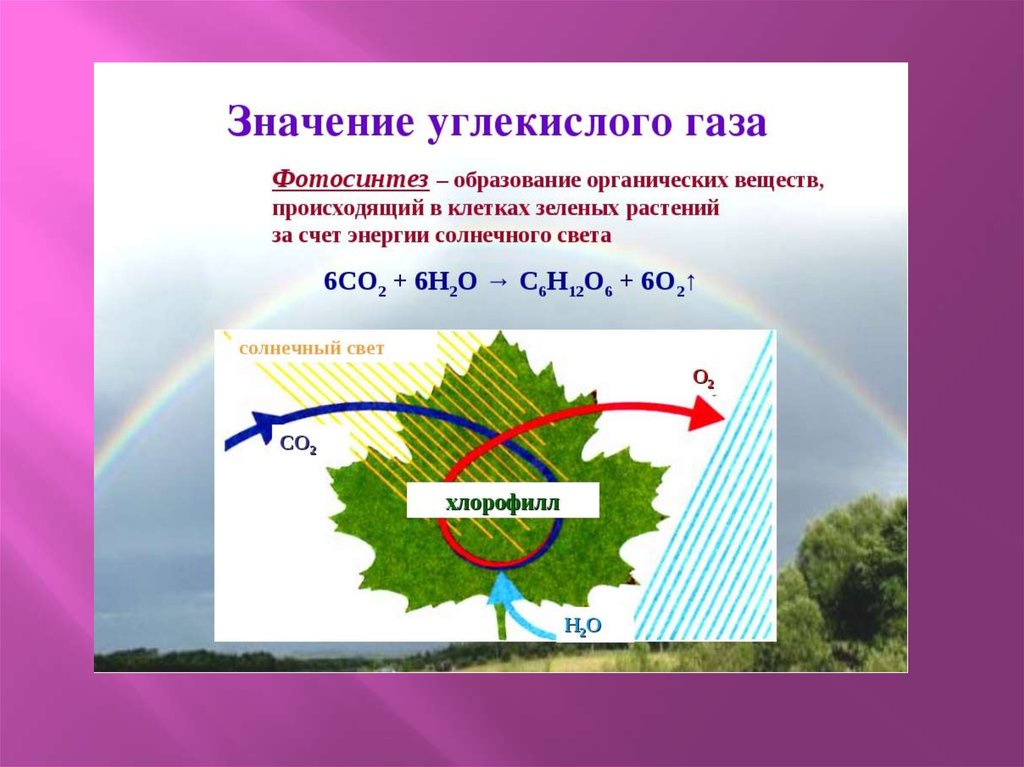
Высокая стойкость
К самозакаливающимся сплавам относится сплав 01911, по химическому составу он является среднелегированным сплавом системы Аl—Zn-Mg. Высокая стойкость против коррозии под напряжением обеспечивается суммарным содержанием цинка и магния до 6,5% и дополнительным введением марганца, хрома, меди и циркония. Причем медь ухудшает свариваемость сплава, поэтому для его сварки применяют проволоку марки 01557, аналогичную по химическому составу сплаву АМг5, но с добавкой циркония й хрома. Сплавы Д20 и АК8 достаточно прочны, но имеют низкую общую коррозионную стойкость. Они обладают высокой стойкостью против коррозии под напряжением и замедленного разрушения.
Перспективными являются спеченные сплавы. К числу жаростойких относятся сплавы типа САП, которые можно применять для конструкций, работающих при температурах до 400—500° С. САП содержит до 13% тугоплавкой окисной фазы, поэтому температура плавления его очень высокая (2000° С).
Из сплавов САП-1 (6,0—9,0% А1203) и САП-2 (9,1 — 13,0% А1203) изготовляют такие же полуфабрикаты, как из алюминиевых сплавов. Сплав САП-3 применяют только для прессованных полуфабрикатов. Наибольшая масса прессованных полуфабрикатов до 400 кг. Размеры изготовляемых листов 1000 X Х7000 мм при толщине от 0,8 до 10 мм.
Сплав САП-3 применяют только для прессованных полуфабрикатов. Наибольшая масса прессованных полуфабрикатов до 400 кг. Размеры изготовляемых листов 1000 X Х7000 мм при толщине от 0,8 до 10 мм.
Сплавы имеют высокие прочностные свойства. Так у сплава САП-1 при 20° С ов = 35 кГ/мм2, а у САП-3 40 кГ/мм2. Подобными свойствами обладает сплав САС-1 (25—30% Si и 7% Nі), получаемый из распыленного порошка. Он износостоек, достаточно прочен (<та = 25,0-28,0 кГ/мм2), имеет коэффициент линейного расширения, близкий к стали, и высокий модуль упругости.
Сплавы САС-1 и САП не склонны к коррозии под напряжением и замедленным разрушениям. Сплав САП можно применять при сравнительно высоких температурах эксплуатации. При сварке этих сплавов обычно применяют присадочную проволоку марки АМг6.
Материалы с сатйа: http://ruswelding.com
алюминий | Использование, свойства и соединения
алюминий
Посмотреть все СМИ
- Ключевые люди:
- Ганс Кристиан Эрстед
Эмиль Ратенау
Фридрих Вёлер
Чарльз Мартин Холл
- Похожие темы:
- химический элемент
обработка алюминия
элемент группы бора
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
алюминий (Al) , также пишется как алюминий , химический элемент, легкий серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы.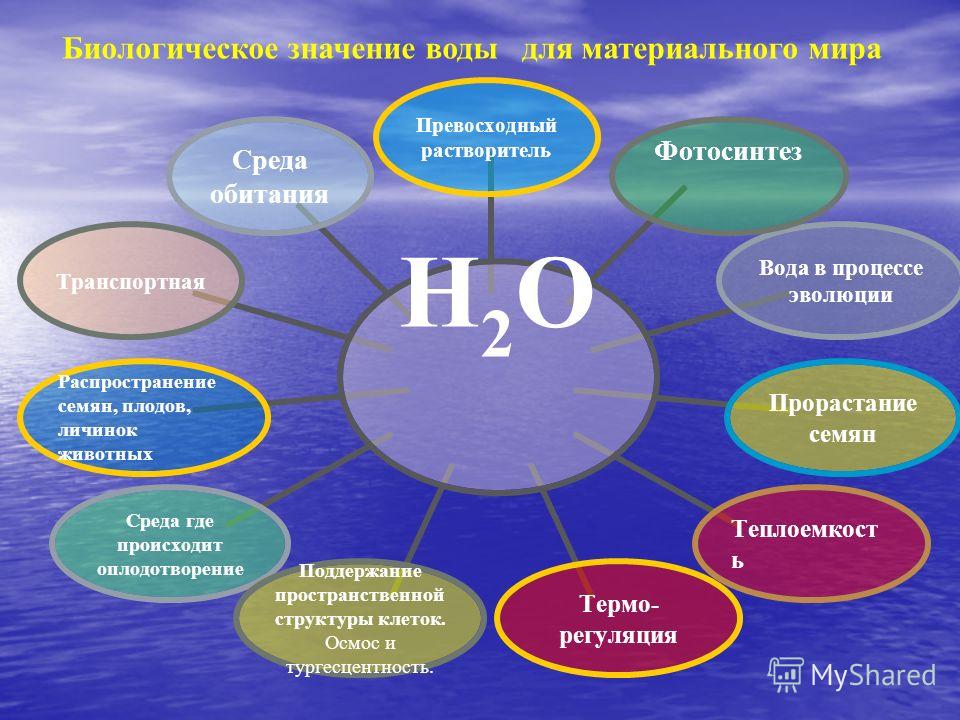 Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0029 alumen , used to describe potash alum, or aluminum potassium sulfate, KAl(SO 4 ) 2 ∙12H 2 O.
Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0029 alumen , used to describe potash alum, or aluminum potassium sulfate, KAl(SO 4 ) 2 ∙12H 2 O.
| atomic number | 13 |
|---|---|
| atomic weight | 26.9815384 |
| melting point | 660 °C (1,220 °F) |
| boiling point | 2,467 °C (4,473 °F) |
| specific gravity | 2. 70 (at 20 °C [68 °F]) 70 (at 20 °C [68 °F]) |
| valence | 3 |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 S 2 3 P 1 |
ВОССТАНОВЛЕНИЕ И ИСТОРИЯ
Алюминий встречается в неганящих породах, главным образом, в том числе в алюминосиликации в Felds, Feldspath, и алюминосиликации в Felds, FELDSID; в полученной из них почве в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов. Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
До 5000 г. до н.э. люди в Месопотамии делали прекрасную керамику из глины, которая состояла в основном из соединения алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химических веществах и лекарствах. Плиний ссылается на квасцы, теперь известные как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле. Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Христианом Эрстедом путем восстановления хлорида алюминия амальгамой калия. Британский химик сэр Хамфри Дэви приготовил (1809 г.) железо-алюминиевый сплав путем электролиза плавленого оксида алюминия (оксида алюминия) и уже назвал этот элемент алюминием; слово позже было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Вёлер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Немецкий химик Фридрих Вёлер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Новый металл был представлен публике (1855 г.) на Парижской выставке примерно в то же время, когда он стал доступен (в небольших количествах за большие деньги) путем восстановления натрием расплавленного хлорида алюминия в процессе Девиля. Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Шарль Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г.) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0031 2 O 3 ), растворенный в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см.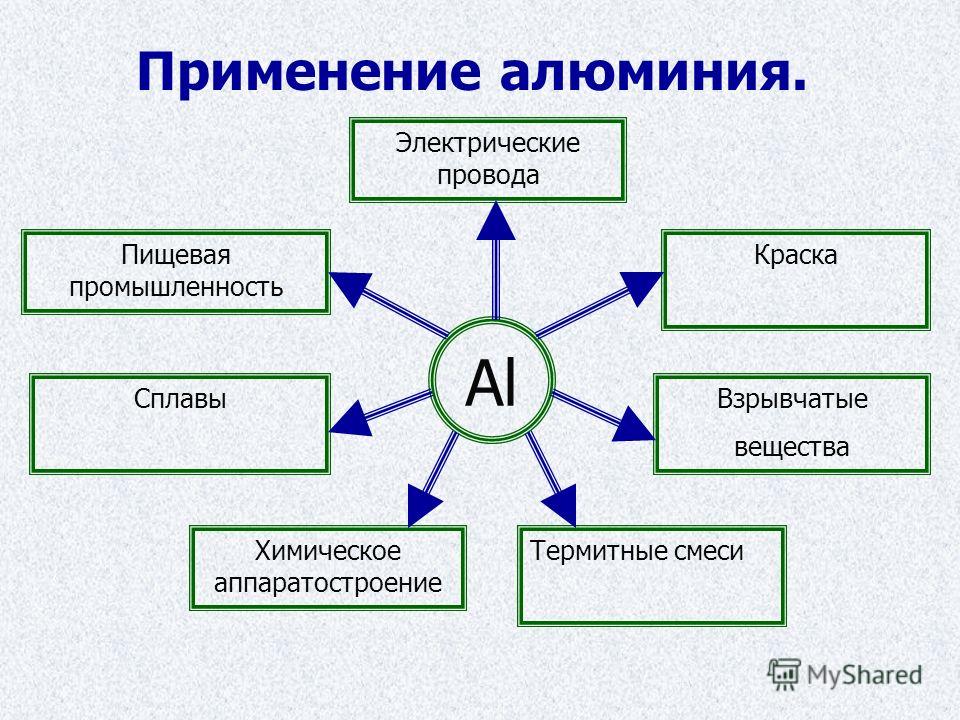 обработка алюминия.
обработка алюминия.
Применение и свойства
Алюминий добавляют в небольших количествах к некоторым металлам для улучшения их свойств для конкретных целей, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, к алюминию добавляются умеренные количества других металлов и кремния. Металл и его сплавы широко используются в авиастроении, строительных материалах, потребительских товарах длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводниках, химическом и пищевом оборудовании.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Чистый алюминий (99,996%) довольно мягкий и непрочный; технический алюминий (чистота от 99 до 99,6%) с небольшими количествами кремния и железа отличается твердостью и прочностью. Ковкий и очень податливый алюминий можно вытягивать в проволоку или сворачивать в тонкую фольгу. Плотность металла составляет всего около одной трети плотности железа или меди. Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Алюминий является отличным проводником тепла и электричества. Его теплопроводность примерно вдвое меньше, чем у меди; его электропроводность, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий представляет собой стабильный изотоп алюминия-27. Металлический алюминий, его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Однако концентрированную азотную кислоту можно перевозить в алюминиевых цистернах, поскольку она делает металл пассивным. Даже очень чистый алюминий подвергается энергичному воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и иона алюмината. Из-за большого сродства к кислороду мелкодисперсный алюминий при возгорании сгорает в монооксиде или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного каления алюминий инертен к сере.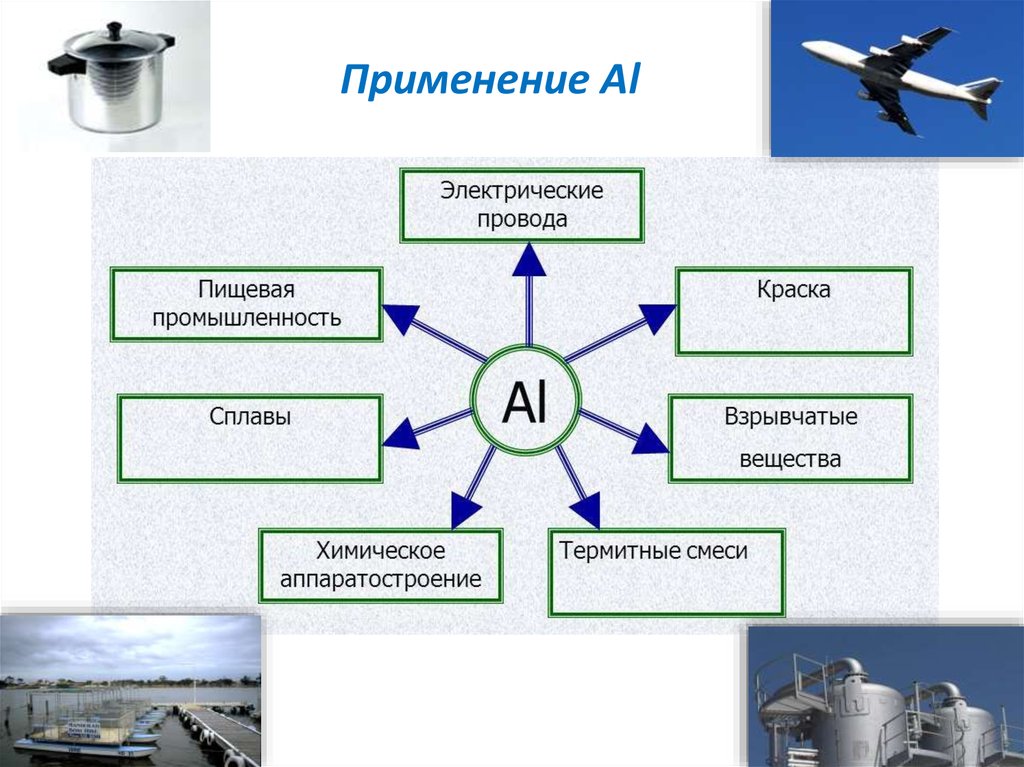
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии. Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3 ) или как производное азоторганического соединения 8-гидроксихинолина. Производное имеет молекулярную формулу Al(C 9 H 6 ON) 3 .
Соединения
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в некоторых соединениях (например, в кристаллическом фториде алюминия [AlF 3 ] и хлориде алюминия [AlCl 3 ]) голый ион Al 3+ образован потеря этих электронов, как известно, происходит. Однако энергия, необходимая для образования иона Al 3+ , очень велика, и в большинстве случаев атому алюминия энергетически выгоднее образовывать ковалентные соединения путем sp 2 гибридизация, как это делает бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия, а также в производстве изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (ААО), обычно получаемый путем электрохимического окисления алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим важным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и в качестве поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием гидратированных двойных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl(SO 4 ) 2 ·12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; М может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен множеством других ионов М 3+ , например, галлия, индия, титана, ванадия, хрома, марганца. , железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
, железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, т. Е. Синтетических органических реакциях, связанных с получением самых разных соединений, включая ароматические кетоны, антрохинон и его производные. Гидратированный хлорид алюминия, широко известный как хлоргидрат алюминия, AlCl 3 ∙H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который сужает поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al(OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO − 2 . С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получают тетрагидроалюминаты (важные восстановители). Алюмогидрид лития (LiAlH 4 ), образующийся при взаимодействии хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получают тетрагидроалюминаты (важные восстановители). Алюмогидрид лития (LiAlH 4 ), образующийся при взаимодействии хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Разгадана тайна активной фазы в каталитическом восстановлении углекислого газа до метанола — ScienceDaily
Исследователи из Стокгольмского университета впервые смогли изучить поверхность медно-цинкового катализатора при восстановлении углекислого газа до метанола. результаты опубликованы в научном журнале Science. Лучшее знание каталитического процесса и возможность найти еще более эффективные материалы открывают двери для перехода к «зеленой» химической промышленности.
Метанол в настоящее время является одним из наиболее важных нефтехимических основных химикатов с годовым объемом производства 110 миллионов тонн и может быть преобразован в десятки тысяч различных продуктов и использован для производства, например, пластмасс, моющих средств, фармацевтических препаратов и топлива. Метанол также может стать энергоносителем будущего, где, например, авиационное топливо можно будет производить с использованием захваченного диоксида углерода и водорода в результате электролиза воды вместо природного газа. Таким образом, возможна грядущая «зеленая» трансформация химической промышленности, аналогичная той, что произошла с «зеленой» сталью, где энергия ветра или солнца приводит в движение электролитические элементы.
«Задача состояла в том, чтобы экспериментально исследовать поверхность катализатора поверхностно-чувствительными методами в реальных условиях реакции при относительно высоких давлениях и температурах. Эти условия в течение многих лет были недостижимы, и различные гипотезы о наличии цинка в виде оксида, металла или в сплаве с медью возникли, но не могли быть однозначно проверены», — говорит Андерс Нильссон, профессор химической физики Стокгольмского университета.
«Потрясающе, что нам удалось пролить свет на эту сложную тему образования метанола на медно-цинковом катализаторе после многих лет усилий», — говорит Питер Аманн, первый автор публикации.
«Особенность заключается в том, что мы построили в Стокгольме прибор для фотоэлектронной спектроскопии, который позволяет изучать поверхности катализатора под высоким давлением и, таким образом, мы можем напрямую наблюдать, что происходит, когда протекает реакция», — говорит Дэвид Дегерман, аспирант кафедры химии. Физика в Стокгольмском университете. «С нашим новым инструментом мы открыли новую дверь в катализ».
«Нам удалось с помощью нашего прибора продемонстрировать, что цинк сплавляется с медью прямо на поверхности, и это создает особые атомные центры, где метанол создается из углекислого газа», — говорит Крис Гудвин, исследователь химической физики Стокгольмского университета. «Во время промышленных процессов примешивается небольшое количество монооксида углерода, что предотвращает образование оксида цинка из диоксида углерода».
«Для проведения исследования было важно, чтобы наш Стокгольмский прибор был у одного из самых ярких источников рентгеновского излучения в мире в PETRA III в Гамбурге», — говорит Патрик Лёмкер, постдоктор Стокгольмского университета. «Теперь мы можем представить себе будущее с еще более яркими источниками, когда машина будет обновлена до PETRA IV».
«Теперь у нас есть инструменты для проведения исследований, ведущих к возможным другим каталитическим материалам, которые можно было бы лучше использовать вместе с водородом, полученным электролизом, для перехода к «зеленой» химической промышленности, которая сегодня полностью основана на ископаемом топливе и составляет 8 % мировых выбросов углекислого газа», — говорит Андерс Нильссон.
Исследование проводилось в сотрудничестве с Университетом Инсбрука и Венским техническим университетом, Австрия, а также DESY в Гамбурге и Институтом Фрица-Габера в Берлине, Германия. В исследовании приняли участие бывшие сотрудники университета Питер Аманн, Хсин-Йи Ван, Маркус Солдемо, Михаил Шиплин, Йорген Глад, Йоаким Халлдин Стенлид и Миа Бёрнер.
