Катодная пара: Электрохимическая защита
Содержание
Решения для резервуаров — Корпорация ПСС
Непрерывный рост добычи и переработки нефти и газа сопровождается интенсивным строительством резервуарных парков, которые предназначены для хранения нефти и нефтепродуктов. Стальные резервуары подвергаются коррозии: с внешней стороны днища– от воздействия грунтового электролита, а с внутренней стороны резервуара – от воздействия технической воды по всей площади резервуара или от воздействия подтоварной воды на днище и первом поясе резервуара.
Существуют четыре основных способа противокоррозионной защиты резервуаров:
1) изоляционное покрытие поверхности резервуара с целью предотвращения взаимодействия с внешней коррозионной средой;
2) применение коррозионно-стойких металлов при строительстве;
3) снижение агрессивности коррозионной среды различными химическими реагентами;
4) применение электрохимической защиты стальных резервуаров.
Корпорация ПСС специализируется на решениях с использованием электрохимической защиты. Применение электрохимической защиты также называют активной защитой. К ней относятся:
Катодная защита – При катодной защите к днищу подключается «минус» источника, который придает ему отрицательный электрический потенциал – металл становится катодом.
Протекторная защита – создание гальванической пары подключением к днищу металла с более отрицательным потенциалом. В созданной гальванопаре металл днища становится катодом, а более электроотрицательный металл – анодом, который и подвергается разрушению.
Внутренняя защита осуществляется, в основном, с помощью протекторов изготовленных из магниевых, алюминиевых или цинковых протекторов, размещаемых на дне и боковых стенках резервуара на уровне подтоварной воды. Данный способ отличается автономностью работы, не требует подключения к сети электропитания и установки дополнительного оборудования.
Корпорация ПСС наладила выпуск нескольких типов резервуарных протекторов:
ПРМ протектор резервуарный магниевый
Магниевый протектор ПМР представляет собой цилиндр, имеет углубление в верхней части. Это сделано для того, чтобы увеличить поверхность протектора и соответственно силу тока в начальный период его работы. В центре протектора впрессована стальная втулка для обеспечения контакта протектора с днищем. Протекторы ПМР рекомендуется располагать на днище по концентрическим окружностям, расстояние между которыми принимается равным удвоенному радиусу действия одного протектора.
Протектор алюминиевый короткозамкнутый резервуарный ПАКР
Протекторы ПАКР устанавливаются на днище РВС горизонтально в виде сборки (гирлянды) стержней, соединенных друг с другом сваркой. Протектор представляет собой соединение сердечника из стального круглого горячекатаного проката диаметром 5 мм и оболочки из протекторного сплава (АЦЦ-1, АЦ5Мг5, АП-4, АП4Н, АЦ5МГ5ч). Протекторы марки ПАКР имеют круглое сечение или трапециевидное. На днище резервуара длинномерные протекторы размещают концентрическими кольцами, соединенными между собой последовательно. От прямого контакта с днищем их изолируют с помощью полиэтиленовых колец и полос.
Протекторы марки ПАКР имеют круглое сечение или трапециевидное. На днище резервуара длинномерные протекторы размещают концентрическими кольцами, соединенными между собой последовательно. От прямого контакта с днищем их изолируют с помощью полиэтиленовых колец и полос.
Протекторы ПРМ, П-КОЦ, П-КОА
Протекторы для резервуаров ( П-КОА, П-КОЦ)
П-КОА — Протектор короткозамкнутый одиночный алюминиевый.
П-КОЦ — Протектор короткозамкнутый одиночный цинковый.
В резервуарах хранения нефти и нефтепродуктов защищается только днище и первый пояс резервуара в среде подтоварной воды, выделившейся из хранимой нефти. Для защиты таких резервуаров рекомендуется применять цинковые протекторы П-КОЦ, так как в отличие от магниевых и алюминиевых протекторов цинковые протекторы не дают искры при ударе о стальную поверхность. Тем самым соблюдаются требования по взрывопожаробезопасности.
Короткозамкнутые протекторы П-КОА, П-КОЦ помимо РВС используются для защиты от коррозии горизонтальных резервуаров, подводной части балластных танков, отсеков, цистерн, кингстонов, ледовых ящиков, других конструкций и оборудования, эксплуатирующихся в морской воде.
Защита внешних поверхностей днищ резервуаров
Для защиты внешних поверхностей применяются методы протекторной и катодной защиты наложенным током, разработано большое количество схем. Выбор метода и решения рассматривается исходя из данных объекта. Так применение защиты с помощью протекторов эффективно только в низкоомных грунтах (до 50 Ом-м). В высокоомных грунтах такой метод необходимой защищенности не обеспечивает. Катодная защита внешними источниками тока более сложная, требует использование станции катодной защиты с источником постоянного тока, но мало зависит от удельного сопротивления грунта и имеет неограниченный энергетический ресурс.
Катодная защита внешних поверхностей днищ вертикальных резервуаров
Наиболее эффективным видом защиты РВС является активная катодная защита при помощи протяженного анодного заземлителя укладываемого под днище резервуаров. Но данный случай применим только в случае монтажа резервуаров, либо при его капитальном ремонте. При необходимости защиты внешней стороны днища уже смонтированного резервуара применяются глубинные анодные заземлители, которые можно смонтировать за пределами резервуарного парка. Катодная поляризация средствами ЭХЗ должна обеспечивать уровень защитных потенциалов на всей поверхности резервуаров .
При необходимости защиты внешней стороны днища уже смонтированного резервуара применяются глубинные анодные заземлители, которые можно смонтировать за пределами резервуарного парка. Катодная поляризация средствами ЭХЗ должна обеспечивать уровень защитных потенциалов на всей поверхности резервуаров .
Типовая схема катодной защиты резервуара состоит из следующих элементов:
Анодные заземлители выпускаемые Корпорацией ПСС соответствуют требованиям предъявляемых для защиты днищ резервуаров, выполняются из маслобензостойких материалов, имеют долгий срок службы, экологически безопасны. При устройстве катодной защиты днища анодные заземлители могут располагаться в земле рядом с резервуаром (при ЭХЗ резервуарных парков АЗ), или непосредственно под днищем. Так как срок службы РВС не менее 50 лет, их обычно проектируется с запасом, стандартная схема для обеспечения указанного срока службы смонтировать два самостоятельных контура анодных заземлителей со сроком службы одного контура не менее 25 лет. Второй контур вводится в эксплуатацию по окончании рабочего ресурса первого контура. При высокоомных грунтах применяют активатор при анодного пространства, он понижает сопротивление грунта. Кабельные выводы анодных заземлителей имеют индивидуальную проектную длину.
Второй контур вводится в эксплуатацию по окончании рабочего ресурса первого контура. При высокоомных грунтах применяют активатор при анодного пространства, он понижает сопротивление грунта. Кабельные выводы анодных заземлителей имеют индивидуальную проектную длину.
ЭПМ — электрод протяженный маслобензостойкий укладывается непосредственно под днище резервуара.
АЗП-РА — полимерный заземлитель используют при устройстве анодного поля за границами резервуара.
Анодные заземлители
Датчик коррозии БПИ-2 устанавливается для контроля остаточной скорости коррозии и уровня защитных потенциалов на днище РВС.
ЭДБ-2П — электрод сравнения. Предлагается использовать биметаллические электроды сравнения длительного действия, они изготовлены из пластин из химически чистых металлов меди и титана. Типовые медносульфатные электроды сравнения не годятся, т.к. к ним должен быть систематический доступ для заправки их медным купоросом.
Клеммный шкаф. Кабели каждого РВС выводят в клеммный шкаф, располагаемый за пределами каре резервуара.
Оборудование для катодной защиты резервуаров
Станция катодной защиты резервуаров обеспечивает телеконтроль и автоматическое поддержание требуемых величин защитных потенциалов и защитного тока СКЗ. Станции катодной защиты, выпускаемые ООО «ЗНГА Анодъ», комплектуются системами телеметрии. СКЗ размещают за пределами взрывоопасной зоны, по возможности, в КТП.
Протекторная защита внешних поверхностей РВС
Основной задачей при проектировании протекторной защиты РВС является определение необходимого количества протекторов и срока их службы. Количество протекторов должно обеспечить минимально допустимую плотность защитного тока, в зависимости от удельного электросопротивления грунта и переходного сопротивления изоляции. Основными преимуществами данного метода являются простота монтажа и замены протекторов, экономичность, отсутствие необходимости подвода электроэнергии. Протекторная защита резервуаров осуществляется одиночными, групповыми сосредоточенными и групповыми рассредоточенными протекторами.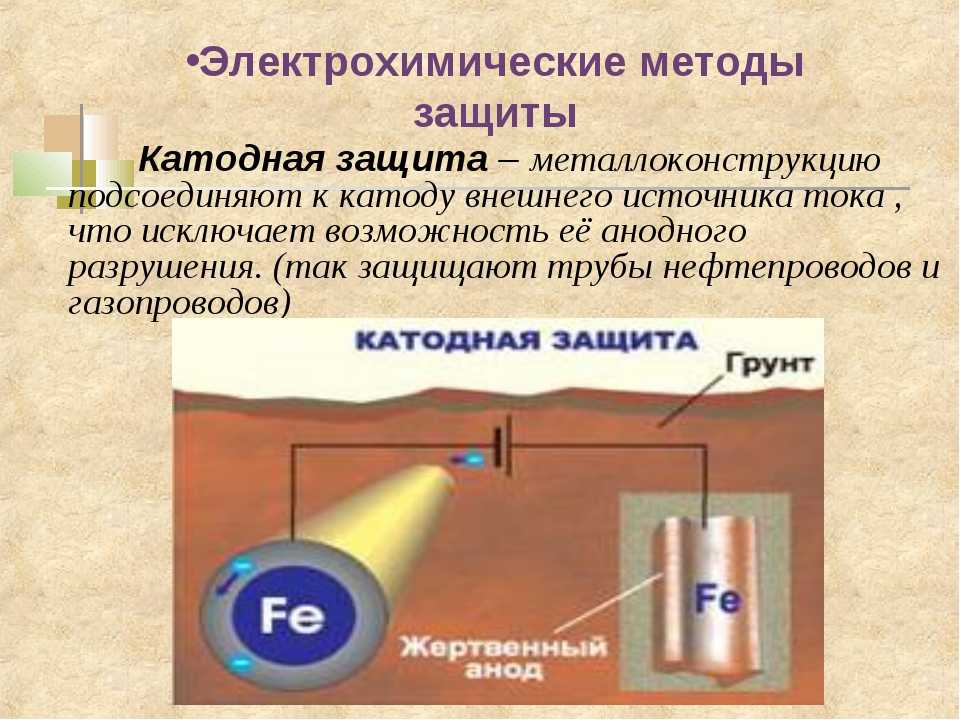
Схемы и расположение элементов при устройстве протекторной защиты.
а — одиночными протекторами;
б — групповыми сосредоточенными протекторами;
в — групповыми рассредоточенными протекторами;
1 — резервуар; 2 — протекторы; 3 — контрольно-измерительные колонки; 4 — дренажный провод.
Протектор ПМ-У, стойка КИП, БДРМ
При устройстве протекторной защиты внешних поверхностей резервуаров применяют протекторы магниевые упакованные — ПМ-У.
Протектор ПМ-У представляет собой анод со стальным сердечником и кабель выводом, анод упаковывают в мешок наполненный активатором при анодного пространства. Протекторы ПМ-У изготавливаются с анодами разных размеров ПМ-5У, ПМ-10У, ПМ-20У.
Помимо собственно протекторов используются контрольно-измерительные стойки КИП для снятия значении защитного потенциала. Стойки КИП могут быть блоком БДРМ или БСЗ.
Наша компания наладила выпуск кабеля КГН-ЭХЗ отличительной особенностью которого является маслобензостойкая оболочка.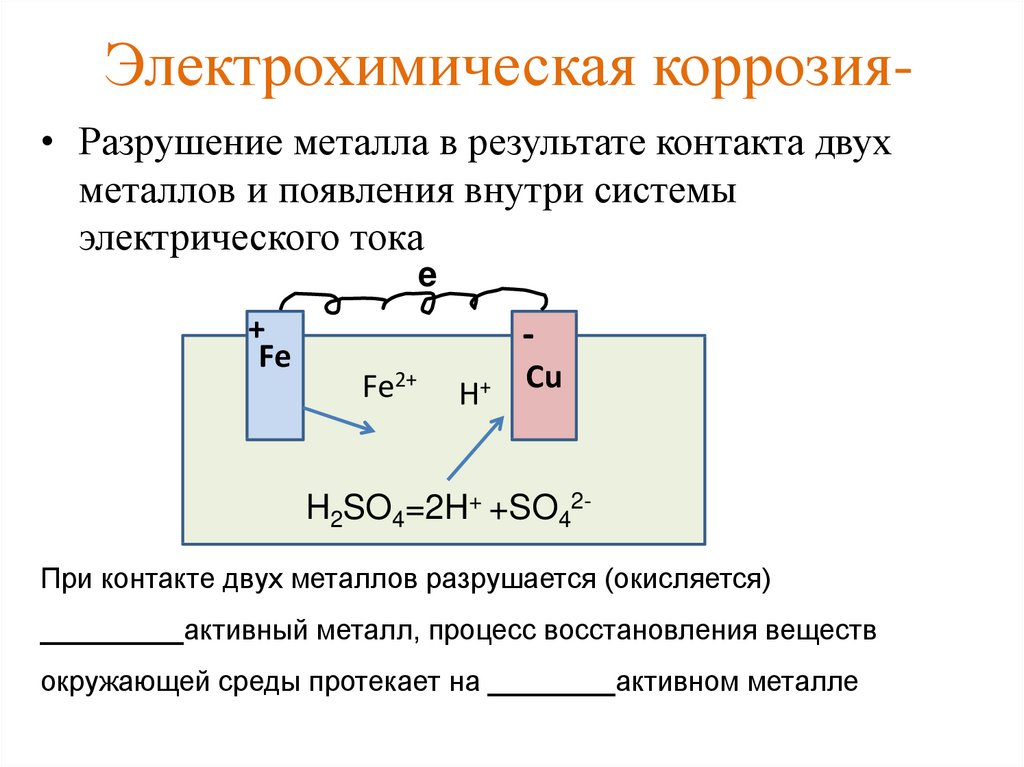
Протекторная защита внешних поверхностей газгольдеров
В силу затратности катодного метода, газгольдеры и остальные подземные емкости, в основном, защищают при помощи протекторной анодно-катодной системы, описанной выше. Для подобной защиты не требуется электроэнергия, но необходима периодическая замена протектора. Для его замены бурят шурф возле резервуара, укладывают туда новый протектор и переключают на него провод. Также защитная система выступает в роли заземлителя.
Преимущества комплекта протекторной защиты:
— для подключения к емкости используются магнитные контакты. Это исключает лишние работы по приварке;
— работа протектора полностью отслеживается на КИП, это позволяет получать полные данные о его состоянии;
— невысокие затраты по установке и замене.
В состав комплекта для защиты газгольдеров могут входить:
— Контрольно-измерительный пункт КИП
— Протектор упакованный магниевый ПМ-У
— Электрод сравнения медносульфатный неполяризующийся Энес-4М
— Контакт магнитный КМ-1 создает надежное соединение и не требует приварки.
— Кабель КГН-ЭХЗ
Корпорация ПСС предлагает услуги по проектированию, монтажу и обследованию защиты резервуаров от коррозии.
Защита металлов от коррозии | Задачи 284
Задание 284.
Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
Решение:
При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Zn + 1/2O2 = ZnO
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом.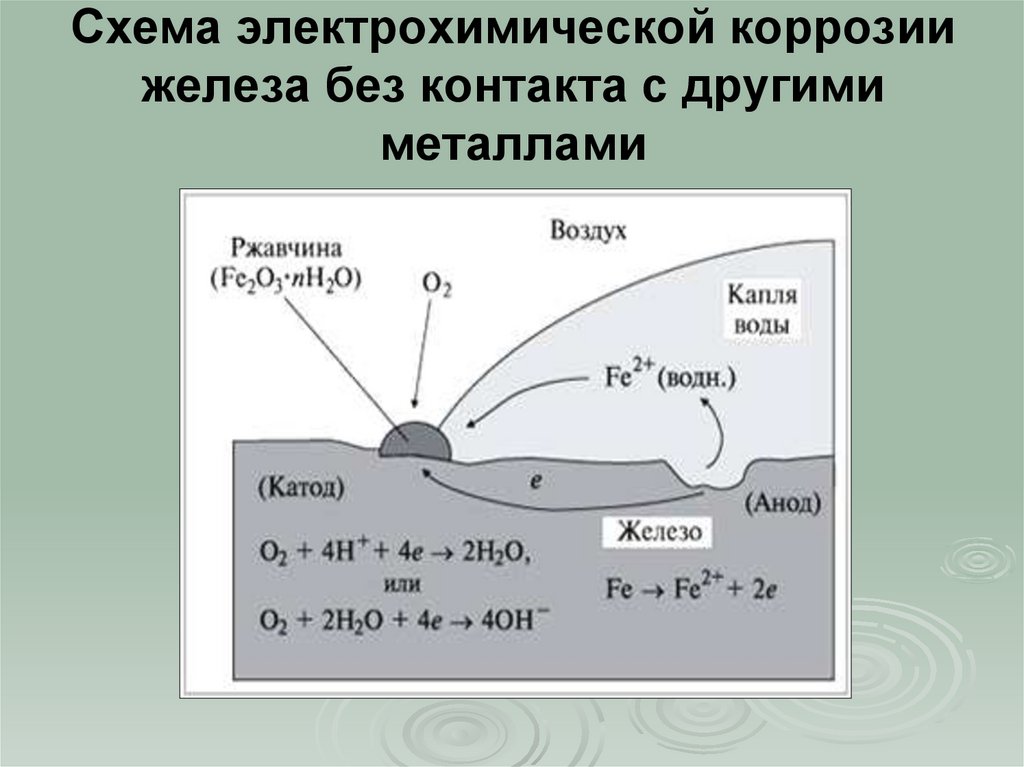 Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Анодный процесс: Zn0 — 2 = Zn2+
Катодный процесс в кислой среде: 2Н+ + 2 = H2↑
Образующиеся ионы Zn2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н+, деполяризуясь на медной палочке, Zn0 — 2 = Zn2+образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:
Zn + 2H+ = Zn2+ + H2↑
Молекулярная форма уравнения реакции:
Zn + 2HCl = ZnCl2 + H2↑
Задание 285.
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.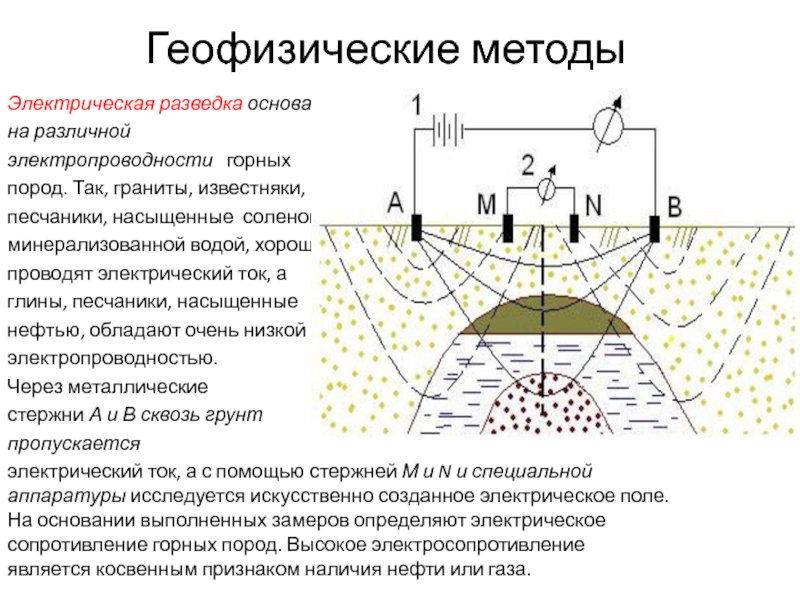
Решение:
Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn0 — 2 = Zn2+;
Катодный процесс:
а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH—;
б) в кислой среде: 1/2O2 + 2H+ + 2 = H2O
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая.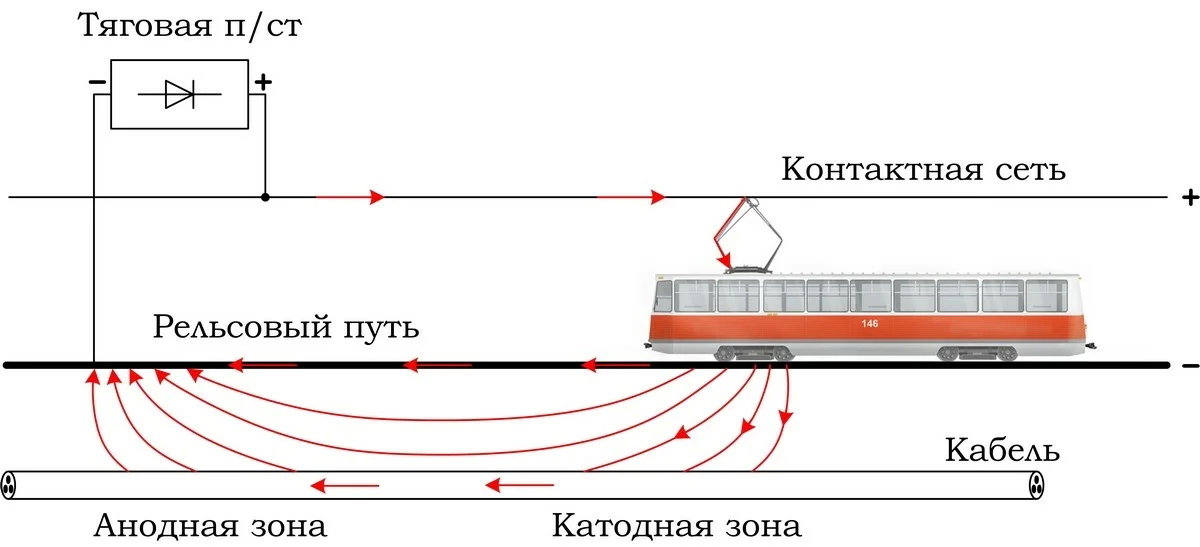 Основной металл остаётся неповреждённым.
Основной металл остаётся неповреждённым.
Задание 286.
Железное изделие покрыли никелем. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe0 — 2 = Fe2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe0 — 2 = Fe2+
Катодный процесс: в кислой среде: 2Н+ + 2 = Н2
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).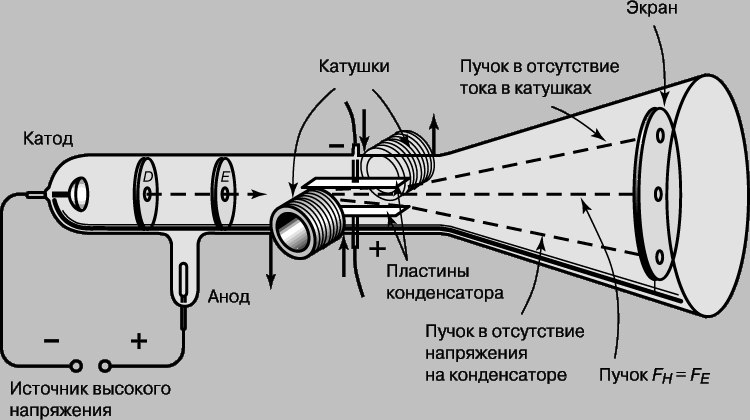
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe0 — 2 = Fe2+
Катодный процесс:
в нейтральной среде: 1/2O2 + H2O + 2 = 2OH—
Так как ионы Fe2+ с гидроксид-ионами ОН— образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
4Fe(OH)2 + О2 = 4FeO(OH) + 2Н2О
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Voltaic Cells — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 285
В окислительно-восстановительных реакциях электроны передаются от одного вида к другому. Если реакция идет самопроизвольно, высвобождается энергия, которую затем можно использовать для совершения полезной работы. Чтобы использовать эту энергию, реакцию необходимо разделить на две отдельные полуреакции: реакции окисления и реакции восстановления. Реакции помещаются в два разных контейнера, и для перемещения электронов с одной стороны на другую используется провод. При этом 9-_{3\;(aq)}\) ионы. Ионы NO 3 — (aq) можно не учитывать, так как они являются ионами-спектаторами и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) легко окисляет Cu (тв.) , в результате чего получается Cu 2 + (водн.), , при этом восстанавливаясь до Ag (тв.) .
При этом 9-_{3\;(aq)}\) ионы. Ионы NO 3 — (aq) можно не учитывать, так как они являются ионами-спектаторами и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) легко окисляет Cu (тв.) , в результате чего получается Cu 2 + (водн.), , при этом восстанавливаясь до Ag (тв.) .
Эта реакция высвобождает энергию. Однако, когда твердый медный электрод помещается непосредственно в раствор нитрата серебра, энергия теряется в виде тепла и не может быть использована для выполнения работы. Чтобы использовать эту энергию и использовать ее для полезной работы, мы должны разделить реакцию на две отдельные полуреакции; Реакции окисления и восстановления. Провод соединяет две реакции и позволяет электронам течь с одной стороны на другую. При этом мы создали Гальванический/гальванический элемент .
Figure \(\PageIndex{1}\): Элемент Вольта
Элемент Вольта (также известный как гальванический элемент) представляет собой электрохимический элемент, который использует спонтанные окислительно-восстановительные реакции для выработки электроэнергии. Он состоит из двух отдельных полуячеек . Полуячейка состоит из электрода (полоска металла М) в растворе, содержащем ионы М n+ , где М — любой произвольный металл. Две полуэлемента соединены между собой проводом, идущим от одного электрода к другому. Солевой мост также соединяется с полуклетками. Функции этих частей обсуждаются ниже.
Полуячейки
Половина окислительно-восстановительной реакции происходит в каждой половине ячейки. Поэтому можно сказать, что в каждой полуклетке происходит полуреакция. Когда две половины соединяются проволокой и соляным мостом, создается электрохимическая ячейка.
Электроды
Электрод представляет собой полоску металла, на которой происходит реакция.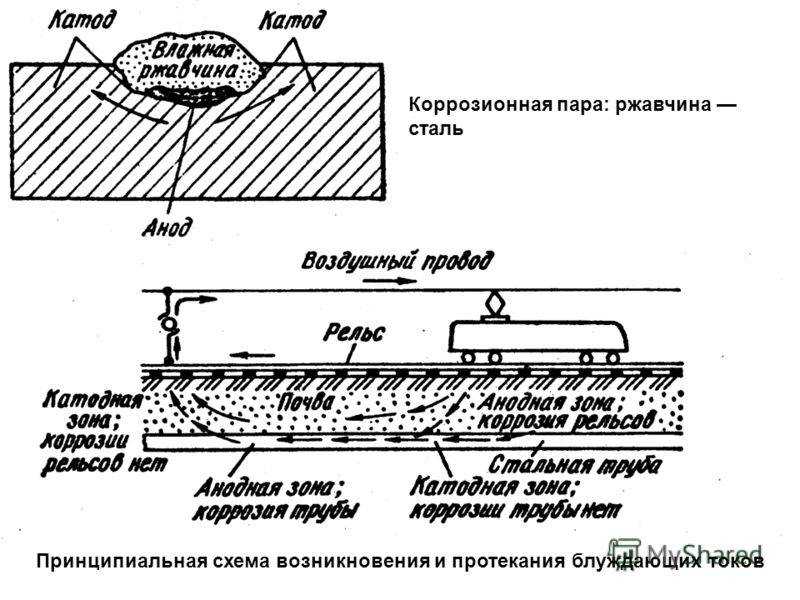 В гальваническом элементе окисление и восстановление металлов происходит на электродах. В гальваническом элементе два электрода, по одному в каждой полуэлементе. 9Катод 0024 — это место, где происходит восстановление, а окисление происходит на аноде .
В гальваническом элементе окисление и восстановление металлов происходит на электродах. В гальваническом элементе два электрода, по одному в каждой полуэлементе. 9Катод 0024 — это место, где происходит восстановление, а окисление происходит на аноде .
С помощью электрохимии эти реакции реагируют на металлических поверхностях или электродах. Между металлом и веществами в растворе устанавливается окислительно-восстановительное равновесие. Когда электроды погружены в раствор, содержащий ионы того же металла, это называется полуэлементом . Электролиты представляют собой ионы в растворе, обычно жидком, проводящем электричество за счет ионной проводимости. Между атомами металла на электроде и ионными растворами могут происходить два возможных взаимодействия.
- Ион металла M n + из раствора может столкнуться с электродом, получив от него «n» электронов, и превратиться в атомы металла.
 Это означает, что ионы восстановлены.
Это означает, что ионы восстановлены. - Атом металла на поверхности может отдать «n» электронов электроду и войти в раствор в виде иона M n + , что означает окисление атомов металла.
Когда электрод окисляется в растворе, он называется анодом и когда электрод восстанавливается в растворе. это называется 9катод 0024.
- Анод : На аноде протекает реакция окисления. Другими словами, именно здесь металл теряет электроны. В приведенной выше реакции анодом является Cu (s), поскольку его степень окисления увеличивается от 0 до +2.
- Катод : На катоде протекает реакция восстановления. Именно здесь металлический электрод получает электроны. Возвращаясь к приведенному выше уравнению, катодом является Ag (s), поскольку его степень окисления уменьшается с +1 до 0,9.0010
Вспоминая об окислении и восстановлении
Когда дело доходит до окислительно-восстановительных реакций, важно понимать, что значит для металла быть «окисленным» или «восстановленным». +_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.
+_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.
Соляной мост является жизненно важным компонентом любого гальванического элемента. Это трубка, заполненная раствором электролита, таким как KNO 3(s) или KCl (s) . Цель солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов из одной клетки в другую. Без солевого мостика вокруг электродов будут накапливаться положительные и отрицательные заряды, что приведет к остановке реакции.
Назначение солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов из одной клетки в другую.
Поток электронов
Электроны всегда текут от анода к катоду или от полуэлемента окисления к полуэлементу восстановления. С точки зрения ячейки полуреакции E o электроны будут течь от более отрицательной полуреакции к более положительной полуреакции. Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.
Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.
Рисунок \(\PageIndex{2}\): Диаграмма ячеек. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\).
При рисовании клеточной диаграммы мы придерживаемся следующих соглашений. Анод всегда размещается с левой стороны , а катод размещается с правой стороны . Соляной мост представлен двойными вертикальными линиями (||). Разница в фазе элемента представлена одной вертикальной линией (|), а изменения в степенях окисления представлены запятыми (,). 9o_{ячейка}\) для гальванического элемента, образованного каждой реакцией.
Раствор
1.a) Ba 2+ (aq) → Ba (s) + 2e- с SRP (для противоположной реакции) E o = -2,92 В, где анод происходит окисление)
Cu 2+ (водн. ) + 2e- → Cu (тв) с SRP E o = +0,340 В (Катод; где происходит восстановление)
) + 2e- → Cu (тв) с SRP E o = +0,340 В (Катод; где происходит восстановление)
1b002 Al 3+ (водн.) → Al (s) + 3e — с SRP (для противоположной реакции) E o = -1,66 В (Анод; где происходит окисление)
Sn 2+ (водн.) +2e → Sn (s) с SRP E o = -0,137 В (катод; где происходит восстановление)
2.a) Ba 2+ (водн.) | Ва (с) || Cu (с) | Cu 2+ (водный)
2.b) Al (s) | Al 3+ (водный) || Sn 2+ (водный) | Sn (s)
3.a) E o ячейка = 0,34 — (-2,92) = 3,26 В
3.b) E o — ячейка ) = 1,523 В
Напряжение ячейки/потенциал ячейки
Показания вольтметра дают реакцию напряжения ячейки или разность потенциалов между двумя полуячейками. Напряжение ячейки также известно как 9o_{анод}\]
Напряжение ячейки также известно как 9o_{анод}\]
Значения E o приведены в таблице для всех растворенных веществ при 1 М и всех газов при 1 атм. Эти значения называются стандартными восстановительными потенциалами . Каждая полуреакция имеет различный восстановительный потенциал, разность двух восстановительных потенциалов дает напряжение электрохимической ячейки. Если клетка E o положительна, реакция идет самопроизвольно и это гальваническая ячейка. Если в ячейке E или отрицательный результат, то реакция не является самопроизвольной, и ее называют электролитической ячейкой.
Ссылки
- Брейди, Джеймс Э., Холум, Джон Р. «Химия: изучение материи и ее изменений», John Wiley & Sons Inc., 1993
- Brown, Theodore L., LeMay, H. Eugene Jr. «Химия: центральная наука», третье издание, Prentice-Hall, Inc. Englewood Cliffs, NJ 07632 1985
- Браун, Теодор Л., ЛеМэй, Х. Юджин мл., Берстен, Брюс Э.
 «Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991
«Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991 - Гессер, Хайман Д. «Описательные принципы химии», C.V. Компания Мосби 1974
- Harwood, William, Herring, Geoffrey, Madura, Jeffry, and Petrucci, Ralph, General Chemistry: Principles and Modern Applications, Ninth Edition, Upper Saddle River, New Jersey, Pearson Prentice Hall, 2007.
- Петруччи, Ральф Х. Общая химия: принципы и современные приложения, 9-е изд. Нью-Джерси: Pearson Education Inc., 2007.
- Вассос Бэзил Х. Электроаналитическая химия. Нью-Йорк: Публикация Wiley-Interscience. 1983.
- Зумдал, Стивен С. Химия, 7-е изд. Нью-Йорк: Компания Houghton Mifflin. 2007.
.
Авторы и ссылки
- Шамшер Сингх, Дебора Го
Voltaic Cells распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- Батареи Вольта
Парный электролиз 5-(гидроксиметил)фурфурола в проточных ячейках с высокоэффективным серебряным катодом на основе оксида
Парный электролиз 5-(гидроксиметил)фурфурола в проточных ячейках с высокоэффективным серебряным катодом на основе оксида†
Хэнчжоу
Лю‡ a
Тинг-Хан
Ли, ‡ и
Ифу
Чен, и
Эрик В.
Кокран
* и
и
Вэньчжэнь
Ли
* и
Принадлежности автора
*
Соответствующие авторы
и
Кафедра химической и биологической инженерии, Университет штата Айова, 618 Bissell Road, Ames, IA 50011, USA
Электронная почта:
wzli@iastate.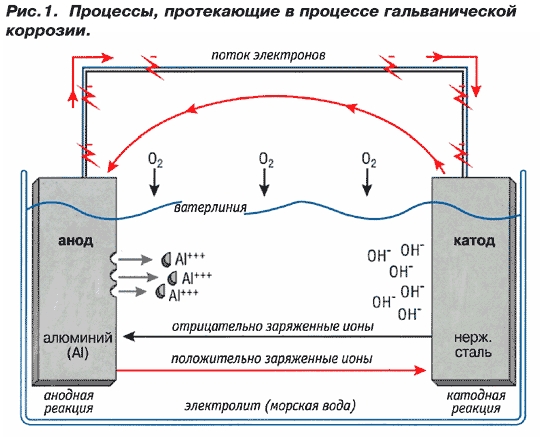 edu, [email protected]
edu, [email protected]
Аннотация
Электрокаталитическая модернизация сырья, полученного из биомассы, с использованием возобновляемой электроэнергии предлагает более экологичный способ уменьшить глобальный углеродный след, связанный с производством химических веществ с добавленной стоимостью. В этом отношении ключевой стратегией является реакция электрокаталитического гидрирования (ECH), которая обычно сочетается с реакцией анодного выделения кислорода (OER) с медленной кинетикой, производя O 2 с небольшим значением. Здесь мы подготовили электрод на основе оксида Ag (OD-Ag) с высокой активностью и селективностью до 98,2% для ECH от 5-(гидроксиметил)фурфурола (HMF) до 2,5-бис(гидроксиметил)фурана (BHMF), и такое эффективное преобразование было достигнуто в трехэлектродной проточной ячейке. Превосходная селективность BHMF поддерживалась в широком диапазоне потенциалов с долговременной стабильностью работы.
