Коррозия электрохимическая примеры: Электрохимическая коррозия
Содержание
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов. Скорость коррозии. Методы защиты металлов от коррозии.
Коррозией называется разрушение металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия приводит к большим потерям металлов в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и пр. Безвозвратные потери металлов от коррозии составляют 10% от ежегодного их выпуска. По ориентировочным подсчетам, мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Однако, затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему.
Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему.
Различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких как, например, сернистая нефть и др.
Газовая коррозия протекает по схеме: n Me + m/2O2 = MenOm;
Коррозию в серусодержащих неэлектролитах можно выразить схемой: Me + S = MeS.
Электрохимическая коррозия может протекать: а) в водных растворах электролитов, то есть солей, кислот и щелочей; б) в атмосфере любого влажного газа; в) в почве.
В воде обычно содержится растворенный кислород, способный к восстановлению по схеме: О2 + 4Н+ + 4е = 2 Н2О, или в нейтральной среде: 2Н2О +О2 + 4е = 4ОН— (1);
Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению: 2Н+ + 2е = Н2 или (в нейтральной среде) Н2О + 2е = Н2 + ОН—(2). Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Потенциал, отвечающий электродному процессу (1), равен 1,229в – 0,059рН. В нейтрально среде он равен около 0,8в. Следовательно, растворенный в воде или нейтральных растворах кислород будет окислять те металлы, потенциал которых меньше, чем 0,8в. Эти металлы расположены в ряду напряжений, начиная от его начала, до серебра.
Потенциал электродного процесса (2) в нейтральной среде равен приблизительно –0,41в. Следовательно, ионы водорода в нейтральных водных растворах могут окислить только те металлы, потенциал которых меньше, чем 0,41в. Это металлы от начала ряда напряжений до кадмия.
Пример 1. Рассмотрим электрохимическую коррозию железа в кислой среде.
На анодных участках происходит окисление железа: (а) Fe – 2e = Fe+2;
На катодных участках происходит восстановление водорода: 2Н+ + 2е = Н2.
Пример 2. Если гвоздь вбить во влажное дерево, то коррозии подвергается (покрывается ржавчиной) та его часть, которая находится внутри дерева. Это объясняется тем, что влага древесины содержит растворенный кислород, то есть, происходит коррозия железа по схеме:
(а) Fe –2e = Fe2+; (к) О2 + 2Н+ + 4е = 2Н2О;
Продуктами коррозии являются вода и оксид железа (II), который в присутствии кислорода окисляется до оксида трехвалентного железа Fe2O3.
Кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксидную пленку, которая препятствует взаимодействию этих металлов с водой. Поэтому количество металлов, которые может окислить водород в нейтральной среде, еще меньше.
Таким образом, вода, содержащая растворенный кислород (в воде его обычно содержится от 0 до 14 мг/л), значительно опаснее в коррозионном отношении, чем вода, способная окислять металлы только за счет ионов водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде: атмосфере или растворе. Могут иметь место различные случаи электрохимической коррозии.
Атмосферная коррозия – это коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы и, в первую очередь, кислород. Скорость атмосферной коррозии зависит от многих факторов. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты (например, СО2 или SО2). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию в них влаги.
Коррозия в грунте (почвенная коррозия) приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный кислород. В зависимости от состава грунтовых вод, а также минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Контактная коррозия протекает, когда два металла в различными потенциалами соприкасаются друг с другом либо в влажной среде, либо при наличии влаги, конденсирующейся из воздуха. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Пример 3. Хром находится в контакте с медью. Какой из металлов будет окисляться, если эта пара металлов попадет в кислую среду? Составьте схему образующегося при этом гальванического элемента.
Хром более активный металл, чем медь (потенциал хрома равен –0,744в, а меди +0,337в), поэтому в образующейся гальванической паре он будет анодом, а медь – катодом. Хромовый анод растворяется: (а) 2Cr – 6e = 2Cr3+;
на медном катоде выделяется водород: (к) 6Н+ + 6е = 3Н2.
Схема образующегося гальванического элемента:
(-) 2Cr/Cr3+//HCl/(Cu)3H2/6H+ (+)
Основным отличием процессов контактной электрохимической коррозии от процессов, происходящих в гальваническом элементе, является отсутствие внешней электрической цепи. Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
На поверхности металла могут быть участки, на которых катодные процессы протекают быстрее (катализируются). Такие участки называют катодными. На других участках будет происходить анодное растворение металла, поэтому они называются анодными участками. Катодные и анодные участки имеют очень малые размеры, однако, они чередуются и образуют коррозионные микроэлементы. Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Пример 4. Атмосферная коррозия алюминия в нейтральной среде протекает по схеме:
(а) 2Al – 6e = 2Al 3+; (к) 3Н2О + 3е = 3Н2 + 3ОН—. Продуктами коррозии являются в данном случае водород и гидроксид алюминия.
Пример 5. Медь не вытесняет водород из разбавленных кислот вследствие того, что ее потенциал более положительный, чем потенциал водорода. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но и от природы растворенных в воде веществ и температуры. Так, в случае контакта железо-цинк, последний интенсивно коррозирует при комнатной температуре, но в горячей воде полярность металлов изменяется, и коррозировать начинает железо.
Для защиты от коррозии и предупреждения ее применяются различные методы. К важнейшим из них относятся следующие методы:
1) Легирование металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию основного металла и повышение его устойчивости к коррозии. В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
2) Защитные покрытия. Слои различных материалов, создаваемые на поверхности металлических изделий и сооружений для защиты от коррозии называются защитными покрытиями. Материалами для защитных покрытий могут быть как чистые металлы цинк, кадмий, алюминий, никель, медь, хром, серебро, так и их сплавы (бронза, латунь и др.).
Защитные покрытия делятся на катодные и анодные покрытия. К катодным покрытиям относятся такие металлические покрытия, потенциалы которых имеют более положительное значение, чем потенциал основного металла. Примерами катодного покрытия на стальных изделиях являются медь, серебро, никель. При повреждении покрытия или при наличии в нем пор возникает коррозионный элемент, в котором основной материал служит анодом и растворяется (коррозирует), а материал – катодом, на котором выделяется водород или поглощается кислород. Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинковое покрытие на стальных изделиях. При повреждении покрытия анодом будет служить металл покрытия, а основной металл, в качестве катода, разрушению подвергаться не будет. Потенциалы металлов зависят от состава растворов, поэтому, например, покрытие стали оловом (лужение) в растворе серной кислоты является катодным, а в растворе органических кислот – анодным.
Пример 6. Железное изделие покрыли кадмием. Какое это покрытие – катодное или анодное? Составьте уравнения анодного и катодного процессов коррозии этого изделия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случае?
Кадмий (потенциал –0,403в) менее активный металл, чем железо, (потенциал –0,440в) и в случае образование коррозионного элемента будет служить катодом поэтому данное покрытие является катодным. При коррозии происходит анодное растворение железа:
При коррозии происходит анодное растворение железа:
(а) Fe – 2e = Fe2+;
Катодным процессом в случае атмосферной коррозии во влажном воздухе будет восстановление кислорода:
(к) H2O +O2 + 4e = 4OH—;
Продуктами коррозии в данном случае являются гидроксид железа.
В кислой среде происходит катодное восстановление ионов водорода:
(к) 2Н+ +2е = Н2.
Продуктами коррозии в этом случае являются хлорид железа (II) и водород.
Пример 7. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Составьте уравнения анодного и катодного процессов коррозии и укажите, какие продукты коррозии образуются.
Ржавчиной быстрее покроется железная пластинка, покрытая медью, так как в паре железо (потенциал –0,440в) – медь (потенциал +0,337в) железо является анодом и разрушается по схеме:
(а) Fe – 2e = Fe2+;
На катоде происходит восстановление растворенного в воде кислорода по схеме:
(к) H2O + O2 + 4e = 4OH—;
Продуктами коррозии является гидроксид железа.
В паре железо-олово (потенциал +0,150в) железо также является более активным металлом, а, следовательно, анодом. Анодный процесс состоит в окислении железа по схеме:
(а) Fe –2e = Fe2+;
Вместе с этой лекцией читают «5 Сетевые модели».
Катодный процесс протекает аналогично предыдущему. Продуктами коррозии является гидроксид железа.
ЭДС первого коррозионного элемента равен +0,337 – (-0,440) = +0,777 в. ЭДС второго коррозионного элемента равен +0,150 – (-0,440) = +0,590 в. Следовательно, в первом случае коррозия железа будет протекать быстрее.
3) Электрохимическая защита. Этот метод защиты от коррозии основан на торможении анодных или катодных реакций коррозионных процессов. К защищаемой конструкции присоединяют металл с более отрицательным электродным потенциалом, чем потенциал металла конструкции. Этот металл называется протектором, а защита от коррозии – протекторной защитой.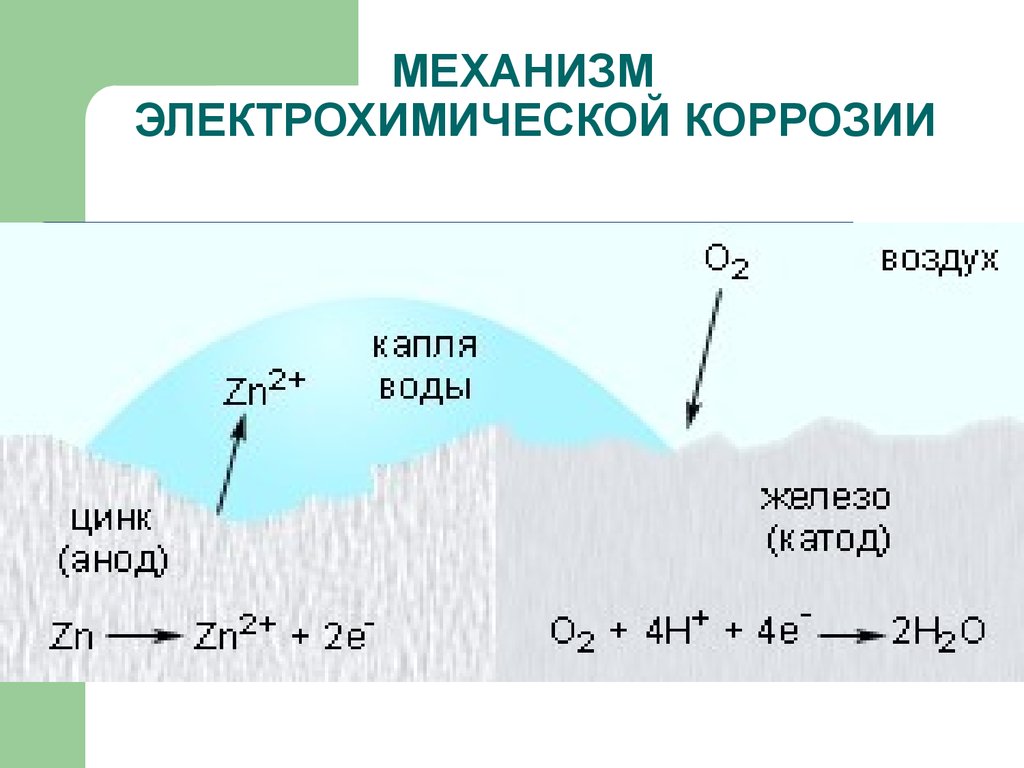 При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
Используется также катодная или анодная поляризация за счет приложенного извне тока. Сущность катодной защиты заключается в том, что защищаемое изделие присоединяется к отрицательному полюсу внешнего источника постоянного тока и становится вследствие этого катодом. Анодом обычно служит стальной вспомогательный электрод, который растворяется. Анодную защиту применяют к металлам, способным легко пассивироваться (образовывать оксидную пленку) при смещении их потенциала в положительную сторону. Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
4) Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию в ней компонентов, опасных в коррозионном отношении. В нейтральных средах, например, коррозия протекает обычно с поглощением кислорода. Кислород удаляют кипячением или вытеснением его из раствора при помощи инертного газа (барботаж инертным газом) или восстанавливают соответствующими реагентами (сульфиты, гидразин). Агрессивность кислых сред можно снизить подщелачиванием (нейтрализацией).
Для защиты от коррозии широко применяют вещества, при добавлении которых в соответствующую среду значительно уменьшается скорость коррозии. Такие вещества называются ингибиторами коррозии. По составу ингибиторы делятся на органические и неорганические. Так как активность ингибиторов зависит от рН среды, их также делят на кислотные, щелочные и нейтральные. По механизму действия ингибиторы можно разделить на анодные, катодные и экранирующие.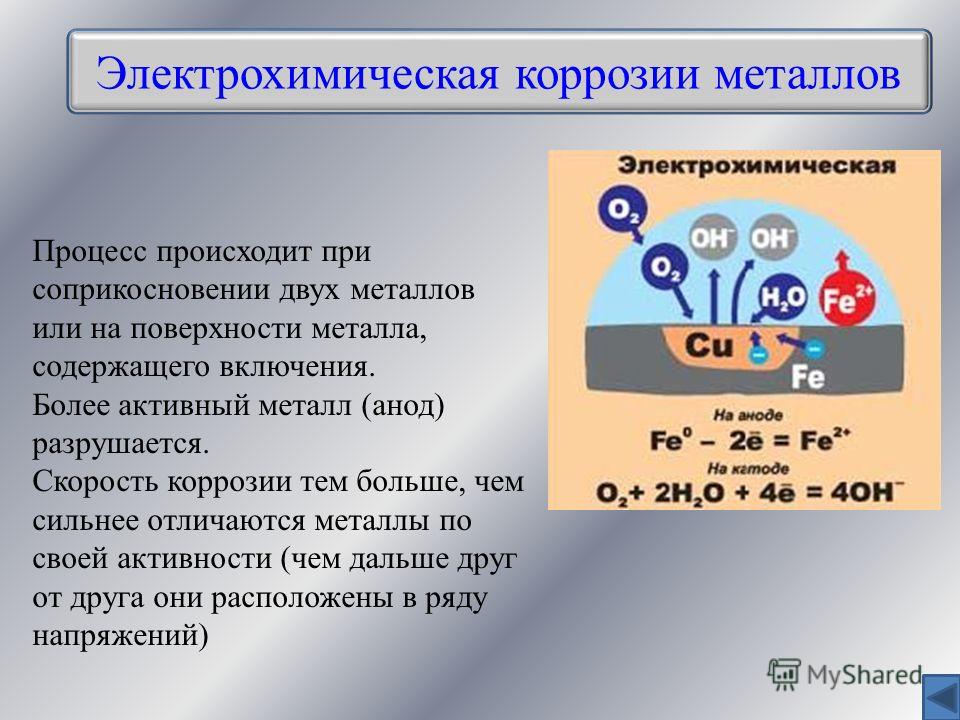 Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
что это и как с ней бороться
Все статьи
Коррозия — процесс разрушения металла под воздействием влаги, агрессивных веществ, с которым контактирует покрытие или изделие в процессе эксплуатации. Это явление распространено, его можно увидеть дома, на улице и на работе. Когда металл оказывается в щелочной, кислой среде начинается окисление, которое со временем преобразуется в ржавчину. Другими словами, происходит химическая коррозия.
Сегодня поговорим о другом типе коррозии, которая образуется из-за «блуждающих токов». Именно она появляется на кранах, полотенцесушителях и прочем сантехническом оборудовании. Разрушение металла «блуждающими токами» называют электрохимической коррозией.
Этому коррозийному процессу подвержены многие металлы, включая надёжную и долговечную нержавеющую сталь. Под воздействием электромеханического влияния изделие быстро теряет привлекательность, происходит разрушение швов, соединений, стенок металла. В результате возникает угроза аварийных ситуаций, вплоть до серьезных протечек, грозящих соседям снизу затоплением и порчей имущества.
Как определить электрохимическую коррозию
Рассмотрим пример образования признаков электрохимкоррозии на полотенцесушителе.
Оборудование производят из всевозможного сырья. Лучшим вариантом считаются модели из нержавейки, так как эксплуатационный период такого изделия гораздо продолжительней, нежели срок использования аналогов из других металлов.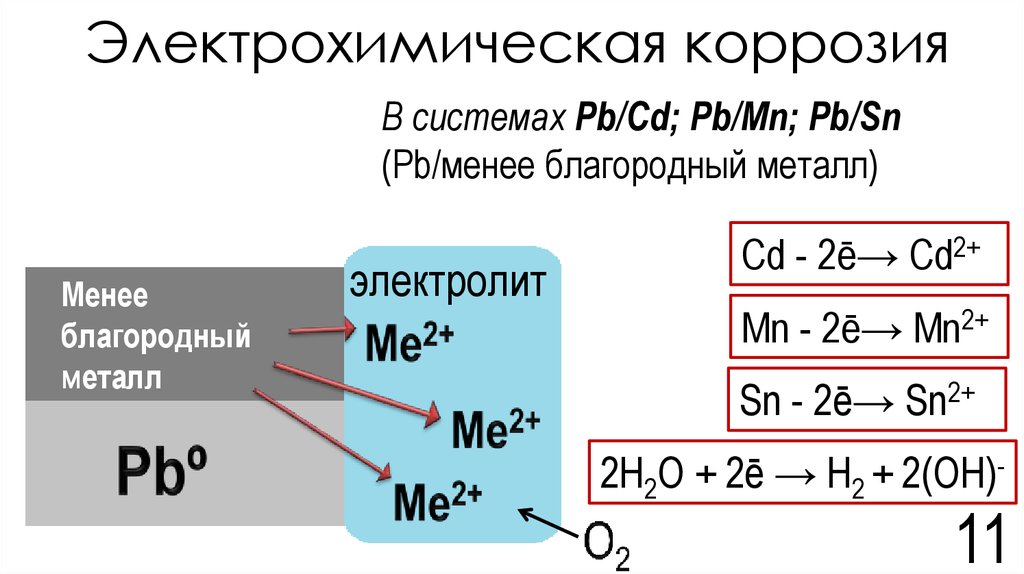 Однако, нержавеющая сталь не всегда способна справиться с агрессивным воздействием электрохимической коррозии.
Однако, нержавеющая сталь не всегда способна справиться с агрессивным воздействием электрохимической коррозии.
На начальный процесс разрушения указывают практически незаметные пятна ржавчины, которая образуется на поверхности изделия, далее они добавляют в размерах, а значит — процесс прогрессирует и становится глубже.
Если очистить ржавчину грубым абразивом, то под ней прячется черная точка, говорящая об активном развитии разрушения. Так, ржавчина «поедает» металл снаружи и изнутри, создавая небольшое отверстие. В подобных случаях повреждениям подвергаются все изделие, включая фитинги. Коррозия, как правило, начинает развиваться на слабых участках, которыми являются сварные швы.
Если ржавчина обнаружена на изделии, изготовленном из стали высокого класса, то наверняка проблема заключается в наличии в воде электричества.
Электрохимкоррозия работает при поддержке «помощников», например, хлора, который используется предприятиями для обеззараживания воды, окислителя кислорода, солей кальция, магния и прочие вещества.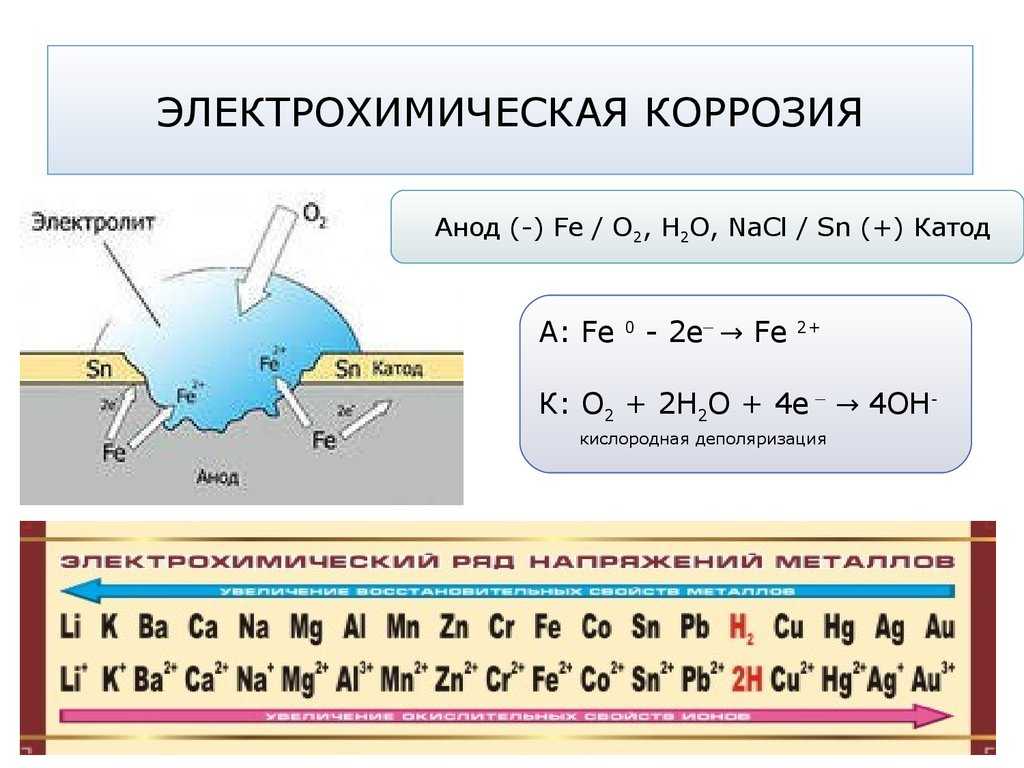 Ржавчина активно распространяется под воздействием горячей воды — если жидкость внутри трубы нагревается свыше 70°С, разрушающее действие ускоряется.
Ржавчина активно распространяется под воздействием горячей воды — если жидкость внутри трубы нагревается свыше 70°С, разрушающее действие ускоряется.
Почему появляется коррозия?
Чтобы понимать всю схему появления ржавчины на сантехническом оборудовании, стоит знать, откуда в воде появляется электричество.
Среди причин:
- Если дом относится к старым постройкам, в нем может быть нереализованным качественное заземление, которое обязательно, если в квартире установлено множество бытовых приборов и современная сантехника, например, ванна с гидромассажем, водонагреватели и пр. Заземление обеспечивает безопасность использования техники.
При эксплуатации оборудования, которое имеет те или иные дефекты, происходит утечка токов, которые отправляются в стояки и взаимодействуют с водой. Таким образом появляются точечные «пробои», которые провоцируют образование ржавчины.
Если заземление выполнено в соответствии с нормативами, подобные неприятности не появятся.

- Если в доме проживают любители сэкономить на оплате коммунальных счетов за электроэнергию, появляется проблема электрохимической коррозии. Так, недобросовестные жильцы используют стояк как нулевой провод или же применяют специальные приборы, чтобы «скрутить» показатели счетчика электроэнергии. В результате этих и других манипуляций высоки риски образования коррозийных процессов. Также ситуация небезопасна для жизни — при прикосновении к трубе существует риск удара током.
- Разница потенциалов между металлами провоцирует образование неприятности. Токи возникают, если два разных металла плотно контактируют друг с другом. Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов.
- Сегодня широко распространены новые материалы, используемые для изготовления труб и сантехнического оборудования: металлопластик, полиэтилен и пр.
 Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно.
Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно. - Образованию токов подвержены не только стояки, но и коммуникации, находящиеся под землей. Блуждающее электричество, находящееся в них, может попасть и в квартиру. На подземные системы оказывают воздействие электрический транспорт (трамвай, троллейбус, поезда метро). Появляются токи утечки, а устранить проблему смогут только эксплуатирующие компании, обязанные проводить тщательные проверки.
- Проблемы нередко возникают, если невдалеке от труб, отвечающих за подачу воды и отопление, присутствует электропроводка с некачественной изоляцией. Повреждения провоцируют появление токов, которые блуждают по трубам водоснабжения.

- Среди причин коррозии — статическое электричество, накапливающееся на металле при контакте с водой.
Произвести контроль над соответствием рекомендованных норм и соблюдением правил монтажа и использования оборудования в высотном доме не представляется возможным. Зачастую подобные работы выполняют мастера без опыта или с его минимальным наличием.
Как следствие — аварийные ситуации и неприятные последствия для жильцов дома. Если полотенцесушитель подвергается коррозии, вы можете не иметь к этому отношения, а также не приостановите процесс из-за разрушения инженерного оборудования по причинам, независящим от вас.
Как предотвратить электрохимическую коррозию
Существует несколько мер, которые помогут предотвратить разрушение металла:
- Приобретая полотенцесушитель, откажитесь от его установки. Работу стоит доверить опытным мастерам, которые имеют допуск к проведению подобных мероприятий.
- Конструкции в обязательном порядке нуждается в заземлении, что особенно актуально для тех, кто врезал пластиковые трубы, расположенные между общим стояком и полотенцесушителем.

Для заземления оборудования можно предпринять несколько вариантов:
- Если стояк и его элементы изготовлены из металла, необходимо соединить стояк, например, с помощью хомута и медного провода, сечение которого не меньше 4 мм2. Затем от стояка горячего водоснабжения подключаются проводом к PE-шине и электрическому щиту, находящемуся на этаже. Для обеспечения полной безопасности при эксплуатации полотенцесушителя проводят заземления других токопроводящих объектов, включая ванны, изготовленные из нержавеющей стали и чугуна.
- Когда стояк и его компоненты изготовлены из полимеров, необходимо установить металлическую вставку, отвечающую диаметру трубы. Деталь вставляют между соединением полотенцесушителя и шаровым краном. На вставку монтируют зажим заземления. Используя провод из меди, подключаются к электрощиту.
- В случае, когда стояк состоит из пластиковых и металлических элементов, устанавливают вставку из металла между монтируемым оборудованием и шаровым краном.
 На нее крепят зажим и посредством медного кабеля подключаются к щиту.
На нее крепят зажим и посредством медного кабеля подключаются к щиту. - Еще одно решение задачи — установка системы для уравнивания потенциалов. Монтаж выполняют непосредственно в ванной. Такой шаг позволит избежать коррозии, а также минимизирует риски, связанные с ударом тока. Если за систему водоснабжения отвечают трубы из полимеров, то к ближайшему электрощиту также выполняются подключение заземляющих повод.
- В продаже представлено множество моделей полотенцесушителей. Эксперты рекомендуют не приобретать слишком дешевые конструкции. Для безопасной и длительной эксплуатации стоит обратить внимание на оборудование, снабженное защитой от «блуждающих токов». Полотенцесушители работают на базе полимера, которым обрабатывают внутреннюю часть трубы. Он ликвидирует контакт воды с металлом.
- Полимер полностью безопасен, так как не содержит вредных веществ, способных навредить человеку. Он не боится чрезмерно высокой температуры, не подвержен разрушению. Стоимость подобной продукции немногим выше стандартных изделий, при этом срок службы превышает период работы аналогов в несколько раз.

- Электрическая коррозия устраняется также заменой оборудования на электрическое. В этом случае нагрев полотенцесушителя начинается при подключении устройства к розетке. Как правило, на корпусе присутствует кнопка, позволяющая включать или отключать его. Это хорошее решение для многих людей, ищущих безопасный и долговечный вариант. Прибор функционирует автономно, не зависит от работоспособности системы водоснабжения, а значит — вы сможет прогреть помещение и высушить вещи даже в том случае, если горячей воды в кране нет. Минус прибора — потребление электроэнергии, за которую придется платить.
Важно! Если выбор пал на электрическое оборудование, следует знать, что оно имеет невысокую мощность, поэтому может работать от стационарного источника питания — розетки. Однако, учитывайте, что прибор работает в ванной, где преобладает высокая влажность, а значит его подключение должно проводиться через УЗО и автомат.
Мы попытались рассказать все самое важное об электрохимической коррозии и методах ее предотвращения/устранения. Вероятно, вы не столкнетесь с подобной проблемой, но, если она уже обнаружена, лучше сразу заявить о неприятности инженеру управляющей компании.
Вероятно, вы не столкнетесь с подобной проблемой, но, если она уже обнаружена, лучше сразу заявить о неприятности инженеру управляющей компании.
Специалист должен рассказать, какие меры стоит предпринять, какое оборудование станет оптимальным вариантом для вашей ванной комнаты. После установки инженер выполнит проверку полотенцесушителя на предмет герметичности, а также подпишет акт ввода прибора в эксплуатации.
Монтаж полотенцесушителя желательно поручить опытному мастеру, ведь от корректности установки во многом зависит долговечность прибора, а также безопасность и комфорт пользователей.
Электрохимическая коррозия металлов — Студопедия
Поделись
Коррозией металлов называется процесс их разрушения в результате взаимодействия с окружающей средой. Коррозия металлов может протекать по химическому и электрохимическому механизму. Химическая коррозия является следствием химического взаимодействия металла с тем или иным окислителем окружающей среды. Электрохимическая коррозия в простейшем случае протекает вследствие работы на поверхности металла короткозамкнутых гальванических элементов – гальванопар.
Причин образования короткозамкнутых гальванопар множество: например, кристаллическая неоднородность металла, микрошероховатость поверхности, наличие примесей и пр. все это приводит к тому, что различные участки поверхности имеют различные значения электродного потенциала, т.е. поверхность металла может рассматриваться как совокупность электродов, одни из которых в условиях контакта поверхности с электролитом окружающей среды будут играть роль анода, другие катода. В отличие от обычных гальванических элементов анод и катод гальванопар на поверхности металла имеют общий электролит.
В типичных случаях электрохимической коррозии короткозамкнутые гальванопары имеют микроскопические размеры и потому называются микрогальванопарами. Коррозию металла вызывает работа не всех микрогальванопар, а лишь тех, в которых металл играет роль анода. Общую схему таких микрогальванопар можно записать следующим образом:
neˉ
|¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯↓
А − Ме │электролит окружающей среды│катодный участок + К
↑____________________|
При работе таких микрогальванопар коррозию металла вызывает процесс его анодного окисления: Ме = Меn+ +neˉ. На катодных участках происходит восстановление окислителя электролита. В кислой среде восстанавливаются ионы Н+ согласно уравнению: 2Н+ + 2еˉ = Н2. В остальных случаях протекает процесс восстановления атмосферного кислорода с участием воды: О2 + 2Н2О + 4 еˉ = 4ОН‾
На катодных участках происходит восстановление окислителя электролита. В кислой среде восстанавливаются ионы Н+ согласно уравнению: 2Н+ + 2еˉ = Н2. В остальных случаях протекает процесс восстановления атмосферного кислорода с участием воды: О2 + 2Н2О + 4 еˉ = 4ОН‾
ПРИМЕР 3: электрохимическая коррозия железа в кислой среде.
В качестве конкретного примера рассмотрим коррозию железа в воздухе, содержащем сернистый газ SO2. На поверхности железа в данном случае образуется пленка сернистой кислоты вследствие взаимодействия сернистого газа с парами воды: SO2 +Н2О = Н2 SO3. Записываем схему микрогальванопар, работа которых в рассматриваемых условиях будет приводить к коррозии железа:
А — Fe| Н2 SO3| катодный участок +К
Записываем уравнение электродных процессов, протекающих при работе таких микрогальванопар:
А: Fe = Fe2++2е‾ − окисление железа на анодных участках (коррозия железа)
К: 2Н+ + 2еˉ = Н2 − восстановление ионов Н+ на катодных участках.
Fe + 2Н+ = Fe2++Н2 − суммарное уравнение электрохимической коррозии.
ПРИМЕР 4: Атмосферная коррозия железа.
Атмосферная коррозия – это электрохимическая коррозия металлов, протекающая в нейтральной среде. Коррозия железа в данных условиях происходит вследствие работы микрогальванопар: А − Fe| O2 , Н2О | катодный участок +К. процессы, протекающие при работе таких микрогальванопар, выражаются следующими уравнениями:
А: Fe = Fe2++2е— − окисление железа на анодных участках (коррозия железа)
К: О2 + 2Н2О + 4 еˉ = 4ОН‾ − восстановление на катодных участках
2 Fe + О2 + 2 Н2О = 2 Fe2++4ОН‾ − суммарное уравнение электрохимической коррозии.
Чтобы предохранить металл от разрушения применяются разнообразные способы защиты от электрохимической коррозии, но все они имеют одно общее: обеспечение условий, предотвращающих работу микрогальванопар.
Наиболее распространенным является метод защиты от коррозии путем создания на поверхности металлов изолирующих покрытий: лакокрасочные покрытия, покрытие металлов другими металлами и пр. Механизм защитного действия изолирующих покрытий заключается в том, что они предотвращают доступ окружающей среде к поверхности металла, тем самым делая невозможным работу микрогальванопар (для работы микрогальванопар необходимы не только анодный и катодный участки, но и электролит). При разрушении покрытия, даже незначительном, в месте нарушения сплошности открывается доступ окружающей среды к поверхности металла и тем самым создаются условия для работы микрогальванопар.
Среди изолирующих защитных покрытий особое место занимают металлические покрытия. По механизму коррозионного разрушения при нарушении целостности покрытия различают анодные и катодные металлические покрытия.
Если электродный потенциал металла покрытия меньше электродного потенциала защищаемого металла, то по отношению к защищаемому металлу металл покрытия является анодом. Поэтому такие металлические покрытия называются анодными. При работе гальванопар в местах нарушения сплошности анодного покрытия разрушается металл покрытия (анод), а защищенный металл (катод) не разрушается.
Поэтому такие металлические покрытия называются анодными. При работе гальванопар в местах нарушения сплошности анодного покрытия разрушается металл покрытия (анод), а защищенный металл (катод) не разрушается.
Если же электродный потенциал металла покрытия больше электродного потенциала защищаемого металла, такое покрытие называется катодным, т.к. по отношению к защищаемому металлу металл покрытия является катодом. Поэтому при работе гальванопар в местах нарушения сплошности катодного покрытия коррозии подвергается защищаемый металл.
ПРИМЕР 5: коррозионные процессы в нейтральной среде при нарушении сплошности анодного и катодного покрытия на железе.
Для железа (Е°= −0,44 В) анодным является покрытие из любого металла с меньшим значением электродного потенциала, например, цинк (Е°= −0,76 В). при нарушении сплошности такого покрытия в нейтральной среде будут работать гальванопары: А–Zn | O2 , Н2О | Fe + К. анодный и катодный процессы, протекающие при том, выражаются уравнениями:
А: Zn = Zn 2++2е— − окисление цинка (коррозия металла покрытия)
К: О2 + 2Н2О + 4 еˉ = 4ОН‾ − восстановление на железе.
2Zn + О2 + 2 Н2О = 2 Zn2++4ОН‾ − суммарное уравнение электрохимической коррозии.
Из записанных уравнений видно, что цинк (и любое анодное покрытие) защищает железо от коррозии не только, пока оно цело, но и в случае нарушения сплошности покрытия.
Для создания на железе катодного покрытия необходимо использовать любой металл с большим значением электродного потенциала, например, никель (Е°= −0,25 В). При нарушении сплошности никелевого покрытия в нейтральной среде будут работать гальванопары: А– Fe | O2 , Н2О | Ni + К. Анодный и катодный процессы при работе данных гальванопар следующие:
А: Fe = Fe 2++2е— − окисление железа (коррозия защищаемого металла)
К: О2 + 2Н2О + 4 еˉ = 4ОН‾ − восстановление на никеле.
2 Fe + О2 + 2 Н2О = 2 Fe 2++4ОН‾ − суммарное уравнение электрохимической коррозии.
Как видим, при нарушении сплошности катодное покрытие не защищает железо от коррозии.
Из всех случаев коррозии металлов наиболее типичной и часто встречающейся является коррозия железа (сплавов железа). Из выше рассмотренных примеров видно, что электрохимическая коррозия железа заключается в его анодном окислении, в результате чего образуются ионы Fe2+ во внешней среде. Для этого в лабораторной работе используется качественная реакция с красной кровяной солью К3 |Fe (CN6)|. Данная качественная реакция заключается в том, что комплексные ионы красной кровяной соли, взаимодействуя с ионами Fe 2+ , образуют соединение с характерной синей окраской –турнбулеву синь Fe 3|Fe (CN)6|2 : 3 Fe 2++2|Fe (CN6)|3- = Fe 3|Fe (CN)6|2
Измерения электрохимической коррозии — гальваническая коррозия Gamry Instruments
Обзор электрохимических основ коррозии
Большая часть коррозии металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита. Например, тонкая пленка влаги на поверхности металла образует электролит для атмосферной коррозии. Второй пример: влажный бетон является электролитом для усиления коррозии арматурных стержней в мостах. Хотя большая часть коррозии происходит в воде, коррозия в неводных системах не является чем-то неизвестным.
Например, тонкая пленка влаги на поверхности металла образует электролит для атмосферной коррозии. Второй пример: влажный бетон является электролитом для усиления коррозии арматурных стержней в мостах. Хотя большая часть коррозии происходит в воде, коррозия в неводных системах не является чем-то неизвестным.
Коррозия обычно происходит со скоростью, определяемой равновесием между противоположными электрохимическими реакциями. Одной из реакций является анодная реакция, при которой металл окисляется, высвобождая электроны в металл. Другая — катодная реакция, в которой растворенные частицы (часто O 2 или H + ) восстанавливаются, удаляя электроны из металла. Когда эти две реакции находятся в равновесии, поток электронов от каждой реакции уравновешивается, и суммарный поток электронов (электрический ток) не возникает. Две реакции могут происходить на одном металле или на двух разнородных металлах (или металлических участках), которые электрически связаны.
Рисунок 1 иллюстрирует этот процесс. По вертикальной оси отложен электрический потенциал, по горизонтальной оси отложен логарифм абсолютного тока. Теоретический ток для анодной и катодной реакций представлен прямыми линиями. Изогнутая линия — это общий ток: сумма анодного и катодного токов. Это ток, который вы измеряете, когда измеряете потенциал металла своим потенциостатом. Острая точка на кривой на самом деле является точкой, где ток меняет полярность при изменении реакции с анодной на катодную или наоборот. Острая точка вызвана построением графика вдоль логарифмической оси. Использование логарифмической оси необходимо из-за широкого диапазона значений тока, которые должны быть зарегистрированы во время эксперимента по коррозии. Из-за явления пассивности ток во время коррозионного эксперимента часто изменяется на шесть порядков.
По вертикальной оси отложен электрический потенциал, по горизонтальной оси отложен логарифм абсолютного тока. Теоретический ток для анодной и катодной реакций представлен прямыми линиями. Изогнутая линия — это общий ток: сумма анодного и катодного токов. Это ток, который вы измеряете, когда измеряете потенциал металла своим потенциостатом. Острая точка на кривой на самом деле является точкой, где ток меняет полярность при изменении реакции с анодной на катодную или наоборот. Острая точка вызвана построением графика вдоль логарифмической оси. Использование логарифмической оси необходимо из-за широкого диапазона значений тока, которые должны быть зарегистрированы во время эксперимента по коррозии. Из-за явления пассивности ток во время коррозионного эксперимента часто изменяется на шесть порядков.
Рис. 1. Процесс коррозии, показывающий анодную и катодную составляющие тока.
Потенциал металла является средством, с помощью которого анодная и катодная реакции поддерживаются в равновесии. Обратитесь к рисунку 1. Обратите внимание, что ток каждой полуреакции зависит от электрохимического потенциала металла. Предположим, что анодная реакция высвобождает слишком много электронов в металл. Таким образом, избыточные электроны сдвигают потенциал металла в сторону отрицательного значения, что замедляет анодную реакцию и ускоряет катодную. Это противодействует начальному возмущению системы.
Обратитесь к рисунку 1. Обратите внимание, что ток каждой полуреакции зависит от электрохимического потенциала металла. Предположим, что анодная реакция высвобождает слишком много электронов в металл. Таким образом, избыточные электроны сдвигают потенциал металла в сторону отрицательного значения, что замедляет анодную реакцию и ускоряет катодную. Это противодействует начальному возмущению системы.
Равновесный потенциал металла при отсутствии электрических соединений с металлом называется потенциалом холостого хода, E oc . В большинстве экспериментов по электрохимической коррозии первым этапом является измерение E oc .
Значение либо анодного, либо катодного тока при E oc называется током коррозии, I corr . Если бы мы могли измерить I corr , мы могли бы использовать его для расчета скорости коррозии металла. К сожалению, я корр. нельзя измерить напрямую. Однако его можно оценить с помощью электрохимических методов. В любой реальной системе I соответствует и скорость коррозии зависят от многих параметров системы, включая тип металла, состав раствора, температуру, движение раствора, историю металла и многие другие.
В любой реальной системе I соответствует и скорость коррозии зависят от многих параметров системы, включая тип металла, состав раствора, температуру, движение раствора, историю металла и многие другие.
Приведенное выше описание процесса коррозии ничего не говорит о состоянии поверхности металла. На практике многие металлы при коррозии образуют на своей поверхности оксидный слой. Если оксидный слой препятствует дальнейшей коррозии, говорят, что металл пассивируется. В некоторых случаях локальные участки пассивной пленки разрушаются, что приводит к значительной коррозии металла на небольшом участке. Это явление называется точечной коррозией или просто точечной коррозией.
Поскольку коррозия происходит в результате электрохимических реакций, электрохимические методы идеально подходят для изучения процессов коррозии. В электрохимических исследованиях образец металла с площадью поверхности несколько квадратных сантиметров используется для моделирования металла в коррозионной системе. Образец металла погружают в раствор, характерный для среды металла в исследуемой системе. Дополнительные электроды погружаются в раствор, и все электроды подключаются к устройству, называемому потенциостатом. Потенциостат позволяет изменять потенциал металлического образца контролируемым образом и измерять протекающий ток в зависимости от приложенного потенциала.
Образец металла погружают в раствор, характерный для среды металла в исследуемой системе. Дополнительные электроды погружаются в раствор, и все электроды подключаются к устройству, называемому потенциостатом. Потенциостат позволяет изменять потенциал металлического образца контролируемым образом и измерять протекающий ток в зависимости от приложенного потенциала.
Полезны как поляризация с контролируемым потенциалом (потенциостатическая), так и поляризация с регулируемым током (гальваностатическая). При потенциостатической поляризации измеряется ток, а при гальваностатической — потенциал. Это обсуждение будет сосредоточено на методах с контролируемым потенциалом, которые гораздо более распространены, чем гальваностатические методы. За исключением зависимости потенциала холостого хода от времени, электрохимического шума, гальванической коррозии и некоторых других, потенциостатический режим используется для нарушения равновесного процесса коррозии. Когда потенциал металлического образца в растворе отклоняется от E oc , это называется поляризацией образца. Отклик (то есть результирующий ток) металлического образца измеряется по мере его поляризации. Ответ используется для разработки модели коррозионного поведения образца.
Отклик (то есть результирующий ток) металлического образца измеряется по мере его поляризации. Ответ используется для разработки модели коррозионного поведения образца.
Количественная теория коррозии
В предыдущем разделе мы указывали, что I corr нельзя измерить напрямую. Во многих случаях вы можете оценить его по данным зависимости тока от напряжения. Вы можете измерить логарифмическую кривую зависимости тока от потенциала в диапазоне около половины вольта. Развертка напряжения сосредоточена на E ок . Затем вы подгоняете измеренные данные к теоретической модели процесса коррозии.
Модель, которую мы используем для процесса коррозии, предполагает, что скорости как анодного, так и катодного процессов контролируются кинетикой реакции переноса электрона на поверхности металла. Обычно это относится к коррозионным реакциям. Электрохимическая реакция под кинетическим контролем подчиняется уравнению. 1, уравнение Тафеля.
В этом уравнении
я | — ток, возникающий в результате реакции . |
I 0 | — константа, зависящая от реакции, называемая током обмена . |
Е | — электродный потенциал |
Е 0 | – равновесный потенциал (постоянный для данной реакции) |
β | — постоянная Тафеля реакции (постоянная для данной реакции, выраженная в вольтах на декаду. |
Уравнение Тафеля описывает поведение одной изолированной реакции. В системе коррозии у нас есть две противоположные реакции: анодная и катодная.
Уравнения Тафеля для анодной и катодной реакций в коррозионной системе можно объединить для получения уравнения Батлера-Фольмера (уравнение 2).
где
я | — измеренный ток от ячейки в амперах |
I корр. | — ток коррозии в амперах |
Е | — электродный потенциал |
Е корр | — потенциал коррозии в вольтах |
β а | – анодная постоянная Тафеля β в вольтах на декаду |
β с | – катодная β-постоянная Тафеля в вольтах на декаду |
Что означает уравнение. 2 предсказать кривую зависимости тока от напряжения? В E corr каждый экспоненциальный член равен единице. Следовательно, ток ячейки равен нулю, как и следовало ожидать. Рядом с Е corr , оба экспоненциальных члена вносят вклад в общий ток. Наконец, поскольку потенциал управляется потенциостатом далеко от E corr , преобладает один экспоненциальный член, а другим членом можно пренебречь. Когда это происходит, график зависимости логарифмического тока от потенциала становится прямой линией.
Когда это происходит, график зависимости логарифмического тока от потенциала становится прямой линией.
График зависимости log I от Е называется графиком Тафеля. График Тафеля на рисунке 1 был создан непосредственно из уравнения Батлера-Фольмера. Обратите внимание на линейные участки кривой тока ячейки.
На практике многие коррозионные системы кинетически контролируются и, таким образом, подчиняются уравнению. 2. Кривая логарифмической зависимости тока от потенциала, линейная по обе стороны от E corr , указывает на кинетический контроль изучаемой системы. Однако могут быть осложнения, такие как:
- Концентрационная поляризация, когда скорость реакции контролируется скоростью, с которой реагенты достигают поверхности металла. Часто катодные реакции демонстрируют концентрационную поляризацию при более высоких токах, когда диффузия кислорода или иона водорода недостаточно быстрая, чтобы поддерживать кинетически контролируемую скорость.
- Образование оксида, которое может привести или не привести к пассивации.
 Этот процесс может изменить поверхность тестируемого образца. Исходная поверхность и измененная поверхность могут иметь разные значения констант в уравнении. 2.
Этот процесс может изменить поверхность тестируемого образца. Исходная поверхность и измененная поверхность могут иметь разные значения констант в уравнении. 2. - Другие эффекты, которые изменяют поверхность, такие как предпочтительное растворение одного компонента сплава, также могут вызывать проблемы.
- Смешанный контрольный процесс, в котором одновременно происходит более одной катодной или анодной реакции, может усложнить модель. Примером смешанного контроля является одновременное восстановление кислорода и иона водорода.
- Наконец, падение потенциала в результате прохождения тока ячейки через сопротивление раствора ячейки вызывает ошибки в кинетической модели. Этот последний эффект, если он не слишком серьезный, может быть устранен с помощью IR-компенсации в потенциостате.
В большинстве случаев осложнения, подобные перечисленным выше, вызывают нелинейность графика Тафеля. С осторожностью используйте результаты, полученные из графика Тафеля без четко определенной линейной области.
Классический анализ Тафеля выполняется путем экстраполяции линейных частей логарифмического графика зависимости тока от потенциала обратно к их пересечению. См. рис. 2 (который является перепечатанным рис. 1 с аннотациями, демонстрирующими анализ). Величина либо анодного, либо катодного тока на пересечении равна I корр . К сожалению, многие реальные системы коррозии не обеспечивают достаточную линейную область для точной экстраполяции. Большинство современных программ для испытаний на коррозию, таких как Corrosion Techniques от Gamry Instruments, выполняют более сложную численную подгонку к уравнению Батлера-Фольмера. Измеренные данные подходят к уравнению. 2 путем корректировки значений E corr , I corr , β a и β c . Преимущество метода подбора кривой состоит в том, что он не требует полностью развитой линейной части кривой.
Рис. 2. Классический анализ Тафеля.
Сопротивление поляризации
Ур. 2 можно еще больше упростить, ограничив потенциал очень близким к E corr . Вблизи E corr кривая зависимости тока от напряжения приближается к прямой линии. Наклон этой линии имеет единицы сопротивления (Ом). Наклон поэтому называется поляризационным сопротивлением, R p . Значение R p можно объединить с оценкой коэффициентов β, чтобы получить оценку тока коррозии.
2 можно еще больше упростить, ограничив потенциал очень близким к E corr . Вблизи E corr кривая зависимости тока от напряжения приближается к прямой линии. Наклон этой линии имеет единицы сопротивления (Ом). Наклон поэтому называется поляризационным сопротивлением, R p . Значение R p можно объединить с оценкой коэффициентов β, чтобы получить оценку тока коррозии.
Если мы аппроксимируем экспоненциальные члены в уравнении. 2 с первыми двумя членами разложения по степеням ( ) и упрощением, мы получаем одну форму уравнения Штерна-Гири:
распространяется в небольшом диапазоне потенциалов, который очень близок к E oc (обычно ±10 мВ). Численная аппроксимация кривой дает значение сопротивления поляризации R p . Данные поляризационного сопротивления не дают никакой информации о значениях коэффициентов β. Следовательно, чтобы использовать уравнение 3, вы должны указать значения β. Их можно получить из графика Тафеля или оценить на основе вашего опыта работы с тестируемой системой.
Расчет скорости коррозии на основе тока коррозии
Численный результат, полученный путем подгонки данных о коррозии к модели, обычно представляет собой ток коррозии. Нас интересуют скорости коррозии в более удобных единицах скорости проникновения, таких как миллиметры в год. Как ток коррозии используется для определения скорости коррозии? Предположим, реакция электролитического растворения с участием химического вещества S:
S ® S n + + n e–
Вы можете связать поток тока с массой с помощью закона Фарадея.
Q = nFM Ур. 4
где
В | — заряд в кулонах, полученный в результате реакции соединений S . |
нет | — количество электронов, переданных на молекулу или атом S . |
Ф | — постоянная Фарадея = 96 485 Кл/моль |
М | — количество молей частиц S, реагирующих с |
Более полезная форма уравнения. 4 требует понятия эквивалентного веса. Эквивалентный вес (EW) — это масса частиц S, которые будут реагировать с зарядом в один фарадей. Для атомарного вида EW = AW /n (где AW — атомный вес вида).
Вспоминая, что M = m /AW и подставляя в уравнение. 4 получаем:
, где m — масса прореагировавших частиц S.
В случаях, когда коррозия происходит равномерно по всей поверхности металла, скорость коррозии можно рассчитать в единицах расстояния в год. Будьте осторожны: этот расчет действителен только для однородной коррозии; он резко недооценивает проблему, когда возникает локальная коррозия!
Для сложного сплава, который подвергается равномерному растворению, эквивалентная масса представляет собой средневзвешенное значение эквивалентных масс компонентов сплава. В качестве весового коэффициента используется мольная доля, а не массовая доля. Если растворение неравномерное, для расчета EW может потребоваться измерение продуктов коррозии.
В качестве весового коэффициента используется мольная доля, а не массовая доля. Если растворение неравномерное, для расчета EW может потребоваться измерение продуктов коррозии.
Преобразование потери веса в скорость коррозии (CR) выполняется просто. Нам нужно знать плотность d и площадь образца A. Заряд определяется выражением Q = It, где t — время в секундах, а I — ток. Мы можем подставить значение постоянной Фарадея. Изменение уравнения 5,
где
I корр. | Ток коррозии в амперах |
К | Константа, определяющая единицы измерения скорости коррозии |
ЭВ | Эквивалентный вес в граммах/эквивалент |
д | Плотность в г/см 3 |
А | Площадь образца в см 2 |
Таблица 1. Константы скорости коррозии
Константы скорости коррозии
Единицы измерения скорости коррозии | К | Единицы |
мм/год (мм/год) | 3272 | мм (А-см-год) |
миллидюйма/год (млн/год) | 1,288 × 10 5 | миллидюйма (А-см-год) |
ИК-компенсация
Когда вы пропускаете ток между двумя электродами в проводящем растворе, в растворе всегда есть области с разными потенциалами. Большая часть общего изменения потенциала происходит очень близко к поверхности электродов. Здесь градиенты потенциала в значительной степени вызваны градиентами концентрации ионов, возникающими вблизи металлических поверхностей. Кроме того, всегда существует разность потенциалов (падение потенциала), вызванная протеканием тока через сопротивление в объеме раствора.
Кроме того, всегда существует разность потенциалов (падение потенциала), вызванная протеканием тока через сопротивление в объеме раствора.
В электрохимическом эксперименте потенциал, который вы хотите контролировать или измерять, представляет собой потенциал металлического образца (называемого рабочим электродом) относительно электрода сравнения. Обычно нас не интересуют падения потенциала, вызванные сопротивлением растворов, потому что они незначительны в типичных растворах электролитов, таких как 1 M H 2 SO 4 или 5% NaCl.
Потенциостаты Gamry Instruments, как и все современные электрохимические приборы, представляют собой трехэлектродные потенциостаты. Они измеряют и контролируют разность потенциалов между нетоковедущим эталонным электродом и одним из двух токоведущих электродов (рабочим электродом). Падение потенциала вблизи другого токоведущего электрода (противоэлектрода) не имеет значения при использовании трехэлектродного потенциостата.
Тщательное размещение контрольного электрода может компенсировать некоторое падение ИК-излучения, возникающее из-за тока ячейки, I, протекающего через сопротивление раствора, R. Вы можете думать об электроде сравнения как о взятии пробы потенциала где-то вдоль сопротивления раствора. Чем ближе он к рабочему электроду, тем ближе вы к измерению потенциала без ИК-ошибок. Однако на практике полная компенсация ИК-излучения не может быть достигнута за счет размещения электрода сравнения из-за конечных физических размеров электрода. Часть сопротивления ячейки, которая остается после размещения электрода сравнения, называется некомпенсированным сопротивлением, R и .
Потенциостаты Gamry могут использовать ИК-компенсацию прерывания тока или положительную обратную связь для динамической коррекции нескомпенсированных ошибок сопротивления. В методе прерывания тока ток ячейки периодически отключается на очень короткое время. При отсутствии протекания тока через растворное сопротивление его ИК-падение мгновенно исчезает. Падение потенциала на поверхности электрода остается постоянным в быстром временном масштабе. Разность потенциалов с протекающим током и без него является мерой некомпенсированного падения IR.
Падение потенциала на поверхности электрода остается постоянным в быстром временном масштабе. Разность потенциалов с протекающим током и без него является мерой некомпенсированного падения IR.
Потенциостат выполняет измерение прерывания тока сразу после получения каждой точки данных. Потенциостат фактически снимает три показания потенциала: E 1 перед отключением тока, а также E 2 и E 3 во время отключения (см. рис. 3). Обычно последние два используются для экстраполяции разности потенциалов ∆E до точного момента, когда ток был прерван. Время прерывания зависит от тока ячейки. Время прерывания составляет 40 мкс в диапазонах с более высоким током. В более низких диапазонах тока прерывание длится дольше.
Рисунок 3 . Потенциал прерывания тока в зависимости от времени.
В режимах с управляемым потенциалом приложенный потенциал может быть динамически скорректирован с учетом измеренной ИК-ошибки одним из нескольких способов. В простейшем из них ошибка IR из предыдущей точки применяется как поправка к приложенному потенциалу. Например, если требуется свободный от ИК-потенциала 1 В, а измеренная ИК-ошибка составляет 0,2 В, потенциостат применяет 1,2 В. Коррекция всегда отстает на одну точку, так как ИК-ошибка от одной точки применяется для исправления приложенного потенциал для следующего пункта. В дополнение к этому обычному режиму потенциостат Gamry Instruments предлагает более сложные режимы обратной связи, в которых две точки на кривой затухания усредняются.
В простейшем из них ошибка IR из предыдущей точки применяется как поправка к приложенному потенциалу. Например, если требуется свободный от ИК-потенциала 1 В, а измеренная ИК-ошибка составляет 0,2 В, потенциостат применяет 1,2 В. Коррекция всегда отстает на одну точку, так как ИК-ошибка от одной точки применяется для исправления приложенного потенциал для следующего пункта. В дополнение к этому обычному режиму потенциостат Gamry Instruments предлагает более сложные режимы обратной связи, в которых две точки на кривой затухания усредняются.
По умолчанию в режимах с управляемым потенциалом ошибка потенциала, измеренная с помощью прерывания тока, используется для корректировки приложенного потенциала. В режимах управляемого тока коррекция не требуется. Если выбрана компенсация ИК, измеренная ошибка ИК вычитается из измеренного потенциала. Таким образом, все зарегистрированные потенциалы свободны от ИК-ошибки.
Подробное теоретическое обсуждение некомпенсированного сопротивления см. в Keith B. Oldham, et al., Analytical Chemistry, 72 (2000), 39.72 и 3981.
в Keith B. Oldham, et al., Analytical Chemistry, 72 (2000), 39.72 и 3981.
Условные обозначения тока и напряжения
Полярность тока при электрохимических измерениях может быть непостоянной. Текущее значение -1,2 мА может означать разные вещи для работников разных областей электрохимии или в разных странах, или даже для разных потенциостатов. Для аналитического электрохимика это представляет собой 1,2 мА анодного тока. Для ученого-коррозиониста это соответствует 1,2 мА катодного тока. Потенциостат Gamry Instruments в режиме по умолчанию следует соглашению о коррозии для тока, в котором положительные токи являются анодными, а отрицательные — катодными. Для удобства наших пользователей по всему миру потенциостаты Gamry Instruments могут задать полярность тока в соответствии с вашими предпочтениями с помощью простой команды программного обеспечения.
Полярность потенциала также может быть источником путаницы. При измерении электрохимической коррозии равновесный потенциал, принимаемый металлом при отсутствии электрических соединений с металлом, называется потенциалом разомкнутой цепи, E oc . Мы используем термин коррозионный потенциал, E corr , для потенциала в электрохимическом эксперименте, при котором ток не протекает, как определено численной подгонкой данных зависимости тока от потенциала. В идеальном случае значения E oc и E corr идентичны. Одна из причин, по которой эти два напряжения могут различаться, заключается в том, что во время сканирования произошли изменения на поверхности электрода.
Мы используем термин коррозионный потенциал, E corr , для потенциала в электрохимическом эксперименте, при котором ток не протекает, как определено численной подгонкой данных зависимости тока от потенциала. В идеальном случае значения E oc и E corr идентичны. Одна из причин, по которой эти два напряжения могут различаться, заключается в том, что во время сканирования произошли изменения на поверхности электрода.
В большинстве современных потенциостатов все потенциалы указываются или сообщаются как потенциал рабочего электрода относительно электрода сравнения или потенциала холостого хода. Первый всегда помечен как «vs. E ref », а последний как «vs. Е ос ». Уравнения для преобразования одной формы потенциала в другую:
E против E
OC = (E против E Ref ) — E OC
E против E
Ref = (E против E OC ) + E OC
Независимо от того, соответствуют ли потенциалы E ref или E oc , используется одно соглашение о знаках. Чем больше положительный потенциал, тем он более анодный. Более анодные потенциалы ускоряют окисление на рабочем электроде. И наоборот, отрицательный потенциал ускоряет восстановление на рабочем электроде.
Чем больше положительный потенциал, тем он более анодный. Более анодные потенциалы ускоряют окисление на рабочем электроде. И наоборот, отрицательный потенциал ускоряет восстановление на рабочем электроде.
Некоторые ссылки по теории коррозии и электрохимическим испытаниям на коррозию
DC Electrochemical Test Methods, N.G. Томпсон и Дж.Х. Пайер, Национальная ассоциация инженеров-коррозионистов. ISBN: 1-877914-63-0.
Принципы и предотвращение коррозии, Денни А. Джонс, Прентис-Холл, 1996. ISBN 0-13-359993-0.
Метод сопротивления поляризации для определения мгновенной скорости коррозии, J.R. Scully, Corrosion, 56 (2000), 199. , ПА 19428. Их можно найти в томе 3.02 стандартов ASTM:
G 5: Потенциостатические и потенциодинамические измерения анодной поляризации
G 59: Измерения поляризационного сопротивления
G 61: Циклические поляризационные измерения для локализованной коррозионной восприимчивости железа, никеля -, и сплавы на основе кобальта
G 100: Циклическая гальваностерегная поляризация
G 106: Проверка алгоритма и оборудования для измерения электрохимического импеданса
G 108: Электрохимическая потенциокинетическая реактивация (ЭПР) для обнаружения сенсибилизации
G 150: Электрохимические испытания нержавеющих сталей при критической температуре точечной коррозии
Электрохимические методы в борьбе с коррозией, Национальная ассоциация инженеров-коррозионистов, 1986.
Коррозионные испытания и оценка, STP 1000, изд. Р. Бабоян и С.В. Декан Американского общества испытаний и материалов, Западный Коншохокен, Пенсильвания, 1991. ISBN 0-8031-1406-0.
Электрохимические испытания на коррозию, STP 727, ред. Ф. Мансфельд и У. Берточчи, Американское общество испытаний и материалов, Западный Коншохокен, Пенсильвания, 1979.
Corrosion and Corrosion Control, 3-е изд., Herbert H. Uhlig, John Wiley and Sons, New York, 1985.
Хотите PDF-версию этого указания по применению?
Пожалуйста, заполните следующую форму, и мы отправим ссылку на ваш почтовый ящик!
Этот сайт использует файлы cookie. Вы можете прочитать, как мы их используем, в нашей политике конфиденциальности.
Закрыть
Электрохимическая теория гальванической коррозии
Лицензионное соглашение ASTM
ВАЖНО – ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ЭТИ УСЛОВИЯ ПЕРЕД ЗАГРУЗКОЙ ЭТОГО ДОКУМЕНТА.
Загружая документ ASTM, вы заключаете договор и признаете, что
у вас есть
читать
настоящего Лицензионного соглашения, что вы понимаете его и соглашаетесь соблюдать его
условия.
Если вы не согласны с условиями настоящего Лицензионного соглашения, немедленно покиньте эту страницу.
без
скачивание
документ ASTM.
Пожалуйста, , нажмите здесь , чтобы просмотреть лицензионное соглашение для образовательных учреждений.
Собственность.
Этот документ защищен авторским правом ASTM International (ASTM), 100
Барр Харбор Драйв, Западный Коншохокен, Пенсильвания, 19428-2959, США.
Все права защищены. Вы (Лицензиат) не имеете прав собственности или других прав на Документ ASTM.
Это не продажа; все права, право собственности и интересы в документе ASTM (как в электронном файле
и печатная копия) принадлежат ASTM.
Вы не можете удалять или скрывать уведомление об авторских правах или другие уведомления, содержащиеся в ASTM.
Документ.
Ограниченная лицензия.
ASTM предоставляет вам ограниченную лицензию без права передачи следующим образом:
Право на загрузку электронного файла настоящего документа ASTM для временного хранения на одном
компьютер для просмотра и/или печати одной копии документа ASTM
для отдельных
использовать.
Ни электронный файл, ни одиночная распечатка не могут быть воспроизведены каким-либо образом.
Кроме того, электронный файл не может распространяться где-либо еще по компьютерным сетям или
в противном случае.
То есть электронный файл нельзя отправить по электронной почте, скачать на диск, скопировать на другой жесткий диск.
диск или иным образом общий доступ. Одна печатная копия может быть распространена только среди других
сотрудники для их внутреннего использования в вашей организации; его нельзя копировать.
Этот документ ASTM не может быть продан или перепродан, сдан в аренду, сдан в аренду, одолжен или
сублицензия. Абонент будет нести ответственность за весь контроль доступа и безопасность
меры, необходимые для того, чтобы IP-адреса Абонента не использовались для
получать доступ к журналам, кроме авторизованных Пользователей.
ASTM International предоставляет подписчикам и авторизованным
Пользователи у Абонента Авторизованы
Сайт , онлайн-доступ к журналу ASTM, для которого Подписчик поддерживает текущую
подписка
к печатной или онлайн-версии. Этот грант распространяется только на Подписчика и таких Уполномоченных
Этот грант распространяется только на Подписчика и таких Уполномоченных
Пользователи индивидуально и не могут быть переданы или распространены на других. Для перепечатки А.
журнальную статью, пожалуйста, свяжитесь со службой поддержки клиентов ASTM, 100 Barr Harbour Dr., PO Box C700, West
Коншохокен, Пенсильвания 19428, тел.: 610-832-9555; факс: 610-832-9585; Эл. адрес:
[email protected]
Проверка:
ASTM имеет право проверять соблюдение настоящей Лицензии.
Соглашение за свой счет и в любое время в течение обычного рабочего дня. Для этого
ASTM привлечет независимого консультанта при условии соблюдения соглашения о конфиденциальности для рассмотрения
использование вами документов ASTM. Вы соглашаетесь разрешить доступ к вашей информации и компьютерным системам
для этой цели. Проверка будет проводиться с уведомлением не менее чем за 15 дней в обычное время.
Проверка будет проводиться с уведомлением не менее чем за 15 дней в обычное время.
в рабочее время и таким образом, чтобы необоснованно не мешать вашей деятельности. Если
проверка выявляет нелицензионное использование документов ASTM, вы должны возместить ASTM расходы
понесенные при проверке и возмещении ASTM за любое нелицензионное использование. Вызывая эту процедуру,
ASTM не отказывается от каких-либо прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности.
собственности иными способами, разрешенными законом.
Пароли.
Вы должны немедленно уведомить ASTM о любом известном или предполагаемом
несанкционированное использование вашего пароля или любое известное или предполагаемое нарушение безопасности, в том числе
потеря, кража или несанкционированное раскрытие вашего пароля или любой несанкционированный доступ или использование
документа ASTM. Вы несете единоличную ответственность за сохранение конфиденциальности ваших
Вы несете единоличную ответственность за сохранение конфиденциальности ваших
пароль и для обеспечения санкционированного доступа и использования документа ASTM.
Определения.
Для целей настоящей Лицензии авторизованным сайтом является
локализованный сайт
(одно географическое местоположение), находящееся под единым управлением в одном месте. Для
Подписчик с местонахождением более чем в одном городе, каждый город считается отдельным сайтом.
Для Подписчика, имеющего несколько местоположений в одном городе, каждое место считается
другой сайт. (Если вам нужен онлайн-доступ к нескольким сайтам, свяжитесь с Кэти
Hooper, ASTM International, по адресу [email protected] или по телефону: 610-832-9.634). Авторизованный
Пользователь означает
только сотрудники, преподаватели, сотрудники и студенты, официально связанные с Подписчиком в
Авторизованный сайт, а также лица, имеющие законный доступ к фондам и объектам библиотеки.
на Авторизованном сайте, используя IP-адрес в диапазоне, указанном в подписке.
Авторизованными пользователями могут быть лица, удаленные от физического местонахождения Абонента, доступ которых
администрируемых с Авторизованного объекта, но не лица, находящиеся на удаленных объектах или в кампусах с отдельными
администрации. Например, сотрудник Абонента может считаться
Авторизованный пользователь при доступе к сети Абонента из дома или во время поездки в другую
город; однако сотрудники филиала или объекта в другом городе не считаются
Авторизованные пользователи. Подписчик — это физическое или юридическое лицо, подписавшееся на
журнал ASTM
и согласился с условиями этой ограниченной лицензии.
Прекращение.
Настоящее Соглашение действует до момента расторжения. Вы можете расторгнуть настоящее Соглашение в любое время путем
Вы можете расторгнуть настоящее Соглашение в любое время путем
уничтожение всех копий (печатных, цифровых или на любом носителе) документа ASTM (журнала).
Применимое право, место проведения, юрисдикция.
Настоящее Соглашение должно толковаться и толковаться в соответствии с законодательством
Содружество Пенсильвании. Лицензиат соглашается подчиняться юрисдикции и месту проведения в штате
и федеральные суды Пенсильвании для разрешения любых споров, которые могут возникнуть в связи с настоящим Соглашением. Ты
также соглашаетесь отказаться от любых претензий на неприкосновенность, которыми вы можете обладать.
Интеграция.
Настоящее Соглашение представляет собой полное соглашение между вами и ASTM в отношении его предмета. Это
заменяет все предыдущие или одновременные устные или письменные сообщения, предложения,
заявлений и гарантий и имеет преимущественную силу над любыми противоречащими или дополнительными условиями любого
цитата, заказ, подтверждение или другое сообщение между сторонами, относящееся к его предмету
вопрос в течение срока действия настоящего Соглашения. Никакие изменения настоящего Соглашения не будут иметь обязательной силы,
Никакие изменения настоящего Соглашения не будут иметь обязательной силы,
если они не оформлены в письменной форме и не подписаны уполномоченным представителем каждой из сторон.
Отказ от гарантии.
Если не указано иное в настоящем Соглашении, все явные или подразумеваемые условия, заявления и
гарантии, включая любые подразумеваемые гарантии товарного состояния, пригодности для определенной цели
или ненарушение прав, за исключением случаев, когда эти отказы считаются
юридически недействительным.
Ограничение ответственности.
В той мере, в какой это не запрещено законом, ASTM ни при каких обстоятельствах не будет нести ответственность за любые потери, повреждения, утерю
данных или за особый, косвенный, косвенный или штрафной ущерб, независимо от того,
теория ответственности, возникающая в связи с использованием или загрузкой ASTM
Документ. Ни при каких обстоятельствах ответственность ASTM не будет превышать сумму, уплаченную вами по настоящей Лицензии.
Ни при каких обстоятельствах ответственность ASTM не будет превышать сумму, уплаченную вами по настоящей Лицензии.
Соглашение.
Эти документы защищены авторским правом ASTM International, 100 Barr Harbour Drive, PO Box C700, West.
Коншохокен, Пенсильвания 19428-2959 США. Все права защищены.
Коррозия – определение, виды, предотвращение, примеры
Электрохимия – это дисциплина физической химии, изучающая связь между электрическим потенциалом как поддающимся количественному определению явлением и распознаваемым химическим изменением, с электрическим потенциалом в результате определенного химического изменить или наоборот. Электроны перемещаются между электродами через электронно-проводящую фазу (обычно, но не всегда, внешнюю электрическую цепь, например, при гальваническом покрытии), которая разделена ионопроводящим и электроизолирующим электролитом (или ионными частицами в растворе).
Коррозия
Коррозия описывается как химическое и электрохимическое разрушение металлов или сплавов окружающей влажной и влажной средой. Коррозия является окислительным процессом, так как она происходит в присутствии кислорода. Почти все металлы подвержены коррозии, однако скорость коррозии зависит от металла.
Металлы образуют устойчивые соединения, такие как оксиды, гидроксиды и сульфиды, в результате коррозии, которая является спонтанным и необратимым процессом.
Факторы, влияющие на коррозию
- Положение металлов в электрохимическом ряду – В коррозии чрезвычайно важен электрохимический ряд. Активные металлы быстрее теряют электроны и быстрее подвергаются коррозии. Железо, например, быстро окисляется, а золото не потому, что оно менее реакционноспособно, чем железо.
- Примеси в металлах – В общем, присутствие загрязняющих веществ в металлах ускоряет коррозию, поскольку эти примеси действуют как микроскопические электрохимические ячейки, вызывающие коррозию.

- Наличие электролитов – Поскольку они переносят ионы, растворенная в воде соль действует как электролит. Коррозия ускоряется, когда в воде присутствуют электролиты.
- Концентрация кислорода – Коррозия ускоряется при увеличении содержания кислорода. Анод — это место с меньшей концентрацией кислорода, тогда как катод — это область с более высокой концентрацией кислорода. В результате происходит коррозия.
- Влажность в погоде – Во влажную погоду присутствие влаги с высокой температурой ускоряет коррозию, поскольку ионы приобретают энергию и начинают двигаться быстрее при более высокой температуре, что приводит к более частым столкновениям.
Типы коррозии
- Равномерная коррозия- Коррозия этого типа довольно распространена. Этот вид коррозии приводит к однородной потере металла по всей поверхности. Примерами являются ржавчина, потускнение серебра и т. д.
- Точечная коррозия- Точечная коррозия — это тип локальной коррозии, которая повреждает поверхность металла, приводя к появлению пятен или ямок.
 В нейтральных или кислых растворах, содержащих галогениды, таких как соленая вода, содержащая NaCl, в нержавеющих сталях может наблюдаться точечная коррозия.
В нейтральных или кислых растворах, содержащих галогениды, таких как соленая вода, содержащая NaCl, в нержавеющих сталях может наблюдаться точечная коррозия. - Щелевая коррозия- Щелевая коррозия вызывается застойным раствором в щелях по краям металлических поверхностей, таких как гайки и головки заклепок. Это может произойти при столкновении двух металлов или при столкновении металла с неметаллом. Например, коррозия металлических или неметаллических прокладок, муфт и соединений.
- Гальваническая коррозия- Когда два разнородных материала соединяются и вступают в электрический контакт с агрессивным электролитом, возникает гальваническая коррозия. Например, в оцинкованном железе лист железа или стали покрыт цинком.
- Коррозионное растрескивание под напряжением — Это форма коррозии, при которой на поверхности металла появляются трещины в результате комбинированного воздействия прочности на растяжение и агрессивной среды.
 Коррозионное растрескивание под напряжением (SCS) — это разновидность коррозии, которая возникает в авиационных компонентах.
Коррозионное растрескивание под напряжением (SCS) — это разновидность коррозии, которая возникает в авиационных компонентах. - Межкристаллитная коррозия — Это разновидность коррозии, которая возникает вокруг границ зерен металла или сплава, содержащего примеси, а не внутри металла или сплава. Литые под давлением цинковые сплавы, содержащие алюминий, подвергающиеся воздействию пара в морской среде, проявляют межкристаллитную коррозию.
- Делегирование — Это редкий вид коррозии, который затрагивает только определенные металлы, такие как медные сплавы и серый чугун. Металл сплава теряет свой реактивный элемент и создает более стабильный коррозионностойкий элемент в пористом состоянии в процессе удаления сплава. Деникелирование, децинкификация и графитовая коррозия — все это случаи удаления сплавов.
- Эрозионная коррозия- Эрозионная коррозия представляет собой механическое разрушение металлической поверхности.
 В агрессивной среде это вызвано относительной подвижностью частиц жидкости и твердых поверхностей. Например, заусенцы, оставленные на концах труб трубопровода, могут нарушить плавный поток воды, вызывая локальную турбулентность и высокие скорости потока, что приводит к эрозии-коррозии.
В агрессивной среде это вызвано относительной подвижностью частиц жидкости и твердых поверхностей. Например, заусенцы, оставленные на концах труб трубопровода, могут нарушить плавный поток воды, вызывая локальную турбулентность и высокие скорости потока, что приводит к эрозии-коррозии.
Различные примеры коррозии
Металлы с более высокой реакционной способностью, такие как железо, медь и цинк, подвержены коррозии быстрее. Коррозия может проявляться по-разному.
Ржавление железа
Ржавление – это процесс коррозии железа в присутствии воздуха и воды, в результате чего поверхность становится красновато-коричневой. Это происходит, когда железо окисляется в присутствии кислорода и воды. Ржавчина — это новое вещество с химической формулой Fe 2 O 3 .xH 2 O, представляющее собой гидратированную форму оксида железа (III) (где x варьируется).
Хотя ржавление железа является естественным явлением, этот процесс очень похож на реакцию электрохимической ячейки.
Анод образуется, когда железо теряет электроны и становится Fe 2+ .
на катоде:
H + +E– → H
4H +O 2 → 2H 2 O
4H + +O 2 +4E — → 2H +O 2 +4E — → 2H +O 2 +4E —
10 → 2H
+o 2 +4E —→ 2. 2 O
Оксиды железа далее окисляются до ионов железа, которые затем объединяются с H 2 O с образованием комплекса.
Полуреакция окисления
Fe(s)→Fe 2 +(aq) +2e — × 2 (E ∘ = –0,44 В)
Снижение полуреакции
4H + +O 2 +4E — → 2H. 2 O(E ∘ =1.23V)
Overall Cell reaction
E ∘ cell = E ∘ red – E ∘ oxd
E ∘ ячейка = 1,23–(–0,44)В
E ∘ ячейка = 1,67В
2FE (S)+4H ++O 2 → 2FE 2+ (AQ)+2H 2 O (E ∘ = 1,67 В)
2FE 3 ++ 2 → 2FE 2 O 3
FE 2 O 3 +XH 2 O → Fe 2 O 3 .
xh 2 O (Rust)
. меди
Под воздействием окружающей среды медные материалы или медные сплавы подвергаются коррозии. Когда медь окисляется, блестящая медная поверхность тускнеет, становясь темно-коричневой или черной, а затем зеленой. В результате этого выщелачивания медь подвергается коррозии.
Сине-зеленый цвет «Статуи Свободы» является примером коррозии медного металла. Он не был окрашен в тот же цвет, что и сейчас, когда был построен. Скорее, он был коричневого цвета. Медь, с другой стороны, со временем окислялась и взаимодействовала с триоксидом серы, углекислым газом и водой в атмосфере, образуя новое химическое вещество, которое придавало ей характерный сине-зеленый налет.
Ниже приводится химическое уравнение коррозии медного металла:
Потускнение серебра
Химическое взаимодействие между серебром и серосодержащими соединениями в воздухе вызывает потускнение серебра. Сульфид серебра образуется при смешивании серебра с серой. Потускнение – это процесс, при котором металлическое серебро становится черным из-за покрытия сульфидом серебра.
Сульфид серебра образуется при смешивании серебра с серой. Потускнение – это процесс, при котором металлическое серебро становится черным из-за покрытия сульфидом серебра.
Ниже приводится химическое уравнение потускнения металлического серебра:
2Ag+H 2 S → Ag 2 S+H 2
Методы предотвращения коррозии
Коррозия является нежелательным явлением, которого следует избегать, поскольку она наносит значительный ущерб металлическим конструкциям, таким как мосты, скульптуры, памятники, металлическая посуда и т.д.
Все методы предотвращения коррозии основаны на одной и той же базовой концепции: прекращение подачи воды и воздуха к металлам. Ниже приведены некоторые меры по предотвращению коррозии:
- Окраска- Окраска металлических изделий, таких как ворота и перила, предотвращает контакт металла с воздухом и водой. Покраска металлических изделий защищает их от коррозии.

- Смазка маслом и смазкой- Смазка маслом и смазкой, как и покраска, создает на металлической поверхности защитное покрытие, защищающее ее от коррозии.
- Гальванизация- Гальванизация — это процесс покрытия железных и стальных изделий тонким слоем цинка для их защиты. Оцинкованные изделия защищены от коррозии или ржавчины даже после разрушения цинкового покрытия.
- Легирование- Сплавы состоят из однородной комбинации металлов и неметаллов. Требуемых характеристик металлов можно добиться путем их легирования. Железо, например, очень полезный металл, но оно быстро ржавеет. В результате, когда это железо соединяется с никелем и хромом, создается нержавеющая сталь. Нержавеющая сталь в настоящее время широко используется в производстве посуды.
Примеры вопросов
Вопрос 1: Что такое коррозия?
Ответ
Коррозия – это химическое и электрохимическое разрушение металлов или сплавов, вызванное окружающей влажной и влажной средой.
Коррозия является окислительным процессом, так как она происходит в присутствии кислорода.
Вопрос 2: Как предотвратить коррозию?
Ответить
- Окраска, смазка и смазка изделий из железа предотвращает воздействие воздуха и воды на металл. Таким образом, предотвращается коррозия.
- Гальванизация — это процесс покрытия железных и стальных изделий тонким слоем цинка для их защиты. Оцинкованные изделия защищены от коррозии или ржавчины даже после разрушения цинкового покрытия.
- Мы можем добиться требуемых качеств металлов и предотвратить коррозию путем их легирования.
Вопрос 3: Какие факторы влияют на коррозию?
Ответ
Положение металлов в электрохимическом ряду, примеси в металлах, наличие электролитов, концентрация кислорода, атмосферная влажность и другие факторы окружающей среды, такие как высокая температура, наличие в атмосфере различных газов, вызывающих коррозия и т.
д. — все это факторы, влияющие на коррозию.
Вопрос 4: Какие существуют виды коррозии?
Ответ
Различные типы коррозии включают равномерную коррозию, точечную коррозию, щелевую коррозию, гальваническую коррозию, коррозионное растрескивание под напряжением, межкристаллитную коррозию, расслаивание, эрозионную коррозию.
Вопрос 5: Что такое потускнение серебра?
Ответ
Серебро тускнеет из-за химической реакции между серебром и серосодержащими химическими веществами в воздухе. При соединении серебра с серой образуется сульфид серебра. Потускнение происходит, когда слой сульфида серебра покрывает серебряный металл, делая его черным.
2Ag+H 2 S → Ag 2 S+H 2
Вопрос 6: Что такое ржавление железа?
Ответ
В присутствии воздуха и воды железо подвергается коррозии, образуя оксид железа и ржавчину.


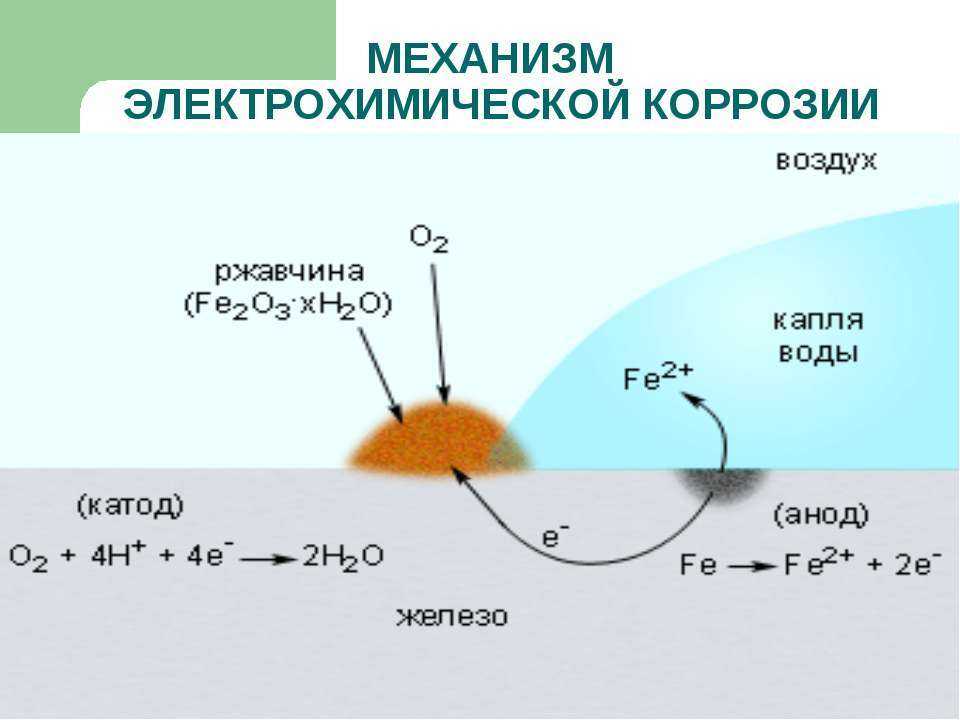 Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно.
Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно.

 На нее крепят зажим и посредством медного кабеля подключаются к щиту.
На нее крепят зажим и посредством медного кабеля подключаются к щиту.