Коррозия это химическое явление почему: Химическая коррозия
Содержание
Ингибиторы коррозии
Коррозия
Коррозия — это естественный процесс. Ингибирование является профилактической мерой против коррозийного воздействия на металлические материалы. Ингибиторы коррозии часто изучались, поскольку они предлагают простое решение для защиты металлов от коррозии в водной среде. Минеральные кислоты, такие как соляная и серная кислоты, наиболее широко используются в процессах травления для удаления образующихся на поверхности оксидов металлов. Ингибиторы используются в промышленных и коммерческих процессах, чтобы минимизировать как потери металла, так и потребление кислоты.
Ключевые слова: ингибиторы коррозии, кислотные ингибиторы, летучие ингибиторы, ингибитор паровой фазы
Введение
Коррозия является основным средством разрушения металлов. Подавляющее большинство из нас лично ощущают важность защиты от коррозии. Слишком многие наблюдают появление ржавых дыр в панелях кузова относительно новых автомобилей. Наружная ржавчина стали бытовой и садовой техники является обычным явлением жизни. Многие знают, каково готовить горячие блюда в ржавой посуде, все ощущали металлический привкус в кислых продуктах, которые слишком долго хранились в открытых банках. То, что эти эффекты вызваны коррозией, хорошо известно.
Наружная ржавчина стали бытовой и садовой техники является обычным явлением жизни. Многие знают, каково готовить горячие блюда в ржавой посуде, все ощущали металлический привкус в кислых продуктах, которые слишком долго хранились в открытых банках. То, что эти эффекты вызваны коррозией, хорошо известно.
Ярким примером, связанным с коррозией, является появление трещин на некоторых участках памятника монументального искусства, идеала и символа советской эпохи, признанного «эталоном социалистического реализма» — «Рабочий и колхозница» Они вызваны тем, что стальные дюбели, которые были встроены внутрь, сильно корродировали и проржавели, и это привело к его разрушению. Однако коррозия так же распространена в других классах материалов, таких как керамика, пластик и резина. Поскольку практически все среды в некоторой степени являются коррозийными, это является основными причинами материального разрушения, а также оборачивается большими экономическими издержками для общества.
Историческая справка
Коррозию можно рассматривать как универсальное явление. Есть везде — с воздухом, водой, почвой и в любой среде, с которой мы сталкиваемся. Известная людям как ржавчина, коррозия является нежелательным явлением, которое разрушает блеск и красоту материалов и уменьшает их жизнь. Ежегодные потери ВВП нашей страны могут достигать 3,5% по причинам, напрямую связанным именно с коррозией. Недавние исследования показывают, что и другие страны также увеличивают свои расходы на ингибиторы коррозии.
Расходы на коррозию проявляются в форме преждевременного износа или отказа, требующего технического обслуживания, ремонта и замены поврежденных частей. Коррозия оказывает огромное экологическое и экономическое воздействие на все элементы национальной инфраструктуры: автомагистрали, мосты, здания, объекты химической обработки, сточные воды. Помимо потерь материала, коррозия негативно влияет не только на окружающую среду, но также угрожает безопасности человека и производственных операций. Осведомленность о коррозии и адаптация своевременных и надлежащих мер контроля являются ключом к снижению коррозионных отказов.
Осведомленность о коррозии и адаптация своевременных и надлежащих мер контроля являются ключом к снижению коррозионных отказов.
Определение коррозии
Самопроизвольное окисление металла называется коррозией, то есть коррозия — это разрушение металлов и сплавов в присутствии окружающей среды химическими или электрохимическими средствами. Среда, в которой металл подвергается коррозии, называется агрессивной. Образующиеся продукты коррозии представляют собой химические соединения, содержащие металл в окисленной форме. За исключением золота и платины все другие металлы разъедаются и превращаются в вещества, подобные минеральным рудам, из которых они извлекаются.
Неблагоприятные экономические и социальные последствия коррозии
Коррозия негативно влияет на безопасную, надежную и эффективную работу оборудования и конструкций, это хуже чем простая потеря массы металла.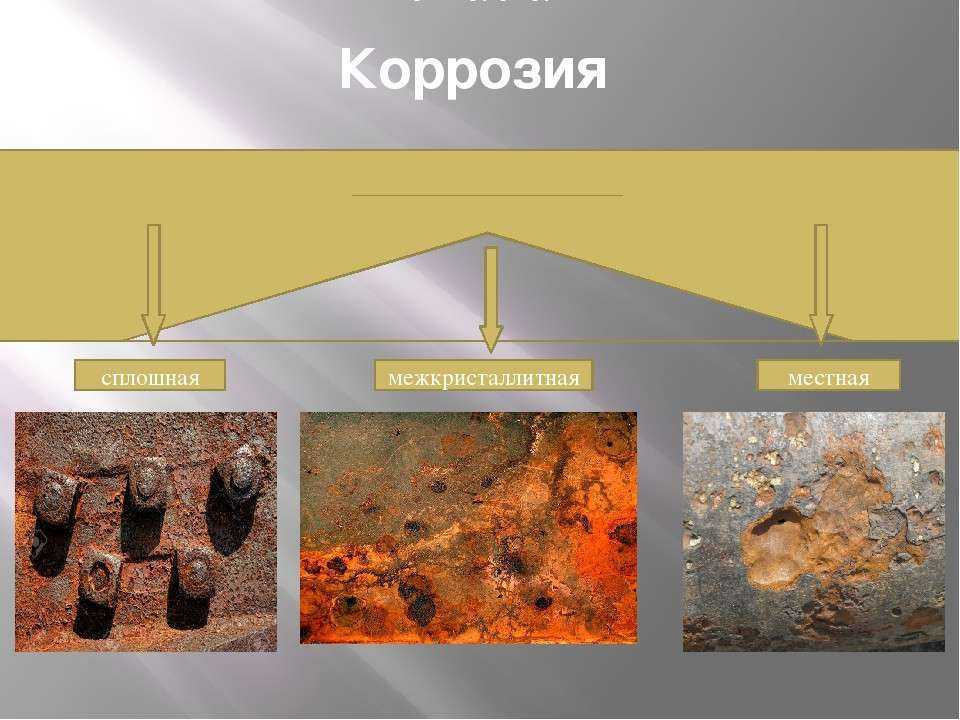 Отказы всех видов оборудования и необходимость дорогостоящих замен могут возникнуть, даже если количество разрушенного металла довольно мало. Некоторые из основных вредных воздействий коррозии могут быть перечислены ниже:
Отказы всех видов оборудования и необходимость дорогостоящих замен могут возникнуть, даже если количество разрушенного металла довольно мало. Некоторые из основных вредных воздействий коррозии могут быть перечислены ниже:
Замена корродированного оборудования, что приводит к большим расходам.
Высокая стоимость профилактического обслуживания, такого как покраска.
Потеря эффективности.
Потеря продукта из поврежденного корродированного контейнера.
Меры безопасности при пожаре, взрыве или выбросе токсичного продукта.
Проблемы со здоровьем, например, загрязнение питьевой воды свинцом, вероятно, связано с коррозией.
Химия коррозии
В целом металлы обладают уникальными свойствами, они непрозрачные, блестящие, проводящие, пластичные, легко образуют металлические связи с другими металлами и ионные связи с неметаллами. Имеют перекрывающиеся зоны проводимости и валентные зоны в своей электронной структуре.
Имеют перекрывающиеся зоны проводимости и валентные зоны в своей электронной структуре.
Рис. 1. Процесс цикла образования коррозии
Металлы получаются из их руды путем расходования большого количества энергии. Металлы сохраняют тепло в качестве потенциальной энергии во время процесса плавки и рафинирования и выделяют эту энергию во время процесса коррозии после реакции с окружающей средой. Следовательно, эти металлы можно рассматривать как находящиеся в метастабильном состоянии, и они будут терять свою энергию, возвращаясь к соединениям, более или менее похожим на их исходное состояние. Например, исходный материал для производства железа (и стали) и ржавчина продукта коррозии имеют одинаковые химический состав (Fe2O3).
Энергия, накопленная во время плавления и выделенная во время коррозии, обеспечивает потенциал для процесса коррозии. Поскольку большинство металлических соединений, и особенно продукты коррозии, имеют небольшую механическую прочность, сильно корродированный кусок металла совершенно бесполезен для своего первоначального назначения. Металлы (такие как Mg, Al, Zn и Fe), которые требуют большего количества энергии для рафинирования, более подвержены коррозии, чем металлы, которые требуют меньшего количества для рафинирования, такие как золото, серебро, платина. Цикл коррозии показан на (рисунок 1).
Металлы (такие как Mg, Al, Zn и Fe), которые требуют большего количества энергии для рафинирования, более подвержены коррозии, чем металлы, которые требуют меньшего количества для рафинирования, такие как золото, серебро, платина. Цикл коррозии показан на (рисунок 1).
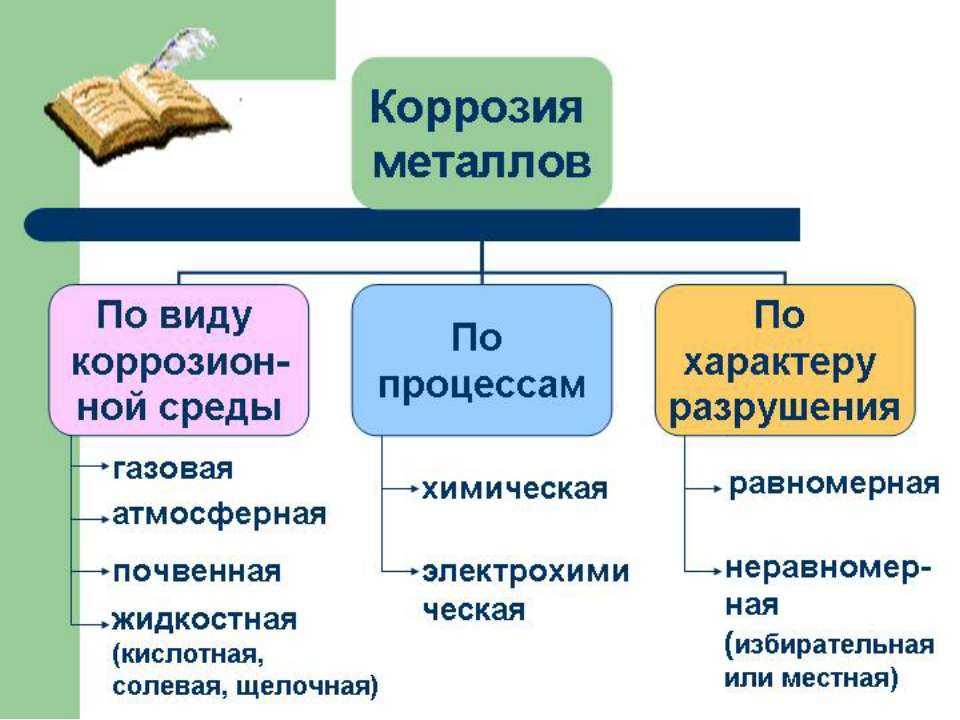
Классификация
Коррозия была классифицирована на различные методы.
Низкотемпературная коррозия и высокотемпературная коррозия.
Электрохимическая коррозия и химическая коррозия.
Влажная и сухая коррозия.
Влажная коррозия происходит, когда металл находится в контакте с электролитически проводящей жидкостью или когда два разнородных металла или сплава погружены либо частично погружены в электролитически проводящие растворы. Это всегда связано с низкотемпературными условиями. Процесс коррозии включает две реакции.
На аноде:
M (металл) → Mn + + ne- (окисление)
Mn + (ион металла) → Растворяется в растворе
Mn + (ион металла) → Образует соединение, такое соединение как оксид
На катоде:
2H + + 2e− → h3 ↑ (в кислотном растворе)
2h3O + 2e− → h3 ↑ + 2OH- (в щелочном растворе)
O2 + 2h3O + 4e− → 4OH- (в нейтральном растворе)
Сухая коррозия происходит главным образом в результате прямого химического воздействия атмосферных газов и паров, присутствующих в окружающей среде. Это чаще всего связано с высокой температурой.
Это чаще всего связано с высокой температурой.
Формы коррозии
Коррозия может проявляться во многих формах, таких как равномерная коррозия или общая коррозия, гальваническая коррозия, щелевая коррозия, точечная коррозия, межкристаллитная коррозия, селективное выщелачивание, эрозионная коррозия, коррозия под напряжением, коррозионная усталость и истирающая коррозия. Чтобы улучшить взаимопонимание между специалистами по коррозии и проектированию, она подразделяется на две широкие категории. Выражено в блок-схеме (рисунок 2).
Рис. 2. Формы коррозии
Общая коррозия
Эта общая коррозия, также называемая равномерной атакой, является наиболее распространенной формой коррозии. Обычно характеризуется химической или электрохимической реакцией, которая протекает равномерно по всей открытой поверхности или по большой ее площади. Металл становится тоньше, и в конечном итоге изделие выходит из строя.
Металл становится тоньше, и в конечном итоге изделие выходит из строя.
Гальваническая коррозия
Происходит, когда существует разность потенциалов между двумя разнородными металлами, погруженными в коррозийный раствор. Эта разность потенциалов создает поток электронов между металлами. Несколько исследований показали, что гальваническая коррозия прямо пропорциональна площади катода анодному металлу. ГОСТ 9.005-72 Группа Т92 МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ Единая система защиты от коррозии и старения МЕТАЛЛЫ, СПЛАВЫ, МЕТАЛЛИЧЕСКИЕ И НЕМЕТАЛЛИЧЕСКИЕ НЕОРГАНИЧЕСКИЕ ПОКРЫТИЯ Допустимые и недопустимые контакты с металлами и неметаллами
Принципиальная схема гальванической коррозии показана ниже (рисунок 3).
Рис. 3. Изображение гальванической коррозии.
Щелевая коррозия или отложения коррозии
Этот вид коррозии в основном подвержен трещинам, связанным с небольшими объемами застойного раствора, захваченными в отверстиях, поверхностях, соединениях и щелях под головками болтов и заклепок (рис. 4). Это также известно как коррозия отложения.
4). Это также известно как коррозия отложения.
Рис. 4. Изображение щелевой коррозии.
Питтинговая (точечная) коррозия или локальная коррозия
Питтинговая коррозия — это локальная атака, приводящая к образованию отверстий в металлах. Эти отверстия относительно маленькие и выглядят как шероховатости поверхности (рис. 5), иногда они были изолированы или расположены близко друг к другу. Питтинг является одной из самых разрушительных и коварных форм коррозии.
Рис. 5. Изображение питтинговой коррозии
Межкристаллитная коррозия
Большинство металлов и сплавов подвержено межкристаллитной коррозии при воздействии специфической коррозионной среды, которая показана на рисунке 6. Границы зерна обычно более реакционноспособны, чем матрица зерна. Следовательно, локализованная атака происходит на границах зерен и рядом с ними с относительно небольшой коррозией матрицы. Этот тип атаки обычно быстр и проникает глубоко в металл, что приводит к потере прочности и к катастрофическим отказам. Причины:
Этот тип атаки обычно быстр и проникает глубоко в металл, что приводит к потере прочности и к катастрофическим отказам. Причины:
Примеси на границах зерна
Обогащение одного из элементов в сплаве
Истощение одного из элементов в пограничной зоне.
Рис. 6. Схематическое изображение межкристаллитной коррозии
Выборочное выщелачивание
Выборочное выщелачивание — это удаление элемента из сплава путем коррозии. Выборочное удаление цинка из латуни является ярким примером этой формы атаки. Подобное нападение наблюдалось с другими сплавами, в которых железо, алюминий, кобальт и хром удалены. Этот тип коррозии нежелателен, так как дает пористый металл с плохими механическими свойствами.
Эрозийная коррозия
Это увеличение атаки металла из-за относительного движения коррозийной среды и поверхности металла. Эту коррозию можно наблюдать в элементах трубопроводной системы, таких как изгибы, колена, насосы, конденсаторы и т. д. Представление эрозионной коррозии показано на рисунке 7. Факторами, влияющими на эрозионную коррозию, являются природа поверхностной пленки, коррозионная среда и наличие пузырьков воздуха с его размерами, химическим составом, взвешенными веществами, коррозионной стойкостью и металлургическими свойствами металлов и сплавов.
Эту коррозию можно наблюдать в элементах трубопроводной системы, таких как изгибы, колена, насосы, конденсаторы и т. д. Представление эрозионной коррозии показано на рисунке 7. Факторами, влияющими на эрозионную коррозию, являются природа поверхностной пленки, коррозионная среда и наличие пузырьков воздуха с его размерами, химическим составом, взвешенными веществами, коррозионной стойкостью и металлургическими свойствами металлов и сплавов.
Рис. 7. Изображение эрозионной коррозии.
Коррозия под напряжением
Растрескивание металла или сплава в результате совместного действия растягивающего напряжения и коррозии (рис. 8) известно как коррозионное растрескивание под напряжением. Восприимчивость к коррозионному растрескиванию под напряжением обусловлена определенными металлургическими факторами, такими как:
Химический состав
Преимущественная ориентация зерен
Состав и распределение осадков
Структура дислокации и факторы окружающей среды и структура металла.

Рис. 8. Изображение коррозии под напряжением.
Коррозионная усталость
Определяется как «снижение усталостной прочности из-за наличия агрессивной среды». Коррозионная усталость возникает из-за комбинированного действия растягивающего и сжимающего напряжения альтернативно. Усталость возникает при снижении нагрузки в агрессивной среде.
Фреттинг-коррозия
Фреттинг — это явление износа, усиленное коррозией. Это связано с износом металла или сплава при контакте с другим твердым материалом в сухом или влажном воздухе. Фреттинг является результатом абразивного износа поверхностных оксидных пленок, которые образуют контактирующие поверхности под нагрузкой в атмосферном воздухе, что показано на рисунке 9. Факторами, влияющими на фреттинговую коррозию, являются:
Величина относительного движения
Температура
Окружающая обстановка
Металлургические факторы
Из-за легкого движения (такого как вибрация) поверхность оксида и подстилающий металл портится. Частицы металла в результате износа окисляются до твердых оксидов, которые действуют как дополнительная абразивная среда. Кроме того, движение размалывает частицы оксидов, вызывая износ.
Частицы металла в результате износа окисляются до твердых оксидов, которые действуют как дополнительная абразивная среда. Кроме того, движение размалывает частицы оксидов, вызывая износ.
Рис. 9. Изображение фреттинг-коррозии
Коррозия кавитации
Это особый тип эрозионной коррозии, которая возникает из-за образования пузырьков пара в коррозийной среде вблизи металлической поверхности, и когда пузырьки разрушаются, возникает атака, например, гидравлическая турбулентность,. От такого типа коррозии повреждаются, например, судовые гребные винты. Кавитация аналогична точечной коррозии, но в этом случае поверхность шероховатая и имеет много близко расположенных ям (Рисунок 10).
Рис. 10. Изображение коррозии кавитации
Факторы, влияющие на коррозию
Степень и скорость коррозии зависят от природы металлов и окружающей среды.
Природа металла
- Положение металлов.
- Перенапряжение.
- Относительная площадь анодной и катодной частей металла.
- Чистота металла.
- Физическая природа металла.
- Природа поверхности пленки.
- Растворимость продуктов.
- Летучие продукты коррозии.
Природа окружающей среды
- Диапазон температур
- Влажность воздуха
- Примеси в воде
- Наличие взвешенных частиц в атмосфере
- Влияние рН
- Природа растворенных газов, растворенных солей, загрязняющих веществ и т. д.
- Проводимость корродирующей среды
- Формирование ячейки концентрации кислорода
- Скорость потока технологического пара
- Поляризация электродов.
Факторы, контролирующие скорость коррозии
Определенные факторы имеют тенденцию ускорять действие коррозионной ячейки, которая включает в себя создание четко определенных мест на поверхности металла для анодной и катодной реакций. Металлы, имеющие более положительный (благородный) потенциал в гальваническом ряду, будут стремиться извлечь электроны из металла, который находится в более отрицательном (базовом) положении в ряду, и, следовательно, ускорить его коррозию при контакте с ним. Агрессивные ионы, такие как хлорид, имеют тенденцию предотвращать образование защитных оксидных пленок на поверхности металла и, таким образом, увеличивать коррозию.
Металлы, имеющие более положительный (благородный) потенциал в гальваническом ряду, будут стремиться извлечь электроны из металла, который находится в более отрицательном (базовом) положении в ряду, и, следовательно, ускорить его коррозию при контакте с ним. Агрессивные ионы, такие как хлорид, имеют тенденцию предотвращать образование защитных оксидных пленок на поверхности металла и, таким образом, увеличивать коррозию.
Скорость коррозии
Скорость коррозии выражается на основе потерь в единицу времени. Скорость, с которой происходит атака, имеет первостепенное значение и обычно выражается одним из двух способов:
- Потеря веса на единицу площади в единицу времени, как правило, нечетное число (миллиграммов на квадратный дециметр в день).
- Уменьшение толщины за единицу времени, то есть скорости проникновения или толщины потерянного металла.
Методы контроля коррозии
Коррозия — это разрушительные и бесшумные рабочие процессы. Это создает проблемы как для крупных, так и для небольших отраслей. Поскольку коррозия неизбежна для устранения, но ее можно минимизировать, приняв определенный антикоррозийный метод, а не предотвращая его. Практические методы защиты металла от коррозии:
Это создает проблемы как для крупных, так и для небольших отраслей. Поскольку коррозия неизбежна для устранения, но ее можно минимизировать, приняв определенный антикоррозийный метод, а не предотвращая его. Практические методы защиты металла от коррозии:
- Модификация металла
- Модификация дизайна
- Модификация агрессивной среды
- Модификация металлического потенциала среды
- Использование ингибиторов
- Модификация поверхности
Эти методы могут использоваться по отдельности или в комбинации. Одним из наиболее известных методов защиты от коррозии является использование ингибиторов коррозии вместо использования различных методов, чтобы избежать или предотвратить разрушение или разрушение поверхности металла. Потому что использование ингибиторов является следствием отстаивания из-за низкой стоимости и практического метода.
Ингибиторы
Ингибитор представляет собой химическое вещество или комбинацию веществ, которые при добавлении в очень низких концентрациях в агрессивную среду эффективно предотвращают или уменьшают коррозию без значительной реакции с компонентами окружающей среды. Концентрации ингибиторов коррозии могут варьироваться от 1 до 15000 частей на миллион (от 0,0001 до 1,5 мас.%). Ингибиторы играют жизненно важную роль в закрытых системах окружающей среды, которые имеют хорошую циркуляцию, так что обеспечивается адекватная и контролируемая концентрация ингибитора. Такие условия могут быть выполнены, например, в системах рециркуляции охлаждающей воды, добычи нефти, нефтепереработки и кислотного травления стальных компонентов. Одним из наиболее узнаваемых применений ингибиторов является антифриз для автомобильных радиаторов. Ингибиторы могут быть органическими или неорганическими соединениями, и они обычно растворяются в водных средах.
Концентрации ингибиторов коррозии могут варьироваться от 1 до 15000 частей на миллион (от 0,0001 до 1,5 мас.%). Ингибиторы играют жизненно важную роль в закрытых системах окружающей среды, которые имеют хорошую циркуляцию, так что обеспечивается адекватная и контролируемая концентрация ингибитора. Такие условия могут быть выполнены, например, в системах рециркуляции охлаждающей воды, добычи нефти, нефтепереработки и кислотного травления стальных компонентов. Одним из наиболее узнаваемых применений ингибиторов является антифриз для автомобильных радиаторов. Ингибиторы могут быть органическими или неорганическими соединениями, и они обычно растворяются в водных средах.
Определение ингибитора
Ингибитор — это вещество, которое при добавлении в окружающую среду в небольших концентрациях сводит к минимуму потери металла, уменьшает степень водородного показателя, защищает металл от точечной коррозии, уменьшает количество травления и испарения кислоты, возникающего в результате чрезмерной реакции между кислотой и основными металлами, и уменьшает потребление кислоты. Они уменьшают коррозию, действуя в качестве барьера и образуя адсорбированный слой или замедляя катодный, анодный или оба процесса. Схематическое представление процесса ингибитора показано на рисунке 12.
Они уменьшают коррозию, действуя в качестве барьера и образуя адсорбированный слой или замедляя катодный, анодный или оба процесса. Схематическое представление процесса ингибитора показано на рисунке 12.
Любой процесс замедления коррозии или снижения скорости окисления металла путем добавления химического соединения в систему вызван ингибиторами коррозии. Ингибиторы часто легко наносятся и дают преимущество применения на месте, не вызывая значительного нарушения процесса. Использование ингибиторов коррозии является одним из лучших методов борьбы с коррозией.
Чтобы их можно было эффективно использовать, необходимо учитывать три фактора:
- Выявление проблем коррозии.
Как правило, ингибиторы коррозии могут воздействовать на компоненты коррозионной ячейки (анод, катод, электролит и электронный проводник), чтобы уменьшить коррозию. Ингибитор может вызвать:
Ингибитор может вызвать:
- Анодное торможение (увеличение поляризации анода)
- Катодное торможение (увеличение поляризации катода)
- Ингибирование сопротивления (увеличение электрического сопротивления цепи при образовании тонкого или толстого осадка на поверхности металла)
- Ограничение диффузии (ограничение диффузии деполяризаторов, например, DO).
Однако при выборе ингибитора следует учитывать несколько факторов.
- Стоимость ингибитора.
- Токсичность ингибитора может оказывать вредное воздействие на людей и других живых организмов.
- Наличие ингибитора определяет его выбор.
- Ингибитор должен быть экологически чистым.
Чтобы избежать или уменьшить коррозию металлических материалов, ингибитор, используемый в
системах охлаждения, должен удовлетворять следующим критериям
- Должен обеспечивать хорошую защиту от коррозии при очень низкой концентрации ингибитора.
- Должен защищать все открытые материалы от воздействия коррозии.
- Должен оставаться эффективным в экстремальных условиях эксплуатации (более высокая температура и скорость).
- В случае недостаточной или избыточной дозы ингибитора скорость коррозии не должна увеличиваться коренным образом.
- Ингибитор или продукты реакции ингибитора не должны образовывать отложений.
на металлической поверхности, особенно в местах, где происходит передача тепла.
- Подавлять как равномерную, так и локальную коррозию.
- Иметь долгосрочный эффект.
- Не должно вызывать проблем с токсичностью и загрязнением.
Определение ингибирования
Одной из широко изученных тем в области коррозии является ингибирование. Ингибирование — это процесс превентивных мер против агрессивного воздействия на металлические материалы. Могут использоваться химические соединения, которые при добавлении в небольших концентрациях в агрессивную среду способны уменьшить коррозию открытого металла.
Могут использоваться химические соединения, которые при добавлении в небольших концентрациях в агрессивную среду способны уменьшить коррозию открытого металла.
Ингибиторы коррозии
Ингибиторы коррозии могут быть любых форм (твердых веществ, жидкостей и газов). На основании растворимости или диспергируемости в жидкостях выбираются ингибиторы коррозии, которые должны быть ингибированы. Установлено, что ингибиторы коррозии являются эффективным и гибким средством уменьшения коррозии. Использование химических ингибиторов для снижения скорости коррозионных процессов довольно разнообразно. Ингибиторы коррозии используются в разведке и добыче нефти и газа, на нефтеперерабатывающих заводах, в химическом производстве, тяжелом производстве, для очистки воды и добавок к продуктам. В нефтедобывающей, перерабатывающей и химической промышленности ингибиторы коррозии всегда считались первой линией защиты.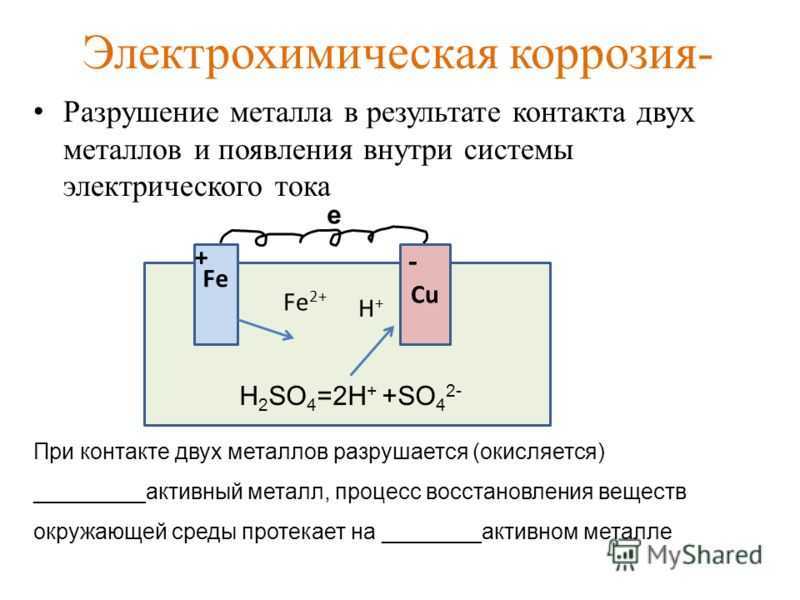 Большое количество научных исследований было посвящено теме ингибиторов коррозии.
Большое количество научных исследований было посвящено теме ингибиторов коррозии.
Роль ингибиторов
Органические и неорганические соединения представляют собой большой класс ингибиторов коррозии, которые, как правило, воздействуют на всю поверхность корродирующего металла, когда присутствуют в достаточной концентрации. Большинство органических / неорганических соединений, содержащих элементы групп V B, VI B или функциональных групп типа аминной, карбонильной и спиртовой групп, являются более эффективными ингибиторами коррозии. Ингибитор адсорбируется на всей поверхности металла корродирующего металла и таким образом предотвращает воздействие коррозии. Органические ингибиторы адсорбируются на поверхности металлов. Ингибиторы можно рассматривать как два основных типа: они образуют защитную барьерную пленку на анодах или катодах в результате реакции между металлом и окружающей средой. Ингибиторы этого типа функционируют в нейтральном или в некоторых случаях в щелочном растворе, в котором основной катодной реакцией является реакция восстановления кислорода, в которой поверхность корродирующего металла покрыта пленкой оксида или гидроксида.
Другой тип первоначально адсорбируется непосредственно на поверхность металла взаимодействием поверхностных зарядов с ионными и / или молекулярными дипольными зарядами. Такое разделение типов ингибиторов происходит главным образом из-за рН-раствора, в котором они действуют. Ингибиторы должны присутствовать в минимальной концентрации, чтобы они были полностью эффективными. Это очень часто встречается у анодных ингибиторов.
Эффективность органических ингибиторов может быть улучшена в присутствии определенных ионов галогена. Также известно, что ионы галогенов в некоторой степени ингибируют коррозию в растворах кислот. Эффективность ингибирования коррозии в порядке; I-> Br-> Cl-. Фтор не проявляет ингибирующих свойств. Синергизм ионов галогенов можно объяснить тем, что металл адсорбирует ионы галогенов, заряд которых смещает поверхность в отрицательном направлении, увеличивая тем самым адсорбцию катионного органического ингибитора. Возможность обнаружить возможные соединения, которые можно использовать в качестве ингибиторов коррозии, требует большой кропотливой работы, инноваций и лабораторного анализа / синтеза.
Возможность обнаружить возможные соединения, которые можно использовать в качестве ингибиторов коррозии, требует большой кропотливой работы, инноваций и лабораторного анализа / синтеза.
Известно, что некоторые ионы галогенов, присутствующие в органических ингибиторах, в некоторой степени ингибируют коррозию в растворах кислот. Эффективность ингибирования коррозии следующая в порядке I−> Br−> Cl−. Фтор не проявляет каких-либо ингибирующих свойств. Синергизм ионов галогенов можно объяснить тем, что металл адсорбирует ионы галогенов, заряд которых смещает поверхность в отрицательном направлении, увеличивая тем самым адсорбцию катионного органического ингибитора.
Классификация ингибиторов коррозии
Ингибиторы коррозии кратко классифицируются (рис. 11) следующим образом:
Классификация ингибиторов коррозии
На основе электродного процесса
Анодные ингибиторы
Анодный ингибитор увеличивает анодную поляризацию и, следовательно, перемещает потенциал коррозии в катодном направлении. Также называется пассивирующими ингибиторами. Анодные ингибиторы, такие как хроматы, фосфаты, вольфраматы и другие ионы переходных элементов с высоким содержанием кислорода, являются такими, которые подавляют реакцию коррозии, происходящую на аноде, путем образования труднорастворимого соединения с недавно полученным ионом металла. Они адсорбируются на поверхности металла, образуя защитную пленку или барьер, тем самым снижая скорость коррозии. Анодные ингибиторы образуют тонкую защитную пленку вдоль анода и увеличивают их потенциал и тем самым замедляют реакцию коррозии.
Также называется пассивирующими ингибиторами. Анодные ингибиторы, такие как хроматы, фосфаты, вольфраматы и другие ионы переходных элементов с высоким содержанием кислорода, являются такими, которые подавляют реакцию коррозии, происходящую на аноде, путем образования труднорастворимого соединения с недавно полученным ионом металла. Они адсорбируются на поверхности металла, образуя защитную пленку или барьер, тем самым снижая скорость коррозии. Анодные ингибиторы образуют тонкую защитную пленку вдоль анода и увеличивают их потенциал и тем самым замедляют реакцию коррозии.
Хотя этот тип контроля подвержен влиянию, он все же может быть опасным, поскольку может произойти серьезная локальная атака, если некоторые области остаются незащищенными из-за истощения ингибиторов. Ряд неорганических ингибиторов, таких как ортофосфаты, силикаты и т.д., подпадают под анодный тип. Несмотря на то, что анодные ингибиторы широко используются, некоторые из них обладают нежелательными свойствами. Если такие ингибиторы используются в очень низких концентрациях, они вызывают стимуляцию коррозии, например, точечной коррозии, и по этой причине анодные ингибиторы обозначаются как опасные.
Если такие ингибиторы используются в очень низких концентрациях, они вызывают стимуляцию коррозии, например, точечной коррозии, и по этой причине анодные ингибиторы обозначаются как опасные.
Существует два типа пассивирующих ингибиторов.
- Окисляющие анионы, такие как хроматы, нитриты и нитраты, которые могут пассивировать сталь в отсутствие кислорода.
- Неокисляющие ионы, такие как фосфаты, вольфраматы и молибдаты, которые требуют присутствия кислорода для пассивации стали.
Как правило, ингибиторы пассивации могут вызвать точечную коррозию и ускорить коррозию, когда концентрации упадут ниже минимальных пределов. По этой причине важно контролировать концентрацию ингибитора.
Катодные ингибиторы
Катодные ингибиторы уменьшают коррозию за счет замедления скорости реакции электрохимической коррозии. Это делается путем блокирования катодных участков осадками. Катодные ингибиторы эффективны, когда они замедляют катодную реакцию. Элементы As, Bi и Sb называются катодными ядами, которые снижают скорость реакции восстановления водорода и снижают общую скорость коррозии. Удаление кислорода из агрессивной среды значительно снизит скорость коррозии. Это можно сделать с помощью:
Это делается путем блокирования катодных участков осадками. Катодные ингибиторы эффективны, когда они замедляют катодную реакцию. Элементы As, Bi и Sb называются катодными ядами, которые снижают скорость реакции восстановления водорода и снижают общую скорость коррозии. Удаление кислорода из агрессивной среды значительно снизит скорость коррозии. Это можно сделать с помощью:
- Использование поглотителей кислорода, таких как сульфит натрия и гидразин, которые реагируют с кислородом и удаляют его из раствора.
- Вакуумная деаэрация
- Кипячение для снижения концентрации растворенного кислорода.
Катодные ингибиторы смещают потенциал коррозии в анодном направлении. Здесь катионы мигрируют к катодным поверхностям, где они осаждаются химически или электрохимически, и таким образом блокируют эти поверхности. Ингибирующее действие катодных ингибиторов происходит по трем механизмам:
- Катодные яды.
 Процесс катодного восстановления подавляется, препятствуя рекомбинации водорода и режиму защитного разряда, но увеличивает склонность металла к восприимчивости к водородному растрескиванию.
Процесс катодного восстановления подавляется, препятствуя рекомбинации водорода и режиму защитного разряда, но увеличивает склонность металла к восприимчивости к водородному растрескиванию.
- Катодные осадки: соединения, такие как кальций и магний, осаждаются в виде оксидов, образуя защитный слой, который действует как барьер на поверхности металла.
- Поглотитель кислорода: эти соединения реагируют с кислородом, присутствующим в системе, с образованием продукта и снижают коррозию. Например, As3 + и Sb3 + при растворении Fe в кислотах.
Смешанные ингибиторы
Эти ингибиторы замедляют как анодные, так и катодные процессы, вовлеченные в процесс коррозии, и поэтому называются смешанными ингибиторами. Как правило, они представляют собой пленкообразующие соединения, которые вызывают образование осадков на поверхности, косвенно блокируя как анодные, так и катодные участки. Анодные ингибиторы являются, по большей части, опасными ингибиторами, особенно если их концентрации слишком малы. Но катодные ингибиторы, как правило, безопасны. Смешанные ингибиторы менее опасны, чем чистые анодные ингибиторы, и в ряде случаев они могут не увеличивать интенсивность коррозии. Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Такие ингибиторы будут иметь большее преимущество в том, что они контролируют как катодную, так и анодную реакции коррозии.
Анодные ингибиторы являются, по большей части, опасными ингибиторами, особенно если их концентрации слишком малы. Но катодные ингибиторы, как правило, безопасны. Смешанные ингибиторы менее опасны, чем чистые анодные ингибиторы, и в ряде случаев они могут не увеличивать интенсивность коррозии. Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Такие ингибиторы будут иметь большее преимущество в том, что они контролируют как катодную, так и анодную реакции коррозии.
На основе окружающей среды
Ингибиторы кислой среды
Неорганические ингибиторы
Такие соединения, как As2O3, Sb2O3, были описаны в качестве ингибиторов в кислых средах. В этом случае защита обусловлена уменьшением электро положительных ионов и осаждением на поверхности металла и снижением перенапряжения главной катодной реакции деполяризации. Недавно было показано, что добавление ионов тяжелых металлов, таких как Pb2 +, Ti +, Mn2 + и Cd2 +, как установлено, ингибирует коррозию железа в кислотах.
Недавно было показано, что добавление ионов тяжелых металлов, таких как Pb2 +, Ti +, Mn2 + и Cd2 +, как установлено, ингибирует коррозию железа в кислотах.
Органические ингибиторы
Органические соединения, содержащие кислород, азот, серу с множественными связями, являются хорошими ингибиторами коррозии. Многие органические ингибиторы, такие как амины, альдегиды, алкалоиды, нитро- и нитрозосоединения, были изучены и опробованы в качестве ингибиторов коррозии. Органические ингибиторы могут быть анодного, катодного и смешанного типа в зависимости от их реакции на поверхности металла и потенциала. Они эффективны в зависимости от его размера, длины углеродной цепи, ароматичности, сопряжения и природы атомов связи.
Щелочные ингибиторы
Металлы, которые образуют амфотерные оксиды, подвержены коррозии в щелочных растворах.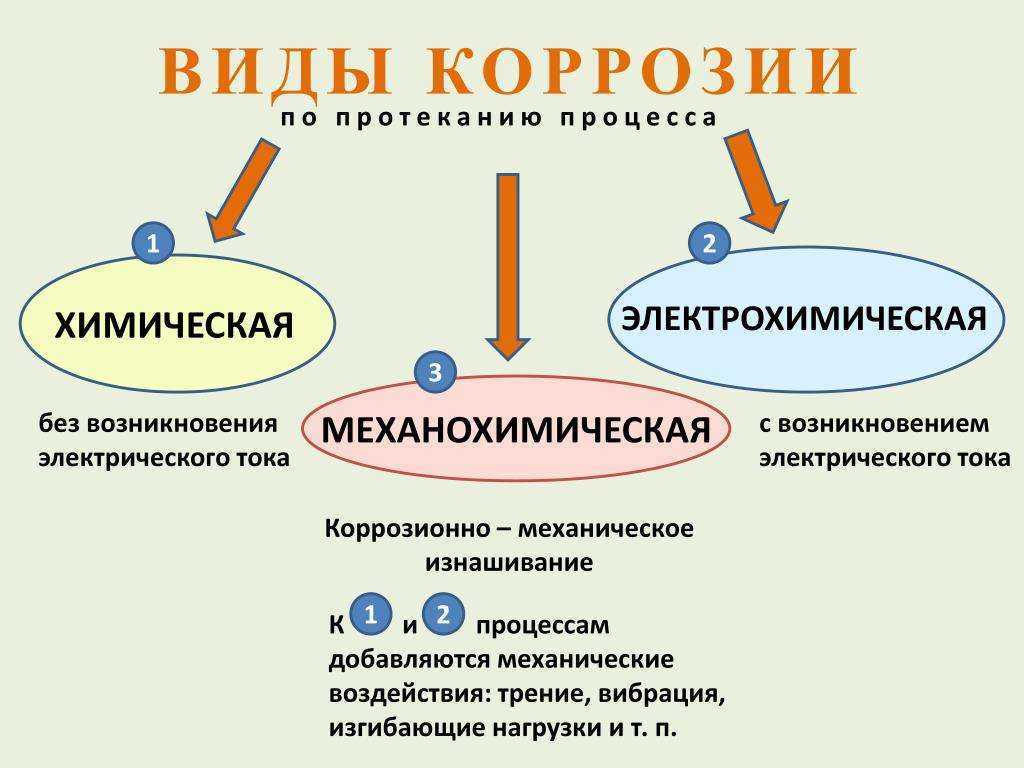 Многие органические соединения часто используются в качестве ингибиторов для металлов в основных растворах [41]. Соединения, такие как тиомочевина, замещенные фенолы, нафтол, β-дикетон и т. Д., Использовались в качестве эффективных ингибиторов в основных растворах вследствие образования металлические комплексы.
Многие органические соединения часто используются в качестве ингибиторов для металлов в основных растворах [41]. Соединения, такие как тиомочевина, замещенные фенолы, нафтол, β-дикетон и т. Д., Использовались в качестве эффективных ингибиторов в основных растворах вследствие образования металлические комплексы.
Нейтральные ингибиторы
Ингибиторы, которые эффективны в кислых растворах, не работают эффективно в нейтральных растворах, поскольку механизм в обоих растворах различен. В нейтральных растворах происходит взаимодействие ингибиторов с покрытой оксидом поверхностью металла и предотвращение реакции восстановления кислорода на катодных участках. Такие ингибиторы защищают поверхностные слои от агрессивности. Было обнаружено, что некоторые поверхностно-активные хелатные ингибиторы являются эффективными ингибиторами в почти нейтральных растворах.
В зависимости от режима защиты
Химические пассиваторы
Вещества, которые обычно имеют достаточно высокий равновесный потенциал (окислительно-восстановительный или электродный потенциал) и достаточно низкий по сравнению с потенциалом, снижают скорость коррозии при достижении пассивности и называются химическими пассиваторами. Например, нитриты используются в качестве ингибиторов охлаждающей воды от замерзания. Хроматы в основном используются в качестве ингибиторов для рециркуляции охлаждающей воды. Молибдат цинка используется в качестве ингибирующего пигмента для красок.
Например, нитриты используются в качестве ингибиторов охлаждающей воды от замерзания. Хроматы в основном используются в качестве ингибиторов для рециркуляции охлаждающей воды. Молибдат цинка используется в качестве ингибирующего пигмента для красок.
Ингибиторы адсорбции
Они представляют собой наиболее широко используемый класс ингибиторов. Как правило, они представляют собой органические соединения, которые адсорбируются на поверхности металла и обеспечивают защитный эффект по всей поверхности, то есть как в катодном, так и в анодном случаях. Обычно они одинаково влияют как на катодную, так и на анодную реакцию, но во многих случаях эффект может быть не одинаковым. Они обычно используются при кислотном травлении горячекатаных продуктов для удаления окалины и, таким образом, известны как ингибиторы травления. Примеры: соединения, содержащие неподеленные пары электронов, такие как атомы азота в аминах, хинолины, атомы серы в тиосоединениях и атомы кислорода в альдегидах.
Ингибиторы пленкообразования
В отличие от ингибиторов адсорбции, которые образуют прямую адсорбированную пленку ингибирующих частиц, многие вещества, называемые ингибиторами пленкообразования, по-видимому, останавливают коррозию, образуя блокирующую или барьерную пленку из материала, отличного от фактических ингибирующих частиц. Такие материалы имеют тенденцию быть специфичными либо к катоду, либо к аноду. Соли цинка и кальция являются наиболее распространенными примерами катодных пленкообразующих ингибиторов. Бензоат является распространенным примером ингибиторов формирования анодной пленки, которые ингибируют коррозию во время рейсов.
Ингибиторы паровой фазы
Атмосферная коррозия металлов в закрытых помещениях, например, во время хранения и транспортировки может быть предотвращена путем использования определенных веществ, называемых ингибиторами паровой фазы, также называемыми летучими ингибиторами (VCI). Это вещества низкого, но значительного давления пара. Пар входит в контакт с поверхностью металла, и происходит адсорбция ингибитора. Влага затем гидролизует ее и выделяет защитные ионы, которые обладают свойствами, препятствующими коррозии. Рисунок 12 показывает схематическое изображение паровой фазы ингибиторов. Примеры: дициклогексиламин хромат и бензотриазол для защиты меди. Хромат фенилтиомочевины и циклогексиламина для латуни. Нитрит дициклогексиламина для черных и цветных металлов.
Это вещества низкого, но значительного давления пара. Пар входит в контакт с поверхностью металла, и происходит адсорбция ингибитора. Влага затем гидролизует ее и выделяет защитные ионы, которые обладают свойствами, препятствующими коррозии. Рисунок 12 показывает схематическое изображение паровой фазы ингибиторов. Примеры: дициклогексиламин хромат и бензотриазол для защиты меди. Хромат фенилтиомочевины и циклогексиламина для латуни. Нитрит дициклогексиламина для черных и цветных металлов.
Рис. 12. Схематическое изображение паровой фазы ингибиторов.
Летучие ингибиторы или ингибиторы паровой фазы
Летучие ингибиторы коррозии (VCI) представляют собой соединения, которые переносятся в закрытой среде на место коррозии путем испарения из источника (рис. 15). Если продукт коррозии является летучим, он испаряется, как только он образуется, тем самым оставляя основную металлическую поверхность открытой для дальнейшего воздействия. Это вызывает быструю и постоянную коррозию, ведущую к чрезмерной коррозии. Например, оксид молибдена (MoO3), продукт окислительной коррозии молибдена, является летучим. В процессе с закрытым паром (транспортировочные контейнеры) летучие твердые вещества, такие как соли дициклогексиламина, циклогексиламина и экзаметиленамина, используются в качестве летучих ингибиторов коррозии [52].
Это вызывает быструю и постоянную коррозию, ведущую к чрезмерной коррозии. Например, оксид молибдена (MoO3), продукт окислительной коррозии молибдена, является летучим. В процессе с закрытым паром (транспортировочные контейнеры) летучие твердые вещества, такие как соли дициклогексиламина, циклогексиламина и экзаметиленамина, используются в качестве летучих ингибиторов коррозии [52].
Синергетические ингибиторы
Это единственный ингибитор, который используется в системах охлаждения воды. Чаще всего комбинация ингибиторов (анодных и катодных) используется для улучшения антикоррозионных свойств. Примеры включают хромат-фосфаты, полифосфатсиликаты, цинк-дубильные вещества и цинк-фосфаты.
Ингибиторы осадков
Это соединения, которые образуют осадки на поверхности металла, обеспечивая тем самым защитную пленку. Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Например, силикат натрия, используется во многих бытовых умягчителях воды для предотвращения возникновения ржавчины.
Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Например, силикат натрия, используется во многих бытовых умягчителях воды для предотвращения возникновения ржавчины.
Зеленые ингибиторы коррозии
Не существует четкого и общепринятого определения «экологически чистых» или «зеленых» ингибиторов коррозии. На практике исследования по ингибированию коррозии стали ориентироваться на здоровье и безопасность человека. С этой целью в последнее время исследователи сосредоточились на использовании экологически чистых соединений, таких как растительные экстракты, нетоксичные лекарства с истекшим сроком годности и т. д., которые содержат много органических соединений. Используются аминокислоты, алкалоиды, пигменты и дубильные вещества
как более экологичные альтернативы для токсичных и опасных соединений. Из-за способности к биологическому разложению, экологичности, низкой стоимости и доступности, экстракты некоторых распространенных растений и лекарственных растений и их продуктов были изучены как ингибиторы коррозии для различных металлов и сплавов в различных условиях окружающей среды.
Из-за способности к биологическому разложению, экологичности, низкой стоимости и доступности, экстракты некоторых распространенных растений и лекарственных растений и их продуктов были изучены как ингибиторы коррозии для различных металлов и сплавов в различных условиях окружающей среды.
Механизм ингибирования коррозии
Механизм процесса ингибирования рассматриваемых ингибиторов коррозии обусловлен главным образом адсорбцией. Явление адсорбции зависит от природы и поверхностного заряда металла, а также от химической структуры ингибиторов. Поверхностный заряд металла обусловлен электрическим полем, возникающим на границе раздела при погружении в электролит. Ингибирование обычно является результатом одного или нескольких из следующих механизмов
- Адсорбция ингибиторов коррозии на металлы
Эффективность ингибирования обычно зависит от доли покрытой поверхности, θ с адсорбированным ингибитором. Но при низком покрытии поверхности (θ <0,1) эффективность адсорбированных частиц ингибитора в замедлении реакций коррозии может быть выше, чем при высоком покрытии поверхности.
Но при низком покрытии поверхности (θ <0,1) эффективность адсорбированных частиц ингибитора в замедлении реакций коррозии может быть выше, чем при высоком покрытии поверхности.
- Наличие поверхностного заряда на металле
Адсорбция ингибитора на поверхности металла может быть обусловлена диполями адсорбированных частиц или электростатической силой притяжения между ионными зарядами и электрическим зарядом на металле на границе раздела металл / раствор.
- Влияние функциональной группы и структуры
Обычно, когда металл содержит свободные электронные орбитали низкой энергии, такие как переходные металлы. Анионы и нейтральные органические молекулы, содержащие неподеленную пару электронов или электронные системы, связанные с множественными связями, особенно с тройными связями или ароматическими кольцами. Плотность электронов в функциональной группе прямо пропорциональна ингибирующей эффективности в ряду родственных соединений.
- Ингибитор и взаимодействие молекул воды
Молекулы адсорбированной воды удаляются с поверхности металла за счет реакции вытеснения адсорбированных молекул ингибитора и увеличивают размер углеводородной части ингибитора, что приводит к снижению растворимости и увеличению адсорбционной способности. Это согласуется с увеличением ингибирующей эффективности, наблюдаемым при постоянных концентрациях с увеличением размера молекулы в ряду родственных соединений.
- взаимодействие между адсорбированными видами ингибиторов
Боковое взаимодействие между адсорбированными видами ингибиторов может значительно увеличить покрытие поверхности и адсорбированные виды. Эти взаимодействия либо привлекательны, либо отвратительны. Если между молекулами, содержащими большие углеводородные компоненты (например, н-алкильные цепи), происходят привлекательные взаимодействия, возможно, длина цепи увеличивается. Тогда возрастающая сила притяжения Ван-дер-Ваальса между соседними молекулами приводит к более сильной адсорбции при большом покрытии.
Тогда возрастающая сила притяжения Ван-дер-Ваальса между соседними молекулами приводит к более сильной адсорбции при большом покрытии.
- Адсорбированная реакция ингибиторов
Адсорбированный ингибитор коррозии может обычно реагировать путем химического или электрохимического восстановления с образованием продукта, который может проявлять ингибирующее действие. Процесс добавления небольшого количества вещества называется первичным ингибированием, а продукт реакции — вторичным ингибированием. В этих случаях ингибирующая эффективность может увеличиваться или уменьшаться со временем, это зависит от степени вторичного ингибирования, более эффективного, чем первичное ингибирование. Например, сульфоксиды могут быть восстановлены до сульфидов, которые являются более эффективными ингибиторами.
- Формирование диффузионного барьера
Поглощенные молекулы ингибитора могут образовывать поверхностный слой, который действует как физический барьер для диффузии ионов или молекул и к поверхности металла или с нее и, следовательно, замедляет скорость реакций коррозии. Поверхностная пленка этих типов ингибиторов влияет как на анодную, так и на катодную реакцию.
Поверхностная пленка этих типов ингибиторов влияет как на анодную, так и на катодную реакцию.
- Блокировка сайтов реакции
Блокировка уменьшает количество атомов металла, при которых могут происходить реакции коррозии. При этом механизмы реакций не затрагиваются, а наклоны Тафеля на поляризационных кривых остаются неизменными.
- Электродные реакции
Реакции коррозии включают образование адсорбированных промежуточных молекул с поверхностными атомами металла. Адсорбированные ингибиторы будут препятствовать образованию этих адсорбированных промежуточных продуктов, но электродные процессы могут протекать альтернативными путями через промежуточные продукты, содержащие ингибитор. В этом процессе ингибитор действует как катализатор и остается неизменным. Такие реакции ингибитора характеризуются увеличением тафелевского наклона при анодном растворении металла. Ингибиторы могут также замедлять скорость выделения водорода на металлах, влияя на механизм реакции. Этот эффект наблюдался на железе в присутствии ингибиторов, таких как фенилтиомочевина, производные анилина, бензальдегид производные и соли пиридиния.
Этот эффект наблюдался на железе в присутствии ингибиторов, таких как фенилтиомочевина, производные анилина, бензальдегид производные и соли пиридиния.
- Электрическая двухслойная переделка
Адсорбция ионов или частиц, которые могут образовывать ионы на металлических поверхностях, изменит двойной электрический слой на границе раздела металл / раствор, и это повлияет на скорость электрохимических реакций]. Адсорбция катионов, таких как ионы четвертичного аммония и протонированные амины, делает потенциал более положительным в плоскости ближайшего сближения с ионами металлов из раствора. Этот положительный сдвиг потенциала препятствует разряду положительно заряженных ионов водорода. Эти эффекты наблюдались для сульфосалицилат-ионов и бензоат-ионов.
Вывод
- Коррозия — это естественный процесс, который снижает энергию связи в металлах и ухудшает полезные свойства материалов.
- Конечный результат коррозии включает окисление атома металла, в результате чего он теряет один или несколько электронов.

- Коррозия проявляется в распаде сыпучего металла до металлического порошка.
- Ингибиторы коррозии — отличный эффективный метод предотвращения коррозии.
- Знание метода действия облегчает выбор ингибиторов, повышает эффективность, позволяет избежать нарушения процесса и побочных эффектов.
- При выборе ингибитора важно, каким бы ни был метод, выяснить последующее воздействие этого на окружающую среду.
- Экологически чистые ингибиторы показали отличные результаты, превосходя обычные ингибиторы.
Чем отличается ржавчина от коррозии
Главная » Разное » Чем отличается ржавчина от коррозии
Ржавчина и коррозия — VECFORT
Многие, не очень осведомленные в делах короззии граждане считают, что коррозия и ржавчина – это одно и то же. Но, на самом деле, это два совсем разных понятия, и отличаются они во многом.
Начнем с того, что коррозия может быть не только у металла, а и у многих других материалов (например, бетона или пластмассы). Конечно, чаще всего мы встречаемся именно с коррозией металла, но в других случаях нужно уточнять, говоря «коррозия металла»; коррозия, – это процесс разрушения материалов, который вызван разнообразными химическими (а также и электрохимическими) процессами
Конечно, чаще всего мы встречаемся именно с коррозией металла, но в других случаях нужно уточнять, говоря «коррозия металла»; коррозия, – это процесс разрушения материалов, который вызван разнообразными химическими (а также и электрохимическими) процессами
Конечно, коррозией это считается в тех случаях, если данные процессы вызваны воздействием окружающей среды. Но не обязательно этим материалом должен быть металл.
Также коррозия металла подразумевает не только ржавление. Согласно международным стандартам, коррозия металла это химическое (в некоторых случаях физико-химическое) явление, возникающее между металлом и средой, которой приводит к тому, что свойства металла и его структура понемногу ухудшаются и разрушаются. Но не всегда результатом коррозии является ржавчина.
Под ржавчиной следует понимать слой оксидов железа, которые прошли частичное гидратирование, и образовали на поверхности металла этот самый слой. Обычно он имеет красно-желтые оттенки, сначала образуется в форме крупинок, а потом – в форме больших пятен, при длительном ржавлении с слоях металла могут появляться отверстия.
Поэтому необходимо постоянно следить даже за малейшими проявлениями ржавчины, проводить профилактику, очистку фасадов и оборудования.
Одно из наиболее важных отличий коррозии от ржавчины: коррозия это процесс, а ржавчина это его результат. Коррозию предотвращают, пытаются обезопасить металлические конструкции от ее проявления.
А вот ржавчина – это результаты проявления коррозии, которой не удалось избежать, либо если для профилактики коррозии не принималось никаких необходимых мер. Для избавления от ржавчины используют бластинг, пескоструйную очистку, или другие методы.
Не стоит также путать коррозию с эрозией – это похожие по звучанию, но совсем разные по сути термины. Эрозия – разрушение металла под влиянием механических и других воздействий, таких как дождь, ветер, пыль и тому подобные явлений. Общее между коррозией и эрозией только то, что обе являются термином для обозначение физического разрушения материала.
Разница между ржавчиной и коррозией — это то же самое, что коррозия и ржавчина
- БЕСПЛАТНАЯ ЗАПИСЬ КЛАСС
- КОНКУРСНЫЕ ЭКЗАМЕНА
- BNAT
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 110003 CBSE
- Книги NCERT
- Книги NCERT для класса 5
- Книги NCERT, класс 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- NCERT Книги для класса 11
- NCERT Книги для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
9plar
- RS Aggarwal
- RS Aggarwal Решения класса 12
- RS Aggarwal Class 11 Solutions
- RS Aggarwal Решения класса 10
- Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- RD Sharma
- RD Sharma Class 6 Решения
- RD Sharma Class 7 Решения
- Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- PHYSICS
- Механика
- Оптика
- Термодинамика
- Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Статистика
- 9000 Pro Числа
- Числа
- 9000 Pro Числа Тр Игонометрические функции
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убытки
- Полиномиальные уравнения
- Деление фракций
- Microology
- 0003000
- Книги NCERT
- FORMULAS
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 000 CALCULATORS
- 000
- 000 Калькуляторы по химии 900 Образцы документов для класса 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 1 1
- Образцы документов CBSE для класса 12
0003000
- Вопросники предыдущего года CBSE
- Вопросники предыдущего года CBSE, класс 10
- Вопросники предыдущего года CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- HC Verma Solutions Класс 12 Физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха класса 9
- Решения Лахмира Сингха класса 10
- Решения Лакмира Сингха класса 8
9000 Класс
9000BSE 9000 Примечания3 2 6 Примечания CBSE
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания 12 CBSE
Примечания
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке
- CBSE Вопросы
- CBSE Class 10 Дополнительные вопросы по математике
- CBSE Class 10 Science Extra questions
- Class 3
- Class 4
- Class 5
- Class 6
- Class 7
- Class 8 Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия
- Решения NCERT для биологии класса 11
- Решение NCERT s Для класса 11 по математике
- NCERT Solutions Class 11 Accountancy
- NCERT Solutions Class 11 Business Studies
- NCERT Solutions Class 11 Economics
- NCERT Solutions Class 11 Statistics
- NCERT Solutions Class 11 Commerce
- NCERT Solutions for Class 12
- Решения NCERT для физики класса 12
- Решения NCERT для химии класса 12
- Решения NCERT для биологии класса 12
- Решения NCERT для математики класса 12
- Решения NCERT, класс 12, бухгалтерский учет
- Решения NCERT, класс 12, бизнес-исследования
- NCERT Solutions Class 12 Economics
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- NCERT Solut Ионы Для класса 4
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для класса 5
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для класса 6
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для класса 6 по социальным наукам
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7
- Решения NCERT для математики класса 7
- Решения NCERT для науки класса 7
- Решения NCERT для социальных наук класса 7
- Решения NCERT для класса 7 Английский язык
- Решения NCERT для класса 8
- Решения NCERT для математики класса 8
- Решения NCERT для науки 8 класса
- Решения NCERT для социальных наук 8 класса ce
- Решения NCERT для класса 8 Английский
- Решения NCERT для класса 9
- Решения NCERT для класса 9 по социальным наукам
- Решения NCERT для математики класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для математики класса 9, глава 2
- для математики класса 9, глава 3
- Решения NCERT для математики класса 9, глава 4
- Решения NCERT для математики класса 9, глава 5
- для математики класса 9, глава 6
- Решения NCERT для математики класса 9 Глава 7
- для математики класса 9 Глава 8
- Решения NCERT для математики класса 9 Глава 9
- Решения NCERT для математики класса 9 Глава 10
- для математики класса 9 Глава 11
- NCERT для математики класса 9 Глава 12
- для математики класса 9 Глава 13
- NCER Решения T для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
Решения NCERT
Решения NCERT
Решения NCERT
Решения NCERT
Решения
Решения NCERT
- Решения NCERT для науки класса 9
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для науки класса 9 Глава 3
- Решения NCERT для науки класса 9 Глава 4
- Решения NCERT для науки класса 9 Глава 5
- Решения NCERT для науки класса 9 Глава 6
- Решения NCERT для науки класса 9 Глава 7
- Решения NCERT для науки класса 9 Глава 8
- Решения NCERT для науки класса 9 Глава 9
- Решения NCERT для науки класса 9 Глава 10
- Решения NCERT для науки класса 9 Глава 12
- Решения NCERT для науки класса 9 Глава 11
- Решения NCERT для науки класса 9 Глава 13
- для науки класса 9 Глава 14
- Решения NCERT для класса 9 по науке Глава 15
Решения NCERT
- Решения NCERT для класса 10
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для математики класса 10
- Решения NCERT для математики класса 10 Глава 1
- Решения NCERT для математики класса 10, глава 2
- Решения NCERT для математики класса 10, глава 3
.
Разница между ржавчиной и коррозией
Ржавчина и коррозия
Хотя рост — это естественный процесс, влияющий на все на Земле, его противоположность, смерть и распад, также очевидна, как и все происходящие изменения. Это очевидно во всем, особенно в живых существах.
Возьмем, к примеру, человека. Он существует в тот момент, когда его зачала мать, а затем он рождается в этом мире и вырастает в ребенка, подростка и взрослого.Через какое-то время он постареет, и его функции организма нарушатся. Со временем его тело больше не сможет жить, и он умрет.
Подобно живым существам, даже неживые материалы со временем распадаются. Это может быть вызвано химическими реакциями или естественными реакциями на элементы окружающей среды. Ржавчина и коррозия — это два процесса, которые вызывают разрушение материалов.
Коррозия — это химическая или электрохимическая реакция, которая приводит к распаду искусственного материала в результате реакции с окружающей средой. Металлы — это обычные материалы, подверженные коррозии. Это постепенный процесс, в котором элементы разъедают материалы, заставляя их разрушаться и разрушаться из-за окисления металлов в результате химической реакции с окислителем, обычно кислородом.
Металлы — это обычные материалы, подверженные коррозии. Это постепенный процесс, в котором элементы разъедают материалы, заставляя их разрушаться и разрушаться из-за окисления металлов в результате химической реакции с окислителем, обычно кислородом.
Хотя это обычное явление для металлов, это также может происходить с другими материалами, такими как керамика и полимеры, но это называется другим названием — разложением. Открытые материалы склонны к коррозии, и это может быть просто трещина на небольшой площади, или они могут быть сосредоточены в большей части.Изменение цвета окрашенных материалов, когда краска выцветает из-за небрежного обращения, является примером коррозии. Даже без видимого окислителя материалы могут подвергаться коррозии, если их оставить на открытом воздухе.
Ржавчина, с другой стороны, представляет собой тип коррозии, которая случается с железом и его сплавами. Когда железо вступает в реакцию с водой или влажным воздухом, образуются оксиды железа, вызывающие коррозию материала. Это вызвано окислением и влажностью, а не химическими веществами. Это происходит, когда нечистое железо вступает в контакт с водой или влажным воздухом, кислородом или другими окислителями, такими как кислоты, и образует ржавчину.
Это вызвано окислением и влажностью, а не химическими веществами. Это происходит, когда нечистое железо вступает в контакт с водой или влажным воздухом, кислородом или другими окислителями, такими как кислоты, и образует ржавчину.
Другими факторами или окислителями, которые могут вызвать ржавчину, являются соль, оксид серы и диоксид углерода. Ржавчина бывает разных форм, наиболее распространенной из которых является красная ржавчина, образованная красными оксидами. Хлор в воде вызывает образование зеленой ржавчины. Как и большинство коррозионных процессов, ржавление происходит постепенно. Через некоторое время, если материал не обрабатывать, он распадется, и все превратится в ржавчину, сделав его непригодным для использования.
Резюме:
1. Коррозия — это разрушение материалов в результате химических или электрохимических реакций, а ржавчина — это один из видов коррозии.
2. Коррозия — это разложение всех типов металлов, а также таких материалов, как полимеры и керамика, а ржавчина — это коррозия железа и его сплавов.
3. Коррозия возникает в результате реакции материала на химические вещества, а ржавчина — в результате воздействия воды или влаги и окисления.
: Если вам понравилась эта статья или наш сайт. Пожалуйста, расскажите об этом. Поделитесь им с друзьями / семьей.
Cite
Емельда М. «Различие между ржавчиной и коррозией.»DifferenceBetween.net. 27 октября 2011 г.
.
Разница между ржавчиной и коррозией
×
Извините !, эта страница сейчас недоступна для добавления в закладки.
Ржавчина и коррозия являются реакциями окисления. Коррозия возникает на широком диапазоне объектов, в то время как ржавление ограничено, поскольку возникает только на железе.Мы можем сказать, что ржавчина — это тип коррозии или наиболее распространенный пример коррозии, поскольку ржавление металлических предметов встречается очень часто.
Что такое ржавчина?
Ржавчина — это окисление железа или железных предметов. Это происходит в присутствии воздуха и влаги. Это медленный процесс. Из-за ржавчины на железных предметах образуется ржавчина. Это оксид железа красно-оранжевого цвета, который образуется при окислении железа в присутствии кислорода, влаги или воды.
Это происходит в присутствии воздуха и влаги. Это медленный процесс. Из-за ржавчины на железных предметах образуется ржавчина. Это оксид железа красно-оранжевого цвета, который образуется при окислении железа в присутствии кислорода, влаги или воды.
Вовлеченные реакции можно записать следующим образом —
4Fe + 3O2 🡪 2Fe2O3
2Fe2O3 + xh4O 🡪 Fe2O3.xh4O
Ржавчина
Что такое коррозия?
Коррозия — это окисление металлов и неметаллов, которое приводит к разрушению и непреднамеренной деградации материалов окружающей средой. Он образует оксиды, гидроксиды и сульфиды элементов, присутствующих в материале.
Разница между коррозией и ржавчиной
Коррозия | Ржавчина |
Коррозия — это процесс разрушения металлов и неметаллов в результате окисления. | Ржавчина — это окисление железа (или стали) в присутствии воздуха и влаги. |
Коррозия может возникать как на металлах, так и на неметаллах. Это может также произойти на коже и дереве. | Ржавчина возникает только на металлах, таких как железо и сталь. |
Коррозия включает ржавчину. | Ржавчина — это один из видов коррозии. |
Требуется воздействие воздуха или химикатов на поверхность. | Требуется и воздух, и влага. |
Могут потребоваться коррозионные химические вещества, такие как HCl, h4SO4 и другие сильные кислоты и основания. | Не требует химикатов. |
Смесь (или слой), образовавшаяся в результате коррозии, может иметь разные цвета, такие как синий, зеленый и т. Д. | Ржавчина образует ржавчину красно-оранжевого цвета. |
Что такое прогорклость?
Обычно студенты путают понятия коррозии и прогорклости.Прогорклость отличается от коррозии, хотя это также реакция окисления. Прогорклость — это окисление жиров и масел, присутствующих в пищевых материалах, из-за которого изменяется запах и вкус пищевого материала.
Мы можем предотвратить это, добавляя антиоксиданты и храня продукты в герметичных контейнерах.
Предотвращение коррозии, ржавчины и прогорклости
Путем нанесения барьерных покрытий, таких как краска, пластмассы и т. Д., На поверхность материалов.
Можно использовать процесс горячего цинкования.
Мы можем формировать сплавы, чтобы предотвратить их коррозию.
Можно использовать катодную защиту.

Содержите стальные и железные предметы в чистоте и сухости, вдали от влаги и воздуха.
Путем нанесения защитного покрытия.
За счет использования сплавов железа вместо чистого железа.
Путем гальванизации.
Путем формирования слоя оксида железа с использованием нитрата калия и гидроксида натрия.
При использовании инертных газов в упаковке.
Используя поглотители кислорода.
При охлаждении пищевых продуктов.
При хранении пищевых продуктов в темном месте.

Используя герметичные контейнеры.
При использовании вакуумной упаковки.
С использованием антиоксидантов.
Мы надеемся, что это поможет вам понять разницу между коррозией и прогорклостью.Тем не менее, если у вас есть сомнения, не стесняйтесь присоединиться к классу сомнений по Веданту. Вы также можете зарегистрироваться на Vedantu или загрузить учебное приложение Vedantu для 6-10 классов, IITJEE и NEET, чтобы получить доступ к бесплатным PDF-файлам с решениями NCERT, учебными материалами и многим другим.
.
Разница между ржавчиной и коррозией
Переключить навигацию
- Дом
- Темы
- ПОСМОТРЕТЬ ВСЕ ТЕМЫ
- Аэрограф
- Американский
- Арт.

- Искусство и дизайн
- Статьи и новости
- Искусство и архитектура
- Искусство и идеи
- Автомобили
- Бейсбол
- Векселя
- Биография
- Биография и мемуары
- Забронировать
- Отрывки из книг
- Книги
- Книги — Художественная литература
- Книги — Научная литература
- Брошюры
- Бизнес и экономика
- Бизнес и лидерство
- Бизнес / право
- Календари
- Калифорния
- Chick Lit
- Детская литература
- Кристиан
- Комическая фантастика и сатиры
- Комиксы
- Компьютеры и технологии
- Современная фантастика
- Современные женщины
- Кулинария и еда
- Корпоративные финансы
- Судебные документы
- Протоколы судебных заседаний
- Ремесла
- Творческое письмо
- Уголовно-процессуальный
- Кроссворды
- Текущая экономика
- Базы данных
- Диета и питание
- Документы
- Экономические условия
- Экономическая история и теория
- Образование
- Эмиграционные и иммиграционные исследования
- Энергия
- Экономика окружающей среды
- Очерки
- Эссе и тезисы
- Этнические исследования и исследования меньшинств
- Этническая принадлежность, раса и пол
- Вера и духовность
- Семейные саги
- Фанфики
- Фантазия
- Художественная литература
- Пленка
- Финансы
- Еда и вино
- Гаджеты
- Игры и головоломки
- Генеалогия
- Жанр Художественная литература
- Правительство и политика
- Правительственные документы
- Графика
- Здоровье и образ жизни
- Здоровье и медицина
- Здоровье и благополучие
- Исторический
- История
- История, критика и теория
- Домашнее задание
- Ужас
- Юмор
- Отрасли промышленности
- Информационные технологии и теория
- Инструкции по эксплуатации
- Интернет и технологии
- Японский
- Еврей
- Журналы
- Закон
- Юридический
- Юридические формы
- Письма
- Литература
.
Белорусский государственный университет транспорта — БелГУТ (БИИЖТ)
Как поступить в БелГУТ:
дневное, заочное полное,
заочное сокращенное
Как получить место
в общежитии БелГУТа
Как поступить иностранному гражданину
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 | 2 | |||||
3 | 4 Дата : 2022-10-04 | 5 | 6 Дата : 2022-10-06 | 7 | 8 | 9 |
10 | 11 Дата : 2022-10-11 | 12 | 13 Дата : 2022-10-13 | 14 Дата : 2022-10-14 | 15 | 16 |
17 | 18 | 19 | 20 | 21 | 22 | 23 |
24 | 25 | 26 Дата : 2022-10-26 | 27 Дата : 2022-10-27 | 28 | 29 | 30 |
31 | ||||||
Все анонсы
- Билеты на концерты Ирины Дорофеевой и группы «АУРА.
 ..
.. - 1 тур серии игр «ЧТО? ГДЕ? КОГДА?» среди студентов…
- Поздравление ректора с Днем матери!…
- КОНКУРС «ТРАНСПОРТ БУДУЩЕГО» 2023…
- Заседание совета университета …
- Изменения в Колдоговор. Примите участие в обсужден…
- Приглашаем вас на мероприятие ко Дню матери…
- Закрутим доброе дело!
- 1-й этап репетиционного тестирования…
- Первый этап интеллектуальной игры «Что? Где? Когда…
Анонсы
Университет
Абитуриентам
Студентам
Конференции
Приглашения
Билеты на концерты Ирины Дорофеевой и группы «АУРА…
1 тур серии игр «ЧТО? ГДЕ? КОГДА?» среди студентов…
Поздравление ректора с Днем матери!…
КОНКУРС «ТРАНСПОРТ БУДУЩЕГО» 2023…
Новости
Университет
Международные связи
Спорт
Воспитательная работа
Жизнь студентов
Новости подразделений
Воспитательная работа
Студенческая семья из БелГУТа участвует в республиканском проекте «Авт. ..
..
18 октября 2022
Университет
Республиканский месячник «Человек с белой тростью»…
18 октября 2022
Студенческая жизнь
В ПРЕДДВЕРИИ ПРАЗДНИКОВ | ВЫПУСК 1 | БЕЛГУТ…
18 октября 2022
Университет
День открытых дверей военно-транспортного факультета…
17 октября 2022
Воспитательная работа
Диалоговая площадка, посвященная теме Великой Октябрьской социалистиче…
17 октября 2022
Студенческая жизнь
Чистота у дома. Субботник у студгородка…
15 октября 2022
Студенческая жизнь
Мероприятие, посвящённое Дню матери «Наши самые-самые!». ..
..
14 октября 2022
Университет
Встреча ректора с молодыми специалистами…
14 октября 2022
Университет
На стыке культур — Happy Mother`S Day — З Днем Маці…
14 октября 2022
Другие новости
- «Студент года» 2022 в БелГУТе
- Мама — самое главное слово!
- Курсы повышения квалификации для специалистов структурных подразделени…
- Дорогим МАМАМ от механического факультета…
- Новый номер газеты «Вести БелГУТа»
- Повышение квалификации сотрудников технического отдела дистанции пути …
- Водным ресурсам – нашу заботу!
- Победа сборной БелГУТа в соревнованиях по гандболу!…
- Формирование коллективного иммунитета начинается с тебя и твоей семьи…
- Памяти Григория Фиглина
- Ко Дню Матери.
 Мама олимпийской чемпионки…
Мама олимпийской чемпионки…
КУДА ПОСТУПАТЬ
Все факультеты
БелГУТ на Доске почета
Достижения университета
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
Понимание явлений коррозии: процесс, механизм и метод
На этой странице
Авторское право Статьи по теме
Явления коррозии материалов очень сложны, поскольку коррозионные реакции и/или процессы в значительной степени зависят от систем материал/окружающая среда. Повреждение материалов, вызванное коррозионными явлениями, привело к потере энергии и ресурсов, нестабильности жизни людей, снижению надежности инфраструктуры и так далее. Чтобы преодолеть их, были введены последние достижения в понимании явлений и механизмов коррозии для новых аспектов и перспектив изучения роли анионных частиц и пленок, образующихся в коррозионном поведении, факторов, влияющих на восприимчивость к SCC (коррозионное растрескивание под напряжением), проникновение водорода поведение, связанное с водородным охрупчиванием, и так далее. Это привело к разработке материала с более высокой коррозионной стойкостью, более подходящего ингибитора и метода предотвращения коррозии, а также к разумному выбору материала в данной коррозионной среде. Поэтому этот специальный выпуск был посвящен последним разработкам в области коррозионного растрескивания под напряжением, достижениям в области коррозионно-стойких материалов, роли атомарного водорода в водородном охрупчивании, стабильности и прочности образующихся пленок, новым аспектам локальной коррозии (точечная коррозия и щелевая коррозия). , последние разработки в области ингибиторов, новые методы изучения коррозионного поведения и т.д.
Это привело к разработке материала с более высокой коррозионной стойкостью, более подходящего ингибитора и метода предотвращения коррозии, а также к разумному выбору материала в данной коррозионной среде. Поэтому этот специальный выпуск был посвящен последним разработкам в области коррозионного растрескивания под напряжением, достижениям в области коррозионно-стойких материалов, роли атомарного водорода в водородном охрупчивании, стабильности и прочности образующихся пленок, новым аспектам локальной коррозии (точечная коррозия и щелевая коррозия). , последние разработки в области ингибиторов, новые методы изучения коррозионного поведения и т.д.
В нескольких статьях описаны защита от коррозии, атомное моделирование явлений коррозии, продукты коррозии, подвергающиеся длительному воздействию атмосферной среды, и коррозионное поведение усовершенствованного материала (интерметаллическое соединение на основе никеля). Т. Оцука рассмотрел защиту стали от коррозии путем покрытия проводящими полимерами, такими как полианилин, полипиррол и политиофен. Он описал, что они действуют как сильный окислитель, вызывая потенциальный сдвиг в благородном направлении. К. Д. Тейлор рассмотрел и рассмотрел атомистическое моделирование процессов коррозии, таких как граница раздела металл-вода, реакция воды, конкурентная адсорбция, структура металлической поверхности и т. д. F. Q-Li и соавт. исследовал множество бронзовых изделий династии Цинь, извлеченных из гробниц в городе Синьфэн, с помощью SEM / EDS, XRD и RM и получил ценную информацию о сохранении бронзовых изделий. С. О. Адеосун и соавт. исследовал коррозионное поведение сплавов Al-Mg в литом состоянии и после регрессии в растворах NaCl, FeCl 3 и так далее. Они указали, что кристаллы Mg 2 Si, являющиеся анодными по отношению к матрице, влияют на коррозионное поведение. Коррозионное поведение двухфазных интерметаллидов Ni 3 Al/Ni 3 V было исследовано в различных кислых растворах с использованием иммерсионного теста и СЭМ G. Priyotomo et al.
Он описал, что они действуют как сильный окислитель, вызывая потенциальный сдвиг в благородном направлении. К. Д. Тейлор рассмотрел и рассмотрел атомистическое моделирование процессов коррозии, таких как граница раздела металл-вода, реакция воды, конкурентная адсорбция, структура металлической поверхности и т. д. F. Q-Li и соавт. исследовал множество бронзовых изделий династии Цинь, извлеченных из гробниц в городе Синьфэн, с помощью SEM / EDS, XRD и RM и получил ценную информацию о сохранении бронзовых изделий. С. О. Адеосун и соавт. исследовал коррозионное поведение сплавов Al-Mg в литом состоянии и после регрессии в растворах NaCl, FeCl 3 и так далее. Они указали, что кристаллы Mg 2 Si, являющиеся анодными по отношению к матрице, влияют на коррозионное поведение. Коррозионное поведение двухфазных интерметаллидов Ni 3 Al/Ni 3 V было исследовано в различных кислых растворах с использованием иммерсионного теста и СЭМ G. Priyotomo et al. Они обнаружили, что преимущественное растворение фазы (L1 2 + D0 22 ) имело место, и коррозионное поведение в значительной степени зависело от анионов.
Они обнаружили, что преимущественное растворение фазы (L1 2 + D0 22 ) имело место, и коррозионное поведение в значительной степени зависело от анионов.
В других статьях описывалось локальное коррозионное поведение, такое как межкристаллитная коррозия, точечная коррозия и SCC M.E. Arikan et al. определили подверженность межкристаллитной коррозии дуплексной нержавеющей стали типа UNS 31803, которая подвергалась старению в разное время при 725°C, с использованием метода электрохимической реактивации и испытания на потерю веса. Они обнаружили, что степень сенсибилизации была связана с областями, обедненными хромом и молибденом. Н. Хара и соавт. изучали стойкость к точечной коррозии нержавеющей стали марки 316 L. Они пришли к выводу, что повышение стойкости к точечной коррозии было связано с положительным эффектом удаления включений MnS с поверхности стали, а не с эффектом модификации химического состава пассивных пленок. SCC стали для сосудов высокого давления A516 исследовали испытаниями на медленную скорость деформации в H 2 O-CO-CO 2 растворы J.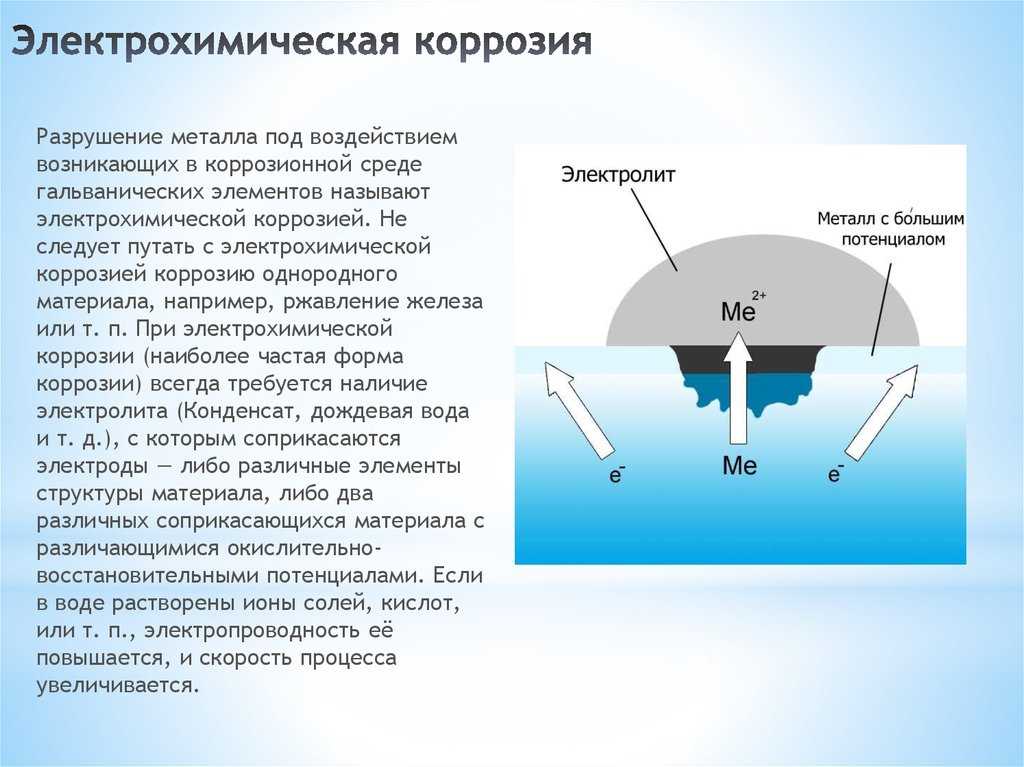 W. van der Merwe. Установлено, что компонент СО играет важную роль в инициировании КРР, то есть торможении коррозионной реакции. Х. Накано и соавт. исследовали свойство SCC сплава Al-Mg, обработанного равноканальным угловым прессованием (ECAP) методом медленной деформации в 3% NaCl с pH 4 при 303 K. Они обнаружили, что снижение восприимчивости к SCC было связано с улучшением коррозионная стойкость, обеспечиваемая ECAP. О. М. Алюсиф и соавт. исследовали влияние приложенного напряжения на индуцированное окружающей средой растрескивание (EIC) алюминиевого сплава (5052) в 0,5 M растворе NaCl с использованием метода постоянной нагрузки. Они пришли к выводу, что стационарная скорость удлинения стала параметром для прогнозирования времени до разрушения, а EIC был вызван SCC, а не HE (водородное охрупчивание).
W. van der Merwe. Установлено, что компонент СО играет важную роль в инициировании КРР, то есть торможении коррозионной реакции. Х. Накано и соавт. исследовали свойство SCC сплава Al-Mg, обработанного равноканальным угловым прессованием (ECAP) методом медленной деформации в 3% NaCl с pH 4 при 303 K. Они обнаружили, что снижение восприимчивости к SCC было связано с улучшением коррозионная стойкость, обеспечиваемая ECAP. О. М. Алюсиф и соавт. исследовали влияние приложенного напряжения на индуцированное окружающей средой растрескивание (EIC) алюминиевого сплава (5052) в 0,5 M растворе NaCl с использованием метода постоянной нагрузки. Они пришли к выводу, что стационарная скорость удлинения стала параметром для прогнозирования времени до разрушения, а EIC был вызван SCC, а не HE (водородное охрупчивание).
Рокуро Нисимура
Тору Цуру
Тошиаки Оцука
Нобуёси Хара
Эн-Хоу Хан
Осама Алюсиф
Авторское право
Авторское право © 2012 Rokuro Nishimura et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
20.8: Коррозия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21797
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы портятся в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за заметным исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), широко известный как ржавчина, который не образует плотной защитной пленки (рис. \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
Рисунок \(\PageIndex{1}\): Ржавчина, результат коррозии металлического железа. Железо окисляется до Fe 2 + (водн.) на анодном участке на поверхности железа, который часто является примесью или дефектом решетки. Кислород восстанавливается до воды в другом месте на поверхности железа, которое действует как катод. Электроны переходят от анода к катоду через электропроводящий металл. Вода является растворителем для Fe 2 + , который производится изначально и действует как солевой мостик. Ржавчина (Fe 9o_{cell}\) для процесса коррозии (уравнение \(\ref{Eq3}\)) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 M H + ) . В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)).
Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)).
Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн. ) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
Рисунок \(\PageIndex{3}\): Гальваническая коррозия. Если железо находится в контакте с более устойчивым к коррозии металлом, таким как олово, медь или свинец, другой металл может действовать как большой катод, который значительно увеличивает скорость восстановления кислорода. Поскольку восстановление кислорода связано с окислением железа, это может привести к резкому увеличению скорости окисления железа на аноде. Гальваническая коррозия, вероятно, возникает всякий раз, когда два разнородных металла соединяются напрямую, позволяя электронам передаваться от одного к другому. 9{2+}}\) (E° = -0,14 В) и Fe 2 + (E° = -0,45 В) в таблице P2 показывают, что \(\ce{Fe}\) легче окисляется, чем \(\ce{Sn}\). В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис. \(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
\(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
Более активный металл вступает в реакцию с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита — это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защите (защита нижележащей стали от кислорода воздуха), так и катодной защите (после воздействия цинк окисляется раньше, чем нижележащая сталь).
В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Рисунок \(\PageIndex{4}\): Использование жертвенного электрода для защиты от коррозии. Присоединение магниевого стержня к подземному стальному трубопроводу защищает трубопровод от коррозии. Поскольку магний (E ° = -2,37 В) окисляется гораздо легче, чем железо (E ° = -0,45 В), стержень Mg действует как анод в гальваническом элементе. Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2 + на аноде анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они пополняют запасы протонов, потребляемых при восстановлении кислорода. Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии в порядке уменьшения затрат и неудобств: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).

Цинковый расходуемый анод (округлый предмет, привинченный к нижней части корпуса), используемый для предотвращения коррозии винта в лодке посредством катодной защиты. Изображение Реми Каупп и используется с разрешения.
Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме — из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
Нет, если только вы не планируете продавать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.

Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
20.8: Коррозия распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- нет на странице
- Метки
- коррозия
- Профилактическая защита
- протекторный анод
- жертвенный электрод
Испытательный реактор Исследования явления теневой коррозии
Лицензионное соглашение ASTM
ВАЖНО – ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ЭТИ УСЛОВИЯ ПЕРЕД ЗАГРУЗКОЙ ЭТОГО ДОКУМЕНТА.
Загружая документ ASTM, вы заключаете договор и признаете, что
у вас есть
читать
настоящего Лицензионного соглашения, что вы понимаете его и соглашаетесь соблюдать его
условия.
Если вы не согласны с условиями настоящего Лицензионного соглашения, немедленно покиньте эту страницу.
без
скачивание
документ ASTM.
Пожалуйста, , нажмите здесь , чтобы просмотреть лицензионное соглашение для образовательных учреждений.
Собственность.
Этот документ защищен авторским правом ASTM International (ASTM), 100
Барр Харбор Драйв, Западный Коншохокен, Пенсильвания, 19428-2959, США.
Все права защищены. Вы (Лицензиат) не имеете прав собственности или других прав на Документ ASTM.
Это не продажа; все права, право собственности и интересы в документе ASTM (как в электронном файле
и печатная копия) принадлежат ASTM.
Вы не можете удалять или скрывать уведомление об авторских правах или другие уведомления, содержащиеся в ASTM.
Документ.
Ограниченная лицензия.
ASTM предоставляет вам ограниченную лицензию без права передачи следующим образом:
Право на загрузку электронного файла настоящего документа ASTM для временного хранения на одном
компьютер для просмотра и/или печати одной копии документа ASTM
для отдельных
использовать.
Ни электронный файл, ни одиночная распечатка не могут быть воспроизведены каким-либо образом.
Кроме того, электронный файл не может распространяться где-либо еще по компьютерным сетям или
в противном случае.
То есть электронный файл нельзя отправить по электронной почте, скачать на диск, скопировать на другой жесткий диск.
диск или иным образом общий доступ. Одна печатная копия может быть распространена только среди других
сотрудники для их внутреннего использования в вашей организации; его нельзя копировать.
Этот документ ASTM не может быть продан или перепродан, сдан в аренду, сдан в аренду, одолжен или
сублицензия. Абонент будет нести ответственность за весь контроль доступа и безопасность
меры, необходимые для того, чтобы IP-адреса Абонента не использовались для
получать доступ к журналам, кроме авторизованных Пользователей.
ASTM International предоставляет подписчикам и авторизованным
Пользователи у Абонента Авторизованы
Сайт , онлайн-доступ к журналу ASTM, для которого Подписчик поддерживает текущую
подписка
к печатной или онлайн-версии. Этот грант распространяется только на Подписчика и таких Уполномоченных
Этот грант распространяется только на Подписчика и таких Уполномоченных
Пользователи индивидуально и не могут быть переданы или распространены на других. Для перепечатки А.
журнальную статью, пожалуйста, свяжитесь со службой поддержки клиентов ASTM, 100 Barr Harbour Dr., PO Box C700, West
Коншохокен, Пенсильвания 19428, тел.: 610-832-9555; факс: 610-832-9585; Эл. адрес:
[email protected]
Проверка:
ASTM имеет право проверять соблюдение настоящей Лицензии.
Соглашение за свой счет и в любое время в течение обычного рабочего дня. Для этого
ASTM привлечет независимого консультанта при условии соблюдения соглашения о конфиденциальности для рассмотрения
использование вами документов ASTM. Вы соглашаетесь разрешить доступ к вашей информации и компьютерным системам
для этой цели. Проверка будет проводиться с уведомлением не менее чем за 15 дней в обычное время.
Проверка будет проводиться с уведомлением не менее чем за 15 дней в обычное время.
в рабочее время и таким образом, чтобы необоснованно не мешать вашей деятельности. Если
проверка выявляет нелицензионное использование документов ASTM, вы должны возместить ASTM расходы
понесенные при проверке и возмещении ASTM за любое нелицензионное использование. Вызывая эту процедуру,
ASTM не отказывается от каких-либо прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности.
собственности иными способами, разрешенными законом.
Пароли.
Вы должны немедленно уведомить ASTM о любом известном или предполагаемом
несанкционированное использование вашего пароля или любое известное или предполагаемое нарушение безопасности, в том числе
потеря, кража или несанкционированное раскрытие вашего пароля или любой несанкционированный доступ или использование
документа ASTM. Вы несете единоличную ответственность за сохранение конфиденциальности ваших
Вы несете единоличную ответственность за сохранение конфиденциальности ваших
пароль и для обеспечения санкционированного доступа и использования документа ASTM.
Определения.
Для целей настоящей Лицензии авторизованным сайтом является
локализованный сайт
(одно географическое местоположение), находящееся под единым управлением в одном месте. Для
Подписчик с местонахождением более чем в одном городе, каждый город считается отдельным сайтом.
Для Подписчика, имеющего несколько местоположений в одном городе, каждое место считается
другой сайт. (Если вам нужен онлайн-доступ к нескольким сайтам, свяжитесь с Кэти
Hooper, ASTM International, по адресу [email protected] или по телефону: 610-832-9.634). Авторизованный
Пользователь означает
только сотрудники, преподаватели, сотрудники и студенты, официально связанные с Подписчиком в
Авторизованный сайт, а также лица, имеющие законный доступ к фондам и объектам библиотеки.
на Авторизованном сайте, используя IP-адрес в диапазоне, указанном в подписке.
Авторизованными пользователями могут быть лица, удаленные от физического местонахождения Абонента, доступ которых
администрируемых с Авторизованного объекта, но не лица, находящиеся на удаленных объектах или в кампусах с отдельными
администрации. Например, сотрудник Абонента может считаться
Авторизованный пользователь при доступе к сети Абонента из дома или во время поездки в другую
город; однако сотрудники филиала или объекта в другом городе не считаются
Авторизованные пользователи. Подписчик — это физическое или юридическое лицо, подписавшееся на
журнал ASTM
и согласился с условиями этой ограниченной лицензии.
Прекращение.
Настоящее Соглашение действует до момента расторжения. Вы можете расторгнуть настоящее Соглашение в любое время путем
Вы можете расторгнуть настоящее Соглашение в любое время путем
уничтожение всех копий (печатных, цифровых или на любом носителе) документа ASTM (журнала).
Применимое право, место проведения, юрисдикция.
Настоящее Соглашение должно толковаться и толковаться в соответствии с законодательством
Содружество Пенсильвании. Лицензиат соглашается подчиняться юрисдикции и месту проведения в штате
и федеральные суды Пенсильвании для разрешения любых споров, которые могут возникнуть в связи с настоящим Соглашением. Ты
также соглашаетесь отказаться от любых претензий на неприкосновенность, которыми вы можете обладать.
Интеграция.
Настоящее Соглашение представляет собой полное соглашение между вами и ASTM в отношении его предмета. Это
заменяет все предыдущие или одновременные устные или письменные сообщения, предложения,
заявлений и гарантий и имеет преимущественную силу над любыми противоречащими или дополнительными условиями любого
цитата, заказ, подтверждение или другое сообщение между сторонами, относящееся к его предмету
вопрос в течение срока действия настоящего Соглашения. Никакие изменения настоящего Соглашения не будут иметь обязательной силы,
Никакие изменения настоящего Соглашения не будут иметь обязательной силы,
если они не оформлены в письменной форме и не подписаны уполномоченным представителем каждой из сторон.
Отказ от гарантии.
Если не указано иное в настоящем Соглашении, все явные или подразумеваемые условия, заявления и
гарантии, включая любые подразумеваемые гарантии товарного состояния, пригодности для определенной цели
или ненарушение прав, за исключением случаев, когда эти отказы считаются
юридически недействительным.
Ограничение ответственности.
В той мере, в какой это не запрещено законом, ASTM ни при каких обстоятельствах не будет нести ответственность за любые потери, повреждения, утерю
данных или за особый, косвенный, косвенный или штрафной ущерб, независимо от того,
теория ответственности, возникающая в связи с использованием или загрузкой ASTM
Документ.


