Магнитные свойства меди и железа химия: Магнитные свойства меди и железа? : )
Содержание
Физико-химические свойства меди и железа (стр. 2 из 2)
Задача № 3. (магнитный материал)
Рассчитать индуктивность катушки с числом витков 50 и размерами сердечника диаметром 5 мм и высотой 10 мм, выполненного из железа или углеродистой стали.
Решение: Индуктивность катушки с заданными параметрами сердечника из заданного материала рассчитывается по формуле:
Где -магнитная постоянная (12,6),
— начальная магнитная проницаемость материала (600),
W — количество витков (50),
Sc— площадь сечения магнитного материала (см2),
lc— средняя длина магнитных силовых линий.
Для расчета площади сечения воспользуемся формулой
Где D – диаметр сердечника в сантиметрах.
lc » hсерд – высота сердечника (1 см)
Подставив данные в формулу, получим:
Задание 4. Зонная теория собственного полупроводника.
Зонная теория собственного полупроводника.
Полупроводники, в известном смысле, занимают промежуточное положение между традиционными проводниками и диэлектриками. С точки зрения зонной теории собственные полупроводники могут рассматриваться как диэлектрики с очень узкой запрещенной зоной. Наиболее распространенными представителями собственных полупроводников являются кристаллы кремния и германия. При сверх низких температурах такие кристаллы проявляют диэлектрические свойства, поскольку электроны оказываются неспособными преодолеть узкую запрещенную зону, отделяющую их от зоны проводимости. Однако, даже комнатных температур оказывается достаточно для того, чтобы указанный энергетический барьер оказался преодолимым для электронов. В результате частицы, перешедшие в следующую разрешенную зону (зону проводимости) приобретают способность ускоряться электрическим полем и, следовательно, переносить ток.
При переходе электрона в зону проводимости из заполненной зоны (валентной зоны) в зону проводимости в первой остается незаполненное место, которое легко может занять какой-либо электрон из той же зоны. В результате образовавшаяся вакансия приобретает возможность перемещаться в пределах валентной зоны. Ее поведение во многом напоминает поведение частицы с положительным зарядом.
В результате образовавшаяся вакансия приобретает возможность перемещаться в пределах валентной зоны. Ее поведение во многом напоминает поведение частицы с положительным зарядом.
Для упрощения описания ансамбля из большого числа электронов в почти заполненной валентной зоне часто оказывается более удобным следить за имеющимися вакансиями, рассматривая их как некоторые гипотетические частицы — дырки (простым гидромеханическим аналогом дырки может служить пузырек в стакане с газированным напитком). Не являющиеся реальными объектами природы дырки, часто обладают весьма экзотическими свойствами. Так их эффективная масса не обязательно должна выражаться положительным числом, а зачастую оказывается тензорной величиной. Наряду с фотонами дырки представляют собой квазичастицы, вводимые в теорию на основе аналогий с формулами, описывающими поведение реальных объектов. Подобно положительным частицам дырки ускоряются электрическим полем и вносят свой вклад в проводимость полупроводниковых кристаллов.
Отметим, что электроны проводимости так же являются квазичастицами. С точки зрения квантовой механики все электроны кристалла являются принципиально неразличимыми, что делает бессмысленными попытки ответа на вопрос, какой именно электрон перешел в зону проводимости. Электрический ток в кристалле обусловлен весьма сложным поведением всех без исключения имеющихся в нем электронов. Однако описывающие это поведение уравнения обнаруживают близкое сходство с уравнениями движения лишь очень небольшого числа заряженных частиц — электронов и дырок.
Наряду с полупроводниками с собственной проводимостью существуют примесные полупроводники. Последние получают внедрением в кристаллы собственных полупроводников (состоящих из атомов четырехвалентных элементов) примесей из трех или пяти валентных атомов (донорные и акцепторные примеси соответственно). Из-за малых концентраций атомов примесей их энергетически уровня в зоны не расщепляются. В результате оказывающиеся на примесных уровнях электроны и дырки не обладают подвижностью. С точки зрения энергетической схемы не участвующий в образовании валентных связей пятый электрон атома донорной примеси оказывается на уровне в непосредственной близости от зоны проводимости и легко переходит в эту зону. Образующаяся при этом дырка оказывается локализованной вблизи атома примеси. Т.о. в примесных полупроводниках донорного типа преимущественно реализуется электроный характер проводимости. В полупроводниках с акцепторной примесью ситуация оказывается точно противоположной. Атом третьей группы захватывает недостающий для образования химической связи электрон у четырехвалентных соседей. В результате в валентной зоне возникают подвижные дырки, являющиеся носителями зарядов в таких системах.
С точки зрения энергетической схемы не участвующий в образовании валентных связей пятый электрон атома донорной примеси оказывается на уровне в непосредственной близости от зоны проводимости и легко переходит в эту зону. Образующаяся при этом дырка оказывается локализованной вблизи атома примеси. Т.о. в примесных полупроводниках донорного типа преимущественно реализуется электроный характер проводимости. В полупроводниках с акцепторной примесью ситуация оказывается точно противоположной. Атом третьей группы захватывает недостающий для образования химической связи электрон у четырехвалентных соседей. В результате в валентной зоне возникают подвижные дырки, являющиеся носителями зарядов в таких системах.
При контакте примесных полупроводников с электронной и дырочной проводимостью возникает пограничный слой, обладающий выпрямительными свойствами — т.н. p-n — переход. В настоящее время полупроводниковые выпрямители практически вытеснили их электровакуумные аналоги.
Два p-n — перехода, разделенных узким полупроводниковым промежутком с примесной проводимостью образуют транзистор — простейшую полупроводниковую структуру, обладающую усилительными свойствами.
Список использованной литературы:
1. Н.П. Богородицкий, В.В. Пасынков, Б.М. Тареев. Электротехнические материалы, 1977г.;
2. Р.М.Терещук, К.М. Терещук, С.А. Седов. Полупроводниковые Приемно-усилительные устройства. Справочник радиолюбителя, 1989г.;
3. П. Эткинс. Молекулы, 1991г.;
4. Н.Н. Калинин и др. Электрорадиоматериалы, 1981г.
Железо
|
Железо | |
|---|---|
|
Атомный номер |
26 |
|
Внешний вид простого вещества |
ковкий, вязкий металл серебристо-белого цвета |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
55,847 а. е. м. (г/моль) |
|
Радиус атома |
126 пм |
|
Энергия ионизации (первый электрон) |
759,1 (7,87) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ar] 3d6 4s2 |
|
Химические свойства | |
|
Ковалентный радиус |
117 пм |
|
Радиус иона |
(+3e) 64 (+2e) 74 пм |
|
Электроотрицательность (по Полингу) |
1,83 |
|
Электродный потенциал |
Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
|
Степени окисления |
6, 3, 2, 0, −2 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
7,874 г/см³ |
|
Молярная теплоёмкость |
25,14[1]Дж/(K·моль) |
|
Теплопроводность |
80,4 Вт/(м·K) |
|
Температура плавления |
1812 K |
|
Теплота плавления |
247,1 кДж/кг 13,8 кДж/моль |
|
Температура кипения |
3134 K |
|
Теплота испарения |
~6088 кДж/кг ~340 кДж/моль |
|
Молярный объём |
7,1 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
кубическая объёмноцентрированная |
|
Параметры решётки |
2,866 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
460 K |
|
Fe |
26 |
|
55,847 | |
|
[Ar]3d64s2 | |
|
Железо | |
Железо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 26. Обозначается символом Fe (Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
И. Менделеева, атомный номер 26. Обозначается символом Fe (Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2 % углерода) и чугун (более 2 % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
История
Железо как инструментальный материал известно с древнейших времён, самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это наконечники для стрел и украшения из метеоритного железа, то есть, сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), из которого состоят метеориты. От их небесного происхождения идёт, видимо, одно из наименований железа в греческом языке: «сидер» (а на латыни это слово значит «звёздный»).
Изделия из железа, полученного искусственно, известны со времени расселения арийских племён из Европы в Азию и острова Средиземного моря (4—3-е тысячелетие до н. э.). Самый древний железный инструмент из известных — стальное долото, найденное в каменной кладке пирамиды Хеопса в Египте (построена около 2550 года до н. э.). Железо часто упоминается в древнейших (3-е тысячелетие до н. э.) текстах хеттов, основавших свою империю на территории современной Анатолии в Турции. Например, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
э.). Железо часто упоминается в древнейших (3-е тысячелетие до н. э.) текстах хеттов, основавших свою империю на территории современной Анатолии в Турции. Например, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошел, человек из города Пурусханды ко мне поклониться пришел (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнес.
В этом тексте железо обозначается словом «par-zi-lum» (сравните латинское «ferrum» и русское «железо»), что, скорее всего, значит «олово всадников» — от древнеарийских слов «PARSA» или «FERSY» (всадник — сравните этноним «персы», отсюда же шахматная фигура «ферзь», и латинские слова «persona» и «partia»), и корня «ZIL» (олово, и вообще белый металл).
В древности мастерами железных изделий слыли халибы, которых Геродот перечисляет в числе эллинских племён Малой Азии, подвластных Крезу. Халибы жили на севере державы Хеттов, у побережья Чёрного моря возле устья реки Галис (современный г. Самсун в Турции), и от их имени происходит греч. Χάλυβας — «сталь». Аристотель описал их способ получения стали: халибы несколько раз промывали речной песок их страны — видимо, таким способом (теперь это называют флотацией) выделяли тяжёлую железосодержащую фракцию породы, добавляли какое-то огнеупорное вещество, и плавили в печах особой конструкции; полученный таким образом металл имел серебристый цвет и был нержавеющим. Из этого процесса, видимо, возникло и название «руда», которое на латыни значит «мокрый» — то есть, «вымытый».
Самсун в Турции), и от их имени происходит греч. Χάλυβας — «сталь». Аристотель описал их способ получения стали: халибы несколько раз промывали речной песок их страны — видимо, таким способом (теперь это называют флотацией) выделяли тяжёлую железосодержащую фракцию породы, добавляли какое-то огнеупорное вещество, и плавили в печах особой конструкции; полученный таким образом металл имел серебристый цвет и был нержавеющим. Из этого процесса, видимо, возникло и название «руда», которое на латыни значит «мокрый» — то есть, «вымытый».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря: эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита, и обломков других пород, так что выплавляемая халибами сталь была легированной, и обладала отличными свойствами. Такой своеобразный способ получения железа не из руды говорит о том, что халибы, в основном, распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Судя по греческому названию инструментальных металлов χαλκός (это слово обозначает и бронзу, и железо), можно понять, что арийские племена нашли способ выделки железа во время перехода в Азию через Кавказ, а именно — в Колхиде (др.-греч. Κολχίς), так как другого удобного сухопутного пути из Европы в Азию не было. Пройдя степи Причерноморья, они оставили многочисленные памятники культуры бронзового века (так называемая «пахотно-скотоводческая культура»), и двинулись дальше — на юг. Конечно же, по пути они искали сырьё для изготовления бронзовых орудий, и так обнаружили свойства причерноморских песков, дающих новый твёрдый металл — железо. Видимо, сперва они приняли его за олово (первые металлурги плохо различали металлы), и это подтверждается также тем, что название «сталь» в языках северных арийцев (романских, германских, славянских) явно происходит от слова «STANN» через аберрацию N-L, а у римлян это слово обозначало олово. То есть, пытаясь найти олово для бронзы, они обнаружили металл, который оказался крепким и без сплавления с медью, и стали называть его по аналогии с оловом. Найденный тогда способ выплавки стальных изделий не позволял получать их в больших количествах, однако использовался более тысячи лет, пока не была разработана технология выплавки железа из руды, добываемой в копях.
То есть, пытаясь найти олово для бронзы, они обнаружили металл, который оказался крепким и без сплавления с медью, и стали называть его по аналогии с оловом. Найденный тогда способ выплавки стальных изделий не позволял получать их в больших количествах, однако использовался более тысячи лет, пока не была разработана технология выплавки железа из руды, добываемой в копях.
Климент Александрийский в своём энциклопедическом труде «Строматы» упоминает, что по греческим преданиям железо (видимо, выплавка его из руды) было открыто на горе Иде — так называлась горная цепь возле Трои (в Илиаде она упоминается как гора Ида, с которой Зевс наблюдал за битвой греков с троянцами). Произошло это через 73 года после Девкалионова потопа, а этот потоп, согласно Паросской хронике, был в 1528 году до нашей эры, то есть метод выплавки железа из руды был открыт примерно в 1455 году до н. э. Однако из описания Климента не ясно, говорит ли он именно об этой горе в Передней Азии (Ида Фригийская у Вергилия), или же о горе Ида на острове Крит, о которой римский поэт Вергилий в Энеиде пишет:
Остров Юпитера, Крета, лежит средь широкого моря,
Нашего племени там колыбель, где высится Ида …
А римляне, как известно, были потомками малоазиатских троянцев, переселившихся в Италию после разрушения Трои. Могила их предводителя Энея до сих пор существует в местечке Пратика-ди-Маре возле Рима, и в ней был обнаружен железный жезл — символ власти, и другие предметы из железа и бронзы.
Могила их предводителя Энея до сих пор существует в местечке Пратика-ди-Маре возле Рима, и в ней был обнаружен железный жезл — символ власти, и другие предметы из железа и бронзы.
Более вероятно, что Климент Александрийский говорит именно о фригийской Иде возле Трои, так как там были найдены древние железные копи и очаги железоделательного производства. Видимо, ознакомившись с методом халибов, древние троянцы развили свой способ выплавки стали из руды, оказавшийся более производительным.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога. В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона и его тестя — царя Хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя. Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты железные месторождения и рудники. Так на смену «Бронзовому» веку настал век «Железный».
В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона и его тестя — царя Хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя. Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты железные месторождения и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полоненых. И пир уготовлен веселый…
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах — от древнего «Horn» — рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. И хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими, чем бронзовые.
Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. И хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 градусов, а чистое железо плавится при 1535 градусах). При этом образуется чугун с температурой плавления 1100—1200 градусов, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке), и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторном прожигании в печи с усиленным продуванием воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторном прожигании в печи с усиленным продуванием воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Происхождение названия
Схема атома железа (условно)
Версии происхождения славянского слова «железо» (белор. жалеза, болг. желязо, укр. залізо, польск. Żelazo, словен. Železo).
Наиболее вероятно, что это название происходит от древнеарийского корня «ZIL», которым обозначали олово и вообще белые металлы (в том числе серебро — «zilber», и название «цинк» получилось из этого же слова аберрацией L-N). От него же, видимо, происходит и санскритское «жальжа», что означает «металл, руда». Другая версия усматривает в слове славянский корень «лез», тот же, что и в слове «лезвие» (так как железо в основном употреблялось на изготовление оружия), третье связывает с греческим словом χαλκός, что означало железо и медь. Есть также связь между словом «желе» и студнеобразной консистенцией «болотной руды», из которой некоторое время добывался металл.
От него же, видимо, происходит и санскритское «жальжа», что означает «металл, руда». Другая версия усматривает в слове славянский корень «лез», тот же, что и в слове «лезвие» (так как железо в основном употреблялось на изготовление оружия), третье связывает с греческим словом χαλκός, что означало железо и медь. Есть также связь между словом «желе» и студнеобразной консистенцией «болотной руды», из которой некоторое время добывался металл.
Название природного карбоната железа (сидерита) происходит от sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Изотопы железа
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут уменьшить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы уменьшить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд, а все последующие элементы могут образоваться только в результате взрывов сверхновых.
Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд, а все последующие элементы могут образоваться только в результате взрывов сверхновых.
Геохимия железа
Гидротермальный источник с железистой водой. Окислы железа окрашивают воду в бурый цвет
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %.
Геохимические свойства железа
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O), а также шпатовый железняк (сидерит, карбонат железа(II), FeCO3; содержит около 48 % Fe). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe(3PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде — 1×10−5—1×10−8 %.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (Fe3O4).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха:
2C + O2 → 2CO↑.

В свою очередь, угарный газ восстанавливает железо из руды:
3CO + Fe2O3 → 2Fe + 3CO2↑.
Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
CaCO3 → CaO + CO2↑.
Оксид кальция соединяется с диоксидом кремния, образуя шлак:
CaO + SiO2 → CaSiO3.
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности, и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор — обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
-
до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа) -
в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика -
в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой -
выше 1394 °C устойчив δ-Fe с объёмоцентрированной кубической решёткой
Металловедение не выделяет β-Fe как отдельную фазу[4], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
-
От абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в α-железе называется ферритом.
-
От 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой. Твёрдый раствор углерода в γ-железе называется аустенитом.
-
От 910 до 1539 °C устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой.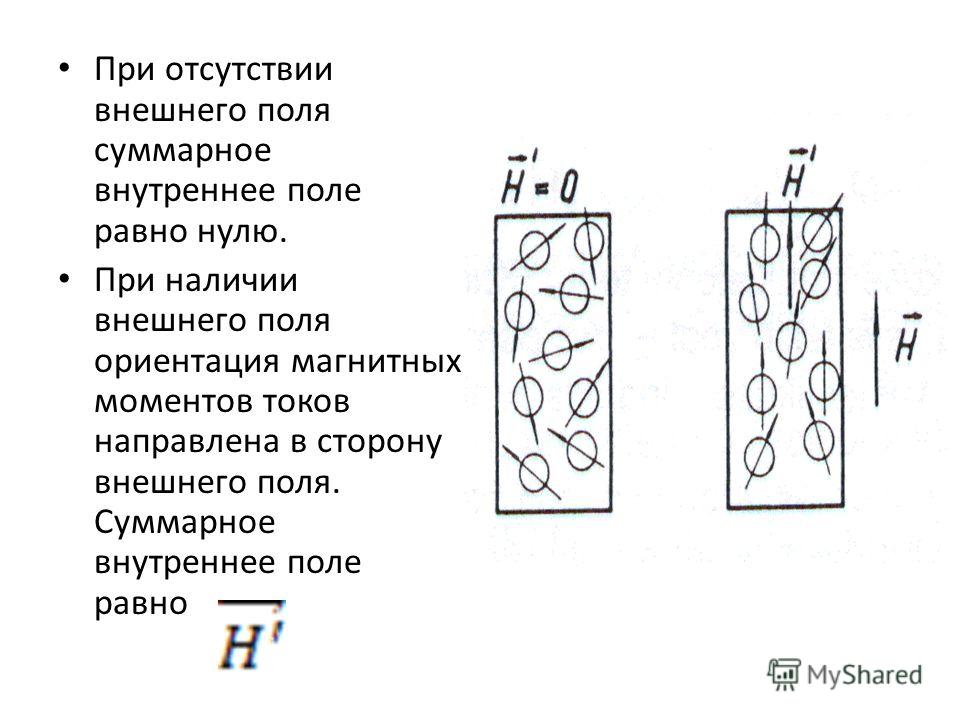 Твёрдый раствор углерода в δ-железе (также как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Твёрдый раствор углерода в δ-железе (также как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо — углерод).
-
В области высоких давлений (свыше 104 МПа, 100 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
Основные степени окисления железа — +2 и +3.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3O4, при сгорании в чистом кислороде — оксид Fe2O3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200—300 °C. При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12.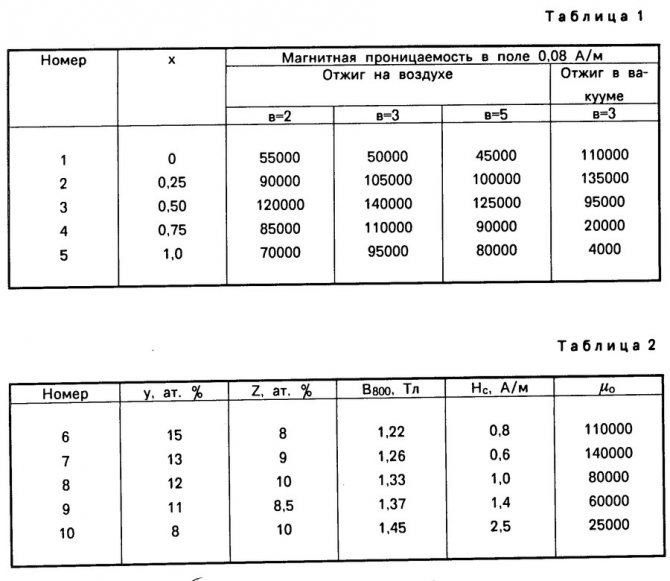 Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная плёнка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 → 3FeCl2.
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа(III) образуются соединения железа(VI) — ферраты, например, феррат(VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа(VIII).
Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN—. При взаимодействии ионов Fe3+ с анионами SCN— образуется ярко-красный роданид железа Fe(SCN)3.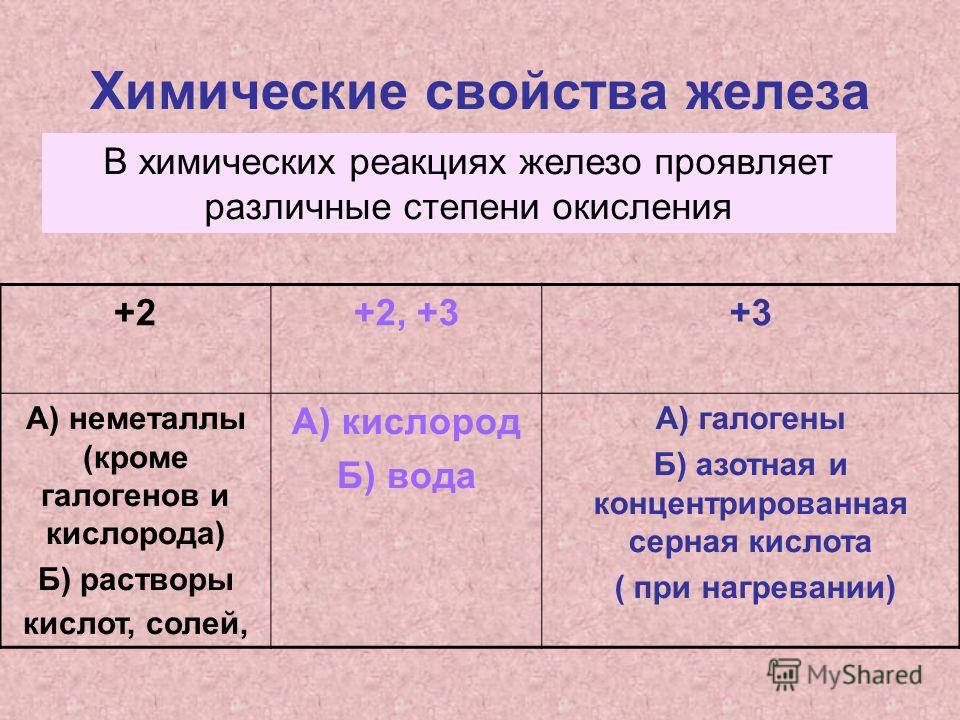 Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+.
Интересно, что берлинская лазурь и турнбулева синь — две формы одного и того же вещества, так как в растворе устанавливается равновесие:
KFeIII[FeII(CN)6] ↔ KFeII[FeIII(CN)6].
Применение
Железная руда
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
-
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 75 % являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Неорганические соединения железа встречается в некоторых бактериях, иногда используется ими для связывания азота воздуха.
В организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Интересно, что некогда шпинат ошибочно был внесён в этот список (из-за опечатки в результатах анализа — был потерян «лишний» ноль после запятой).
Суточная потребность человека в железе следующая: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг. У женщин потребность несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс).
Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз). ПДК железа в воде 0,3 мг/л.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Соединения железа
Оксиды железа
Гидроксиды железа
Железнение
Железо самородное
Железо. Химия железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.
(изображение с портала vchemraznica.ru)
Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).
(изображение с портала karatto.ru)
Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.
(изображение с портала livemaster.ru)
Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO
(изображение с портала 900igr. net)
net)
2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).
Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2. 2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц. ) → NO2 + Fe(NO3)3 + 2H2O
) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц. ) → NO2↑ + 3Fe(NO3)3 + 5H2O
) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см.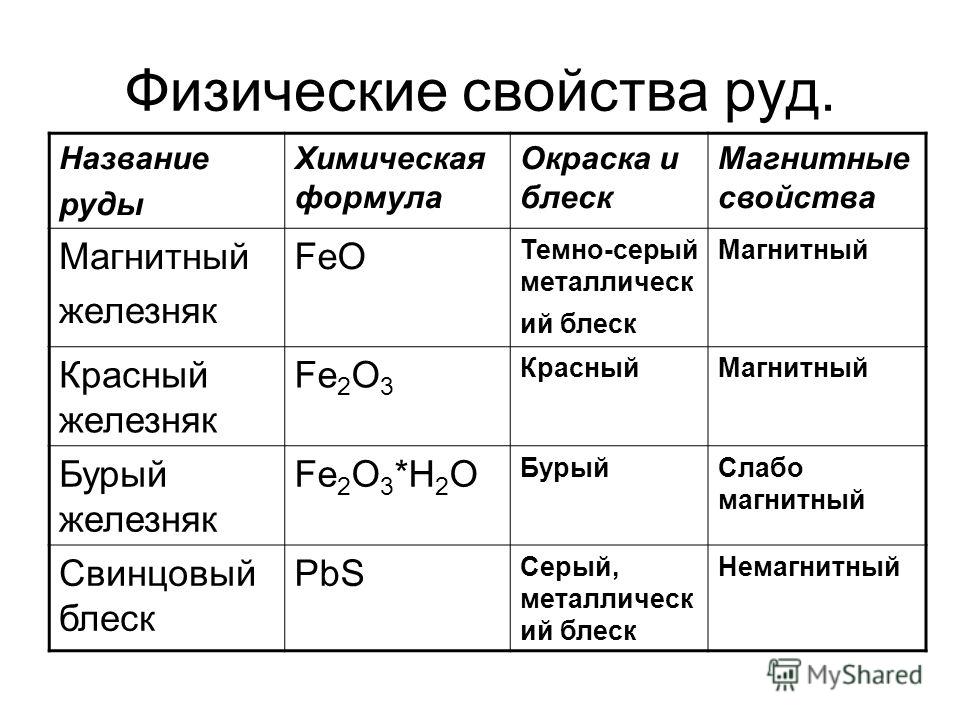 выше).
выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями.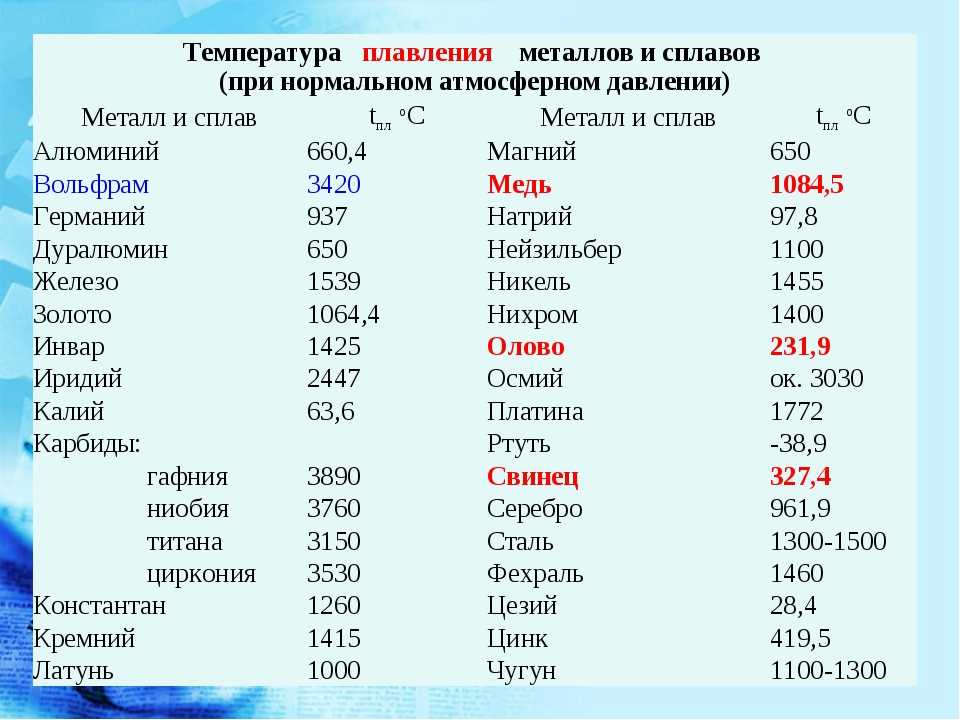 При этом образуются соединения железа (III).
При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.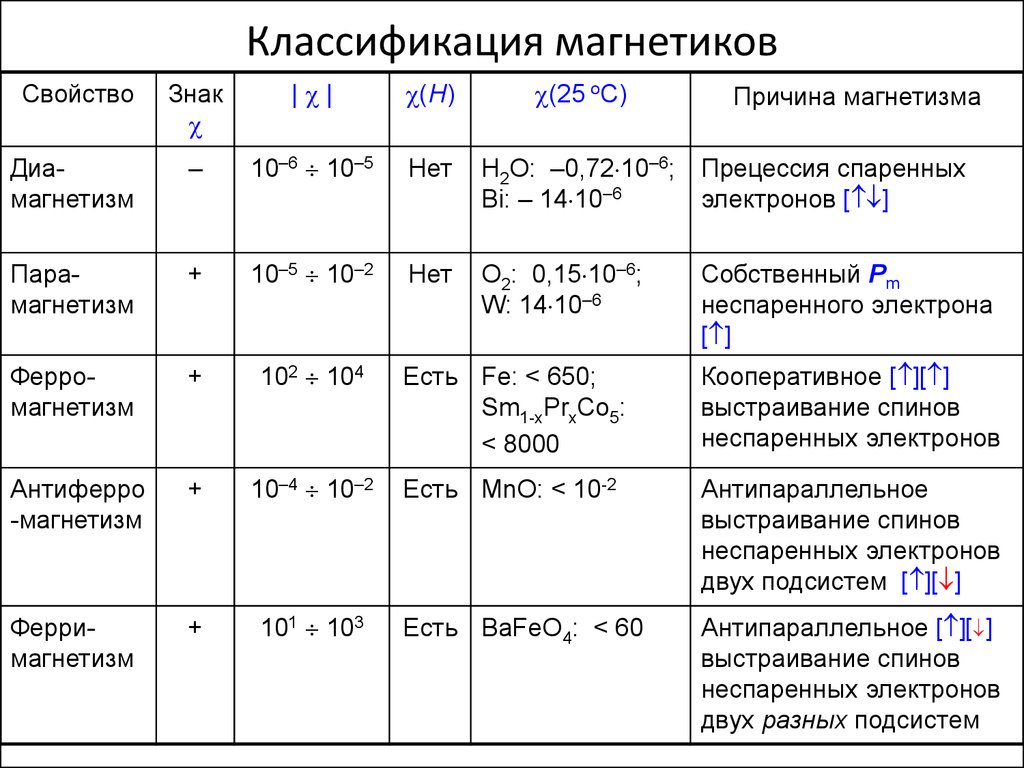
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Понравилось это:
Нравится Загрузка. ..
..
Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
+6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит
Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 —
происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3
Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
реагирует с кислотами, кислотными оксидами.
CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.
Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
К ним относятся оксид хрома (III) гидроксид хрома (III).
Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
Хроматы окрашивают
раствор в желтый цвет, а дихроматы — в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» :)
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi
Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа +3 до +2.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II)
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Соединения меди (I) можно получить путем восстановления соединений меди (II).
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди (I) окисляется кислородом до оксида меди (II).
Cu2O + O2 = (t) CuO
Оксид меди (I) вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.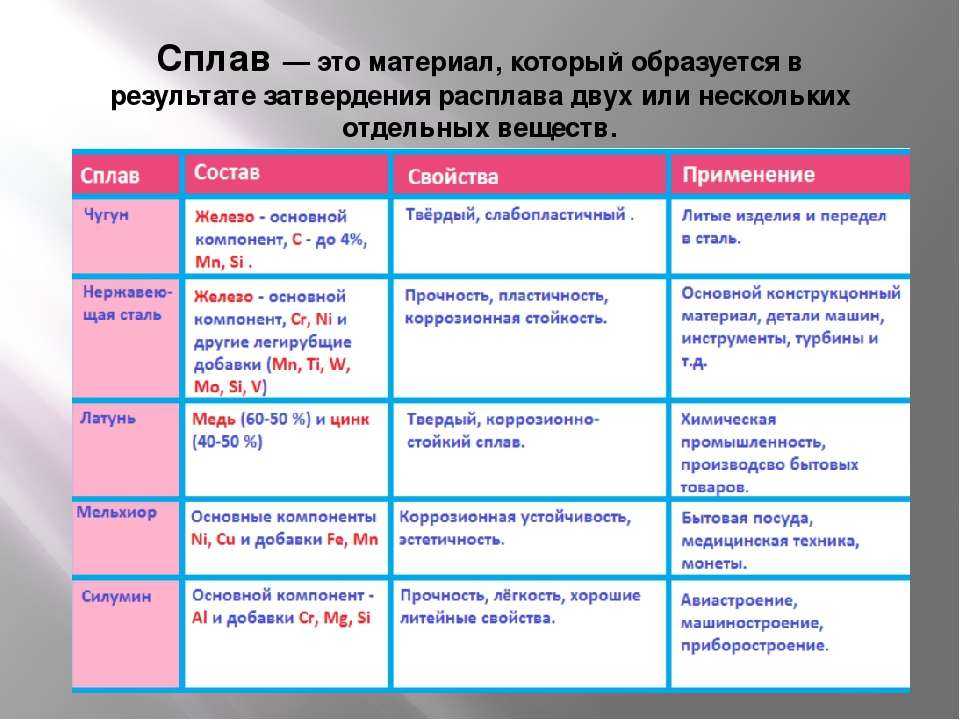
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Железо и его соединения
Учитель
химии Уразгельдиева Айымгул Мадиевна
ОСШ
имени Жангирхана, Бокейординского района, ЗКО
Урок химии на тему «Железо и его соединения».
Дата: 03 март 2017
год Класс: 10
В класс
Образовательная цель: обеспечить
усвоение знаний о важнейших соединениях железа +2 и +3, качественных реакциях
на ионы железа +2 и +3, биологической роли железа, используя опорные знания о
строении железа, демонстрацию занимательных опытов, лабораторную работу,
сообщения учащихся, мультимедийное приложение.
Задачи:
- Продолжить
формировать умения составлять схемы строения атома, электронную формулу,
графическую формулу; на основе этого определять степени окисления,
окислитель, восстановитель. - Систематизировать
знания о характере оксидов и гидроксидов со степенями окисления +2 и +3 на
примере оксидов и гидроксидов железа +2 и +3. - Формировать
умения сравнивать свойства важнейших соединений железа(II) и железа(III),
научиться определять с помощью качественных реакций соединения, содержащие
ионы Fe2+, Fe3+ - Совершенствовать
умения школьников из предложенных формул составлять генетические ряды,
осуществлять цепочки превращений, составлять уравнения химических реакций.
- Совершенствовать
навыки работы с реактивами при выполнении опытов, соблюдать правила по ТБ. - Раскрыть
значение железа в природе и жизни человека.
Развивающая цель:
- мыслительных
способностей: умения пользоваться опорными знаниями, умения сравнивать,
обобщать, делать выводы, объяснять ход эксперимента; - навыков
самостоятельности при работе с учебником, инструктивной картой и
реактивами; - исследовательских
навыков при исследовании свойств соединений железа(II) и железа (III) и
проведении качественных реакций; - способности
к рефлексии, коммуникативные умения.
Воспитывающая цель:
- положительной
мотивации обучения, используя привлечение учащихся к подготовке
занимательных опытов, сообщений о роли железа, лабораторной работы,
мультимедийного сопровождения; - чувство
ответственности при подготовке сообщений, выполнения домашнего задания; - правильной
самооценки.
Тип урока: Комбинированный. Сообщение
новых знаний и их совершенствование.
Вид урока: Лабораторный.
Оборудование: Периодическая система
химических элементов Д. И. Менделеева, таблица растворимости веществ, таблица
“Генетические ряды неорганических веществ”, инструктивные карты к лабораторной
работе, тесты, презентация “Соединения железа”, Коллекция минералов: красный
железняк, бурый железняк, магнитный железняк, железный колчедан.
Реактивы:
На столах учащихся:
растворы: FeCI2, FeCI3, KSCN, желтая
кровяная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6],
NaOH, соли: FeSO4•7H2O, FeCI3, Fe2(SO4)3•9H2O
Для занимательного опыта: скальпель,
вата, пинцет, растворы: FeCI3 растворы: FeCI3, KSCN,
желтая кровяная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6],
нашатырный спирт.
Проверка домашнего задания. Важнейшие d— элементы. Медь. Цинк. Хром.
Учащиеся делятся на три
группы А, В, С, которые заранее получают задания по соответствующим темам для
подготовки рассказов, сообщений, стихотворений, геологических карт,
дополнительного материала по данной теме.
Оформление доски.
Доска разделена на три части в соответствии с маршрутами:
А — медь; В — цинк; С — хром. Указаны
этапы маршрутов с заданиями, проверка которых осуществляется у доски. Также
используем презентацию, в которой указаны все этапы маршрутов с заданиями.
Этап I. Собери рюкзак, с геологическим молотком
за открытиями
Предварительно учитель рассказывает немного о положении металлов
в периодической системе химических элементов.
Далее учитель предлагает учащимся устно рассказать о положении
меди, цинка, хрома в периодической системе химических элементов.
Пример ответа группы А – медь: Медь
— элемент побочной подгруппы I группы. Относится к d —
элементам. На последнем энергетическом уровне атома находится 1 e. Радиус у
атома меди меньше радиуса атомов металлов главной подгруппы. Это малоактивный
металл. С кислородом образует оксид меди (II), в котором проявляет степень
окисления +2, и оксид меди (I), в котором проявляет степень окисления +1.
Оксиды и гидроксиды меди носят основной характер.
+ 29Cu 1S2/2S22p6/3S2 3p63d10/4S1 т.к.
в атомах меди десятый d — электрон поместился на третий d-подуровень в
результате “провала” с четвертого s-подуровня, то этот электрон подвижный.
Поэтому медь в соединениях проявляет степени окисления +1 (например, Сu2О)
и +2 (например, СuО).
Медь – блестящий металл светло-розового
цвета, тягучий, вязкий , легко прокатывается. Т.плавления 1083°С,
Плотность 8,9 г/см3.
Отличный проводник электрического тока (уступает только серебру).
Пример ответа группы В –
цинк: Цинк
– элемент
побочной группы ІІ группы. Относится к d — элементам.
В атоме цинка последний d –подуровень
полностью завершен и энергетически устойчив, поэтому цинк в химических реакциях
может отдавать только два s-электрона
с последнего уровня, проявляя степень окисления +2.
+ 30Zn
1S2/2S22p6/3S2 3p63d10/4S2
Физические свойства. Голубовато-серебристый металл. Т. плавл.
419,5°; т. кип. 906,2°; плотн. 7,14; давл. паров 0,0013 мм рт. ст. (300).
Растворяется в кислотах и щелочах. Нижний предел взрывоопасной концентрации
цинковой пыли в воздухе .
Пример ответа группы В –
хром: Хром – это белый с
голубоватым отливом блестящий металл, очень твердый (плотность 7, 2 г/см3),
температура плавления 1890
Хром при обычных
условиях неактивный металл. Это объясняется тем, что его поверхность покрыта
Это объясняется тем, что его поверхность покрыта
оксидной пленкой (Сr2О3). При нагревании оксидная пленка
разрушается, и хром реагирует с простыми веществами при высокой температуре
хром | …3s23p63d54s1 | +2,+3,+6 |
Говорит учитель: “Итак, мы выполнили с
вами поставленную задачу — т. е. рассмотрели положение металлов в периодической
системе химических элементов, таким образом, рюкзак нами собран”
Этап II.
Вызываем к доске представителей от каждой группы, которые берут
конверты с тестовыми заданиями, которые соответствуют названию каждой группы.
Число тестовых заданий в конверте соответствует числу учащихся в каждой группе.
Представители, получившие конверты, раздают тестовые задания
всем членам своей группы, которые по мере готовности отвечают на вопросы,
остальные учащиеся проверяют правильность ответа.
Примерные тестовые задания, находящиеся в конвертах для группы А
– медь:
1. Какие
физические свойства характеризуют медь:
А)
Металл светло-розового цвета, тягучий, вязкий, легко прокатывается в листы. (+)
Б)
Серебристо-белый металл. В)
Металл голубовато-серебристого цвета.
2. Выберите
свойства, которые характерны для меди:
А)
Отличный проводник электрического тока (уступает только серебру). (+)
Б)
При температуре 100-150С хорошо прокатывается в листы. Выше 200С становится
очень хрупким.
В)
Сравнительно легкий, немного тяжелее алюминия, но в три раза прочнее его.
3. Какова
температура плавления меди?
А)
Температура плавления 1890С. Б)
Температура плавления 1083С. (+)
В)
Тугоплавкий металл, температура плавления1665°С, в обычных условиях отличается
высокой прочностью и вязкостью.
4. С
каким из перечисленных веществ будет реагировать медь?
А)
H2S04 конц. (+) Б)
(+) Б)
Cl2 (+) В)
NaOH Г) H2O Д)
O2 (+) Е)
HNO3 конц. (+)
5. Какими
двумя веществами, из перечисленных, вы воспользовались бы для получения меди?
А)
O2 (+) Г)
HNO3 Б) Fe Д)
Сu2S (+) В) Al Е)
SO2
6. Каким
соединением меди определяют альдегидную группу в органических соединениях?
А)
СuCl2 Б) СuO В)
Сu(OH)2 (+)
Примерные тестовые задания, находящиеся в конвертах для группы В
– цинк:
1.
Какие физические свойства характеризуют цинк?
А)
Металл голубовато-серебристого цвета.
Б)
Металл серебристо-белого цвета с металлическим блеском по внешнему виду похожий
на сталь.
В)
Металл светло-розового цвета, тягучий, вязкий, легко прокатывается в листы.
2.
Выберите свойства, которые характерны для цинка:
А)
Отличный проводник электрического тока (уступает только серебру).
Б)
При температуре 100-150°С хорошо прокатывается в листы. Выше 200°С становится
очень хрупким.
В)
Сравнительно легкий, немного тяжелее алюминия, но в три раза прочнее его.
3.
Какова температура плавления цинка?
А)
Температура плавления 1890С. Б) Температура плавления 419,5С.
В)
Тугоплавкий металл, температура 1665С, в обычных условиях отличается высокой
прочностью и вязкостью.
4.С
какими из перечисленных веществ будет реагировать цинк?
А)
NаOH Б) О2 В) S Г) H2O
Д) CuСl2 Е) NаOH+H20
5.
Какими двумя веществами вы воспользовались бы для получения цинка?
А)
H2SO4 Б) MgO В) С Г) NaOH Д) O2 Е)
H2S
6.
Какие соединения цинка обладают амфотерными свойствами?
А)
ZnO Б) Na2ZnO2
В) Zn(OH)2
Примерные тестовые задания, находящиеся в конвертах для группы В
– цинк:
1.
Какие физические свойства характеризуют хром?
А)
Металл светло-розового цвета, тягучий, вязкий, легко прокатывается в листы.
Б)
Металл серебристо-белого цвета с металлическим блеском по внешнему виду похожий
на сталь.
В)
Металл голубовато-серебристого цвета.
2.
Выберите свойства, которые характерны для хрома:
А)
Отличный проводник электрического тока (уступает только серебру).
Б)
При температуре 100-150°С хорошо прокатывается в листы. Выше 200°С становится
очень хрупким.
В)
При комнатной температуре стоек и к воде и к воздуху. Разбавленная серная и
соляная кислота растворяют металл с выделением водорода.
3.
Какова температура плавления хрома?
А)
Температура плавления 1890°С. Б) Температура плавления 1083°С.
Б) Температура плавления 1083°С.
В)
Плавится при температуре 419,5°С.
4.С
какими из перечисленных веществ будет реагировать хром?
А)
N2 Б)
H2SO4
В) HNO3 Г)
Сl2 Д) NaOH
Е) HСl
5.
Какими двумя веществами из перечисленных вы воспользовались бы для получения
хрома?
А)
O2 Б) H2SO4
В) Al Г) С Д) NО2
Е) NaOH
6.
Какие соединения хрома обладают амфотерными свойствами?
А)
СrO3 Б) Cr2O3 В) H2CrO4
Г) Cr(OH)3 Д) СrO E)
Сг(OH)2
И так мы повторили домашнее задание, теперь
хочу загадать вам загадку. Давайте послушаем.
Давайте послушаем.
Ход урока
1. Организационный момент.
Среди металлов самый славный
Важнейший древний элемент.
В тяжелой индустрии – главный
Знаком с ним школьник и студент.
Родился в огненной стихии
А сплав его течет рекой.
Важнее нет в металлургии
Он нужен всей стране родной.
О каком металле идет речь?
(Это железо.)
Учитель: Сегодня на уроке мы
продолжим изучение металла 8 группы, побочной подгруппы Fe и рассмотрим его
соединения.
2. Проверка знаний (индивидуальный опрос).
Цель: повторение изученного
материала, необходимого для открытия “нового знания” и выявления затруднений в
работе учащихся.
1-й ученик. Написать на доске
схему строения атома железа, электронную и графическую формулы. Какие степени
окисления может проявлять железо? Окислитель или восстановитель?
Проверка: (Презентация.
Слайд 8)
2-й ученик.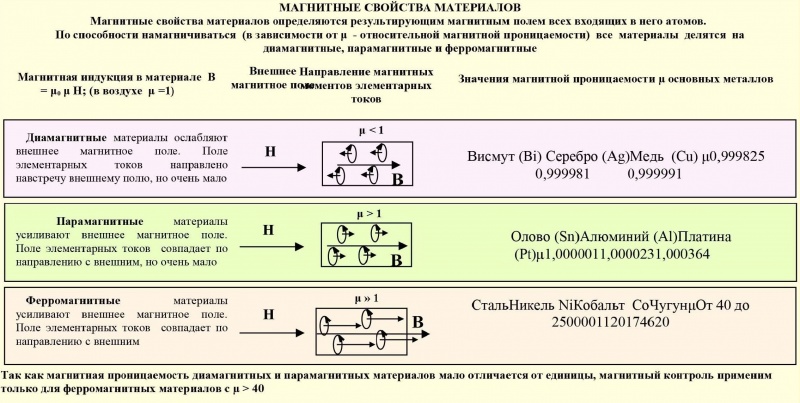 Написать на доске уравнения
Написать на доске уравнения
реакций взаимодействия железа с простыми веществами: хлором, серой, кислородом.
Расставить степени окисления, уравнять методом электронного баланса.
Проверка (Слайд 18-19)
Fe + S→ Fe S
3Fe
+ 2O2→
Fe3O4
2Fe
+3СI₂ → 2FeCI₃
3-й ученик. Написать уравнения реакций
взаимодействия железа со сложными веществами: с растворами кислот, солей, водой
при нагревании. Для одной из реакций ионного обмена написать полное и
сокращенное ионное уравнение. (Слайд 20-21)
Fe +
2HCI → FeCI₂ + H₂
Fe + H₂SO₄
→ FeSO₄ + H₂
Fe +
CuCl2→ Cu + FeCl2
3Fe+
4H2O
(пар) → Fe₃O₄
+ 4H2
4-й ученик. Рассказать о распространенности
Рассказать о распространенности
железа в земной коре. Среди предложенных образцов выбрать важнейшие руды железа
и назвать их.
Учитель: Железо дает два ряда
соединений, соответствующих степени окисления +2, +3. Степень окисления Fe
зависит от окислительной способности реагирующего вещества. У сильных
окислителей железо принимает степень окисления +3, у более слабых +2.
Ученики записывают схему в тетрадь. (Слайд 22)
4. Актуализация знаний
Цель: на основе имеющихся знаний о металлах подготовить учащихся
к восприятию новых знаний о соединениях железа.
5. Формирование знаний о получении гидроксидов железа и
качественных реакциях на ионы Fe2+, Fe3+.
Учитель: Как можно получить
гидроксиды железа в лаборатории?
Предполагаемый ответ: нерастворимые
основания можно получить при взаимодействии раствора соответствующей соли со
щелочью.
Лабораторный опыт 1. Получение гидроксида железа(II) и
Получение гидроксида железа(II) и
гидроксида железа(III) (Приложение
1)
(Выполняют по инструкции в парах.)
Получить гидроксиды железа в лаборатории можно
взаимодействием солей железа со щелочью.
а) Налейте в пробирку 1 мл раствора хлорид железа(II). Добавьте
к нему по каплям раствор гидроксида натрия до появления явных признаков
химической реакции. Отметьте цвет образовавшегося осадка. Записать
уравнения реакций.
б) К хлориду железа(III) прилейте
по каплям раствор гидроксида натрия до появления явных признаков химической
реакции. Отметьте цвет образовавшегося осадка.
Что наблюдаете? Записать уравнения реакции.
Слайд 6 – уравнение реакций (самопроверка)
FeCI2 + 2NaOH = Fe(OH)2↓ | FeCI3 + 3NaOH = Fe(OH)3↓ |
Вывод: Это один из способов распознавания соединений железа с
различной степенью окисления, качественные реакции на ионы Fe2+ Fe3+.
Fe(OH)2 окисляется на воздухе: сначала зеленеет,
потом приобретает бурую окраску.
(Демонстрация разрезанного яблока и пробирки с Fe(OH)2,
на стенках которой видно как осадок становится бурого цвета.)
4Fe(OH)2 + 2H2O + O2 =
4Fe(OH)3 (Слайд 8)
Лабораторный опыт 2. (Приложение
1) Качественная реакция на ион Fe3+
1. Реактив – роданид калия KSCN.
К раствору хлорида железа(III) добавить одну каплю раствора
роданида калия (KSCN). Перемешайте содержимое пробирки и рассмотрите на свету.
Отметьте цвет.
Результат воздействия – интенсивно красный цвет
FeCl3 + 3KSCN = Fe (SCN)3 +
3KCl.
2. Реактив – желтая
кровяная соль K4 [Fe(CN)6]
г) К раствору хлорида железа(III) Во 2-ю пробирку добавьте 1–2
капли раствора гексацианоферрата(II) калия K4[Fe(CN)6]
(желтой кровяной соли). Перемешайте содержимое пробирки, отметьте цвет.
Перемешайте содержимое пробирки, отметьте цвет.
Результат воздействия –
синий осадок берлинской лазури.
K4 [Fe(CN)6] + FeCI3 =
3KCI + KFe[Fe(CN)6]
Лабораторный опыт 3. Качественная
реакция на ион Fe2+.
Реактив – красная кровяная
соль K3[Fe(CN)6].
Налейте в пробирку 1 мл раствора хлорида железа(II). Добавьте к
нему по каплям раствор осадка.гексацианоферрата(III) калия K3[Fe(CN)6]
(красной кровяной соли). Отметьте цвет осадка.
Результат воздействия – синий осадок (турнбулевой сини)
FeCI2 + K3[Fe(CN)6] =
2КCI + KFe[Fe(CN)6]↓
Вывод:
- Реактивами на ионы Fe2+ являются щелочи
и красная кровяная соль K3[Fe(CN)6].
- Реактивами на ионы Fe3+ являются щелочи,
роданид калия и желтая кровяная соль K4[Fe(CN)6].
Учащиеся записывают уравнения качественных реакций в тетради и
выводы.
6. Первичное закрепление знаний. (Работа по цепочке.)
- Перечислите,
какие соединения образует железо со степенью окисления +2. - Каков
характер оксида и гидроксида железа(II)? - Перечислите
формулы соединений железа со степенью окисления +3. - Каков
характер оксида и гидроксида железа(III)? - Как
можно получить гидроксиды железа? - По
каким признакам можно распознать осадки гидроксида железа(II) и гидроксида
железа(III)? - При
помощи каких качественных реакций можно распознать соли железа(II) и соли
железа(III)?
9. Формирование знаний о соединениях железа, имеющих
наибольшее практическое значение.
(Самостоятельная работа с учебником и образцами минералов.)
Задания для самостоятельной работы
- Рассмотреть образцы выданных вам минералов, отметить их агрегатное
состояние, цвет. - Выписать в тетради формулы, название этих соединений, их
практическое значение.
Формула вещества | Название вещества | Практическое значение | |
Систематическое | техническое | ||
FeSO4•7H2O | кристаллогидрат сульфата железа(II) | железный купорос | Для борьбы с вредителями растений, для приготовления |
FeCI3 | хлорид железа(III) | При очистке воды, в качестве протравы при крашении тканей | |
Fe2(SO4)3•9H2O | кристаллогидрат сульфата железа(III) | При очистке воды, в качестве растворителя в гидрометаллургии и | |
10. Первичное закрепление.
Первичное закрепление.
Ребята, давайте еще раз повторим, что мы сегодня изучили.
Формы и способы организации учебной деятельности (по “цепочке”
учащиеся повторяют все вопросы этого урока, используя слайды презентации
учителя,)
Выявление возможных затруднений и способы их коррекции.
11. Контроль знаний. Тест.
Тест
по теме:
1. Металл,
реагирующий с серной кислотой при обычных условиях :
А)
серебро; б) медь; в) железо; г) ртуть.
2. Металл,
взаимодействующий с водой при обычных условиях:
А)
натрий; б) медь; в) железо; г) ртуть .
3. Возможные
степени окисления атома железа:
А) +2;
б) +2, +3; в) 0, +2, +3, +6.
4. Вещество,
в котором степень окисления железа +3:
А)
NaFeO2 б) FeO3
в) FeCl2 г) FeCO3 .
5. Пластинка,
вытесняющая медь из раствора ее солей:
А)
железная б) серебряная в) золотая .
6. Среда,
в которой коррозия железа идет наиболее быстро:
А)
вода; б) воздух; в) влажный воздух.
7. Характер
оксида железа (II) :
А)
кислотный; б) основный; в) амфотерный.
8. Характер
оксида железа (III) :
А)
кислотный; б) основный; в) амфотерный.
9. Укажите
вещество, взаимодействующее с железом:
А)
кислород; б) сероводород; в) углекислый газ.
10.
Укажите вещество, взаимодействующее с оксидом железа (III)
А)
кислород; б) вода; в) серная кислота.
11.
Укажите металл, более активный, чем железо:
А)
кальций; б) медь; в) олово.
12.
Осуществить превращение FeCl3 → Fe(OH)3
можно с помощью:
А)
кислоты; б) воды; в) щелочи.
12.
Установите соответствие:
Тип
реакции
Исходные вещества
1)
соединения
а) Fe(OH)3 →
2)
разложения
б)
Fe + H2SO4 →
3)
замещения
в)
Fe + ZnSO4 →
4)
обмена
г) Fe(OH)3 + NaOH →
д) Fe + Cl2 →
е) Fe + O2 →
13.
Установите соответствие:
Исходные
вещества
Продукты реакции
1) Fe
+ H2SO4 →
а)
Fe(OH)3 + NaCl
2) Fe
+ Cl2 →
б) Fe(OH)2 + NaCl
3) Fe
+ HCl →
в) FeCl2
4)
FeCl2 + NaOH →
г)
FeCl2 +H2
д)
FeCl3
е)
FeSO4 + H2
Задача: На
сколько граммов увеличится масса железной пластинки, опущенной в раствор СuS04,
если при этом на пластинке оказалось 20,8 г металлической меди?
Х г —
20,8 г
56 г —
64 г
Х =
18,2 г железа растворилось => m (Fе) увеличилась на 20,8 г-18,2 г = 2,6 г
ОТВЕТ
: 2, 6 г.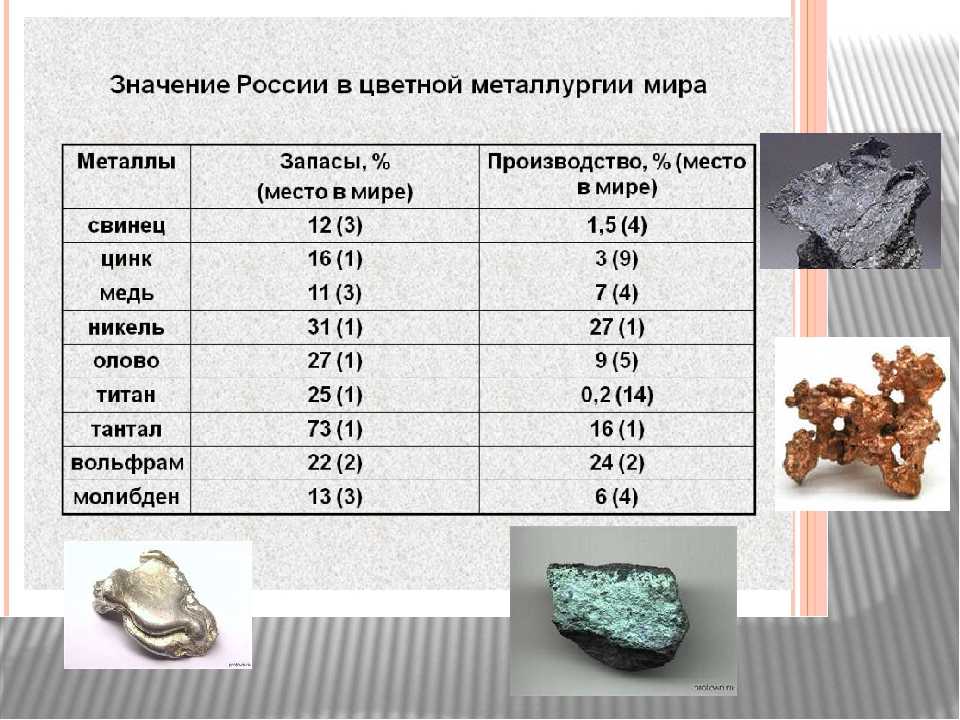
12. Подведение итогов. Выставление оценок.
Д/З. § 6.5
стр.186 упр. 7
письменно,
13. Рефлексия учебной деятельности на уроке.
- Зафиксировать
новое знание, полученное на уроке. - Оценить
собственную деятельность на уроке. - Оценить
учебную деятельность класса. - Зафиксировать
неразрешенные затруднения как направления будущей учебной деятельности. - Обсудить
и записать домашнее задание.
Литература:
- Венецкий
С. И. В мире металлов. М., 1988. - Габриелян
О. С. Химия
9 класс, М.: Дрофа, 2010 Химия – 9 с. 76–82. - Денисова
В. Г. Химия. 9 класс: поурочные планы по учебнику О. С.
Габриеляна – Волгоград: Учитель, 2009. - Книга
для чтения по неорганической химии. Под ред. В. А. Крицмана. М.,
1979. - Мезин
Н. А. Занимательно
А. Занимательно
о железе. М., Металлургия, 1977. - Пузынина
М. А. Занимательный час “Чудеса своими руками” Химия в
школе. 1991. № 5. С. 66–67.
Чистая медь, чистое железо
Чистая медьЖелезоЖелезный купоросМедный купорос
Чистая медь
Чистая медь(Cu) — металл красного цвета, имеет высокую пластичность, то есть способность деформироваться, при этом не ломаясь. Чистая медь – отличный проводник тока. По проводимости она занимает третье место после золота и серебра.
Медь отлично проводит тепло. При контакте с горячей поверхностью очень быстро нагревается, поэтому не рекомендуется её использовать для переноса горячих предметов.
Чистая медь хорошо окисляется. При длительном пребывании в воде на её поверхности образуется зеленоватый налёт, — это гидроксид меди Cu(OH)2 и карбонат меди CuCO3.
Чистая медь на воздухе быстро покрывается тонкой плёнкой тёмного оксида меди CuO, которая предохраняет её от дальнейшего разрушения. Разбавленная серная кислота и медь практически не реагируют, но концентрированная серная кислота и медь легко взаимодействуют друг с другом с образованием голубого раствора медного купороса CuSO4 (используем для напыления деревьев), ядовитого сернистого газа SO2 и воды.
Разбавленная серная кислота и медь практически не реагируют, но концентрированная серная кислота и медь легко взаимодействуют друг с другом с образованием голубого раствора медного купороса CuSO4 (используем для напыления деревьев), ядовитого сернистого газа SO2 и воды.
При нагревании меди на воздухе происходит интенсивное окисление. Изделие из меди чернеют, покрываясь слоем оксида меди (II) CuО. При нагреве медных изделий до температуры свыше 1000 °С образуется другой оксид — Cu2О.
Находясь долгое время на воздухе, чистая медь покрывается плёнкой малахита, образующегося по химической реакции
2Cu+О2+Н2О+СО2=(CuОН)2СО3. Именно этому веществу обязаны своим цветом бронзовые памятники и старые крыши городов Западной Европы.
Все соли меди ядовиты. Поэтому не рекомендуется использовать её при приготовлении или употреблении пищи.
Азотная кислота и медь реагируют постепенно: сначала чистая медь окисляется до окисла меди, а после реагирует, образуя двуокись азота (NO2), нитрат меди Cu(NO3)2 – голубоватый раствор и воду. Двуокись азота (NO2) – ещё знакомо это вещество под названием “бурый газ”.
Двуокись азота (NO2) – ещё знакомо это вещество под названием “бурый газ”.
Соляная кислота и чистая медь реагируют только при нагревании. Сначала чистая медь окисляется до оксида меди, а дальше образуется зеленоватый хлорид меди CuCl2 и вода.
С медным купоросом Вам приходилось сталкиваться и в домашних условиях: он представляет собой кристаллики синего цвета, хорошо растворимые в воде. Сама молекула медного купороса уже содержит воду (5 молекул воды соединены с 1 молекулой медного купороса). Если нагреть синие кристаллики, то вскоре мы увидим, что они теряют свою форму и цвет, превращаясь в рыхлую белую безводную массу (безводный сульфат меди CuSO4).
Медь влияет на цвет и окраску некоторых минералов, таких как малахит (от светло-голубого до тёмно-зелёного цвета), диоптаз (изумрудно-зелёный) и др.
Чистое железо
Чистое железо (Fe): серебристый металл белого цвета, проявляющий амфотерные свойства (то есть может вступать в реакцию с кислотами и щелочами). Железо — металл тяжёлый (1 м3 весит 7800 кг), имеет высокую пластичность и прочность (прочнее меди). Чистое железо — металл с содержанием чистого железа по массе около 99,995%, — практически не применяется. Говоря о железе, обычно подразумевают его сплавы с углеродом и другими элементами: до 2,14% углерода – это стали, более 2,14% – чугуны. При наличии других элементов и изменении их концентрации в железном сплаве (стали) резко меняются физико-механические свойства сплава.
Железо — металл тяжёлый (1 м3 весит 7800 кг), имеет высокую пластичность и прочность (прочнее меди). Чистое железо — металл с содержанием чистого железа по массе около 99,995%, — практически не применяется. Говоря о железе, обычно подразумевают его сплавы с углеродом и другими элементами: до 2,14% углерода – это стали, более 2,14% – чугуны. При наличии других элементов и изменении их концентрации в железном сплаве (стали) резко меняются физико-механические свойства сплава.
Если концентрация углерода в сплаве железа превысит 6,67%, то углерод вступит в химическую реакциюс железом, образовав уже не сплав, а химическое соединение — карбид железа FeC2.
Чистое железо плавится при температуре 1540°С, пластично, легко поддаётся намагничиванию. При нагревании до 768°С железо теряет свои магнитные свойства.
Чистое железо — химически активный элемент. Железо и соляная кислота легко реагирует друг с другом, образуя хлорид железа FeCl2. Чистое железо легко окисляется даже во влажном воздухе, образуя триокись железа Fe2 O3*nH2O, по-другому называемая ржавчиной. Железо и серная кислота реагирует с образованием сульфата железа Fe(SO4)2, — прозрачного зеленоватого раствора. Если оставить раствор на воздухе, то можно заметить через некоторое время образование бурого осадка,- это сульфат железа соединился с кислородом воздуха, образовав рыхлую бурую массу нового соединения железа: Fe(SO4)3
Железо и серная кислота реагирует с образованием сульфата железа Fe(SO4)2, — прозрачного зеленоватого раствора. Если оставить раствор на воздухе, то можно заметить через некоторое время образование бурого осадка,- это сульфат железа соединился с кислородом воздуха, образовав рыхлую бурую массу нового соединения железа: Fe(SO4)3
Азотная кислота и чистое железо реагируют с образованием нитрата железа Fe(NO3)2, окиси азота NO или аммиачной селитры NH4NO3 (вещество ещё известное в качестве аммиачного удобрения) и воды.
Так реагируют разбавленные кислоты с железом. Концентрированная азотная и серная кислоты на чистое железо не действуют (при комнатной температуре), благодаря наличию образующейся оксидной плёнки.
Железо легко вытесняет медь в химической реакции замещения, если в раствор медного купороса опустить металлическое изделие. Мы будем наблюдать на поверхности железа образование микроскопических кристаллов химически чистой меди красно-бурого цвета.
При этом голубой раствор медного купороса постепенно бледнеет и приобретает зеленоватый окрас, происходит образование железного купороса FeSO4x5H2O.
Но это способ не эффективен для прочного медного покрытия. Для более качественного нанесения медного покрытия используют электричество. Таким способом (реакцией замещения) можно покрыть медью любой металл, стоящий левее меди в ряду напряжений.
Но необходимо помнить, что в случае образования глубоких царапин по поверхности покрытия, могут образовываться (если система находится в электролите) гальванические элементы, что приводит к разрушению металлов.
Чистое железо придаёт окрас некоторым минералам: гематит (от серого до тёмного тона окраски), топаз (бесцветный, синий голубой, жёлтый, оранжевый).
Наиболее важными химическими соединениями железа являются:
FeSO4x5H2O — железный купорос — применяется в сельском хозяйстве как яд для борьбы с вредителями;
Fe2(SO4)3x9H2O — водный сульфат железа применяется для очистки воды;
FeCl3 — также применяется для очистки воды, а также для травления меди (электроника)
Fe(NO3)2x9H2O — водный нитрат железа — применяется в текстильной промышленности для обработки и покраски ткани
Что касается чистого железа, то оно используется, в основном, как катализатор в химических реакциях.
Определить наличие ионов железа (2-х или 3-х валентного) можно с помощью Качественной реакции
Железо образует 3 различных оксида железа, отличающихся степенью окисления железа и цветом химического соединения и его активностью.
23.5: Железная триада: железо, кобальт и никель
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24345
Железная триада состоит из трех элементов: железа (Fe), кобальта (Co) и никеля (Ni), которые имеют сходные химические и физические характеристики. Они находятся рядом друг с другом в периоде 4 периодической таблицы.
Введение
Железная триада известна наличием ферромагнитных элементов, подобных гадолинию (Gd) и неодиму (Nd). Эти типы ферромагнитных элементов обладают способностью создавать большой магнитный полюс благодаря своим неспаренным электронам. Когда один из этих элементов находится внутри среды, где температура находится на его индивидуальной точке Кюри (T c ), специфическая парамагнитная оболочка атомов разрушается под действием энергии внутри элемента, и ферромагнетизм теряется. (Т c ) для железа, кобальта и никеля составляют 768°C, 1121°C и 354°C соответственно и используются для использования этих элементов в промышленности. Кроме того, элементы триады железа обычно комбинируются с углеродом и друг с другом для создания различных типов сплавов. Именно из-за этих магнитных свойств и использования в сплавах три элемента обычно группируются вместе и обозначаются как «железная триада». Хотя эти элементы очень похожи по магнитным свойствам и реакции, они также очень уникальны и по-разному используются как в природе, так и в промышленности.
Эти типы ферромагнитных элементов обладают способностью создавать большой магнитный полюс благодаря своим неспаренным электронам. Когда один из этих элементов находится внутри среды, где температура находится на его индивидуальной точке Кюри (T c ), специфическая парамагнитная оболочка атомов разрушается под действием энергии внутри элемента, и ферромагнетизм теряется. (Т c ) для железа, кобальта и никеля составляют 768°C, 1121°C и 354°C соответственно и используются для использования этих элементов в промышленности. Кроме того, элементы триады железа обычно комбинируются с углеродом и друг с другом для создания различных типов сплавов. Именно из-за этих магнитных свойств и использования в сплавах три элемента обычно группируются вместе и обозначаются как «железная триада». Хотя эти элементы очень похожи по магнитным свойствам и реакции, они также очень уникальны и по-разному используются как в природе, так и в промышленности.
Железо
Железо (Fe) представляет собой переходный металл с атомным весом 55,845 и атомным номером 26. Его наиболее распространенная и удобная степень окисления +3 и обычно блестящего серебристого цвета. Хотя его можно найти на солнце и в звездах, он чрезвычайно распространен на планете Земля, и его содержание в земной коре составляет 4,7%. Чистая металлическая форма железа встречается редко из-за его способности легко реагировать с другими металлами и окружающей средой.
Его наиболее распространенная и удобная степень окисления +3 и обычно блестящего серебристого цвета. Хотя его можно найти на солнце и в звездах, он чрезвычайно распространен на планете Земля, и его содержание в земной коре составляет 4,7%. Чистая металлическая форма железа встречается редко из-за его способности легко реагировать с другими металлами и окружающей средой.
Железо чаще всего используется в мировой промышленности для использования в сплавах и сталях для повседневного использования, некоторые из которых даже содержат другие элементы Триады. Комбинируя такие металлы, как железо, с углеродом для получения сплавов, можно получить очень прочные материалы, которые используются для стальных корпусов, опор телевизионных трубок и других важных изделий. Чистое железо коммерчески доступно в Соединенных Штатах, и ежегодно во всем мире производится около 500 миллионов тонн железа.
С биологической точки зрения железо необходимо организмам, поскольку оно необходимо для образования гемоглобина. Людям нужен гемоглобин, так как эти красные пигменты снабжают наш организм кислородом через эритроциты. Чтобы увеличить потребление железа, следует употреблять такие продукты, как яйца, арахис и зеленые листовые овощи. Без железа наши тела не смогли бы образовывать гемоглобин, и организм не смог бы выжить.
Людям нужен гемоглобин, так как эти красные пигменты снабжают наш организм кислородом через эритроциты. Чтобы увеличить потребление железа, следует употреблять такие продукты, как яйца, арахис и зеленые листовые овощи. Без железа наши тела не смогли бы образовывать гемоглобин, и организм не смог бы выжить.
Кобальт
Кобальт (Co) представляет собой переходный металл с атомным весом 58,93 и атомный номер 27, прямо между железом и никелем. Однако кобальт не так распространен, как железо, и составляет всего около 0,0020% земной коры. Это делает кобальт немного более редким и ценным, чем другие члены триады, потому что он все еще широко используется в международной промышленности. Именно по этой причине этот твердый серый элемент добывается и продается по всему миру.
Как и железо, этот элемент обычно смешивают с другими металлами для создания сплавов. Суперсплавы, содержащие кобальт, используются для деталей газотурбинных двигателей, которые приносят пользу как коммерческим, так и военным устройствам. Однако в настоящее время появление перезаряжаемых батарей привело к тому, что спрос на этот элемент поднялся на новую высоту, поскольку он обычно используется для электродов в этой относительно новой технологии. Хотя это его самые популярные применения, кобальт также используется в производстве нефти, красителей, магнитов и электроники из-за его ферромагнитных свойств.
Однако в настоящее время появление перезаряжаемых батарей привело к тому, что спрос на этот элемент поднялся на новую высоту, поскольку он обычно используется для электродов в этой относительно новой технологии. Хотя это его самые популярные применения, кобальт также используется в производстве нефти, красителей, магнитов и электроники из-за его ферромагнитных свойств.
Кобальт и его сплавы недавно добились больших успехов в биомедицинской сфере, играя большую роль в неврологических, стоматологических, ортопедических и сердечно-сосудистых имплантатах. Это связано с тем, что сплавы обладают хорошей коррозионной стойкостью, механическими свойствами и биосовместимостью.
Никель
Никель (Ni), переходный металл с атомным весом 58,69 и атомным номером 28, обычно узнаваем по серебристому блеску с оттенком золота. Впервые он был обнаружен Акселем Фредриком Кронштедтом в 1751 году и назвал никель из руды «купферникель». Хотя никель не очень распространен, он по-прежнему занимает 24-е место в списке самых распространенных элементов на Земле.
Этот элемент наиболее распространен в Канаде, и ежегодно в Америке используется около 300 миллионов фунтов. Никель чаще всего используется в качестве ключевого ингредиента в низколегированных сталях, нержавеющих сталях и чугунах. Фактически, четыре из пяти из этих 300 миллионов фунтов никеля идут на изготовление этого типа сплава. Как и кобальт, он обладает уникальными характеристиками коррозионной стойкости и идеально подходит для коррозионностойких и жаростойких покрытий, магнитных сплавов и сплавов с контролируемым расширением.
Более 2000 лет назад бактрийская цивилизация в Западной Азии использовала для своих монет сплав меди и никеля 75:25. Современный американский никель имеет тот же состав, но современный канадский никель представляет собой никелированную сталь и содержит всего 2,5% никеля по массе.
Новые никель-кадмиевые перезаряжаемые аккумуляторы также позволили взглянуть на использование никеля по-новому. Как и в случае с кобальтом, начало нового тысячелетия и более широкое использование перезаряжаемых батарей предоставили никелю новое широкое применение, которое, вероятно, превзойдет другие в будущем. Никель-кадмиевые аккумуляторы улучшили работу беспроводных электроинструментов, портативных компьютеров и других портативных электронных устройств.
Никель-кадмиевые аккумуляторы улучшили работу беспроводных электроинструментов, портативных компьютеров и других портативных электронных устройств.
Железо | Кобальт | Никель | |
Атомный номер | 26 | 27 | 28 |
Масса | 55,85 | 58,93 | 58,69 |
Электронная конфигурация | 3д 6 4с 2 | 3д 7 4с 2 | 3д 8 4с 1 |
Металлический радиус, пм | 124 | 125 | 125 |
Энергия ионизации, кДж моль -1 | 762,5 | 760,4 | 737,1 |
| 759 | 758 | 737 |
| 1561 | 1646 | 1753 |
| 2957 | 3232 | 3393 |
В°, В б | -0,440 | -0,277 | -0,257 |
Общие (+) степени окисления | 2, 3, 6 | 2, 3 | 2, 3 |
Температура плавления (°C) | 1530 | 1495 | 1455 |
Температура кипения (°С) | 2862 | 2927 | 2732 |
Плотность, г см -3 | 7,87 | 8,90 | 8,91 |
Электропроводность e | 16 | 25 | 23 |
Ссылки
- Краколис, Марк С.
 и Питерс, Эдвард И. — Введение в химию: активный подход к обучению
и Питерс, Эдвард И. — Введение в химию: активный подход к обучению - John A. Disegi, Richard L. Kennedy, Robert Pilliar — Сплавы на основе кобальта для биомедицинских применений
- Джозеф Р. Дэвис, ASM International — Специальное руководство ASM: никель, кобальт и их сплавы
- Ким Б. Шедд — Ежегодник полезных ископаемых Геологической службы США за 2006 г.
- Петруччи, Харвуд, Херринг и Мадура — Общая химия, 9-е издание
- Вальтер Х. Коль — Справочник по материалам и технологиям вакуумного устройства
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Содержание тяжелых металлов и магнитные свойства пыли с детских площадок в Гонконге
. 2003 г., декабрь; 89 (3): 221–32.
дои: 10.1023/а:1026103318778.
Сай Люн Нг
1
, Лунг Сан Чан, Кин Че Лам, Вин Кан Чан
принадлежность
- 1 Факультет географии и управления ресурсами, Китайский университет Гонконга, Шатин, Северная Каролина, Гонконг. [email protected]
PMID:
14632091
DOI:
10.
 1023/а:1026103318778
1023/а:1026103318778
Сай Леунг Нг и др.
Оценка окружающей среды.
2003 Декабрь
. 2003 г., декабрь; 89 (3): 221–32.
дои: 10.1023/а:1026103318778.
Авторы
Сай Люн Нг
1
, Лунг Сан Чан, Кин Че Лам, Винг Кан Чан
принадлежность
- 1 Факультет географии и управления ресурсами, Китайский университет Гонконга, Шатин, Северная Каролина, Гонконг. [email protected]
PMID:
14632091
DOI:
10.
 1023/а:1026103318778
1023/а:1026103318778
Абстрактный
В этом исследовании изучались уровни семи тяжелых металлов (а именно, цинка, меди, кадмия, хрома, свинца, марганца и железа) и их связь с магнитными свойствами в пыли с игровых площадок в Гонконге. Результаты показали, что пыль на детской площадке содержала высокие концентрации Zn (в среднем = 1883 мкг/г), Cu (в среднем 143 мкг/г) и Cr (в среднем 263 мкг/г). Качественное исследование образцов пыли под микроскопом показало, что местный транспорт является одним из важных источников загрязнения. Магнитные измерения показали, что эти антропогенные загрязнители в основном состоят из крупнозернистых многодоменных (МД) ферримагнитных минералов. Суперпарамагнитные (SP), стабильные однодоменные (SSD) ферримагнитные зерна и неферримагнитные минералы присутствовали в относительно небольших количествах. Значительная корреляция между тяжелыми металлами и различными магнитными параметрами указывала на сильное сродство тяжелых металлов к магнитным минералам, следовательно, указывала на потенциал магнитных свойств для простых и быстрых косвенных признаков загрязнения тяжелыми металлами пыли на детской площадке.
Похожие статьи
Магнитный отклик загрязнения тяжелыми металлами в пыли детской площадки промышленной зоны.
Ян М., Ли Х.М., Ли Ф.Ю., Ван Д.Х., Дяо Ю.В., Цянь Х., Ян З.П., Ван К.
Ян М. и др.
Хуан Цзин Кэ Сюэ. 2017 8 декабря; 38 (12): 5282-5291. doi: 10.13227/j.hjkx.201704197.
Хуан Цзин Кэ Сюэ. 2017.PMID: 29964592
Китайский язык.
Взаимосвязь между магнитными свойствами и загрязнением тяжелыми металлами образцов уличной пыли из Шанхая, Китай.
Ван Г, Чен Дж, Чжан В, Чен Ю, Рен Ф, Фанг А, Ма Л.
Ван Г и др.
Environ Sci Pollut Res Int. 2019 март; 26 (9): 8958-8970. doi: 10.1007/s11356-019-04338-4. Epub 2019 4 февраля.
Environ Sci Pollut Res Int. 2019.PMID: 30715708
Магнитные свойства и содержание тяжелых металлов в автомобильных выхлопных газах.

Лу С.Г., Бай С.К., Цай Дж.Б., Сюй С.
Лу С.Г. и соавт.
J Zhejiang Univ Sci B. 2005 Aug; 6 (8): 731-5. doi: 10.1631/jzus.2005.B0731.
J Zhejiang Univ Sci B. 2005.PMID: 16052705
Бесплатная статья ЧВК.Характеристики загрязнения, источники и оценка риска для здоровья от воздействия на человека Cu, Zn, Cd и Pb, загрязненных городской уличной пылью в Китае в период с 2009 по 2018 год.
Хоу С., Чжэн Н., Тан Л., Цзи С., Ли И., Хуа С.
Хоу С. и др.
Окружающая среда Интерн. 2019Июль; 128: 430-437. doi: 10.1016/j.envint.2019.04.046. Эпаб 2019 10 мая.
Окружающая среда Интерн. 2019.PMID: 31082721
Обзор.
Безопасность школ на основе концентрации тяжелых металлов в пыли классных комнат: систематический обзор и метаанализ.

Мохтадери М., Хоссейни Тешнизи С., Могтадери Т., Ашраф М.А., Фараджи Х.
Могтадери М. и др.
Иран J Общественное здравоохранение. 2020 дек;49(12):2287-2294. doi: 10.18502/ijph.v49i12.4809.
Иран J Общественное здравоохранение. 2020.PMID: 34178735
Бесплатная статья ЧВК.Обзор.
Посмотреть все похожие статьи
Цитируется
Приготовление стандартов из беззольной целлюлозной бумаги для быстрого определения концентрации многих элементов в взвешенных в воздухе мелких частицах с использованием масс-спектрометрии с индуктивно-связанной плазмой с лазерной абляцией.
Цяо Л., Чжан Р., Цяо Дж., Хе Х., У З.
Цяо Л. и др.
RSC Adv. 2021 10 февраля; 11 (12): 6644-6653. doi: 10.1039/d0ra09200b. Электронная коллекция 2021 4 февраля.
RSC Adv. 2021.PMID: 35423202
Бесплатная статья ЧВК.
Выявление связи между коэффициентами подвижности отдельных тяжелых металлов и размерами почвенных частиц в почвах детских площадок.
Verla EN, Verla AW, Osisi AF, Okeke PN, Enyoh CE.
Верла Э.Н. и др.
Оценка окружающей среды. 201912 ноября;191(12):742. doi: 10.1007/s10661-019-7937-7.
Оценка окружающей среды. 2019.PMID: 31713691
Оценка воздействия множества токсичных элементов на основе рисков, с которыми сталкиваются дети на школьных игровых площадках и в парках в юго-западном регионе Саудовской Аравии.
Джавед С.А., Аль-Братти М., Аль-Раджаб А.Дж., Альхазми Х.А., Ахсан В., Абдельвахаб С.И., Тангавел Н.
Джавед С.А. и др.
Оценка окружающей среды. 20198 августа; 191(9):549. doi: 10.1007/s10661-019-7640-8.
Оценка окружающей среды. 2019.PMID: 31392440
Использование магнитной восприимчивости для оценки состояния загрязнения отложений типичного водохранилища на северо-западе Китая.
Пан Х, Лу С, Лэй К, Ши Д, Рен С, Ян Л, Ван Л.
Пан Х и др.
Environ Sci Pollut Res Int. 2019 янв; 26(3):3019-3032. doi: 10.1007/s11356-018-3844-7. Epub 2018 30 ноября.
Environ Sci Pollut Res Int. 2019.PMID: 30506383
Являются ли детские игровые площадки безопасными игровыми площадками? Неорганический анализ и соотношение изотопов свинца для оценки загрязнения в рекреационных (бразильских) парках.
Гредилья А., Фдес-Ортис де Вальехуэло С., Гомес-Нубла Л., Карреро Х.А., де Леао Ф.Б., Мадариага Х.М., Силва ЛФО.
Гредилья А. и др.
Environ Sci Pollut Res Int. 2017 ноябрь;24(31):24333-24345. doi: 10.1007/s11356-017-9831-6. Epub 2017 Сентябрь 9.
Environ Sci Pollut Res Int. 2017.PMID: 28889400
Просмотреть все статьи «Цитируется по»
использованная литература
Научная общая среда. 1991 март; 100 Спец. №: 125-50
—
пабмед
Клин Педиатр (Фила). 1994 авг; 33 (8): 480-4
—
пабмед
Загрязнение окружающей среды.
 1988;50(1-2):139-61
1988;50(1-2):139-61—
пабмед
Hong Kong Mon Dig Stat. 1996 декабрь;: 1-17
—
пабмед
Технологии экологических наук. 1973 март 1; 7 (3): 235-40
—
пабмед
Типы публикаций
термины MeSH
вещества
Хиральные тетраядерные комплексы меди(ii): синтез, оптические и магнитные свойства
Выпуск 39, 2020 г.
Из журнала:
Новый химический журнал
Хиральные тетраядерные комплексы меди(ii): синтез, оптические и магнитные свойства†
Наушад
Ахмед,‡ a
Шалини
Трипати, и
Аруп
Саркара, и
Камаль Уддин
Ансари, и
Чинмой
Дас, б
Ниту
Праджеш, c
Сатоши
Хорике, bde
Рамамурти
Бумишанкар
* с
а также
Махесваран
Шанмугам
* и
Принадлежности автора
*
Соответствующие авторы
и
Кафедра химии, Индийский технологический институт Бомбей, Поваи, Мумбаи-400076, Махараштра, Индия
Электронная почта:
eswar@chem. iitb.ac.in
iitb.ac.in
б
Лаборатория открытых инноваций химико-энергетических материалов AIST-Киотского университета (ChEM-OIL), Национальный институт передовых промышленных наук и технологий (AIST), Ёсида-Хонмачи, Сакио-ку, Киото 606-8501, Япония
в
Кафедра химии, Индийский институт научного образования и исследований (IISER), Пуна, Dr Homi Bhabha Road, Пуна-411008, Индия
Электронная почта:
[email protected]
д
Институт интегрированных наук о клеточных материалах, Институт перспективных исследований, Киотский университет, Ёсида-Хонмачи, Сакио-ку, Киото 606-8501, Япония
и
Департамент материаловедения и инженерии, Школа молекулярной науки и инженерии, Институт науки и технологий Видьясиримедхи, Районг 21210, Таиланд
Аннотация
rsc.org/schema/rscart38″> Обработка лиганда энантиомерически чистого базы Schiff (R-H 2 L 1 или S-H 2 L 1 ) с равенством в рамках ISERATARANARANALATION ISERATARATION ISERATARATION TORATION ISERATARATION TORATION ISERATARATION ISERATARATION LADATARATION ISERATARATION ISERATARANALATION ISERATARANALATION 1 ). II ) Кубинские комплексы с общей молекулярной формулой [CU 4 (R-L 1 ) 4 ] ( R-1 ) и [CU 4. 98181981981981981981981 ( R-1 ) и [CU 4 4 9 498189 4 498189 4 ( R-1 ) и [CU ].0030 1 ) 4 ] ( S-1 ), которые характеризуются монокристаллической рентгенографией. Как R-1 , так и S-1 структурно аналогичны друг другу, что отражается в параметрах их элементарной ячейки. Используемые хиральные лиганды эффективно передают хиральность металлическому комплексу, что отражается в их параметрах флака, и комплекс R-1 кристаллизуется в хиральной, полярной точечной/пространственной группе ( C 2). Хиральность сохраняется не только в твердом состоянии, но и в растворенном состоянии как для R/S-H 2 L 1 , так и для R / S-1 . Измерения магнитной восприимчивости при постоянном токе, выполненные на поликристаллическом образце репрезентативного комплекса R-1 , демонстрируют преобладающее ферромагнитное взаимодействие, приводящее к основному состоянию S = 2, в отличие от других алкоксидных мостиков [Cu 4 O 4 ] комплексы. Электронная структура и наблюдаемая ферромагнитная обменная связь в R-1 объясняются подробными теоретическими расчетами.
Используемые хиральные лиганды эффективно передают хиральность металлическому комплексу, что отражается в их параметрах флака, и комплекс R-1 кристаллизуется в хиральной, полярной точечной/пространственной группе ( C 2). Хиральность сохраняется не только в твердом состоянии, но и в растворенном состоянии как для R/S-H 2 L 1 , так и для R / S-1 . Измерения магнитной восприимчивости при постоянном токе, выполненные на поликристаллическом образце репрезентативного комплекса R-1 , демонстрируют преобладающее ферромагнитное взаимодействие, приводящее к основному состоянию S = 2, в отличие от других алкоксидных мостиков [Cu 4 O 4 ] комплексы. Электронная структура и наблюдаемая ферромагнитная обменная связь в R-1 объясняются подробными теоретическими расчетами.
Варианты загрузки Пожалуйста, подождите. ..
..
Дополнительные файлы
Дополнительная информация
PDF (1157K)Данные о кристаллической структуре
СИФ (66K)
Информация о товаре
- ДОИ
- https://doi.org/10.1039/D0NJ02856H
- Тип изделия
- Бумага
- Отправлено
- 05 июн 2020
- Принято
- 19 авг 2020
- Впервые опубликовано
- 20 авг 2020
Скачать цитату
New J. Chem. , 2020, 44 , 16845-16855
Chem. , 2020, 44 , 16845-16855
BibTexEndNoteMEDLINEProCiteReferenceManagerRefWorksRIS
Разрешения
Запросить разрешения
Социальная деятельность
Получение данных из CrossRef.
Загрузка может занять некоторое время.
Прожектор
Объявления
металлургия | Определение и история
металлургия
Смотреть все СМИ
- Ключевые люди:
- Михаил Ломоносов
Георгиус Агрикола
Дэниел Коуэн Джеклинг
Сэр Алан Коттрелл
Арден Л. Бемент-младший
- Похожие темы:
- металлоконструкции
переработка полезных ископаемых
металлография
технологическая металлургия
физическая металлургия
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
металлургия , искусство и наука по извлечению металлов из руд и модификации металлов для использования.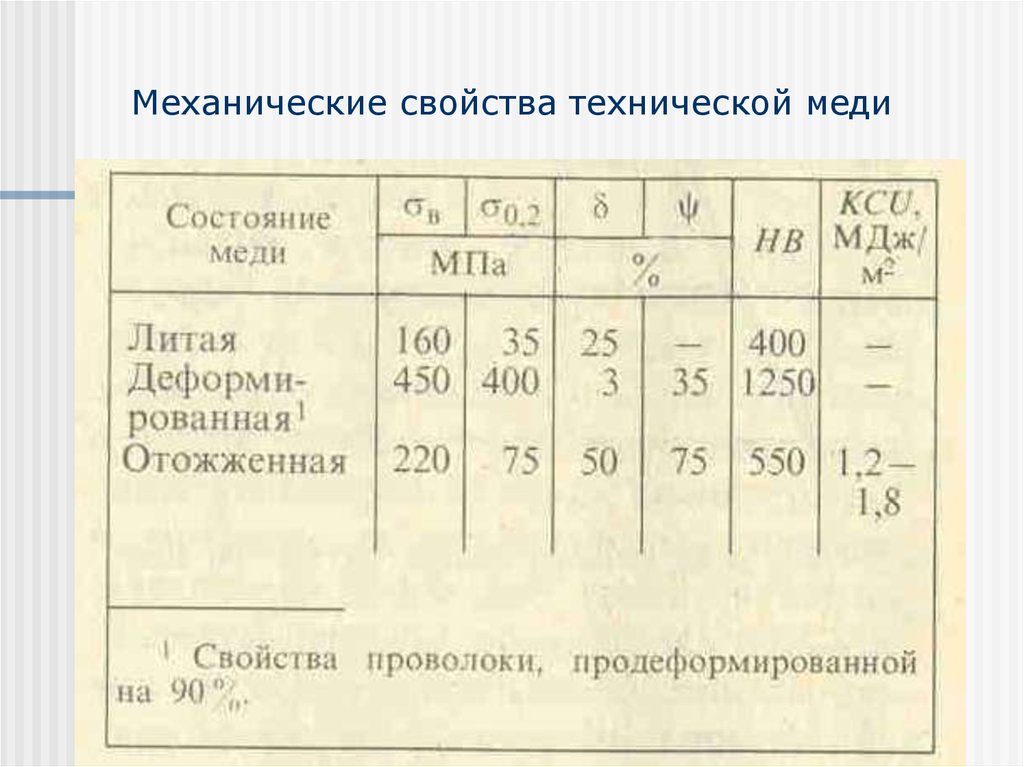 Металлургия обычно относится к коммерческим, а не к лабораторным методам. Это также касается химических, физических и атомных свойств и структуры металлов, а также принципов, по которым металлы объединяются в сплавы.
Металлургия обычно относится к коммерческим, а не к лабораторным методам. Это также касается химических, физических и атомных свойств и структуры металлов, а также принципов, по которым металлы объединяются в сплавы.
История металлургии
Современное использование металлов является кульминацией долгого пути развития, растянувшегося примерно на 6500 лет. Принято считать, что первыми известными металлами были золото, серебро и медь, находившиеся в самородном или металлическом состоянии, из которых самыми ранними, по всей вероятности, были самородки золота, найденные в песках и гравии в руслах рек. Такие самородные металлы стали известны и ценились за их декоративную и утилитарную ценность во второй половине каменного века.
Самая ранняя разработка
Золото можно агломерировать в более крупные куски путем холодной ковки, но самородная медь не может, и важным шагом на пути к Веку металлов стало открытие того, что такие металлы, как медь, могут быть преобразованы в формы путем плавления и отливки в формы; среди самых ранних известных изделий этого типа — медные топоры, отлитые на Балканах в 4-м тысячелетии до н. э. Еще одним шагом стало открытие того, что металлы можно извлекать из металлосодержащих минералов. Они были собраны, и их можно было отличить по цвету, текстуре, весу, цвету пламени и запаху при нагревании. Заметно больший выход, полученный при нагревании самородной меди с сопутствующими оксидными минералами, мог привести к процессу плавки, поскольку эти оксиды легко восстанавливаются до металла в слое древесного угля при температурах выше 700 ° C (1300 ° F) в качестве восстановителя. , угарный газ, становится все более стабильным. Чтобы осуществить агломерацию и отделение расплавленной или выплавленной меди от сопутствующих минералов, необходимо было ввести оксид железа в качестве флюса. Этот дальнейший шаг вперед можно объяснить наличием минералов оксида железа госсан в выветрелых верхних зонах месторождений сульфидов меди.
э. Еще одним шагом стало открытие того, что металлы можно извлекать из металлосодержащих минералов. Они были собраны, и их можно было отличить по цвету, текстуре, весу, цвету пламени и запаху при нагревании. Заметно больший выход, полученный при нагревании самородной меди с сопутствующими оксидными минералами, мог привести к процессу плавки, поскольку эти оксиды легко восстанавливаются до металла в слое древесного угля при температурах выше 700 ° C (1300 ° F) в качестве восстановителя. , угарный газ, становится все более стабильным. Чтобы осуществить агломерацию и отделение расплавленной или выплавленной меди от сопутствующих минералов, необходимо было ввести оксид железа в качестве флюса. Этот дальнейший шаг вперед можно объяснить наличием минералов оксида железа госсан в выветрелых верхних зонах месторождений сульфидов меди.
Во многих регионах в последующий период производились медно-мышьяковые сплавы, обладающие превосходными свойствами по сравнению с медью как в литом, так и в деформируемом виде. Сначала это могло быть случайным из-за сходства по цвету и цвету пламени между ярко-зеленым медно-карбонатным минералом малахитом и продуктами выветривания таких медно-мышьяковых сульфидных минералов, как энаргит, а позднее за этим мог последовать целенаправленный отбор соединений мышьяка на основе их чесночного запаха при нагревании.
Сначала это могло быть случайным из-за сходства по цвету и цвету пламени между ярко-зеленым медно-карбонатным минералом малахитом и продуктами выветривания таких медно-мышьяковых сульфидных минералов, как энаргит, а позднее за этим мог последовать целенаправленный отбор соединений мышьяка на основе их чесночного запаха при нагревании.
Содержание мышьяка варьировалось от 1 до 7 процентов, олова до 3 процентов. Практически не содержащие мышьяка медные сплавы с более высоким содержанием олова — другими словами, настоящая бронза — по-видимому, появились между 3000 и 2500 годами до нашей эры, начиная с дельты Тигра и Евфрата. Открытие значения олова могло произойти благодаря использованию станнита, смешанного сульфида меди, железа и олова, хотя этот минерал не так широко доступен, как основной минерал олова, касситерит, который, должно быть, был конечным источником. металла. Касситерит поразительно плотный и встречается в виде гальки в аллювиальных отложениях вместе с арсенопиритом и золотом; это также происходит в определенной степени в госсанах оксида железа, упомянутых выше.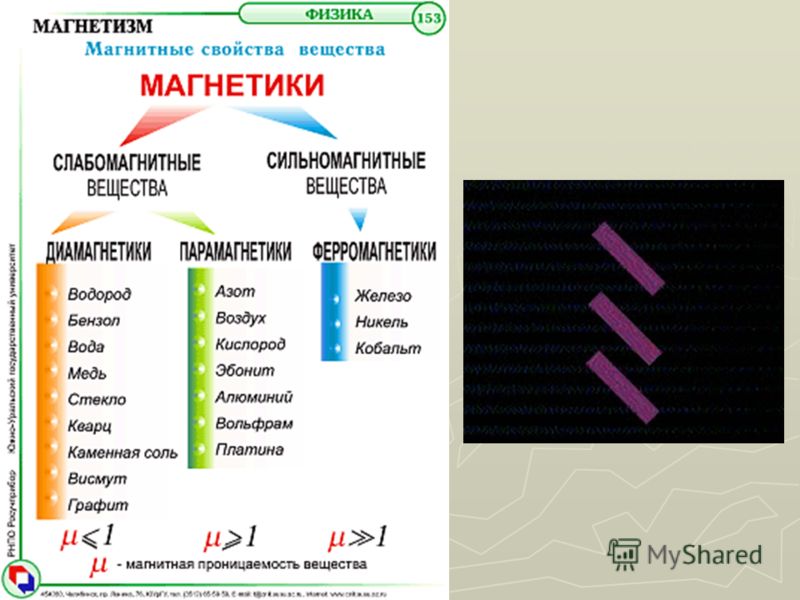
Хотя бронза могла развиваться независимо в разных местах, наиболее вероятно, что бронзовая культура распространилась через торговлю и миграцию народов с Ближнего Востока в Египет, Европу и, возможно, Китай. Во многих цивилизациях производство меди, мышьяковой меди и оловянной бронзы какое-то время продолжалось вместе. Возможное исчезновение медно-мышьяковых сплавов трудно объяснить. Производство могло быть основано на полезных ископаемых, которые не были широко доступны и стали дефицитными, но относительная нехватка минералов олова не мешала значительной торговле этим металлом на значительных расстояниях. Возможно, оловянные бронзы в конечном итоге стали предпочитаться из-за возможности отравления мышьяком от паров, образующихся при окислении мышьякосодержащих минералов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
По мере разработки выветрелых медных руд в определенных местах, более твердые сульфидные руды под ними добывались и плавились. Используемые минералы, такие как халькопирит, сульфид меди и железа, нуждались в окислительном обжиге для удаления серы в виде диоксида серы и получения оксида меди. Это не только требовало больших металлургических навыков, но также окисляло тесно связанное железо, что в сочетании с использованием флюсов из оксида железа и более сильными восстановительными условиями, создаваемыми усовершенствованными плавильными печами, приводило к более высокому содержанию железа в бронзе.
Используемые минералы, такие как халькопирит, сульфид меди и железа, нуждались в окислительном обжиге для удаления серы в виде диоксида серы и получения оксида меди. Это не только требовало больших металлургических навыков, но также окисляло тесно связанное железо, что в сочетании с использованием флюсов из оксида железа и более сильными восстановительными условиями, создаваемыми усовершенствованными плавильными печами, приводило к более высокому содержанию железа в бронзе.
Невозможно провести четкую границу между бронзовым веком и железным веком. Небольшие куски железа должны были производиться в медеплавильных печах, поскольку использовались флюсы оксида железа и железосодержащие сульфидные руды меди. Кроме того, более высокие температуры печи создали бы условия для более сильного восстановления (то есть более высокое содержание монооксида углерода в газах печи). Ранний кусок железа с дороги в провинции Дренте, Нидерланды, был датирован 1350 годом до нашей эры, датой, которую обычно принимают за средний бронзовый век для этой области. С другой стороны, в Анатолии железо использовалось уже в 2000 г. до н. э. Есть также случайные ссылки на железо и в более ранние периоды, но этот материал имел метеоритное происхождение.
С другой стороны, в Анатолии железо использовалось уже в 2000 г. до н. э. Есть также случайные ссылки на железо и в более ранние периоды, но этот материал имел метеоритное происхождение.
Как только была установлена взаимосвязь между новым металлом, найденным в медных плавках, и рудой, добавленной в качестве флюса, естественным образом последовала работа печей для производства только железа. Несомненно, к 1400 г. до н. э. в Анатолии большое значение приобрело железо, а к 1200–1000 гг. до н. э. из него в больших масштабах изготавливали оружие, первоначально лезвия кинжалов. По этой причине 1200 г. до н.э. был принят за начало железного века. Данные раскопок указывают на то, что искусство изготовления железа зародилось в гористой местности к югу от Черного моря, где доминировали хетты. Позже это искусство, по-видимому, распространилось среди филистимлян, поскольку в Гераре были обнаружены грубые печи, датируемые 1200 г. до н. э., вместе с рядом железных предметов.
Плавка оксида железа с древесным углем требовала высокой температуры, и, поскольку температура плавления железа 1540 °C (2800 °F) тогда была недостижима, продукт представлял собой просто губчатую массу пастообразных глобул металла, смешанных с полужидкий шлак.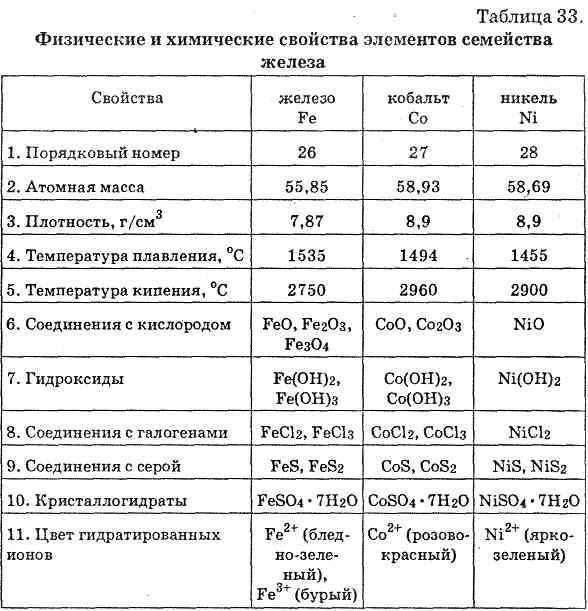 Этот продукт, позже известный как блюм, вряд ли можно было использовать в том виде, в каком он был, но повторный нагрев и горячая ковка устранили большую часть шлака, создав кованое железо, продукт гораздо лучшего качества.
Этот продукт, позже известный как блюм, вряд ли можно было использовать в том виде, в каком он был, но повторный нагрев и горячая ковка устранили большую часть шлака, создав кованое железо, продукт гораздо лучшего качества.
На свойства железа сильно влияет присутствие небольшого количества углерода, при этом значительное увеличение прочности связано с содержанием менее 0,5 процента. При достижимых тогда температурах — около 1200 ° C (2200 ° F) — восстановление древесным углем давало почти чистое железо, которое было мягким и имело ограниченное применение для оружия и инструментов. с изобретением лучших мехов железо поглощало больше углерода. Это привело к цветению и железным изделиям с различным содержанием углерода, что затрудняло определение периода, в течение которого железо могло быть преднамеренно упрочнено путем науглероживания или повторного нагревания металла в контакте с избытком древесного угля.
Углеродосодержащее железо имело еще одно большое преимущество, заключавшееся в том, что, в отличие от бронзы и безуглеродистого железа, его можно было сделать еще более твердым путем закалки, т. е. быстрого охлаждения путем погружения в воду. Нет никаких свидетельств использования этого процесса закалки в раннем железном веке, так что он должен был быть либо неизвестен тогда, либо не считался выгодным, поскольку закалка делает железо очень хрупким и должна сопровождаться отпуском или повторным нагревом при более низкая температура, чтобы восстановить ударную вязкость. То, что, по-видимому, было установлено на раннем этапе, было практикой многократной холодной ковки и отжига при 600–700 ° C (1100–1300 ° F), температура, естественно достигаемая при простом огне. Эта практика распространена в некоторых частях Африки даже сегодня.
е. быстрого охлаждения путем погружения в воду. Нет никаких свидетельств использования этого процесса закалки в раннем железном веке, так что он должен был быть либо неизвестен тогда, либо не считался выгодным, поскольку закалка делает железо очень хрупким и должна сопровождаться отпуском или повторным нагревом при более низкая температура, чтобы восстановить ударную вязкость. То, что, по-видимому, было установлено на раннем этапе, было практикой многократной холодной ковки и отжига при 600–700 ° C (1100–1300 ° F), температура, естественно достигаемая при простом огне. Эта практика распространена в некоторых частях Африки даже сегодня.
К 1000 г. до н. э. железо стало известно в Центральной Европе. Его использование медленно распространялось на запад. Производство железа было широко распространено в Великобритании во время римского вторжения в 55 г. до н. э. В Азии железо также было известно в древности, в Китае около 700 г. до н.э.
Синтез, структурные и магнитные свойства медьзамещенных ферритов никеля золь-гель методом
Материаловедение и приложения
Vol. 3 No.2 (2012), ID статьи:17253,4 страницы DOI:10.4236/msa.2012.32013
3 No.2 (2012), ID статьи:17253,4 страницы DOI:10.4236/msa.2012.32013
Синтез, структурные и магнитные свойства медьзамещенных ферритов никеля золь-гель методом
Gopathi Ravi Kumar 1* , Katrapally Vijaya Kumar 2 , Yarram Chetty Venudhar 1
1 Department of Physics, Osmania University, Hyderabad, India; 2 Факультет физики, Хайдарабадский инженерный колледж JNTU, Начупалли (Кондагатту), Индия.
Электронная почта: * [email protected]
Получено 22 сентября -й , 2011; пересмотрено 23 ноября -й -й, 2011 г.; принят 21 декабря ст , 2011
Ключевые слова: Феррит; Высокая температура спекания; рентгеновские дифрактограммы; структура шпинели; СЭМ; Магнитные свойства
Аннотация
NI 1– X CU X FE 2 O 4 (x = 0,0, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0). были приготовлены золь-гель методом для получения однородной кристаллической структуры и спечены при высокой температуре. Исследовано влияние легирования медью на структурные и магнитные свойства ферритов никеля, спеченных при 1000°С. Рентгеноструктурные измерения четко показали формирование однофазной структуры феррита-шпинели во всех приготовленных ферритных композициях. Из-за высокой температуры спекания размер частиц во всех композициях выходит за наноразмерный диапазон. Установлено, что параметры решетки увеличиваются с увеличением концентрации легирования содержания меди. Результаты намагничивания демонстрируют неколлинеарную ферримагнитную структуру для x = 0,0–0,5 и коллинеарную ферримагнитную структуру Нееля для x = 0,5–0,9.что свидетельствует об изменении магнитного порядка.
были приготовлены золь-гель методом для получения однородной кристаллической структуры и спечены при высокой температуре. Исследовано влияние легирования медью на структурные и магнитные свойства ферритов никеля, спеченных при 1000°С. Рентгеноструктурные измерения четко показали формирование однофазной структуры феррита-шпинели во всех приготовленных ферритных композициях. Из-за высокой температуры спекания размер частиц во всех композициях выходит за наноразмерный диапазон. Установлено, что параметры решетки увеличиваются с увеличением концентрации легирования содержания меди. Результаты намагничивания демонстрируют неколлинеарную ферримагнитную структуру для x = 0,0–0,5 и коллинеарную ферримагнитную структуру Нееля для x = 0,5–0,9.что свидетельствует об изменении магнитного порядка.
1. Введение
Ферриты являются технологически важными материалами, которые используются в производстве магнитных, электронных и микроволновых устройств. Они приобрели технологическое значение благодаря высокому удельному сопротивлению и незначительным потерям на вихревые токи [1,2]. Никель- и медьзамещенные никелевые ферриты представляют собой важный класс ферритов-шпинелей [3]. По кристаллической структуре феррит никеля является инверсным ферритом-шпинелем и обладает высоким удельным электрическим сопротивлением и низкими потерями на вихревые токи. Замена феррита никеля медью изменяет свойства феррита никеля, которые используются во многих устройствах. Никель-медные ферриты занимают важное место среди магнитных материалов благодаря их высокому удельному электрическому сопротивлению, высокой намагниченности насыщения и высокой магнитной проницаемости [4,5]. Структурные и магнитные свойства ферритов-шпинелей зависят от магнитного взаимодействия и распределения катионов в двух подрешетках, то есть в тетраэдрических (А) и октаэдрических (В) узлах решетки. Ni-Cu ферриты обладают привлекательными электрическими и магнитными свойствами, поскольку феррит меди является одним из самых интересных ферритов-шпинелей среди всех ферритов. Он претерпевает структурный фазовый переход, сопровождающийся понижением симметрии кристалла до тетрагональной [6].
Никель- и медьзамещенные никелевые ферриты представляют собой важный класс ферритов-шпинелей [3]. По кристаллической структуре феррит никеля является инверсным ферритом-шпинелем и обладает высоким удельным электрическим сопротивлением и низкими потерями на вихревые токи. Замена феррита никеля медью изменяет свойства феррита никеля, которые используются во многих устройствах. Никель-медные ферриты занимают важное место среди магнитных материалов благодаря их высокому удельному электрическому сопротивлению, высокой намагниченности насыщения и высокой магнитной проницаемости [4,5]. Структурные и магнитные свойства ферритов-шпинелей зависят от магнитного взаимодействия и распределения катионов в двух подрешетках, то есть в тетраэдрических (А) и октаэдрических (В) узлах решетки. Ni-Cu ферриты обладают привлекательными электрическими и магнитными свойствами, поскольку феррит меди является одним из самых интересных ферритов-шпинелей среди всех ферритов. Он претерпевает структурный фазовый переход, сопровождающийся понижением симметрии кристалла до тетрагональной [6].
Несколько исследовательских групп сообщили, что намагниченность в Ni-Cu ферритах уменьшается с увеличением содержания Cu и наоборот [7-14]. Установлено, что содержание Cu оказывает существенное влияние на электромагнитные свойства. Поэтому имеет смысл исследовать структурные и магнитные свойства ферритов Ni-Cu. Таким образом, в данной статье мы представляем систематические исследования медьзамещенных ферритов никеля.
2. Экспериментальная методика
Ферриты Ni-Cu с общей формулой Ni 1–x Cu x Fe 2 O 4 (0,0 ≤ x ≤ 1,0) были синтезированы золь-гель методом [15]. ]. Все химические вещества были аналитической чистоты с чистотой ≥99% и использовались. В типичной процедуре гидрат нитрата никеля Ni (NO 3 ) 2 ·6H 2 O, cupric nitrate hydrate Cu(NO 3 ) 2 ·6H 2 O, ferric nitrate nonahydrate Fe(NO 3 ) 3 ·9H 2 O использовали в качестве исходных материалов. Процесс синтеза описан в [15]. Полученные конечные образцы порошков спекали при 1000°С в течение 24 часов.
Процесс синтеза описан в [15]. Полученные конечные образцы порошков спекали при 1000°С в течение 24 часов.
Структурная характеристика ферритовых порошков была выполнена на Panalytical Expert Diffractometer (XRD), PW 3040/60 Philips с излучением CuKα (длина волны, λ = 1,54 Å). Сканирующие электронные микрофотографии всех образцов были сделаны на машине JEOL JSM 6360 SEM. Измерения намагниченности проводились с помощью магнитометра с вибрирующим образцом (VSM).
3. Результаты и дискуссии
На рисунке 1 показаны рентгенограммы Ni 1 — x Cu x Fe 2 O 4 (0 ≤
33 Рисунок. дифрактограммы Ni 1–x Cu x Fe 2 O 4 (0 ≤ x ≤ 1,0) ферритов
x ≤ 1,0) проб. Рентгеновские дифрактограммы четко указывают на формирование однофазной структуры шпинели. Рентгенограммы сравнивали и индексировали с использованием карт ICDD № (86-2287) и (34-0425) для ферритов Ni и Cu. Как видно из рисунка 1, пики XRD очень узкие, что указывает на то, что более высокий размер зерна выходит за пределы наноразмерной области (более 100 нм). Как правило, золь-гель метод дает наноразмерные зерна в ферритовых системах [15]. Но, поскольку температура и время спекания (1000°С в течение 24 ч) были очень высокими, это привело к большему размеру зерен в приготовленных образцах феррита.
Как видно из рисунка 1, пики XRD очень узкие, что указывает на то, что более высокий размер зерна выходит за пределы наноразмерной области (более 100 нм). Как правило, золь-гель метод дает наноразмерные зерна в ферритовых системах [15]. Но, поскольку температура и время спекания (1000°С в течение 24 ч) были очень высокими, это привело к большему размеру зерен в приготовленных образцах феррита.
Значения параметров решетки были получены для всех образцов с использованием данных XRD и перечислены в таблице 1. Изменение параметра решетки в зависимости от содержания меди показано на рисунке 2. Из рисунка 2 видно, что параметр решетки увеличивается с ростом содержания меди. увеличение содержания меди х. Такое поведение параметра решетки с содержанием Cu x объясняется различием ионных радиусов Ni 2+ (0,69 Å) и Cu 2+ (0,724 Å). Подобные результаты наблюдались в исследовании S. Manjura Hoque et al. [6] и M.A. Gabal et al. [7]. В случае наших образцов параметры решетки оказались несколько выше, чем у других. Улучшенные параметры решетки могут быть получены благодаря методу зольгель. Рентгеновская плотность всех Ni 1–x Cu x Fe 2 O 4 (0 ≤ x ≤ 1,0) ферриты рассчитаны по молекулярной массе и объему элементарной ячейки по соотношению
Улучшенные параметры решетки могут быть получены благодаря методу зольгель. Рентгеновская плотность всех Ni 1–x Cu x Fe 2 O 4 (0 ≤ x ≤ 1,0) ферриты рассчитаны по молекулярной массе и объему элементарной ячейки по соотношению
(1)
где M — молекулярная масса, N — число Авогадро, a — параметр решетки.
Таблица 1. Параметр решетки (а), рентгеновская плотность (d x ), намагниченность насыщения (M S ) и магнитный момент (η B ) с содержанием Cu x.
Рис. 2. Изменение параметра решетки a в зависимости от содержания меди x.
Изменение рентгеновской плотности в зависимости от содержания меди также показано в таблице 1. Установлено, что рентгеновская плотность уменьшается с увеличением содержания меди x. Установлено, что рентгеновская плотность зависит от параметра решетки и молекулярной массы образцов.
На рис. 3 представлены типичные микроструктуры СЭМ образцов Ni 1 – x Cu x Fe 2 O 4 (0 ≤ x ≤ 1,0). По микроструктурам хорошо видны структурные изменения с содержанием меди х. Морфология и размер зерна образцов кажутся неоднородными с некоторой агломерацией в синтезированных образцах, что неизбежно. В нескольких образцах с x = 0,2 и 0,5 видно, что зерна хорошо разделены. Из предварительных наблюдений изображений СЭМ можно сказать, что на размер зерна незначительно влияет концентрация легирующей меди.
По микроструктурам хорошо видны структурные изменения с содержанием меди х. Морфология и размер зерна образцов кажутся неоднородными с некоторой агломерацией в синтезированных образцах, что неизбежно. В нескольких образцах с x = 0,2 и 0,5 видно, что зерна хорошо разделены. Из предварительных наблюдений изображений СЭМ можно сказать, что на размер зерна незначительно влияет концентрация легирующей меди.
Измерения намагниченности образцов Ni 1–x Cu x Fe 2 O 4 (0 ≤ x ≤ 1,0) проводились с помощью вибрационного магнитометра (VSM) с максимальным приложенным полем 8 кЭ при комнатной температуре. Было обнаружено, что петли гистерезиса хорошо насыщаются доступным приложенным полем. Полученные петли гистерезиса показаны на рис. 4. Петли гистерезиса отражают характеристики магнитомягких материалов. Намагниченность насыщения (M S ) было
x = 0,0 x = 0,2 x = 0,5x = 0,7 x = 0,9 x = 1,0
О 4 (0 ≤ x ≤ 1,0) ферриты.
увеличивается до x = 0,5, а затем постепенно уменьшается с дальнейшим увеличением содержания Cu x, как показано на рисунке 5. Экспериментальный магнитный момент (η B ) определяется из данных намагниченности насыщения с использованием следующего соотношения [7]:
Рис. 5. Изменение намагниченности насыщения и магнитного момента в зависимости от содержания меди x.
(2)
где, M W – молекулярная масса образца, а M S – намагниченность насыщения в э.эм.е./г.
Рассчитанные значения экспериментального магнитного момента (η B ) и намагниченности насыщения приведены в табл. 1. Установлено, что тренд изменения содержания меди x в обоих случаях одинаков. Изменение намагниченности в зависимости от содержания Cu x очень хорошо согласуется с тем, о котором сообщают Doh et al. [8] на феррите Ni Cu, полученном методом соосаждения. Габал и др. [9] наблюдали уменьшение намагниченности с увеличением содержания Cu x.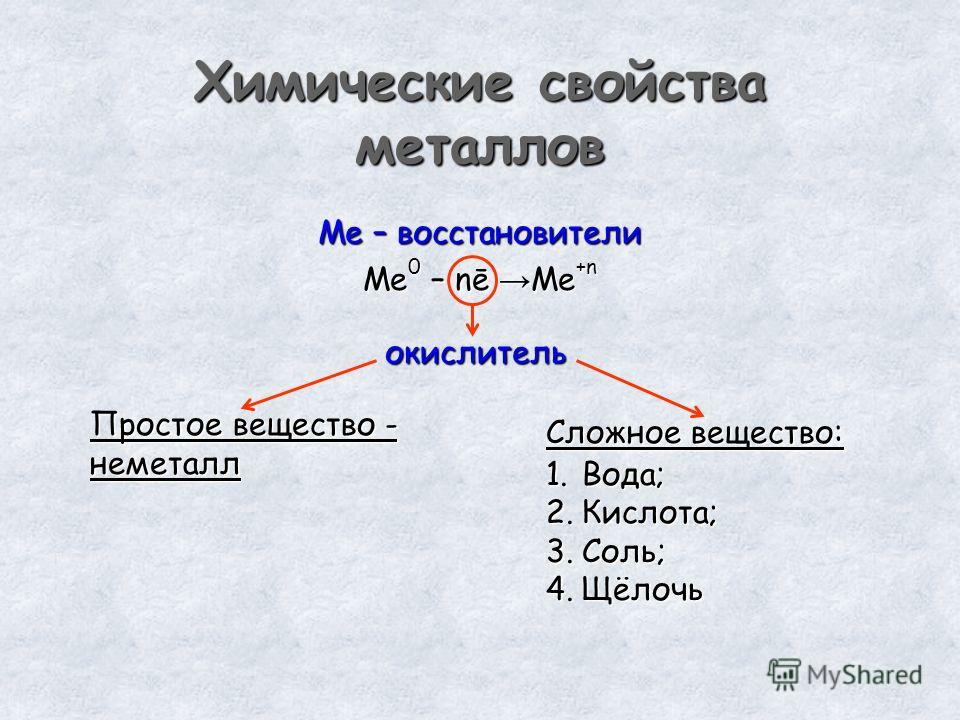 Отмечено, что метод подготовки играет важную роль в изменении магнитных свойств ферритов-шпинелей.
Отмечено, что метод подготовки играет важную роль в изменении магнитных свойств ферритов-шпинелей.
Из рисунка 5 видно, что образцы с x = 0,0 до 1,0 проявляют ферримагнитное поведение, которое сначала увеличивается от x = 0,0 до 0,5, а затем уменьшается от x = 0,5 до 0,9.что свидетельствует об изменении магнитного упорядочения [16]. Изменение η B с содержанием Cu 2+ x можно объяснить тем, что ионы Cu 2+ замещают магнитные ионы Fe 3+ в тетраэдрической (А) позиции. Таким образом, магнитный момент Bsite уменьшается с содержанием Cu x. Отсюда можно понять, что ионы Cu замещают ионы Fe в A-позиции, и в результате момент A-позиции уменьшается. Однако разница между моментом точки А и моментом точки В увеличивается. Таким образом, увеличение магнитного момента η B с содержанием Cu x до x = 0,5 обусловлен неколлинеарной ферримагнитной структурой. Уменьшение η B при x > 0,5 указывает на возможность неелевской коллинеарной ферримагнитной структуры. Габал и др. [9] предположили, что присутствие Cu 2+ в позиции A может влиять на уменьшение намагниченности за счет замещения Ni 2+ по Cu 2+ .
Габал и др. [9] предположили, что присутствие Cu 2+ в позиции A может влиять на уменьшение намагниченности за счет замещения Ni 2+ по Cu 2+ .
Наблюдаемые изменения намагниченности можно объяснить на основе распределения катионов и обменного взаимодействия между ионами железа и меди в тетраэдрических A и октаэдрических B позициях. Когда ионы Cu 2+ вводятся за счет ионов никеля, часть ионов Fe 3+ мигрирует из позиций A в позиции B ввиду предпочтения позиций для различных ионов. Это увеличивает Fe 3+ концентрация ионов в В-центрах. В результате магнитный момент подрешетки B увеличивается. Однако по мере того, как концентрация Cu 2+ увеличивается, количество ионов железа, остающихся в А-позиции, невелико, и взаимодействие А-В, испытываемое ионами железа в В-позиции, уменьшается. Кроме того, увеличение количества ионов Fe 3+ в B-сайте увеличивает взаимодействие BB, что приводит к наклону спина [17]. Следовательно, намагниченность подрешетки B уменьшается. Таким образом, увеличение содержания Cu в образце приводит к уменьшению магнитного момента А-подрешетки. Причина уменьшения намагниченности может быть также связана с тем, что низкие Cu 9Концентрация 0134 2+ уменьшает число спинов, занимающих A-подрешетки, что приводит к увеличению суммарной намагниченности. По мере увеличения содержания Cu 2+ обменные взаимодействия ослабевают, и спины B больше не удерживаются жестко параллельно нескольким оставшимся спинам A. Уменьшение момента подрешетки B, интерпретируемое как отклонение спина от коллинеарности, вызывает эффект, известный как наклон. Значения намагниченности образцов, приготовленных в настоящее время, сравнительно меньше, чем у образцов, приготовленных из оксалата [9].]. Ожидается меньшая намагниченность в приготовленных в настоящее время образцах по сравнению с другими методами синтеза из-за поверхностного беспорядка и вероятного модифицированного катионного распределения [18].
Следовательно, намагниченность подрешетки B уменьшается. Таким образом, увеличение содержания Cu в образце приводит к уменьшению магнитного момента А-подрешетки. Причина уменьшения намагниченности может быть также связана с тем, что низкие Cu 9Концентрация 0134 2+ уменьшает число спинов, занимающих A-подрешетки, что приводит к увеличению суммарной намагниченности. По мере увеличения содержания Cu 2+ обменные взаимодействия ослабевают, и спины B больше не удерживаются жестко параллельно нескольким оставшимся спинам A. Уменьшение момента подрешетки B, интерпретируемое как отклонение спина от коллинеарности, вызывает эффект, известный как наклон. Значения намагниченности образцов, приготовленных в настоящее время, сравнительно меньше, чем у образцов, приготовленных из оксалата [9].]. Ожидается меньшая намагниченность в приготовленных в настоящее время образцах по сравнению с другими методами синтеза из-за поверхностного беспорядка и вероятного модифицированного катионного распределения [18].
4. Заключение
Никель-медные ферриты были успешно приготовлены методом золь-гель и спечены при 1000°C в течение 24 часов. Температура и время спекания играют жизненно важную роль в определении размера частиц. Рентгеноструктурные исследования четко показали формирование однофазной структуры шпинели и размер частиц за пределами наномасштаба. Установлено, что параметр решетки увеличивается с увеличением содержания меди. Установлено, что замещение медью оказывает существенное влияние как на структурные, так и на магнитные свойства. Результаты намагниченности насыщения демонстрируют неколлинеарную ферримагнитную структуру для x = 0,0–0,5 и коллинеарную ферримагнитную структуру Нееля для x = 0,5–0,9.что свидетельствует об изменении магнитного порядка.
5. Благодарности
Авторы выражают искреннюю благодарность профессору П. Кистайяху, руководителю и председателю Исследовательского совета физического факультета Университета Османии, Хайдарабад. Автор, KVK, выражает благодарность доктору Б. Судхиру Прему Кумару, директору (I/c) Инженерного колледжа JNTUH, Начупалли (Кондагатту), округ Каримнагар, штат А.П., Индия, за его поддержку.
Судхиру Прему Кумару, директору (I/c) Инженерного колледжа JNTUH, Начупалли (Кондагатту), округ Каримнагар, штат А.П., Индия, за его поддержку.
ССЫЛКИ
- C. Venkataraju, G. Sathishkumar и K. Sivakumar, «Влияние распределения катионов на структурные и магнитные свойства никель-замещенных наноразмерных ферритов Mn-Zn, приготовленных методом совместного осаждения», Journal of Magnetism and Magnetic Материалы, Том. 322, № 2, 2010, стр. 230-233. doi:10.1016/j.jmmm.2009.08.043
- А. Голдман, «Современная ферритовая технология», Ван Ностранд Рейнхольд, Нью-Йорк, 1990. , Химия и физика материалов, Vol. 117, № 1, 2009, стр. 163-168. doi:10.1016/j.matchemphys.2009.05.027
- К. Упадхьяй, Х.К. Девабрата Миштра, С. Верма и Р.П. Ананд Дас, «Влияние условий подготовки на образование нанофазных никель-цинковых ферритов с помощью гидротермальной техники», Журнал магнетизма и магнитных материалов, Vol. 260, № 1-2, 2003, стр. 188-194. doi:10.1016/S0304-8853(02)01320-3
- З.
 Цвейич, С. Ракич, А. Кременович, Б. Антич, К. Йовалекич и П. Коломбан, «Наноразмерные ферриты, полученные шаровым измельчением: кристаллическая структура, Распределение катионов, анализ размерной деформации и исследования комбинационного рассеяния // Науки о твердом теле, Vol. 8, № 8, 2006, стр. 908-915. doi:10.1016/j.solidstatesciences.2006.02.041
Цвейич, С. Ракич, А. Кременович, Б. Антич, К. Йовалекич и П. Коломбан, «Наноразмерные ферриты, полученные шаровым измельчением: кристаллическая структура, Распределение катионов, анализ размерной деформации и исследования комбинационного рассеяния // Науки о твердом теле, Vol. 8, № 8, 2006, стр. 908-915. doi:10.1016/j.solidstatesciences.2006.02.041 - С. Манджура Хок, доктор медицинских наук Аманулла Чоудхури и доктор медицинских наук Фахрул Ислам, «Характеристика смешанного Ni-Cu феррита шпинели», Журнал магнетизма и магнитных материалов, Vol. 251, № 3, 2002, стр. 292-303. doi: 10.1016/S0304-8853(02)00700-X
- М. А. Габал, Ю. М. Аль Ангари и С. С. Аль-Джуайд, «Исследование Cu-замещенных ферритов Ni-Cu-Zn, синтезированных с использованием яичного белка», Journal of Alloys and Соединения, Vol. 492, № 1-2, 2010. С. 411-415. doi:10.1016/j.jallcom.2009.11.124
- Г. Дох, Э. Б. Ким, Б. Х. Ли и Дж. Х. О, «Характеристики и синтез нанопорошков феррита Cu-Ni методом соосаждения с ультразвуковым облучением», Журнал магнетизма и магнитных материалов , Том.
 272-276, часть 3, 2004 г., стр. 2238-2240. doi: 10.1016/j.jmmm.2003.12.926
272-276, часть 3, 2004 г., стр. 2238-2240. doi: 10.1016/j.jmmm.2003.12.926 - М. А. Габал, Ю. М. Аль Ангари и М. В. Кади, «Структурные и магнитные свойства нанокристаллического Ni 1-x Cu x Fe 2 O 4 , полученные с помощью оксалатов-предшественников», Vol. 30, № 6, 2011. С. 1185-1190. doi:10.1016/j.poly.2011.01.032
- Дж. Мсоми и Т. Мойо, «Влияние доменной трансформации на магнитные свойства Cu x Ni 1-x Fe 2 O 4 Ферриты», Journal of Magnetism and Magnetic Materials, Vol. 321, № 9, 2009 г., стр. 1246-1250. doi:10.1016/j.jmmm.2008.11.003
- Дж. Азадманджири, Х.К. Салехани, М.Р. Барати и Ф. Фарзан, «Получение и электромагнитные свойства Ni 1-x Cu x 1- Fe29031 4 Ферриты с наночастицами методом автосжигания Sol-Gel», Materials Letters, Vol. 61, № 1, 2007, стр. 84-87. doi:10.1016/j.matlet.2006.04.011
- К. Румаих, «Транспортные свойства смешанного феррита NiCu», Журнал сплавов и соединений, Vol.
 465, № 1-2, 2008, стр. 291-295. doi:10.1016/j.jallcom.2007.10.073
465, № 1-2, 2008, стр. 291-295. doi:10.1016/j.jallcom.2007.10.073 - X.Y. Tan, G.Y. Li, Y. Zhao and C.W. Hu, «Влияние содержания Cu на структуру Ni 1−x Cu x Fe 2 O 4 Шпинели», Бюллетень исследования материалов, Vol. 44, № 12, 2009 г., стр. 2160-2168. doi:10.1016/j.materresbull.2009.08.018
- Д. Р. Патил и Б. К. Чугул, «Влияние замены меди на электрические и магнитные свойства феррита NiFe 2 O 4 », Химия материалов. и физика, Vol. 117, № 1, 2009, стр. 35-40. doi:10.1016/j.matchemphys.2008.12.034
- А. Т. Рагхавендер, Н. Билишков и Ж. Скоко, «Рентгенофазовый и ИК-анализ нанокристаллического Ni-Zn феррита, синтезированного золь-гель методом», Materials Letters, Vol. 65, № 4, 2011. С. 677-680. doi:10.1016/j.matlet.2010.11.071
- Р. Г. Кулкарни и Х. Х. Джоши, «Сравнение магнитных свойств MgFe 2 O 4 , полученных влажными химическими и керамическими методами», Журнал химии твердого тела, Vol.
 64, № 2, 1986, стр. 141-147. doi:10.1016/0022-4596(86)
64, № 2, 1986, стр. 141-147. doi:10.1016/0022-4596(86)-7
- С.Э. Ширсат, Б.Г. Токша, Р.Х. Кадам, С.М. Патанж, Д.Р. Мане, Г.С. Джангам и А. Гасеми, «Легирующий эффект Mn 2+ о магнитном поведении в наночастицах феррита Ni-Zn, приготовленных с помощью золь-гелевого автосгорания», Journal of Physics and Chemistry of Solids, Vol. 71, № 12, 2010, стр. 1669-1675. doi:10.1016/j.jpcs.2010.08.016
- Б. Парватишвара Рао, О. Калтун, В.С. Чо, К.-О. Ким и К. Ким, «Синтез и характеристика смешанных ферритовых наночастиц», Журнал магнетизма и магнитных материалов, Vol. 310, № 2, 2007 г., стр. e812-e814. doi:10.1016/j.jmmm.2006.10.771
ПРИМЕЧАНИЯ
* Автор, ответственный за переписку.
Список магнитных металлов
Эта запись была опубликована пользователем Anne Helmenstine (обновлено )
Магнитные металлы включают железо, никель, кобальт и сталь.
Магнитные материалы притягиваются к магниту и могут даже намагнититься. Почти все магнитные материалы являются металлами. Знакомые примеры магнитных металлов включают железо, никель, кобальт и сталь. Но магнетизм — сложное явление. Не все железо или сталь являются магнитными. Есть даже некоторые неметаллы, которые проявляют магнетизм! Вот обзор типов магнетизма, список магнитных материалов и взгляд на металлы, которые не магнитятся.
Типы магнетизма
Чтобы понять, какие металлы обладают магнитными свойствами, полезно рассмотреть пять типов магнетизма:
- Диамагнетизм : Все вещество диамагнитно, что означает, что оно слабо отталкивается магнитным полем. В магнитном материале притяжение к магниту превышает отталкивание от диамагнетизма.
- Парамагнетизм : Парамагнитный материал слабо притягивается к магнитному полю. Алюминий, кислород, оксид железа (FeO) и титан являются парамагнитными.
- Ферромагнетизм : Ферромагнитные материалы сильно притягиваются к магнитам и могут намагничиваться.
 Выше температуры, называемой точкой Кюри, ферромагнитные материалы теряют свой магнетизм. Железо, кобальт, никель, большинство их сплавов и некоторые соединения редкоземельных металлов являются ферромагнитными.
Выше температуры, называемой точкой Кюри, ферромагнитные материалы теряют свой магнетизм. Железо, кобальт, никель, большинство их сплавов и некоторые соединения редкоземельных металлов являются ферромагнитными. - Ферримагнетизм : Ферримагнетики притягиваются к магнитам и сами действуют как постоянные магниты. Выше точки Кюри ферримагнетики теряют свой внешний магнетизм. Магниты (минерал магнетит, Fe 3 O 4 ) являются ферримагнитными.
- Антиферромагнетизм : В антиферромагнетизме выравнивание соседних ионов при низких температурах делает материал нечувствительным к магнитному полю. Однако выше температуры, называемой температурой Нееля, некоторые атомы вырываются из выравнивания, и материал становится слабомагнитным. Оксид марганца (MnO) и чистый неодим являются примерами антиферромагнитных материалов.
Обычно, когда люди говорят о «магнитных металлах», они имеют в виду ферромагнитные и ферримагнитные металлы. Но, если вы включите условный и более слабый типы магнетизма, гораздо больше металлов (и некоторых неметаллов) являются магнитными.
Но, если вы включите условный и более слабый типы магнетизма, гораздо больше металлов (и некоторых неметаллов) являются магнитными.
Какие металлы обладают магнитными свойствами?
Магнитные металлы включают некоторые чистые металлические элементы и их сплавы. Here is a list of some of the most magnetic metals:
- Iron
- Nickel
- Cobalt
- Gadolinium
- Dysprosium
- Terbium
- Some types of steel (e.g., ferritic stainless steel)
- Neodymium, iron, сплав бора (магнит Nd)
Хотя и железо, и никель являются магнитными, не вся сталь является магнитной. Кристаллическая структура сплава определяет его магнетизм, поэтому элементы, обладающие магнитными свойствами сами по себе, не обязательно образуют магнитные сплавы.
Железо считается магнитным, но его поведение зависит от кристаллической структуры и температуры. Это α-форма, которая является ферромагнитной и только ниже точки Кюри 770 ° C. γ-железо антиферромагнитно.
γ-железо антиферромагнитно.
Рутений и актиноиды (например, плутоний, нептуний) при определенных условиях являются ферромагнитными.
Какой металл является самым сильным магнитом?
Самый сильный постоянный магнит из металла, который вы можете купить, — это неодимовый (Nd) магнит. Неодимовые магниты не являются чистым неодимом. Чистый элемент является парамагнитным при комнатной температуре и антиферромагнитным при очень низких температурах (20 К или -253,2 ° C). Неодимовые магниты представляют собой неодимовый сплав (Nd 2 Fe 14 B).
Магниты из неодимового сплава теряют свои магнитные свойства при более низких температурах. В этих условиях самариево-кобальтовые (SmCo) магниты являются самыми сильными магнитными металлами.
Какие металлы не магнитятся?
Подавляющее большинство металлов считаются «немагнитными». Точнее, большинство этих металлов являются парамагнитными.0010
 g., austenitic stainless steel, 304 stainless steel)
g., austenitic stainless steel, 304 stainless steel)Магнитное поведение зависит от условий. Например, металлическая медь и соли, содержащие ион Cu + , диамагнитны, а атомы меди и соли, содержащие ионы меди (Cu 2+ ), парамагнитны. Нержавеющая сталь 304 обычно не является магнитной, но становится частично ферромагнитной, если ее согнуть при комнатной температуре.
Являются ли какие-либо неметаллы магнитными?
Неметаллы обычно считаются немагнитными. Некоторые типы графита (аллотроп углерода) настолько диамагнетичны, что могут отталкивать сильный магнит так, что создается впечатление, что он левитирует.
