Опишите физическое свойство меди: а) меди; б) воды; в) соли.
Содержание
Физические и химические свойства драгоценного металла серебра
Серебро относится к числу редких элементов, которые образуют группу драгоценных или благородных металлов. К этой группе так же относится золото, платина и пять металлов платиновой группы.
Как и все благородные металлы, серебро в обычных условиях не подвержено воздействию воздуха, воды, а так же каких-либо других факторов, которые обычно приводят к быстрой коррозии и окислению «обычных» металлов. Кроме того, серебро достаточно редко встречается в земной коре и обладает еще рядом замечательных свойств, что относит его к разряду драгоценных металлов.
Физические свойства серебра
Чистое серебро представляет собой довольно тяжелый, блестящий металл белого цвета. По высказыванию Д.И. Менделеева в учебнике «Основы химии», серебро обладает наиболее «чистым» белым цветом среди всех металлов.
Серебро обладает замечательной отражающей способностью –около 95% в видимой части спектра, что является наибольшим среди металлов. Именно это свойство серебра люди использовали для изготовления зеркал. Наиболее древнее из обнаруженных зеркал было изготовлено из отполированного серебра около 5 тысяч лет назад. Стоили серебряные зеркала очень дорого и, естественно, позволить себе обладать ими могли только очень богатые люди. Более привычные нам стеклянные зеркала появились лишь около 600 лет назад.
Именно это свойство серебра люди использовали для изготовления зеркал. Наиболее древнее из обнаруженных зеркал было изготовлено из отполированного серебра около 5 тысяч лет назад. Стоили серебряные зеркала очень дорого и, естественно, позволить себе обладать ими могли только очень богатые люди. Более привычные нам стеклянные зеркала появились лишь около 600 лет назад.
Серебро является довольно тяжелым металлом, его плотность составляет 10,5 г/см3. Оно почти в два раза легче золота (19,32 г/см3), немного легче свинца (11,3 г/см3), но тяжелее меди (8,96 г/см3) и железа (7,87 г/см3).
Серебро обладает наибольшей теплопроводностью среди металлов. Поэтому следует аккуратно использовать серебряные столовые приборы с горячими блюдами. К примеру, серебряная чайная ложка в чашке с очень горячим чаем мгновенно нагревается и может даже стать причиной ожога.
Одним из главных свойств серебра является его уникальная электрическая проводимость. При температуре +20°С оно обладает наибольшей электропроводностью среди всех элементов.
Серебро плавится при температуре 961°С, которая является наименьшей среди всех драгоценных металлов. Поэтому серебро, как и золото с температурой плавления в 1063°С, люди научили обрабатывать плавкой с незапамятных времен. Температуры горения угля для этого было вполне достаточно.
Чистое серебро очень мягкий, ковкий и пластичный металл. По мягкости и ковкости серебро немного уступает золоту, но по пластичности (то есть способности менять форму под воздействием нагрузки не разрушаясь) превосходит золото. Эти качества обусловливают широкое применение серебра для изготовления ювелирных украшений.
Химические свойства серебра
Как и все благородные металлы, серебро является инертным металлом и в природе практически не вступает во взаимодействие с другими веществами. Однако, в ряду драгоценных металлов, серебро является наиболее реакционноспособным.
Серебро растворяется в азотной кислоте, в горячей концентрированной серной кислоте. В отличие от золота и платины, серебро не растворяется в царской водке из-за образования на поверхности металла защитной пленки из хлорида серебра.
В отличие от золота и платины, серебро не растворяется в царской водке из-за образования на поверхности металла защитной пленки из хлорида серебра.
Серебро легко растворяется в ртути, образуя амальгаму.
На что реагирует серебро в быту?
Наибольшее значение в быту имеет крайняя чувствительность серебра к воздействию сероводорода. Даже минимального его количества достаточно для образования на поверхности металла сульфида серебра. Обычно, именно соединения серы являются причиной потемнения серебряных изделий. Вокруг нас существует множество источников сероводорода, от продуктов питания до строительных материалов. Обоняние человека не может улавливать его минимальные концентрации (которые абсолютно безвредны), а серебро реагирует. Кроме того, соединения серы входят в состав пота и выделений кожных желез, поэтому серебро при ношении на теле обычно со временем темнеет, что является вполне нормальным явлением.
Серебро легко вступает в реакцию с галогенами, в частности с йодом, поэтому следует избегать контакта серебра с раствором йода, часто используемым в домашних условиях.
Серебро при нагревании хорошо адсорбирует газы — кислород, водород, аргон и другие. К примеру, твердое серебро может поглотить до 5 объемов О2 на 1 объем металла, а в жидком виде поглощает до 22 объемов О2. При застывании жидкого серебра может происходить любопытное явление — через верхнюю застывшую корку будет прорываться выделяющийся кислород, увлекая за собой частички расплавленного металла. В итоге образуется небольшой серебряный вулканчик.
Необычные соединения серебра
Поскольку из драгоценных металлов серебро обладает наибольшей способностью вступать в реакции, в настоящее время известно достаточно много различных соединений этого металла. Некоторые из них обладают весьма необычными свойствами. К примеру, йодид серебра AgI даже в минимальных количествах приводит к образованию очагов конденсации влаги в облаках, мгновенно вызывая выпадение дождя. Конденсацию образуют уже мельчайшие частицы AgI, поэтому для «разгона» дождевых облаков на значительной территории расходуется всего несколько грамм серебра и данный метод управления погодой экономически себя вполне оправдывает.
ВСЕ ЮВЕЛИРНЫЕ МЕТАЛЛЫ: КАТАЛОГ | ЮВЕЛИРНЫЕ МЕТАЛЛЫ — СПРАВОЧНИК | СЕРЕБРО — КАТАЛОГ
Всё о золоте | Все о серебре | Все о платине | Все о палладии
Серебряные сплавы и пробы | Мировые запасы серебра. Добыча серебра в мире
Поделитесь статьей с друзьями
Работы дизайнеров из каталога ЮВЕЛИРУМ
фенол, физические, химические свойства и применение фенола
Фенол (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Получение, производство фенола
В настоящее время производство фенола в промышленном масштабе осуществляется следующими способами способами:
Кумольный метод получение фенола
Кумольный метод. Этим способом получают более 95 % всего производимого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
Этим способом получают более 95 % всего производимого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
Окисление толуола, с промежуточным образованием бензойной кислоты
Около 3 % всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты.
Весь остальной фенол выделяют из каменноугольной смолы.
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Физические свойства
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов).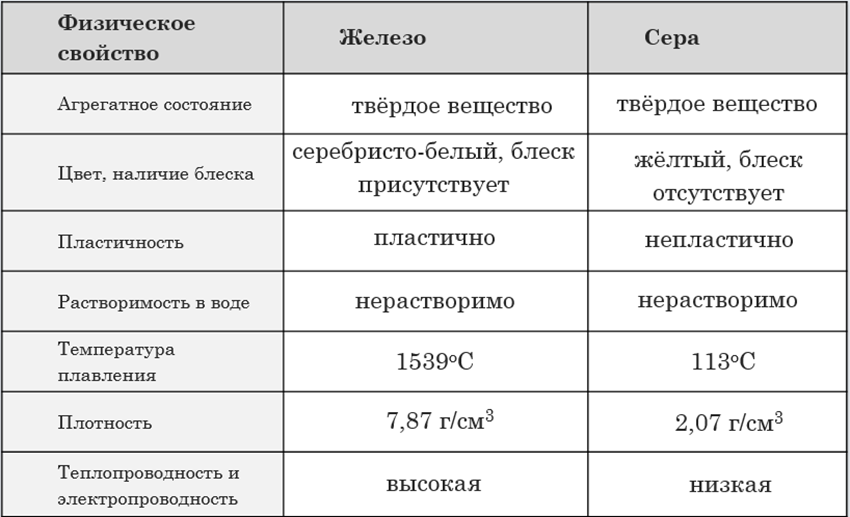 Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства
Из-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.
По гидроксильной группе:
Обладает слабыми кислотными свойствами (более сильными, чем у спиртов), при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa):
\mathsf{C_6H_5OH + NaOH \rightarrow C_6H_5ONa + H_2O}
Фенол — очень слабая кислота; даже угольная кислота вытесняет его из фенолятов:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+H_{2}CO_{3}\rightarrow C_{6}H_{5}OH+NaHCO_{3))))
Более интенсивно феноляты разлагаются под действием сильных кислот, например, серной:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+H_{2}SO_{4}\rightarrow C_{6}H_{5}OH+NaHSO_{4))))
Взаимодействие с металлическим натрием:
\mathsf{2C_6H_5OH + 2Na \rightarrow 2C_6H_5ONa + H_2\uparrow}
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+CH_{3}COCl\rightarrow C_{6}H_{5}OCOCH_{3}+NaCl))}
{\displaystyle {\mathsf {C_{6}H_{5}ONa+(CH_{3}CO)_{2}O\rightarrow C_{6}H_{5}OCOCH_{3}+CH_{3}COONa))}
Образование простых эфиров.

Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+CH_{3}I\rightarrow C_{6}H_{5}OCH_{3}+NaI))}
Во втором случае получают чисто-ароматические простые эфиры:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+C_{6}H_{5}Cl{\xrightarrow[{}]{Cu))C_{6}H_{5}OC_{6}H_{5}+NaCl))}
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом:
{\displaystyle {\mathsf {C_{6}H_{5}OH+Zn\rightarrow C_{6}H_{6}+ZnO))}
По ароматическому кольцу:
Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
{\displaystyle {\mathsf {C_{6}H_{5}OH+CO_{2}{\xrightarrow[{}]{NaOH))C_{6}H_{4}OH(COONa)))}
{\displaystyle {\mathsf {C_{6}H_{4}OH(COONa)+H_{2}SO_{4}\rightarrow C_{6}H_{4}OH(COOH)+NaHSO_{4))))
Взаимодействие с бромной водой (качественная реакция на фенол):
\mathsf{C_6H_5OH + 3Br_2 \rightarrow C_6H_2Br_3OH + 3HBr}
образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
\mathsf{C_6H_5OH + 3HNO_3 \rightarrow C_6H_2(NO_2)_3OH + 3H_2O}
Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
\mathsf{6C_6H_5OH + FeCl_3 \rightarrow [Fe(C_6H_5OH)_6]Cl_3}
Реакция присоединения
Гидрированием фенола в присутствии металлических катализаторов получают циклогексанол и циклогексанон:
{\displaystyle {\mathsf {2C_{6}H_{5}OH+5H_{2}{\xrightarrow {t,p,kat:Pt/Pd,Pd/Ni,Pd/Al_{2}O_{3},Ni/Cr/Al_{2}O_{3))}C_{6}H_{11}OH+C_{6}H_{10}O))}
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
{\displaystyle {\mathsf {C_{6}H_{5}OH+2H_{2}O_{2}{\xrightarrow[{-H_{2}O}]{kat:Fe))C_{6}H_{4}(OH)_{2))))
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Биологическая роль и значение
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
Ммировое потребление фенола имеет следующую структуру (данные 2006 г.):
44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных смол;
12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
в России большое количество фенола используется в нефтепереработке, в частности для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу;
остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство.
Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство.
Фенол и его производные обусловливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт» и «Фукорцин». В косметологии как химический пилинг (токсично).
в скотоводстве: дезинфекция животных растворами фенола и его производных.
в косметологии для проведения глубокого пилинга.
Токсические свойства
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Предельно допустимые концентрации (ПДК) фенола:
-
ПДКр.з. = 1 мг/м³ -
ПДКр. с. = 0,3 мг/м³
с. = 0,3 мг/м³ -
ПДКм.р. = 0,01 мг/м³ -
ПДКс.с. = 0,003 мг/м³ -
ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г[9].
Фенольная катастрофа в Уфе
Наглядный пример воздействия фенола на окружающую среду был продемонстрирован весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз.
Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз.
Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Было оповещено население Уфы об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек
1.3 Физические и химические свойства – CHEM 1114 – Введение в химию
Глава 1. Химия: экспериментальная наука
Цели обучения
К концу этого раздела вы сможете:
- Определять физические или химические свойства и изменения материи
- Определите свойства материи как экстенсивные или интенсивные
Напомним, что химия изучает материю, ее свойства, изменения, которые претерпевает материя, и энергию, связанную с этими изменениями. В этой главе мы более подробно рассмотрим материю и энергию и то, как они связаны.
В этой главе мы более подробно рассмотрим материю и энергию и то, как они связаны.
Когда вещество претерпевает изменение, процесс часто сопровождается изменением энергии — тепла, света, звука, кинетической энергии движущегося вещества и т. д. Если при изменении выделяется (выделяется) теплота, то изменение экзотермическое . Если необходимо подать тепло, изменение эндотермическое .
Важным отличием является то, что тепло — это энергия, которая течет из-за разницы температур, а температура — это мера средней кинетической энергии молекул в веществе. Чем быстрее они двигаются, тем «горячее».
Характеристики, которые позволяют нам отличить одно вещество от другого, называются свойствами. Физическое свойство — характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. А физическое изменение — это изменение состояния (рисунок 1) или свойств материи без какого-либо сопутствующего изменения ее химического состава (тождественности веществ, содержащихся в материи), таких как растворение и разбавление.
Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. А физическое изменение — это изменение состояния (рисунок 1) или свойств материи без какого-либо сопутствующего изменения ее химического состава (тождественности веществ, содержащихся в материи), таких как растворение и разбавление.
Рисунок 1. Различные фазовые изменения, которым может подвергаться материя.
Мы наблюдаем физические изменения, когда воск плавится, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 2). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Рисунок 2. (a) Воск претерпевает физические изменения при нагревании твердого воска и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
Преобразование одного типа материи в другой тип (или невозможность изменения) относится к химическому веществу . свойство . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 3). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рис. 3. (a) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает. (кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 4).
4).
Рисунок 4. (a) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Пример 1
Классифицируйте каждое из следующих свойств как физическое или химическое свойство:
a) Точка кипения воды составляет 100 o C
b) Кислород представляет собой газ
c) Сахар сбраживается с образованием спирта
Решение
а) Хотя это свойство описывает изменение, это изменение не влечет за собой изменение существа. H 2 O остается H 2 O, несмотря на то, в каком состоянии он находится. Таким образом, это физическое свойство.
H 2 O остается H 2 O, несмотря на то, в каком состоянии он находится. Таким образом, это физическое свойство.
b) Это неотъемлемое свойство и, следовательно, физическое свойство.
c) Это свойство связано с изменением вещества с сахара на спирт. Это химическое свойство.
Проверьте себя
Классифицируйте каждое из следующих свойств как физическое или химическое:
вых
Ответы
а) физическое свойство б) химическое свойство в) химическое свойство
Свойства материи попадают в одну из двух категорий. Если свойство зависит от количества присутствующей материи, то это экстенсивное свойство . Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца материи не зависит от количества присутствующей материи, то это интенсивное свойство . Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство образца материи не зависит от количества присутствующей материи, то это интенсивное свойство . Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Пример 2
Классифицируйте каждое из следующих явлений как физическое или химическое изменение:
a) Конденсация пара на зеркале в душе
b) Железообразующая ржавчина
c) Таблетка антацида шипит при контакте с желудком кислота
d) Соль растворяется в воде
Раствор
а) Пар представляет собой водяной пар, и когда он конденсируется, он образует жидкую воду на зеркале.
Это физическое изменение.
б) Железо реагирует с кислородом воздуха, образуя оксид железа, который представляет собой ржавчину.
Это химическое изменение.
c) Шипение в воде – это выделение углекислого газа при контакте с кислотой. Это химическое изменение.
d) Растворение считается физическим изменением. Хотя связи соли при растворении разрываются, они не образуют новых связей или нового вещества. Если выпарить воду, останется соль.
Проверьте себя
Классифицируйте каждое из следующих явлений как физическое или химическое:
высокие температуры
d) Серебро со временем тускнеет
Ответы
г) химическое изменение
Пример 3
Опишите каждый процесс как физическое или химическое изменение.
а) Вода в воздухе превращается в снег.
б) Человеку подстригли волосы.
c) Тесто для хлеба превращается в свежий хлеб в духовке.
Решение
а) Поскольку вода переходит из газовой фазы в твердую, это физическое изменение.
б) Ваши длинные волосы укорачиваются. Это физическое изменение.
c) Из-за температуры в духовке в тесте для хлеба происходят химические изменения, необходимые для приготовления свежего хлеба. Это химические изменения. (На самом деле во многих процессах приготовления пищи происходят химические изменения.)
Проверьте себя
Определите каждый процесс как физическое или химическое изменение.
а) В камине бушует огонь.
б) Вода нагревается для приготовления чашки кофе.
Ответы
а) химическое изменение б) физическое изменение
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 5, на контейнерах химических веществ в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Рисунок 5. Алмаз опасности Национального агентства по противопожарной защите (NFPA) обобщает основные опасности химического вещества.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Разложение воды / Производство водорода
Вода состоит из элементов водорода и кислорода, соединенных в соотношении 2:1. Вода может подвергаться химическому изменению, в ходе которого молекулы воды расщепляются на водород и кислородные газы за счет добавления энергии. Один из способов сделать это — использовать батарею или блок питания, как показано на (Рисунок 6).
Рисунок 6. Разложение воды показано на макроскопическом, микроскопическом и символическом уровнях. Батарея обеспечивает электрический ток (микроскопический), который разлагает воду. На макроскопическом уровне жидкость разделяется на газы водород (слева) и кислород (справа). Символически это изменение представлено тем, что показано, как жидкий H 2 O разделяется на газы H 2 и O 2 .
Расщепление воды включает перегруппировку атомов в молекулах воды в разные молекулы, каждая из которых состоит из двух атомов водорода и двух атомов кислорода соответственно. Две молекулы воды образуют одну молекулу кислорода и две молекулы водорода. Представление того, что происходит, [латекс]2\текст{H}_2\текст{O}(l) \rightarrow 2\text{H}_2(g) + \text{O}_2(g)[/latex] , будут более подробно рассмотрены в последующих главах.
Две молекулы воды образуют одну молекулу кислорода и две молекулы водорода. Представление того, что происходит, [латекс]2\текст{H}_2\текст{O}(l) \rightarrow 2\text{H}_2(g) + \text{O}_2(g)[/latex] , будут более подробно рассмотрены в последующих главах.
Два образовавшихся газа имеют совершенно разные свойства. Кислород не воспламеняется, но необходим для сгорания топлива, а водород легко воспламеняется и является мощным источником энергии. Как эти знания можно применить в нашем мире? Одно приложение включает исследования в области более экономичного транспорта. Автомобили на топливных элементах (FCV) работают на водороде вместо бензина (рис. 7). Они более эффективны, чем автомобили с двигателями внутреннего сгорания, не загрязняют окружающую среду и сокращают выбросы парниковых газов, что делает нас менее зависимыми от ископаемого топлива. Однако FCV еще не являются экономически жизнеспособными, и текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производства водорода другим экологически безопасным способом, FCV могут стать способом будущего.
Рисунок 7. Топливный элемент вырабатывает электроэнергию из водорода и кислорода посредством электрохимического процесса и производит только воду в качестве отходов.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы со сходными свойствами расположены близко друг к другу (рис. 6). Вы узнаете больше о периодической таблице, когда продолжите изучение химии.
Рисунок 6. Периодическая таблица показывает, как элементы могут быть сгруппированы в соответствии с некоторыми сходными свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.
Периодическая таблица показывает, как элементы могут быть сгруппированы в соответствии с некоторыми сходными свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.
Ключевые понятия и резюме
Все вещества обладают различными физическими и химическими свойствами и могут подвергаться физическим или химическим изменениям. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, связаны с образованием вещества, отличного от того, что было ранее.
Измеряемые свойства попадают в одну из двух категорий. Экстенсивные свойства зависят от количества присутствующего вещества, например, массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотность золота. Теплота — пример экстенсивного свойства, а температура — пример интенсивного свойства.
Интенсивные свойства не зависят от количества присутствующего вещества, например, плотность золота. Теплота — пример экстенсивного свойства, а температура — пример интенсивного свойства.
Упражнения
1. Классифицируйте каждое из следующих изменений как физическое или химическое:
а) конденсация пара
б) сжигание бензина
в) скисание молока
г) растворение сахара в воде
9000 2 е ) плавление золота
2. Объем образца газообразного кислорода изменялся с 10 мл до 11 мл при изменении температуры. Это химическое или физическое изменение?
3. Объясните разницу между экстенсивными и интенсивными свойствами.
4. Плотность (d) вещества – интенсивное свойство, определяемое как отношение его массы (m) к его объему (V).
[латекс]\text{плотность}= \frac{\text{масса}}{\text{объем}}[/latex] [латекс]\text{d} = \frac{\text{m}}{ \text{V}}[/latex]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
5. Представляет ли каждое утверждение физическое или химическое свойство?
а) Сера желтая.
b) Стальная вата горит при воспламенении от пламени.
c) Галлон молока весит более восьми фунтов.
6. Представляет ли каждое утверждение физическое или химическое свойство?
а) Куча листьев медленно гниет на заднем дворе.
b) В присутствии кислорода водород может взаимодействовать с образованием воды.
c) Золото можно растянуть в очень тонкую проволоку.
7. Представляет ли каждое утверждение физическое или химическое изменение?
а) Вода закипает и превращается в пар.
b) Пища преобразуется в пригодную для употребления форму пищеварительной системой.
c) Спирт во многих термометрах замерзает при температуре около -40 градусов по Фаренгейту.
8. Представляет ли каждое утверждение физическое или химическое изменение?
а) Графит, форма элементарного углерода, может быть превращен в алмаз, другую форму углерода, при очень высоких температурах и давлениях.
b) Элементы натрия и хлора объединяются, чтобы создать новое вещество, называемое хлоридом натрия.
Ответы
1. а) физический; б) химическая; в) химический; г) физические; д) физическое
2. физическое
3. Значение экстенсивного свойства зависит от количества рассматриваемой материи, тогда как значение интенсивного свойства одинаково, независимо от количества рассматриваемой материи.
4. Будучи экстенсивными свойствами, масса и объем прямо пропорциональны количеству изучаемого вещества. Деление одного экстенсивного свойства на другое фактически «отменит» эту зависимость от количества, дав отношение, не зависящее от количества (интенсивное свойство).
5. а) физическое свойство б) химическое свойство в) физическое свойство
6. а) химическое свойство б) химическое свойство в) физическое свойство
7. а) физическое изменение б) химическое изменение в) физическое изменение 90 005
8. а) физическое изменение б) химическое изменение
Глоссарий
химическое изменение: изменение, приводящее к образованию вещества, отличного от исходного
химическое свойство: поведение, связанное с превращением одного вида материи в другую материю
эндотермическое: если требуется подвод тепла, чтобы произошло изменение
энергия: способность выполнять «работу», то есть сила воздействовать на что-то и толкать на некоторое расстояние
экзотермический: , если при изменении выделяется тепло
экстенсивное свойство: свойство вещества, которое зависит от количества вещества
интенсивное свойство: свойство вещества, которое не зависит от количества вещества
физическое изменение: изменение состояния или свойств материи, не связанное с изменением ее химического состава
физическое свойство: характеристика вещества, не связанная с каким-либо изменением его химического состава
Изменения в материи: физические и химические изменения
Материя способна претерпевать изменения, которые классифицируются как физические или химические. Физические изменения в материи часто обратимы: кубик льда может превратиться в жидкую воду, а затем жидкая вода может снова превратиться в кубик льда. Химические изменения, с другой стороны, необратимы: полено, сожженное в огне, превращается в пепел, но пепел нельзя превратить обратно в полено.
Физические изменения в материи часто обратимы: кубик льда может превратиться в жидкую воду, а затем жидкая вода может снова превратиться в кубик льда. Химические изменения, с другой стороны, необратимы: полено, сожженное в огне, превращается в пепел, но пепел нельзя превратить обратно в полено.
Что такое физическое изменение?
При физическом изменении материал, участвующий в изменении, структурно одинаков до и после изменения. Видами некоторых физических изменений являются текстура, форма, температура и изменение состояния вещества. Изменение текстуры вещества — это изменение его ощущений. Например, деревянный брусок может казаться шероховатым, когда вы проводите по нему пальцем, но трение дерева наждачной бумагой сглаживает поверхность, и она больше не кажется шероховатой. Сама древесина не изменилась во время шлифовки, чтобы стать новым материалом, изменилась только текстура поверхности. Кусок металла можно нагреть в огне до тех пор, пока он не загорится, но металл остается одним и тем же материалом до нагревания и после охлаждения. Точно так же, когда материал меняет фазу, он меняется только физически; субстанция все та же. Представьте, что лед тает в воду, а затем вода нагревается и превращается в пар. Химическая структура воды одинакова, будь то твердое тело (лед), жидкость или газ (пар).
Точно так же, когда материал меняет фазу, он меняется только физически; субстанция все та же. Представьте, что лед тает в воду, а затем вода нагревается и превращается в пар. Химическая структура воды одинакова, будь то твердое тело (лед), жидкость или газ (пар).
Что такое химическое изменение?
Химическое изменение происходит при изменении состава вещества, что требует разрыва и образования химических связей в ходе химической реакции. Это приводит к перегруппировке атомов в веществах с образованием продуктов химической реакции, которые представляют собой совершенно новые молекулы, которые нельзя легко вернуть обратно в исходное состояние.
Иногда трудно определить, произошла ли химическая реакция. Чтобы определить, была ли реакция, химики рассматривают основные индикаторы того, что реакция произошла, такие как изменение температуры, изменение цвета, появление запаха, образование осадка или образование осадка. газ.
При химическом изменении изменение температуры происходит в результате разрыва или образования химических связей. Когда химические связи реагентов разрываются, иногда высвобождается избыточная энергия, что приводит к выделению тепла и повышению температуры. В качестве альтернативы, для протекания реакции может потребоваться энергия из окружающей среды, что приводит к поглощению тепла и снижению температуры. Сжигание древесины является примером реакции, при которой избыточная энергия выделяется в виде тепла. Химический холодный пакет в аптечке является примером химической реакции, которая поглощает тепловую энергию, что приводит к охлаждению.
Когда химические связи реагентов разрываются, иногда высвобождается избыточная энергия, что приводит к выделению тепла и повышению температуры. В качестве альтернативы, для протекания реакции может потребоваться энергия из окружающей среды, что приводит к поглощению тепла и снижению температуры. Сжигание древесины является примером реакции, при которой избыточная энергия выделяется в виде тепла. Химический холодный пакет в аптечке является примером химической реакции, которая поглощает тепловую энергию, что приводит к охлаждению.
Пример изменения цвета, сигнализирующего о химической реакции, можно наблюдать, когда железо реагирует с кислородом с образованием оксида железа, например, когда железный гвоздь остается снаружи, и на нем появляется красновато-коричневая ржавчина.
Гниющая пища является примером появления запаха в результате химического изменения. Когда пища не хранится слишком долго или срок ее годности подходит к концу, она в конечном итоге портится, часто издавая неприятный запах в гнилом состоянии. Это происходит из-за химических реакций, происходящих по мере того, как пища начинает разлагаться и портиться, что приводит к образованию новых веществ, связанных с ними уникальными запахами.
Это происходит из-за химических реакций, происходящих по мере того, как пища начинает разлагаться и портиться, что приводит к образованию новых веществ, связанных с ними уникальными запахами.
Другим распространенным признаком химической реакции является образование осадка. Это происходит, когда химические вещества, растворенные в растворе, смешиваются друг с другом, и в жидкой смеси образуется нерастворимое твердое вещество, известное как осадок. Создание нового твердого вещества из двух жидких веществ указывает на то, что произошла реакция, которая изменила исходные вещества.
Распространенной химической реакцией является смешивание уксуса и пищевой соды. При смешивании этих двух бытовых химикатов сразу начинает пузыриться и пениться. Пузырьки — это выделение углекислого газа, продукта химической реакции между пищевой содой и уксусом.
Помните, что часто одним из способов отличить физическую реакцию от химической является то, что химическую реакцию нельзя легко обратить вспять, если вообще можно.
Химическое или физическое изменение?
Иногда трудно определить, является ли изменение физическим или химическим. Например, подумайте о растворении поваренной соли (хлорида натрия) в жидкой воде. Твердая поваренная соль добавляется в воду и исчезает. Это растворение легко идентифицировать как физическое изменение, потому что, если воде позволить испариться, соль останется после того, как вся вода испарится, то есть она не будет постоянно изменена. Однако поваренная соль является ионным соединением. Ионы — это отрицательно или положительно заряженные атомы или молекулы (из-за потери или приобретения электрона). Когда ионные соединения добавляются в воду, они диссоциируют или распадаются на ионы. В случае поваренной соли она диссоциирует в воде на ионы натрия (положительные) и ионы хлора (отрицательные), что, по-видимому, является химическим изменением. Однако ученые не считают это химическим изменением, поскольку твердая поваренная соль остается после испарения воды. Поваренная соль диссоциировала, но после удаления воды атомы воссоединяются в том же порядке.
Поваренная соль диссоциировала, но после удаления воды атомы воссоединяются в том же порядке.
Другим примером изменения, которое трудно идентифицировать как физическое или химическое, является случай, когда два или более металлов смешиваются вместе при расплавлении с образованием сплава; сплав — это металл, свойства которого отличаются от свойств металлов, которые были смешаны вместе для его изготовления. Распространенным сплавом является латунь, которую можно найти в декоративных петлях и ручках, а также в музыкальных инструментах, таких как трубы, тромбоны и саксофоны. Латунь состоит примерно из 60 процентов меди и 40 процентов цинка, но свойства латуни отличаются от свойств меди или цинка. Однако, несмотря на то, что свойства латуни отличаются от свойств меди и цинка, латунь не производится в результате химической реакции. Атомы меди и цинка находятся в латуни, но химически не связаны друг с другом. В результате латунь представляет собой физическое изменение, а не химическое изменение.
