Скорость коррозии мм год: Скорость коррозии металла | corrosio.ru
Содержание
Перевод единиц скоростей равномерной коррозии / износа поверхности. Плотность тока (А/м2) эквивалентная скорости коррозии 1 г/(м2*сут) для некоторых реакций.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление
| Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Инженерное ремесло/ / Защита от воздействия окружающей среды. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коррозионная стойкость нержавеющих сталей, сплавов и чистых металлов :: Книги по металлургии
УСЛОВИЯ ПОВЫШЕНИЯ КОРРОЗИОННОЙ СТОЙКОСТИ, ВИДЫ КОРРОЗИИ И ОБЛАСТИ ПРИМЕНЕНИЯ СТАЛЕЙ И СПЛАВОВ
Высокая коррозионная стойкость сталей и сплавов основана на явлении пассивности [7, 8, 9, 123, 335], открытом еще в 1738 г. нашим знаменитым соотечественником Михаилом Васильевичем Ломоносовым [35].
Большой вклад в изучение явления пассивности внесли наши ученые Н. А. Изгарышев, В. А. Кистяковский, Г. В. Акимов, Н. Д. Томашов и др.
Пассивность металлов до настоящего времени широко и всесторонне исследуется.
Пассивность — состояние высокой коррозионной стойкости металла или сплава (в условиях, когда с термодинамической точки зрения они являются вполне рслкциопиосиособными), вызванное избирательным торможением анодного процесса [121].
Коррозионностойкие стали хорошо пассивируются не только в азотной (Кислоте, но и в других реагентах, представляющих сильные окислители.
Пассивирующим агентом является также кислород воздуха.
Пассивность коррозионностойких сталей зависит от содержания хрома как основного легирующего элемента. Наименьшее содержание хрома, обеспечивающее сталям пассивное состояние, составляет 12 %.
С увеличением содержания хрома коррозионная стойкость сталей в окислительных средах резко возрастает.
Явление пассивности металлов обычно объясняют воздействием окислительной среды, однако известно, что некоторые металлы очень энергично пассивируются и в неокислительных средах, например молибден в НСl. Поэтому не случайно, что в средах, содержащих хлор-ион, для уменьшения точечной коррозии и повышения общей стойкости следует применять коррозионностойкие стали, в состав которых входит молибден.
В морской воде и в восстановительных средах (сернистая, фтористоводородная, муравьиная, щавелевая кислоты) применяют стали 08Х21Н6М2Т, 10Х17Н13М2Т, 10Х17НЗМЗТ и др. коррозионная стойкость которых значительно выше, чем сталей аналогичного состава, не содержащих молибдена..
коррозионная стойкость которых значительно выше, чем сталей аналогичного состава, не содержащих молибдена..
Для придания высокой коррозионной стойкости в ряде случаев стали легируют не только хромом, никелем и молибденом, но также медью, ниобием и другими элементами.
На рис. 5 показано влияние легирующих элементов на коррозионную стойкость сталей в серной кислоте. Сталь Х18Н10 в серной кислоте при комнатной температуре в интервале почти всех концентраций является нестойкой. В стали 20Х23Н18 (рис. 5,6), где содержание хрома и никеля больше, чем в стали Х18Н10, диапазон стойкости значительно больше. Никель, хотя и в значительно меньшей степени, чем хром, повышает пассивируемость стали вследствие торможения анодного процесса растворения и практически не оказывает влияния на катодную реакцию водородной деполяризации. На рис. 5, β и г показано, что и другие легирующие элементы, например медь и молибден, также способствуют еще большему повышению коррозионной стойкости стали. Примером такой стали, содержащей медь и молибден, служит сталь 06ХН28МДТ (см. рис. 5, г), предназначенная для работы в условиях производства серной кислоты и других сернокислотных сред.
Примером такой стали, содержащей медь и молибден, служит сталь 06ХН28МДТ (см. рис. 5, г), предназначенная для работы в условиях производства серной кислоты и других сернокислотных сред.
Механизм защитного действия меди и молибдена в сплаве 06ХН28МДТ сводится к следующему: медь уменьшает площадь анодных участков в результате накопления ее в поверхностном слое. Это происходит в области анодного растворения, где в результате электрохимической реакции обмена медь переходит из раствора, осаждаясь на поверхность стали и создавая таким образом защитный экранирующий слой.
Молибден, по-видимому, также накапливается в поверхностном слое стали, так как скорость коррозии его при потенциалах, характерных для активного состояния стали, очень мала и обусловлена высокой химической стойкостью поверхностной пленки, которая не восстанавливается на катоде.
Для исследования механизма пассивности и кинетики процессов, протекающих при пассивации, используют потенциостатический метод.
Сущность метода заключается в определении скорости коррозии растворения металла при заданном, поддерживаемом постоянным значении потенциала и установлении зависимости скорости растворения металла от потенциала в широкой области его значений.
Причина, вызывающая точечную коррозию в коррозионно-стойких сталях, связана с местным нарушением пассивности металла, которое возникает в средах, содержащих в основном хлор-ион. Развитию точечной коррозии способствуют дефекты стали (плены, раковины, трещины, неметаллические включения и т. п.), а также наличие на поверхности металла остатков неудаленной окалины или ржавчины.
Этот вид коррозии наблюдают также на стали Х18Н10Т в минеральных водах. В источнике № 6 Тбилисского месторождения она равна 0,06 г/(м2-ч), а глубина местного поражения за 6 мес составляет 0,16 мм.
Хромистая коррозионностойкая сталь Х13 в этих же условиях корродирует со скоростью 0,031 г/(м2-ч), а глубина местного поражения за тот же период испытания достигает 0,24 мм.
В процессе получения метакриловой кислоты [91] коррозионностойкие стали и сплавы подвергаются точечной коррозии. Причем скорость коррозии в углублениях в пересчете на год работы аппарата составляет для стали 12Х18Н10Т 0,32—2,16, 08Х22Н5Т 0,54—2,34 и 10Х17Н13М2Т 2,4 мм/год. Сплав 06ХН28МДТ в этих условиях корродирует равномерно и незначительно (0,0005 мм/год).
В тех случаях, когда металл не подвержен точечной коррозии и аппаратура предназначена для получения технических продуктов, т. е. не требующих химической чистоты, можно применять стали с баллом 6 по коррозионной стойкости.
|
Коррозионный износ Категория: Ремонт оборудования предприятий молочной промышленности Коррозионный износ Коррозия — это процесс Химическая коррозия. В сухих газах при высоких температурах или в неэлектролитах (бензин, керосин, масло) металл вступает в химическую реакцию с внешней средой, в результате на поверхности металла образуется окисная пленка и он начинает разрушаться. В одних случаях (у стали и чугуна) окисная пленка непрочная, и коррозия распространяется в металл. Электрохимическая коррозия. В результате взаимодействия металла с электролитами (растворы солей, кислот, щелочей), т.е. жидкостями, проводящими электрический ток, происходит электрохимическая коррозия. Металлы в молочной промышленности подвергаются значительной коррозии, так как на производстве широко используют такие электролиты, как щелочные и кислотные моющие растворы, раствор хлористого кальция (рассол) и др. Способствует коррозии металлов их контакт с молочными продуктами, содержащими молочную кислоту, а также образование конденсата на поверхностях трубопроводов, по которым транспортируются жидкости температурой ниже температуры цеха (холодная вода, молоко и т.д.). При взаимодействии металла с электролитом образуются микрогальванические элементы. Часто встречается атмосферная коррозия при увлажнении поверхностей металла. Скорость ее возрастает с увеличением влажности воздуха (выше 60—70%) и его загрязненности частицами угля, золы и особенно S02 (в котельных). По характеру коррозионных разрушений поверхности различают коррозию равномерную (поверхностную), местную и межкристаллитную. Защита от коррозии. Борьба с коррозией ведется по следующим направлениям: воздействие на состав металла и среды, электрохимическая защита, конструктивные меры и применение защитных (антикоррозийных) покрытий. Воздействие на состав металла производят путем добавления в него компонентов, повышающих коррозионную стойкость (для железа — медь и хром), или повышения степени очистки металла (алюминий). Воздействие на состав среды применяют в том случае, когда среда заключена в сравнительно небольшом объеме. Например, воду для питания паровых котлов освобождают от кислорода, нагревая ее при пониженном давлении в специальных устройствах деаэраторах. Для замедления скорости коррозии добавляют ингибиторы (замедлители, пассиваторы), частицы которых на поверхности металлов создают тонкие защитные пленки, препятствующие реакции металла с агрессивной средой. При использовании ингибиторов необходимо учитывать агрессивность среды и металла. Электрохимическая (протекторная) защита основана на том, что при контакте двух различных металлов в электролите металл с более низким электродным потенциалом (протектор), разрушаясь, защищает от разрушения металл с более высоким потенциалом. Конструктивные меры заключаются в том, что недопускают взаимных контактов металлов, способных вызвать коррозию (например, алюминия с медью или латунью). Применение защитных покрытий получило наибольшее распространение из всех способов борьбы с коррозией металлов. Наносят металлические покрытия гальваническим, меха-нотермическим или другими способами. Гальваническим способом на поверхность металлического изделия наносят тонкий слой (0,005—0,030 мм) защитного металла (хром, никель, олово, цинк, кадмий и др.) из раствора его соли при помощи электролиза. В этом случае обеспечивается равномерность и плотность покрытия, экономный расход цветных металлов, возможность регулирования толщины защитного слоя. Механотермический способ (плакирование)—покрытие одного металла другим в результате их совместной горячей прокатки. Способ набрызгивания (металлизация) состоит в нанесении на деталь расплавленного металла струей сжатого воздуха специальным аппаратом-металлизатором. Диффузионный способ основан на диффузии различных элементов (металлов) в поверхностные слои детали при высокой температуре. При горячем способе защиты детали погружают в ванну с расплавленным металлом (цинком, оловом, свинцом) или наносят защитный металл либо его порошок на предварительно нагретую деталь. Неметаллические покрытия разделяют на лакокрасочные, эмали, смазки, окисные защитные пленки. Лакокрасочные покрытия наносят и закрепляют на поверхности детали. Пленка состоит из раствора красителей (пигментов) в органических пленкообразующих веществах (растительное масло, лаки, смолы и др.). Лакокрасочные покрытия дешевле металлических, легко восстанавливаются при износе. Эмали —это нерастворимые силикаты типа стекла (стеклообразующие сплавы). Эмалевые покрытия применяют для защиты внутренних поверхностей емкостей для хранения молока, вакуум-аппаратов, трубопроводов для молока и тары. В качестве антикоррозийных покрытий металлических изделий при их хранении и транспортировке применяют смазки. Реклама:Читать далее:Основы гидродинамической теории смазки
Статьи по теме:
Главная → Справочник → Статьи → Блог → Форум
|
|
|
Скорость коррозии | Американская ассоциация гальванистов
Дом »
Коррозия »
Процесс коррозии металла »
Скорость коррозии
Приблизительно 85% всей производимой стали представляет собой углеродистую сталь и поэтому подвержена естественному окислению и гальванической коррозии. Скорость коррозии хорошо известна в типичных атмосферных условиях, но инженер-конструктор должен хорошо понимать точные локальные условия или условия микроокружения, чтобы быть уверенным в конечной долговечности конструкции. Другие микросреды включают воздействие пресной и соленой воды (в или очень близко) или в почве.
Скорость коррозии хорошо известна в типичных атмосферных условиях, но инженер-конструктор должен хорошо понимать точные локальные условия или условия микроокружения, чтобы быть уверенным в конечной долговечности конструкции. Другие микросреды включают воздействие пресной и соленой воды (в или очень близко) или в почве.
Коррозия углеродистой стали и даже легированных сталей в микросреде может быть очень сложной. Например, pH, содержание влаги и уровень хлоридов — это всего лишь три переменных, определяющих скорость коррозии оцинкованной стали в почве.
Карты коррозии трудно разработать из-за множества переменных, присутствующих в любой данной микросреде. Например, коррозия в воде должна учитывать такие факторы, как содержание кислорода, степень волнения, воздействие волн, температура, уровень хлоридов и многое другое. Это делает разработку диаграммы, предсказывающей скорость коррозии для любого конкретного места, обширной и иногда дорогостоящей, и поэтому существует множество диаграмм скорости коррозии, но только для уникальных мест и условий.
Немного подробнее о скорости коррозии стали в различных средах.
Атмосферный
Наиболее распространенной средой для коррозии металлов является атмосферный воздух. Когда сталь, медь, магний, алюминий и др. подвергаются воздействию атмосферы, они вступают в реакцию со свободно текущим воздухом и влагой с образованием оксидов. Характеристики металлов, подвергающихся воздействию атмосферы, зависят от пяти основных факторов: температуры, влажности, количества осадков, концентрации диоксида серы (загрязнения) в воздухе и солености воздуха. Ни один из этих факторов нельзя выделить в качестве основного фактора коррозии. Были проведены обширные исследования этих металлов, и для каждого доступна предсказуемая скорость коррозии.
Коррозия углеродистой стали возникает при относительной влажности воздуха от 70% до 80% и температуре воздуха выше 32 F. Скорость коррозии может быть ускорена примесями воздуха, которые растворяются в конденсированной воде или дождевой воде, а также пылью и грязью. оседание на металлическую поверхность.
оседание на металлическую поверхность.
Общие скорости коррозии углеродистой стали в различных атмосферах, и следует отметить, что скорости коррозии в микросредах могут значительно превышать эти скорости коррозии.
В почве
Сталь в почве подвергается ряду коррозионных воздействий, совершенно не похожих на те, которые испытываются в атмосферных условиях, и характеристики стали в земле не так хорошо изучены, как долговечность в наземных условиях. Поскольку в Северной Америке выявлено более 200 различных типов почв, скорость коррозии в почвах различна и ее трудно предсказать. Для коррозии стали требуются кислород, влага и присутствие растворенных солей. Если какой-либо из них отсутствует, коррозионная реакция прекратится или будет протекать очень медленно. Сталь быстро корродирует в кислой среде и медленно или совсем не корродирует при увеличении щелочности. Скорость коррозии стали в почве может варьироваться от менее 0,2 микрон в год в благоприятных условиях до 20 микрон в год и более в очень агрессивных почвах.
Коррозия металлов в почве чрезвычайно изменчива, и хотя почвенная среда сложна, можно сделать некоторые обобщения о типах почвы и коррозии. Основными факторами, определяющими коррозионную активность почвы, являются влажность, уровень pH и хлориды. На эти почвенные условия влияют дополнительные характеристики, такие как аэрация, температура, удельное сопротивление и текстура или размер частиц. Любая почва представляет собой очень неоднородный материал, состоящий из трех фаз: твердой, газообразной и водной.
Твердая фаза состоит из частиц почвы, которые различаются по размеру, химическому составу и уровню вовлеченного органического материала. Твердая фаза почв классифицируется по среднему размеру частиц и химическому составу. Традиционно частицы от 0,07 мм до 2 мм считаются песком, частицы от 0,0005 мм до 0,07 мм — илами, а 0,005 мм и меньше — глинами. Из-за меньшего размера частиц и их способности легко поглощать воду глинистые почвы имеют более высокую скорость коррозии, чем песчаные почвы.
Газообразная фаза состоит из воздуха, вовлеченного в поры почвы. Доступ газа (воздуха) в почву зависит от ее водопроницаемости. Более сухие почвы или более крупнозернистые почвы обеспечат больший доступ кислорода к недрам и увеличат скорость коррозии стали по сравнению с областями с меньшим содержанием кислорода.
Водная фаза, или почвенная влага, является средством, способствующим развитию коррозии. Относительная кислотность водного раствора является наиболее важным фактором скорости коррозии. При низком pH выделение водорода имеет тенденцию исключать возможность образования защитной пленки, поэтому коррозия стали продолжается, но в щелочных растворах образуются защитные пленки и снижают скорость коррозии. Чем выше щелочность, тем медленнее становится скорость атаки. В нейтральных растворах другие факторы, такие как аэрация, становятся более важными, поэтому делать обобщения труднее.
Менее распространенной средой для металла является погружение в воду или воздействие воды. Влага вызывает сильную коррозию большинства металлов, включая сталь, алюминий и цинк. Существует множество различных типов воды (чистая вода, природная пресная вода, питьевая вода (очищенная питьевая вода) и морская вода), и каждый из них имеет различные механизмы, определяющие скорость коррозии. Параметры, влияющие на коррозию металлов в воде, включают уровень pH, содержание кислорода, температуру воды, волнение, наличие ингибиторов и приливные условия.
Влага вызывает сильную коррозию большинства металлов, включая сталь, алюминий и цинк. Существует множество различных типов воды (чистая вода, природная пресная вода, питьевая вода (очищенная питьевая вода) и морская вода), и каждый из них имеет различные механизмы, определяющие скорость коррозии. Параметры, влияющие на коррозию металлов в воде, включают уровень pH, содержание кислорода, температуру воды, волнение, наличие ингибиторов и приливные условия.
Береговые зоны морской коррозии включают доки, гавани, военно-морские верфи, где могут использоваться расходуемые аноды, обеспечивающие катодную защиту, а также защитные покрытия, такие как судовые краски и цинкование. Морские нефтяные и газовые платформы подвергаются особенно агрессивной коррозии от брызг морской соли и погружения.
Трубопровод
В зависимости от характера перевозимого продукта, условий воздействия, условий эксплуатации (24 часа в сутки, 7 дней в неделю по сравнению со спорадическими) и необходимости технического обслуживания коррозия трубопровода может означать срок полезного использования от одного года до более 50 лет. Северная Америка стоимость коррозии трубопровода составляет приблизительно 9 долларов США.миллиардов в год, при этом 10 % приходится на затраты в связи с отказом, 38 % — на требования к капиталу и 52 % — на эксплуатацию и техническое обслуживание.
Северная Америка стоимость коррозии трубопровода составляет приблизительно 9 долларов США.миллиардов в год, при этом 10 % приходится на затраты в связи с отказом, 38 % — на требования к капиталу и 52 % — на эксплуатацию и техническое обслуживание.
Несмотря на то, что инвестиции в технологии и оборудование для мониторинга значительно выросли за последние несколько лет, включая программы оценки рисков и управления целостностью трубопроводов, несколько громких отказов ставят под сомнение эффективность такой приверженности безопасности.
Одной из проблем, связанных с коррозией трубопровода, является то, что она обычно не начинается внутри трубы, что затрудняет ее обнаружение. В отрасли трубопроводов широко распространено менталитет ожидания, пока не произойдет сбой, чтобы исправить его. Это связано с тем, что стоимость внедрения эффективной инспекции, такой как умные свиньи, очень высока. Эта близорукая стратегия может сэкономить деньги в краткосрочной перспективе, но, безусловно, будет иметь более высокие издержки для окружающей среды и будущих требований к капиталу.
Влияние краски на коррозию стали для морских применений
Журнал поверхностных материалов и передовых технологий
Том 04 № 04 (2014 г.), идентификатор статьи: 46818, 6 стр.
10.4236/jsemat.2014.44022
Влияние краски на коррозию стали в судостроении
Абду Абдель-Самад 1* , Ясер Суд 1 , М. Заки 2
1 Факультет машиностроения и машиностроения , Университет Мансура, Мансура, Египет
2 Факультет технологии производства и полиграфии, Академия Ахбар Эль-Йом, 6 октября, Египет
Электронная почта: * [email protected]
Это произведение находится под лицензией Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/
Поступила в редакцию 20 апреля 2014 г.; пересмотрено 15 мая 2014 г.; принято 10 июня 2014 г.
АННОТАЦИЯ
Большинство военных кораблей построены из мягкой стали. Коррозия является серьезной проблемой в морской среде. Этот конкретный тип деградации материала в последнее время привлекает больше внимания в морской промышленности. Настоящая работа направлена на изучение влияния последних покрытий, используемых на поверхностях морских судов, для предотвращения коррозии. Эксперименты проводились в соответствии со стандартными тестами для оценки и измерения адгезии покрытия к стали и измерения скорости коррозионного износа, если таковая имеется, для трех типов покрытий. Было проведено ускоренное испытание на коррозию, чтобы воспроизвести в лаборатории коррозионные характеристики продукта в полевых условиях. Результаты показывают, что все испытанные типы краски привели к снижению скорости коррозии по сравнению со сталью без покрытия. Минимальная скорость коррозии 0,8 мм/год для покрытия «Hempadur 52,140» была получена по сравнению с 2,1 мм/год для стали без покрытия. Было проведено микроскопическое исследование корродированных стальных поверхностей, на которых преобладала питтинговая активность различной степени.
Коррозия является серьезной проблемой в морской среде. Этот конкретный тип деградации материала в последнее время привлекает больше внимания в морской промышленности. Настоящая работа направлена на изучение влияния последних покрытий, используемых на поверхностях морских судов, для предотвращения коррозии. Эксперименты проводились в соответствии со стандартными тестами для оценки и измерения адгезии покрытия к стали и измерения скорости коррозионного износа, если таковая имеется, для трех типов покрытий. Было проведено ускоренное испытание на коррозию, чтобы воспроизвести в лаборатории коррозионные характеристики продукта в полевых условиях. Результаты показывают, что все испытанные типы краски привели к снижению скорости коррозии по сравнению со сталью без покрытия. Минимальная скорость коррозии 0,8 мм/год для покрытия «Hempadur 52,140» была получена по сравнению с 2,1 мм/год для стали без покрытия. Было проведено микроскопическое исследование корродированных стальных поверхностей, на которых преобладала питтинговая активность различной степени.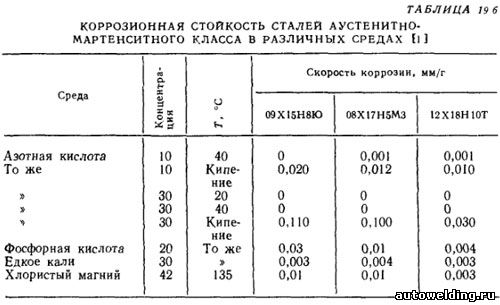 Поверхность с минимальной коррозией демонстрировала небольшое количество точечной коррозии по сравнению с другими образцами. Несмотря на точечное поражение поверхностного слоя (краски), можно сделать вывод, что поверхность образца без покрытия агрессивно поражена ямками.
Поверхность с минимальной коррозией демонстрировала небольшое количество точечной коррозии по сравнению с другими образцами. Несмотря на точечное поражение поверхностного слоя (краски), можно сделать вывод, что поверхность образца без покрытия агрессивно поражена ямками.
Ключевые слова:
Коррозия, морская краска, адгезия, испытание солевым туманом, испытание на электрохимическую поляризацию постоянным током
1. Введение Коррозия якобы является причиной 30% отказов судов и другого морского оборудования. Было подсчитано, что общая стоимость морской коррозии во всем мире составляет от 50 до 80 миллиардов долларов в год [1]. На производство покрытий приходится почти 40 % всех прямых затрат, и наибольшая часть этих затрат (88 %) приходится на органические покрытия [2].
Скорость коррозии в открытой природной системе контролируется скоростью диффузии кислорода из объемного раствора к поверхности стали, а состав углеродистой стали, подвергаемой агрессивному воздействию, не влияет на скорость [3] . Уровень растворенных солей среды воздействия оказал влияние на свойства покрытий, первоначально скорости коррозии выше и, по данным некоторых исследований, не менее чем в 2,5 раза превышают последующую устойчивую скорость, которая начинается раньше, чем через месяц после воздействия [4]. .
Уровень растворенных солей среды воздействия оказал влияние на свойства покрытий, первоначально скорости коррозии выше и, по данным некоторых исследований, не менее чем в 2,5 раза превышают последующую устойчивую скорость, которая начинается раньше, чем через месяц после воздействия [4]. .
Аварии с участием судов, перевозящих экологически опасные грузы, таких как нефтяные танкеры, могут иметь серьезные последствия для окружающей среды. Во многих авариях конструкция корабля была ослаблена коррозией [5]-[7]. Безопасность на море и предотвращение несчастных случаев требуют прочной конструкции корабля. Таким образом, предотвращение коррозии является ключевым приоритетом для безопасной транспортировки. Современные системы покрытий работают хорошо и имеют достаточный срок службы, если они наносятся в соответствии со спецификациями производителя покрытий [8]–[10].
Существуют органические и металлические защитные покрытия, другие распространенные методы предотвращения и контроля коррозии включают: коррозионно-стойкие сплавы, пластмассы и полимеры; ингибиторы коррозии; и катодной защиты. Покрытия, используемые для технического обслуживания судов, составляют 65 %, а для морского бурения и платформ — 20 % [11]. Последствия коррозии приводят к дорогостоящим затратам на эксплуатацию судов, конструкций и оборудования, усугубляемым финансовыми штрафами за поломки, простои и ремонты. Эти проблемы бросали вызов отрасли в течение многих лет, но она должна оставаться активной в предотвращении и контроле морской коррозии. Многие виды морской коррозии, их возможное взаимодействие и необходимость пересмотра всей системы при рассмотрении изменений подчеркивают важность решения проблемы посредством проектирования, выбора материалов, конструкции, использования и технического обслуживания. Обмен знаниями о результатах исследований и опытом разработчиков современных инженерных систем жизненно важен для контроля разрушительного воздействия морской среды [12] [13].
Покрытия, используемые для технического обслуживания судов, составляют 65 %, а для морского бурения и платформ — 20 % [11]. Последствия коррозии приводят к дорогостоящим затратам на эксплуатацию судов, конструкций и оборудования, усугубляемым финансовыми штрафами за поломки, простои и ремонты. Эти проблемы бросали вызов отрасли в течение многих лет, но она должна оставаться активной в предотвращении и контроле морской коррозии. Многие виды морской коррозии, их возможное взаимодействие и необходимость пересмотра всей системы при рассмотрении изменений подчеркивают важность решения проблемы посредством проектирования, выбора материалов, конструкции, использования и технического обслуживания. Обмен знаниями о результатах исследований и опытом разработчиков современных инженерных систем жизненно важен для контроля разрушительного воздействия морской среды [12] [13].
Краски, используемые в морской среде, обычно состоят из полимерной смолы (обычно эпоксидной, алкидной или полиуретановой), органических растворителей и широкого спектра органических и неорганических добавок (таких как пигменты, биоциды, наполнители и т. д.) [14] — [17 ]. Активные антикоррозионные пигменты, такие как хроматы металлов, пассивируют поверхность металла, покрывая ее оксидной пленкой. Однако эти агенты предпочтительно не должны попадать в окружающую среду из-за токсичности тяжелых металлов.
д.) [14] — [17 ]. Активные антикоррозионные пигменты, такие как хроматы металлов, пассивируют поверхность металла, покрывая ее оксидной пленкой. Однако эти агенты предпочтительно не должны попадать в окружающую среду из-за токсичности тяжелых металлов.
С другой стороны, такие металлы, как цинк, которые обычно используются в качестве антикоррозионной добавки в эпоксидных красках, предотвращают разряд тока от подложки (военно-морской стали) к электролиту за счет электрохимического прикрепления менее пассивного анода, т. е. он покрывает краску в жертвенное покрытие. В последние годы появилось новое поколение красок, в которых в качестве растворителя используется вода. Однако их антикоррозионные свойства ниже, чем у красок на органической основе, которые они намереваются заменить. Это актуальная проблема для судостроительной отрасли, требующей высоких технических характеристик из-за агрессивной морской среды. Несмотря на это, были получены многообещающие результаты для различных экологических красок на водной основе, которые включают фосфаты цинка в качестве незагрязняющей антикоррозионной добавки. Таким образом, попадание воды через покрытие образует цинковую пленку, пассивирующую металлическую подложку. Однако при исчерпании антикоррозионной добавки происходит полная потеря защитных свойств краски из-за ее высокой пористости, что затрудняет практическое применение этого типа красок в агрессивных средах. Что касается барьерной защиты, то она заключается в защите поверхности металла от проникновения кислорода и воды. Обычно защиту за счет барьерного эффекта, обеспечиваемого покрытием, оценивают с помощью иммерсионных анализов, в которых измеряют как объем воды и кислорода, поступающих в систему, так и скорость проникновения [18] [19].]. Структура полимеров важна для определения степени проникновения через них. Действительно, взаимосвязь между структурой полимеров и их проницаемостью успешно используется в таких областях, как мембраны и упаковка. Однако при нанесении покрытий присутствие пигментов и добавок может изменить пористость и адгезию пленок, модифицируя их защитное действие.
Таким образом, попадание воды через покрытие образует цинковую пленку, пассивирующую металлическую подложку. Однако при исчерпании антикоррозионной добавки происходит полная потеря защитных свойств краски из-за ее высокой пористости, что затрудняет практическое применение этого типа красок в агрессивных средах. Что касается барьерной защиты, то она заключается в защите поверхности металла от проникновения кислорода и воды. Обычно защиту за счет барьерного эффекта, обеспечиваемого покрытием, оценивают с помощью иммерсионных анализов, в которых измеряют как объем воды и кислорода, поступающих в систему, так и скорость проникновения [18] [19].]. Структура полимеров важна для определения степени проникновения через них. Действительно, взаимосвязь между структурой полимеров и их проницаемостью успешно используется в таких областях, как мембраны и упаковка. Однако при нанесении покрытий присутствие пигментов и добавок может изменить пористость и адгезию пленок, модифицируя их защитное действие. Например, пигменты уменьшают пористость покрытий; чем мельче частицы пигмента, тем ниже пористость.
Например, пигменты уменьшают пористость покрытий; чем мельче частицы пигмента, тем ниже пористость.
2. Экспериментальная процедура
2.1. Материалы
Три различных покрытия были нанесены (Таблица 1) на стальные пластины толщиной 5 мм. Химический состав стальной подложки показан в таблице 2. Перед нанесением покрытия подложки были подготовлены в соответствии со стандартом ISO 8501-4:2006 [11] [20].
Таблица 1. Испытанные типы красок
Таблица 2. Химический состав стальной подложки (мас. %).
2.2. Экспериментальные испытания
2.2.1. Испытание на адгезию
Испытания на отрыв адгезии и липкость (тест X-Cut + Испытание на поперечный надрез) измеряли в соответствии со стандартными тестами ASTM D 4541 и ASTM D 3359 соответственно (испытания ISO 4624 и ISO 2409). Результаты испытания на адгезию представлены в таблице 3.
2.2.2. Испытание в солевом тумане
Для оценки поверхностного слоя трех различных окрашенных образцов был проведен гравиметрический тест, а также визуальный и оптический контроль неокрашенного образца.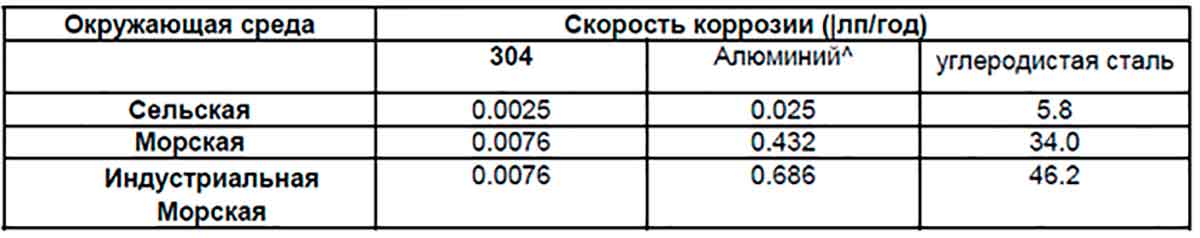 Используется атмосферное морское испытание (ASTM B287-62) (рис. 1), при котором хлоридная атмосфера воздействует на образцы. Хлоридная атмосфера в основном возникает в результате реакции между уксусной кислотой и хлоридом натрия с различной концентрацией (стандартно) при 40°C и аэрации. Продолжительность теста около 54 часов; каждые 2 часа оценивали изменение веса (ΔW). Наконец, изменение веса было построено в зависимости от времени. Визуальный осмотр и оптическая микроскопия были проведены для исследования повреждения поверхностного слоя и образовавшегося продукта коррозии. Кроме того, было проверено зарождение и распространение питтинга.
Используется атмосферное морское испытание (ASTM B287-62) (рис. 1), при котором хлоридная атмосфера воздействует на образцы. Хлоридная атмосфера в основном возникает в результате реакции между уксусной кислотой и хлоридом натрия с различной концентрацией (стандартно) при 40°C и аэрации. Продолжительность теста около 54 часов; каждые 2 часа оценивали изменение веса (ΔW). Наконец, изменение веса было построено в зависимости от времени. Визуальный осмотр и оптическая микроскопия были проведены для исследования повреждения поверхностного слоя и образовавшегося продукта коррозии. Кроме того, было проверено зарождение и распространение питтинга.
2.2.3. Испытания электрохимической поляризации постоянным током
Все испытания проводились с использованием потенциостата/гальваностата Autolab (PGSTAT 30), предназначенного для электрохимических измерений. в качестве противоэлектрода). Рабочими электродами служили покрытые образцы с открытой площадью 0,785 см 2 . Все потенциалы измеряли относительно насыщенного каломельного электрода (НКЭ). Электролит состоял из 3,5%-ного раствора NaCl, приготовленного из дистиллированной воды и NaCl марки «хч» («Fisher Scientific»). Опыты проводились при комнатной температуре. Техника линейной поляризации выполнялась путем воздействия на рабочий электрод диапазоном потенциалов на 20 мВ ниже и выше потенциала коррозии (Ecorr) при скорости сканирования 0,0125 мВ/сек. Ток в этом диапазоне линейно изменялся в зависимости от приложенного потенциала. Поляризационное сопротивление Rp (Ом) определяли по наклону графиков зависимости приложенного потенциала от измеряемого тока. Ток коррозии Icorr (A) можно рассчитать по соотношению Штерна-Гири:
Электролит состоял из 3,5%-ного раствора NaCl, приготовленного из дистиллированной воды и NaCl марки «хч» («Fisher Scientific»). Опыты проводились при комнатной температуре. Техника линейной поляризации выполнялась путем воздействия на рабочий электрод диапазоном потенциалов на 20 мВ ниже и выше потенциала коррозии (Ecorr) при скорости сканирования 0,0125 мВ/сек. Ток в этом диапазоне линейно изменялся в зависимости от приложенного потенциала. Поляризационное сопротивление Rp (Ом) определяли по наклону графиков зависимости приложенного потенциала от измеряемого тока. Ток коррозии Icorr (A) можно рассчитать по соотношению Штерна-Гири:
где
где βa и βc – анодная и катодная константы Тафеля в (v/декада).
С помощью этой методики к образцу обычно применяли контролируемое сканирование потенциала (0,5 мВ/с), начиная с Ecorr и продолжая как в анодном, так и в катодном направлениях на несколько сотен милливольт (около ± 250 мВ от Ecorr). Когда результирующие данные потенциал-ток были построены, как показано на рисунке 3, они характерно демонстрировали линейные области как на анодной, так и на катодной ветвях. Наклон этих линейных областей в v/декада тока известен как константы Тафеля βa и βc соответственно. Затем скорость коррозии CR в миллиметрах в год (миллиметрах в год) можно рассчитать по закону Фарадея по формуле:
Наклон этих линейных областей в v/декада тока известен как константы Тафеля βa и βc соответственно. Затем скорость коррозии CR в миллиметрах в год (миллиметрах в год) можно рассчитать по закону Фарадея по формуле:
Рис. 1. Испытательная камера с соляным туманом.
Рисунок 2. Потенциостат/гальваностат Autolab.
Рис. 3. Результаты потенциально-токовых данных.
Таблица 3. Результаты испытаний на адгезию.
где EW и d — эквивалентный вес (г) и плотность (г/см 3 ) стали, а icorr — плотность тока коррозии (мА/см 2 ), полученная из icorr = Icorr/открытая площадь .
3. Результаты и обсуждение
Результаты испытаний на адгезию показаны в таблице 3.
Результаты испытаний на электрохимическую поляризацию постоянным током показаны в таблице 4, а скорость коррозии образцов показана на рисунке 4.
Обычное покрытие повышает коррозионную стойкость стали без покрытия.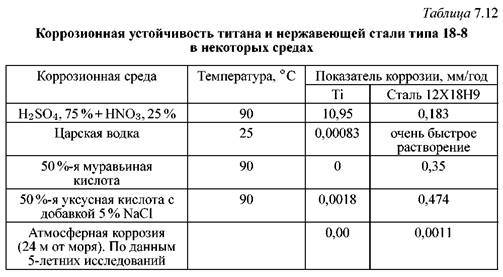 Ясно, что покрытия № 2 и 3 обладают гораздо более низкой коррозионной стойкостью, чем покрытие № 1.
Ясно, что покрытия № 2 и 3 обладают гораздо более низкой коррозионной стойкостью, чем покрытие № 1.
Изменение веса (мг/см 2 ) трех образцов, покрытых красками разных типов, измеряли в хлоридной атмосфере при 40°С. С в течение примерно 54 часов. Эти результаты представлены на рисунке 5. Как видно, можно сделать вывод, что образец 2 выдерживает 54 часа без агрессивного воздействия, два других образца 1 и 3 демонстрируют значительные изменения в увеличении массы. Для образцов 3 и 1 было получено более высокое увеличение веса, чем для образца 2. По сравнению с эталонным образцом (без поверхностного покрытия) было зафиксировано меньшее увеличение веса. Значения скорости коррозии в мм/год через 54 часа после эксперимента рассчитывают по соотношению (Скорость коррозии = KW/ρAt), как показано в Таблице 5. Где W — потеря веса после времени воздействия t; ρ и A представляют собой плотность и открытую площадь образца соответственно, а K — постоянная величина, величина которой зависит от используемой системы единиц (K = 87,6, а W, ρ, A и t указаны в миллиграммах, граммах на кубический сантиметр, квадратный дюйм и час соответственно).
Чтобы подтвердить наш результат, во время экспозиции был проведен визуальный осмотр, а также оптические микрофотографии. В целом все образцы проявляют питтинговое поведение с разной степенью в зависимости от его поверхностного слоя, слабости и прочности. Тем не менее, микрофотографии образца 2 представляют меньше точечной коррозии по сравнению с образцом 1 и 3, а также с эталоном. Несмотря на точечное поражение поверхностного слоя (краски), можно сделать окончательный вывод о том, что поверхность образца без покрытия агрессивно поражена ямками. На этой поверхности образуются более крупные и широкие ямки. Во всех случаях вокруг язв образовался темно-коричневый продукт коррозии. Некоторые выбранные микрофотографии показаны на рисунке 6 для образцов 1, 2 и 3, а также для сравнения эталонного образца (без покрытия) через 54 часа.
Рисунок 4. Скорость коррозии образцов с покрытием и без покрытия.
Таблица 4. Результаты испытаний на электрохимическую поляризацию постоянного тока.
Рис. 5. Коррозия в солевом тумане ускоряет коррозию.
Образец 1 Образец 2 Образец 3 Эталонный образец
Рисунок 6. Оптические микрофотографии поверхностей, обработанных соляным напылением, через 54 часа.
Таблица 5. Результаты испытаний в солевом тумане.
4. Выводы
Из настоящего экспериментального исследования и полученных результатов можно сделать вывод, что:
1) Полимерное покрытие стальных конструкций для морского применения необходимо для снижения коррозии в соленой воде. Для поверхностей с покрытием было достигнуто снижение скорости коррозии примерно на 77% по сравнению со стальной поверхностью без покрытия.
2) Минимальную скорость коррозии 0,8 мм/год продемонстрировало покрытие «HEMPALIN ENAML 52140» в течение 54 часов испытания в солевом тумане.
3) Оптические микрофотографии показали, что окисление и точечная коррозия преобладают на корродированных поверхностях.
Ссылки
- Исследование NACE Int’l Co C (2001 г.
 ) Затраты на методы борьбы с коррозией включают услуги, НИОКР, образование и обучение, внедрение систем предотвращения коррозии — основные расходы владельца/оператора. Национальное управление океанических и атмосферных исследований (NOAA), Силвер-Спринг.
) Затраты на методы борьбы с коррозией включают услуги, НИОКР, образование и обучение, внедрение систем предотвращения коррозии — основные расходы владельца/оператора. Национальное управление океанических и атмосферных исследований (NOAA), Силвер-Спринг. - Гринфилд, Д. и Скантлбери, Д. (2000) Защитное действие органических покрытий на сталь: обзор. Journal of Corrosion Science and Engineering, 3, 5.
- Гудзеа М.Т. и Мельхерсб, Р.Е. (2009 г.) Эксплуатационный анализ коррозии на военных кораблях. Журнал Corrosion Science, 50, 3296-3307.
- Фанг, Х.Т. (2006) Влияние низкой температуры и высокой концентрации соли на общую коррозию CO 2 для углеродистой стали. Электронная диссертация или диссертация, Университет Огайо. https://etd.ohiolink.edu/
- Ши, В. (1992) Эксплуатационная оценка судовых конструкций: влияние общей коррозии на предел прочности. Труды Королевского института морских архитекторов, 135, 77–9.1.
- Кима В.К., Кохб С.У., Янб Б.
 Ю. и Кима, К.Ю. (2008) Влияние экологических и металлургических факторов на водородное растрескивание сталей HSLA. Progress in Organic Coatings, 50, 3336-3342.
Ю. и Кима, К.Ю. (2008) Влияние экологических и металлургических факторов на водородное растрескивание сталей HSLA. Progress in Organic Coatings, 50, 3336-3342. - Fredja, N., Cohendoza, S., Feaugasa, X. and Touzain, S. (2008) Влияние механического напряжения на кинетику деградации морских покрытий. Прогресс в органических покрытиях, 63, 316-322. http://dx.doi.org/10.1016/j.porgcoat.2008.05.001
- См. С.С., Жанга З.Ю. и Ричардсона, M.O.W. (2009 г.) Исследование характеристик водопоглощения нового наногелькоута для морского применения. Прогресс в органических покрытиях, 65, 169-174. http://dx.doi.org/10.1016/j.porgcoat.2008.11.004
- Мехтаа, Н.К. и Богере, М.Н. (2009) Экологические исследования умной/самовосстанавливающейся системы покрытия для стали. Прогресс в органических покрытиях, 64, 419-428. http://dx.doi.org/10.1016/j.porgcoat.2008.08.007
- Тадрос, А.Б. и Абд Эль-Наби, Б.А. (2000) Морские антикоррозионные краски на основе тиоурациловых соединений. Антикоррозионные методы и материалы, 47, 211-214.
 http://dx.doi.org/10.1108/000355
http://dx.doi.org/10.1108/000355344303
- Окли, Р. и Кинети, К. (2009 г.) Испытания на коррозию в поддержку технических презентаций морских приложений на собрании в апреле 2009 г., Форум по морской коррозии (MCF). http://www.marinecorrosionforum.org/tpapr09.htm
- Гедес Соареш, К., Гарбатов, Ю., Заид, А. и Ван, Г. (2009 г.) Влияние факторов окружающей среды на коррозию конструкций судов в морской атмосфере . Коррозионная наука, 51, 2014-2026. http://dx.doi.org/10.1016/j.corsci.2009.05.028
- Абд Эль Аал, Э.Э., Абд Эль Ванис, А., Диаб, А. и Абд Эль Халим, С.М. (2009 г.) Факторы окружающей среды, влияющие на коррозионное поведение арматурной стали III. Измерение токов точечной коррозии стали в растворах Ca(OH) 2 в условиях естественной коррозии. Corrosion Science, 51, 1611-1618. http://dx.doi.org/10.1016/j.corsci.2009.04.006
- Аль-Тураиф, Х. (2009) Свойства поверхностного покрытия смесей пигментов различной формы и размера. Прогресс в органических покрытиях, 65, 322-327.
 http://dx.doi.org/10.1016/j.porgcoat.2009.01.001
http://dx.doi.org/10.1016/j.porgcoat.2009.01.001 - Акбаринежад Э., Эбрахими М. и Фариди Х.Р. (2009 г.) Ингибирование коррозии стали в растворе хлорида натрия с помощью нелегированного полианилинового эпоксидного покрытия. Прогресс в органических покрытиях, 64, 361-364. http://dx.doi.org/10.1016/j.porgcoat.2008.07.018
- Календова, А., Сапурина, И., Стейскал, Дж. и Веселы, Д. (2008) Антикоррозионные свойства пигментов с полианилиновым покрытием в органических покрытиях. Corrosion Science, 50, 3549-3560. http://dx.doi.org/10.1016/j.corsci.2008.08.044
- Bierwagen, G.P. (1992) Критическая объемная концентрация пигмента (CPVC) как точка перехода в свойствах покрытий. Журнал технологии покрытий, 64, 71-75.
- Скуликидис, Т. и Рагуссис, А. (1992) Диффузия ионов железа через защитные покрытия на стали. Коррозия, 48, 666-670. http://dx.doi.org/10.5006/1.3315987
- Дефлориан Ф. и Росси С. (2006 г.) Исследование диффузии ионов через органические покрытия методом ЭИС.
 Электрохимика Акта, 51, 1736-1744.
Электрохимика Акта, 51, 1736-1744. - Baboian, R. (2005) Коррозионные испытания и стандарты: применение и интерпретация. 2-е издание, Серия руководств ASTM 2005 г., Западный Коншохокен.
ПРИМЕЧАНИЯ
* Автор, ответственный за переписку.
Какова приемлемая скорость коррозии трубопровода в мм в год? – KnowledgeBurrow.com
Джим Браун Блог
Содержание
- 1 Какова приемлемая скорость коррозии трубопровода в мм в год?
- 2 Как выбрать припуск на коррозию?
- 3 Как рассчитать скорость коррозии труб?
- 4 Что увеличивает скорость коррозии?
- 5 Какова стандартная скорость коррозии детали?
- 6 Как рассчитывается скорость коррозии открытой водопроводной системы?
Какова приемлемая скорость коррозии трубопровода в мм в год?
Допуски на коррозию обычно устанавливаются конечным пользователем и в некоторой степени основаны на личных предпочтениях и отраслевых традициях.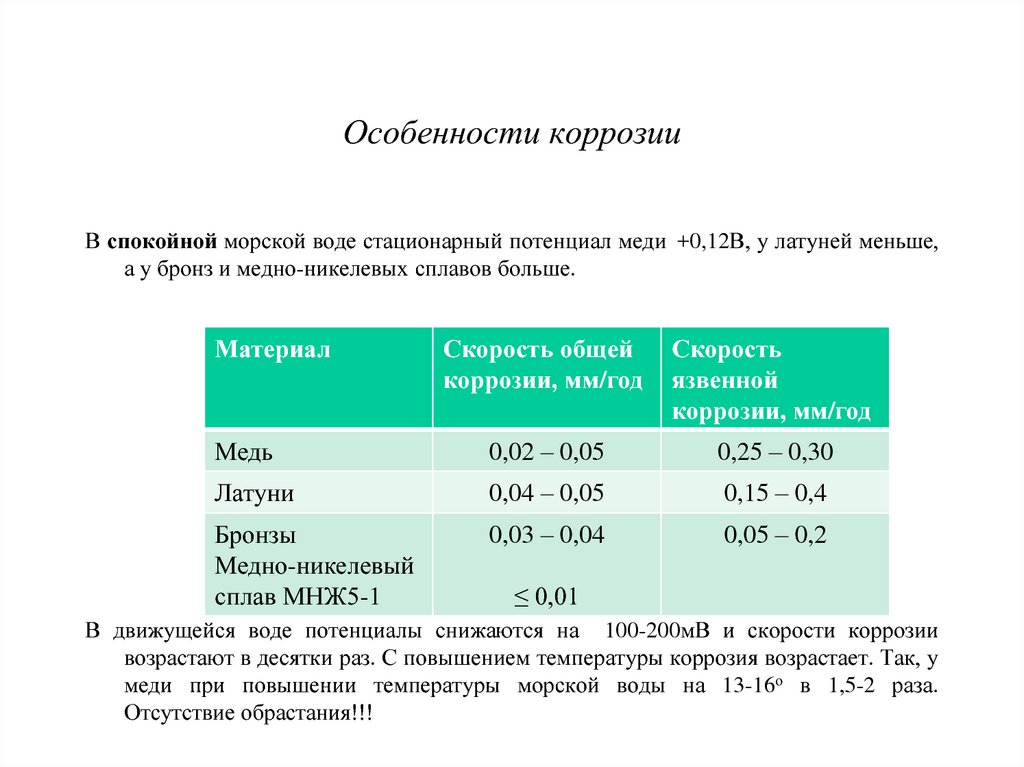 1,5 мм для трубопровода является общепринятым стандартом, но вы можете установить допуск на коррозию по своему усмотрению, если только государственное или местное учреждение не приняло и не заменило B31.
1,5 мм для трубопровода является общепринятым стандартом, но вы можете установить допуск на коррозию по своему усмотрению, если только государственное или местное учреждение не приняло и не заменило B31.
Когда скорость коррозии высока?
Коррозия углеродистой стали возникает при относительной влажности воздуха от 70% до 80% и температуре воздуха выше 32°F. Скорость коррозии может увеличиваться за счет примесей воздуха, растворяющихся в конденсированной воде или дождевой воде, а также пыли и грязь, оседающая на металлической поверхности.
Как выбрать припуск на коррозию?
Например, если прогнозируемая скорость коррозии для нового охладителя продукта из углеродистой стали составляет 4 миллиона миль в год, поскольку устройство рассчитано на 15 лет, требуемый допуск на коррозию составляет 4 миллиона миль в год × 15 лет = 60 мил (0,060 дюйма). Общей практикой является минимальный припуск на коррозию в размере 1/8 дюйма или 3,2 мм.
Какова скорость коррозии при критической влажности?
В большинстве случаев это происходит при относительной влажности 80%. Но не только влажность вызывает коррозию; именно изменение температуры наряду со значительным повышением влажности приводит к образованию влаги на деталях.
Но не только влажность вызывает коррозию; именно изменение температуры наряду со значительным повышением влажности приводит к образованию влаги на деталях.
Как рассчитать скорость коррозии труб?
Скорость коррозии механизмов утонения определяется как разница между двумя показаниями толщины, деленная на интервал времени между показаниями. Определение скорости коррозии может включать данные о толщине, собранные более чем в два разных периода времени.
Что такое MPY?
Мили проникновения в год (MPY) — единица измерения, равная одной тысячной дюйма. Проникновение в милах в год широко известно как mil в системе измерения США. Проникновение в милах в год используется для измерения скорости коррозии купона. Эта единица также может использоваться для измерения толщины или допуска покрытия.
Что увеличивает скорость коррозии?
На скорость коррозии влияет несколько факторов, включая диффузию, температуру, электропроводность, тип ионов, значение pH и электрохимический потенциал.
Какой металл быстрее всего подвергается коррозии?
Цинк и обычная сталь подвержены коррозии быстрее всех растворов. неожиданно алюминий, который в ряду реакционной способности выше, чем цинк, показал небольшую коррозию.
Какова стандартная скорость коррозии детали?
Стандартные скорости коррозии. В общем, приемлемость любой конкретной скорости коррозии зависит от конструкции или ожидаемого срока службы корродирующей детали. В большинстве стандартных таблиц коррозии скорость коррозии ниже 20 мил в год (0,5 мм/год) считается «приемлемой», исходя из того, что большинство коррозионно-активных компонентов были разработаны с учетом логической коррозии…
Как скорость коррозии связана с потерей веса?
Скорость коррозии может быть выражена плотностью тока, скоростью потери веса или скоростью потери сечения.

 Коррозия. Климатические исполнения / / Перевод единиц скоростей равномерной коррозии / износа поверхности. Плотность тока (А/м2) эквивалентная скорости коррозии 1 г/(м2*сут) для некоторых реакций.
Коррозия. Климатические исполнения / / Перевод единиц скоростей равномерной коррозии / износа поверхности. Плотность тока (А/м2) эквивалентная скорости коррозии 1 г/(м2*сут) для некоторых реакций.
 фут
фут Г., Реви Р. У. Коррозия и борьба с ней. Введение в коррозионную науку и технику. Под ред. А. М. Сухотина.» Химия, 1989 / США, 1985
Г., Реви Р. У. Коррозия и борьба с ней. Введение в коррозионную науку и технику. Под ред. А. М. Сухотина.» Химия, 1989 / США, 1985 В результате появляется ржавчина на стали и чугуне, зеленый налет на меди, белый налет на сплавах алюминия. Скорость коррозии измеряется уменьшением толщины поверхностного слоя металла. При равномерной коррозии для измерения применяют глубинный показатель (мм/год), при неравномерной — массовый показатель (кг/м2
В результате появляется ржавчина на стали и чугуне, зеленый налет на меди, белый налет на сплавах алюминия. Скорость коррозии измеряется уменьшением толщины поверхностного слоя металла. При равномерной коррозии для измерения применяют глубинный показатель (мм/год), при неравномерной — массовый показатель (кг/м2 В других случаях (у алюминия) из-за высокой прочности пленки металл больше не разрушается. Однако сопротивляемость коррозии одного и того же металла или сплава в различных средах различна. Алюминий, например, стоек в воздухе и пресной воде, но нестоек в растворах щелочей и кислот.
В других случаях (у алюминия) из-за высокой прочности пленки металл больше не разрушается. Однако сопротивляемость коррозии одного и того же металла или сплава в различных средах различна. Алюминий, например, стоек в воздухе и пресной воде, но нестоек в растворах щелочей и кислот. Зерна металла будут являться анодами, а загрязнения, примеси, другие компоненты сплава — катодами. В результате растворения анода происходит электрохимическая коррозия металла. Следовательно, чем чище (однороднее по составу) металлы, тем выше их коррозионная стойкость. Сплавы больше подвергаются коррозии, чем металлы.
Зерна металла будут являться анодами, а загрязнения, примеси, другие компоненты сплава — катодами. В результате растворения анода происходит электрохимическая коррозия металла. Следовательно, чем чище (однороднее по составу) металлы, тем выше их коррозионная стойкость. Сплавы больше подвергаются коррозии, чем металлы.
 Покрытия разделяются на металлические и неметаллические. Металлические осуществляют изоляцию металла от воздействия внешней среды, по возможности обеспечивая электрохимическую защиту.
Покрытия разделяются на металлические и неметаллические. Металлические осуществляют изоляцию металла от воздействия внешней среды, по возможности обеспечивая электрохимическую защиту.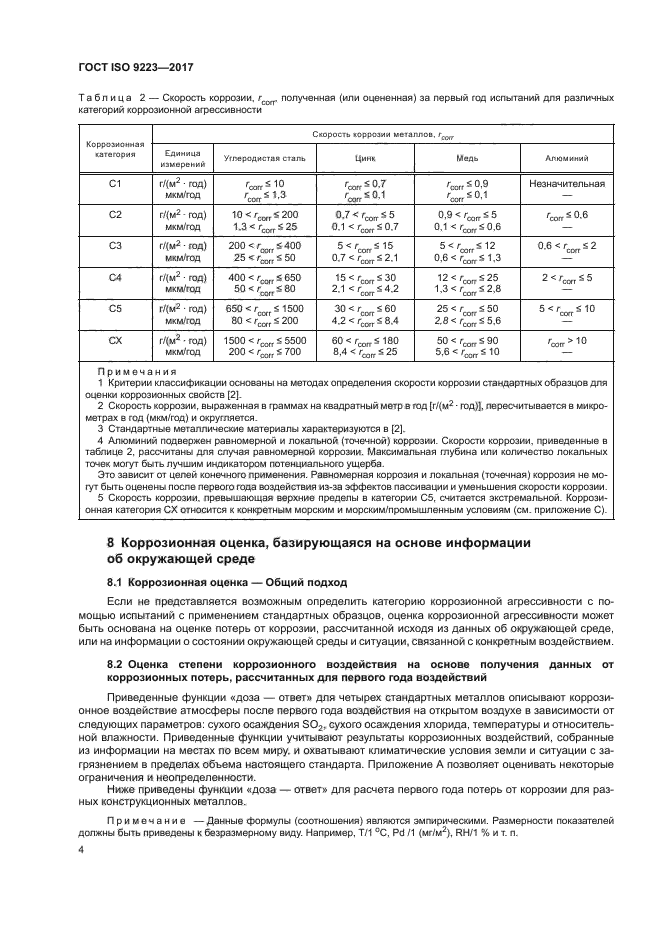
 ) Затраты на методы борьбы с коррозией включают услуги, НИОКР, образование и обучение, внедрение систем предотвращения коррозии — основные расходы владельца/оператора. Национальное управление океанических и атмосферных исследований (NOAA), Силвер-Спринг.
) Затраты на методы борьбы с коррозией включают услуги, НИОКР, образование и обучение, внедрение систем предотвращения коррозии — основные расходы владельца/оператора. Национальное управление океанических и атмосферных исследований (NOAA), Силвер-Спринг. Ю. и Кима, К.Ю. (2008) Влияние экологических и металлургических факторов на водородное растрескивание сталей HSLA. Progress in Organic Coatings, 50, 3336-3342.
Ю. и Кима, К.Ю. (2008) Влияние экологических и металлургических факторов на водородное растрескивание сталей HSLA. Progress in Organic Coatings, 50, 3336-3342. http://dx.doi.org/10.1108/000355
http://dx.doi.org/10.1108/000355 http://dx.doi.org/10.1016/j.porgcoat.2009.01.001
http://dx.doi.org/10.1016/j.porgcoat.2009.01.001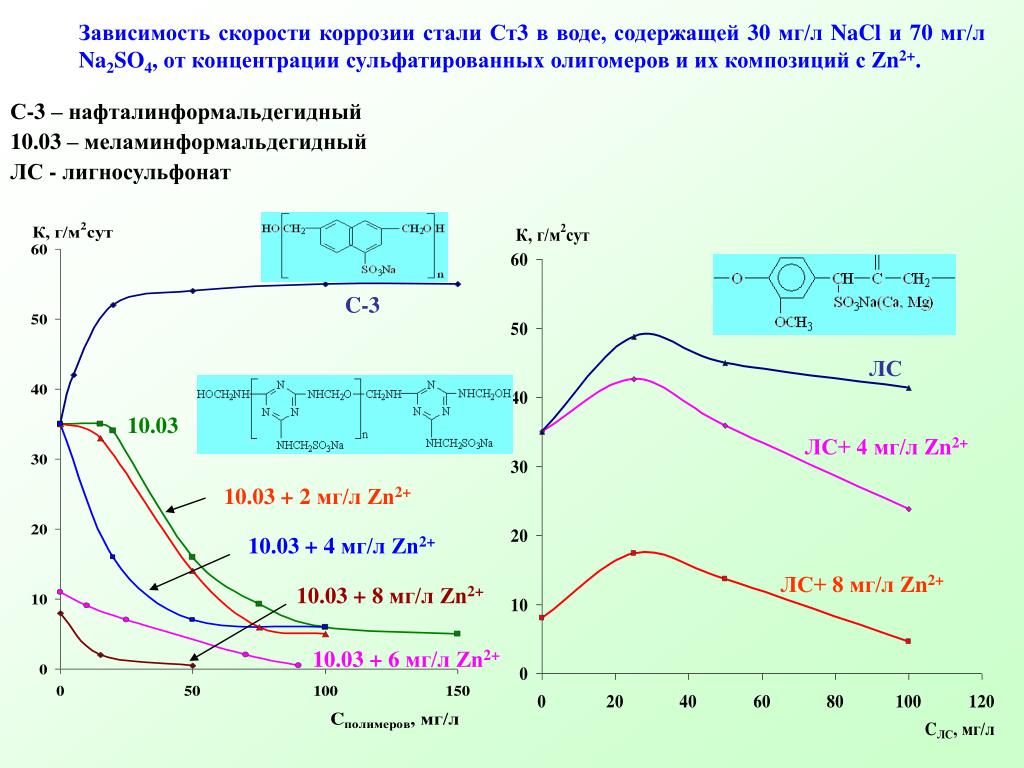 Электрохимика Акта, 51, 1736-1744.
Электрохимика Акта, 51, 1736-1744.