Свинцевание химическое: Технология и механизм получения покрытия. Свойства свинца.
Содержание
Технология и механизм получения покрытия. Свойства свинца.
Фазлутдинов К.К.
19.08.2019 (обновленно 20.12.2020)
3337 просмотров
Содержание:
1. Что такое свинец и для чего применяют свинцевание?
2. Электролиты для получения покрытий свинцом.
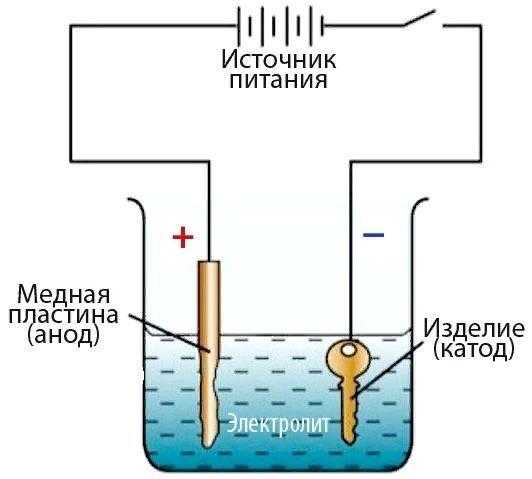
1. Что такое свинец и для чего применяют свинцевание?
Свинец — металл серого цвета. Нормальный потенциал свинца равен -0,126 В. В паре с железом свинец, является катодом. Он мало склонен к пассивации в окислительных кислотах. Химическая стойкость свинцовых покрытий объясняется образованием сравнительно толстых защитных пленок, которые непосредственно защищают свинец. В серной кислоте, в частности, образуется защитная пленка сульфата свинца.
В азотной и уксусной кислотах свинец не устойчив, так как нитраты и ацетаты хорошо растворимы в воде. Неустойчив свинец и в растворах щелочей.
Неустойчив свинец и в растворах щелочей.
Свинцевание — нанесение тонкого слоя металлического свинца на изделие для придания ему необходимых характеристик.
Электролитические свинцовые покрытия применяют для защиты стали в химической промышленности, на коксохимических предприятиях, для предохранения аппаратуры от действия серной кислоты, сернистых газов, для защиты от действия на сталь отравляющих веществ, для защиты от действия бензина. Применяют свинцовые покрытия для защиты от воздействия паров серной кислоты.
Для электролитического свинцевания пригодны как кислые, так и щелочные электролиты. Известны составы на основе простых и комплексных солей: фторборатные, кремнефторидные, перхлоратные, сульфаматные, нитратные, ацетатные, плюмбитные, фенолсульфоновые, тартратные, пирофосфатные, полиэтиленполиаминовые, нитрилтриацетатные и др. Промышленное значение имеют борфторидные, кремнефторидные и фенолсульфоновые электролиты.
2. Электролиты для получения покрытий свинцом.

Состав электролитов для свинцевания и режимы электролиза представлены в таблице ниже.
Таблица 1 – Состав электролитов для свинцевания.
|
Компоненты и режим работы
|
Состав электролитов, г/л
| |||
|
1
|
2
|
3
|
4
| |
|
Свинец борфтористоводородный
|
125-200
|
—
|
—
|
145-200
|
|
Свинец
кремнефтористоводородный
|
—
|
—
|
80-150
|
—
|
|
Свинец фенолсульфоновый
|
—
|
170-180
|
—
|
—
|
|
Кислота борфтористоводородная
|
40-60
|
—
|
—
|
30-60
|
|
Кислота
кремнефтористоводородная
|
—
|
—
|
20-35
|
—
|
|
Кислота парафенолсульфоновая
|
—
|
20-25
|
—
|
—
|
|
Кислота борная
|
—
|
—
|
5-6
|
7-11
|
|
Клей мездровый (столярный)
|
0,5-1,0
|
0,4-0,5
|
0,5-1,0
|
0,8-1,0
|
|
Температура, °С
|
15-25
|
15-25
|
15-25
|
20-35
|
|
Плотность тока, А/дм2
|
0,5-2,0
|
0,5-1,0
|
1-2
|
1-5
|
|
Скорость осаждения, мкм/мин
|
0,25-1,00
|
0,25-0,50
|
0,5-2,5
|
0,5-2,2
|
В состав кислых электролитов свинец входит в виде следующих солей: борфторида Pb(BF4)2, кремнефторида Pb(SiF6)2, фенолсульфоната Pb(C6H4SO3OH)2, перхлората Pb(ClO4)2 и сульфамата Pb(H2NSO3). В таких электролитах необходимо присутствие свободной кислоты для предупреждения гидролиза соли свинца, увеличения электропроводимости, некоторого улучшения структуры осадков и снижения склонности к дендритообразованию. В составе электролита для первых двух ванн содержится, кроме того, борная кислота, необходимая для повышения устойчивости соответствующих свинцовых солей.
В таких электролитах необходимо присутствие свободной кислоты для предупреждения гидролиза соли свинца, увеличения электропроводимости, некоторого улучшения структуры осадков и снижения склонности к дендритообразованию. В составе электролита для первых двух ванн содержится, кроме того, борная кислота, необходимая для повышения устойчивости соответствующих свинцовых солей.
Температура электролитов 18-40 °С. Катодная плотность тока составляет до 0,3 кА/м2 в борфторидном, кремнефторидном, перхлоратном электролитах и до 0,1-0,2 кА/м2 в фенолсульфонатном и сульфаматном электролитах. Выход металла по току близок к 100% вследствие высокого перенапряжения выделения водорода на свинце и невысокой катодной поляризации. Аноды изготовлены из чистого свинца. Анодная плотность тока равна катодной. В качестве добавок в кислые электролиты свинцевания вводят коллоиды (клеи, желатин, декстрин), которые оказывают благоприятное влияние на структуру покрытий и несколько увеличивают катодную поляризацию.
Режим электролиза, в частности, плотность тока, выбирают в зависимости от необходимой толщины покрытия. Для получения тонких слоев покрытий (~ 30 мкм) рекомендуется применять более разбавленный электролит.
Щелочные плюмбитные электролиты просты по составу, доступны, их легко приготовить. В этих электролитах свинец присутствует в виде анионов Pb(OH)42-, образующихся в результате диссоциации комплексных солей плюмбитов натрия или калия Na2[Pb(OH)4] или K2[Pb(OH)4]. Низкая растворимость плюмбитов в щелочном растворе (0,23 экв. Pb в 4 н. КОН)ограничивает верхний предел допустимых плотностей тока (10-40 А/м2). Для расширения интервала плотностей тока рабочую температуру поддерживают в пределах 60-70 °С. Растворимость свинца увеличивается в присутствии 60-65 г/л глицерина или сегнетовой соли. Это объясняется образованием растворимых комплексных соединений свинца типа глицератов.
Свинцовые аноды пассивируются вследствие накопления карбоната натрия, образующегося при взаимодействии свободной щелочи с диоксидом углерода воздуха. Катодная поляризация в щелочном плюмбитном электролите невелика.
Катодная поляризация в щелочном плюмбитном электролите невелика.
Поляризуемость катода в интервале рабочих плотностей тока более высокая, что наряду с хорошей электропроводимостью электролита обуславливает более высокую рассеивающую способность по сравнению с кислыми растворами.
Широкое применение щелочных электролитов ограничено невысокой стабильностью растворов, низкими плотностями тока, пассивированием анодов и отсутствием хорошего сцепления свинцовых покрытий со стальной основой.
Борфтористоводородные электролиты отличаются высокой стабильностью, в них получаются мелкокристаллические, хорошо сцепленные с основой осадки непосредственно на стали, поэтому выбран именно этот электролит.
Рисунок 1 — Излом гальванического свинцового покрытия.
Конец статьи
Понравилась статья?
Оцените статью. Всего 1 клик!
Нажмите на звезду
Средняя оценка:
5,00
Всего оценок:
7
Данная статья является интеллектуальной собственностью ООО «НПП Электрохимия». Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
10 Свинцевание
Полученное
путем гальванического
осаждения
свинцовое
покрытие
используется главным образом в технике,
так как очень красивая серая поверхность
его быстро покрывается слоем окислов.
Из-за этого свинцовые покрытия не
рекомендуются для декоративных целей.
Свинцовая поверхность хорошо
сопротивляется агрессивному действию
разбавленных серной, сернистой и
плавиковой кислот, а также атмосферы,
содержащей очень агрессивную двуокись
серы. Поэтому она используется при
изготовлении различных химических
приборов, частей аккумуляторов и других
технических устройств, где необходима
хорошая противокоррозийная защита.
К азотной кислоте и некоторым органическим
кислотам, особенно уксусной, свинцовые
покрытия не имеют большой стойкости и
сильно ими разрушаются.
По
сравнению со свинцовыми покрытиями,
полученными погружением
в ванну с расплавленным металлом,
гальванические покрытия имеют то
преимущество, что их можно нанести
на самые различные металлические
материалы (в том числе на чугун), причем
даже на мелкие детали, что исключено
при работе с расплавленным свинцом.
В
табл. 5.27 приведены составы электролитов,
используемых для свинцевания.
Таблица
5.27.
Состав | Номер | |||||
1 | 2 | 3 | 4 | 5 | 6 | |
Борфтористоводородный | 180-200 | — | — | — | — | — |
Кремнефтористоводородный | — | 80-150 | — | — | — | — |
Парафенолсульфоновый | — | — | 140-200 | — | — | — |
Углекислый | — | — | — | 145 | — | — |
Борфтористоводородная | 40-45 | — | — | — | — | — |
Плавиковая | — | — | — | 115 | — | — |
Борная | — | 5-6 | — | 114 | — | — |
Кремнефтористоводородная | — | 20-35 | — | — | — | |
Фенолсульфоновая | — | — | 20-40 | — | — | — |
Виннокислый | — | — | — | — | 75 | — |
Резинат | — | — | — | — | 4-8 | — |
Едкий | — | — | — | — | 200 | — |
Окись | — | — | — | — | — | 5 |
Едкий | — | — | — | — | — | 50 |
Катехинол | — | — | — | — | — | 0,1 |
Столярный | 0,5-1,0 | 0,5-1,0 | 0,5-1,0 | 0,2 | — | — |
Температура, | 20-30 | 20-30 | 20-30 | 20-40 | 60-70 | 20-30 |
Плотность | 0,5-2,5 | 1,0-1,2 | 1,5-4,0 | 1-4 | 1-2 | 0,5 |
Электролит
№ 1 обеспечивает получение свинцовых
покрытий при более высоких плотностях
тока. Адгезия покрытий толщиной более
Адгезия покрытий толщиной более
100 мкм неудовлетворительная, и для
ее увеличения необходимо подвергать
детали пескоструйной обдувке.
Электролит
№ 2 по эксплуатационным качествам
аналогичен электролиту № 1, но содержит
более дешевые компоненты.
Электролит
№ 3 позволяет получать более светлые
слои свинца и с лучшей адгезией к
основному металлу. Его применение,
однако, вызывает дополнительные
трудности с обезвреживанием сточных
вод, содержащих производные фенола.
Электролит
№ 4 — кислый фторборатный. Плотность
тока 3-4 А/дм2
для тонких покрытий (до 20 мкм) и 1 А/дм2
при
толщине покрытия более 0,1 мм; напряжение
1-4 В. Толщина покрытия зависит от
назначения деталей. На стальных
изделиях можно создать слой толщиной
от 0,01-0,1 мм, в исключительных случаях
при специальном назначении до 1 мм.
Цветные
металлы
(особенно медь и латунь) можно покрыть
слоем толщиной не более 10-30 мкм. Время
металлизации определяется необходимой
толщиной свинцового слоя. При плотности
При плотности
тока 1 А/дм2
слой толщиной 1 мкм образуется
приблизительно за 2 мин. В этой и других
ваннах для свинцевания нужно использовать
аноды только из чистого свинца.
Электролит
№ 5 составлен на основе виннокислой
соли свинца.
Электролит
№ 6 — старый испытанный щелочной раствор
с хорошим глубинным эффектом. Работает
при напряжении 2,5-3 В и плотности тока
0,5 А/дм2
и дает тонкие покрытия.
Борфтористоводородный
электролит готовится растворением
борфтористоводородного свинца в рабочей
ванне, куда затем вводятся
борфтористоводородная кислота и клей,
предварительно замоченный в воде для
набухания.
При
отсутствии борфтористоводородной соли
свинца ее можно приготовить, растворяя
в борфтористоводородной кислоте
свинцовый глет (PbO) или свежеосажденный
углекислый свинец, который получается
осаждением из любой растворимой соли
свинца действием раствора соды.
Для
приготовления кремнефтористоводородного
электролита вначале в отдельной емкости
получают соль свинца, растворяя глет
или свежеосажденный углекислый
свинец в кремнефтористоводородной
кислоте. Затем в рабочую ванну после
Затем в рабочую ванну после
отстаивания вводят последовательно
растворы кремнефтористоводородного
свинца, борной кислоты и
кремнефтористоводородной кислоты.
Основным компонентом фенолсульфонового
электролита является фенолсульфоновый
свинец Pb(C6H5OSO3)2
—
соль фенолсульфоновой кислоты, которая
получается в результате взаимодействия
фенола и серной кислоты. Фенолсульфоновая
кислота, реагируя с соединениями свинца,
образует соответствующую соль.
Электролит
№ 4 готовят следующим образом: необходимое
количество столярного клея, соответствующее
общему количеству раствора, сначала
растворяют в горячей воде и только
потом смешивают его с остальными
растворенными веществами. Для этого
раствора используется железная ванна,
выложенная твердой резиной или свинцом.
Сосуд для приготовления электролита
должен иметь эффективную вытяжку,
ванна для металлизации вытяжку может
не иметь.
Ильин В.А. Краткий справочник гальванотехника
- формат doc
- размер 413.
 01 КБ
01 КБ - добавлен
26 ноября 2008 г.
Растворы. Коррозия и выбор гальванических покрытий. Водные
растворы. Свойства электролитических покрытий. Определение площади
катодной поверхности. Материалы, применяемые в гальванотехнике и
производстве печатных плат. Растворители, кислоты, щелочи, соли и
вспомогательные материалы. Аноды. Материалы для изготовления
печатных плат. Оборудование и технологическое оснащение.
Оборудование для подготовительных операций. Оборудование для
гальванических операций. Оборудование для производства печатных
плат. Вспомогательное оборудование. Подготовка поверхности деталей
к покрытию. Механические способы подготовки. Химические способы
подготовки. Защитные покрытия. Цинкование. Кадмирование.
Оловянирование и свинцевание. Покрытие оловом и его сплавами.
Свинцевание. Защитно-декоративные покрытия. Назначение и выбор.
Назначение и выбор.
Меднение и покрытия медными сплавами. Электроосаждение никеля.
Хромирование. Покрытие драгоценными металлами. Серебрение.
Золочение. Палладирование и родирование. Покрытия специального
назначения. Износостойкие покрытия хромом, железом и никелем.
Композиционные покрытия. Гальванические покрытия деталей из легких
сплавов. Покрытия с заданными магнитными свойствами. Металлизация
диэлектриков. Подготовка поверхности. Химическое меднение.
Технологические процессы производства печатных плат. Назначение
печатных плат и методы их изготовления. Механическая обработка в
процессах изготовления печатных плат. Получение защитного рисунка.
Химическое и гальваническое меднения. Защитное покрытие сплавом
олово-свинец. Травление меди. Анодные способы обработки.
Анодирование алюминия. Электролитическое полирование. Анодное
оксидирование меди, ее сплавов и титана. Неметаллические
(неорганические) покрытия. Оксидирование и фосфатирование черных и
цветных металлов. Пассивирование металлов. Бестоковые (химические)
Бестоковые (химические)
металлические покрытия. Химическое никелирование. Бестоковое
(химическое) осаждение олова, серебра, золота, палладия.
Безотходная технология в гальваническом производстве. Малоотходная
технология. Утилизация отходов. Безотходная технология. Контроль
электролитов и качества покрытий. Контроль электролитов. Контроль
качества покрытий. Нормирование расхода материалов. Расход
растворимых анодов. Расход химикатов. Охрана труда и техника
безопасности. Общие правила по охране труда и технике безопасности.
Правила обращения с токсичными растворами. Индивидуальные средства
защиты и оказание первой помощи пострадавшим.
Похожие разделы
- Академическая и специальная литература
- Машиностроение и металлообработка
- Термо- и химобработка
- Электрофизические и электрохимические методы обработки
- Академическая и специальная литература
- Химия и химическая промышленность
- Электрохимия
Смотрите также
- формат pdf
- размер 1.
 69 МБ
69 МБ - добавлен
17 апреля 2011 г.
Краткий конспект лекций. Казань: КГТУ, 2006. — 78 с. Дано краткое описание процессов, лежащих в основе электрохимических технологий в машиностроительных и приборостроительных производствах, в производстве товарных химических продуктов, в электрохимической энергетике, в электрохимической металлургии. Кратко описаны электрохимические технологии защиты от коррозии крупных технических объектов. Предназначен для студентов химико-технологических специ…
Практикум
- формат pdf
- размер 328.86 КБ
- добавлен
08 мая 2011 г.
КГТУ. Казань. 2005. 42 с. Дано краткое описание четырех работ по основам электрохимической технологии (гальванотехника), с использованием опыта преподавания этой дисциплины на кафедре ТЭП КГТУ. Рассмотрены принципы устройства и электрические характеристики электрохимических объектов – гальванических ванн для нанесения цинковых, медных, никелевых и хромовых металлопокрытий. Выполнение работ сопровождается построением ПД-портретов моделей таких э…
Рассмотрены принципы устройства и электрические характеристики электрохимических объектов – гальванических ванн для нанесения цинковых, медных, никелевых и хромовых металлопокрытий. Выполнение работ сопровождается построением ПД-портретов моделей таких э…
- формат djvu
- размер 1.91 МБ
- добавлен
02 февраля 2012 г.
Брошюра, Изд. 5 переработанное и дополненное — Ленинград: Машиностроение Ленинградское отделение 1984 год — 97 страниц В книге даны основы хромирования, изложены свойства электролитов и хромовых покрытий, режимы хромирования, особенности технологии, нанесения защитно-декоративных, защитных и износостойких покрытий. Разделы: 1.Основы процесса хромирования 2.Свойства хромовых электролитических покрытий 3.Технология хромирования 4.Практическое приме…
Статья
- формат doc
- размер 319 КБ
- добавлен
26 октября 2011 г.
Статья. Опубликована в Galvanotechnik 2007, vol. 98, №o1, pp. 38-62 Перевод с немецк. 35 c. В статье отмечается, что по данным официальной статистики прибыль в производстве, связанном с обработкой поверхности, превысила прошлогодние показатели. Гальванотехника, вакуумная техника, неметаллические покрытия, анодирование, термообработка и лакирование оказывают решающее влияние на качество и конкурентоспособность товаров. При широком спектре потребит…
Статья
- формат pdf
- размер 3.29 МБ
- добавлен
18 января 2012 г.
Журнал Электрохимия, 2006, том 42, № 5, с. 557-565 Метод электрохимических шумов достаточно хорошо зарекомендовал себя как способ оценки скорости коррозии по сопротивлению или импедансу, вычисленному с помощью электрохимического шума. Метод электрических шумов интересен еще и тем, что потенциально он позволяет исследовать природу коррозионного процесса. В настоящей работе исследован ряд типов коррозии; показано, что большинству из них соответству…
Метод электрических шумов интересен еще и тем, что потенциально он позволяет исследовать природу коррозионного процесса. В настоящей работе исследован ряд типов коррозии; показано, что большинству из них соответству…
Справочник
- формат djvu
- размер 18.7 МБ
- добавлен
04 сентября 2010 г.
Изд.: Химия; Год: 1981; Стр. : 488; Справочник содержит обширную сводку сведений по теоретической и прикладной электрохимии. Рассмотрено около 300 уравнений электрохимии. Даны таблицы значений электропроводности, вязкости, чисел переноса и других свойств электролитов в водных и расплавленных средах. Приведено более 1000 стандартных электродных потенциалов, около 300 кинетических параметров и более 1500 потенциалов полуволн электрохимических реакц. ..
..
- формат djvu
- размер 11.18 МБ
- добавлен
29 апреля 2010 г.
В книге описаны гидроэлектрометаллургия, гальванотехника, электролиз расплавленных соединений, электролиз без выделения металлов и химические источники тока. Каждой части предшествует краткое теоретическое введение, далее идет описание процесса и аппаратуры. В конце книги приведены примеры расчета установок.
- формат djvu
- размер 1.01 МБ
- добавлен
10 сентября 2009 г.
Изд. 4-е, перераб. и доп. Л., «Машиностроение» (Ленингр. отд-ние), 1977. -96 с. с ил. (б-чка гальванотехника). В брошюре изложена технология нанесения покрытий из серебра, золота и прочих драгоценных и редких металлов, а также из сурьмы, висмута, марганца и др. В четвертом издании (3-е изд. 1971 г.) освещены новые улучшенные и ускоренные методы осаждения благородных металлов, а также сурьмы, висмута, марганца. Брошюра рассчитана на рабочих, лабор…
В четвертом издании (3-е изд. 1971 г.) освещены новые улучшенные и ускоренные методы осаждения благородных металлов, а также сурьмы, висмута, марганца. Брошюра рассчитана на рабочих, лабор…
свинец | Определение, использование, свойства и факты
ведущий
Посмотреть все СМИ
- Ключевые люди:
- Георг Рафаэль Доннер
- Похожие темы:
- обработка свинца
Месторождение типа долины Миссисипи
свинец-207
общий провод
свинец-206
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
свинец (Pb) , мягкий серебристо-белый или сероватый металл в группе 14 (IVa) периодической таблицы. Свинец очень податлив, пластичен, плотен и является плохим проводником электричества. Известный в древности и считавшийся алхимиками старейшим из металлов, свинец очень прочен и устойчив к коррозии, о чем свидетельствует продолжающееся использование свинцовых водопроводных труб, установленных древними римлянами. Символ Pb для обозначения свинца является аббревиатурой латинского слова свинец, plumbum 9.0028 .
Символ Pb для обозначения свинца является аббревиатурой латинского слова свинец, plumbum 9.0028 .
| atomic number | 82 | |
|---|---|---|
| atomic weight | 207.19 | |
| melting point | 327.5 °C (621.5 °F) | |
| boiling point | 1,744 ° C (3171,2 °F) | |
| плотность | 11,29 г/см 3 при 20 °C (68 °F) | |
| степени окисления | +2,0036 electron configuration | [Xe]4 f 14 5 d 10 6 s 2 6 p 2 or 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 4 ж 14 5 с 2 5 p 6 5 d 10 6 s 2 6 p 2 |
Occurrence and distribution
Свинец часто упоминается в ранних библейских рассказах. Вавилоняне использовали металл в качестве пластин для записи надписей. Римляне использовали его для изготовления таблеток, водопроводных труб, монет и даже кухонной утвари; действительно, в результате последнего употребления отравление свинцом было признано во времена Августа Цезаря. Соединение, известное как свинцовые белила, по-видимому, было приготовлено в качестве декоративного пигмента по крайней мере еще в 200 г. до н. э. Современные разработки относятся к разработке в конце 1700-х годов месторождений в районе Миссури-Канзас-Оклахома в Соединенных Штатах.
Вавилоняне использовали металл в качестве пластин для записи надписей. Римляне использовали его для изготовления таблеток, водопроводных труб, монет и даже кухонной утвари; действительно, в результате последнего употребления отравление свинцом было признано во времена Августа Цезаря. Соединение, известное как свинцовые белила, по-видимому, было приготовлено в качестве декоративного пигмента по крайней мере еще в 200 г. до н. э. Современные разработки относятся к разработке в конце 1700-х годов месторождений в районе Миссури-Канзас-Оклахома в Соединенных Штатах.
По весу свинец имеет почти такое же содержание в земной коре, как и олово. В космосе на 10 6 атомов кремния приходится 0,47 атома свинца. Космическое изобилие сравнимо с изобилием цезия, празеодима, гафния и вольфрама, каждый из которых считается достаточно дефицитным элементом.
Хотя свинца не так уж много, процессы естественной концентрации привели к значительным запасам, имеющим коммерческое значение, особенно в Соединенных Штатах, а также в Канаде, Австралии, Испании, Германии, Африке и Южной Америке. Значительные месторождения находятся в США в западных штатах и долине Миссисипи. Редко встречающийся в природе в свободном виде, свинец присутствует в нескольких минералах, но все они имеют второстепенное значение, за исключением сульфида PbS (галенит или свинцовый блеск), который является основным источником производства свинца во всем мире. Свинец также содержится в англезите (PbSO 4 ) и церуссит (PbCO 3 ). К началу 21 века Китай, Австралия, США, Перу, Мексика и Индия были ведущими мировыми производителями свинца в концентрате.
Значительные месторождения находятся в США в западных штатах и долине Миссисипи. Редко встречающийся в природе в свободном виде, свинец присутствует в нескольких минералах, но все они имеют второстепенное значение, за исключением сульфида PbS (галенит или свинцовый блеск), который является основным источником производства свинца во всем мире. Свинец также содержится в англезите (PbSO 4 ) и церуссит (PbCO 3 ). К началу 21 века Китай, Австралия, США, Перу, Мексика и Индия были ведущими мировыми производителями свинца в концентрате.
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Свинец может быть извлечен путем обжига руды и последующей плавки в доменной печи или путем прямой плавки без обжига. Дополнительная очистка удаляет примеси, присутствующие в слитках свинца, произведенных любым способом. Почти половина всего рафинированного свинца извлекается из переработанного лома. (Для коммерческого производства см. обработка свинца.)
Дополнительная очистка удаляет примеси, присутствующие в слитках свинца, произведенных любым способом. Почти половина всего рафинированного свинца извлекается из переработанного лома. (Для коммерческого производства см. обработка свинца.)
Использование металла
Известна только монокристаллическая модификация с плотноупакованной металлической решеткой. Свойства, которые обуславливают множество применений элементарного свинца, включают его пластичность, легкость сварки, низкую температуру плавления, высокую плотность и способность поглощать гамма-излучение и рентгеновское излучение. Расплавленный свинец является отличным растворителем и собирателем элементарного серебра и золота. Конструкционные применения свинца ограничены его низкой прочностью на растяжение и усталостной прочностью, а также его тенденцией к течению даже при небольшой нагрузке.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Свежевырезанный свинец быстро окисляется, образуя тускло-серое покрытие, ранее считавшееся субоксидом свинца, Pb 2 O, но теперь признанным смесью свинца и монооксида свинца, PbO, который защищает металл от дальнейшей коррозии. Точно так же, хотя свинец растворим в разбавленной азотной кислоте, соляная или серная кислоты разрушают его только поверхностно, поскольку нерастворимый хлорид (PbCl 2 ) или сульфатные (PbSO 4 ) покрытия препятствуют продолжению реакции. Из-за этой общей химической стойкости значительное количество свинца используется в кровельных работах, в качестве покрытий для электрических кабелей, проложенных в земле или под водой, а также для облицовки водопроводных труб и трубопроводов и конструкций для транспортировки и обработки агрессивных веществ.
Точно так же, хотя свинец растворим в разбавленной азотной кислоте, соляная или серная кислоты разрушают его только поверхностно, поскольку нерастворимый хлорид (PbCl 2 ) или сульфатные (PbSO 4 ) покрытия препятствуют продолжению реакции. Из-за этой общей химической стойкости значительное количество свинца используется в кровельных работах, в качестве покрытий для электрических кабелей, проложенных в земле или под водой, а также для облицовки водопроводных труб и трубопроводов и конструкций для транспортировки и обработки агрессивных веществ.
Элементарный свинец также может быть окислен до иона Pb 2+ ионами водорода, но нерастворимость большинства солей Pb 2+ делает свинец устойчивым к воздействию многих кислот. Окисление в щелочных условиях легче осуществить, и ему способствует образование растворимых частиц свинца в степени окисления +2. Оксид свинца (PbO 2 , со свинцом в виде иона Pb 4+ ) является одним из более сильных окислителей в кислом растворе, но он сравнительно слаб в щелочном растворе. Легкость окисления свинца повышается за счет комплексообразования. Электроосаждение свинца лучше всего осуществляется из водных растворов, содержащих гексафторсиликат свинца и гексафторкремниевую кислоту.
Легкость окисления свинца повышается за счет комплексообразования. Электроосаждение свинца лучше всего осуществляется из водных растворов, содержащих гексафторсиликат свинца и гексафторкремниевую кислоту.
Свинец имеет множество других применений, самое крупное из которых — производство аккумуляторных батарей. Применяется в боеприпасах (дробях и пулях), а также в составе припоев, типографских металлов, подшипниковых сплавов, легкоплавких сплавов и оловянных сплавов. В тяжелом и промышленном оборудовании листы и другие детали, изготовленные из соединений свинца, могут использоваться для гашения шума и вибрации. Поскольку свинец эффективно поглощает коротковолновое электромагнитное излучение, его используют в качестве защитного экрана вокруг ядерных реакторов, ускорителей частиц, рентгеновского оборудования и контейнеров, используемых для транспортировки и хранения радиоактивных материалов. Вместе с составным оксидом свинца (PbO 2 ) и со свинцово-сурьмяными или свинцово-кальциевыми сплавами он используется в обычных аккумуляторных батареях.
Lead (Pb) — Chemical properties, Health and Environmental effects
- Home
- Periodic table
- Elements
- Lead
|
. Области применения Свинцовые трубы с гербами римских императоров, использовавшиеся в качестве стоков для бань, все еще находятся в эксплуатации. Сплавы включают олово и припой. Тетраэтилсвинец (PbEt 4 ) по-прежнему используется в некоторых сортах бензина (бензина), но его использование постепенно прекращается по экологическим соображениям. Свинец в окружающей среде Самородный свинец редко встречается в природе. В настоящее время свинец обычно находится в рудах с цинком, серебром и медью и добывается вместе с этими металлами. Основной минерал свинца в галените (PbS), а также разрабатываются месторождения церрусита и англезита. Галена добывается в Австралии, которая производит 19% нового свинца в мире, за ней следуют США, Китай, Перу и Канада. Некоторое количество также добывается в Мексике и Западной Германии. Мировое производство нового свинца составляет 6 млн тонн в год, а общие извлекаемые запасы оцениваются в 85 млн тонн, что меньше 15-летнего запаса. Свинец естественным образом встречается в окружающей среде.
Подробнее о свинце в воде Назад к периодической таблице . |
More from ‘Elements’
Actinium
Silver
Aluminum
Americium
Argon
Arsenic
Astatine
Gold
Boron
Barium
Beryllium
Борий
Висмут
Берклий
Бром
Углерод
Кальций
Cadmium
Cerium
Californium
Chlorine
Curium
Cobalt
Chromium
Cesium
Copper
Dubnium
Darmstadtium
Dysprosium
Erbium
Einsteinium
Europium
Fluorine
Железо
Фермий
Франций
Галлий
Гадолиний
Германий
Водород
Helium
Hafnium
Mercury
Holmium
Hassium
Iodine
Indium
Iridium
Potassium
Krypton
Lanthanum
Lithium
Lawrencium
Lutetium
Mendelevium
Magnesium
Марганец
Молибден
Мейтнерий
Азот
Натрий
Ниобий
Neodymium
Neon
Nickel
Nobelium
Neptunium
Oxygen
Osmium
Phosphorus
Protactinium
Palladium
Promethium
Polonium
Praseodymium
Platinum
Plutonium
Radium
Rubidium
Рений
Резерфордий
Рентгений
Родий
Радон
Ruthenium
Sulfur
Antimony
Scandium
Selenium
Seaborgium
Silicon
Samarium
Tin
Strontium
Tantalum
Terbium
Technetium
Tellurium
Thorium
Lead — Element information , свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Висмут >
| Группа | 14 | Температура плавления | 327,462 ° С, 621,432 ° F, 600,612 К |
| Период | 6 | Температура кипения | 1749°С, 3180°F, 2022 К |
| Блок | п | Плотность (г см −3 ) | 11. 3 3 |
| Атомный номер | 82 | Относительная атомная масса | 207,2 |
| Состояние при 20°C | Твердый | Ключевые изотопы | 208 Pb |
| Электронная конфигурация | [Xe] 4f 1 4 5d 1 0 6s 2 6p 2 | Номер КАС | 7439-92-1 |
| ChemSpider ID | 4509317 | ChemSpider — бесплатная база данных химической структуры. | |
Свинец известен и используется людьми на протяжении многих веков. Эта длинная история отражена в изображении с использованием раннего алхимического символа для свинца и вырезанных древнеримских символов.
Тусклый серебристо-серый металл. Он мягкий и легко превращается в листы.
Этот легко обрабатываемый и устойчивый к коррозии металл использовался для изготовления труб, олова и красок со времен Римской империи. Он также использовался в свинцовой глазури для гончарных изделий, а в этом столетии — в инсектицидах, красках для волос и в качестве антидетонационной добавки к бензину. Все эти виды использования в настоящее время запрещены, заменены или не поощряются, поскольку известно, что свинец вреден для здоровья, особенно для детей.
Свинец до сих пор широко используется в автомобильных аккумуляторах, пигментах, боеприпасах, оболочке кабелей, грузах для подъема, грузовых ремнях для дайвинга, свинцовом хрустале, радиационной защите и в некоторых припоях.
Часто используется для хранения агрессивных жидкостей. Он также иногда используется в архитектуре, для кровли и витражей.
Биологическая роль свинца неизвестна. Он может накапливаться в организме и вызывать серьезные проблемы со здоровьем. Он токсичен, тератогенен (нарушает развитие эмбриона или плода) и канцерогенен.
Ежедневное потребление свинца из всех источников составляет около 0,1 миллиграмма. В среднем человеческое тело хранит около 120 миллиграммов свинца в костях.
Свинец в основном получают из минерального галенита в процессе обжига. Не менее 40% свинца в Великобритании перерабатывается из вторичных источников, таких как лом батарей и труб.
Элементы и история периодической таблицы
Свинец добывали более 6000 лет, и этот металл и его соединения использовались на протяжении всей истории. Небольшие свинцовые самородки были найдены в доколумбовых Перу, Юкатане и Гватемале.
Греки добывали свинец в больших масштабах с 650 г. и знали не только, как получить металл, но и как превратить его в свинцовые белила. Из-за своей превосходной кроющей способности он был основой красок более 2000 лет, до середины прошлого века.
и знали не только, как получить металл, но и как превратить его в свинцовые белила. Из-за своей превосходной кроющей способности он был основой красок более 2000 лет, до середины прошлого века.
Римляне использовали свинец в больших масштабах, добывая его в основном в Испании и Британии, а также используя его для изготовления водопроводных труб, гробов, оловянной посуды и для обесценивания своих серебряных монет. В то время как его добыча сократилась в Средневековье, он снова появился в средневековье и нашел новые применения, такие как глазурь для керамики, пули и типографские шрифты. В прошлом веке это была добавка к топливу.
| Атомный радиус, несвязанный (Å) | 2.02 | Ковалентный радиус (Å) | 1,45 |
| Сродство к электрону (кДж моль −1 ) | 35. 121 121 | Электроотрицательность (шкала Полинга) | 1,8 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 715,596 2 -й 1450.414 3 рд 3081. 4 -й 4083,26 5 -й 6638,2 | ||
| Общие степени окисления | 4, 2 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 204 Pb | 203,973 | 1,4 | — | — | |
| 206 Pb | 205. 974 974 | 24.1 | — | — | |
| 207 Pb | 206.976 | 22.1 | — | — | |
| 208 Pb | 207,977 | 52,4 | > 2 x 10 19 г | нф | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 130 | Модуль Юнга (ГПа) | 16. 1 1 | |||||||||||
| Модуль сдвига (ГПа) | 5,59 | Объемный модуль (ГПа) | 45,8 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
Слушайте ведущий подкаст |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет, на этой неделе мы погружаемся на новые глубины, встречая металл, породивший отвес, рок-группу, водопровод и даже отравление, а не не говоря уже о поколении алхимиков, которые тщетно пытались превратить это вещество в золото. Это, конечно же, свинец, и здесь, чтобы разжечь его для нас, научный писатель Фил Болл. Фил Болл Свинец — Иа-Иа среди металлов — медленный, тупой и тяжелый. В своей латинской форме, plumbum , оно входит в наш лексикон благодаря своему мягкому и тяжеловесному характеру: когда-то мы ныряли в глубины с подвешенным серым шариком вещества, управляемым силой тяжести, а сантехники уже давно поменяли свои гибкие свинцовые трубы. для пластика. Все, что связано со свинцом, тяготеет к перегруженному мраку: в древней схеме металлической символики свинец связывался с Сатурном, печальной планетой, олицетворяемой старым богом, также называемым Кроносом, который кастрировал своего отца и проглотил своих детей. Да, свинец — это изначальный тяжелый металл, самый печально известный преступник в этой токсичной группе. Свинец повреждает мозг и почки, может вызывать анемию и форму подагры с печальным названием сатурниновой подагры. Даже римляне знали об отравлении свинцом — врач Корнелий Цельс предупреждал о пагубном влиянии свинцовых белил, используемых в красках и косметике, а инженер Витрувий рекомендовал глиняные трубы вместо свинцовых. И все же мы медленно учились. Свинцовые белила, форма карбоната свинца, оставались лучшим белым пигментом художника вплоть до девятнадцатого века, когда его заменили цинковыми белилами. Когда производство красок стало промышленным, свинцовые белила распространяли болезни и смерть среди фабричных рабочих: в отчете «Труды Королевского общества» за семнадцатый век среди причин, которые он вызывал, перечислены головокружение, головокружение, слепота, тупость и паралитические состояния. А уже в 2007 году производитель игрушек Mattel был вынужден отозвать миллионы игрушек китайского производства, окрашенных свинцовой краской. Тем временем токсичные струйки свинца из припоя и электродов аккумуляторов медленно вымываются со свалок по всему миру. В 2006 году Европейский Союз фактически запретил использование свинца в большинстве бытовой электроники, но он по-прежнему используется в других странах. Для алхимиков свинец был самым низшим из металлов — в некотором смысле именно с него зародились все металлы. Говоря о неблагородных металлах, которые алхимия пыталась превратить в серебро и золото, не было ни одного столь неблагородного металла, как свинец. Алхимики считали, что свинец медленно превращается в другие металлы в земле. Но алхимия также давала свинцу шанс избавиться от серого и безобразного образа. Чтобы получить великолепные цвета из свинца, не требуется много времени. Древние технологи отбеливали тусклый металл, помещая свинцовые полоски в горшки с уксусом и закрывая их в сарае, полном навоза животных. Для алхимиков эти изменения цвета были не просто способом изготовления пигментов. Они означали более глубокие изменения, происходящие в металле, приближающие его цвет к золоту. Неудивительно поэтому, что их эксперименты часто начинались со свинца. Они не приблизились к получению настоящего золота, но начали исследовать процессы химического превращения. Свинец, однако, кажется, привык показывать свои истинные и грязные цвета. На воздухе он может продолжать поглощать кислород, пока не станет черным. Красный свинец стал шоколадно-коричневым на картинах по всему миру, от Японии до Индии и Швейцарии. Крис Смит Фил Болл исследует глубины научной истории о свинце. Следующее издание Химии в своей стихии обещает стать рекордсменом. Марк Пеплоу Вы можете многое узнать о человеке, познакомившись с его семьей, то же самое можно сказать и об элементе. Вот как мы так много узнали об астате. Часто провозглашаемый самым редким природным элементом в мире, было подсчитано, что верхний километр земной коры содержит менее 50 мг астата, что делает его самым редким элементом в Книге рекордов Гиннеса. Крис Смит И вы можете услышать, как Марк Пеплоу рассказывает историю о самом редком в мире химическом веществе в выпуске «Химия в его стихии» на следующей неделе. Я Крис Смит, спасибо, что выслушали, увидимся в следующий раз. (Promo) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о лиде
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
Data
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. Таблица 904 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
Использование и свойства
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.

 154 nm
154 nm Он очень мягкий, очень податливый, пластичный и относительно плохой проводник электричества. Он очень устойчив к коррозии, но тускнеет на воздухе. Изотопы свинца являются конечными продуктами каждого из трех рядов встречающихся в природе радиоактивных элементов.
Он очень мягкий, очень податливый, пластичный и относительно плохой проводник электричества. Он очень устойчив к коррозии, но тускнеет на воздухе. Изотопы свинца являются конечными продуктами каждого из трех рядов встречающихся в природе радиоактивных элементов. Одним из основных его применений является изготовление стекол компьютерных и телевизионных экранов, где он защищает зрителя от радиации. Другие виды использования включают в себя защитное покрытие, кабели, припои, посуду из свинцового хрусталя, боеприпасы, подшипники и в качестве веса в спортивном снаряжении.
Одним из основных его применений является изготовление стекол компьютерных и телевизионных экранов, где он защищает зрителя от радиации. Другие виды использования включают в себя защитное покрытие, кабели, припои, посуду из свинцового хрусталя, боеприпасы, подшипники и в качестве веса в спортивном снаряжении. Однако большая часть концентраций свинца в окружающей среде является результатом деятельности человека. Из-за применения свинца в бензине возник неестественный свинцовый цикл. В автомобильных двигателях свинец сжигается, так что образуются соли свинца (хлор, бром, оксиды).
Однако большая часть концентраций свинца в окружающей среде является результатом деятельности человека. Из-за применения свинца в бензине возник неестественный свинцовый цикл. В автомобильных двигателях свинец сжигается, так что образуются соли свинца (хлор, бром, оксиды).  Свинец является одним из четырех металлов, оказывающих наиболее вредное воздействие на здоровье человека. Он может попасть в организм человека с пищей (65%), водой (20%) и воздухом (15%).
Свинец является одним из четырех металлов, оказывающих наиболее вредное воздействие на здоровье человека. Он может попасть в организм человека с пищей (65%), водой (20%) и воздухом (15%). Из-за этого он может нанести серьезный ущерб нервной системе и мозгу еще не родившихся детей.
Из-за этого он может нанести серьезный ущерб нервной системе и мозгу еще не родившихся детей. Вот почему мы сейчас начинаем задаваться вопросом, может ли загрязнение свинцом повлиять на глобальные балансы.
Вот почему мы сейчас начинаем задаваться вопросом, может ли загрязнение свинцом повлиять на глобальные балансы. 481
481 2
2 1
1

 Даже искра гламура, которую металл получает от ассоциации с величайшей рок-группой мира, проистекает из предсказания Иа-Иа, что они утонут, как свинцовый воздушный шар или дирижабль.
Даже искра гламура, которую металл получает от ассоциации с величайшей рок-группой мира, проистекает из предсказания Иа-Иа, что они утонут, как свинцовый воздушный шар или дирижабль.
 Уксусные пары и газ от брожения навоза разъедали свинец в свинцовые белила. Осторожно нагрейте его, и он станет желтым: форма оксида свинца, известная как глет или, в средние века, массакот. Нагрейте его еще немного, и он станет ярко-красным, поскольку вы образуете другой вид оксида. Оба этих вещества использовались художниками — сурик долгое время был их лучшим красным цветом, которым в Средние века красили многие яркие одежды. Это был фирменный цвет Святого Иеронима.
Уксусные пары и газ от брожения навоза разъедали свинец в свинцовые белила. Осторожно нагрейте его, и он станет желтым: форма оксида свинца, известная как глет или, в средние века, массакот. Нагрейте его еще немного, и он станет ярко-красным, поскольку вы образуете другой вид оксида. Оба этих вещества использовались художниками — сурик долгое время был их лучшим красным цветом, которым в Средние века красили многие яркие одежды. Это был фирменный цвет Святого Иеронима. В городских галереях существует еще одна опасность, так как сернистые пары загрязнений вступают в реакцию с суриком, образуя сульфид черного свинца. Кажется, от этого никуда не деться: у свинца мрачное и меланхоличное сердце.
В городских галереях существует еще одна опасность, так как сернистые пары загрязнений вступают в реакцию с суриком, образуя сульфид черного свинца. Кажется, от этого никуда не деться: у свинца мрачное и меланхоличное сердце.