Защита меди от коррозии: Защита меди от коррозии ингибитором СП-В-12-0
Содержание
Как защитить от коррозии медные трубы и другие знания из коллекции ПромВодСнаб
Катодная защита может быть неотъемлемой частью водопроводной системы в зданиях.
Возникновение в зданиях под бетонными перекрытиями (плитами) протечек, вызываемых коррозией медного трубопровода для сточных вод, является широко распространенной проблемой. В таких случаях всё чаще и чаще используется катодная защита, как экономичная альтернатива замене труб и непрерывному ремонту при постоянных протечках. Катодная защита представляет собой электрический процесс, используемый для предотвращения коррозии металла, находящегося в контакте с электролитом (сточными водами или водой). Примером распространенного применения катодной защиты от коррозии служит ее использование в обычных бойлерах (см. рис. №1).
Применение катодной защиты может значительно сократить частоту протечек или же устранить их. Herbert H. Uhlig, ученый из Массачусетского технологического института, пишет о важной роли катодной защиты в современном обществе: “Гарантия того, что в почве не появятся никакие протечки в трубопроводе, проходящем под землей и находящемся под катодной защитой, сделала транспортировку нефти и природного газа через половину американского континента экономически выполнимой задачей”.
Утечки газа и нефти из трубопроводов абсолютно неприемлемы с точки зрения безопасности окружающей среды и стоимости этих продуктов. В то же время водопроводные протечки, к сожалению, рассматриваются как рутинный вопрос, связанный с ремонтом. Такое мышление привело к огромным тратам в силу распространенности этой проблемы, предотвратить которую можно было бы катодной защитой.
Правильная конструкция системы
Чтобы быть эффективной, катодная защита должна быть правильно спроектирована; требования к ее конструкции могут меняться. Факторы, влияющие на надлежащее качество конструкции, могут быть следующими: количество металла в грунте; современные требования по защите; удельная проводимость грунта; схема трубопровода и геологические формирования, влияющие на текущее распределение; непрерывность перекачки по трубопроводу; размеры здания и потребность в потреблении электроэнергии.
Неправильное применение катодной защиты и ее неправильное сочетание с псевдонаучными техническими новинками исказили представление некоторых владельцев и менеджеров относительно использования этого метода.
Преимуществом катодной защиты является ее низкая стоимость и удобство в использовании. Она может быть установлена без каких-либо неудобств, так как все работы проводятся вне здания (типичный проект представлен на рис. 2). Катодная защита может служить дополнением к другим способам по уменьшению протечек; в то же время она не мешает вам использовать традиционный метод борьбы с ними — полную или частичную замену труб и покрытия — или же использовать трубы из новых, продвинутых материалов.
Принцип работы
Научный принцип работы катодной защиты описан в каждом учебнике по химии для средней школы. Этот принцип заключается в том, что электрический поток проходит между двумя электродами (анодом и катодом) в электролите (грунте или воде). В таких условиях электрохимические реакции должны происходить на поверхности электродов.
Окисление (коррозия) должно происходить на одном электроде (аноде), а восстановление (защита от коррозии) – на другом электроде (катоде). В катодной системе труба, которая должна быть защищена, выступает в роли катода, и на ее поверхности может произойти только безопасная реакция восстановления.
В катодной системе труба, которая должна быть защищена, выступает в роли катода, и на ее поверхности может произойти только безопасная реакция восстановления.
Опасная реакция окисления происходит только на отдаленно установленных анодах, которые разработаны так, чтобы использоваться в течение всего срока службы. Для достижения полной защиты у вас должно быть достаточное количество анодов, расположенных в правильном месте.
Ограничения / недостатки в применении катодной защиты
Из вышеприведенного описания, очевидно, что есть некоторые физические требования, необходимые для работы катодной защиты. Для того чтобы провести электрический поток между анодом и катодом, у вас должно быть напряжение, электрическая цепь (схема), катод, анод и электролит.
Поскольку воздух — непроводник (не является электролитом), с помощью катодов вы не сможете защитить поверхности трубопровода или устройств, которые находятся на открытом воздухе. Кроме того, вы не можете установить катодную защиту на внутренние поверхности трубопровода, т.к. непрактично тянуть аноды внутри водопроводных труб по всему зданию.
Кроме того, вы не можете установить катодную защиту на внутренние поверхности трубопровода, т.к. непрактично тянуть аноды внутри водопроводных труб по всему зданию.
Внутренние поверхности водонагревателя местного значения вы можете защитить, т.к. физически возможно поместить анод в резервуар; защита ограничена тем, что физически может «видеть» анод; от анода защитный поток направится к катоду по пути наименьшего сопротивления, чтобы замкнуть цепь и он не спустится вниз по сети трубопровода.
Короче говоря, применение катодной защиты ограничивается защитой внешней (со стороны почвы) поверхности помещенных в грунт труб и резервуаров.
В случаях, когда коррозия металлического трубопровода в зданиях возникает от контакта с водой, могут применяться другие методы контроля над коррозией, такие как использование ингибиторов (замедлителей реакции), обшивки или обработка поверхностей.
Жизнеспособная альтернативная
Катодная защита является жизнеспособной альтернативой в борьбе с постоянной проблемой протечек под плитами из-за коррозии трубопроводов, расположенных в грунте. Ее следует использовать в дополнение к оплетке или другим покрытиям, наносимым на медные трубопроводы, расположенные в грунте. Неправильное использование катодной защиты, а также неправильная диагностика того, что действительно вызывает протечки, препятствуют ее более широкому использованию.
Ее следует использовать в дополнение к оплетке или другим покрытиям, наносимым на медные трубопроводы, расположенные в грунте. Неправильное использование катодной защиты, а также неправильная диагностика того, что действительно вызывает протечки, препятствуют ее более широкому использованию.
В отношении правильного применения катодной защиты необходимо обратиться за консультацией к опытному и надлежащим образом обученному инженеру или специалисту по вопросу коррозии.
Коррозия меди: виды, ингибиторы, скорость развития
Медь относится к категории материалов, которые подвергаются коррозии при воздействии агрессивных сред. В результате происходит порча материала, постепенное разрушение и потеря нормальных эксплуатационных качеств.
Во многом особенности процесса и его динамика могут отличаться в зависимости от среды, температурных условий и других характеристик.
Рассмотрим, в каких средах материал начинает портиться быстрее всего и как дополнительно защитить его от процесса ржавения.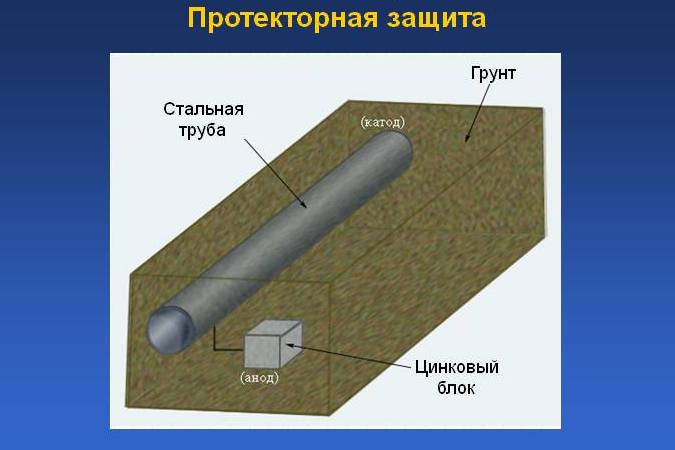
Особенности разных видов агрессивных сред
Тип повреждений и скорость коррозии меди напрямую зависят от того, в какой атмосфере она находится. Даже самые качественные материалы не могут выдержать на протяжении длительного времени под сильным агрессивным воздействием.
Далее опишем основные виды сред и их воздействие на материал.
Вода
Медные детали могут использоваться в различных вариантах водных сред. Меняется состав жидкости, скорость ее движения и другие важные характеристики.
Основной параметр, влияющий на интенсивность протекания процесса – наличие на поверхности материала уже успевшей сформироваться оксидной пленки.
Есть несколько параметров, влияющих на протекание процесса в водной среде:
- Интенсивность движения потока. Коррозия меди в воде усиливается, когда поток движется с большой скоростью. В таком случае процесс ржавения будет называться ударным.
- Степень аэрированности. Чем больше в воде кислорода, тем выше скорость протекания ударной коррозии.
 Это особенно актуально для воды с пониженной жесткостью и значительной степенью содержания хлора.
Это особенно актуально для воды с пониженной жесткостью и значительной степенью содержания хлора. - Климатическая зона. Обычно в теплых и влажных областях скорость протекания процесса становится значительно выше.
- Состав воды. Как и для других видов металлов, морская вода представляет для меди самую большую опасность. Есть значительный риск развития электрохимической коррозии меди при контакте нескольких видов металлических изделий, расположенных неподалеку друг от друга. Но есть и преимущество – исключено биологическое ржавение, потому что на медных поверхностях вредоносные морские микроорганизмы не выживают. При использовании в чистой воде, опасность намного меньше, потому часто медные трубы применяются для монтажа системы отопления и водоснабжения в частном секторе.
Иногда разрушение может стимулироваться и неожиданными катализаторами. Один из них – прохождение воды через сильно изношенные коммунальные сети. Если в воде большое количество железа, есть большой риск начала электрохимического процесса.
Если в воде большое количество железа, есть большой риск начала электрохимического процесса.
Стоит также обратить внимание на то, какие материалы располагаются рядом с медными изделиями в условиях высокой влажности.
Среди наиболее опасных – алюминий и цинк.
Универсальным решением для проблемы использования труб в коммунальных сетях, становится применение в процессе их изготовления луженой меди. В этом случае изнутри труба покрывается оловом.
Стоимость производства становится выше, но процесс окупает себя за счет увеличения продолжительности использования без замен.
Атмосферное воздействие
Этот тип материала – один из наиболее стойких среди всех представленных на рынке, когда дело доходит до применения на открытом воздухе.
Главное свойство материала в таком случае – возможность постепенного появления оксидной пленки (патины). Именно патина становится естественным защитным покрытием, которое ограничивает контакт такого вида сырья со множеством типов потенциальных окислителей.
Таким образом достигается аналогичный цинкованию эффект, но без использования дополнительных примесей и составов.
По причине склонности к патинированию, можно свободно использовать медь на открытом воздухе. Этим часто пользуются архитекторы, когда нужно обеспечить покрытие кровли, создание малых архитектурных форм и решить другие вопросы в рамках комплексного благоустройства.
Скорость появления патины может отличаться в зависимости от климатической зоны, средних температур и других особенностей.
Вероятность негативного воздействия атмосферы увеличивается в том случае, если в воздухе много посторонних примесей. Особенно часто начинает развиваться коррозия в местах, где в воздушной среде рассеяно много хлоридов и сульфидов.
Почва
При ответе на вопрос о том, может ли медь ржаветь, когда изделие помещается в почву, важно учитывать главный параметр грунта – рН или степень щелочности.
Чем она выше, тем больше будет кислотность. Так как кислоты негативно влияют на состояние меди и запускают процесс коррозии, лучше не использовать материал в сильно щелочных грунтах.
Еще один потенциальный фактор опасности – большая концентрация грунтовых микроорганизмов.
Проблем связана с тем, что в процессе своей жизни они выделяют сероводород.
Это еще одно вещество, которое негативно влияет как на саму медь, так и на ее многочисленные сплавы.
Обычно при контакте с негативными факторами грунта, на поверхности материала начинают накапливаться продукты коррозии. Они наслаиваются друг на друга, пленка может становиться рыхлой, неоднородной.
Потому если в атмосфере на материале возникает благородная патина, то в почве структура сильно отличается. Чаще всего – это крупные слоистые твердые наросты.
Интересная особенность меди заключается в том, что даже если она провела в земле много лет, большинство продуктов окисления можно удалить механическим или химическим методами.
Может ли ржаветь луженая медь
Выше отмечалось, что одним из средств борьбы с коррозией медных труб становится использование процесса лужения – нанесения на внутреннюю поверхность слоя олова. Но важно понимать, что для металлического изделия это не панацея.
Но важно понимать, что для металлического изделия это не панацея.
Само оловянное покрытие становится анодом. Это значит, что по отношению к меди у него более отрицательный потенциал.
Главное условие защиты от ржавения заключается в том, чтобы на оловянном слое не было трещин и иных дефектов. Если они все-таки появляются, коррозия меди на воздухе протекает намного быстрее.
В каких средах можно и нельзя использовать медь
При правильной обработке, материал прослужит без коррозии более 100 лет. Но важно понимать, где медь будет устойчива к катализаторам коррозии, а где есть большой риск ее появления.
Безопаснее всего применять материал на открытом воздухе и в пресной воде, вне зависимости от степени охлаждения или нагрева. В морской воде материал также долго остается неповрежденным и сохраняет свои эксплуатационные характеристики.
Также можно не беспокоиться за сохранность медной детали, если в окружающей среде нет сильных окислителей.
Опасность потенциально может появляться в том случае, если в почве, воде или воздухе есть много сероводорода, присутствует угольная кислота, соли тяжелых металлов, амины.
Когда вода сильно аэрирована, также возникает значительная опасность ударной коррозии и других видов постепенного разрушения.
Потому при покупке такого материала очень важно понимать, где вы будете использовать медное изделие, и какие внешние угрозы будут действовать на него в процессе эксплуатации.
О важности чистки
Чтобы продлить срок использования вашего изделия, его нужно регулярно чистить.
Постепенно большинство типов бытовых приборов и других материалов могут потерять товарный вид и потускнеть из-за образования оксидной пленки.
Это красивое средство для состаривания посуды или других видов изделий, но многим присутствие патины не нравится.
Есть несколько наиболее распространенных методов очистки, помогающих снять патину и оставить основной материал без повреждений:
- Специальные растворы для мытья посуды.
 В таком случае поверхность становится более восприимчивой к удалению оксидной пленки. Если она появилась недавно, снять продукты окисления можно будет, не прикладывая серьезных усилий.
В таком случае поверхность становится более восприимчивой к удалению оксидной пленки. Если она появилась недавно, снять продукты окисления можно будет, не прикладывая серьезных усилий. - Лимонная кислота. Может использоваться как в составе раствора, так и при простом воздействии на поверхность свежеразрезанной долькой. Патина удаляется быстро и эффективно.
- Уксус. Оказывает такое же действие, как и лимон. Для улучшения эффекта, его часто смешивают с солью или мукой.
И это только часть методов, которые можно применять для борьбы с патиной.
Как защитить медь от коррозии
Существует множество средств, которые позволяют уменьшить вероятность появления коррозии в различных средах. Среди них такие, как:
- Изменение состава материала. Использование легирования позволяет значительно увеличить уровень коррозийной стойкости. При этом примеси могут быть разные – главное учитывать область использования готовой детали и понимать потенциальные риски, чтобы их устранить.

- Лужение. Процесс заключается в обработке жидким оловом. На поверхности создается эффективный защитный слой. При условии отсутствия дефектов, он ограничит контакт с атмосферой и другими факторами, приводящими к появлению коррозии.
- Контроль за областью использования. При закупке медных изделий важно понимать, где вы будете их применять. Требуется оградить материал от контакта с серой и ее соединениями, не допустить, чтобы поблизости располагались цинковые или алюминиевые детали. Они могут спровоцировать появление электрохимической коррозии.
Учет стандартных требований по использованию медных изделий позволит значительно увеличить срок их службы и не допустить проблем с возникновением коррозии.
Вернуться к статьям
Поделиться статьей
защита, как происходит в щелочной среде, во влажном воздухе
Содержание:
- 1 Воздействие водной среды
- 2 Воздействие кислот и щелочей
- 3 Коррозия в почве и влажном воздухе
- 4 Видео: Как остановить коррозию медных монет
Медь широко применяется в различных отраслях промышленности, это обусловлено высокой коррозионной стойкостью, электропроводностью и теплопроводностью. Коррозия меди представляет собой разрушение физического состояния под воздействием факторов окружающей среды. Разрушение материала может происходить при следующих условиях:
Коррозия меди представляет собой разрушение физического состояния под воздействием факторов окружающей среды. Разрушение материала может происходить при следующих условиях:
Изделия из меди наиболее устойчивы в атмосфере, морской воде, в горячей и холодной пресной воде. В морской воде медь не обрастает микроорганизмами, поскольку ее ионы оказывают губительное воздействие на водоросли и моллюсков. Этот металл абсолютно не устойчив в растворах серы и ее соединениях, в окислительных веществах, аэрированных водах, азотная кислота полностью разрушает его структуру.
Воздействие водной среды
В водной среде медь подвергается коррозии
В воде скорость коррозии меди зависит от наличия в ее составе оксидных пленок и растворенного кислорода. Чаще всего металл подвергается ударной или точечной коррозии. Чем насыщеннее вода кислородом, тем быстрее протекают процессы коррозии меди. Пагубно влияют воды, содержащие ионы хлора и низкий уровень pH. Но в целом этот металл оказывает высокое сопротивление водной среде, а разрушению препятствует появление слоя оксида. Так называемая зеленая или черная корка плотно соприкасается с поверхностью изделия и не позволяет разрушающим веществам проникать в металл. Оксид начинает образовываться после двух месяцев непрерывного нахождения изделия в воде. Оксидный слой бывает двух видов:
Так называемая зеленая или черная корка плотно соприкасается с поверхностью изделия и не позволяет разрушающим веществам проникать в металл. Оксид начинает образовываться после двух месяцев непрерывного нахождения изделия в воде. Оксидный слой бывает двух видов:
Медные изделия поднятые со дна океана
- карбонат – имеет зеленый цвет и считается более прочным;
- сульфат – имеет темный цвет и рыхлую структуру.
Медь является наиболее предпочтительным металлом для изготовления трубопроводов. Но если, вода, проходящая по медным трубам, в дальнейшем контактирует с алюминием, железом или цинком, то она в значительной мере ускорит коррозию этих металлов. Для предотвращения этого и защиты меди от коррозии используют лужение металла, которое получают путём нанесения на поверхность изделия расплавленного олова. Луженое изделие отличается высокой коррозийной стойкостью, оно не подвержено перепадам температур и способно противостоять негативным атмосферным факторам.
Воздействие кислот и щелочей
Водопроводные трубы из меди
Кислотная среда является для меди наиболее агрессивной. Самое сильное воздействие оказывают азотная и серная кислота, если раствор концентрированный, то металл может полностью раствориться. Эту особенность металла учитывают при изготовлении труб, деталей для нефтегазовой промышленности, где такие кислоты присутствуют постоянно. Коррозия меди в щелочной среде не наблюдается, наоборот, в щелочи медь восстанавливается с двухвалентного состояния до одновалентного. Медь сама по себе является щелочным металлом.
Для защиты металла от кислотного воздействия используют ингибиторы – это такие вещества, которые способны замедлить химические реакции. Различают следующие виды ингибиторных веществ:
- экранирующие – образуют на поверхности металла защитную пленку и не позволяют ему контактировать с кислотой;
- окислительные – образуют слой окиси на металле, который вступает в реакцию с кислотой и препятствуют ее проникновению к поверхности металла, при этом чем толще это слой, тем выше защита;
- катодные – повышают перенапряжение катодов раствора, вследствие чего химическая реакция замедляется.

Для меди наиболее приемлемым является экранирующий вид ингибиторов, при этом используют бензотриазол, вместе с солями меди он образует защитную пленку и препятствует разрушению металла.
Коррозия в почве и влажном воздухе
Разрушение меди в грунте происходит под влиянием кислот, содержащихся в почве, в отличие от воды насыщенные кислородом породы в меньшей степени окисляют металл. Наибольшую опасность для изделий из меди представляют живущие в почве микроорганизмы, точнее, продукты их жизнедеятельности.
Земля также как и вода подвергает медные трубы коррозии
Многие из них выделяют сероводород, который способен разрушить структуру металла. Изделие, которое находилось долгое время в земле, может полностью рассыпаться при изъятии.
Во влажном воздухе коррозия меди проявляется с течением длительного периода времени. Сухой климат вообще не влияет на разрушение металла. Влажный воздух насыщен углекислым газом, сульфидами, хлоридами – эти вещества вызывают коррозию металла, разрушая ее защитную пленку. При длительном пребывании изделия во влажном воздухе начинает образовываться слой патины – это оксид солей, он сначала имеет темно-коричневый цвет, затем приобретает зеленый оттенок. Патина не растворяется в воде и не подвержена влиянию влажности, а также нейтральна к меди, поэтому не только не разрушает ее, но и выполняет защитную функцию. На сегодняшний день существуют методы искусственного создания патины, их чаще всего используют художники и скульпторы, делая предметы, похожими на старинные вещи. Винтажный стиль в интерьере сейчас пользуется большой популярностью.
При длительном пребывании изделия во влажном воздухе начинает образовываться слой патины – это оксид солей, он сначала имеет темно-коричневый цвет, затем приобретает зеленый оттенок. Патина не растворяется в воде и не подвержена влиянию влажности, а также нейтральна к меди, поэтому не только не разрушает ее, но и выполняет защитную функцию. На сегодняшний день существуют методы искусственного создания патины, их чаще всего используют художники и скульпторы, делая предметы, похожими на старинные вещи. Винтажный стиль в интерьере сейчас пользуется большой популярностью.
Видео: Как остановить коррозию медных монет
Как быстро ржавеет медь и что с этим делать
Как быстро ржавеет медь и что с этим делать
Медные изделия применяются людьми на протяжении многих веков. Даже в древнейшие времена стоимость такого металла могла приравниваться к стоимости золота, так как производства данного металла было очень дорогостоящим.
На данный момент медь стала куда дешевле, и потому из нее, помимо украшений, стараются делать посуду, аксессуары в интерьер и остальные предметы. Не задумывались ли над тем, как быстро ржавеет медь?
Коррозия меди, в отличия от того же железа, развивается крайне медленно за счет ее устойчивости к такому явлению, и все же иногда требуется принимать меры по очищению изделий от ужасного налета.
Содержание:
- 1 Коррозия металлов/сплавов – что это
- 2 Подробности
- 2.1 Коррозионные качества
- 2.2 Условия для разрушения меди
- 2.2.1 Воздействие воды
- 2.2.2 Влияние щелочей и кислот
- 2.3 Коррозия от влажного воздуха и почвы
- 3 Почему медные изделия требуется регулярно очищать?
- 3.1 Эффективные способы очистки меди
- 3.2 Очистка медных монет
Коррозия металлов/сплавов – что это
Под ржавлением подразумевается процесс разрушения металла под воздействием негативных факторов в окружающей среде.
В той или иной мере будут ржаветь все металлы, сплавы, и в результате этого на них появляется ржавчина и места ухудшения целостности (а именно, дыры). Со временем могут начать портиться все неметаллы – примером можно называть старение резины или даже пластика от воздействия с кислородом, при постоянном контакте с водой, а еще из-за температурных перепадов.
Главной первопричиной ржавления можно считать термодинамическую неустойчивость металла к воздействию факторов физического типа или даже веществ химического происхождения, которые есть в контактной среде. В сравнении с железом медь будет окисляться куда меньше, но при увеличении температуры такой процесс будет сильно ускоряться. При регулярном нахождении в среде при температуре выше +105 градусов любой металл будет ржаветь в несколько раз быстрее.
Подробности
Коррозионные качества
Медь представляет собой металл с высокими свойствами пластичности, которые имеют красновато-золотистый цвет, а после снятия оксидной пленки немного розоватым. По электрической проводимости он будет уступать только серебру, еще характеризуется огромной степенью тепловой проводимости. За счет низкого удельного сопротивления медь используется в электротехнике – она идет на изготовление пластинок из меди, обмотки электрической двигателей, проволоки.
По электрической проводимости он будет уступать только серебру, еще характеризуется огромной степенью тепловой проводимости. За счет низкого удельного сопротивления медь используется в электротехнике – она идет на изготовление пластинок из меди, обмотки электрической двигателей, проволоки.
Обратите внимание, что из-за прекрасных антикоррозионных свойств металл будет включаться в сплавы для усовершенствования их инженерных характеристик (латунь, бронза и прочие). В гальванической среде медь превращается в катод, и начинает вступать в электрохимические процессы, а еще вызывает ускоренный процесс ржавления остальных металлов.
Медь является неактивным химическим элементов, и потому она практически не взаимодействует с водой (морской или пресной), воздухом. Если воздух сухой, на поверхность материала будет формироваться оксидная пленка с толщиной до 50 мн. Изделие из меди начинает темнеть, становится зеленоватым или коричневым, и это называется патиной. Во множестве случаев патина воспринимается, как покрытие декоративного типа. Коррозионная интенсивность мала при контактировании с разведенной соляной кислотой, но при реакции со множеством остальных кислот, с галогенами, «царской водкой» металл будет окислен с образованием медного карбоната.
Коррозионная интенсивность мала при контактировании с разведенной соляной кислотой, но при реакции со множеством остальных кислот, с галогенами, «царской водкой» металл будет окислен с образованием медного карбоната.
Условия для разрушения меди
Несмотря на стойкости к порче, даже изделия из меди при определенных условиях способны ржаветь. Меньше всего такие явления выражены в воде, влажном воздухе, почве и даже больше – в среде кислого типа. Ощутимо уменьшать коррозию можно посредством лужения – покрытия меди оловянным слоем. Качественный процесс лужения дает надежность и защиту от дефектов, а еще повышает устойчивость к коррозии, делает материал не подверженным воздействию высокой температуры, града, дождя и снега. Срок применения луженых изделий будет составлять больше сотни лет без потери первозданных качеств.
Воздействие воды
Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Обратите внимание, что, если на поверхности изделия, которое покрыто посредством меди, имеет зеленая или даже коричневая оксидная корочка, разрушающие компоненты в малой степени будут проникать внутрь. Как правило, слой оксида образуется спустя 2 месяца нахождения металла в воде. Намного прочнее будет считаться зеленая корочка (то есть карбонатная), рыхлой и не такой крепкой – черная (сульфатная).
В воде из моря степень коррозии почти такой же, как и в обычной, то есть пресной. Лишь при ускорении передвижения воды ржавление станет ударным, и потому более интенсивным. Медь является материалом, который не может обрастать морскими микроскопическими организмами, потому что его ионы губительные для водорослей и моллюсков. Такое свойство металла применяется в судоходстве, а также в рыбном хозяйстве.
Такое свойство металла применяется в судоходстве, а также в рыбном хозяйстве.
Влияние щелочей и кислот
В щелочах медь не будет портиться, потому что материал сам по себе является щелочным, зато кислоты для нее будут являться самыми негативными по воздействию. Самая быстрая и значимая коррозия будет происходить при контактировании с серой и ее кислотными типами соединений, а азотная кислота способна полностью разрушать структуру материала. В концентрированной кислоте медь начинает растворяться, и потому при изготовлении оборудования для промышленности нефтегазового типа требуется дополнительная защита.
С такой целью применяют ингибиторы – замедлители химической реакции:
- Экранирующие – создают пленку, которая не дает кислотам достигать медной поверхности.
- Окислительные – помогают превратить верхний слой в окись, которая начнет вступать в реакцию с кислотами без вреда непосредственно для самого металла.
- Катодные – увеличивают катодное перенапряжение, чем замедлят реакцию.
Рассмотрим еще кое-что, касающееся коррозии
Коррозия от влажного воздуха и почвы
В почве проживает большое количество микроскопических организмов, которые способны вырабатывать сероводород, так как среда тут кислая, а скорость коррозии меди возрастет. Чем больше отклонение значения рН в стороне окисления, тем скорее будут протекать разрушительные процессы. Если почва оснащена кислородом, то металл начинает окисляться, но ржаветь будет меньше. При длительном нахождении изделий из меди в земле они начинают зеленеть, становятся рыхлыми и способны даже рассыпаться. Краткосрочное пребывание в грунте вызывает образование патины, от которой предмет можно очищать. Кстати, влажный воздух способен плохо сказываться на состоянии материала лишь при длительном контакте, а для начала тоже вызывает образование патины (оксидного слоя). Исключение будет составлять пар, который насыщенный сульфидами, хлоридами, углекислотой – в нем коррозия будет развиваться стремительнее.
Почему медные изделия требуется регулярно очищать?
Ковши из меди, турки, самовары отличаются высокой степенью тепловой проводимости, и потому нагревание в них протекает равномерно, а продукты будут приготовлены быстрее. Это обусловлено высокую популярность изделий в быту. Потребность в очистке медных предметов обусловлено утратой ими визуальной привлекательности спустя время. Особенно быстро начинают тускнеть и теряют естественный цвет изделия, которые находятся на воздухе или даже часто нагревающиеся.
Коррозия меди в виде оксидной пленки (патины) популярна лишь в тот момент, где требуется придание предметам винтажного облика, стилизация под старину. В обратном случае она будет портиться внешний вид посуды, утвари, а также статуэток и украшений. Чтобы устранять оксидный налет, элементы потемнения и вернуть прежний блеск, требуется время от времени чистить предметы. Также очищение требуется для того, чтобы исключить попадания в пищу вредоносных соединений, которые способы присутствовать в зеленом и черном слое.
Эффективные способы очистки меди
Произвести очищение медных предметов несложно, для этого не требуются дорогостоящие средства. Вот наиболее популярные методики, которые используют в домашних условиях:
- Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды.
- Раствор для мытья посуды – следует намылить хозяйственную губку простым средством для посуды, тщательно протирайте поверхность и смывайте водой. такой метод лучше всего подойдет для изделий, которые лишь слегка потускнели.
- Лимон – следует натереть медную поверхность лимонной долькой, а после пройдитесь по нему щеточкой с жесткими ворсинками и помойте водой.
- Мука и уксус – влейте в чашку малое количество, добавьте муки до получения теста со средней густотой. Смажьте медное изделие посредством теста, оставьте до просыхания, а после удалите остатки. После остается натереть изделия мягкой тряпкой.
- Соль и уксус – налейте в кастрюльку из нержавеющей стали уксус 9%, всыпьте немного соли и доведите до кипения.
 Огонь следует выключить, закинуть в раствор предмет из меди, не убирать его до остывания жидкости. Данный способ подойдет для очень загрязненных поверхностей.
Огонь следует выключить, закинуть в раствор предмет из меди, не убирать его до остывания жидкости. Данный способ подойдет для очень загрязненных поверхностей.
А теперь рассмотрим, как чистить медные монеты.
Очистка медных монет
Именно монетки из меди представляют собой антиквариат, и в наше время не будут выпускаться. Нередко требуется их очищать, чтобы вернуть красивый внешний вид. Если монета из меди контактировала со свинцом, налет на ней бывает желтоватым. В этом случае он будет прекрасно очищаться посредством столового уксуса (9%). Зеленый налет следует убрать посредством раствора лимонной кислоты (10%) или даже лимонным натуральным соком, коричневый аммиаком или углекислым аммонием.
Следует помнить о том, что иногда слой патины помогает придавать монетам более винтажный и благородный внешний вид, и потому удалять его стоит не всегда. Некоторые де стараются искусственно состарить деньги домашним методом. Для этого возьмите литр дистиллированной воды, 5 грамм марганцовки (аптечной) и 50 грамм медного купороса. Раствор следует нагреть, не доводя до кипения, бросить в него монеты, оставить до получения требуемого оттенка. Для закрепления полученного эффекта просохшие деньги обработайте все смесью спирта и бензола (1 к 1). После монеты обретают красивый состаренный вид и способны украшать любые коллекции антикварных предметов.
Раствор следует нагреть, не доводя до кипения, бросить в него монеты, оставить до получения требуемого оттенка. Для закрепления полученного эффекта просохшие деньги обработайте все смесью спирта и бензола (1 к 1). После монеты обретают красивый состаренный вид и способны украшать любые коллекции антикварных предметов.
Методы и способы защиты от коррозии металлов
Проблема изыскания новых и совершенствование старых способов защиты от коррозии актуальна, как для всей тяжёлой промышленности в целом, так и для автомобильной отрасли в частности.
Еще в XIX веке лучшие инженерные умы того времени волновала проблема защиты металлических конструкций от ржавления. Например, Александр Гюста́в Э́йфель, отец и создатель знаменитой «Tour de 300 mètres», говорил: «Трудно переоценить роль краски в сохранении металлического сооружения, и забота об этом – единственная гарантия его долголетия».
Портрет Александра Гюста́ва Э́йфель и его творение — Эйфелева башня
Кстати, вот уже 131 год эта достопримечательность Парижа противостоит воздействию неблагоприятных факторов окружающей среды именно благодаря краске. Интересный факт – для защиты 200.000 м2 наружной поверхности башни используется около 60 тонн специальной краски. Покраской занимается обслуживающая Эйфелеву башню специально созданная компания «SETE» («Société Nouvelle d’exploitation de la Tour Eiffel»). Весь процесс окраски занимает около 18 месяцев! Вначале, все детали конструкции тщательно осматриваются. Те, на которых слой антикоррозионного покрытия нарушен, – очищаются от старого и покрываются новым.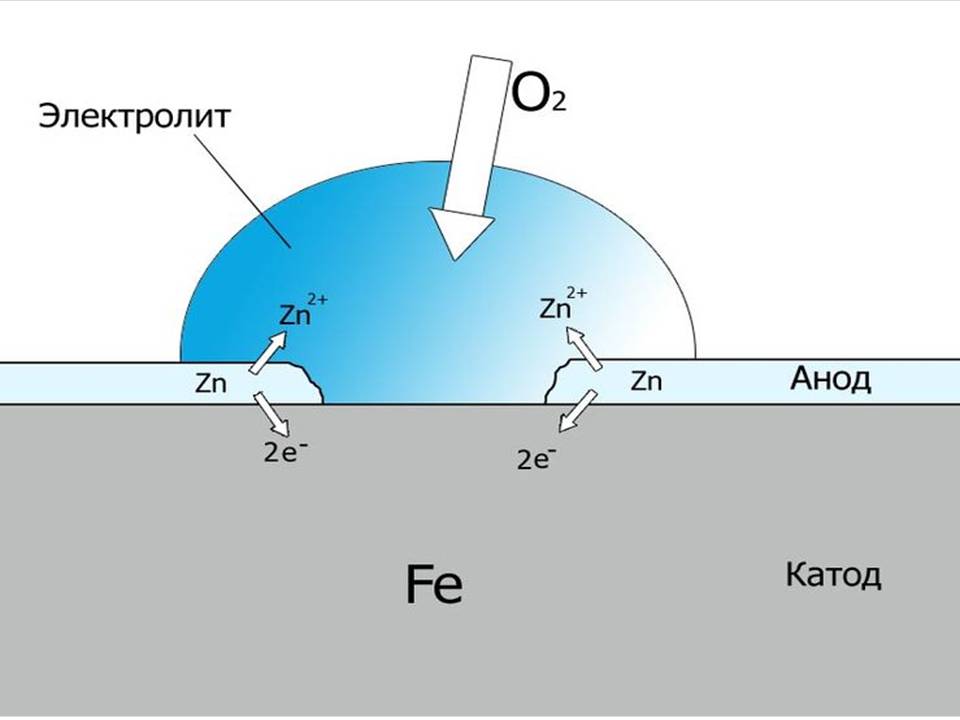 Кроме того, вся поверхность сооружения перед окраской очищается паром высокого давления. Красят башню в два слоя.
Кроме того, вся поверхность сооружения перед окраской очищается паром высокого давления. Красят башню в два слоя.
Но, окрашивание защищаемой поверхности – всего лишь один из способов защиты металла от коррозии. Применительно к автомобилестроению, все методы защиты можно условно разделить на следующие виды:
1. Нанесение защитных покрытий (металлических и неметаллических).
2. Изменение характеристик коррозионной среды.
3. Легирование.
4. Электрохимическая защита
5. Рациональное конструирование.
Нанесение защитных покрытий
Нанесение защитных покрытий – один из самых простых, а также исторических старых способов защиты металла от коррозии. Различают металлические и неметаллические покрытия. В свою очередь неметаллические покрытия делят на органические и неорганические.
Органические покрытия – это, привычные нам, лак и краска, а также разнообразные смолы. Сюда же относят полимерные плёнки и резину.
Сюда же относят полимерные плёнки и резину.
Неорганические покрытия включают в себя разнообразные эмали и грунты на основе соединений кремния, фосфора, цинка и хрома, а также оксидов металлов (например, оксид титана). Классическим примером использования неорганического покрытия в автомобилестроении является процесс фосфатирования автомобильных кузовов. Так, слоем фосфатов перед покраской покрывают кузова автомобилей на заводах Mercedes-Benz.
Металлические покрытия (анодные и катодные) представляют собой нанесённый на защищаемую поверхность слой металла (цинк, хром, кадмий, алюминий и др.) или металлического сплава (олово, бронза, латунь и т.д.). У анодного покрытия электродный потенциал меньше электродного потенциала защищаемого металла. Поэтому, при повреждении анодного покрытия в первую очередь будет окисляться непосредственно оно само. В случае с катодным металлическим покрытием – наоборот: электродный потенциал покрытия выше потенциала защищаемого металла. Значит, при повреждении такого покрытия первой будет окисляться сама защищаемая поверхность.
Значит, при повреждении такого покрытия первой будет окисляться сама защищаемая поверхность.
Нанесение антикоррозийной защиты Krown
Цинкование
Применительно к автомобилестроению, классическим примером защиты с помощью металлического покрытия является оцинкованный автомобильный кузов. Этот способ получил очень широкое распространение и на сегодняшний день целый ряд автопроизводителей используют цинкование для защиты кузовных деталей. Но, первопроходцем в этом деле стала немецкая компания Audi, впервые применившая оцинковку для защиты кузовов своих автомобилей. Не остановившись на этом, инженеры Audi AG разработали и внедрили в производство двухстороннюю цинковую защиту не только кузовных деталей, но и их сварных соединений, а также и самих кузовов в целом. (Метод т.н. «горячего» цинкования погружением в ванну.) Первым серийным автомобилем с полностью оцинкованным кузовом стал Audi 80 B3, впервые сошедший с конвейера в уже далеком 1986 году.
Процесс цинкования
Изменение характеристик коррозионной среды
Изменение характеристик коррозионной среды – суть этого метода защиты заключается в том, что для снижения агрессивности среды в ней уменьшают количество опасных в коррозионном отношении компонентов или же применяют ингибиторы коррозии. (Это специальные вещества, замедляющие её скорость.) И вот, казалось бы, неразрешимая дилемма – как можно снизить количество опасных для стальных деталей автомобиля химических соединений в городской среде? Да очень просто – для начала перестать сыпать на дороги зимой активаторы коррозии, к примеру, тот же хлорид натрия. (О его роли в химическом процессе ржавления автомобиля мы говорили в первой части нашего рассказа.)
Что касается ингибиторов коррозии, то их целесообразно использовать в замкнутых системах (где редко или мало обновляется циркулирующая жидкость). В автомобилестроении типичным примером таковой является система охлаждения двигателя. А все современные антифризы в обязательном порядке содержат в себе ингибиторы коррозии.
А все современные антифризы в обязательном порядке содержат в себе ингибиторы коррозии.
Легирование
Легирование (от немецкого legieren – «сплавлять» и от латинского ligare – «связывать») – один из самых эффективных и, одновременно, дорогих способов борьбы со ржавчиной. Суть этого метода заключается в том, что в состав стали добавляют т.н. «легирующие элементы». Таковыми являются некоторые металлы: хром, никель, марганец, ванадий, ниобий, вольфрам, молибден, титан, медь. Данные компоненты придают сплаву пассивность – т.е. при начале коррозии образуются плотные поверхностные продукты реакции, предохраняющие металл от дальнейшего коррозионного разрушения.
Легированные стали, устойчивые к коррозии в атмосфере и агрессивных средах, также называют «нержавеющими сталями», или же, в простонародье, «нержавейкой». Если говорить об её применении в машиностроении, то нужно сказать, что изготовить кузов автомобиля целиком из нержавеющего сплава, конечно же, возможно. Вот только никакой целесообразности в этом нет, ибо цена такой машины будет астрономической. Причина – изначально высокая стоимость коррозионно-стойкой стали. Тем не менее, в автомобилестроении она активно используется. Так, из неё изготавливают детали системы выпуска отработанных газов и термоотражающие экраны.
Вот только никакой целесообразности в этом нет, ибо цена такой машины будет астрономической. Причина – изначально высокая стоимость коррозионно-стойкой стали. Тем не менее, в автомобилестроении она активно используется. Так, из неё изготавливают детали системы выпуска отработанных газов и термоотражающие экраны.
Электрохимическая защита
Электрохимическая защита автомобиля
Если говорить о методе электрохимической защиты, то, применительно к автомобилестроению, он является малоиспользуемым. Его суть заключается в торможении протекающих при электрохимической коррозии процессов (катодного / анодного). Например, к защищаемому элементу присоединяется деталь из более активного, нежели сам элемент, металла. В образовавшейся гальванической (коррозионной) паре в первую очередь будет разрушаться активный металл (протектор).
А вот метод рационального конструирования, в силу своей относительной простоты и малозатратности, наоборот, получил широкое распространение в машиностроении. Суть его заключается в том, что при проектировании узлов и агрегатов по возможности пытаются уменьшить площадь контакта с агрессивной средой опасных в коррозионном отношении участков деталей (сварных швов и металлических соединений). Если, в силу особенностей конструкции, сделать это не представляется возможным, предусматривают защиту данных узлов от коррозии различными вышеуказанными методами.
Суть его заключается в том, что при проектировании узлов и агрегатов по возможности пытаются уменьшить площадь контакта с агрессивной средой опасных в коррозионном отношении участков деталей (сварных швов и металлических соединений). Если, в силу особенностей конструкции, сделать это не представляется возможным, предусматривают защиту данных узлов от коррозии различными вышеуказанными методами.
причины ржавления и способы защиты
Изделия из меди используются человеком на протяжении нескольких веков. В дореволюционные времена цена этого металла приравнивалась к стоимости золота, настолько дорогим было его производство. Сейчас медь намного подешевела, поэтому из нее, кроме украшений, делают посуду, интерьерные аксессуары и иные предметы.
Содержание:
- Что такое коррозия металлов и сплавов
- org/ListItem»> Коррозийные свойства меди
- Условия разрушения материала
- Влияние воды
- Воздействие кислот и щелочей
- Коррозия в почве и влажном воздухе
- Почему изделия из меди необходимо регулярно чистить
- Эффективные методы очистки меди
- Чистка монет из меди
Коррозия меди, в отличие от железа, развивается медленно благодаря ее устойчивости к данному явлению, и все-таки иногда приходится принимать меры по очистке изделий от некрасивого налета.
Что такое коррозия металлов и сплавов
Под коррозией понимают процесс разрушения металла под действием агрессивных факторов окружающей среды. В той или иной степени ржавеют все металлы, сплавы, в результате чего на них появляются ржавчина и участки нарушения целостности (дыры). Портиться со временем способны и неметаллы: примером можно назвать старение резины или пластика от взаимодействия с кислородом, при частых контактах с водой, перепадами температур.
Основной причиной коррозии считается термодинамическая неустойчивость металла к влиянию физических факторов или химических веществ, которые присутствуют в контактной среде. По сравнению с железом медь окисляется намного меньше, но при увеличении температуры этот процесс значительно ускоряется. При регулярном нахождении в среде с температурой выше +100 градусов любой металл ржавеет в несколько раз быстрее.
к содержанию ↑
Коррозийные свойства меди
Медь – металл с высокими пластическими свойствами, имеющий красно-золотистый цвет, а после удаления оксидной пленки – чуть розоватый.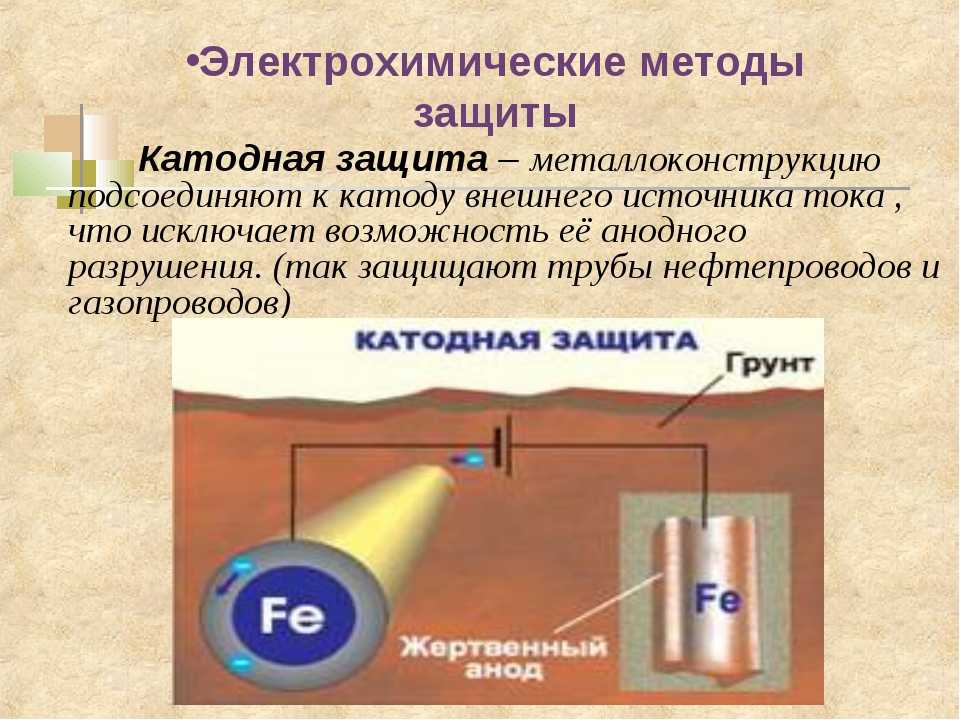 По электропроводности он уступает лишь серебру, также характеризуется высокой теплопроводностью. Благодаря низкому удельному сопротивлению медь применяется в электротехнике: идет на изготовление медных пластинок, проволоки, обмотки двигателей.
По электропроводности он уступает лишь серебру, также характеризуется высокой теплопроводностью. Благодаря низкому удельному сопротивлению медь применяется в электротехнике: идет на изготовление медных пластинок, проволоки, обмотки двигателей.
Из-за высоких антикоррозионных качеств металл включается в сплавы для улучшения их технических характеристик (бронза, латунь и другие). В гальванической среде медь становится катодом, вступает в электрохимические процессы и вызывает ускоренное ржавление прочих металлов.
Медь – неактивный химический элемент, поэтому практически не взаимодействует с воздухом, водой (пресной, морской). Если воздух сухой, на поверхности материала формируется оксидная пленка толщиной до 50 мн. Медное изделие темнеет, становится коричневым или зеленоватым, это называется патиной. В ряде случаев патина воспринимается как декоративное покрытие. Интенсивность коррозии низкая при контакте с разбавленной соляной кислотой, но при реакции с рядом иных кислот, с галогенами, «царской водкой» металл окисляется с образованием карбоната меди.
к содержанию ↑
Условия разрушения материала
Несмотря на устойчивость к порче, даже медные изделия при определенных условиях могут ржаветь. Меньше всего подобные явления выражены во влажном воздухе, воде, почве, больше – в кислой среде.
Серьезно снизить коррозию можно путем лужения – покрытия меди слоем олова. Качественное лужение дает надежную защиту от повреждений, повышает коррозионную стойкость, делает материал не подверженным действию высоких температур, дождя, града, снега. Срок службы луженых изделий составляет более 100 лет без потери первоначальных свойств.
к содержанию ↑
Влияние воды
Скорость коррозии меди в воде сильно зависит от наличия оксидной пленки на ее поверхности, а также от степени насыщенности воды кислородом. Чем больше содержание последнего, тем интенсивнее протекает разрушение материала. В целом, медь считается стойкой к вредному воздействию соленой и пресной воды, и пагубно влияют на нее только растворенные ионы хлора, низкий уровень pH. Прочность, неподверженность ржавлению позволяет применять материал для изготовления трубопроводов.
Прочность, неподверженность ржавлению позволяет применять материал для изготовления трубопроводов.
Если на поверхности изделия, покрытого медью, имеется коричневая или зеленая оксидная корка, разрушающие вещества в малой степени проникают внутрь. Обычно оксидный слой формируется спустя 60 дней нахождения металла в воде. Более прочной считается зеленая корка (карбонатная), рыхлой и менее крепкой – черная (сульфатная).
В морской воде уровень коррозии практически такой же, как и в пресной. Лишь при ускорении движения жидкости коррозия становится ударной, поэтому – более интенсивной. Медь – материал, который не способен обрастать морскими микроорганизмами, ведь его ионы губительны для моллюсков, водорослей. Это свойство металла используется в судоходстве, рыбном хозяйстве.
к содержанию ↑
Воздействие кислот и щелочей
В щелочах медь не портится, ведь материал сам по себе является щелочным, зато кислоты для нее являются самыми пагубными по воздействию. Наиболее значимая и быстрая коррозия происходит при контакте с серой и ее кислотными соединениями, а азотная кислота и вовсе полностью разрушает структуру материала.
Наиболее значимая и быстрая коррозия происходит при контакте с серой и ее кислотными соединениями, а азотная кислота и вовсе полностью разрушает структуру материала.
В концентрированных кислотах медь растворяется, поэтому при изготовлении оборудования для нефтегазовой промышленности требует дополнительной защиты. С этой целью применяются ингибиторы – замедлители химических реакций:
- Экранирующие – формируют пленку, которая не позволяет кислотам достигать медной поверхности.
- Окислительные – превращают верхний слой в окись, которая будет вступать в реакцию с кислотами без вреда для самого металла.
- Катодные – увеличивают перенапряжение катодов, чем замедляют реакцию.
к содержанию ↑
Коррозия в почве и влажном воздухе
В почве проживает множество микроорганизмов, которые вырабатывают сероводород, поэтому среда тут кислая, скорость коррозии меди возрастает. Чем более отклонено значение pH в сторону закисления, тем быстрее протекают процессы разрушения. Если грунт насыщен кислородом, металл окисляется, но ржавеет меньше. При длительном нахождении медных изделий в земле они зеленеют, становятся рыхлыми и могут даже рассыпаться. Краткосрочное пребывание в почве вызывает появление патины, от которой предмет можно очистить.
Если грунт насыщен кислородом, металл окисляется, но ржавеет меньше. При длительном нахождении медных изделий в земле они зеленеют, становятся рыхлыми и могут даже рассыпаться. Краткосрочное пребывание в почве вызывает появление патины, от которой предмет можно очистить.
Влажный воздух плохо сказывается на состоянии материала только при долгом контакте, а вначале тоже вызывает появление патины (оксидного слоя). Исключение составляет пар, насыщенный хлоридами, сульфидами, углекислотой – в нем коррозия развивается стремительнее.
к содержанию ↑
Почему изделия из меди необходимо регулярно чистить
Медные турки, ковши, самовары отличаются высокой теплопроводностью, потому нагрев в них протекает равномерно, а продукты готовятся быстрее. Это обуславливает высокую популярность изделий в быту. Потребность в чистке медных предметов обусловлена утратой ими внешней привлекательности со временем. Особенно быстро тускнеют и теряют естественный цвет изделия, находящиеся на воздухе или часто нагревающиеся.
Окисная пленка – патина – популярна лишь там, где требуется придание вещам винтажного облика, стилизация под старину. В противном случае она портит вид посуды, утвари, украшений и статуэток. Чтобы устранить оксидный налет, элементы потемнения и вернуть блеск, придется периодически чистить предметы. Также очищение требуется для исключения попадания в еду вредных соединений, которые могут присутствовать в черном или зеленом слое.
к содержанию ↑
Эффективные методы очистки меди
Провести чистку медных предметов несложно, для этого не понадобятся дорогостоящие средства. Вот самые популярные методики, применяемые в домашних условиях:
- Кетчуп. Взять немного томатного кетчупа, смазать им изделие, оставить на две минуты. После ополоснуть струей воды.
- Раствор для мытья посуды. Намылить хозяйственную губку обычным средством для посуды, тщательно протереть поверхность, смыть водой. Этот способ лучше всего подходит для изделий, которые лишь немного потускнели.

- Лимон. Натереть медную поверхность долькой лимона, после пройтись по ней щеткой с жесткими ворсинками и помыть водой.
- Уксус и мука. Влить в чашку немного уксуса, добавить муку до получения теста средней густоты. Смазать медь тестом, оставить до высыхания, потом удалить остатки, а изделие натереть мягкой тряпочкой.
- Уксус и соль. Налить в кастрюлю из нержавеющей стали уксус 9%, всыпать немного соли, дать закипеть. Огонь выключить, в раствор положить медный предмет, не убирать его до остывания жидкости. Этот способ подходит для сильно загрязненных поверхностей.
к содержанию ↑
Чистка монет из меди
Медные монеты представляют собой антиквариат, и в наше время не выпускаются. Нередко их приходится чистить, чтобы вернуть привлекательный вид. Если монета контактировала со свинцом, налет на ней может быть желтоватым. В таком случае он прекрасно очищается столовым уксусом (9%). Зеленый налет убирают раствором лимонной кислоты (10%) или соком лимона, коричневый – аммиаком, углекислым аммонием.
Нужно помнить, что порой слой патины придает монетам более благородный и винтажный вид, поэтому удалять его желательно не всегда. Некоторые, напротив, стараются искусственно состарить деньги домашним способом. Для этого надо взять литр дистиллированной воды, 5 г аптечной марганцовки, 50 г медного купороса. Раствор нагреть, не кипятя, бросить в него монеты, оставить до достижения нужного оттенка. Для закрепления эффекта высохшие деньги обработать смесью бензола и спирта (1:1). После монеты обретут красивый состаренный облик и смогут украсить любую коллекцию предметов антиквариата.
Условия, способствующие коррозии меди под землей
Этот документ представляет собой отредактированную версию статьи, опубликованной в журнале American Water Works Association Journal за август 1984 г. и перепечатанной с разрешения American Water Works Association .
и перепечатанной с разрешения American Water Works Association .
By J.R. Myers
JRM Associates, 4198 Merlyn Drive, Franklin, OH 45005
A. Cohen
Copper Development Association Inc., 260 Madison Ave., New York, NY 10016
- Скачать PDF-версию [PDF — 700 Kb]
- Аномально агрессивные почвы
- Концентрация-клеточная коррозия
- Блуждающая коррозия постоянного тока
- Неправильный дизайн и качество изготовления
- Действие переменного тока
- Термогальванические эффекты
- Выявление проблемы коррозии без земляных работ
- Снижение подземной коррозии меди
- Резюме
- Ссылки
Медь, благородный металл, встречающийся в природе в своей элементарной форме, почти полностью невосприимчив к коррозии почв, встречающихся по всему миру. Но было бы ошибкой полагать, что медь не подвергается коррозии. В этой статье описано множество возможных ситуаций, в которых медные трубы или трубки могут подвергаться внешней коррозии. Эти ситуации подробно обсуждаются, и даются предложения о том, как определить подземную коррозию медных труб без земляных работ и как смягчить существующие условия коррозии.
Эти ситуации подробно обсуждаются, и даются предложения о том, как определить подземную коррозию медных труб без земляных работ и как смягчить существующие условия коррозии.
Уверенность знающих инженеров, архитекторов и персонала водоканала в том, что медь не подвергается неблагоприятному воздействию большинства почв во всем мире, вполне обоснована. В Месопотамии из-под глины, отложившейся во время «Великого потопа», который, как полагают, произошел около 4000 г. до н.э., продолжают находить необычайно хорошо сохранившиеся медные артефакты. 1 Многие подземные медные трубы, использовавшиеся для подачи воды в Египте почти 5000 лет назад, все еще существуют. Кроме того, медь является одним из немногих металлов, которые существуют как элемент в своей естественной форме. Существует также выдающаяся история медных труб как материала с высокой коррозионной стойкостью в большинстве подземных сред. Однако существуют условия, которые могут вызвать коррозию меди при воздействии на нее определенных почв. К ним относятся:
К ним относятся:
- аномально агрессивные почвы,
- локализованные и ярусные концентрационные ячейки, созданные различиями в составе почвы,
- действие блуждающих постоянных токов (DC), протекающих в земле,
- дефект конструкции и изготовления,
- определенные условия, создаваемые переменным током (AC),
- термогайванные эффекты и
- гальваническое воздействие с участием разнородных материалов.
Вернуться к началу
Аномально агрессивные почвы
Медь практически не подвержена коррозии. Он ведет себя как благородный металл в большинстве подземных сред из-за естественной защитной пленки, которая образуется на поверхности металла. Если эта пленка, которая часто состоит из красновато-коричневого оксида меди (Cu 2 0), будет разрушена и не может быть восстановлена, медь будет подвергаться коррозии. К счастью, защитная пленка на меди остается неповрежденной или легко восстанавливается в большинстве почвенных условий.
Было проведено три окончательных исследования подземной коррозии меди. 2-4 Вполне вероятно, что такое явное отсутствие интереса к почвенной коррозии меди является результатом известной коррозионной стойкости металла в подземных условиях.
Анализ результатов, полученных в этих трех независимых исследованиях, ясно показывает, что подземная коррозия меди необычайно сложна. Как правило, коррозия не может быть напрямую связана с каким-либо одним или даже несколькими факторами, поскольку задействовано множество взаимосвязанных почвенных условий. Данные, представленные в трех исследованиях, и результаты других 5,6 позволяют сделать некоторые предварительные выводы относительно коррозии меди в подземных условиях. К ним относятся:
- Коррозия часто связана с сочетанием повышенного содержания сульфатов или хлоридов в почве в сочетании с плохим дренажем, почвой, имеющей значительную способность удерживать влагу, и годовым количеством осадков от умеренного до сильного (обычно более 76 см [30 дюймов]).
 ]).
]). - Повышенные концентрации сульфата или хлорида или того и другого в почве, вероятно, являются основным фактором процесса подземной коррозии, но для поддержания электрохимического действия требуется значительная влажность. Сульфаты и хлориды могут не оказывать неблагоприятного воздействия на медь, если количество осадков незначительное, а дренаж достаточный.
- Очень низкое удельное сопротивление почвы (т. е. менее 100-500 Ом·см) обычно указывает на то, что почва может быть агрессивной.
- Почвы, содержащие большое количество органического вещества (особенно почвы, содержащие органические кислоты), могут вызывать коррозию
- Влажные шлаковые наполнители обычно вызывают коррозию либо из-за присутствия сульфидов, либо из-за гальванического воздействия, создаваемого углеродными частицами в шлаках
- Строительный щебень, содержащий значительное количество извести, не должен быть особенно коррозионно-активным при условии, что при обратной засыпке не образуются локальные концентрационные ячейки, особенно кислородные дифференциальные ячейки
- Такие почвы, как глина, песок, гравий, суглинок и мел, редко обладают сочетанием свойств, связанных с коррозией
- Органические почвы, содержащие активные анаэробные бактерии (т.
 е. сульфатредуцирующие виды), могут образовывать сульфиды, агрессивные по отношению к меди
е. сульфатредуцирующие виды), могут образовывать сульфиды, агрессивные по отношению к меди - Почвы, содержащие неорганические кислоты, могут быть необычно агрессивными по отношению к меди
Почвы, содержащие значительное количество соединений аммиака, обычно вызывают коррозию меди. Внешний вид медной поверхности и идентификация продуктов коррозии, как правило, дают представление о причине износа. Например, зеленые продукты коррозии меди часто представляют собой основной карбонат меди, основной сульфат меди или оксихлориды меди. Существование заметных количеств оксихлоридов меди в продуктах коррозии можно было бы ожидать для медной водопроводной трубы, которая была закопана в приливно-отливной болотной среде с низким удельным сопротивлением. Тяжелый черный слой на меди предполагает наличие сульфида меди и возможную активность анаэробных бактерий как причины коррозии. Присутствие аммиака в сочетании с сульфатными соединениями на поверхности меди указывает на то, что причиной коррозии могли быть удобрения для газонов.
Коррозия подземной меди может быть как равномерной, так и локальной (рисунок ниже).
Локальная коррозия предполагает наличие ячеек локального действия, таких как те, которые создаются неоднородными засыпками. Подозрение на коррозию клеток локального действия также возникает, когда коррозия преимущественно подвергается нижней стороне горизонтального трубопровода с медными водопроводными трубами.
Наверх
Концентрация-ячеистая коррозия
Существует по крайней мере три типа электрохимических концентрационных ячеек, которые вызывают коррозию металла или сплава из-за различий в окружающей среде. К ним относятся кислородные, нейтрально-солевые и водородно-ионные элементы.
Участки металлической поверхности, соприкасающиеся с почвой с повышенным содержанием кислорода, обычно будут катодными по сравнению с участками, где кислорода меньше. Кислород обычно действует как катодный деполяризатор; кроме того, области с повышенным содержанием кислорода, как правило, являются предпочтительными катодными участками, где может происходить восстановление кислорода:
2H 2 0 + 0 2 + 4e — 40H —
Это обычно называют кислородно-дифференциальной концентрационной ячейкой. Кислородная коррозия концентрационных ячеек часто является объяснением преимущественной коррозии нижней стороны медных водопроводных труб. Нижняя сторона трубы часто находится в контакте с ненарушенной почвой с пониженным содержанием кислорода, тогда как верхняя часть трубы подвергается воздействию аэрируемой обратной засыпки. Коррозия на нижней стороне трубки в этих условиях усугубляется большим отношением площади катода к площади анода. Кислородно-дифференциальные концентрационные ячейки также могут быть созданы неоднородными засыпками. Металлы и сплавы, соприкасающиеся с кусками глины, почти всегда будут анодными по отношению к близлежащему металлу, если основным материалом обратной засыпки является супесь. Точно так же могут существовать продольные токи коррозии, если линия обслуживания проходит через области с большими различиями в почве.
Кислородная коррозия концентрационных ячеек часто является объяснением преимущественной коррозии нижней стороны медных водопроводных труб. Нижняя сторона трубы часто находится в контакте с ненарушенной почвой с пониженным содержанием кислорода, тогда как верхняя часть трубы подвергается воздействию аэрируемой обратной засыпки. Коррозия на нижней стороне трубки в этих условиях усугубляется большим отношением площади катода к площади анода. Кислородно-дифференциальные концентрационные ячейки также могут быть созданы неоднородными засыпками. Металлы и сплавы, соприкасающиеся с кусками глины, почти всегда будут анодными по отношению к близлежащему металлу, если основным материалом обратной засыпки является супесь. Точно так же могут существовать продольные токи коррозии, если линия обслуживания проходит через области с большими различиями в почве.
Коррозия подземной меди может быть вызвана некоторыми ячейками концентрации нейтральной соли. Области с повышенным содержанием хлоридов обычно являются анодными по отношению к областям с пониженным содержанием хлоридов. Такие концентрационные ячейки хлоридного типа иногда создаются противогололедными солями, например, в траншее для коммуникаций, которая может действовать как подземная дренажная канава в течение нескольких лет после ее выемки и обратной засыпки.
Такие концентрационные ячейки хлоридного типа иногда создаются противогололедными солями, например, в траншее для коммуникаций, которая может действовать как подземная дренажная канава в течение нескольких лет после ее выемки и обратной засыпки.
Также есть основания полагать, что области на поверхности металла, находящиеся в контакте с почвой с низким рН, будут катодными по отношению к областям на том же металле, где локальное значение рН несколько выше. Концепция ячеек концентрации ионов водорода частично подтверждается наблюдением, что коррозионный потенциал металла или сплава обычно становится все более положительным по мере снижения pH окружающей среды. 7
Наверх
Блуждающая коррозия постоянного тока
Коррозия или помехи от блуждающих токов, которые слишком часто ошибочно называют «электролизом», могут возникать в подземных медных водопроводных трубах, когда в этом районе существуют неконтролируемые постоянные токи. Эта форма коррозии связана с величиной и направлением постоянных токов, протекающих в земле по путям, отличным от предусмотренных. Когда блуждающие токи текут по подземному сооружению, коррозионное повреждение не происходит, потому что эти области защищены катодом. Эти блуждающие токи также не вызывают ухудшения состояния при протекании внутри конструкции и вдоль нее. Однако в конечном итоге токи должны покинуть структуру, вернуться на землю и течь к своему источнику генерации. Области, где эти токи покидают конструкцию и попадают в почву, являются анодными, и в этих местах может возникнуть серьезная коррозия.
Когда блуждающие токи текут по подземному сооружению, коррозионное повреждение не происходит, потому что эти области защищены катодом. Эти блуждающие токи также не вызывают ухудшения состояния при протекании внутри конструкции и вдоль нее. Однако в конечном итоге токи должны покинуть структуру, вернуться на землю и течь к своему источнику генерации. Области, где эти токи покидают конструкцию и попадают в почву, являются анодными, и в этих местах может возникнуть серьезная коррозия.
Распространенным источником паразитного электричества постоянного тока является система катодной защиты нагнетаемого тока, которая широко используется коммунальными службами и компаниями по транспортировке нефти и газа для уменьшения коррозии подземных стальных трубопроводов. Системы электропередачи постоянного тока высокого напряжения (HVDC), транзитные системы с питанием от постоянного тока, сварочное оборудование и горнодобывающее оборудование также являются потенциальными источниками паразитного постоянного тока.
Наверх
Неправильный дизайн и качество изготовления
В дополнение к проблемам, создаваемым аномально агрессивными почвами, концентрационными ячейками и рассеянным постоянным током, коррозия подземной меди может усугубляться дефектами конструкции и изготовления.
Должны быть сделаны допуски на тепловое расширение и сжатие при прохождении медных водопроводных труб через бетонную плиту здания. Если этого не сделать, коррозионная усталость может иногда возникать на выпуклой поверхности труб вблизи места их прохождения через бетон. 5, 8 На коррозионную усталость указывают, когда в пластичной трубе присутствуют поперечные трещины хрупкого типа. Хотя случаи коррозионной усталости редки, они могут возникать на неправильно проложенных, подплитных, бытовых линиях горячего водоснабжения, где происходят периодическое расширение и сжатие.
Также известно, что неправильная подготовка или установка развальцованных трубных соединений на подземных коммуникационных линиях, вызванная наличием остаточных заусенцев на посадочной поверхности, может привести к локальной эрозии и коррозии.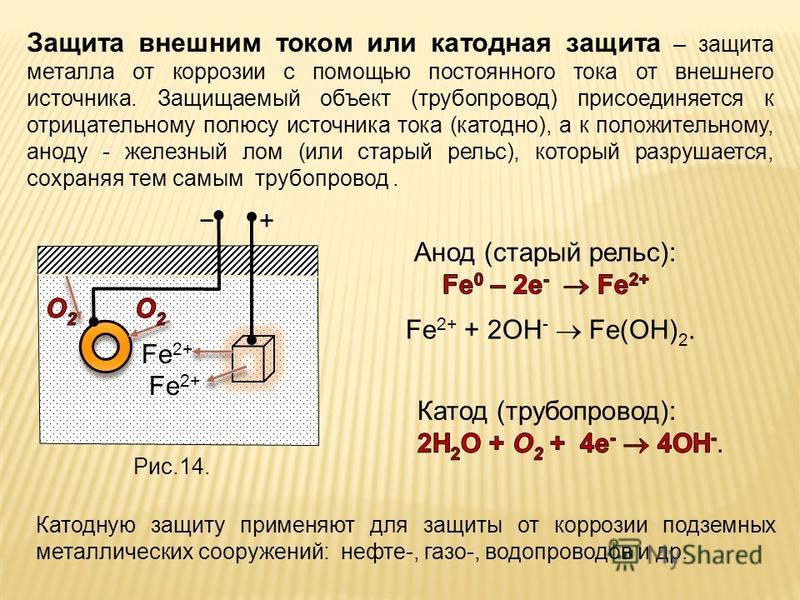 Когда это происходит, проблему легко распознать по U-образным ямкам на пораженных участках, которые практически не содержат остаточных продуктов коррозии (рисунок ниже).
Когда это происходит, проблему легко распознать по U-образным ямкам на пораженных участках, которые практически не содержат остаточных продуктов коррозии (рисунок ниже).
Это может усугубляться аномально высокими скоростями воды в распределительной системе.
Наверх
Действие переменного тока
Роль переменного тока в подземной коррозии меди изучена недостаточно. 9 Некоторые исследователи утверждают, что любой металл, растворенный во время анодного полупериода, должен быть повторно осажден во время катодного полупериода. Другие считают, что эффективность анодного полупериода выше, чем у катодного полупериода, и, следовательно, может возникнуть коррозия, вызванная переменным током. Продолжается спор о том, может ли закись меди на внешней поверхности подземной медной водопроводной трубы выпрямить переменный ток, хотя некоторые из недавних исследований показывают, что этого выпрямления не происходит. 10, 11
Некоторые исследователи считают, что критическая плотность переменного тока должна быть превышена, чтобы произошла коррозия переменного тока. 12, 13 Также возможно, что переменный ток способствует деполяризации местных анодов и катодов на подземной медной поверхности. 11 Ожидается, что эта деполяризация повысит плотность тока коррозии и результирующую скорость коррозии.
12, 13 Также возможно, что переменный ток способствует деполяризации местных анодов и катодов на подземной медной поверхности. 11 Ожидается, что эта деполяризация повысит плотность тока коррозии и результирующую скорость коррозии.
До тех пор, пока эти разногласия не будут устранены и не будут подтверждены результаты недавних исследований, разумно полагать, что общепринятая практика заземления электрических систем на подземные медные водопроводные системы может привести к коррозии. Если медная водопроводная система подключена к непроводящей магистрали, такой как асбестоцементная, можно ожидать некоторого коррозионного повреждения в месте выхода тока из меди, даже если ток переменный. Кроме того, оксид меди может стать полупроводником при определенных условиях рН почвы и напряженности электрического поля. Заземление системы переменного тока на подземный медный водопровод и дисбаланс в системе переменного тока вполне могут быть вовлечены в процесс подземной коррозии.
Наверх
Термогальванические эффекты
Управляющие потенциалы для коррозии меди могут быть созданы разницей температур в подплитных, горячих и холодных водопроводах, которые находятся в металлическом контакте друг с другом в водонагревателе. Это явление следует подозревать, когда наружная коррозия медных водопроводов затрагивает только трубы горячей воды.
Термическое воздействие в непосредственной близости от подземных труб горячего водоснабжения иногда может усугубить проблему коррозии из-за концентрации солей в этих местах в результате испарения воды, которая может просачиваться через почву.
Гальваническое действие. Хотя медь обычно является катодной по отношению к наиболее часто используемым под землей металлам и сплавам, таким как сталь, оцинкованная сталь и чугун, в подземных медных линиях могут возникать две формы гальванической коррозии. 14 Это ячейки углерод-медь, связанные с некоторыми шлаковыми засыпками, и ячейка медь-в-почве-медь-в-бетон, связанная с конструкцией на перекрытиях.
Медь является анодом по отношению к углероду, и можно ожидать возникновения коррозии, если огарки, используемые для обратной засыпки, содержат значительное количество углерода. Однако для осуществления этого гальванического воздействия должна присутствовать влага.
Также известно, что медь, внедренная в бетон, обычно является катодной по отношению к близлежащей меди, находящейся в почве. Эта едва уловимая форма гальванической коррозии может привести к ухудшению состояния меди, находящейся в контакте с почвой в непосредственной близости от границы раздела грунт-бетон. Сообщается, что эта форма коррозии является причиной того, что в некоторых районах Южной Калифорнии требуется полная бетонная оболочка медных водопроводных труб. 5
Наверх
Выявление проблемы коррозии без земляных работ
Исследования потенциала между трубами и почвой часто можно использовать для прогнозирования тех областей, где происходит активная коррозия подземной меди. 15-17
15-17
На основании одного исследования, 17 , которое поддерживается другим, 18 , считается, что данные в Таблице 1 можно использовать для прогнозирования коррозионной активности в подземной медно-водопроводной системе.
Аналогичные потенциальные исследования могут быть использованы для выявления основных участков коррозии, вызванных блуждающими токами.
| Потенциал-V по сравнению с сульфатом меди | Коррозионная активность |
|---|---|
| -0,5 или более отрицательный | Медь хорошо защищена; предполагает, что медь имеет катодную защиту |
| -0,25 или более отрицательный | Отсутствие коррозии в большинстве почв |
| -0,1 или менее отрицательный | Может вызывать коррозию |
| 0,0 или положительный | Вероятно коррозия |
Как правило, отрицательные потенциалы регистрируются там, где блуждающий ток входит в медную трубку и материал защищен катодом. Гораздо меньше отрицательных и даже положительных потенциалов будет получено там, где блуждающий ток покидает подземное сооружение, возвращается в землю и вызывает коррозию. Коррозия блуждающих токов также может быть подтверждена с помощью метода исследования потенциала между трубой и почвой. Прерывание источника тока, вызывающего нарушение, часто выявляет значительные потенциальные различия между показаниями тока при выключенном и включенном токе, особенно если эталонная ячейка расположена в месте основной анодной активности.
Гораздо меньше отрицательных и даже положительных потенциалов будет получено там, где блуждающий ток покидает подземное сооружение, возвращается в землю и вызывает коррозию. Коррозия блуждающих токов также может быть подтверждена с помощью метода исследования потенциала между трубой и почвой. Прерывание источника тока, вызывающего нарушение, часто выявляет значительные потенциальные различия между показаниями тока при выключенном и включенном токе, особенно если эталонная ячейка расположена в месте основной анодной активности.
Наверх
Снижение подземной коррозии меди
Подземную коррозию меди можно эффективно уменьшить с помощью ряда методов. К ним относятся:
- катодная защита,
- улучшенный дренаж,
- избегание неоднородных и шлаковых закладок,
- разумное использование селективных неагрессивных засыпок,
- надлежащая конструкция системы и стандартное качество изготовления, а также
- смягчение любой коррозии блуждающего тока.

Одним из наиболее экономичных методов снижения коррозии меди, подвергающейся воздействию агрессивных сред, является катодная защита. 17, 19 Борьба с коррозией достигается, когда потенциалы катодов на корродирующей медной поверхности поляризованы до потенциалов холостого хода анодов локального действия. Для большинства систем с медными водопроводными трубами этого можно легко добиться с помощью расходуемых анодов. Цинковые аноды в упакованных засыпках можно использовать при условии, что удельное сопротивление грунта меньше примерно 2000 Ом·см. Упакованные магниевые аноды следует использовать, если удельное сопротивление грунта превышает примерно 2000 Ом·см.
Хотя ток, необходимый для катодной защиты подземной меди, будет варьироваться в зависимости от местных почвенных условий, очевидно, что медь довольно легко поляризуется в большинстве почв. Ток, необходимый для защиты квадратного фута оголенной меди, может составлять всего 0,4–1,7 мА. 20 Представление о том, что для катодной защиты подземной меди требуются относительно небольшие токи, подтверждается наблюдением, что эта форма электрохимического контроля коррозии обычно достигается автоматически, когда инженерные сети находятся в металлическом контакте с чугунными водопроводными сетями. Общие рекомендации по проектированию работающей системы катодной защиты подземной меди доступны в технической литературе.
Общие рекомендации по проектированию работающей системы катодной защиты подземной меди доступны в технической литературе.
Улучшение схемы дренажа, чтобы вода стекала от здания или линии обслуживания, может быть использована для устранения проблем с коррозией меди под землей. Траншея, в которой находится линия обслуживания, не должна располагаться непосредственно ниже каких-либо септических дренажных систем или водосточных труб зданий. Точно так же траншея не должна быть резервуаром для сбора противогололедных солей и газонных удобрений.
Для тех участков, где известно, что подземный котел будет подвергаться воздействию аномально агрессивных грунтов, можно полностью заключить металл в селективную засыпку. Эти засыпки могут быть приготовлены путем смешивания песка с цементным порошком, просеянного грунта с мелом или просеянного грунта с пылевидным известняком. Однако селективная засыпка может не достичь поставленной цели, если дренаж таков, что агрессивные виды могут концентрироваться и вступать в контакт с медью.
Коррозия блуждающих токов подземной меди должна быть смягчена ответственной организацией. Эта пагубная форма подземной коррозии легко устраняется с помощью резистивных соединений и правильной установки расходуемых анодов на неблагоприятно пострадавшем сооружении. В тяжелых условиях, когда источником помех является система катодной защиты с подачей тока, иногда необходимо переместить анодный слой, связанный с причиной помех.
Нельзя переоценить тот факт, что подземные медно-водопроводные системы должны быть правильно спроектированы и установлены. Должны быть предусмотрены меры по тепловому расширению там, где медные трубы для горячей воды проходят через бетонные плиты. Следует избегать неправильно установленных развальцованных трубных соединений на медных линиях обслуживания.
Наверх
Резюме
Медные водопроводные трубы имеют выдающуюся историю коррозионной стойкости в большинстве подземных сред. Медь естественным образом не подвергается коррозии в большинстве глин, мелов, суглинков, песков и гравия. Однако некоторые агрессивные почвенные условия могут вызвать коррозию. Основной предпосылкой коррозии является присутствие значительного количества влаги. Другие факторы, которые могут способствовать процессу коррозии, включают почвы, имеющие: (1) повышенные концентрации сульфатов, хлоридов, соединений аммиака или сульфидов; (2) плохая аэрация, поддерживающая активность анаэробных бактерий; (3) большое количество органической или неорганической кислоты; и (4) большие перепады кислорода или нейтральных солей (особенно хлоридов).
Однако некоторые агрессивные почвенные условия могут вызвать коррозию. Основной предпосылкой коррозии является присутствие значительного количества влаги. Другие факторы, которые могут способствовать процессу коррозии, включают почвы, имеющие: (1) повышенные концентрации сульфатов, хлоридов, соединений аммиака или сульфидов; (2) плохая аэрация, поддерживающая активность анаэробных бактерий; (3) большое количество органической или неорганической кислоты; и (4) большие перепады кислорода или нейтральных солей (особенно хлоридов).
Медь также подвержена коррозии из-за паразитного электричества постоянного тока. По-видимому, на него могут неблагоприятно повлиять определенные условия в системе переменного тока, в которой он может быть заземлен. Сообщается, что подземная медь подвержена термогальваническому воздействию и коррозии разнородных материалов. Медные водопроводные трубы могут иногда подвергаться коррозионной усталости.
К счастью, в тех редких случаях, когда медь подвергается коррозии в подземных условиях, можно определить причину износа. Как только это будет достигнуто, коррозию можно будет снизить с экономической точки зрения с помощью различных методов.
Как только это будет достигнуто, коррозию можно будет снизить с экономической точки зрения с помощью различных методов.
Наверх
Каталожные номера
- Медь под землей: устойчивость к почвенной коррозии.
Ассоциация развития меди. Опубл. 40. Лондон (1947). - ДЕНИСОН, И.А. Электролитическое поведение черных и цветных металлов в контурах почвенной коррозии.
Транс. Electrochemical Soc., 81:435 (1942). - ГИЛБЕРТ, П.Т. Коррозия образцов меди, свинца и свинцовых сплавов после захоронения в ряде грунтов на срок до 10 лет.
Журнал. Инст. металлов, 73:139(1947). - РОМАНОФ М. Подземная коррозия.
Нац. Бу. Циркуляр стандартов 579. NBS, Вашингтон, округ Колумбия (1957). - ВУДСАЙД, Р.Д.; УОТЕРС, Ф.О.; & CORNET, Коррозия и другие проблемы в медных трубах в некоторых жилых районах Южной Калифорнии.
Проц. Третий междунар. Конгресс по коррозии металлов, Москва (1966). - KROON D.H. Обнаружение коррозии медных концентрических нейтралей на кабеле URD.

Проц. Анна. Краткий курс по подземной коррозии в Аппалачах, Моргантаун, Западная Вирджиния (1979). - МАЙЕРС, МЛ.Р.; БЕК, Ф.Х.; и ФОНТАН, М.Г. Анодно-поляризационное поведение никель-хромовых сплавов в растворах серной кислоты.
Коррозия, 21:277 (1965). - ВОДЫ, Д.М. Внутренняя и внешняя коррозия меди в бытовых водопроводах.
Проц. АВВА Энн. Conf., Анахайм, Калифорния (май 1977 г.). - ЗАСТРОУ, О.В. Влияние переменного тока на коррозию подземного электрического распределительного кабеля.
Materials Performance, 20:12:41 (декабрь 1981 г.). - УИЛЬЯМС, Дж.Ф. Коррозия металлов под действием переменного тока.
Защита материалов, 5:2:52 (февраль 1966 г.). - КОМПТОН, К.Г. Коррозия концентрических нейтралей.
Материалы, 16:12 (1974). - KRUGER, S. & BIRD, CE. Коррозия металлов приложенным переменным током.
British Corrosion jour., 13:163 (1978). - СЕРРА, И.Т.; ДЕ АРАУЖО, М.М.; & МАНН. HFIMER, WA О влиянии переменного тока на коррозию алюминия и меди в контакте с почвой.

Проц. Коррозия ’79, Атланта (1979). - ДЕНИСОН, И.А. & ROMANOFF, M. Исследования почвенной коррозии, 1946 и 1948: медные сплавы, свинец и цинк.
Журнал. Рез. Натл. Бу. Стандарты, 44:259 (1950). - KROON, D.H. Подземная коррозия меди.
Проц. Corrosion ’75, Торонто, Онтарио, Канада (1975). - ХАСОК, Б. Использование потенциальных измерений при анализе коррозии концентрических нейтралей в кабелях URD.
Проц. Коррозия ’78, Хьюстон (1979). - Руководство по подземной коррозии в сельских электрических системах.
Электрификация сельской местности Админ. Бык. 161-23. Министерство сельского хозяйства США, Вашингтон, округ Колумбия (1977). - KROON, D.H. Оценка коррозии и катодная защита кабеля URD.
Проц. Коррозия ’76, Хьюстон (1976). - РОДЖЕРС, ПК; ГРОСС, Э.Э.; и ХАСОК, Б. Катодная защита подземных тепловых линий.
Защита материалов, 1:7 (1962). - ЗАСТРОУ, О.В. Гальваническое поведение нейтральных проводов подземных кабелей и материалов оболочки.

Материалы Производительность, 16:11 (1977).
Вернуться к началу
Что такое коррозия меди? — Определение из Corrosionpedia
Последнее обновление: 30 декабря 2020 г.
Что означает коррозия меди?
Коррозия меди – это коррозия материалов, изготовленных из меди или медных сплавов. Под воздействием атмосферы медь окисляется, в результате чего обычно блестящие медные поверхности тускнеют. Через несколько лет этот налет постепенно меняется на темно-коричневый или черный и, наконец, на зеленый.
Существует два известных типа коррозии меди: равномерная коррозия меди и неоднородная коррозия меди. Медь также подвержена щелевой коррозии.
Коррозия меди происходит с незначительной скоростью в незагрязненном воздухе, воде и деаэрированных неокисляющих кислотах. Однако он подвержен более быстрому воздействию окисляющих кислот, окисляющих солей тяжелых металлов, серы, аммиака и некоторых соединений серы и аммиака.
Медь может быть токсичной и может попасть в водопроводную воду как в старых, так и в новых домах. Это выщелачивание является продуктом коррозии. Небольшое потребление меди приемлемо для человека, потому что она служит важным питательным веществом, но слишком много может вызвать проблемы с желудочно-кишечным трактом. Высокий уровень меди с течением времени может привести к повреждению печени или почек. Если проверка труб показывает уровень выше 1,0 миллиграмма на литр (мг/л), необходимо лечение.
Advertisement
Corrosionpedia объясняет коррозию меди
Медь считается благородным металлом, поэтому она способна сопротивляться воздействию кислорода. Металл в основном невосприимчив к коррозии из-за естественной защитной пленки, известной как патина, которая образуется на поверхности металла. Если эту защитную пленку, обычно состоящую из красновато-коричневого оксида меди (Cu 2 O), разрушить, то медь со временем подвергнется коррозии. К счастью, защитная пленка на меди обычно остается неповрежденной и восстанавливается в большинстве почв.
К счастью, защитная пленка на меди обычно остается неповрежденной и восстанавливается в большинстве почв.
Типы коррозии меди
Существует два типа коррозии меди:
- Равномерная коррозия, которая определяется наличием относительно однородного слоя побочных продуктов коррозии меди на внутренней поверхности стенки трубы. Обычно это связано с повышенным уровнем содержания меди в кранах.
- Неравномерная коррозия, представляющая собой изолированное развитие очагов коррозии на внутренней поверхности стенки трубы. Чрезмерная точечная коррозия может привести к точечным утечкам в трубе, повреждению водой и росту плесени.
Условия, которые могут способствовать коррозии меди
Определенные условия могут вызывать коррозию, когда медь подвергается воздействию определенных почв, в том числе:
- Аномально агрессивные почвы состав
- Действие блуждающих постоянных токов (DC), протекающих в земле
- Неправильная конструкция и качество изготовления
- Определенные условия, создаваемые переменными токами (AC)
- Термогальваническое воздействие
- Гальваническое воздействие на разнородные материалы
Загрязнители воздуха (например, H 2 S) изменяют свойства поверхности меди, что может значительно снизить адгезию, создаваемую припоями или проводящими смолами и пастами.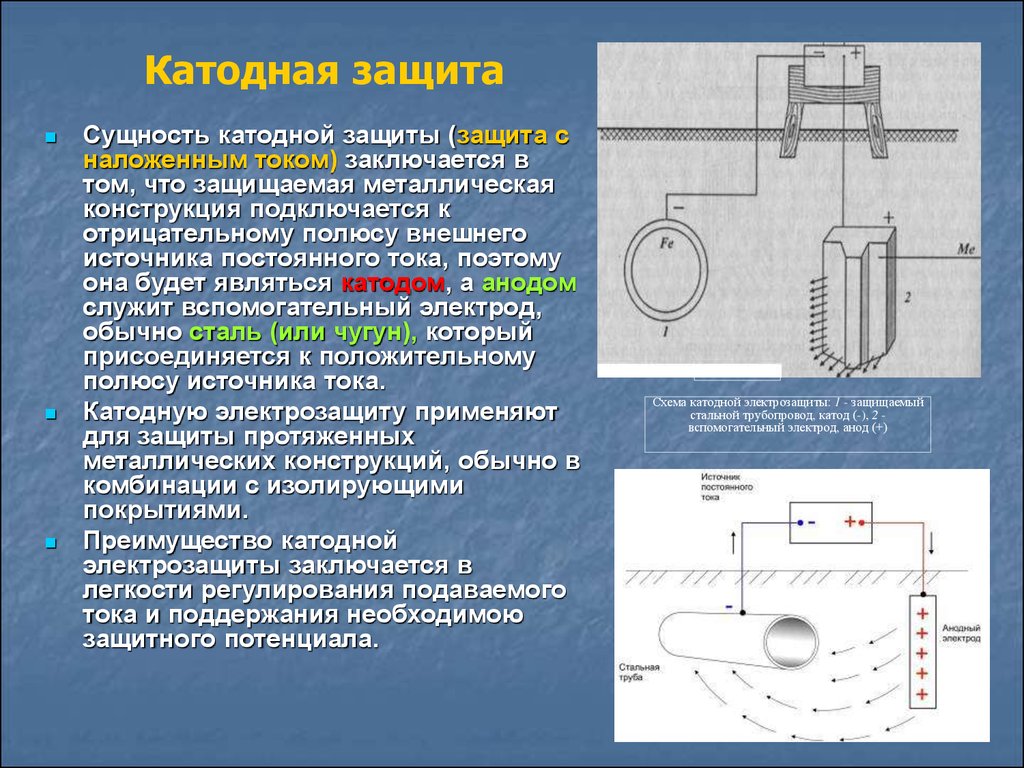 Это изменение способствует выходу из строя печатных плат в микроэлектронных устройствах.
Это изменение способствует выходу из строя печатных плат в микроэлектронных устройствах.
Соединение меди с алюминием или сталью может привести к сильной гальванической коррозии. Цианиды также вызывают коррозию медных труб.
Хорошая стойкость медных сплавов для труб к коррозии в морской воде частично зависит от присущего металлу катодного благородства, но также зависит от способности меди образовывать защитную пассивную пленку. Высокая скорость и условия турбулентного потока могут удалить эти пленки и вызвать местную быструю коррозию.
Рис. 1. Медная коррозия крепежа и окружающего металла. (Источник: Twilightartpictures/Dreamstime.com
Реклама
Поделиться этим термином
Связанные термины
- Щелевая коррозия
- Локальная коррозия
- Коррозия блуждающими токами
- Точечная коррозия
- Медь
- Оксидированная медь
- Гальваническая коррозия
- Коррозия медной полосы
- Равномерная коррозия
- Неоднородная коррозия
Связанное Чтение
- Почему два разнородных металла вызывают коррозию?
- Если медь — благородный металл, то почему мои трубы ржавеют?
- Ваш путеводитель по коррозионно-стойким металлам
- Объяснение повышенной скорости коррозии меди в зоне аэрации
- Важные факты о медной патине
- Гальваническая коррозия металлов, связанных с полимерами, армированными углеродным волокном
, которые вы могли не знать
Теги
Выбор материаловКоррозияКоррозия 101Тип коррозииЭлектрохимические свойстваМеталлыКоррозионное разрушение
Актуальные статьи
Покрытия
4 типа покрытий для бетонных полов (и что следует знать о каждом)
Процедуры
5 способов измерения твердости материалов
Покрытия
5 наиболее распространенных типов металлических покрытий, о которых должен знать каждый
Коррозия
21 Типы коррозии и разрушения труб
Обзор агрессивных сред для меди и ее ингибиторов коррозии
Том 13, выпуск 1, январь 2020 г.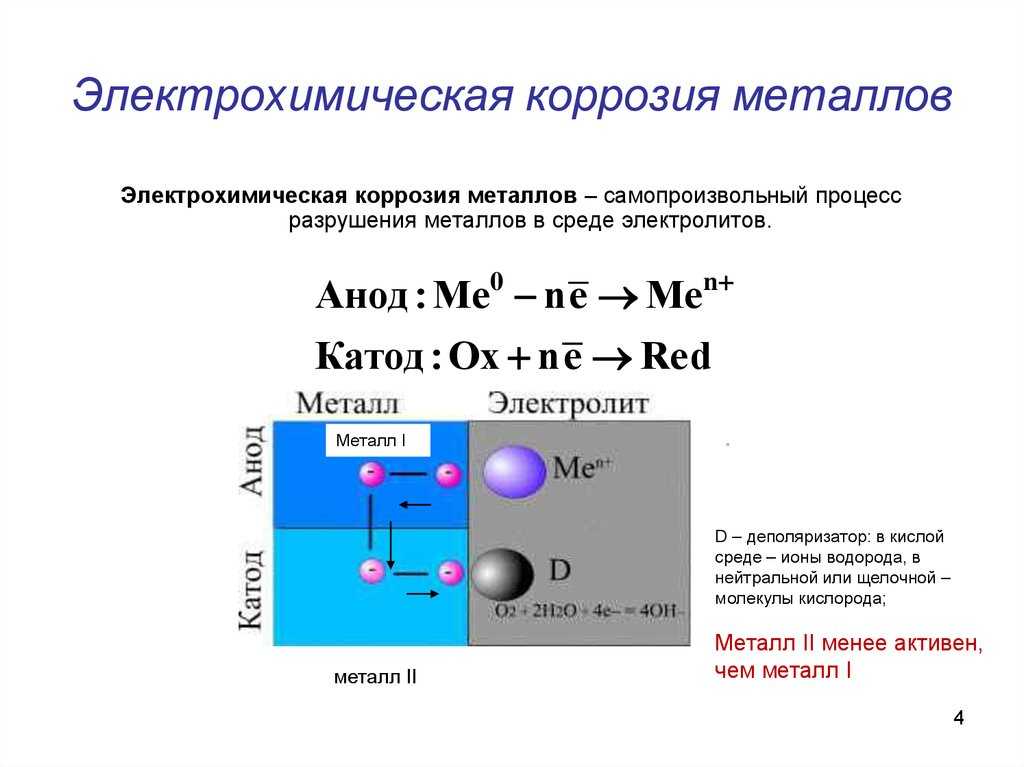 , страницы 481-544
, страницы 481-544
https://doi.org/10.1016/j.arabjc.2017.05.021Получить права и содержание
В этом обзорном документе рассматривается коррозия меди и ее сплавов в агрессивных средах и их ингибиторы коррозии. Введены основные группы ингибиторов коррозии для меди и дан обзор моделей адсорбции. Основная часть этой работы заключается в исследовании различных агрессивных сред для меди и ее сплавов и их ингибиторов коррозии, используемых в таких средах для защиты меди. Согласно литературным данным, дополнительно оценивается ингибирующее действие на коррозию органических ингибиторов коррозии и их производных по сравнению с неорганическими. Знание максимальной эффективности ингибирования коррозии конкретного ингибитора коррозии в конкретной коррозионной среде помогает выбрать наиболее подходящий состав ингибитора коррозии.
1 PBTA
(2-pyrrole carbonyl) benzotriazole
1 TBTA
(2-thienyl carbonyl)-benzotriazole
3 ATA
amino-1,2,4-triazole
3 APP I
methyl -6-оксо-4,5,6,7-тетрагидро-2H-пиразоло[3,4-b]пиридин-5-карбонитрил
3 APP II
метил-6-оксо-4-(3-феноксифенил) -4,5,6,7-тетрагидро-2H-пиразоло[3,4-b]пиридин-5-карбонитрил
3 APP III
метил-6-оксо-4-(тиофен-2-ил)-4 ,5,6,7-тетрагидро-2H-пиразоло[3,4-b]пиридин-5-карбонитрил
3,5 ДАТ
диамино-1,2,4-триазол
3 МТА
меркапто-1Н-1,2,4-триазол
4 MePhl
метил-2-фенил-имидазол 4
2 метил-2-фенил-имидазол 4
7 OP
Октилфенол
4
AHMT Амино-3-гидразино-5-меркапто-1,2,4-триазол
5 PTAH
фенил-H-Х-тетразол
AE
Coquous Extract
ae
quepous axtract
AE
queous astract
AE
queous
AE
.
амикацина дисульфат
AO
Аргановое масло
ATA
анисальдегид-[5-(п-метил)фенил-4-амино-(1,2,4-триазолил)-2-тиол]ацилдразон
AV
Adhatoda vasica
BBC
N- benzyl-1H-benzotriazole-1-carbothioamide
BIMD
benzimidazole
BNS
benzothiazole
BTA
benzotriazole
C. siliqua
Ceratonia siliqua
CC
Calligonum comosum
CDs
Capparis decidua seeds
Cys,
cysteine
DFT
density functional theory
DTUr
dithiouracil
EHE
helioscopia linn
E HOMO
highest занятые молекулярные орбитали
EIS
спектроскопия электрохимического импеданса
EN
метод электрохимического шума
FBC
N-(furan-2-ylmethyl)-1H-benzotriazole-1-carbothioamide
HME
Hyoscyamus muticus
IMD
imidazole
LF
Langmuir-Freundlich
MBIMD
mercaptobenzimidazole
MBT
меркаптобензотиазол
MD
молекулярная динамика
MMPB
метил 3-((2-меркаптофенил)имино)бутаноат
Na-CMC
натрий карбоксиметилцеллюлоза0007
NH
natural honey
NS
Nigella sativa
NTBC
nitrotetrazolium blue chloride
PP
potentiodynamic–galvanostatic polarization
SAMs
self assembled monolayers
SA
Saraka asoca
SB
(NE)-N-(фуран-2-илметилиден)-4-({4-[E)-(фуран-2-илметилиден)амино]фенил}этил)анилин
SDS
додецил натрия сульфат
SECM
Сканирующая электрохимическая микроскопия
STA
Салицилал-[5-(п-метил)-фенил-4-амино-(1,2,4-триазолил)-2-тиол]-ацилгидразон
СВЕТ
техника сканирующего вибрационного электрода
TBC
N-(2-тиазолил)-1H-бензотриазол-1-карботиоамид
VN
Vitex negundo
VTA
фенил-4-амино-(1,2,4-триазолил)-2-тиол]-ацилгидразон
Wl
weight loss measurements
XPS
X-ray photoelectron spectroscopy
Azole
Copper
Corrosion
Corrosion inhibitor
Corrosion inhibition efficiency
Isotherm
Peer review under responsibility of King Saud University.

© 2017 Авторы. Производство и размещение Elsevier BV от имени Университета короля Сауда.
Нитрит натрия в качестве ингибитора коррозии меди в имитирующей охлаждающей воде
Нитрит натрия в качестве ингибитора коррозии меди в моделируемой охлаждающей воде
Скачать PDF
Скачать PDF
- Артикул
- Открытый доступ
- Опубликовано:
- Marziya Rizvi 1 ,
- Husnu Gerengi 1 ,
- Savas Kaya 2 ,
- Ilyas Uygur 1 ,
- Mesut Yıldız 1 ,
- Ibrahim Sarıoglu 1 ,
- Zafer Cingiz 3 ,
- Михал Мельничек 4 и
- …
- Брахим Эль Ибрахими 5
Научные отчеты
том 11 , Номер статьи: 8353 (2021)
Процитировать эту статью
3658 доступов
9 цитирований
1 Альтметрика
Сведения о показателях
Предметы
- Химия
- Материаловедение
Abstract
Ингибирование коррозии нитритом натрия (NaNO 2 ) по отношению к чистой меди (99,95%) в имитированной охлаждающей воде (SCW) было исследовано с помощью спектроскопии электрохимического импеданса (EIS) и спектроскопии динамического электрохимического импеданса (DEIS). . NaNO 2 препятствует растворению металла и снижает скорость коррозии за счет образования или сохранения ингибиторной пленки на поверхности металла. Морфология поверхности показала, что однородность поверхности увеличилась при добавлении нитрита натрия. Адсорбция нитрита натрия на поверхности меди соответствовала модифицированной форме изотерм Ленгмюра, Фрейндлиха и Фрумкина. В защите от коррозии был задействован физиосорбционный режим. Электрохимические результаты показали, что коррозионная стойкость меди увеличивается с увеличением концентрации ингибитора. Результаты DEIS показали, что механизм коррозии меди может быть замедлен на 50% даже после 24-часового интервала за счет оптимальной концентрации нитрита натрия. Максимальное ингибирование было достигнуто при 2000 ч/млн NaNO 9.0069 2 . При такой концентрации была достигнута эффективность ингибирования до 61,8%.
. NaNO 2 препятствует растворению металла и снижает скорость коррозии за счет образования или сохранения ингибиторной пленки на поверхности металла. Морфология поверхности показала, что однородность поверхности увеличилась при добавлении нитрита натрия. Адсорбция нитрита натрия на поверхности меди соответствовала модифицированной форме изотерм Ленгмюра, Фрейндлиха и Фрумкина. В защите от коррозии был задействован физиосорбционный режим. Электрохимические результаты показали, что коррозионная стойкость меди увеличивается с увеличением концентрации ингибитора. Результаты DEIS показали, что механизм коррозии меди может быть замедлен на 50% даже после 24-часового интервала за счет оптимальной концентрации нитрита натрия. Максимальное ингибирование было достигнуто при 2000 ч/млн NaNO 9.0069 2 . При такой концентрации была достигнута эффективность ингибирования до 61,8%.
Введение
Согласно расчетам, промышленные издержки коррозии во всем мире составляют 3–4% валового национального продукта (ВНП). Кроме того, 20 % этих потерь неизбежны, если для защиты от коррозии используются подходящие методы 1,2 . Основной мотив для исследования коррозии состоит в том, чтобы найти приемы и методы, позволяющие свести к минимуму или контролировать эту проблему.
Кроме того, 20 % этих потерь неизбежны, если для защиты от коррозии используются подходящие методы 1,2 . Основной мотив для исследования коррозии состоит в том, чтобы найти приемы и методы, позволяющие свести к минимуму или контролировать эту проблему.
Медь широко используется в промышленности из-за ее коррозионной стойкости, электрических, термических и механических свойств 3,4 . Он также является неотъемлемой частью при производстве проволоки, трубопроводов и листов на электронных заводах, морских станциях, электростанциях, градирнях и теплообменниках 5,6 . Медь обладает значительной коррозионной стойкостью к атмосферным агрессивным агентам. Даже в некоторых коррозионно-активных электролитах он легко защищает себя от деградации, образуя пассивную оксидную пленку, которая по своей природе является непроводящей 7,8 . Однако точечная коррозия ускоряется при близости O 2 и некоторых галогенидов, подобных хлоридам. Накипь, вызванная карбонатами и сульфатами, также ускоряет коррозию, если электролит просачивается ниже осажденного слоя 9,10 . Такое поведение защищает медь от чрезмерного повреждения, но снижает производительность системы и эффективность оборудования, изготовленного с использованием этого металла 11 . Такое оборудование, как теплообменники, котлы, трубопроводы, змеевики, электрические щиты и цепи, изготовленные из меди, обычно находятся в непосредственной близости от агрессивной среды в опреснительных установках или нефтепроводах 12,13,14,15,16,17 и т.д. Кроме того, приливно-отливные/морские волны, образующие сухой и влажный циклы, усиливают эту коррозию, поскольку в такой ситуации затруднительно удерживание пассивного слоя на поверхности меди 18,19, 20,21 . Увеличение числа публикаций об исследованиях, связанных с защитой меди ингибиторами коррозии, свидетельствует о важности этой промышленной проблемы 22,23 . Несмотря на то, что медь считается устойчивым металлом, она все же может подвергаться коррозии в водных условиях под действием агрессивных ионов, таких как галогениды, сульфаты и т.
Накипь, вызванная карбонатами и сульфатами, также ускоряет коррозию, если электролит просачивается ниже осажденного слоя 9,10 . Такое поведение защищает медь от чрезмерного повреждения, но снижает производительность системы и эффективность оборудования, изготовленного с использованием этого металла 11 . Такое оборудование, как теплообменники, котлы, трубопроводы, змеевики, электрические щиты и цепи, изготовленные из меди, обычно находятся в непосредственной близости от агрессивной среды в опреснительных установках или нефтепроводах 12,13,14,15,16,17 и т.д. Кроме того, приливно-отливные/морские волны, образующие сухой и влажный циклы, усиливают эту коррозию, поскольку в такой ситуации затруднительно удерживание пассивного слоя на поверхности меди 18,19, 20,21 . Увеличение числа публикаций об исследованиях, связанных с защитой меди ингибиторами коррозии, свидетельствует о важности этой промышленной проблемы 22,23 . Несмотря на то, что медь считается устойчивым металлом, она все же может подвергаться коррозии в водных условиях под действием агрессивных ионов, таких как галогениды, сульфаты и т. д. Еще одним препятствием для ее применения является загрязнение, вызванное колониями микроорганизмов, которые в течение длительного времени процветают в нейтральной или щелочной среде. системы водяного охлаждения 24 . Эффективность и долговечность охлаждающих змеевиков/трубопроводов зависят от защиты медной поверхности, которая должна быть лишена ямок и накопленных токсичных отходов после разложения.
д. Еще одним препятствием для ее применения является загрязнение, вызванное колониями микроорганизмов, которые в течение длительного времени процветают в нейтральной или щелочной среде. системы водяного охлаждения 24 . Эффективность и долговечность охлаждающих змеевиков/трубопроводов зависят от защиты медной поверхности, которая должна быть лишена ямок и накопленных токсичных отходов после разложения.
В этой исследовательской статье содержится важная информация о подверженности коррозии меди в имитированной охлаждающей воде (SCW), которая является неотъемлемой частью промышленных установок, таких как котлы, конденсаторы, теплообменники, трубопроводы, экономайзеры и т. д. Экстремальные значения pH могут привести к коррозия любого металла, но pH моделируемой охлаждающей воды находится в нейтральном диапазоне. Хотя рН приготовленной СКВ первоначально был зафиксирован как 7,07, при растворении максимальной концентрации ингибитора он увеличился до 7,9.{ — }$$
(2)
Частично растворимый хлорид меди в разбавленном NaCl реагирует с образованием куприта или закиси меди (Cu 2 O). Этот закись меди в присутствии растворенных в воде солей окисляется до гидроксида меди (Cu(OH) 2 ). Растворенные в SCW соли вызывают не только коррозию, но и образование накипи и отложений. Обычно медь в системах охлаждения образует защитный пассивный слой Cu 2 O, который позже превращается в CuO/Cu(OH) 2 , что можно подтвердить проверкой потенциала и pH электрохимического процесса на диаграмме E-pH водной коррозии меди 25,26 . Более высокие температуры приводят к полной конверсии Cu(OH) 2 в CuO, но поскольку анализ проводится при комнатной температуре, в пассивном слое ожидается преимущественное присутствие Cu(OH) 2 .
Этот закись меди в присутствии растворенных в воде солей окисляется до гидроксида меди (Cu(OH) 2 ). Растворенные в SCW соли вызывают не только коррозию, но и образование накипи и отложений. Обычно медь в системах охлаждения образует защитный пассивный слой Cu 2 O, который позже превращается в CuO/Cu(OH) 2 , что можно подтвердить проверкой потенциала и pH электрохимического процесса на диаграмме E-pH водной коррозии меди 25,26 . Более высокие температуры приводят к полной конверсии Cu(OH) 2 в CuO, но поскольку анализ проводится при комнатной температуре, в пассивном слое ожидается преимущественное присутствие Cu(OH) 2 .
Хлорид особенно агрессивен по отношению к меди даже при базовых значениях pH. Хорошо известно, что хлориды и сульфаты антагонистически ускоряют разложение меди. Небольшие агрессивные анионы мигрируют через пленку в области с высокой плотностью положительного заряда. Может произойти замена одновалентных хлоридов на двухвалентные заряженные формы кислорода, что приведет к высвобождению Cu 2+ ионов в объеме раствора (коррозия). Кальций и магний вместе с ионами бикарбоната, присутствующими в SCW, защищают медь, образуя осажденную пленку, однако локальная коррозия все еще может происходить под этими осажденными слоями. Следовательно, ожидается, что в таких сценариях питтинговая коррозия будет происходить в большом количестве на медном металле.
Кальций и магний вместе с ионами бикарбоната, присутствующими в SCW, защищают медь, образуя осажденную пленку, однако локальная коррозия все еще может происходить под этими осажденными слоями. Следовательно, ожидается, что в таких сценариях питтинговая коррозия будет происходить в большом количестве на медном металле.
Для борьбы с коррозией меди наиболее удобным и экономичным вариантом являются ингибиторы коррозии. Роль ингибитора в подавлении анодной или катодной реакции или их обеих определяет тип ингибитора коррозии, которым он может быть. Если добавление ингибитора коррозии в агрессивную среду снижает анодное растворение меди, то ингибитор коррозии обеспечивает анодное ингибирование. Ингибиторы коррозии, включая неорганические или органические соединения, такие как азолы, амины и аминокислоты, эффективно защищают медь и медные сплавы. Это действие связано с хелатирующим эффектом функциональных групп в них или образованием непроницаемого барьера между ингибитором и медью, препятствующего ее растворению. Кроме того, наличие вакантных d-орбиталей у атома меди приводит к координационным взаимодействиям с гетероатомами, такими как азот, сера и кислород, или к π-взаимодействию среди ароматических колец через гетероциклическую часть ингибитора. Многие органические и неорганические вещества использовались в качестве ингибиторов коррозии меди в кислых, щелочных и нейтральных средах. В то время как хроматы, которые увеличивают скорость коррозии за счет увеличения скорости катодных реакций, были отвергнуты из-за их токсичности, было обнаружено, что тетрабораты и молибденаты образуют нестабильные защитные пленки на поверхности меди. Бензотриазолы действуют путем образования защитной монослойной или многослойной пленки в присутствии окислителей или за счет анодной поляризации. Для щелочных и нейтральных сред бензотриазолы обладают впечатляюще высокими антикоррозионными свойствами, но их не биоразлагаемость создает опасность попадания небиоразлагаемых веществ в больших количествах в обычные водные пути 27 .
Кроме того, наличие вакантных d-орбиталей у атома меди приводит к координационным взаимодействиям с гетероатомами, такими как азот, сера и кислород, или к π-взаимодействию среди ароматических колец через гетероциклическую часть ингибитора. Многие органические и неорганические вещества использовались в качестве ингибиторов коррозии меди в кислых, щелочных и нейтральных средах. В то время как хроматы, которые увеличивают скорость коррозии за счет увеличения скорости катодных реакций, были отвергнуты из-за их токсичности, было обнаружено, что тетрабораты и молибденаты образуют нестабильные защитные пленки на поверхности меди. Бензотриазолы действуют путем образования защитной монослойной или многослойной пленки в присутствии окислителей или за счет анодной поляризации. Для щелочных и нейтральных сред бензотриазолы обладают впечатляюще высокими антикоррозионными свойствами, но их не биоразлагаемость создает опасность попадания небиоразлагаемых веществ в больших количествах в обычные водные пути 27 . Натрий является нейтральным соединением, влияние которого на коррозию систем охлаждающей воды незаметно. В этой исследовательской статье нитрит натрия использовался для проверки его влияния на коррозию меди в SCW. Выдвинута гипотеза и доказано, что нитрит подавляет анодное растворение меди 28 . Авторы в текущей исследовательской статье попытались объяснить точную роль нитрита натрия в защите меди в SCW. Нитрит натрия — нетоксичное и экологически чистое соединение, используемое в качестве пищевого консерванта. Хорошо известен тот факт, что ингибиторы коррозии с гетероатомами, такими как «N», склонны адсорбироваться на поверхности с образованием ингибиторной пленки в качестве барьера между раствором электролита и металлом, чтобы предотвратить протекание реакции коррозии 9{2 — }$$
Натрий является нейтральным соединением, влияние которого на коррозию систем охлаждающей воды незаметно. В этой исследовательской статье нитрит натрия использовался для проверки его влияния на коррозию меди в SCW. Выдвинута гипотеза и доказано, что нитрит подавляет анодное растворение меди 28 . Авторы в текущей исследовательской статье попытались объяснить точную роль нитрита натрия в защите меди в SCW. Нитрит натрия — нетоксичное и экологически чистое соединение, используемое в качестве пищевого консерванта. Хорошо известен тот факт, что ингибиторы коррозии с гетероатомами, такими как «N», склонны адсорбироваться на поверхности с образованием ингибиторной пленки в качестве барьера между раствором электролита и металлом, чтобы предотвратить протекание реакции коррозии 9{2 — }$$
(3)
Эти ионы O 2− окисляют ионы меди до меди. В щелочном растворе на поверхности металла образуется устойчивая пассивная пленка CuO/Cu(OH) 2 30 .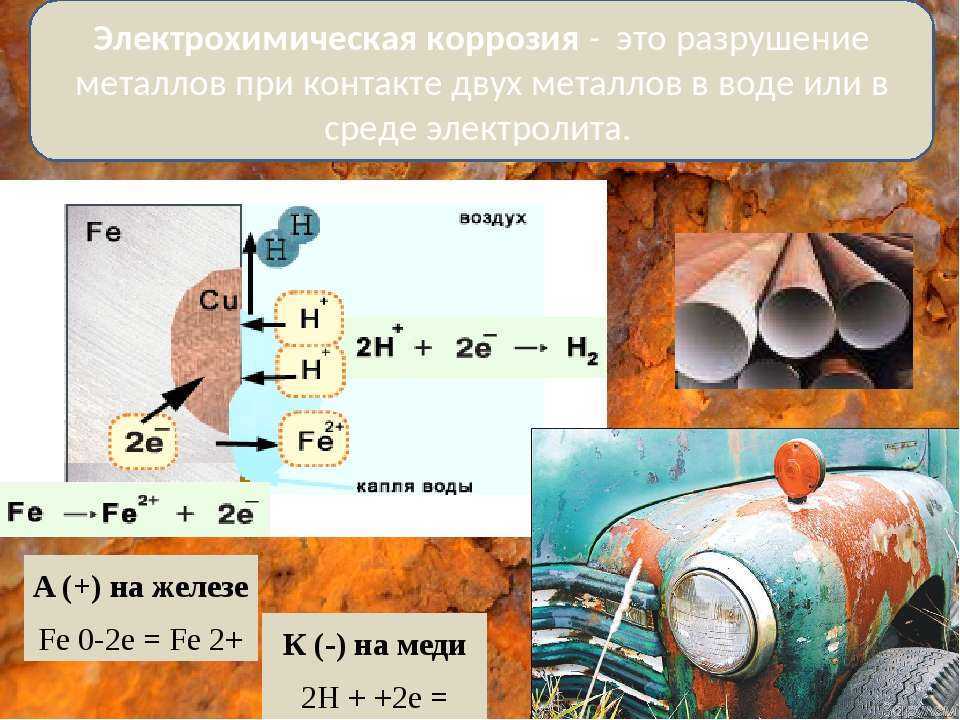
Результаты
Измерения EIS
Спектроскопия импеданса – это обычная практика, используемая для оценки сопротивления между границей раздела металла и агрессивной среды. На рисунке 1а показаны данные ЭИС для образцов меди, подвергнутых воздействию различных концентраций NaNO 9.0069 2 в SCW. Графики Найквиста показывают емкостное поведение спектров, что означает, что процесс коррозии медного электрода включает сопротивление переносу заряда. Диаметр емкостного полукруга увеличивался при добавлении NaNO 2 , что означает улучшение коррозионно-защитных свойств меди при увеличении концентрации ингибитора. Графики фазы Боде показали единственную константу в спектре импеданса, которая снова обычно была связана с процессом переноса заряда (рис. 1b). Графики EIS показали, что поверхность меди была покрыта тонкой пленкой, пассивным слоем, который предотвращал воздействие коррозионно-активных ионов, присутствующих в SCW. Диаграммы фазового угла также показали, что максимальный фазовый угол увеличивался каждый раз, когда концентрация NaNO 2 увеличилось в смоделированной охлаждающей воде. Это еще раз доказывает, что добавление NaNO 2 благотворно влияет на рост ингибирующего барьера.
Это еще раз доказывает, что добавление NaNO 2 благотворно влияет на рост ингибирующего барьера.
Рисунок 1
( a ) Графики Найквиста и ( b ) образцов меди в SCW, ингибированных различными концентрациями NaNO
Изображение в натуральную величину
Это может свидетельствовать о том, что пассивный слой оксидов или тонкая пленка Cu 2+ /ингибитор комплекс, покрывающий поверхность меди, утолщается или улучшается с увеличением концентрации ингибитора. То же можно понять и по значениям Y o , связанным с ростом емкости двойного слоя. Хотя значения R ct увеличиваются при добавлении с увеличением его концентрации, также отмечается увеличение значений R s . Обычно ингибиторы пленкообразования адсорбируются на металле и R с имеет тенденцию к уменьшению. В случае NaNO 2 его обычно считают анодным ингибитором, который способствует образованию тонкого защитного слоя оксида на поверхности меди 30 . Это означает, что из-за этого оксидного барьера на поверхности перенос ионов между медью и объемным раствором уменьшается каждый раз, когда увеличивается концентрация ингибитора, что приводит к увеличению R s . Данные импеданса приведены в таблице 1. Значения импеданса были точно подобраны к R ( QR ) и х 2 значений 10 -3 были получены для обеспечения правильности этой подгонки (рис. 1с). R s — сопротивление раствора без компенсации, R ct — сопротивление переноса заряда и Q — элемент с постоянной фазой, CPE используется вместо ‘ C dl’ двойного слоя емкость для учета неидеального поведения рабочего электрода 31 . «n» — это количественная оценка неоднородности конденсатора, значение которой может находиться в диапазоне 0 < n < 1. В таблице 1 показано улучшение однородности поверхности с увеличением концентрации ингибитора.
Это означает, что из-за этого оксидного барьера на поверхности перенос ионов между медью и объемным раствором уменьшается каждый раз, когда увеличивается концентрация ингибитора, что приводит к увеличению R s . Данные импеданса приведены в таблице 1. Значения импеданса были точно подобраны к R ( QR ) и х 2 значений 10 -3 были получены для обеспечения правильности этой подгонки (рис. 1с). R s — сопротивление раствора без компенсации, R ct — сопротивление переноса заряда и Q — элемент с постоянной фазой, CPE используется вместо ‘ C dl’ двойного слоя емкость для учета неидеального поведения рабочего электрода 31 . «n» — это количественная оценка неоднородности конденсатора, значение которой может находиться в диапазоне 0 < n < 1. В таблице 1 показано улучшение однородности поверхности с увеличением концентрации ингибитора.
Таблица 1 Параметры ЭИС образцов меди в СКВ, ингибированных различными концентрациями NaNO 2 при комнатной температуре.
Полноразмерная таблица
В таблице 1 четко указано, что значения R ct увеличивались с увеличением NaNO 2 концентрация. Значения R ct , полученные для неингибированного раствора, являются результатом прежде всего адсорбированных молекул воды и других ионов на границе раздела металл/электролит, которые позже были вытеснены частицами ингибитора. Потенциал 0,2 В/Ag/AgCl, соответствующий значению pH 7,9, можно отнести к начальному образованию Cu 2 O, которое на более поздних стадиях превратилось в CuO/Cu (OH) 2 в неингибированном растворе электролита. Однако он также может измениться на Cu 2+ /Ингибитор в ингибированном растворе 26 . NaNO 2 в максимальной концентрации является ингибитором с эффективностью 61,8% по данным EIS.
Измерения ДЭИС
Анализ ДЭИС в разные промежутки времени для получения информации для отслеживания изменений адсорбированной ингибиторной пленки нитрита на поверхности меди в СКВ проводили до 24 ч погружения образца. На рисунке 2а представлены спектры DEIS за 24 ч для образцов меди, испытанных при комнатной температуре, после достижения стабильного потенциала разомкнутой цепи (OCP).
На рисунке 2а представлены спектры DEIS за 24 ч для образцов меди, испытанных при комнатной температуре, после достижения стабильного потенциала разомкнутой цепи (OCP).
Рисунок 2
( a ) Спектры DEIS образцов меди, погруженных в SCW на 24 часа, неингибированных и ингибированных 2000 ppm NaNO погружали в СКВ в ингибированном и неингибированном состоянии на 24 ч.
Увеличить
Для лучшего понимания закономерностей растворения образования ионов Cu 2+ на поверхности меди и предотвращения этой коррозионной реакции нитритом натрия в СКВ были проведены эксперименты по ДЭИС для всех сред в разных временных диапазонах 2 ч, 6 ч, 12 ч и 24 ч соответственно. Было замечено, что R ct улучшается со временем, что указывает на лучшую эффективность ингибитора с увеличением его концентрации. Эквивалентная схема, использованная в анализе DEIS, была аналогична анализу EIS (рис. 1c). Как обычно, наилучшее соответствие определялось на основе низких значений х 2 в диапазоне 10 -3 . Полученные таким образом параметры DEIS приведены в таблице 2. Влияние добавления максимальной ингибирующей концентрации нитрита натрия к SCW можно ясно понять, посмотрев на график зависимости переноса заряда от времени на рис. 2b.
Полученные таким образом параметры DEIS приведены в таблице 2. Влияние добавления максимальной ингибирующей концентрации нитрита натрия к SCW можно ясно понять, посмотрев на график зависимости переноса заряда от времени на рис. 2b.
Таблица 2 Анализ диаграммы DEIS Найквиста для образца меди, погруженного в SCW в ингибированном и неингибированном состоянии, во временном интервале 2 ч, 6 ч и 24 ч.
Полноразмерная таблица
Значения R ct после 2-часового интервала с DEIS совпадают с результатом EIS максимальной концентрации ингибитора, что свидетельствует о согласованности проведенных тестов. В случае неингибированного раствора наблюдалось падение R ct в течение начальных значений от 0 до 14 400 с, что может быть связано с начальной атакой агрессивных ионов в SCW. После 14 400 с очень постепенное постоянное увеличение значений R ct наблюдался стойкий к агрессивному раствору. В образце меди, ингибированном 2000 частей на миллион нитрита натрия в SCW, не было падения значений R ct , что связано с ингибированием, обеспечиваемым ионами нитрита, и предотвращением растворения меди, а также предотвращением ионов хлорида в разрушение пассивного слоя оксида, образовавшегося на поверхности меди в водных растворах. Однако величина переноса заряда для первых полученных спектров сразу после погружения в ингибированный раствор была ниже, чем у холостого раствора SCW.
Однако величина переноса заряда для первых полученных спектров сразу после погружения в ингибированный раствор была ниже, чем у холостого раствора SCW.
Предыдущие исследования поведения нитрит-иона по отношению к меди и ее оксидам в различных средах пришли к выводу, что рост сопротивления первоначально образовавшегося Cu 2 O на поверхности меди тормозится нитрит-ионом, однако через некоторое время когда Cu 2 O превращается в Cu 2 O + CuO/Cu(OH) 2 , ионы нитрита начинают способствовать росту сопротивления оксидной пленки, реагируя с Cu(OH) 2 25 ,26 . В отсутствие нитрит-ионов в неингибированном растворе растущая пленка Cu 2 O, первоначально образовавшаяся на образце меди, проявляла некоторое сопротивление наряду с атакой агрессивных ионов, вытесняющих кислород и приводящих к анодному растворению. Однако интересно, что когда ингибитор, содержащий ион нитрита, добавлялся к чистому раствору СКВ, он препятствовал росту слоя закиси меди на поверхности, что приводило к облегчению воздействия на ионы СКВ на поверхности и коррозии. Следовательно, R ct начал развиваться с более низкого значения в первых спектрах, чем наблюдаемое в холостом растворе (табл. 2). Однако именно через 14 400 с образование гидроксида меди (II) наряду с оксидом меди способствовало защите от коррозии за счет образования нитрита меди на поверхности. Это привело к повышению значений R ct выше, чем в контрольном растворе, через 2 ч, и в течение 24 ч наблюдалась устойчивая эффективность ингибирования в диапазоне 50–59%. В интервале 2 ч был достигнут 54% IE, что может быть связано с ускорением роста пассивного оксидного слоя нитрит-ионом. Через 6 ч ИЭ достигает максимума 59.5%. Через 12 часов IE немного уменьшился до 58% и далее снизился до 50,5% с интервалом в 24 часа. Обычно ожидалось, что нитрит-ион будет продолжать способствовать росту пассивного слоя, а ИЭ будет сохранять тенденцию к увеличению до 24 ч. Это снижение IE позволяет предположить, что нитрит-ион сам участвует в какой-то реакции на поверхности меди.
Следовательно, R ct начал развиваться с более низкого значения в первых спектрах, чем наблюдаемое в холостом растворе (табл. 2). Однако именно через 14 400 с образование гидроксида меди (II) наряду с оксидом меди способствовало защите от коррозии за счет образования нитрита меди на поверхности. Это привело к повышению значений R ct выше, чем в контрольном растворе, через 2 ч, и в течение 24 ч наблюдалась устойчивая эффективность ингибирования в диапазоне 50–59%. В интервале 2 ч был достигнут 54% IE, что может быть связано с ускорением роста пассивного оксидного слоя нитрит-ионом. Через 6 ч ИЭ достигает максимума 59.5%. Через 12 часов IE немного уменьшился до 58% и далее снизился до 50,5% с интервалом в 24 часа. Обычно ожидалось, что нитрит-ион будет продолжать способствовать росту пассивного слоя, а ИЭ будет сохранять тенденцию к увеличению до 24 ч. Это снижение IE позволяет предположить, что нитрит-ион сам участвует в какой-то реакции на поверхности меди. Если в такую ассоциацию вовлечен процесс физиосорбции, то через определенный период времени снижение ИЭ можно было бы объяснить задействованным способом адсорбции, который будет обсуждаться в следующем разделе. Следует отметить, что после 14 400 с нитрит-ион сильнее мешает анодному растворению меди и выше R ct получается по сравнению с холостым раствором SCW. Результаты этого анализа показали, что нитрит натрия эффективно предотвращает коррозию меди в SCW.
Если в такую ассоциацию вовлечен процесс физиосорбции, то через определенный период времени снижение ИЭ можно было бы объяснить задействованным способом адсорбции, который будет обсуждаться в следующем разделе. Следует отметить, что после 14 400 с нитрит-ион сильнее мешает анодному растворению меди и выше R ct получается по сравнению с холостым раствором SCW. Результаты этого анализа показали, что нитрит натрия эффективно предотвращает коррозию меди в SCW.
Изотермы адсорбции
Изотермы, используемые для описания процесса адсорбции нитрит-иона на поверхности меди, позволили лучше понять ингибирование коррозии в текущем исследовании. Процесс адсорбции имеет тенденцию подчиняться модифицированной изотерме адсорбции Ленгмюра или изотерме Эль-Авади, изотерме адсорбции Фрейндлиха и изотерме адсорбции Фрумкина на основе значений корреляции « R 2 », который должен быть близок к единице. Полученные таким образом параметры адсорбции приведены в Таблице 3.
Таблица 3 Значения адсорбции, полученные для образца меди в SCW, ингибированном NaNO 2 , в течение 2 ч при комнатной температуре.
Полноразмерная таблица
Экспериментальные данные лучше всего соответствовали модифицированной изотерме Ленгмюра, которую обычно называют изотермой Эль-Авади (рис. 3а) 32 . Изотерма Эль-Авади описывается выражением
$$\log \left( {\frac{\uptheta}{{1 -\uptheta}}} \right) = \log K + y\log C$$ 9{1/y}$$
(5)
Рисунок 3
Изотермы адсорбции для образца меди, погруженного в SCW, ингибированного 2000 ppm NaNO ) Изотерма Фрейндлиха и ( c ) изотерма Фрумкина.
Полноразмерное изображение
Когда это 1/ y меньше 1, это предполагает многослойную адсорбцию. В настоящее время полученные значения 1/ y превышают единицу (1/y = 1,4), что означает, что каждая ингибирующая молекула присоединена более чем к одному активному центру на поверхности меди. Это может быть связано с присутствием двух гидроксидных или двух нитритных ионов в связи с анодным участком. Константа адсорбционного равновесия ‘ K ads ‘ (получено из пересечения графиков изотерм адсорбции) помогло получить свободную энергию адсорбции ‘Δ G ads ‘ согласно следующему уравнению:
Это может быть связано с присутствием двух гидроксидных или двух нитритных ионов в связи с анодным участком. Константа адсорбционного равновесия ‘ K ads ‘ (получено из пересечения графиков изотерм адсорбции) помогло получить свободную энергию адсорбции ‘Δ G ads ‘ согласно следующему уравнению:
$$K_{ads} = \frac{1}{{C_{{H_{2} O}} }}exp \frac{{ — \Delta G_{ads} }}{RT}$$
(6)
где концентрация молекул воды составляет 1000 г/л, ‘R’ представляет собой универсальную газовую постоянную (R = 8,314 Дж K -1 моль -1 ) и T 9{n}$$
(7)
$$\log \theta = \frac{1}{n}log C + \log K_{ads}$$
(8)
, где 1/ n = 1,15 – константа, зависящая от природы адсорбированной молекулы, K адс (3,2 × 10 3 м.д. –1 ) – константа адсорбции-десорбции, отражающая силу взаимодействия адсорбированного слоя. Фактически, когда его значение близко к нулю, это означает неоднородность поверхности; тогда как значение ниже единицы означает сильную адсорбцию (хемосорбцию), аналогично, выше единицы это указывает на умеренную адсорбцию (комплексную/смешанную). Значение 1/n было чуть больше единицы, что свидетельствовало об умеренной физиосорбции на поверхности меди. Коэффициент корреляции для изотермы Фрейндлиха составил 0,9.{{2{{\varvec{\upalpha}}}{\varvec{\theta}}}}$$
Значение 1/n было чуть больше единицы, что свидетельствовало об умеренной физиосорбции на поверхности меди. Коэффициент корреляции для изотермы Фрейндлиха составил 0,9.{{2{{\varvec{\upalpha}}}{\varvec{\theta}}}}$$
(9)
$$log\frac{\theta}{{\left( {1 — \ theta } \right) \cdot C}} = 2,303 log K_{ads} + 2{\upalpha }\theta$$
(10)
α (0,37) связано с молекулярным взаимодействием в адсорбированном слое, где α — параметр латерального взаимодействия, описывающий взаимодействие в адсорбированном слое. Параметр молекулярного взаимодействия можно считать положительным или отрицательным: при α < 0 в адсорбированном слое имеет место отталкивание, в противном случае притяжение 34 .
Отрицательные значения ΔG объявления означали спонтанную адсорбцию. Когда значения ( ΔG и ) до — 20 кДж моль -1 , они предполагают электростатические взаимодействия между заряженными молекулами и заряженным металлом (физисорбция), а когда эти значения составляют около -40 кДж моль −1 , они предполагают хемосорбцию, которая происходит в результате разделения или переноса электронов от молекул ингибитора к поверхности металла с образованием координационной связи (хемосорбция) 35 . Все значения ΔG и , перечисленные в таблице 3, были отрицательными, что свидетельствовало о спонтанной адсорбции ингибитора на поверхности меди. Диапазон значений указывал на преобладающую роль физиосорбции, что предполагает незначительную возможность образования комплекса на металлической подложке. Однако изотерма Эль-Авади предполагала роль комплексного типа адсорбции, которая могла бы иметь место в присутствии двух гетероатомов N и O, непосредственно участвующих в защите поверхности меди. Подводя итоги, на основании адсорбционного анализа было высказано предположение, что с каждым активным центром на поверхности меди связано более одного вида ингибитора, и адсорбированные частицы взаимодействуют друг с другом. Через 2 ч CuO/Cu(OH) 2 образовался на поверхности меди. Существует также вероятность того, что он подвергается реакции замещения нитрит-иона, чтобы адсорбироваться на поверхности меди.
Все значения ΔG и , перечисленные в таблице 3, были отрицательными, что свидетельствовало о спонтанной адсорбции ингибитора на поверхности меди. Диапазон значений указывал на преобладающую роль физиосорбции, что предполагает незначительную возможность образования комплекса на металлической подложке. Однако изотерма Эль-Авади предполагала роль комплексного типа адсорбции, которая могла бы иметь место в присутствии двух гетероатомов N и O, непосредственно участвующих в защите поверхности меди. Подводя итоги, на основании адсорбционного анализа было высказано предположение, что с каждым активным центром на поверхности меди связано более одного вида ингибитора, и адсорбированные частицы взаимодействуют друг с другом. Через 2 ч CuO/Cu(OH) 2 образовался на поверхности меди. Существует также вероятность того, что он подвергается реакции замещения нитрит-иона, чтобы адсорбироваться на поверхности меди.
Анализ поверхности
Анализ поверхности привел к важным выводам об адсорбции NaNO 2 на поверхности меди в SCW. Улучшение свойств поверхности, количественную и качественную оценку молекул, адсорбированных на образцах меди, можно было понять только с помощью анализа поверхности. Одной из важных целей исследования состава поверхности ингибированного образца было выяснить, зависит ли адсорбция исключительно от кислорода или азот также связан с поверхностью меди.
Улучшение свойств поверхности, количественную и качественную оценку молекул, адсорбированных на образцах меди, можно было понять только с помощью анализа поверхности. Одной из важных целей исследования состава поверхности ингибированного образца было выяснить, зависит ли адсорбция исключительно от кислорода или азот также связан с поверхностью меди.
АСМ
Чтобы судить об эффективности и роли NaNO 2 в предотвращении коррозии и поддержании однородности поверхности меди при погружении в СКВ, для каждого образца наблюдали 3D и 2D изображения, полученные с помощью АСМ. Свежеотполированный образец меди имел средний коэффициент шероховатости R m 27,4 нм (рис. 4а). Когда этот полированный образец был погружен в SCW на 2 часа, шероховатость ухудшилась до R m = 246,8 нм (рис. 4b). Линии истирания, видимые на полированном образце, растворялись в образце, погруженном в СКВ.
Рисунок 4
АСМ-изображения ( a ) полированного образца меди, ( b ) образца меди, подвергшегося коррозии в SCW, и ( c ) образца меди в SCW, защищенного 2000 ppm NaNO 2
Полноразмерное изображение
Корродированный образец в неингибированном растворе также имел области синего цвета в двухмерном изображении, что может быть связано с питтингом, вызванным ионами хлорида (рис. 4a). В соответствии с масштабом изображений изображенные синие области — это области, где металл был удален коррозией. Локальная коррозия очень хорошо видна на корродированном образце (рис. 4b). Шероховатость образца была меньше при его погружении в раствор СКВ, ингибированного 2000 м.д. NaNO 2 наблюдалось явное уменьшение синих областей. Средняя шероховатость улучшилась до R m = 32,9 нм (рис. 4c). По-видимому, на 2D-изображении ингибированного образца на рис. 4c видно несколько синих областей (ямок), что предполагает меньшее количество питтинга и низкую коррозию. Добавление нитрита натрия явно улучшило шероховатость поверхности образца меди, что было очень заметно на изображениях АСМ.
4a). В соответствии с масштабом изображений изображенные синие области — это области, где металл был удален коррозией. Локальная коррозия очень хорошо видна на корродированном образце (рис. 4b). Шероховатость образца была меньше при его погружении в раствор СКВ, ингибированного 2000 м.д. NaNO 2 наблюдалось явное уменьшение синих областей. Средняя шероховатость улучшилась до R m = 32,9 нм (рис. 4c). По-видимому, на 2D-изображении ингибированного образца на рис. 4c видно несколько синих областей (ямок), что предполагает меньшее количество питтинга и низкую коррозию. Добавление нитрита натрия явно улучшило шероховатость поверхности образца меди, что было очень заметно на изображениях АСМ.
SEM/EDX
На рисунке 5a,b,c,d,e и f представлены графики SEM и связанных с ними EDX для образца меди, имеющего различную морфологию и состав в различных средах. Изменения, происходящие на поверхности меди, были очевидны из изображений, полученных с помощью SEM, и по элементному составу поверхности, предложенному EDX. 9Рис. 5 в SCW, защищенном 2000 ppm NaNO 2 .
9Рис. 5 в SCW, защищенном 2000 ppm NaNO 2 .
Изображение в полный размер
СЭМ полированной меди на рис. 5а показала некорродированную, довольно гладкую поверхность с несколькими линиями истирания, что можно отнести к подготовке поверхности бумагой SiC. Относительный график EDX показал, что поверхность была лишена каких-либо продуктов коррозии и представляет собой образец чистой меди (рис. 5b). СЭМ образца меди, погруженного в SCW на рис. 5c, показала значительно корродированную и изъеденную поверхность, что может быть связано с присутствием сигналов хлорида, серы и кислорода в спектрах EDX (рис. 5d). На поверхности подвергшихся коррозии образцов локальная коррозия была более выражена наряду с некоторой равномерной коррозией. Количество хлоридов и сульфид-ионов на поверхности имело низкий сигнал из-за их низкой миллимолярной концентрации в СКВ. Однако интересно отметить, что даже в таких концентрациях эти агрессивные ионы вызывали значительные локальные повреждения поверхности меди. Сигнал кислорода был более очевидным, чем сигнал хлорида, и даже его массовый процент выше, чем у хлорида, что указывало на присутствие оксидов на корродированной поверхности, особенно оксида меди в случае неингибированного образца.
Сигнал кислорода был более очевидным, чем сигнал хлорида, и даже его массовый процент выше, чем у хлорида, что указывало на присутствие оксидов на корродированной поверхности, особенно оксида меди в случае неингибированного образца.
Основной особенностью, замеченной в СЭМ образца меди, ингибированного 2000 ppm NaNO 2 на рис. 5e, была значительная коррозия и точечная коррозия, которые наблюдались ранее и теперь значительно уменьшились по сравнению с неингибированным образцом, подвергшимся коррозии в SCW.
Чтобы получить более четкое заключение, значения EDX элементов, присутствующих на медной подложке, показали наличие значительных количеств N, O и следовых количеств S. Количество ионов Cl − было уменьшено на ингибированной поверхности. согласно графику EDX (рис. 5f), который предполагает, что ионы нитрита явно предотвратили ассоциацию хлорида с поверхностью меди. Сигнал кислорода был немного низким в ингибированном образце, потому что нитрит натрия более благоприятен для образования оксида меди и гидроксидов на поверхности меди, которые также могли быть замещены молекулами ингибитора, и, следовательно, был получен низкий сигнал для кислорода. Спектр EDX также показал улучшение процентного содержания меди в ингибированном образце.
Спектр EDX также показал улучшение процентного содержания меди в ингибированном образце.
Оптическая профилометрия
Оптическое профилирование проводилось, чтобы узнать шероховатость поверхности, потери материала и статистику ямок на поверхности меди, чтобы понять влияние SCW и ингибитора на нее.
На 3D-изображении очень четко видны красные области на полированном образце (рис. 6а), непроржавевшие красные области уменьшились в неингибированном корродированном образце (рис. 6б), в то время как на ингибированном образце были видны корродированные, а также более защищенные области на 3D-изображение (рис. 6c). 2D-изображение и высотный профиль четко отображали возникновение локальной и точечной коррозии в корродированном образце, погруженном в СКВ (рис. 6б). Ингибированный образец продемонстрировал улучшение коэффициента глубины впадин и средней шероховатости всего образца в присутствии 2000 м.д. NaNO 2 в SCW (рис. 6в). Количественные данные представлены в таблице 4.
Рисунок 6
Оптический профиль для ( a ) полированного образца меди, ( b ) образца меди, подвергшегося коррозии в SCW, и ( c ) образца меди в SCW, защищенного 2000 м.д. NaNO 2 .
Изображение с полным размером
Таблица 4. Результаты оптического профиля меди в SCW, ингибированной 2000 ppm NaNO 2 .
Полноразмерный стол
Вычислительный анализ
В таблице 5 значения граничных орбитальных энергий, энергетической щели, электроотрицательности, твердости, доли переданных электронов, электронодонорной способности, электроноакцепторной способности и дипольного момента, рассчитанные для нитрит-иона на различных уровнях расчета теории, приведены в подробном виде (рис. . 7). Пограничные орбитальные энергии, а именно ВЗМО/высокая занятая молекулярная орбитальная энергия и НСМО/низкая незанятая молекулярная орбитальная энергия, широко рассматриваются при анализе свойств молекул ингибировать коррозию. Высокие значения Е HOMO облегчают адсорбцию молекул ингибитора на металлических поверхностях и, следовательно, повышают эффективность ингибирования. С другой стороны, энергетический уровень самой низкой незанятой молекулярной орбитали представляет собой способность молекулы принимать электроны от донора электронов. Энергетическая щель, а именно разница между орбитальными энергиями ВЗМО и НСМО, является важным показателем реакционной способности молекул. Следует отметить, что высокие значения энергетической щели принадлежат молекулам с низкой реакционной способностью. Эту ситуацию можно объяснить в свете принципа максимальной твердости.
Высокие значения Е HOMO облегчают адсорбцию молекул ингибитора на металлических поверхностях и, следовательно, повышают эффективность ингибирования. С другой стороны, энергетический уровень самой низкой незанятой молекулярной орбитали представляет собой способность молекулы принимать электроны от донора электронов. Энергетическая щель, а именно разница между орбитальными энергиями ВЗМО и НСМО, является важным показателем реакционной способности молекул. Следует отметить, что высокие значения энергетической щели принадлежат молекулам с низкой реакционной способностью. Эту ситуацию можно объяснить в свете принципа максимальной твердости.
Таблица 5 Параметры электронной структуры нитрит-иона с использованием различных комбинаций методов/базисных наборов. Рис. 7
Изображение с полным размером
В соответствии с принципом жесткости и мягкости кислотно-щелочного баланса, введенным Пирсоном, жесткость, мягкость и энергетическая щель являются тесно связанными друг с другом параметрами. Пирсон определил твердость как сопротивление поляризации электронного облака или деформации химических частиц. Жесткие молекулы с большими значениями энергетической щели неэффективны против коррозии металла. С другой стороны, мягкие молекулы с низкими значениями запрещенной зоны являются хорошими ингибиторами коррозии. В классификации жестких и мягких кислотных оснований Пирсона № 9.0069 2 − ион появляется между пограничными основаниями. Здесь видно, что нитрит-ион более эффективен против коррозии поверхности меди по сравнению с нитрат-ионом, который является твердым основанием. Из данных, приведенных в таблице 5, видно, что значения жесткости, рассчитанные для нитрит-иона, в целом довольно низкие. Согласно принципу максимальной жесткости 36 твердые молекулы более стабильны по сравнению с мягкими. Адсорбционное поведение нитрит-иона на поверхности меди подтверждает справедливость этого принципа электронной структуры. Склонность химических частиц притягивать электроны объясняется с помощью концепции электроотрицательности.
Пирсон определил твердость как сопротивление поляризации электронного облака или деформации химических частиц. Жесткие молекулы с большими значениями энергетической щели неэффективны против коррозии металла. С другой стороны, мягкие молекулы с низкими значениями запрещенной зоны являются хорошими ингибиторами коррозии. В классификации жестких и мягких кислотных оснований Пирсона № 9.0069 2 − ион появляется между пограничными основаниями. Здесь видно, что нитрит-ион более эффективен против коррозии поверхности меди по сравнению с нитрат-ионом, который является твердым основанием. Из данных, приведенных в таблице 5, видно, что значения жесткости, рассчитанные для нитрит-иона, в целом довольно низкие. Согласно принципу максимальной жесткости 36 твердые молекулы более стабильны по сравнению с мягкими. Адсорбционное поведение нитрит-иона на поверхности меди подтверждает справедливость этого принципа электронной структуры. Склонность химических частиц притягивать электроны объясняется с помощью концепции электроотрицательности. Молекулы, имеющие высокие значения электроотрицательности, неэффективны против коррозии металла. Значения электроотрицательности, рассчитанные для исследуемой молекулы ингибитора, оказались не столь высокими.
Молекулы, имеющие высокие значения электроотрицательности, неэффективны против коррозии металла. Значения электроотрицательности, рассчитанные для исследуемой молекулы ингибитора, оказались не столь высокими.
Другим полезным параметром, используемым в исследованиях ингибирования коррозии, является показатель электрофильности. Принцип электронной структуры, известный как принцип минимальной электрофильности, связывает индекс электрофильности с химической стабильностью. В соответствии с этим принципом естественное направление химической реакции направлено к состоянию минимальной электрофильности. Отсюда можно сделать вывод, что молекулы с низким значением электрофильности более стабильны. В противоречии с этим принципом в исследованиях коррозии широко сообщается, что молекулы, имеющие высокие значения электрофильности, не являются хорошими ингибиторами коррозии. Ион нитрита с низким значением электрофильности является хорошим ингибитором коррозии для поверхности меди. Этот результат показывает, что принцип минимума электрофильности 37 не может объяснить антикоррозионную активность молекул. В соответствии с параметрами электронодонорной и электроноакцепторной способности, полученными Газкесом и его сотрудниками, хорошие ингибиторы коррозии должны иметь высокие значения электронодонорной способности. Из соответствующей таблицы видно, что значения электронодонорной способности, рассчитанные для исследуемого иона, достаточно высоки. Значения энергии адсорбции, полученные методом моделирования молекулярной динамики, показывают, что взаимодействие между ионом нитрита и поверхностью меди является достаточно сильным. Из данных, приведенных в Таблице 6, можно понять, что нитрит-ион сильнее взаимодействует с поверхностью Cu (111) по сравнению с другими ионами. Теоретически полученные результаты хорошо согласуются с экспериментальными наблюдениями.
В соответствии с параметрами электронодонорной и электроноакцепторной способности, полученными Газкесом и его сотрудниками, хорошие ингибиторы коррозии должны иметь высокие значения электронодонорной способности. Из соответствующей таблицы видно, что значения электронодонорной способности, рассчитанные для исследуемого иона, достаточно высоки. Значения энергии адсорбции, полученные методом моделирования молекулярной динамики, показывают, что взаимодействие между ионом нитрита и поверхностью меди является достаточно сильным. Из данных, приведенных в Таблице 6, можно понять, что нитрит-ион сильнее взаимодействует с поверхностью Cu (111) по сравнению с другими ионами. Теоретически полученные результаты хорошо согласуются с экспериментальными наблюдениями.
Таблица 6 Энергия адсорбции (E ads ) компонентов раствора (выделенные виды) и (адсорбированные вещества) на поверхности меди.
Полная таблица
Выводы
Обнаружено влияние добавки NaNO 2 на электрохимические и поверхностные свойства меди в СКВ. Были сделаны следующие выводы:
Были сделаны следующие выводы:
- 1.
Максимальная концентрация NaNO 2 при концентрации 2000 частей на миллион предотвратил коррозию на 61,8%, согласно данным EIS. Параметры ЭИС свидетельствовали об образовании тонкой барьерной пленки, которая улучшалась с увеличением концентрации ингибитора. Первый вывод, который был сделан, заключался в том, что ионы нитрита способствовали росту пассивного оксидного слоя на поверхности меди.
- 2.
Анализ DEIS дал некоторые важные сведения о роли нитрит-иона в ингибировании коррозии меди в SCW. Ион нитрита уменьшал рост образования начального оксидного слоя Cu 2 O, но ровно через два часа улучшилось ингибирование меди, когда Cu 2 O + Cu(OH) 2 образовалась через 14 400 с. Эффект ингибирования составил 50–59% в течение 24 ч.
 Снижение значений ИЭ через 12 и 24 ч могло быть связано с потерей нитрит-ионов с поверхности меди, которые были физиосорбированы и давали хорошую защиту (59,5%) через 6-часовой интервал. Такое поведение NaNO 2 не могло быть обнаружено и объяснено исключительно с помощью EIS, что повысило важность DEIS в измерениях коррозии. Еще один важный вывод, сделанный на основе данных DEIS, заключался в том, что этот ингибитор продолжал оставаться эффективным даже через 24 часа.
Снижение значений ИЭ через 12 и 24 ч могло быть связано с потерей нитрит-ионов с поверхности меди, которые были физиосорбированы и давали хорошую защиту (59,5%) через 6-часовой интервал. Такое поведение NaNO 2 не могло быть обнаружено и объяснено исключительно с помощью EIS, что повысило важность DEIS в измерениях коррозии. Еще один важный вывод, сделанный на основе данных DEIS, заключался в том, что этот ингибитор продолжал оставаться эффективным даже через 24 часа. - 3.
Адсорбционные исследования показали спонтанную и преимущественную физиосорбцию нитрита натрия на меди в СКВ. Исследования адсорбции также показали, что каждый активный центр на поверхности меди связан с более чем одним адсорбирующим веществом. Это может быть связано с образованием либо Cu(OH) 2 , либо Cu(NO 2 ) 2 . Исследования также показали меньшее взаимодействие между адсорбированными частицами.
 Адсорбция комплексного типа, предложенная изотермой Эль-Авади, также указывает на некоторую роль хемосорбции в процессе, что может быть связано с образованием комплекса [Cu / ингибитор] с использованием кислорода или азота.
Адсорбция комплексного типа, предложенная изотермой Эль-Авади, также указывает на некоторую роль хемосорбции в процессе, что может быть связано с образованием комплекса [Cu / ингибитор] с использованием кислорода или азота. - 4.
Ингибитор NaNO 2 оказался действительно эффективным в улучшении однородности поверхности, что подтверждается анализом АСМ и ОП.
- 5.
Один из самых интересных выводов был сделан на основе анализа SEM/EDX. Наблюдаемое ингибирование не может быть связано исключительно с образованием пассивного слоя Cu 2 O + CuO/Cu(OH) 2. Значительные количества азота и кислорода, обнаруженные с помощью анализа EDX в ингибированном образце, позволяют предположить связь нитрит-иона с поверхностью меди.

- 6.
Параметры, полученные по энергии ВЗМО и НСМО системы, предполагают, что нитрит-ион имеет низкое значение электрофильности и высокую способность донора электронов. Молекулярно-динамическое моделирование показало мощное взаимодействие между нитрит-ионом и поверхностью меди, то есть нитрит натрия можно рассматривать как анодный ингибитор, но в ходе экспериментов было обнаружено, что он может действовать как пленкообразующий ингибитор меди в моделируемой охлаждающей воде.
- 7.
Все анализы, проведенные для установления роли нитрита натрия в защите меди в SCW, показали, что он является очень эффективным ингибитором для систем охлаждающей воды, изготовленных из меди.
Методы
Материалы и среды
Образцы меди сертифицированы как 9В качестве тест-образцов использовали чистоту 9,99%, полученную от Sofıa Med Ad, Болгария. Рабочая поверхность испытуемых образцов шлифовалась наждачной бумагой SiC зернистостью от 360 до 2000, обезжиривалась спиртом и затем промывалась дистиллированной водой. Имитируемую охлаждающую воду готовили растворением NaCl (7,5 ммоль/л), NaHCO 3 (2,0 ммоль/л), Na 2 SO 4 (3,5 ммоль/л), MgSO 4 (0,25 ммоль/л). л) и CaCl 2 (0,50 ммоль/л) в дистиллированной воде 38 .
Рабочая поверхность испытуемых образцов шлифовалась наждачной бумагой SiC зернистостью от 360 до 2000, обезжиривалась спиртом и затем промывалась дистиллированной водой. Имитируемую охлаждающую воду готовили растворением NaCl (7,5 ммоль/л), NaHCO 3 (2,0 ммоль/л), Na 2 SO 4 (3,5 ммоль/л), MgSO 4 (0,25 ммоль/л). л) и CaCl 2 (0,50 ммоль/л) в дистиллированной воде 38 .
Спектроскопия электрохимического импеданса (ЭИС)
Эксперименты проводились в системе, где электродом сравнения служил Ag/AgCl, противоэлектрод из платины (Pt) и рабочий электрод из меди с площадью открытой поверхности 0,785 см 2 следственная камера. Стационарное состояние OCP было получено с интервалом в два часа. ЭИС проводилась при размахе коррозионного потенциала амплитуды сигнала 10 мВ ( E корр. ) с частотным диапазоном от 10 мГц до 100 кГц 9{(i)} }} \times 100$$
(11)
где R ct (i) представляет сопротивление переносу заряда в присутствии NaNO 2 ct , а R
— значение для неингибированного раствора соответственно.
Спектроскопия динамического электрохимического импеданса (DEIS)
С помощью DEIS можно контролировать эффективность ингибиторов против образования накипи и коррозии меди в течение более длительных периодов времени. ДЭИС выполняли с использованием сигнала возмущения тока, выдаваемого цифро-аналоговой картой National Instrument Ltd PCI-4461, и регистрации сигнала отклика напряжения медного образца. Гальваностатические условия устанавливались с помощью Slepski Galvanostat, который также служил преобразователем ток-напряжение во время процесса 40 . В качестве источника возмущения использовался мультисинусоидальный сигнал, состоящий из 20 элементарных токовых синусоид с оптимизированным значением сдвига фазы и амплитуды. Частота дискретизации составляла 12,8 кГц, применялся диапазон частот от 300 мГц до 4,5 кГц с 8 точками на декаду частоты. DEIS обеспечивает оперативную оценку процесса коррозии на рабочем электроде. Спектры импеданса, полученные с помощью DEIS, анализировались с помощью той же программы, которая интерпретировала данные EIS.
Анализ поверхности
Визуальное определение степени коррозии на поверхности медных образцов с точки зрения неоднородности/шероховатости требует высокоточных методов, таких как АСМ и СЭМ/EDX. Текущие эксперименты проводились на образцах меди в ингибированном и неингибированном состояниях при комнатной температуре. Исследование SEM/EDX проводили на FEG250 (FEI, Голландия) с приставкой EDX. Прибором для АСМ служила модель Park Systems XE-100E. Скорость сканирования составляла 0,2 Гц, а оптическое разрешение — 1 мкм. Площадь (90,09 × 9,09) мкм 2 тестового образца визуализировали в бесконтактном режиме. Оптическую профилометрию проводили с помощью профайлера Phase View optik.
Вычислительные методы
В концептуальной теории функционала плотности, предложенной Парром и Пирсоном, дескрипторы химической активности, такие как химический потенциал (µ), электроотрицательность (χ), твердость (η) и мягкость (σ), выводятся по отношению к числу электрон полной электронной энергии при постоянном внешнем потенциале. Мягкость — это мультипликативная обратная величина твердости. Электроотрицательность сообщается как отрицательное значение химического потенциала. В рамках подхода конечных разностей связь с энергией ионизации основного состояния (I), сродством к электрону основного состояния (A), полной электронной энергией E и числом электронов (N) вышеупомянутых дескрипторов представлена следующими уравнениями 9{2} }}} \right]_{\nu (r)} = \frac{I — A}{2}$$
Мягкость — это мультипликативная обратная величина твердости. Электроотрицательность сообщается как отрицательное значение химического потенциала. В рамках подхода конечных разностей связь с энергией ионизации основного состояния (I), сродством к электрону основного состояния (A), полной электронной энергией E и числом электронов (N) вышеупомянутых дескрипторов представлена следующими уравнениями 9{2} }}} \right]_{\nu (r)} = \frac{I — A}{2}$$
$$\sigma = 1/\eta$$
Теорема Купманса 42 можно рассматривать как мост между молекулярно-орбитальной теорией и концептуальной функциональной теорией плотности. Теорема Купманса утверждает, что отрицательные значения орбитальных энергий ВЗМО и НСМО связаны с энергией ионизации, а сродство молекул к электрону является параллельным подходом к прогнозированию значений энергии ионизации молекул и сродства к электрону. В свете этой теоремы даются следующие соотношения \(I = -E_{HOMO}\) и \(A = -E_{LUMO}\). Согласно индексу электрофильности (ω), данному Parr, Szentpaly и Liu 9{2} /2\eta$$
$$\varepsilon = 1/\omega$$
В последние годы Газкес и его коллеги 44 провели подробные исследования, касающиеся предсказания электронодонорной и электроноакцепторной способности молекул и они предложили два новых параметра, называемых электронодонорной способностью (ω — ) и электроноакцепторной способностью (ω + ), и сформулировали эти параметры на основе концепций энергии ионизации и сродства к электрону с помощью следующих уравнений. {2} /(16(I — A))$$ 9{2} /(16(I — A))$$
{2} /(16(I — A))$$ 9{2} /(16(I — A))$$
Важным параметром является доля перенесенных электронов (ΔN) от молекулы ингибитора к поверхности металла. Уравнение, предложенное для расчета этого параметра, было предложено с учетом принципа выравнивания электроотрицательности, переданного науке Сандерсоном. До недавнего времени для расчета доли переданных электронов использовалась электроотрицательность атома металла, но некоторые исследователи предложили использовать работу выхода, определенную для поверхности металла, вместо электроотрицательности металла. Уравнение для расчета значений ΔN процессов адсорбции имеет вид:
$$\Delta N = \frac{{\phi_{Cu} — \chi_{inh} }}{{2(\eta_{Cu} + \eta_{inh} )}}$$
при этом важно отметить, что χ inh , η Cu и η inh обозначают электроотрицательность ингибитора, твердость металла и твердость ингибитора соответственно. В расчетах η Cu = 0 принимается в предположении, что для металлического объема I = A. Значение работы выхода, указанное для поверхности Cu (111), составляет 4,80 эВ 45 .
Значение работы выхода, указанное для поверхности Cu (111), составляет 4,80 эВ 45 .
Моделирование молекулярной динамики
Адсорбционные свойства нитрит-иона (NO 2 − ) были оценены с использованием подхода молекулярно-динамического моделирования на модуле Forcite от Accelrys Inc. В качестве модели была выбрана металлическая поверхность Cu (111). Чтобы увидеть влияние растворителя, расчеты проводились как в вакууме, так и в водной среде. Расчеты проводились в моделирующем блоке, где нитрит-ион находится в контакте с поверхностью меди при температуре 303 К. Метод молекулярно-динамического моделирования хорошо зарекомендовал себя для анализа взаимодействия металла и ингибитора. Особенно важно, что при расчете взаимодействия (E взаимодействия ) и энергии связи (E связывания ) относительно процесса адсорбции нитрит-иона на поверхности Cu (111), рассматриваются следующие уравнения 46 .
$$E_{{{\text{взаимодействие}}}} = E_{всего} — (E_{{поверхность + H_{2} O}} + E_{ингибитор} )$$
$$E_{связывание } = — E_{{{\text{взаимодействие}}}}$$
В приведенных уравнениях E total обозначает полную энергию всей системы. E поверхность+h3O представляет собой полную энергию поверхности Cu (111) с H 2 Молекулы О. Ингибитор Е представляет собой общую энергию одного только ингибитора.
E поверхность+h3O представляет собой полную энергию поверхности Cu (111) с H 2 Молекулы О. Ингибитор Е представляет собой общую энергию одного только ингибитора.
Change history
29 July 2021
A Correction to this paper has been published: https://doi.org/10.1038/s41598-021-95574-7
References
Philip, A. & Schweitzer, PA Основы коррозии: механизмы, причины и методы предотвращения 1–4 (CRC Press, 2010).
Google ученый
Финшгар М. и Милошев И. Ингибирование коррозии меди 1,2,3-бензотриазолом: обзор. Коррос. науч. 52 , 2737–2749 (2010).
Артикул
Google ученый
Амин, М. А. и Халед, К. Ингибирование коррозии меди в растворах O 2 -насыщенных H 2 SO 4 .
 Коррос. науч. 52 , 1194–1204 (2010).
Коррос. науч. 52 , 1194–1204 (2010).КАС
СтатьяGoogle ученый
Дэвис, Дж. Р. Медь и медные сплавы (Информационное общество по материалам: ASM International, 2001).
Google ученый
Дюран Б., Берекет Г. и Дюран М. Электрохимический синтез и определение характеристик поли(м-фенилендиаминовых) пленок на меди для защиты от коррозии. Прог. Орг. Покрытия. 73 , 162–168 (2012).
КАС
СтатьяGoogle ученый
Шериф Э.-С. М. Коррозионное поведение меди в 0,50 М солянокислых травильных растворах и его ингибирование 3-амино-1,2,4-триазолом и 3-амино-5-меркапто-1,2,4-триазолом. Междунар. Дж. Электрохим. науч. 7 , 1884–1897 (2012).
Аделою С. и Хьюз Х.
 Коррозия медных труб в водопроводной воде с высоким содержанием хлоридов и низким содержанием карбонатов. Коррос. науч. 26 , 851–870 (1986).
Коррозия медных труб в водопроводной воде с высоким содержанием хлоридов и низким содержанием карбонатов. Коррос. науч. 26 , 851–870 (1986).КАС
СтатьяGoogle ученый
Suter, T., Moser, E. & Böhni, H. Характеристика потускнения сплавов Cu–15Ni–8Sn и Cu–5Al–5Sn. Коррос. науч. 34 , 1111–1122 (1993).
КАС
СтатьяGoogle ученый
Хабиб, К. Мониторинг точечной коррозии медных сплавов на месте методом голографической интерферометрии. Коррос. науч. 40 , 1435–1440 (1998).
КАС
СтатьяGoogle ученый
Соуто Р. и др. Кинетика питтинговой коррозии меди в щелочных растворах, содержащих перхлорат натрия. Электрохим Acta 37 , 1437–1443 (1992).
КАС
СтатьяGoogle ученый
«>Абиола О.К., Джон М.О., Асекуново П.О., Окафор П.С. и Джеймс О.О. 3-[(4-амино-2-метил-5-пиримидинил)метил]-5-(2-гидроксиэтил)- Гидрохлорид 4-метилтиазолия хлорида как ингибитор сырой коррозии меди в растворе HNO 3 и его адсорбционные характеристики. Зеленый хим. лат. 4 , 273–279 (2011).
КАС
СтатьяGoogle ученый
Feng, L., Yang, H. & Wang, F. Экспериментальные и теоретические исследования ингибирования коррозии углеродистой стали производным имидазолина в 5% NaCl, насыщенном растворе Ca (OH) 2 . Электрохимический. Acta 58 , 427–436 (2011).

КАС
СтатьяGoogle ученый
Тан Ю. М. и др. Фенилзамещенные аминотиадиазолы в качестве ингибиторов коррозии меди в 0,5 М h3SO4. Матер. хим. физ. 116 , 479–483 (2009).
КАС
СтатьяGoogle ученый
Lachowicz, M.M. Металлографическое исследование муравьиной коррозии в медных трубах теплообменника. англ. Потерпеть неудачу. Анальный. 111 , 104502. https://doi.org/10.1016/j.engfailanal.2020.104502 (2020).
КАС
СтатьяGoogle ученый
Zanotto, F., Grassi, V., Balbo, A., Monticelli, A.C. & Zucchi, F. Коррозионное растрескивание под напряжением дуплексной нержавеющей стали LDX 2101® в растворах хлоридов в присутствии тиосульфата. Коррос. науч. 80 , 205–212 (2014).
КАС
СтатьяGoogle ученый
«>Эль-Махди, Г. А. и Ким, К. Б. Исследование импеданса переменного тока при атмосферной коррозии алюминия в периодических влажно-сухих условиях. Электрохим. Acta 49 , 1937–1948 (2004 г.).
КАС
СтатьяGoogle ученый
Парк, Дж., Ли, Г., Ошиге, Х., Нишиката, А. и Цуру, Т. Мониторинг поглощения воды органическими покрытиями при циклическом влажном-сухом состоянии. Коррос. науч. 45 , 1881–1894 (2003).
КАС
СтатьяGoogle ученый
Ши, Ю., Чжан, З., Су, Дж., Цао, Ф.
 и Чжан, Дж. Исследование электрохимического шума коррозии алюминиевого сплава 2024–T3 в моделируемых кислотных дождях в циклических влажно-сухих условиях. Электрохим. Acta 51 , 4977–4986 (2006).
и Чжан, Дж. Исследование электрохимического шума коррозии алюминиевого сплава 2024–T3 в моделируемых кислотных дождях в циклических влажно-сухих условиях. Электрохим. Acta 51 , 4977–4986 (2006).КАС
СтатьяGoogle ученый
Антониевич М.М., Милич С.М. и Петрович М.Б. Пленки, образующиеся на поверхности меди в хлоридных средах в присутствии азолов. Коррос. науч. 51 , 1228–1237 (2009).
Артикул
Google ученый
Михайлович М.Б.П. и Антониевич М.М. Ингибиторы коррозии меди. Период 2008–2014 гг. Обзор. Междунар. Дж. Электрохим. науч. 10 , 1027–1053 (2015).
Google ученый
Гарверик, Л. Коррозия в нефтехимической промышленности 3-е изд. (Информационное общество материалов, 1994).

Google ученый
Элхоусни, Л. и др. Исследования коррозии и накипи меди, используемой в марокканских промышленных системах водяного охлаждения. Евро-Средиземноморье. Дж. Окружающая среда. интегр. 2 , 12–25 (2017).
Артикул
Google ученый
Piippo, J., Saario, T. & Laitinen, T. Технология производства VTT, материалы и структурная целостность. Отчет SKI https://inis.iaea.org/collection/NCLCollectionStore/_Public/28/027/28027599.pdf (1996 г.).
Pourbaix, M. Альты электрохимических равновесий в водных растворах (Pergamon Press Ltd., 1966).
Google ученый
Фатех А., Алиофхазраи М. и Резванян А. Р. Обзор агрессивных сред для меди и ее ингибиторов коррозии. араб. Дж. Хим.
 13 , 481–544 (2020).
13 , 481–544 (2020).КАС
СтатьяGoogle ученый
Scendo, M. Ингибирование коррозии меди в растворах нитрата натрия нетоксичными ингибиторами. Коррос. науч. 50 , 1584–1592 (2008).
КАС
СтатьяGoogle ученый
Аскари М., Алиофхазраи М., Гаффари С. и Гаджизаде А. Пленкообразующие ингибиторы коррозии для нефте- и газопроводов. Технический обзор. J. Nat. Газ инж. 58 , 92–114 (2018).
КАС
СтатьяGoogle ученый
Хани Х. и Арефини Р. Механизм ингибирования нитритом коррозии углеродистой стали в моделируемых системах водяного охлаждения. Матер. Коррозия. 69 , 337–347 (2018).
КАС
СтатьяGoogle ученый
«>Эль-Авади, А.А., Абд-Эль-Наби, Б.А. и Азиз, С.Г. Анализ кинетико-термодинамических и адсорбционных изотерм ингибирования кислотной коррозии стали циклическими аминами и аминами с открытой цепью. Дж. Электрохим. соц. 139 , 2154–2149 (1992).
Артикул
Google ученый
Li, X., Deng, S. & Fu, H. Молибдат натрия как ингибитор коррозии алюминия в растворе h4PO4. Коррос. науч. 53 , 2748–2753 (2011).
КАС
СтатьяGoogle ученый
Христов М. и Попова А. Адсорбционные характеристики ингибиторов коррозии по результатам измерения скорости коррозии.
 Коррос. науч. 46 , 1613–1620 (2004).
Коррос. науч. 46 , 1613–1620 (2004).КАС
СтатьяGoogle ученый
Мобин, М., Ризви, М., Лукман, О. О. и Эбенсо, Э. Э. Биополимер из трагакантовой камеди в качестве ингибитора сырой коррозии для углеродистой стали в 1 М растворе HCl. САУ Омега 2 , 3997–4008 (2017).
КАС
СтатьяGoogle ученый
Кая, С., Кая, К. и Ислам, Н. Принципы максимальной твердости и минимальной поляризуемости через энергию решетки ионных соединений. Физ. B 485 , 60–66 (2016).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Пан С., Сола М. и Чаттарадж П. К. О справедливости принципа максимальной жесткости и принципа минимальной электрофильности во время химических реакций. J. Phys. хим. А. 117 , 1843–1852 (2013).

КАС
СтатьяGoogle ученый
Ша, Дж. Ю. и др. Поведение додецилбензолсульфоната натрия в отношении ингибирования коррозии для латуни в наножидкости Al 2 O 3 и смоделированной охлаждающей воде. Коррос. науч. 148 , 123–133 (2019).
КАС
СтатьяGoogle ученый
Gerengi, H. и др. Оценка антикоррозионной эффективности вновь синтезированного нитрона в отношении коррозии стали Ст37 в кислой среде: экспериментальный и теоретический подходы. Матер. науч. англ. C. 93 , 539–553 (2018).
КАС
СтатьяGoogle ученый
Gerengi, H. Использование спектроскопии динамического электрохимического импеданса в исследованиях ингибиторов коррозии. Защита. Встретились.
 физ. хим. Поверхности 54 , 536–540 (2018).
физ. хим. Поверхности 54 , 536–540 (2018).КАС
СтатьяGoogle ученый
Ислам, Н. и Кая, С. Концептуальная теория функционала плотности и ее применение в химической области (CRC Press, 2018).
Книга
Google ученый
Цунэда Т., Сонг Дж. В., Судзуки С. и Хирао К. О теореме Купманса в теории функционала плотности. J. Chem. физ. 133 , 174101. https://doi.org/10.1063/1.34 (2010).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Парр, Р. Г., Сентпалы, Л. В. и Лю, С. Индекс электрофильности. Дж. Ам. хим. соц. 121 , 1922–1924 (1999).
КАС
СтатьяGoogle ученый
Газкес, Дж. Л., Седильо, А.
 и Вела, А. Электродонорство и электроакцепторная способность. J. Phys. хим. А. 111 , 1966–1970 (2007).
и Вела, А. Электродонорство и электроакцепторная способность. J. Phys. хим. А. 111 , 1966–1970 (2007).КАС
СтатьяGoogle ученый
Кумар, Д., Джайн, Н., Джайн, В. и Рай, Б. Аминокислоты как ингибиторы коррозии меди: подход теории функционала плотности. Заяв. Прибой. науч. 514 , 145905. https://doi.org/10.1016/j.apsusc.2020.145905 (2020).
КАС
СтатьяGoogle ученый
Го, Л., Тан, Дж., Кая, С., Ленг, С. К. и Ли, Ф. Чжан, Многомерное понимание ингибирования коррозии 3,3-дитиодипропионовой кислотой на стали Q235 в H 2 Среда SO 4 : комбинированное экспериментальное исследование и исследование in silico. J. Коллоидный интерфейс Sci. 570 , 116–124 (2020).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Аттиа А.А., Эльмелеги Э.М., Эль-Батути М. и Ахмед А.-М.М. Ингибирование анодной коррозии в присутствии протонных растворителей. Азиатская J. Chem. 28 , 267–272 (2016).
КАС
Статья
Google ученый
del PB Hernández, R., Aoki, I., Tribollet, B. & De Melo, H. Исследование электрохимической спектроскопии импеданса электрохимического поведения меди, покрытой искусственными слоями патины и подвергнутой влажным и сухим циклам. Электрохим. Acta 56 , 2801–2814 (2011).
Соломон М. М., Геренги Х., Кая Т. и Уморен С. А. Оценка эффективности композита хитозан/наночастицы серебра при коррозии стали Ст37 в 15% растворе HCl. ACS Sustain. хим. англ. 5 , 809–820 (2017).
КАС
Статья
Google ученый
Скачать ссылки
Благодарности
Авторы выражают искреннюю благодарность профессору, доктору Казимежу Даровицкому и доктору Павлу Слепски (Гданьский технологический университет, Польша) за установку DEIS.
Информация об авторе
Авторы и организации
Лаборатория исследования коррозии, кафедра машиностроения, инженерный факультет, Университет Дюздже, Дюздже, Турция0007
Факультет фармацевтики, Профессиональная школа здравоохранения, Университет Сивас Джумхуриет, 58140, Сивас, Турция
Савас Кая
Факультет электричества и энергетики, Высшая профессиональная школа Дюздже, Университет Дюздже, Дюздже, Турция
Cingiz
Коррозия и материаловедение, кафедра электрохимии, химический факультет, Гданьский технологический университет, 11/12, Нарутовича, 80-233, Гданьск, Польша
Michal Mielniczek
Applied Chemistry-Physics Team, Materials and Environment Laboratory, Faculty of Sciences, Ibn Zohr University, B.P.8106, Cité Dakhla, Agadir, Morocco
Brahim El Ibrahimi
Authors
- Marziya Ризви
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Husnu Gerengi
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Savas Kaya
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ильяс Уйгур
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Mesut Yıldız
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Ибрагим Сарыоглу
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Zafer Cingiz
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Michal Mielniczek
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Brahim El Ibrahimi
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Вклады
М. Р. провел электрохимические эксперименты и составил рукопись, Х.Г. разработал и руководил исследовательской работой, С.К. проводил эксперименты и составил раздел вычислительного анализа, И.Ю. рецензировал рукопись, М.Ю. провел поверхностный анализ, И.С. помог в анализе практического применения ингибитора в промышленности, З.К. рецензировал рукопись, М.М. рецензировал рукопись, Б.Е. проведен и составлен расчетный анализ. Все авторы внесли свой вклад в редактирование и улучшение рукописи.
Р. провел электрохимические эксперименты и составил рукопись, Х.Г. разработал и руководил исследовательской работой, С.К. проводил эксперименты и составил раздел вычислительного анализа, И.Ю. рецензировал рукопись, М.Ю. провел поверхностный анализ, И.С. помог в анализе практического применения ингибитора в промышленности, З.К. рецензировал рукопись, М.М. рецензировал рукопись, Б.Е. проведен и составлен расчетный анализ. Все авторы внесли свой вклад в редактирование и улучшение рукописи.
Автор, ответственный за переписку
Переписка с
Марзия Ризви.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Первоначальная онлайн-версия этой статьи была изменена: Первоначальная версия этой статьи содержала ошибку, когда единица «мГц» была неправильно указана как «МГц» в разделе «Методы».
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате при условии, что вы укажете авторство оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
К вопросу о механизмах удаления нитрит-ионов и аммиака из водных растворов: фотолиз против фотокатализа
- Бассам Мохтар
- Амира Ю.
 Ахмед
Ахмед - Тарек А. Кандиэль
Фотохимические и фотобиологические науки (2022)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Защита меди от коррозии гибридным золь-гелем, содержащим 1H-1,2,4-триазол-3-тиол
Тип документа: Исследовательская статья
Авторы
Кафедра химии, Сельский институт Гандиграм-Предполагаемый университет, Гандиграм-624 302, Тамил Наду, ИНДИЯ
10.30492/ijcce. 2016.23557
2016.23557
Abstract
Для улучшения защиты металлической меди от коррозии в гибрид был включен 1H-1,2,4-триазол-3-тиол (ТАТ) в концентрации 0,01 М. золь-гель монослои, содержащие 3-глицидоксипропилтриметоксисилан (ГПТМС) и тетраэтоксисилан (ТЭОС). Затем его подвергали реакции гидролиза и конденсации с образованием золь-гелевой матрицы. Гибридное золь-гель покрытие, легированное ТАТ, было нанесено на поверхность меди методом самособирающегося монослоя (SAM). Полученное покрытие было охарактеризовано с помощью инфракрасного излучения с преобразованием Фурье (FT-IR), рентгеновского излучения Дифракционный (XRD) анализ, сканирующая электронная микроскопия (SEM) и энергодисперсионный рентгеновский анализ (EDX) Спектроскопия. Способность этих покрытий защищать от коррозии оценивалась с помощью исследований электрохимического импеданса (EIS) и измерений потенциодинамической поляризации (PP) в среде 3,5% NaCl. Результаты EIS и PP показали, что гибридное золь-гелевое покрытие, легированное ТАТ, обеспечивает лучшую защиту от коррозии, чем одно нелегированное гибридное покрытие. Таким образом, эти исследования выявили усиление коррозионной защиты гибридного золь-гель покрытия, легированного ТАТ, на поверхности металлической меди.
Таким образом, эти исследования выявили усиление коррозионной защиты гибридного золь-гель покрытия, легированного ТАТ, на поверхности металлической меди.
Ключевые слова
Основные темы
[1] Шериф Э.М., Эразмус Р.М., Коминс Дж.Д., Коррозия меди в аэрированных синтетических растворах морской воды и ее ингибирование 3-амино, 4-1, 2 , Journal of Colloid Interface Science , 309 : 470-477 (2007)
[2] Otmacic H, Telegdi J, Papp K, Stupnisek-Usac E., Защитные свойства слоя ингибитора, сформированного на меди в нейтральном растворе хлорида, J. Appl Electrochem, 34 : 545-550 (2004)
[3] Шериф Э.М., Парк С.М., Электрохимическое поведение меди в буферном растворе буры в присутствии 1-фенил-5-меркаптотетразола, J. Electrochem. Soc ., 152 : B428-B433 (2005)
[4] Куркович Х.О., Ступнисек-Лизак Э., Такеноути Х., Влияние значения рН на эффективность ингибиторов коррозии меди на основе имидазола, Corros. Наука, 52 : 398-405 (2010)
Наука, 52 : 398-405 (2010)
[5] Szocs E, Vastag G, Shaban A, Kalman E., Электрохимическое поведение пленки ингибитора, сформированной на поверхности меди, Corros. наук, 38 : 2019-2029 (1996)
[6] Шериф Э.М., Парк С.М., 2-амино-5-этил-1,3,4-тиадиазол в качестве ингибитора коррозии меди в 3,0% растворах NaCl, Corros. науч. , 48 : 4065-4079 (2006).
[7] Финсгар М., Милошев И., Пихлар Б., Ингибирование коррозии меди, изученное электрохимическими методами и методами EQCN, Acta Chimica Slovenica , 54 : 591-597 (2007).
[8] Амин М.А., Потеря веса, поляризация, спектроскопия электрохимического импеданса, J. Appl Electrochem , 36 : 215-226 (2006).
[9] Исмаил К.М. Электрохимическое получение и кинетическое исследование поли(о-толидина) в водной среде // Электрохим. Acta, 52 : 3883-3888 (2007)
[10] Бисвас Б. Н., Молла М.Ю.А., Сьюзен М.А.Б.Х., Потенциодинамические исследования коррозии меди ионами хлорида и ее ингибирование неорганическими и органическими ионами в водном буферном растворе, Ионика , 18 : 189-195 (2012)
Н., Молла М.Ю.А., Сьюзен М.А.Б.Х., Потенциодинамические исследования коррозии меди ионами хлорида и ее ингибирование неорганическими и органическими ионами в водном буферном растворе, Ионика , 18 : 189-195 (2012)
[11] Liang C, Wang P, Wu B, Huang N., Ингибирование коррозии меди самособирающимися монослоями производного триазола в хлоридсодержащем растворе, J. Solid State Electrochem, 14 : 1391- 1399 (2010).
[12] Sorensen P.A., Kiil S., Dam-Johansen K., Weinell CE., Anticorrosive Coatings: A Review, J. Coat. Технол. Рез. , 6 : 135-146 (2009).
[13] Huynh N., Bottle SE, Notoya T., Schweinsberg DP, Ингибирующее действие октиловых эфиров 4- и
5-карбоксибензотриазола на коррозию меди в сульфатных растворах, Corros. науч. , 42 : 259-274 (2000).
[14] Антониевич М.М., Милич С.М., Сербула С.М., Богданович Г.Д. Влияние ионов хлорида и бензотриазола на коррозионное поведение латуни Cu37Zn в щелочной среде, Электрохим. Акта. , 50 : 3693-3701 (2005).
Акта. , 50 : 3693-3701 (2005).
[15] Ульман. А., «Введение в ультратонкие органические пленки, от Ленгмюра-Блоджетта до самосборки», Academic Press: Boston (1991).
[16] Свален Дж. Д., Аллара Д. Л., Андраде Дж. Д., Чандросс Э. А., Гароф С., Исраэлахвили Дж., Маккарти Т. Дж., Мюррей Р., Пиз Р. Ф., Рабольт Дж. Ф., Винн Ю. Х., Молекулярные монослои и пленки. Отчет группы для отдела материаловедения Министерства энергетики, Langmuir , 3 : 932-950 (1987).
[17] Zhang D.Q., Gao L.X., Cai Q.R., Lee K.Y., Ингибирование коррозии меди путем модификации цистеиновой самособирающейся пленки алкиламиновыми/алкилацидными соединениями, Матер. Corros ., 61 : 16-21 (2010).
[18] Li G.Y., Ma H.Y., Jiao Y.L., Chen S.H., Импедансное исследование защиты меди от коррозии с помощью самоорганизующихся монослоев алкантиолов в водном растворе, J. Serb. хим. соц. , 69 : 791-805 (2004).
[19] Chen W., Hong S., Bing Li H., Luo H.Q., Li M., Li N.B. Защита меди от коррозии в 0,5 М растворе NaCl путем модификации 5-меркапто-3-фенил-1, 3, самособирающийся монослой 4-тиадиазол-2-тиона калия, Corros Sci ., 61 : 53-62 (2012).
[20] Шериф Э.М., Парк С.М., Ингибирование коррозии меди в кислых травильных растворах с помощью N-фенил-1,4-фенилендиамина, Электрохим. Акта. , 51 : 4665-4673 (2006)
[21] Zucchi F., Trabanelli G., Fonsati M., Производные тетразола в качестве ингибиторов коррозии для меди в растворах хлоридов, Corros. наук, 38 : 2019-2029 (1996).
[22] Антониевич М.М., Петрович М.Б. Ингибиторы коррозии меди. Обзор, Междунар. Дж. Электрохим. науч. , 3 : 1-28 (2008).
[23] Ким Х., Ван Т.Х., Эффект усиления защиты от коррозии за счет наночастиц смешанного диоксида кремния разного размера, включенных в золь-гель кремнеземную пленку, J. Sol-Gel Sci Technol. , 63 : 563-568 (2012).
Sol-Gel Sci Technol. , 63 : 563-568 (2012).
[24] Чжэн С.С., Ли Дж.Х., Неорганические-органические золь-гелевые гибридные покрытия для защиты металлов от коррозии, J. Sol-Gel Sci Technol. , 54 : 174-187 (2010).
[25] Zucchi F., Grassi V., Frignani A., Trabanelli G., Ингибирование коррозии меди с помощью силановых покрытий, Corros. науч. , 46 : 2853-2865 (2004).
[26] Лайбинис П.Е., Уайтсайдс Г.М., Аллара Д.Л., Тао Ю.Т., Парих А.Н., Нуццо Р.Г., Сравнение структур и смачивающих свойств самоорганизующихся монослоев н-алкантиолов на поверхностях металлов чеканки, меди, серебра и золота. , Дж. Ам. хим. Soc., 113 :7 152-7167 (1991)
[27] Баладжи Дж., Сетураман М.Г., Защита меди от коррозии с помощью золь-гель покрытия на основе 3-глицидоксипропилтриметоксисилана посредством легирования 3-амино-5-меркапто-1,2,4-триазолом, Res. хим. Intermed, DOI: 10. 1007/s11164-015-2087-1, (2015).
1007/s11164-015-2087-1, (2015).
[28] Картик Н., Аша С., Сетураман М.Г., Влияние рН-чувствительного 4-аминотиофенола на ингибирование коррозии меди гибридных золь-гель монослоев, J. Sol-Gel Sci. Технол. , DOI: 10.1007/s10971-015-3944-5, (2016).
[29] Картик Н., Сетураман М.Г., Повышение коррозионной стойкости эпоксидно-функционализированных гибридных золь-гель монослоев с помощью тиосемикарбазида, Ionics , 21 : 1477-1488 (2015)
[30] Alvarez D., Colazzo A., Hernandez M., Nova X.R., Perez C., Характеристика гибридных золь-гелевых покрытий, легированных гидроталькитоподобными соединениями, для улучшения коррозионной стойкости сплавов AA2024-T3, Prog. Орг. Покрытие, 68 : 91-99 (2010).
[31] Krishnakumar V, Xavier RJ, FT Raman и FT-IR Spectral Studies of 3-Mercapto-1,2,4-Triazole, Spectrochimica Acta Part A , 60 :709–714 (2004).
[32] Lu S., Chen Y., Xu W. , Liu W., Контролируемый рост супергидрофобных пленок золь-гель методом на алюминиевой подложке, Appl. Прибой. науч. , 256 : 6072-6075 (2010).
, Liu W., Контролируемый рост супергидрофобных пленок золь-гель методом на алюминиевой подложке, Appl. Прибой. науч. , 256 : 6072-6075 (2010).
[33] Картик Н., Арункумар В., Сетураман М.Г., Усиление защиты алюминия путем импрегнирования дофамина в гибридные золь-гель монослои, Дж. Матер. науч. , 49 : 7970-7978 (2014).
[34] Ламака С.В., Желудкевич М.Л., Ясаков К.А., Серра Р., Позняк С.К., Феррейра М.Г.С., Нанопористая промежуточная прослойка титана как резервуар ингибиторов коррозии для самовосстанавливающихся покрытий, Prog. Орг. Coat., 58:127-135 (2007).
[35] Ван П., Лян С.Х., Ву Б., Хуанг Н.Б., Ли Дж.Л., Защита от коррозии меди путем модификации самоорганизующихся монослоев додекантиола, приготовленных в водном мицеллярном растворе, Электрохим. Acta, 55 : 878-883 (2010).
[36] Ma H, Chen S, Niu L, Zhao S, Li S, Li D., Ингибирование коррозии меди несколькими основаниями Шиффа в растворах аэрированных галогенидов, J. Appl. Electrochem., 32 : 65-72 (2002).
Appl. Electrochem., 32 : 65-72 (2002).
[37] Qin T.T., Li J., Qun Luo H., Li M., Bing Li N., Ингибирование коррозии меди монослоем 2,5-димеркапто-1,3,4-тиадиазола в кислом растворе, Коррос. Sci., 53 : 1072-1078 (2011).
[38] Zhou Y., Xu S., Guo L., Zhang S., Lu H., Gong Y., Gao F., Оценка двух новых оснований Шиффа, синтезированных на ингибирование коррозии меди в растворах NaCl, RSC Adv. , 5, 14804-14813 (2015).
[39] Appa Rao B.V., Narsihma Reddy M., Самособирающаяся пленка 1-октадецил-1H-бензимидазола на поверхности меди для защиты от коррозии, J. Chem. наук, 125 : 1325-1338 (2013).
[40] Аппа Рао Б.В., Якуб Икбал М.д., Сридхар Б., Электрохимические и поверхностно-аналитические исследования самоорганизующегося монослоя 5-метокси-2-(октадецилтио)бензимидазола при защите от коррозии меди, Электрохим. Acta, 55 : 620-631 (2010).
[41] Кир Г., Баркер Б.Д., Уолш Ф.К., Электрохимическая коррозия нелегированной меди в хлоридной среде – критический обзор, Corros. науч. , 46 : 109-135 (2004).
[42] Otmacic H., Stupnisek-Lisac E., Ингибиторы коррозии меди в средах, близких к нейтральным, Electrochim. Acta, 48 : 985-991 (2003).
[43] Инноченци П., Кидчоб Т., Гибридные органо-неорганические золь-гелевые материалы на основе эпоксидно-аминовых систем, J. Sol-Gel Sci. Technol., 35 : 225-235 (2005).
Ингибиторы коррозии медной проволоки | Товары и поставщики
Товары и услуги
Смотрите также:
Категории
|
Рекомендуемые продукты
|
Дополнительная информация
Поиск поставщиков по категориям Лучшие
Рекомендуемые продукты
верхний
Лапп Таннехилл
Насколько устойчива медь ?не поддается коррозии как некоторые другие металлы и не ржавеет как железо.
 Наряду с этими характеристиками, прочностью и гибкостью, устойчивостью к тепловому расширению и превосходной электропроводностью, медь идеально подходит для использования в качестве электрического провода . Медь Проволока может состоять из
Наряду с этими характеристиками, прочностью и гибкостью, устойчивостью к тепловому расширению и превосходной электропроводностью, медь идеально подходит для использования в качестве электрического провода . Медь Проволока может состоять из
(читать далее)
Просмотреть технические описания кабельных сборок для Lapp TannehillПолигард Продактс, Инк.
Контроль и предотвращение коррозии в трубопроводных системах, фитинги, клапаны, резервуары и сосуды. Его свойства отсутствия пленки и провисания делают его постоянным решением. RG-2400® LT предотвращает возникновение коррозии , а также останавливает распространение существующей коррозии в существующих системах, требует минимального ( провода
(читать далее)
Просмотр технических описаний Polyguard Products, Inc.Зевс
Изолированный ПЭЭК ПроводИзолированный провод из ПЭЭК получается в результате смешения ПЭЭК с медным проводом .
 Провод с изоляцией PEEK имеет высокую непрерывную рабочую температуру, отличную стойкость к истиранию и химическому воздействию, а также диэлектрическую прочность. Приложения Разработаны специально для использования в
Провод с изоляцией PEEK имеет высокую непрерывную рабочую температуру, отличную стойкость к истиранию и химическому воздействию, а также диэлектрическую прочность. Приложения Разработаны специально для использования в
(читать далее)
Просмотреть технические описания магнитных проводов для ZeusDaburn Электроника и кабели
Пластиковый тестовый провод без перегибов Провод. Проволока стабильна при температуре от -80°C до +80°C и превосходит требования MIL-I-3930A, тип JP (ПВХ). Он устойчив к химической коррозии и грибкам. Испытательный провод , номинальное напряжение 5000 В*, провод . Один многожильный проводник из луженой меди со специальной виниловой изоляцией для яркого света.
(читать далее)
Browse Hookup Wires Datasheets для Daburn Electronics & CableОмайт Мануфактуринг Ко.
HCLB Серия Провод Рана Сильноточная нагрузкаработают в суровых условиях, блоки нагрузки Ohmite оснащены опорами из нержавеющей стали , устойчивыми к коррозии , цельными никелевыми клеммами и специальными клеммными опорами из твердой меди с химическим никелированием .
 Элемент сопротивления изготовлен из сплава сопротивления нержавеющей стали. Клеммы приварены или
Элемент сопротивления изготовлен из сплава сопротивления нержавеющей стали. Клеммы приварены или
(читать далее)
Просмотреть технические описания резисторов с проволочной обмоткой для Ohmite Manufacturing Co.Engineered Materials, дочерняя компания аэрокосмического подразделения PPG.
Что такое катодная защита?Эксперименты доказали, что катодная защита сохраняет медь , но имеет нежелательный побочный эффект: процесс коррозии высвобождает ионы меди , обладающие противообрастающим эффектом. Из-за ингибирования коррозии в результате образовался морской рост, что повлияло на управляемость и характеристики кораблей.
(читать далее)
Browse Expanded Sheet Materials Datasheets для Engineered Materials, дочерней компании аэрокосмического подразделения PPGEngineered Materials, дочерняя компания аэрокосмического подразделения PPG.



