4. Коррозия металлов в различных условиях. Скорость коррозии стали на воздухе
КОРРОЗИЯ МЕТАЛЛОВ В РАЗЛИЧНЫХ УСЛОВИЯХ
В зависимости от условий, в которых эксплуатируются изделия, элек- трохимическая коррозия подразделяется на атмосферную, подземную, мор- скую и коррозию в расплавленных солях.
Атмосферная коррозия
Атмосферной коррозией называют разрушение металлов и сплавов во влажном воздухе при обычной температуре. Это самый распространенный вид коррозии. Примерно 80% металлических конструкций эксплуатируется в атмосферных условиях. Атмосферная коррозия металлов носит, в основном, электрохимический характер и протекает в тонких слоях влаги, сконденси- ровавшейся на поверхности металла.
Основными факторами, определяющими скорость коррозии в атмосфе- ре, являются степень увлажненности поверхности корродирующих металлов, наличие загрязнений и температура. Эти факторы изменяются в широких пределах, например, в морской атмосфере очень много солей, особенно хло- рида натрия, в атмосфере промышленных районов много оксидов серы, уг- лерода, азота и др.
По степени увлажненности поверхности металла различают следующие типы атмосферной коррозии: сухая, влажная и мокрая.
Сухая атмосферная коррозия – это коррозия при полном отсутствии пленки влаги на поверхности металла. Механизм сухой коррозии металлов представляет собой чисто химический процесс взаимодействия агрессивных газов с окисленной поверхностью. В сухом воздухе на поверхности металла образуются оксидные пленки, которые снижают дальнейшее окисление ме- талла. Если в воздухе имеются другие газы, например сернистые соединения, защитные свойства пленки могут снизиться и скорость коррозии в связи с этим возрастет.
Влажная атмосферная коррозия протекает при наличии на поверхности металла тончайшей невидимой пленки влаги, которая образуется в результа- те конденсации при относительной влажности воздуха ниже 100%. Конден- сация влаги в такой атмосфере может быть различной:
— Капиллярная. Капилляры, щели, зазоры способствуют конденсации влаги, так как в них имеется небольшая вогнутость мениска жидкости, сле-
довательно, давление насыщенных паров наименьшее. С уменьшением ра- диуса кривизны вогнутого мениска снижается давление насыщенных водя- ных паров над ним. Таким образом, наличие капилляров со смачивающимися стенками приводит к конденсации водяного пара, ненасыщенного по отно- шению к плоскому мениску жидкости.
— Адсорбционная. Конденсация протекает за счет адсорбции влаги на поверхности металла.
— Химическая. Конденсация влаги происходит вследствие химического взаимодействия продуктов коррозии или соли, находящихся на поверхности металла, с водой и сопровождается образованием гидратированных соедине- ний. Наличие пленки раствора соли способствует конденсации влаги, так как давление пара над раствором ниже, чем над чистым растворителем. Гигро- скопичность соли также ускоряет конденсацию влаги.
Механизм коррозии металлов во влажной атмосфере преимущественно электрохимический. На работу коррозионного микрогальванического эле- мента оказывает существенное влияние сопротивление пленки влаги на по- верхности металла.
Мокрая атмосферная коррозия – коррозия металлов при наличии на их поверхности видимой пленки влаги, протекающая при относительной влаж- ности около 100%. Такая атмосферная коррозия наблюдается при капельной конденсации влаги на поверхности металла, а также при непосредственном попадании влаги на металл (дождь, обливание конструкций водой и т. д.). Мокрая атмосферная коррозия близка к электрохимической коррозии при полном погружении металла в электролит.
На скорость атмосферной коррозии оказывает существенное влияние степень увлажненности поверхности, т. е. толщина слоя влаги (рис. 5.1).
Рис. 5.1 Зависимость скорости атмосферной коррозии от логарифма толщины слоя влаги (h) на поверхности металла: I –
сухая; II – влажная; III – мокрая; IV – коррозия при полном погружении в электролит
С увеличением толщины влажной пленки на поверхности металла ско- рость коррозии вначале резко повышается за счет увеличения электро- проводности электролита, а затем незначительно снижается вследствие уменьшения скорости диффузии кислорода к поверхности металла.
Влажность воздуха является одним из главных факторов, способствую- щих образованию на поверхности металла пленки влаги. Влажность воздуха, при которой появляется сплошная пленка влаги на поверхности металла в ре- зультате конденсации воды, называют критической влажностью. Величина критической влажности воздуха значительно изменяется в зависимости от состояния поверхности металла и состава атмосферы. Критическая влаж- ность промышленной атмосферы составляет в среднем 60% (относительная влажность). При относительной влажности атмосферы выше критической скорость атмосферной коррозии резко увеличивается.
На скорость атмосферной коррозии металлов оказывает влияние также состав пленки влаги, температура, контакт с другими металлами.
Примеси в воздухе очень сильно влияют на скорость атмосферной кор- розии. Состав пленки влаги на поверхности металла и степень ее агрессивно- сти зависят от загрязненности воздуха и характера этих загрязнений. Про- мышленные газы (SO2, SO3, СO2, h3S, NН3, Cl2, HCl), попадая в пленку влаги на поверхности металла, увеличивают ее электропроводность, гигроскопич- ность продуктов коррозии, действуют как депассиваторы (например SO2,
НС1). Твердые частицы (например частицы угля), попадающие на поверх- ность металла, способствуют адсорбции различных газов, конденсации вла- ги. Наиболее агрессивными являются сильно загрязненные индустриальные атмосферы, наименее активными – чистые и сухие континентальные ат- мосферы (табл. 5.1).
Таблица 5.1
| Характер атмосферы | Относительная скорость корро- зии, углеродистой стали (по Гадсону), балл |
| Сухая континентальная | 1 – 9 |
| Морская чистая | |
| Морская индустриальная | |
| Индустриальная | |
| Индустриальная, сильно загрязненная |
На скорость атмосферной коррозии металлов оказывают влияние резкие температурные колебания. Повышение коррозионной агрессивности при пе- реходе от отрицательных к положительным температурам объясняется по- вышением скорости электрохимических процессов в связи с переходом пленки влаги на поверхности металла из твердого агрегатного состояния в жидкое. При снижении температуры вечером и ночью относительная влаж- ность воздуха резко увеличивается, что приводит к выпадению росы на по- верхности металлов и увеличению электрохимической коррозии.
На скорость атмосферной коррозии значительно влияет контакт двух металлов, обладающих различными значениями электродных потенциалов. При решении вопроса о допустимости контакта между металлами или спла- вами следует руководствоваться следующими данными. Все металлы и спла- вы разделены на пять основных групп: 1 – магний; 2 – цинк, алюминий, кад- мий; 3 – железо, углеродистая сталь, свинец, олово; 4 – никель, хром, хро- мистая сталь, хромоникелевые стали; 5 – медно-никелевые сплавы, медь, се- ребро. Контакт металлов, входящих в одну группу, считается допустимым, но металлы каждой последующей группы усиливают коррозию металлов предыдущей группы.
Для защиты металлов от атмосферной коррозии широко используются следующие методы.
— Легирование металлов. Для атмосферных условий эксплуатации наи- более эффективным можно считать легирование, приводящее к получению металлических сплавов с более совершенным защитным слоем продуктов
коррозии, или сплавов с пониженной анодной активностью. Например, ле- гирование стали легко пассивирующимися металлами (хром, никель, алюми- ний, титан) или катодными добавками (медь), облегчающими пассивирова- ние стали в условиях атмосферной коррозии, снижает скорость коррозии.
— Снижение относительной влажности воздуха. Уменьшение слоя электролита на поверхности металла путем снижения влажности воздуха консервацией приборов в герметичные чехлы с осушителем (силикагелем) приводит к замедлению работы коррозионных элементов.
— Использование ингибиторов.
— Применение защитных покрытий. Для защиты от атмосферной кор- розии широко применяют защитные неметаллические (лакокрасочные), ме- таллические, оксидные, фосфатные и другие покрытия.
Подземная коррозия
Подземная коррозия металлических конструкций протекает в почвен- ных или грунтовых условиях и имеет обычно электрохимический механизм. Подземной коррозии подвержены, главным образом, металлические трубо- проводы, подземные резервуары, силовые электрические кабели и др. Осо- бенно сильное разрушение наблюдается в условиях совместного воздействия грунта и блуждающих токов.
Различают следующие виды почвенной коррозии:
- Подземная коррозия – коррозия в почве, вызываемая коррозионными элементами, возникающими на металле в местах соприкосновения его с кор- розионной средой вследствие неоднородности металла сооружения, неоди- накового состава почвы, различия температур, влажности и воздухопровод- ности почвы на различных участках сооружения.
- Подземная биокоррозия – это коррозия, вызываемая жизнедеятельно- стью микроорганизмов, воздействующих на металл, обычно процесс завер- шается электрохимической коррозией.
- Электрокоррозия – коррозия металлических подземных сооружений под действием токов утечки с рельсов электрифицированных железных до- рог и других промышленных установок. Она подразделяется на коррозию блуждающими токами и коррозию внешним током.
В почве содержатся влага и различные химические реагенты, поэтому она обладает ионной проводимостью и в большинстве случаев, за исключе- нием очень сухих грунтов, механизм подземной коррозии – электрохимиче- ский. Наиболее характерным катодным процессом в подземных условиях яв-
ляется кислородная деполяризация. В кислых грунтах (болотистый) может проходить коррозия и с водородной деполяризацией.
Рассмотрим пример работы коррозионного элемента в почве (рис. 5.2).
Рис. 5.2 Работа коррозионного микроэлемента
На аноде протекает реакция окисления железа с образованием гидрати- рованных ионов:
Fe + mh3O →® Fe2+×mh3O + 2e.
На катоде протекает реакция ионизации кислорода:
O2 + 2h3O + 4e ®→ 4OH-.
В электролите почвы ионы Fe2+ и OH-взаимодействуют друг с другом, образуя нерастворимый осадок гидроксида железа, который затем может пе- рейти в оксид железа:
Fe2+ + 2OH-® Fe(OH)2, 2Fe(OH)2 ® Fe2O3 + h3O.
Анодные и катодные процессы, в большинстве случаев, протекают на различных участках, т.е. поверхность корродирующего металла состоит из некоторого числа коррозионных микроэлементов и общая скорость коррозии зависит от числа таких элементов и интенсивности их работы. Такой меха- низм коррозии называют гетерогенно-электрохимическим.
Общая скорость коррозии определяется скоростью процесса, проте- кающего медленнее других. Процесс, кинетика которого определяет общую скорость коррозии, называется контролирующим.
В зависимости от условий возможны следующие виды контроля под- земной коррозии металлов: преимущественно катодный контроль – во влаж- ных грунтах; преимущественно анодный контроль – в рыхлых и сухих грун-
тах; смешанный катодно-омический контроль – при грунтовой коррозии ме- таллических конструкций, вследствие работы протяженных макропар (тру- бопроводы).
В большинстве случаев коррозия подземных сооружений протекает с преимущественным катодным контролем, обусловленным торможением дос- тавки кислорода к поверхности металла.
Критериями опасности коррозии подземных металлических сооруже- ний, согласно ГОСТ 9.602 – 89, являются:
- коррозионная агрессивность среды по отношению к металлу конст- рукции;
- опасные действия постоянного и переменного блуждающих токов. Скорость коррозии металла в почве зависит от коррозионной активно-
сти почвы, то есть от некоторых ее свойств: структуры, пористости, влажно-
сти, минерализации грунтовых вод, кислотности, воздухопроводности, удельного электрического сопротивления и температуры среды.
— Влажность почвы. Наличие влаги делает грунт электролитом и вы- зывает электрохимическую коррозию металлов.
Рис. 5.3 Влияние влажности почвы на скорость коррозии стали: 1 – в песке; 2 – в глине
На рис. 5.3 показано влияние влажности почвы на скорость коррозии стали. Для каждой почвы существует определенный интервал влажности, со- ответствующий максимальной скорости коррозии.
— Воздухопроводность грунтов. Пористые грунты могут сохранять влагу в течение длительного времени и создавать благоприятные условия для аэрации (диффузии кислорода). Повышение воздухопроводности грун-
тов ускоряет коррозионный процесс вследствие облегчения протекания ка- тодного процесса.
— Электропроводность грунтов. Наличие в почве водорастворимых солей способствует увеличению ее электропроводности. Наиболее сильно
- 2- - 2+ 2+
влияют на коррозионный процесс ионы Cl-, NO3 , SO4 , НСО3 , Са , Mg
Na2+ и др. Увеличение засоленности грунта, кроме того, облегчает протека-
ние анодного (депассивация анодных участков поверхности) и катодного процессов.
— Кислотность грунта. Она колеблется в широких пределах (рН 3—9). Очень кислые грунты ускоряют коррозию металлов в результате повышения растворимости вторичных продуктов коррозии и возможной дополнительной водородной деполяризации. По величине рН различают кислые (рН 3—5), нейтральные (рН 6—8) и щелочные (рН 9—10) почвы.
— Наличие микроорганизмов. Микроорганизмы, находящиеся в грунтах, могут вызывать значительное местное ускорение коррозии металлов. Наи- большую опасность представляют анаэробные сульфат-редуцирующие бак- терии, которые развиваются в илистых, глинистых и болотистых грунтах. Эти бактерии в процессе жизнедеятельности восстанавливают содержащиеся в грунте сульфаты, потребляя образующийся при катодном процессе водо- род, до сульфид-ионов с выделением кислорода:
MgSО4 + 4H = Mg(OH)2 + h3S + О2.
Выделяющийся кислород принимает участие в катодной деполяризации коррозионного процесса. Сульфид-ион является депассиватором, а также связывает ионы железа, образуя малозащитные пленки сульфида, и тем са- мым облегчает анодный процесс.
— Температура грунта. Температура грунта влияет на кинетику элек- тродных процессов и диффузию, определяющие скорость коррозии. Обычно с увеличением температуры наблюдается экспоненциальное возрастание скорости подземной коррозии металла. Различие температур на отдельных участках протяженных подземных сооружений может привести к возникно- вению термогальванических коррозионных элементов, усиливающих корро- зию.
Удельное электрическое сопротивление почвы является функцией всех рассмотренных свойств почвы и представляет один из наиболее характерных показателей коррозионной активности почв по отношению к стали. В опре- деленных границах существует прямая зависимость: чем меньше удельное электрическое сопротивление, тем больше скорость коррозии. Эта зависи- мость позволяет приближенно оценить коррозионную активность почв.
Согласно ГОСТ 9.602 – 89, коррозионную активность почв по отноше-
нию к стали оценивают:
- по удельному электросопротивлению почвы;
- по средней катодной плотности тока при смещении потенциала катода на 100 мВ отрицательнее потенциала коррозии стали.
В табл. 5.2 приведены удельное электрическое сопротивление грунта и величина средней плотности катодного тока, характеризующие коррозион- ную активность грунтов по отношению к стали.
Таблица 5.2
| Коррозионная ак- тивность | Удельное электросопро- тивление грунта, Ом·м | Средняя плотность катодного то- ка, А/м2 |
| Низкая | Свыше 50 | До 0,05 |
| Средняя | От 20 до 50 | От 0,05 до 0,20 |
| Высокая | До 20 | Свыше 0,20 |
Для борьбы с подземной коррозией сооружений широко используют следующие способы:
— Защитные изолирующие покрытия. Это основной метод защиты. На- пример, на трубопроводы наносят битумное покрытие. Применяют также покрытия на основе липких поливинилхлоридных и полиэтиленовых лент.
— Катодная защита от внешнего источника постоянного тока или про- текторная защита.
— Искусственные среды. Для защиты от коррозии трубопроводов обра- батывают грунт, окружающий металл, различными веществами для снижения или нейтрализации его агрессивных свойств (например об- работка кислого грунта известью). Иногда для создания однородного грунта по всей длине трубопровод засыпают песчаным грунтом. Од- нако этот метод очень трудоемкий и дорогой.
Коррозия металлов блуждающим током
Коррозия металлов блуждающими токами является частным, но имею- щим большое практическое значение, случаем влияния электрического поля в электролите на процесс электрохимической коррозии металлов.
Электрический ток в почве, ответвляющийся от своего основного пути, называют блуждающим. Источником блуждающего тока могут быть элек- трические железные дороги, электролизеры, сварочные аппараты, катодные установки, линии электропередач и др. Рассмотрим влияние блуждающих
токов от электрифицированного рельсового транспорта на коррозию подзем- ных сооружений (рис. 5.4).
Рис. 5.4 Коррозия трубопровода от блуждающих токов электрифицированных железных дорог: 1 – направление движения тока; 2 – направление движения электронов;
3 – направление движения ионов
При протекании тягового тока по рельсам вдоль них происходит паде- ние напряжения и рельсы получают некоторый положительный потенциал относительно земли, а несовершенная изоляция рельсов от земли вызывает утечку тока в окружающий грунт. И чем больше продольное сопротивление и меньше переходное электросопротивление, тем больше суммарный ток утечки в землю. Вблизи подстанций и пунктов присоединения кабелей токо- отводов к рельсам существуют участки постоянной отрицательной полярно- сти рельсов, а на значительном удалении от них – постоянной положитель- ной полярности. Протекающие в земле блуждающие токи, встречая на своем пути металлические сооружения, проникают в них и текут по ним на некото- ром протяжении, создавая анодные и катодные зоны.
Особенность процесса коррозии металла в поле блуждающих токов за- ключается в том, что это электролитический процесс, который протекает по законам электролиза. На катодных участках сооружения будет протекать ре- акция восстановления водорода:
2H+ + 2e →® h3,
на анодных участках – реакция окисления металла:
Me + mh3O→ ® Men+×mh3O + ne.
Наличие катодных и анодных участков на сооружении определяется на- правлением тока. Участок сооружения входа тока или выхода электронов яв- ляется катодом. Участок сооружения выхода тока или входа электронов яв- ляется анодом.
Если электрический ток постоянный, то участки металла, с которых по- ложительные ионы поступают в электролит, являются анодами и подверга- ются электрокоррозии; участки, на которых положительные ионы переходят из электролита в металл, являются катодами, на которых протекает процесс восстановления. Скорость коррозии пропорциональна протекающему току. Переменный блуждающий ток также коррозионноопасен, но в меньшей сте- пени, чем постоянный.
Интенсивность процесса коррозии металла в поле блуждающих токов, как правило, намного больше, чем интенсивность почвенной коррозии. Эти два процесса накладываются друг на друга. При этом совпадение анодных зон коррозионных элементов и блуждающих токов приводит к усилению коррозии.
При достаточно больших потенциалах блуждающих токов последние подавляют ток катодного микроэлемента, возникающего в процессе почвен- ной коррозии, распространяя разрушение на все микроучастки сооружения в анодной зоне блуждающих токов.
Под действием блуждающих токов величина поляризационного потен- циала сооружения смещается в анодных зонах в положительную сторону от- носительно стационарного потенциала, в катодных – в отрицательную. Ве- личина скорости коррозии определяется плотностью тока утечки.
Нанесение защитного покрытия (лакокрасочного, битумного, полиэти- ленового и др.) резко повышает сопротивление. Сопротивление изоляции подземного сооружения – наиболее существенный фактор ограничения блу- ждающих токов, воздействующих на сооружение. По сравнению с плохо изолированным сооружением в хорошо изолированном ток коррозии уменьшается в сотни раз.
Почва является параллельным проводником, например рельсов, и, в за- висимости от величины электросопротивления рельсов и грунта, ток иногда весьма значительной величины (до сотен ампер) проходит по земле. Блуж- дающие токи имеют радиус действия до десятков километров в сторону от токонесущих конструкций.
Морская коррозия
Коррозии в морской воде подвержены металлические части морских су- дов, механизмы и трубопроводы, металлические сооружения морских портов и т. д. Морская вода является хорошо аэрированным, нейтральным электро- литом с высокой электропроводностью, обусловленной наличием в ней со- лей с большим содержанием хлоридов, оказывающих депассивирующее дей- ствие.
Механизм морской коррозии металлов электрохимический, преимуще- ственно с кислородной деполяризацией. На скорость морской коррозии ока- зывают влияние состав морской воды, ее температура и скорость движения, дополнительный механический фактор (аэрирование, кавитация), контакт разнородных металлов, биологический фактор (обрастание подводной части металлических сооружений морскими растительными и животными орга- низмами). Общая концентрация солей в морской воде достигает 4%, что влияет на ее электропроводность. Йод и бром играют роль дополнительных катодных деполяризаторов и ускоряют коррозию. Хлор-ион является силь- ным депассиватором, т. е. ускоряет анодный процесс коррозии металлов. Се- роводород подкисляет морскую воду и связывает ионы металлов в трудно- растворимые сульфиды, облегчая протекание анодного и катодного элек- тродных процессов электрохимической коррозии. При прохождении элек- трического тока через подводную часть судов и морских сооружений возни- кает их электрокоррозия.
Большое влияние на скорость коррозии в морской воде оказывает глу- бина погружения. Скорость коррозии металлов резко уменьшается с глуби- ной погружения, что связано с уменьшением содержания кислорода в воде. На глубине 1000 м наблюдается минимум скорости коррозии, что соответст- вует достижению минимального содержания кислорода в морской воде.
Относительно высока скорость коррозии морских судов по ватерлинии. Особенно интенсивно процесс разрушения металла развивается в зоне, рас- положенной несколько выше этой линии. Этому способствует облегченный доступ кислорода, смывание защитных пленок с поверхности, периодиче- ское ее смачивание электролитом с последующим высыханием, перепадом температур.
Наиболее распространенным методом защиты металлов от коррозии в морской воде является нанесение лакокрасочных покрытий. Используют также цинковые и кадмиевые покрытия как самостоятельные или как под- слой под лакокрасочные. Широкое применение находит электрохимическая
защита морских судов и сооружений, а также применение некоторых корро- зионно-стойких сплавов (например сплав меди с никелем).
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
Скорость коррозии атмосферной - Справочник химика 21
Наиболее трудоемки работы по подготовке к окраске и окраска баллонов. Наружная поверхность стальных баллонов для сжиженных газов подвергается атмосферной коррозии. Скорость коррозии незащищенной углеродистой стали зависит от характеристики атмосферы и может достигать 0,17 мм/год. Защита наружной [c.87] Пленки ржавчины, образующиеся в атмосферных условиях, могут иметь защитные свойства поэтому скорость коррозии со временем снижается (рис. 8.1). Это справедливо, хотя и в меньшей степени, для чистого железа, скорость коррозии которого относительно высока по сравнению с более устойчивыми медьсодержащими или низколегированными сталями. На этих сплавах образуются пленки с плотной структурой и хорошей адгезией, тогда как на чистом железе продукты коррозии рыхлые порошкообразные. Через некоторое время скорость коррозии достигает устойчивого значения и обычно слабо меняется в дальнейшем. Это свойственно и другим металлам, о чем свидетельствуют данные, полученные Американским обществом по испытанию материалов (табл. 8.2). Различия в скорости коррозии за 10 и 20 лет находятся в пределах ошибки эксперимента. [c.171]Характер развития атмосферной коррозии во времени у разных металлов заметно отличается вследствие неодинаковости защитных свойств образующихся продуктов коррозии. Свинец и алюминий образуют хорошую защитную пленку из продуктов коррозии, и зависимость величины коррозии от времени для этих металлов имеет вид затухающей логарифмической кривой (рис. 138). Защитные свойства продуктов коррозии меди, олова и особенно никеля несколько ниже. Скорость коррозии цинка по мере образования слоя продуктов коррозии сначала уменьшается во времени,. а затем остается постоянной. Для железа в [c.180]
Для определения влагопроницаемости полиэтиленовых пленок в атмосферных условиях и скорости коррозии образцы устанавливали на специальные стенды в открытой атмосфере. Периодически (1 раз в две недели) образцы взвешивали. Кроме того, испытывались покрытия на трубчатых образцах с замерами изменения переходного сопротивления во времени. [c.140]
Сравнение скорости атмосферной коррозии со средними скоростями коррозии в морской воде и в почвах [c.174]
В табл. VI.5 приведены сравнительные данные скорости Коррозии цинковых н алюминиевых покрытий в атмосферных условиях, полученные в результате двадцатилетних испытаний Американским обществом испытаний материалов. [c.199]
Образующиеся продукты атмосферной коррозии металлов, как правило, остаются на металле, хорошо с ним сцепленными, и оказывают большее (на свинце и алюминии) или меньшее (на никеле и цинке) защитное действие, уменьшая скорость коррозии со временем (рис. 271). Ускорение коррозии железа в начальный период обусловлено большой гигроскопичностью продуктов коррозии (ржавчины), защитное действие которых начинает сказываться только при значительной толщине. [c.381]
При испытании стали марки СтЗ при постоянной 80%-ной относительной влажности воздуха наблюдался экспоненциальный рост скорости коррозии с увеличением температуры (рис. 273). Вычисленное из опытных данных значение эффективной энергии активации процесса (30 ккал/г-атом) соответствует электрохимической поляризации и подтверждает отсутствие диффузионного контроля в условиях влажной атмосферной коррозии. [c.383]
Коррозия в морской атмосфере отличается от коррозии в морской воде в основном тем, что она связана с малой толщиной слоя электролита на поверхности корродирующего металла. Скорость морской атмосферной коррозии зависит от влажности воздуха, количества осадков, температуры, различных загрязнений и агрегатного состояния воды. При относительной влажности воздуха около 100%, а также при непосредственном попадании влаги на металл коррозия металлов относится к типу мокрой атмосферной коррозии. [c.188]
Время года и количество атмосферных осадков оказывают влияние на скорость коррозии металлов в воздухе. В осенние месяцы, более дождливые, коррозия протекает интенсивнее, чем в летние месяцы. [c.181]
В сточные нефтепромысловые воды кислород попадает при подготовке нефти и воды на стадии обессоливания нефти он вносится пресными водами, при смешении потоков сточной воды с дождевой, технической или канализационной водой, захватывается из воздуха -при подаче воды в открытые резервуары атмосферный воздух может попасть в сточные пластовые воды при нарушении технологического режима эксплуатации центробежных насосов. При этом скорость коррозии стали возрастает в десятки раз. [c.161]
Влага на поверхности металла, возникшая в результате конденсации или попадания осадков, является электролитом для данного элемента. Кучера и др. для определения скоростей атмосферной коррозии предложили установку, представленную на рис. 8.4 [27, 28]. Элемент В расположен на расстоянии около 1 м над поверхностью земли, под углом 45°. В течение длительных периодов времени электронный интегратор регистрирует появление тока в элементе. Сопоставление результатов электрохимических измерений с параллельными гравиметрическими показало пригодность электрохимической методики для оценки быстрых изменений скорости коррозии [28]. [c.179]
Легирование металлов. Легирование стали небольшими количествами меди, фосфора, никеля и хрома особенно эффективно для защиты от атмосферной коррозии. Добавление меди более эффективно в умеренном, чем в тропическом морском климате добавки хрома и никеля в сочетании с медью и фосфором повышают стойкость как в умеренном, так и в тропическом климате (табл. 8.5). Скорость коррозии конструкционных сталей в тропиках (например, в Панаме) в два и более раза выше, чем в умеренном климате (например, Кюр Бич), главным образом вследствие более высоких средних температур и относительной влажности. [c.180]
Из большого числа факторов, определяющих скорость коррозии металлических деталей, находящихся в воздушной среде, наиболее важными являются влажность воздуха и состав воздушной атмосферы. Влага, оседающая на металлических поверхностях, всегда содержит растворенные соли и коррозионно-активные газы. Источники минерализации атмосферной влаги — мельчайшие твердые частицы минеральных веществ в виде солей морского и вулканического происхождения, находящиеся в атмосфере. Минерализация пленок влаги па металлических поверхностях происходит также за счет обогащения их продуктами коррозии. Большое значение для развития коррозии имеет непосредственное выпадение на поверхность металлических конструкций атмосферных осадков в виде дождя и снега, а также увлажнение конструкций вследствие обрызгивания и> морской или речной водой. [c.191]
Кроме массовых (гравиметрических) способов измерения потерь металла при оценке скорости коррозии нередко прибегают к объемным (волюметрическим) способам. Это возможно в тех случаях, когда окисление металла сопровождается расходом или выделением газа. Так, при атмосферной коррозии расходуется кислород, а при кислотной выделяется водород. Объем израсходованного кислорода или выделившегося водорода пропорционален массе окислившегося металла. При этом следует помнить, что на 1 моль израсходованного кислорода окисляются 4 моля металла, а при выделении водорода на один моль водорода окисляются два моля металла. Измерение объема менее точно, чем взвешивание, но при массовом определении скорости коррозии необходимо прерывать испытание, удалять продукты коррозии и лишь после этого определять уменьшение массы образца. Поэтому найденная скорость коррозии представляет собой некоторую усредненную величину аа 1 ерйод испытания. При этом предполагается, что скорость процесса не изм яялась в течение опыта, что не всегда справедливо. За изменением объема газа в некоторой замкнутой системе можно следить, не прерывая испытания, что дает более содержательную информацию о кинетике процесса коррозии. Массовую потерю металла (г) при атмосферной и кислотной коррозии вычисляют по формуле [c.11]
Как уже говорилось, некоторые металлы в определенных условиях переходят в пассивное состояние — на их поверхности образуются слои или пленки, состоящие из адсорбированного кислорода, из оксида данного металла или из его соли. Присутствие таких слоев и их структура сильно влияют на скорость коррозии металла в ряде случаев эти слои обладают защитным действием, вследствие чего металл корродирует лишь ничтожно медленно. В условиях атмосферного воздуха пассивирующие пленки образуются на хроме, никеле, алюминии, цинке. [c.690]
После окончания опыта образцы осторожно снимают с крючков и взвешивают, при этом нужно следить, чтобы не было потерь продуктов коррозии. Зная площадь образца и время испытаний, скорость коррозии вычисляют по привесу. Определение скорости атмосферной, коррозии по убыли в весе представляет некоторые трудности, так как продукты коррозии плохо снимаются. [c.263]
В определенных условиях атмосферная коррозия может протекать с гораздо ббльшей скоростью, чем в случае, когда металл погружен непосредственно в электролит. Так, известно, что атмосферная коррозия свай над уровнем моря превышает среднюю скорость коррозии стали в морской воде приблизительно в 5-6 раз. [c.5]
Кроме характера и состава атмосферы, большое значение для развития атмосферной коррозии имеют климатические условия. Наблюдается заметная разница в коррозионном поведении металлов в разные периоды года. Так, в теплую погоду понижается относительная влажность, затрудняется конденсация влаги и происходит быстрое испарение ее, поэтому скорость коррозии уменьшается. Понижение температуры приводит к ускорению коррозионного процесса, так как облегчается конденсация влаги на поверхности металла и затрудняется ее испарение. Важную роль играет направление ветра. В зависимости от него может изменяться состав атмосферы ветры, дующие преимущественно из промышленных районов или с моря, способствуют обогащению атмосферы коррозионно-активными газами, частичками солей и влаги. [c.9]
В Японии были проведены сопоставления результатов изучения атмосферной коррозии углеродистой стали с результатами замеров количества загрязняющих примесей воздуха и метеорологическими данными. Установлено, что наиболее высокая скорость коррозии наблюдалась в осенне-зимний период, так как в это время северо-западный муссон приносит с моря значительное количество хлоридов. Скорость коррозии в сельской местности в 2 раза больше, чем в прибрежной, и в 3 раза больше, чем в промышленной зоне. Содержание хлоридов, сульфатов и скорость ветра влияют на атмосферную коррозию меньше, чем температура воздуха, солнечная радиация и окислы серы. [c.9]
Изменение свойств коррозионной среды пригодно для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация) или в добавлении к этому раствору веществ, замедляющих коррозию, — ингибиторов. В зависимости от вида коррозии, природы металла и раствора применяются различные ингибиторы. При атмосферной коррозии применяют хорошо адсорбирующиеся на металле вещества мо-ноэтаноламин, карбонат аммония, уротропин, нитрит натрия. Для нейтральной коррозионной среды и растворов солей в качестве ингибиторов используют неорганические соли хромовых кислот, фосфорной, кремниевой, азотной и азотистой кислот. В кислых средах используют органические ингибиторы, содержащие атомы азота, серы, фосфора, кислорода и группировки атомов с ненасыщенными связями. Защитное действие ингибиторов обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы) переводят металл в пассивное состояние. [c.693]
Влияние разнообразных факторов на коррозионное поведение металлов не позволяет однозначно предсказать скорость коррозии различных металлов в атмосферных условиях. Она может колебаться в довольно широких пределах, как это следует из сравнительных данных (табл. 1). [c.13]
В условиях высоких среднегодовых температур воздуха Средней Азии, небольшого количества атмосферных осадков температура и влажность грунтов существенно различаются по глубине, а сами грунты имеют высокую засоленность. Коррозия в этих условиях протекает крайне неравномерно с образованием глубоких каверн. Скорость коррозии составляет 2—2,5 мм/год, а в некоторых случаях достигает 5 мм/год. [c.183]
Механизм сухой атмосферной коррозии металлов аналогичен химическому процессу образования и роста на металлах пленок продуктов коррозии, описанному в ч. I. Процесс сухой атмосферной коррозии металлов сначала протекает быстро, но с большим торможением во времени так, что через некоторое время, порядка нес температурами атмосферного воздуха. Так образуются на металлах в кислороде или сухом воздухе тонкие окисные пленки, и поверхность металлов тускнеет. Если в воздухе содержатся другие газы, например сернистые соединения, защитные свойства пленки образующихся продуктов коррозии могут снизиться, а скорость коррозии в связи с этим несколько возрасти. Однако, как правило, сухая атмосферная коррозия не приводит к существенному коррозионному разрушению металлических конструкций. [c.373]
Введение сорбента улучшает качество бумаги-основы и, прежде всего, уменьшает скорость коррозии в водных экстрактах, что имеет большое значение при длительной эксплуатации бумажного упаковочного материала в условиях капиллярной конденсации или атмосферных осадков. Общий эффект улучшения свойств основы антикоррозионной бумаги зависит от типа взятого сорбента или наполнителя, условий его введения и закрепления в структуре бумаги. [c.113]
Скорость коррозии металла при использовании нитро- и динитробензоатов определяется специфическим влиянием нитрогрупп в бензольном кольце, способных пассивировать поверхность металлоизделия за счет ускорения катодной реакции. Образование пленки на поверхности металла, а следовательно, и эффективность защитного действия указанных ингибиторов возрастает с увеличением числа нитрогрупп и позволяет защитить от атмосферной коррозии цветные металлы. Введение в молекулу ингибитора органических катионов, и, в частности, аминов, обладающих способностью хорошо адсорбироваться на поверхности металла, позволяет значительно усилить ингибирующее действие указанных составов. Отсутствие в бензольном кольце нитрогрупп лишает ингибитор его универсальности и делает его пригодным только для защиты от атмосферной коррозии черных металлов. [c.124]
В условиях атмосферной коррозии латунь устойчива до температуры 500° С. В морской и пресной воде скорость коррозии латуни составляет 0,06—0.25 г-м за сутки. В неорганических кислотах латунь применять не рекомендуется. [c.36]
К числу факторов, влияющих на скорость коррозии в атмосфере, не меньщую роль, чем степень влажности воздуха, играет остаи пленки, скондеиеированиой на металлической поверхности. Состав пленки и степень ее агрессивности зависят от степени загрязненности воздуха и характера этих загрязнений. В зависимости от этих условий, скорость атмосферной коррозии одного и того же металла или сплава может изменяться в десятки и сотни раз. [c.177]
О влиянии характера атмосферы на коррозию металлов можно судить по следующим данным, приведенным С. Г. Веденки-ным. Сроки службы проводов связи в сельской местности и в районах промышленных предприятий (металлургических и химических заводов, электростанций и т.д.) резко отличаются. Так, в первом случае они ие теряют своей эксплуатационной пригодности в течение 50—60 лет, а во втором — срок службы проводов ограничивается 4—5 годами, т. е. скорость коррозии в этих условиях в 10—15 раз выше. При воздействии дымовых газог скорость атмосферной коррозии стали достигает иногда 0,4— 0,8 мм год. [c.177]
Установлено также влияние ЗОо на скорость коррозии некоторых алюминиевых сплавов во влажном воздухе. Как это видно нз кривых, приведенных на рис. 136, алюминиевый сплав Д16 в отсутствие в воздухе примесей ЗОг достаточно устойчив в ус-лопиях атмосферной коррозии. Загр5/зненность индустриальной атмосферы другими агрессивными газами сказывается также [c.179]
На скорость атмосферной коррозии значительно влияет контакт днух. металлов, обладающих различными значениями электродных потенциалов. Изучением механизма контактной коррозии применительно к алюминиевым и медным сплавам занимались в Советском Союзе И. Л. Розенфельд с сотрудниками (ИФХ АН СССР) и за рубежом К. Г. Комптон с сотрудниками. На G Hori этих исследований авторы рекомендуют следующие количественные показатели. Абсолютно допустимыми контактами являются такие, при которых скорость коррозии анода со-стапляет 0—50 гЦм -год), относительно допустимыми — при которых скорость коррозии составляет 50—150 г (м год)-, коп- [c.181]
Олово — металл светло-серого цвета с атомной массой 118,7, валентностью 2 и 4, плотностью 7,3 г/сы удельное электросопротивление олова ОД 15 Ом-ым, температура плавления 232 °С. Для олова характерны высокие пластичность и вязкость, твердость оловянных покрытий колеблется от 120 до 200 МПа. Олово устойчиво в воде, не корродирует во влажном воздухе, даже содержащем сернистые соединения В минеральных кислотах скорость коррозии олова в значительной степени зависит от наличия Б растиорах кислорода, который резко увеличивает ее. Примеси с низким перенагряжекием водорода также усиливают коррозию олова. Стандартный электродный потенциал олова —0.14 В по отношению к его двухвалентным нонам и -1-0.01 В н четырехвалентиым. Относительно железа олово электроположительно, поэтому оно не защищает железо от атмосферной коррозии. Электрохимическую защиту от коррозии оловянные покрытия обеспечивают изделиям из медн. Оловянные покрытия — эффективный барьер для серы н азота [22, 31. 37, 44]. [c.83]
Следует помнить, что во всех атмосферах, за исключением особо агрессивных, средняя скорость коррозии металлов в общем ниже, чем в природных водах или почвах. Это видно из табл. 8.3, где скорость коррозии стали, цинка и меди в трех различных атмосферах сравнивается со средней скоростью коррозии в морской воде и различных почвах. Кроме того, атмосферная коррозия равномерна, пассивирующиеся металлы (например, алюминий или нержавеющие стали) в этих условиях в меньшей степени подвержены питтингу, чем в воде или в почвах. [c.174]
Данные, полученные Грэделом и др. [2] на стенде для испытаний на атмосферную коррозию [21], свидетельствуют, что скорость коррозии при воздействии OS и H S одинакова. Скорость образования сульфидной пленки в присутствии OS и влаги линейно зависит от полной выдержки , которая является произведением времени выдержки образца и средней концентрации OS. [c.177]
При атмосферной коррозии малолегированных сталей около 3 г/дм в год металла превращается в ржавчину. Рассчитать линейную скорость коррозии. [c.206]
Обычно атмосферную коррозию классифицируют по степени увлажненности металлической поверхности и различают три типа сухую, влажную и мокрую. При сухой атмосферной коррозии на поверхноста металла пленки электролита отсутствуют, скорость коррозии при этом мала и не вызьшает существенных разрушений металла. Мокрая и влажная [c.4]
Скорости коррозии углеродистых и низколегированных сталей, а также чугунов в морской воде отличаются незначительно. Скорость коррозии углеродистой и низколегированном стали в морской воде при полном погружении и длительных испыганиях колеблется в пределах 0,08-0,12 мм/год, и максимальный глубинный показатель для стали без окалины составляет 0,3—0.4 мм/год. Уже после годичной выдержки достигается достаточно постоянное во времени значение скорости коррозии. Введение легирующих элеменюв. ю 5 % в сталь мало влияет на скорость коррозии. Исключение лреД 1авляет хром, начиная от 5 % хрома сильно растет местная коррозия стали. Легирование стали одной медью в условиях морской коррозии в отличие от атмосферной коррозии не дает положительных результатов. [c.19]
Способ противокоррозионной защиты стальных конструкций и оборудования зависит от требуемого срока службы и агрессивности атмосфер. Во всех случаях сталь обнаруживает наименьшую коррозионную стойкость, и скорость коррозии стали при средней агрессивности атмосфер составляет 25-35 мкм/год, а при жестких условиях превышает 100 мкм. Большинство стальных конструкций в атмосферных условиях необходимо защитить покрытиями, наносимыми на углеродистую или низколегированную сталь, что дает возможность обеспечить более долговременную защиту. Наиболее широко используют металлические покрытия на основе алюминия и цинка, значительно повышающие срчк службы металлических конструкций в атмосферных условиях. [c.51]
В атмосферных условиях латуни корродируют слабо. Скорость коррозии латуней в атмосфере составляет 0,0001—0,004 мм1год. Сухой пар слабо влияет на латунь. Однако скорость коррозии резко возрастает, если в паровом конденсате присутствуют кислород, двууглекислый газ или аммиак. Влажный насыщенный пар прн больших скоростях (порядка 1000 м1сек) вызывает на поверхности латуни ударную коррозию. [c.150]
На правом образце промежуточное пространство было сухим. Поверхность стали проржавела, как и при атмосферной коррозии. Отслоение было вызвано электроосмотическим переносом молекул HjO и с последующей коррозией. Скорость коррозии не превышала I мкмХ Хгод и в техническом смысле ею можно было пренебречь, [c.172]
chem21.info
Факторы влияющие на скорость коррозии
pH. В кислотной среде (при рН <7) процесс коррозии протекает быстрее, а в щелочной среде (при рН >7) замедляется (см. Рис. 2).При увеличении рН (pH = – log [H+]) содержание ионов H+ уменьшается, что может привести к замедлению коррозии. И наоборот, снижение рН приводит к увеличению концентрации ионов H+ и, соответственно, скорости катодной реакции, в результате чего скорость коррозии может возрасти (в кислотах диссоциация металлов происходит быстрее). В кислотной среде высокопрочные стали подвержены водородному охрупчиванию и катастрофическому разрушению. Это может наблюдаться и при отсутствии сульфидов. Как правило, при уровне рН от 9,5 до 10,5 большинство коррозионных процессов замедляется. В некоторых случаях необходимо увеличить рН до 12. При высоком значении рН (>10,5) нейтрализуются кислые газы и уменьшается растворимость продуктов коррозии.
Алюминиевые изделия.Алюминиевые сплавы подвержены сильнейшей коррозии в щелочной среде, имеющей высокие значения рН. Не допускается использование алюминиевых бурильных труб в средах, имеющих показатели рН, превышающие предельные значения, рекомендованные изготовителем. Если максимально допустимые значения рН неизвестны, необходимо поддерживать рН на уровне, не превышающем 9. Не допускается использование систем буровых растворов с высоким значением рН, например известковых или силикатных растворов, в скважинах, строительство которых осуществляется с применением алюминиевых труб. Почернение алюминиевых труб может быть признаком воздействия силикатов на алюминиевый сплав посредством щелочного вытравливания. Необходимо понизить рН до 8. В сероводородосодержащих средах использование алюминиевых труб не допускается.
Растворенные соли.
Соли, растворенные в воде, влияют на скорость коррозии за счет увеличения электропроводности воды и потенциалов, обуславливающих высокую скорость коррозии. Этим объясняются коррозионные свойства нефтепромысловых соляных растворов и жидкостей для заканчивания скважин. Малоизвестным фактом является то, что жидкости с массовой долей солей 3% более агрессивны, чем высокоминерализованные жидкости (см. Рис. 3).
При увеличении солесодержания количество растворенного кислорода уменьшается (см. Рис. 4).В 3%-ном растворе NaCl или KCl скорость коррозии выше, чем в насыщенном растворе этих солей. Как правило, содержание солей в морской воде и ингибирующих системах на основе KCl близко к вышеуказанному значению, и поэтому необходима защита металла от коррозии.
Растворимость кислорода в буровых растворах с высоким содержанием солей очень незначительна. Тем не менее, в большинстве солесодержащих растворов коррозия не зависит от расчетной растворимости кислорода. Дело в том, что вспенивающиеся или аэрирующиеся растворы (т.е. которые удерживают пузырьки кислорода), например, недиспергирующие соляные растворы могут содержать кислород в количестве, в несколько раз превышающем предел растворимости.
Давление.Давление влияет на коррозию, поскольку с его увеличением возрастает растворимость кислорода и других агрессивных газов (см. Рис. 5). При температуре 100° F (38° C) и давлении 100 фунт/кв.дюйм (6,9 бар) растворимость кислорода в пресной воде составляет приблизительно 230 ppm. Однако при температуре 100° F (38° C) и давлении 500 фунт/ кв. дюйм (34 бар) растворимость кислорода возрастает до 1270 ppm. Можно допустить, что весь кислород, запертый или захваченный в буровом растворе на водной основе, полностью растворится в нем при достижении забойного давления.
Температура.Влияние температуры на коррозию двояко. Как правило, с увеличением температуры скорость коррозии возрастает. Скорость большинства химических реакций возрастает с температурой, а коррозия представляет собой не что иное, как химическую реакцию. При атмосферном давлении растворимость кислорода быстро уменьшается с ростом температуры.Растворимость кислорода в пресной воде при температуре 32 °F (0° C) и атмосферном давлении составляет 14,6 частей на млн. При повышении температуры всего до 85° F (29° C) растворимость кислорода падает на 44% до значения 8 ppm и достигает нуля при температуре кипения воды. Как показано на Рис. 6, при умеренных температурах растворимость кислорода довольно низкая.
В то время как растворимость кислорода в условиях прямого контакта воздуха с раствором на поверхности уменьшается с ростом температуры, количество воздуха, запертого или уловленного циркулируемым в скважине буровым раствором, изменяется незначительно или остается неизменным.На Рис. 7 показана зависимость свойств высококоррозионных 3%- ных соляных растворов KCl и NaCl от роста температуры.
На Рис. 8 видно, что в условиях избыточного давления, рост температуры приводит к увеличению скорости коррозии, при этом в результате увеличения солесодержания с 3% до значения насыщения, скорость коррозии снижается. Кроме того, удаление кислорода при помощи поглотителя приводит к дальнейшему снижению скорости коррозии.
Солеотложения. Отложения солей являются результатом выпадения в осадок и накапливания на поверхности нерастворимых веществ, как правило, соединений кальция, магния и бария (CaCO3, CaSO4, и т.д.). Растворимые ионы, такие как Ca2+ и CO32- могут соединяться и откладываться на стенках труб, спущенных в скважину, в виде соли CaCO3. При образовании солеотложений на стенках бурильных труб, экранированная или изолированная слоем соли поверхность металла подвержена точечной коррозии или коррозии концентрационного типа.Прокатная окалина представляет собой слой окисей железа, образующийся в процессе изготовления труб на трубопрокатном стане. Эта окалина является проводником и отличается хрупкостью. При изгибании новой трубы прокатная окалина растрескивается. В основании этих трещин развивается кислородная коррозия в концентрированном виде и образует язвы. Использование бурильных труб в агрессивных средах без учета коррозии и обеспечения соответствующей защиты от нее не рекомендуется. В процессе операций с трубами и в результате соприкосновения со стенками скважины прокатная окалина быстро разрушается.
Растворенные газы.Кислород, углекислый газ и сероводород, как правило, являются причиной коррозии в буровых растворах. Данные газы относят к числу коррозионно-активных веществ. Если в растворе не присутствует ни один из перечисленных выше газов, коррозия металла в буровых растворах не представляет серьезной проблемы.
Растворенный кислород (О2).
Присутствие кислорода является главной причиной коррозии металлов в растворах на водной основе. Кислород непрерывно поступает в циркуляционную систему через вибросита, смесительную воронку, перемешиватели, негерметичную сальниковую набивку центробежных насосов и гидроциклоны; он всегда присутствует в воде затворения. В наземных условиях в промывочных жидкостях на водной основе обычно содержится большое количество растворенного кислорода.Даже следы кислорода в растворе могут стать причиной образования язв на поверхности металла и ускорить процесс коррозии. Чем ниже температура бурового раствора на поверхности, тем выше содержание растворенного в нем кислорода. Вследствие улавливания воздуха буровым раствором, общее содержание кислорода в циркуляционной системе может превысить ожидаемое значение растворимости, определенное для данной температуры, давления и солесодержания. При избыточном давлении уловленный воздух быстро растворяется (см. Рис. 5). При циркуляции такого раствора в скважине, скорость коррозии может существенно возрасти и привести к образованию коррозионных язв.Реакции, происходящие с участием железа в присутствии кислорода:Анод: Fe0 → Fe2+ + 2e— Fe2+ + 2OH— → Fe(OH)2Катод: 2H+ + 2e— → h3 ½O2 + h3 → h3O
Типичная катодная реакция заключается в том, что ионы водорода захватывают электроны и образуют атомы водорода. Если водород не удаляется из раствора, он «покрывает» или, иначе говоря, поляризует катод, что приводит к замедлению или приостановлению процесса коррозии. При наличии водорода кислород вступает с ним в реакцию, и водород удаляется с катода, то есть деполяризует последний. Кислород является ускорителем катодной реакции, что в свою очередь увеличивает скорость анодной реакции (скорость коррозии). Кислородная коррозия часто приводит к образованию язв, которые и являются характерным признаком данного типа коррозии. Кислород, являясь деполяризатором катода, также усиливает степень коррозии, обусловленной присутствием других растворенных газов, например h3S и CO2.
Содержание растворенного кислорода в различных системах буровых растворов может существенно различаться, при этом некоторые добавки к раствору могут реагировать с кислородом, что приводит к снижению его концентрации. Например, органические кислоты, такие как лигносульфонат, таннин и лигнит, быстро реагируют с кислородом, в результате чего уменьшается содержание растворенного и уловленного кислорода. Данные вещества являются высокоэффективными поглотителями кислорода, хотя это не является их основным назначением.
Из дефлокулированных буровых растворов (с низким значением СНС) захваченный воздух (кислород) высвобождается быстрее, чем из недиспергированных растворов.
Полимерные буровые растворы (с низким содержанием твердой фазы, недиспергированные растворы и на основе полиакриламидов), растворы на основе морской воды и соленасыщенные растворы обладают большей способностью улавливать воздух, что приводит к увеличению содержания растворенного кислорода. Во многие полимерные растворы также добавляют небольшое количество солей (например, KCl) для обеспечения устойчивости стенок скважины. Как было указано выше, при таких низких концентрациях солей возрастает скорость реакций, которые могут привести к значительной коррозии металла. Для замедления коррозии и ослабления воздействия растворенного кислорода и коррозионных солей в данных растворных системах используется ингибитор например марки ConQor 404 от M-I SWACO.
Диоксид углерода (СО2).
Диоксид углерода растворяется в воде, образуя углекислоту (h3CO3), снижая при этом рН. Поэтому данный газ часто называют углекислым. Углекислый газ (подобно прочим кислотам) вызывает коррозию за счет выделения водорода.В отличие от кислорода, диоксид углерода (углекислота) оказывает прямое коррозионное воздействие на железо, образуя карбонат железа на аноде коррозионного элемента. В данном процессе водород является поляризатором катода. Если в растворе присутствует кислород, то он деполяризует катод. Если углекислота вступает в реакцию с железом на аноде, а при этом кислород деполяризует катод, то одновременное коррозионное воздействие двух газов будет значительно сильнее совокупного действия обоих газов, реагирующих отдельно друг от друга.Основным способом борьбы с углекислой коррозией является повышение pH до уровня более 6 и (или) выделение CO32- при помощи вещества, содержащего кальций (например, извести или гипса). Увеличение рН свыше 6 приведет к превращению углекислоты (h3CO3) в бикарбонат (HCO3—) при средних значениях рН и в карбонат (CO32-) при более высоком рН.
Коррозионное воздействие диоксида углерода (углекислого газа), как правило, проявляется в виде язв и канавок, напоминающих древоточины. В Справочнике по коррозии НАИК, Том 22, стр. 244, 1966 г. приводится описание случаев растрескивания металла под воздействием СО2 в среде, не содержащей сероводород. Речь идет о стали марки N-80 с твердостью 33–34 по шкале Роквелла. При необходимости, рекомендуется добавлять в раствор небольшое количество извести для нейтрализации углекислоты, увеличения рН и выделения карбоната кальция (CaCO3). При использовании источника кальция для нейтрализации СО2 вероятность отложения солей возрастает, особенно при высоких значениях рН. При нейтрализации углекислого газа при помощи соединений, содержащих кальций, рекомендуется применять ингибитор, например SI-1000*, в целях уменьшения интенсивности процессов солеотложения.Контроль содержания СО2 и связанных с ним ионов рекомендуется осуществлять при помощи газоанализатора Гаррета. Если в исследуемой среде содержится карбонат кальция, то на индикаторе коррозии (купоне) при воздействии на него кислотой будет выделяться газ.
Сульфид водорода (h3S)
Сульфид водорода является ядовитым газом, токсичность которого приблизительно соответствует токсичности цианистого водорода. Это чрезвычайно опасный газ с характерным запахом тухлых яиц, в результате действия которого быстро утрачивается обоняние.
ПРИМЕЧАНИЕ: В случае обнаружения h3S необходимо немедленно принимать соответствующие меры с соблюдением максимальной предосторожности для обеспечения безопасности персонала и проведения необходимых обработок.
См. «Опасные факторы Н2S и его свойства» на стр. 19.28. Сероводород является химически- и коррозионно-активным кислым газом, в результате воздействия которого оборудованию может быть нанесен серьезный ущерб. Данный газ попадает в циркуляционную систему бурового раствора как минимум из четырех источников:
1. Из разбуриваемых сероводородосодержащих пластов.2. Из воды и жидкостей, используемых для приготовления раствора.3. В результате бактериального восстановления сульфатов до сульфидов в растворах на водной основе.4. В результате термического распада добавок к буровому раствору.
Сероводород растворяется в воде, образуя сероводородную кислоту. Данная кислота характеризуется меньшей коррозионной активностью, чем углекислота, тем не менее, она может оказывать чрезвычайно разрушительное воздействие на металл и вызывать растрескивание сталей, подверженных данному типу коррозии.В упрощенном виде химическая реакция сероводородной коррозии выглядит следующим образом:
Fe0 + h3S → FexSy + 2H0 (атомарный водород) с присутствием h3O
Сульфид железа, образующийся в результате данной реакции в виде черного осадка, прочно прилегает к поверхности стали. Под слоем окалины может наблюдаться точечная коррозия. Поскольку коррозионные язвы, являются очагами начального растрескивания и усталостного разрушения, они могут стать причиной сокращения срока эксплуатации бурильных труб.Ионы водорода, образующиеся в результате описанной выше реакции, могут вызвать хрупкое разрушение металла в результате растрескивания под напряжением или водородного охрупчивания. Сероводород является катализатором (ускорителем) коррозионного воздействия кислорода на сталь. Ионы водорода (протоны), высвобождаемые из молекул h3S или HS– в процессе сероводородной коррозии, настолько малы, что они легко поглощаются сталью. Эти ионы могут захватывать электроны, образуя атомарный водород, или вступать в реакцию с карбидами, содержащимися в стали, с образованием газообразного ацетилена. И тот и другой газ улавливается в пустотах вдоль межзеренных границ. По мере накопления газа давление, создаваемое им, возрастает. Когда это давление и нагрузка на трубу превысят предел ее прочности на растяжение, произойдет разрыв трубы. В случае с высокопрочными сталями, например НКТ марки Р-110, концентрация сероводорода всего в 1 ppm при низких значениях рН может со временем вызвать растрескивание.Сопротивление стали хрупкому разрушению, вызванному присутствием сероводорода, зависит от твердости или предела текучести стали. В нормальных условиях высокопрочные стали обладают большей хрупкостью, чем стали низкой прочности. Стали, имеющие твердость менее 22 по шкале Роквелла или предел текучести не более 90000 фунтов/кв.дюйм (6205 бар), как правило, не подвержены водородному охрупчиванию. Высокопрочные стали, твердость и предел текучести которых превышает указанные значения, не рекомендуется применять в сероводородосодержащих средах.В качестве руководящего документа при выборе стальных изделий для эксплуатации в средах, содержащих сероводород или кислоты, рекомендуется использовать документ MR-01-75 NACE International (последнее издание).Как правило, считается, что бурильные трубы, изготовленные из стали марки Е, могут безопасно применяться в сероводородосодержа щей среде, однако деформационное упрочнение стали делает ее менее устойчивой к растрескиванию в сульфидосодержащей среде. Трубы, испытывающие нагрузки, близкие к пределу упругости (превышение которого приводит к стойкому удлинению трубы от растяжения) нельзя применять в средах, в которых определено наличие сероводорода.Факты свидетельствуют о том, что при температурах свыше 135° F (57° C) вероятность хрупкого разрушения металла уменьшается. Поэтому при более высоких температурах допускается использование обсадных труб, изготовленных из более прочных сортов стали.Данные исследований показывают, что при комнатной температуре и атмосферном давлении растворимость сероводорода составляет 0,1 моль или 0,2N (3400 ppm). В буровых растворах и обрабатывающих жидкостях, эти показатели могут быть несколько выше, так как сероводород вступает в реакцию с каустической содой, содержащейся в буровых растворах, образуя щелочные соли, гидросульфид натрия, сульфид натрия и воду, как показано в следующих уравнениях:h3S + NaOH → NaHS + h3ONaHS + NaOH → Na2S + h3OПри увеличении рН сероводород (h3S) нейтрализуется, превращаясь в гидросульфид (HS—), а затем и в сульфид (S2-). При увеличении рН общая концентрация сульфидов, присутствующих в виде сероводорода, снижается до ничтожной величины, как показано в Табл. 1 и Рис. 9.
Для уменьшения негативного воздействия сероводорода в буровых растворах чрезвычайно важно поддерживать высокие значения рН поскольку реакция нейтрализации является обратимой. Когда сероводород обрабатывается каустической содой, известью или гидроокисью калия для повышения рН, часть растворенного кислого газа преобразуется в растворимые сульфиды. Если не поддерживать рН посредством постоянных обработок раствора, или если наблюдается дополнительный приток кислого газа (h3S или некоторого количества СО2), показатель рН снижается. При снижении рН растворенные сульфиды восстанавливаются до h3S.
Химические реакции с участием сероводорода довольно сложны. В результате реагирования сульфидов образуются соединения, которые не подчиняются стехиометрическим отношениям и условиям простых химических реакций, описанным выше. Наиболее важным моментом является образование щелочного сульфида, чаще всего сульфида натрия, при попадании h3S в щелочной буровой раствор. Не смотря на то, что в определенных условиях поддержание высокого рН является эффективным способом нейтрализации негативного воздействия h3S, это не обеспечивает его удаления из жидкости, и поэтому любое снижение рН может иметь опасные последствия.
Наиболее целесообразным методом нейтрализации сероводорода или растворимых сульфидов является обработка раствора веществами, содержащими цинк, например, оксидом цинка. Данное вещество осаждает сульфиды в виде нерастворимого сульфида цинка (ZnS). В нормальных условиях при щелочном показателе рН, данный нерастворимый осадок не восстанавливается до сероводородной кислоты или сероводорода. Контроль за содержанием сульфидов осуществляется при помощи газоанализатора Гаррета и трубок Драгера в соответствии со стандартами RP-13B-1 и В-2 Американского нефтяного института (последнее издание).
ВНИМАНИЕ! Сероводород представляет серьезную опасность для персонала. См. «Опасные факторы Н2S и его свойства» на стр. 19.28. Данный газ опасен еще и тем, что он способен вызывать катастрофическое разрушение высокопрочных сталей, из которых изготавливаются обсадные и бурильные трубы.
При относительно низких давлениях сероводород переходит в жидкое состояние и растворяется в промывочных жидкостях на водной, нефтяной и синтетической основах. Во время притока пластового флюида в скважину, сероводород остается в жидком состоянии до тех пор, пока не приблизится к устью, после чего он переходит в газообразное состояние, что сопровождается быстрым и значительным увеличением объема газа. Это может привести к утрате контроля над скважиной, представляет опасность для жизни и здоровья персонала буровой установки, а также является причиной коррозии оборудования. Ликвидация проявлений представляет особую сложность в случаях, когда сероводород составляет значительную часть объема поступающего пластового флюида. Если есть подозрениена поступление в скважину h3S, скважина глушится «в лоб» с задавкой флюида обратно в пласт, во избежание опасности выхода сероводорода на устье при циркуляции раствора.
Весь персонал, принимающий участие в работах в зонах, подверженных воздействию сероводорода, обязан ознакомиться со средствами защиты, техникой безопасности, своими обязанностями, а также нормами и правилами, относящимися к выполнению этих обязанностей. Для обеспечения безопасных условий работы необходимо соблюдать меры предосторожности и использовать соответствующее оборудование.
Читайте далее Борьба с коррозией
fluidspro.ru
Атмосферная коррозия
Содержание:
Виды атмосферной коррозии
Факторы атмосферной коррозии
Особенности протекания атмосферной коррозии металлов
Уравнение атмосферной коррозии
Защита металлов и сплавов (стали) от атмосферной коррозии
Атмосферная коррозия – коррозионное разрушение конструкций, оборудования, сооружений, эксплуатируемых в приземной части атмосферы. Атмосферная коррозия носит менее разрушительный характер, чем почвенная и морская.
Скорость атмосферной коррозии зависит от некоторых факторов: природы металла, окружающей его атмосферы, влажности воздуха.
Виды атмосферной коррозии
Атмосферную коррозию по степени увлажненности поверхности принято разделять на сухую, влажную и мокрую. Влажная и мокрая протекают по электрохимическому механизму, а сухая – химическому.
Сухая атмосферная коррозия наблюдается при отсутствии на поверхности металла пленки влаги. Если относительная влажность воздуха составляет 60% и меньше – протекает сухая атмосферная коррозия. Механизм коррозионного разрушения – химический. На поверхности образуются защитные оксидные пленки, которые тормозят процесс коррозии.
Сначала процесс протекает быстро (образование тонкой окисной пленки), потом – сильно замедляется и устанавливается постоянная, очень маленькая скорость коррозии. Такое явление обусловлено невысокой температурой окружающей среды. На металле почти сразу (может пару часов) образуется тонкая окисная пленка, которая приводит к потускнению поверхности. Толщина окисной пленки на поверхности нержавеющей стали может составлять 10 – 20 Å, железе – 30 – 40 Å. Предельная толщина слоя влаги при протекании сухой атмосферной коррозии может составлять 100 Å. Если в атмосфере присутствуют примеси агрессивных газов (например, сернистые газы) – скорость коррозии значительно возрастает.
Влажная атмосферная коррозия наблюдается при наличии на поверхности тончайшей пленки влаги. Толщина такой пленки составляет от 100 Å до 1 мкм. Относительная влажность воздуха, при которой начинается образование влажной пленки, составляет около 60 – 70%. Значение, при котором начинается конденсация на поверхности влаги, называется критической влажностью. Критическая влажность зависит от загрязнения воздуха и состояния металла. Конденсация влаги при этом происходит по капиллярному, химическому либо адсорбционному механизму.
Капиллярная конденсация влаги. Наблюдается в щелях, зазорах, трещинах на поверхности металла, порах в пленке продуктов коррозии, под загрязнениями и т.п.
Адсорбционная конденсация влаги. Возникает в результате проявления на поверхности металла адсорбционных сил.
Химическая конденсация влаги проявляется во взаимодействии продуктов коррозии с атмосферной влагой. При этом образуется ржавчина, которая и удерживает эту влагу.
Мокрая атмосферная коррозия протекает при относительной влажности воздуха около 100%, когда на поверхности влага собирается в виде хорошо видных капель, либо при прямом воздействии на конструкцию дождя, тумана. Мокрая атмосферная коррозия также наблюдается на конструкциях, которые обливаются водой либо полностью погружаются. При мокрой коррозии пленка влаги в толщину составляет более 1 мм.
Факторы атмосферной коррозии
Влажность воздуха при атмосферной коррозии
Наличие на поверхности металлоконструкции влаги усиливает атмосферную коррозию. Влага чаще всего поступает в качестве атмосферных осадков (дождь, туман). С повышение температуры значение относительной влажности уменьшается.
Существует критическое значение атмосферной влажности. Для каждого сплава или металла это свое определенное число. Для никеля, цинка, стали, меди значение критической влажности составляет около 50 – 70%. Если относительная влажность воздуха укладывается в рамки вышеназванных – то коррозионное разрушение перечисленных металлов незначительно. Если же выше – начинается усиленное разрушение. При сильно загрязненной атмосфере (например, технологическая среда) понятие критической влажности не всегда применяется и играет важную роль, т.к. коррозионный процесс значительно усиливается за счет вредных примесей в атмосфере.
Примеси в атмосфере (газы)
Загрязнение атмосферы газами резко увеличивает скорость коррозии.
Очень агрессивной средой является технологическая, вблизи больших промышленных предприятий, которые ежеминутно выбрасывают в воздух вредные примеси. Присутствие SO2, SO3, HCl, h3S, Cl2, Nh4 и других соединений значительно увеличивает скорость атмосферной коррозии.
Интересное и самое сильное влияние оказывает SO2 (диоксид серы). Малая его концентрация (15 – 35 мкг/м3) очень сильно увеличивает скорость коррозии (десятки и сотни раз). В больших же концентрациях скорость атмосферной коррозии увеличивается не так сильно (всего в 5 – 7 раз). Этот компонент образуется при сгорании угля, газолина, нефти.
Газы, попадая на пленку влаги на поверхности металлоконструкции, увеличивают электропроводность этой пленки. SO2 и Cl2 воздействуют как катодные деполяризаторы, SO3 и HCl увеличивают поглощательную способность продуктов коррозии, Nh4 действует как комплексообразователь, SO2 и HCl – депассиваторы.
Очень сильно увеличивает скорость коррозии содержание в атмосфере серной кислоты. Особенно это относится к неустойчивым в ней металлам – железо, никель, цинк, кадмий. Медь в таких случаях белее устойчива, т.к. на ее поверхности образуется защитная пленка из ее основного сульфата зеленого цвета (патина).
Твердые частицы в атмосфере
Из атмосферы на поверхность попадают твердые активные либо пассивные частицы. Они могут действовать как депассиваторы, комплексообразователи, увеличивать электропроводность пленки влаги и поглощательную способность (гигроскопичность) продуктов коррозии, облегчать капиллярную конденсацию влаги (такой инертный материал как песок). В атмосфере встречаются такие твердые частицы, как Na2SO4, NaCl, (Nh5)2SO4, частицы угля, различные соединения углерода, оксиды металлов и другие. Эти вещества в виде твердых частиц или пыли контактируют с влажной поверхностью металлоконструкции, образуют гальванические элементы, интенсифицируя процесс коррозии. Поэтому незапыленный воздух гораздо менее активен, чем загрязненная различными частицами атмосфера.
Катодные включения в атмосфере
Включения меди, палладия, платины, а также некоторых других металлов несколько повышают сопротивляемость железоуглеродистых сплавов коррозионному разрушению. Медь, которая может входить в состав таких сплавов замедляет коррозию, т.к. способствует пассивированию поверхности железа. При атмосферной коррозии палладий воздействует аналогично даже при очень маленьких его добавках в сплав.
Географический фактор
В различных географических местностях влажность, загрязнение атмосферы, температура различаются. Наибольшее влияние на атмосферную коррозию оказывает влажность воздуха. Установлено, что в регионах с постоянно повышенной влажностью коррозионные процессы протекают интенсивнее. Основное влияние оказывает не количество дождливых дней, а время нахождения на поверхности металла пленки влаги.
В пустынях, где влажность воздуха очень маленькая, на поверхности стальных изделий оксидная пленка появляется через достаточно большой промежуток времени, изделия долго остаются блестящими.
Температура окружающей среды
С повышением температуры окружающей среды процесс атмосферной коррозии замедляется. Влага, покрывающая поверхность металлоизделия, испаряется, уменьшается абсолютная влажность воздуха. С понижением температуры все происходит наоборот. Повышается относительная влажность среды, что способствует конденсации влаги. Скорость атмосферной коррозии увеличивается.
Особенности протекания атмосферной коррозии металлов
Поверхность металла покрыта тонкой пленкой электролита. В качестве электролита может выступать как сама влага, так и продукты коррозии, впитавшие влагу.
Особенностью атмосферной коррозии является возможность свободного подхода кислорода к корродирующей поверхности. Это обусловлено малой толщиной пленки и за счет конвекции перемешивания электролита. Именно поэтому даже в подкисленных электролитах атмосферная коррозия протекает с кислородной деполяризацией.
Также из-за тонкого слоя влаги на поверхности корродирующего металла анодный процесс идет с затруднением, а протекание катодного, наоборот, облегчается.
При работе гальванопар небольшая толщина пленки влаги тоже играет свою роль - увеличивается омическое сопротивление электролита.
Атмосферная коррозия сплавов, в основу которых входит железо (например, сталь), протекает с анодно-такодно-омическим контролем. Но в зависимости от некоторых условий (толщина, электропроводность пленки влаги, ее состав, природа металла) анодно-такодно-омический контроль может переходить в преимущественно анодный, преимущественно катодный или омический.
Уравнение атмосферной коррозии:
Анод: ионы металла переходят в раствор:
Мe→ Мen+ + ne
Катод: проходит реакция восстановления:
O2 + 2h3O + 4e → 4OH- (щелочные, нейтральные среды)
O2 + 4H+ + 4e → 2h3O (подкисленная среда)
Во многом стойкость металлов и сплавов, в условиях атмосферной коррозии, зависит от природы металла и состояния его поверхности.
Защита металлов и сплавов (стали) от атмосферной коррозии
Для защиты от атмосферной коррозии применяют множество различных методов.
Нанесение металлических или неметаллических покрытий. Неметаллическими защитными покрытиями могут выступать различные смазки, пасты, лакокрасочные материалы. Часто в их состав дополнительно вводят ингибиторы, пигменты, пассивирующие поверхность (например, цинк-хроматный пигмент для стали). Иногда поверхность превращают в труднорастворимый оксид или фосфат, обладающий защитными свойствами. Металлическими покрытиями служат цинковые, никелевые, многослойные.
Снижение относительной влажности воздуха. Очень эффективный способ защиты металла от коррозии. Удаление влаги осуществляют подогревом помещения (отопление) либо осушкой воздуха. Очень часто достаточно поддерживать влажность атмосферы до 50 %. Если воздух содержит пиль, другие примеси, то 50% влажность очень велика.
При осушке воздуха или повышении температуры затрудняется конденсация влаги на металле, что приводит к значительному уменьшению скорости коррозии.
Применение контактных и летучих (парофазных) ингибиторов. Контактные замедлители коррозии наносятся на поверхность изделия в виде водных растворов. Примером контактного ингибитора атмосферной коррозии может служить NaNO2.
Летучие ингибиторы обладают высокой упругостью паров, применяются при длительном хранении стальных либо других металлических изделий, транспортировке. Летучими ингибиторами коррозии заполняют герметичное пространство (защита внутренней части трубы, на концах которой стоят специальные заглушки) либо ими пропитывают оберточные материалы (бумага). Летучими ингибиторами могут пропитываться специальные гранулы, которыми заполняют объем упаковки защищаемого изделия. Примеры летучих ингибиторов: карбонаты, нитриты, бензоаты моноэтаноламина и дициклогексиламина.
Легирование металлов. Добавление в сталь небольшого количества никеля, хрома, алюминия, титана (переводят поверхность стали в пассивное состояние), меди (катодная добавка), фосфора тормозят анодную реакцию.
www.okorrozii.com
4. Коррозия металлов в различных условиях
В зависимости от условий, в которых эксплуатируются изделия, электрохимическая коррозия подразделяется на атмосферную, подземную, морскую, коррозию в расплавленных солях и биохимическую.
4.1. Атмосферная коррозия
Атмосферной коррозией называют разрушение металлов и сплавов во влажном воздухе при обычной температуре. Это самый распространенный вид коррозии. Примерно 80% металлических конструкций эксплуатируется в атмосферных условиях. Атмосферная коррозия металлов носит, в основном, электрохимический характер и протекает в тонких слоях влаги, сконденсировавшейся на поверхности металла.
Основными факторами, определяющими скорость коррозии в атмосфере, являются степень увлажненности поверхности корродирующих металлов, наличие загрязнений и температура. Эти факторы изменяются в широких пределах, например, в морской атмосфере очень много солей, особенно хлорида натрия, в атмосфере промышленных районов много оксидов серы, углерода, азота и др.
По степени увлажненности поверхности металла различают следующие типы атмосферной коррозии: сухая, влажная и мокрая.
Сухая атмосферная коррозия - это коррозия при полном отсутствии пленки влаги на поверхности металла. Механизм сухой коррозии металлов представляет собой чисто химический процесс взаимодействия агрессивных газов с окисленной поверхностью. В сухом воздухе на поверхности металла образуются оксидные пленки, которые снижают дальнейшее окисление металла. Если в воздухе имеются другие газы, например сернистые соединения, защитные свойства пленки могут снизиться и скорость коррозии в связи с этим возрастет.
Влажная атмосферная коррозия протекает при наличии на поверхности металла тончайшей невидимой пленки влаги, которая образуется в результате конденсации при относительной влажности воздуха ниже 100 %. Конденсация влаги в такой атмосфере может быть различной:
— Капиллярная. Капилляры, щели, зазоры способствуют конденсации влаги, так как в них имеется небольшая вогнутость мениска жидкости, следовательно, давление насыщенных паров наименьшее. С уменьшением радиуса кривизны вогнутого мениска снижается давление насыщенных водяных паров над ним. Таким образом, наличие капилляров со смачивающимися стенками приводит к конденсации водяного пара, ненасыщенного по отношению к плоскому мениску жидкости.
— Адсорбционная. Конденсация протекает за счет адсорбции влаги на поверхности металла.
— Химическая. Конденсация влаги происходит вследствие химического взаимодействия продуктов коррозии или соли, находящихся на поверхности металла, с водой и сопровождается образованием гидратированных соединений. Наличие пленки раствора соли способствует конденсации влаги, так как давление пара над раствором ниже, чем над чистым растворителем. Гигроскопичность соли также ускоряет конденсацию влаги.
Механизм коррозии металлов во влажной атмосфере преимущественно электрохимический. На работу коррозионного микрогальванического элемента оказывает существенное влияние сопротивление пленки влаги на поверхности металла.
Мокрая атмосферная коррозия - коррозия металлов при наличии на их поверхности видимой пленки влаги, протекающая при относительной влажности около 100 %. Такая атмосферная коррозия наблюдается при капельной конденсации влаги на поверхности металла, а также при непосредственном попадании влаги на металл (дождь, обливание конструкций водой и т.д.). Мокрая атмосферная коррозия близка к электрохимической коррозии при полном погружении металла в электролит.
На скорость атмосферной коррозии оказывает существенное влияние степень увлажненности поверхности, т.е. толщина слоя влаги. С увеличением толщины влажной пленки на поверхности металла скорость коррозии вначале резко повышается за счет увеличения электропроводности электролита, а затем незначительно снижается вследствие уменьшения скорости диффузии кислорода к поверхности металла.
Влажность воздуха является одним из главных факторов, способствующих образованию на поверхности металла пленки влаги. Влажность воздуха, при которой появляется сплошная пленка влаги на поверхности металла в результате конденсации воды, называют критической влажностью. Величина критической влажности воздуха значительно изменяется в зависимости от состояния поверхности металла и состава атмосферы. Критическая влажность промышленной атмосферы составляет в среднем 60 % (относительная влажность). При относительной влажности атмосферы выше критической скорость атмосферной коррозии резко увеличивается.
На скорость атмосферной коррозии металлов оказывает влияние также состав пленки влаги, температура, контакт с другими металлами.
Примеси в воздухе очень сильно влияют на скорость атмосферной коррозии. Состав пленки влаги на поверхности металла и степень ее агрессивности зависят от загрязненности воздуха и характера этих загрязнений. Промышленные газы (, , , , , , ), попадая в пленку влаги на поверхности металла, увеличивают ее электропроводность, гигроскопичность продуктов коррозии, действуют как депассиваторы (например, , ). Твердые частицы (например, частицы угля), попадающие на поверхность металла, способствуют адсорбции различных газов, конденсации влаги. Наиболее агрессивными являются сильно загрязненные индустриальные атмосферы, наименее активными - чистые и сухие континентальные атмосферы (табл. 4.1).
Таблица 4.1
| Характер атмосферы | Относительная скорость коррозии углеродистой стали (по Гадсону), балл |
| Сухая континентальная | 1-9 |
| Морская чистая | 38 |
| Морская индустриальная | 50 |
| Индустриальная | 65 |
| Индустриальная, сильно загрязненная | 100 |
На скорость атмосферной коррозии металлов оказывают влияние резкие температурные колебания. Повышение коррозионной агрессивности при переходе от отрицательных к положительным температурам объясняется повышением скорости электрохимических процессов в связи с переходом пленки влаги на поверхности металла из твердого агрегатного состояния в жидкое. При снижении температуры вечером и ночью относительная влажность воздуха резко увеличивается, что приводит к выпадению росы на поверхности металлов и увеличению электрохимической коррозии.
На скорость атмосферной коррозии значительно влияет контакт двух металлов, обладающих различными значениями электродных потенциалов. При решении вопроса о допустимости контакта между металлами или сплавами следует руководствоваться следующими данными. Все металлы и сплавы разделены на пять основных групп: 1 - магний; 2 - цинк, алюминий, кадмий; 3 - железо, углеродистая сталь, свинец, олово; 4 - никель, хром, хромистая сталь, хромоникелевые стали; 5 - медно-никелевые сплавы, медь, серебро. Контакт металлов, входящих в одну группу, считается допустимым, но металлы каждой последующей группы усиливают коррозию металлов предыдущей группы.
Для защиты металлов от атмосферной коррозии широко используются следующие методы:
— Легирование металлов. Для атмосферных условий эксплуатации наиболее эффективным можно считать легирование, приводящее к получению металлических сплавов с более совершенным защитным слоем продуктов коррозии, или сплавов с пониженной анодной активностью. Например, легирование стали легко пассивирующимися металлами (хром, никель, алюминий, титан) или катодными добавками (медь), облегчающими пассивирование стали в условиях атмосферной коррозии, снижает скорость коррозии.
— Снижение относительной влажности воздуха. Уменьшение слоя электролита на поверхности металла путем снижения влажности воздуха консервацией приборов в герметичные чехлы с осушителем (силикагелем) приводит к замедлению работы коррозионных элементов.
— Использование ингибиторов.
— Применение защитных покрытий. Для защиты от атмосферной коррозии широко применяют защитные неметаллические (лакокрасочные), металлические, оксидные, фосфатные и другие покрытия.
studfiles.net
Скорость - коррозия - низколегированная сталь
Скорость - коррозия - низколегированная сталь
Cтраница 1
Скорость коррозии низколегированных сталей, как и углеродистых, очень сильно зависит от количества морской соли, попадающей на доступную поверхность металла и задерживающейся на ней. [2]
Скорость коррозии низколегированных сталей в воде Баренцова моря практически постоянна и равна 0 06 мм / год. Большое влияние на коррозию сталей оказывает окалина, имеющаяся на их поверхности. [4]
При испытаниях в нейтральной среде скорость коррозии низколегированных сталей в начальный период времени уменьшается во времени, однако через 80 - 100 суток она становится неизменной. III, 12 ] считают, что к этому моменту пленка достигает предельной толщины, становится пористой, и скорость диффузии ионов железа через нее поддерживается на постоянном уровне. Поскольку, по данным тех же авторов, наличие на поверхности металла окисной пленки, образовавшейся в процессе отжига при температуре 800 С, не изменило скорости коррозии железа, измеренной по количеству выделившегося водорода, очевидно, диффузия через окисную пленку не является стадией, полностью определяющей эффективность коррозионного процесса в этом случае. Скорость катодного процесса на образцах с окисной пленкой, полученной при оксидировании и образовавшейся при окислении на воздухе, и на образцах без искусственной пленки, почти что одинакова, а это также свидетельствует о том, что диффузия через окисную пленку не влияет на скорость коррозии. При температуре ниже 200 С эффективность коррозионного процесса железа определяется скоростью реакции, протекающей на поверхности раздела металл - вода. Однако, по мнению этих авторов, скорость диффузии ионов железа через окисную пленку и в этом случае оказывает некоторое ( но не определяющее) влияние на скорость коррозионного процесса. [5]
На рис. 10.2 представлена зависимость скорости коррозии низколегированной стали от концентрации кислорода в высокотемпературной воде. Как видно, увеличение концентрации растворенного в воде кислорода приводит к первоначальному росту скорости коррозии, последующему ее снижению и дальнейшей стационарности. [7]
В условиях полного погружения в морскую воду скорости коррозии низколегированных сталей, рассчитанные по потерям массы, составляют от 60 до 130 мкм / год. Следовательно, низколегированные стали, как материал для погружаемых конструкций, не обладают заметным преимуществом в отношении коррозии перед углеродистой сталью. [9]
Поверхностная окалина и термообработка не оказывают влияния на скорость коррозии низколегированных сталей в песчаном и глинистом грунтах. [10]
В табл. 13 приведены результаты, полученные при 4 5-летней экспозиции различных сталей в Кюр-Биче ( Сев. Полученные значения скоростей коррозии низколегированных сталей в условиях погружения лежат в тех же пределах, что и значения, полученные в ходе испытаний около Зоны Панамского канала. [11]
В ряде случаев при введении морфалина наблюдалась точечная коррозия образцов, так как он недостаточно стоек при наличии облучения. Ингибиторы целесообразно вводить в систему в начальный период работы установки, когда скорость коррозии низколегированных сталей довольно высокая. [12]
Ш-6) Особенно резко возрастает она при увеличении температуры свыше 400 С. Как указывалось выше ( см. табл. 1 - 5 и 1 - 6), при постоянной температуре давление воды и пара на скорость коррозии низколегированных сталей не влияет. Снижается она более чем в два раза за первые 250 - 500 час испытаний у сталей, легированных 5t % хрома. [14]
Страницы: 1 2
www.ngpedia.ru
Результаты коррозии металла. Методы определения скорости коррозии. |
По какому бы типу ни протекала коррозия, в результате ее металл разрушается. Прежде всего страдает внешний вид изделия: гладкая отполированная поверхность становится тусклой, затем шероховатой и, наконец, покрывается различными химическими соединениями — продуктами коррозии. Она проникает и в глубь металлических изделий, окончательно разрушая их.
Метод определения потери веса металла. Потери от коррозии.
Для определения величин коррозийной устойчивости разных металлов, используют несколько шкал оценок. Самый распространенный метод оценки по потере веса металла. Метод заключается в взвешивании детали до того, как она подвергается коррозии, а затем после удаления коррозии с поверхности детали, по разности веса вычисляют потерю металла. Принято, например, считать металл вполне стойким, если потери в весе вещества не более 0,1 г с 1 м2/ч поверхности. При потере металла от 3 до 10 г · м2/ч металл считают малостойким, при большей потере — нестойким.
Определение скорости коррозии металла.
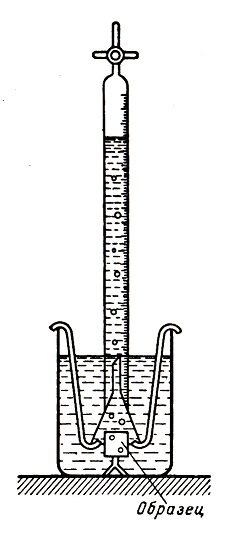
Иногда коррозионную стойкость определяют по количеству выделившегося водорода, например, при растворении металла в кислотах.
Для этой цели применяют простой прибор, схема которого изображена на рисунке 1
Образец металла, предварительно обработанный соответствующим образом, погружают в раствор электролита, например кислоты, накрывают воронкой, на которую одета бюретка. Бюретку наполняют тем же раствором кислоты. Выделяющийся газ (обычно водород) через воронку попадает в бюретку и вытесняет из нее раствор кислоты. По количеству выделившегося водорода, а также по скорости его выделения судят о коррозионной стойкости металла. Этот метод часто используют для определения скорости протекания химического взаимодействия металла с такими кислотами, как серная, соляная, а также иногда для определения характеристики растворения алюминия и цинка в растворах щелочей и кислот.
Рис. 1. Прибор для определения
скорости коррозии по количеству
выделяющегося водорода.
Результаты коррозии металла.
Однако методы оценки коррозионных разрушений по потере веса или по выделению водорода не всегда дают представление как о характере самого процесса коррозии, так и о возможных ее последствиях.
Равномерная коррозия металлов.
Совершенно очевидно, что при одном и том же количестве разрушенного металла (потере веса) больший вред от коррозии будет в том случае, если в отдельных местах ржавление проникло в глубь металла, а не распределено равномерно по всей поверхности. Поэтому по результатам коррозии различают несколько видов, или, как говорят, типов, коррозионных разрушений.

Рис. 2. Равномерная коррозия труб.
Почти всегда коррозия распределяется по всей поверхности детали. Такой тип коррозии называется равномерным. Это наиболее распространенный тип коррозии, который проявляется на открытом воздухе. Так, например, ржавеют железные трубы и другие изделия. Если снять слой ржавчины с железной трубы или какого-нибудь болта, то под ним обнаружится шероховатая поверхность металла, но эта шероховатость одинакова по всей поверхности изделия (рис. 2).
Коррозия язвами.
В отдельных случаях коррозия разрушает металл отдельными неравномерными пятнами (рис. 3).

Рис. 3. Местная коррозия (разрез):
а – коррозия пятнами; б – язвенная коррозия.
Серьезную опасность доставляет коррозия в виде язв, она образуется на разных участках друг от друга и глубоко корродирует, вся остальная поверхность металла остается без коррозии.
Точечная коррозия металлов. Питтинговая коррозия.

Рис. 4. Питтинговая коррозия.
Не менее ужасный вид — это точечная коррозия. Её ещё называют питтинговая. Она почти не заметна, зато глубоко проникает в металлические предметы. Такая коррозия, чаще всего встречается на железных крышах в виде тоненьких отверстий, как будто проткнутых тонкой иглой. Объясняется это тем, что в больших городах в воздух выбрасывается большое количество мельчайших частичек несгоревшего угля (сажи). Эти частички оседают на поверхности железных листов крыши, а уголь, как вам известно, хорошо притягивает (адсорбирует) некоторые газы, которые, растворяясь, создают незначительное количество электролита иногда очень большой концентрации в виде кислоты или солей, в этих условиях железо легко разрушается. Но это разрушение местное и глубоко проникающее внутрь железа, вплоть до того, что железные листы в отдельных случаях корродируют насквозь (рис. 4).
Межкристаллитная коррозия нержавеющих сталей.

Рис. 5. Межкристаллитная коррозия нержавеющей стали.
Очень опасен тип межкристаллитной коррозии, т. е. когда разрушению подверглось межкристаллитное вещество, цементирующее кристаллы в прочный металл. При межкристаллитной коррозии металл не подвергается внешнему изменению, он становится хрупким и при ударе разлетается на мелкие частички. Такая коррозия характерна для нержавеющих сталей и некоторых видов чугуна (рис. 5).
Коррозионное растрескивание металла.

Рис. 6. Коррозионное растрескивание латунных патронов под действием агрессивной среды.
При некоторых условиях возникает коррозионное растрескивание, при котором создаются коррозионные трещины, распространяющиеся не только по границам зерен кристаллов металла, но и прорезывающие даже тело самого кристаллита (рис. 6).
Избирательная коррозия металлов.
У кое-каких сплавов металлов встречается избирательная коррозия. Так, если сплав металла состоит из двух или более металлов, то коррозии подвергается один из этих металлов, и его поверхность постепенно обогащается другим металлом. К избирательной коррозии относится обесцинкование латуни — сплава из меди и цинка. В раствор переходит главным образом цинк, а поверхность его обогащается медью. Это легко наблюдать, так как обесцинкование сопровождается покраснением сплава за счет увеличения меди на поверхности.
К избирательной коррозии относится также такая коррозия, когда преимущественно разрушается какая-либо одна структура, составляющая данный сплав. Например, при растворении стали в кислотах разрушается феррит, т. е. железо, а более устойчивыми являются карбиды (соединение железа с углем). Она наблюдается при коррозии чугунов.
Линейная коррозия металлов.
И, наконец, одним из видов коррозионных разрушений является так называемая линейная коррозия. С этим типом коррозии можно ознакомиться на сравнительно простом опыте; на тонкую пластинку железа нанесите каплю парафина или менделеевской замазки, погрузите ее в 10-процентный раствор соляной или серной кислоты. Наблюдайте, что будет происходить. Вы заметите, что пузырьки водорода будут выделяться преимущественно на границе раздела (отсюда и название — линейная коррозия) между парафином и металлом, т. е. коррозия будет протекать по линии соприкосновения парафина с металлом. Если вы оставите эту пластинку на сутки в растворе, то металл прокорродирует настолько глубоко, что из него выпадает пластинка с очертанием капли парафина. Если же вынуть пластинку из раствора раньше, до того, как металл прокорродировал насквозь, и снять каплю парафина, то обнаружится, что вокруг капли образуется борозда, представляющая результат коррозии металла. Такого рода коррозия, как мы уже сказали, называется линейной (рис. 7).

Рис. 7. Линейная коррозия.
Точечная коррозия — это результат линейной коррозии. Хорошо вычищенная блестящая поверхность металла через некоторое время покрывается мельчайшими точками коррозии. Почему возникли эти точечные разрушения? При ближайшем рассмотрении оказывается, что причиной этого является пыль, которая оседала на поверхности металла. Она здесь сыграла, с одной стороны, роль парафиновой капли в нашем опыте, а с другой — мельчайшие пылинки были местами, вокруг которых оседали из воздуха газы и пары воды, вызвавшие коррозию поверхности металла.
Подповерхностная коррозия металлов.

Рис. 8. Подповерхностная коррозия.
Не менее опасна и подповерхностная коррозия. На рисунке 8 приведена фотография этого вида коррозии.
Типы коррозионных разрушений.
Рассмотрение различных видов коррозионных разрушений, которые схематически изображены на рисунке 9, то судить о вреде коррозии только по количеству разрушенного металла, по потере его веса еще далеко не достаточно. Потеря в весе может быть мала, а коррозионное разрушение чрезвычайно опасным. Так, например, межкристаллитная коррозия, коррозионное растрескивание особенно опасно для котлов высокого давления, авиационных двигателей, валов машин. Глубокая язвенная коррозия, точечная или межкристаллитная, подобна острым надрезкам на наиболее ответственных участках той или иной детали и ведет к разрушениям всей детали.

Рис. 9. Типы коррозионных разрушений:
1 – равномерная; 2 – неравномерная; 3 – структурно-избирательная; 4 – коррозия пятнами; 5 – коррозия язвами; 6 – коррозия точками; 7 – межкристаллитная; 8 – внутрикристаллитная; 9 – подповерхностная.
В некоторых случаях опасна и коррозия равномерного типа. Здесь неприятным является не само коррозионное разрушение того или иного металлического аппарата, а загрязнение продуктами коррозии изделий. Это приводит к разрушению декоративных покрытий, придающих красивый вид изделию, к потускнению металлических зеркал, например, зеркала прожекторов, автомобильных фар. Следовательно, в этом случае она более нежелательна, нежели местная или точечная коррозия.
Рассмотрев причины коррозионных разрушений, можно теперь подробно разобрать, в каких случаях и какие методы применяют для защиты металла от коррозии.
Перед тем, как начать фосфатирование нужно снять слой грубой ржавчины, чтобы как можно меньше потратить раствора и ускорить процесс.
Коррозионную устойчивость фосфатной пленки можно значительно повысить, если пропитать ее маслом и лаком. Способ фосфатирования довольно прост и поэтому широко применяется во многих отраслях промышленности.
sprav0chnik.ru







